抽象的
背景
蓝莓(VacciniumSPP。)的特征在于生产小于大多数常见水果的浆果,蓝莓果实大小的潜在机制仍然难以捉摸。V. Corymbosum.'o'neal'和'Bluerain'是商业南方高骨蓝莓品种,分别是大小的水果,成熟的'o'neal'水果比'Bluerain'重1〜2倍。在这项研究中,比较了'o'neal'和'bluerain'脾植物和水果的染发模式,并且在早期果实发育期间进行了比较转录组分析。
结果
V. Corymbosum.‘O’Neal’和‘Bluerain’托杯和果实表现出复杂的时间和空间细胞增殖和扩张模式。开花前的细胞分裂和受精后的细胞膨胀是蓝莓基因型果实大小变异的主要限制因素,外中果皮是影响果实大小变异的关键组织。对差异表达基因的比较转录组学和注释分析表明,植物激素信号转导途径丰富,茉莉酸相关Tifys.在蓝莓果实发育早期,基因可能是调控其它激素和影响果实大小的关键成分。
结论
这些结果为确定蓝莓果实大小提供了详细的个体发育证据,揭示了植物激素信号转导在果实早期发育中的重要作用。这个提菲这些基因可作为蓝莓大果选择的标记,为当前蓝莓育种提供参考。
背景
果实是一种独特的植物植物生殖结构,可促进种子分散,并为人类提供丰富的营养素。因此,在长期的自然选择和人工驯化之后,因此采用了不同的形式和特征,包括肉质或干燥,接触或解除,并且具有Apocarpous或Syncarpous Carpels [1,2].在这些适应性性状中,果实大小/重量是植物进化和作物改良的一个重要农艺性状,对产量、质量和消费者接受度至关重要。番茄果实就是一个典型的例子,它是成功驯化的作物之一,重量从几克增加到大约1公斤,增加了100多倍[2,3.].研究已经确定了果实大小/重量的几个关键调控因素,包括气候、管理、基因型、营养、果实负荷和外部和内部因素的相互作用[4]. 此外,最终果实大小/重量由细胞增殖和扩张决定,细胞增殖和扩张涉及到花分生组织、雌蕊形成、授粉和受精、子房和种子形成以及果实生长发育的连续过程[2,5,6,7].从细胞学观点来看,细胞增殖活性是果组合物的结构块,而细胞体积确定其最终尺寸[4,8].
目前,模式植物研究取得了重要进展拟南芥,茄属植物lycopersicum和奥雅萨苜蓿并且已经确定了影响果实尺寸/重量的多种基因,调节剂和信号通路,例如果重2.2(FW2.2 /中国北车),果子重3.2.(FW3.2 / KLUH),果子重11.3.(固件11.3/CSR),依诺(过多的花器官)等。2,3.,6,9,10,11,12,13,14,15,16].果实大小/重量调节因子在亲缘关系较近的物种间大多起源久远,功能相对保守,但在不同的物种或品种间,其表达模式或生物学功能也存在显著差异。例如,FW2.2(果子重2.2.),第一个分离的定量特质轨迹来自S. lycopersicum.,通过负调控细胞分裂,贡献了约30%的果实重量变化[2,12];但是,最大的差异FW2.2转录物丰富Vaccinium corymbosum在越橘花芽膨大和果实发育早期(细胞增殖最快的时期),没有出现果实大小不同的品种,这说明越橘果实发育和果实大小/重量变化涉及复杂的机制[17]. 因此,识别更多的调控因子及其生物学功能将有助于我们进一步解释果实大小/重量的基本机制,并开发实际应用来控制这些性状。
蓝莓(VacciniumSPP。),Ericaceae的部落痘痘的主要属性之一,产生具有高水平生物活性代谢物的小浆果,已被发现对人体健康有益,抗氧化剂,抗炎,抗遗传学,抗菌性和神经保护活动[18,19]. 然而,蓝莓果实比大多数驯化水果小,如番茄、猕猴桃和葡萄,然而果实大小/重量的系统解剖学和分子调控机制仍然是难以捉摸的。在这项工作中,细胞增殖和扩张的时空模式V. Corymbosum.品种“o'neal”和“bluerain”分别代表大小的水果,分别在脾脏(花芽的容器和较差的花芽和授粉和施用后形成果实)和水果发育中。此外,在开花和早期果实发育期间在这些品种中进行比较转录组分析。这些结果为细胞增殖和膨胀的时空模式提供了详细的组织性证据,并有助于识别参与调节蓝莓果实尺寸/重量的潜在基因。
结果
描述V. Corymbosum.花蕾和水果开发
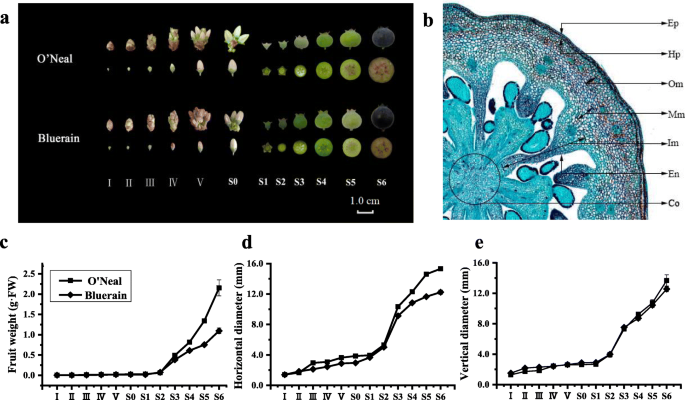
在我们以前的研究之后[20.]将‘奥尼尔’和‘蓝雨’花芽和果实的发育过程分为12个阶段(图1)。1).第一阶段,丰满的芽被棕色苞片包围,‘O’neal’和‘Bluerain’托柄最宽的水平直径约为1.40 mm。’O’neal’和’Bluerain’的托柄花赤道水平直径分别为3.08 mm和2.44 mm。在花期早期的花被定义为S0期或开花期。授粉受精后(S0-S1期),果实呈双s型生长模式,可分为3个阶段[21,22]早期和第一个快速生长阶段(阶段S2-S3,约12d),长而缓慢的生长期(阶段S3-S4,24) ~ 30天),以及第二个快速生长阶段(阶段S5-S6,约6天)。从S5期开始,花青素开始在外果皮中积累,果实逐渐变成深紫色或蓝色,在S6期成熟。总的来说,“奥尼尔”和“蓝雨”的果实生长期从花期开始持续了约74d。
细胞增殖和扩张模式的时程分析V. Corymbosum.脾植物/水果开发
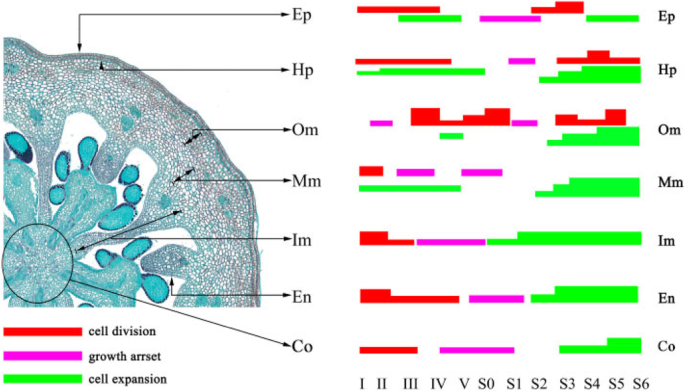
参考Cano-Medrano和Darnell的划定标准[23]和renaudin等人。[24]人工将蓝莓赤道托杯和果实分为7个部分(图。1b),包括表皮的单细胞层(EP),皮下注射(HP)和Endocarp(en)和外部Mesocarp(OM),中间瘤(MM),内部Mesocarp(IM)和孔氏菌(CO)的多个细胞层(CO).测量每个代表性组织中的平均细胞数和细胞面积,如下计算和分析(图。2).
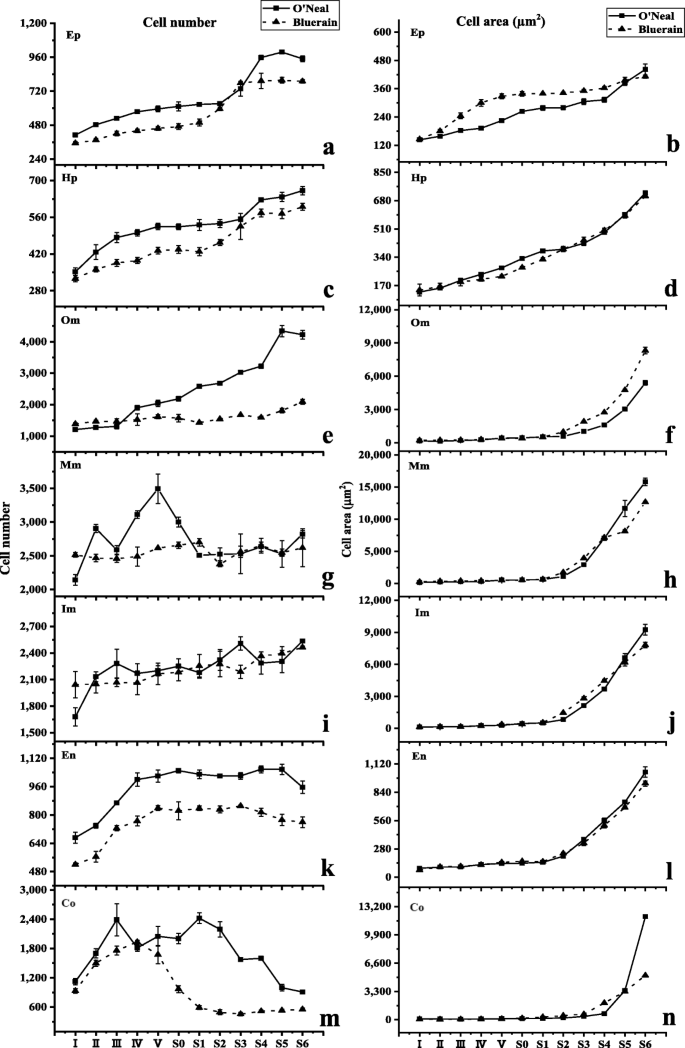
“O’neal”和“Bluerain”托柄和果实发育过程中表皮和皮下的细胞形态、细胞增殖和扩张模式相似(图1)。2广告)。在阶段I,表皮和皮下细胞是矩形的,并且抗冲击壁比垂直壁长。此后表皮和皮下细胞再次逐渐变成正方形(阶段IV)和矩形(阶段S0,图S1).第一期“O’neal”表皮和皮下细胞数量略大于“Bluerain”(图1)。2(a和c),尽管托柄的水平直径相似(图。1d)之后,细胞在I-III期迅速增殖。经长时间生长阻滞后,表皮细胞和皮下细胞从S1/S2期开始再次快速增殖,并在S4/S5期保持稳定。值得注意的是,除I和S6阶段外,在整个发育过程中,“Bluerain”的表皮细胞都比“O’neal”的细胞大,而“O’neal”和“Bluerain”的皮下细胞的面积大致相同(图。2B和D)。
数字2e表明‘O'Neal’和‘Bluerain’外中果皮的细胞增殖模式有显著差异。在整个发育过程中,“奥尼尔”外中果皮的细胞数几乎增加了3000个左右(~ 花前1000个细胞 ~ 花后有2000个细胞),但在“蓝雨”中大约有700个(~ 花前200个细胞 ~ 花后500个细胞)。两个品种的细胞面积在S0期前均略有增加,从S1期到果实成熟期均迅速扩大。外中果皮的平均细胞面积增加~ 在整个开发过程中30.6倍的“O'Neal”,以及 ~ 36.6折“蓝雨”(图。2f) S6期外中果皮总面积约为28.61mm2《奥尼尔》和18.12 毫米2果实成熟面积分别为12.0和9.3%。年代2和s3.).
中部和内部Mesocarp的初始细胞数高于其他脾植物/水果组织;然而,两个品种的细胞数在整个发育过程中保持2100〜2500(图。2g和i)。类似于外部Mesocarp,中间和内部Mesocarp细胞也连续膨胀(图。2h和j)。总共,中间和内部Mesocarp的平均细胞面积分别在“o'neal”中增加了80.1〜91.0倍,“奥尔伯特”中的48.6〜56.4倍(图。2h) 是的。值得一提的是,S6期中果皮总面积约为35.0%(~ 85.40 毫米2)在'o'neal'成熟的水果和24.4%(〜47.51 mm2)在“Bluerain”(Figs。年代2和s3.).类似地,阶段S6的总内部Mesocarp区域约为33.3%(〜74.35mm2)在'o'neal'和14.5%(〜28.21毫米)2)在'bluerain'。
在整个发育过程中,“O’neal”和“Bluerain”内果皮的形状、细胞数量和面积的增长规律与表皮细胞基本一致(图1)。2在整个发育过程中,‘O’neal’的内果皮细胞数量显著高于‘Bluerain’。2个品种的平均内果皮细胞面积在整个花蕾和果实发育过程中增加了11 ~ 12倍,而‘O’neal’和‘Bluerain’在果实发育过程中分别增加了~ 6.5倍和~ 4.9倍。
与其他效果/水果组织相比,孔氏菌显示出独特的细胞增殖图案(图。2m) 是的。‘O’Neal’columella的细胞数在花芽膨大早期(I~III期)迅速增加,随后从S1期开始急剧减少;而‘Bluerain’的细胞数在I~IV期迅速增加,从IV期到S1期逐渐减少,到S2期后一直保持不变。同时,小柱细胞在开花前稍有膨胀,之后急剧增加(图。2n) 是的。在整个发育过程中,平均小柱细胞面积增加~ 122折在“奥尼尔”里,然后 ~ “蓝雨”76.5折。
基于发育阶段的dna序列分析V. Corymbosum.早期果实发展
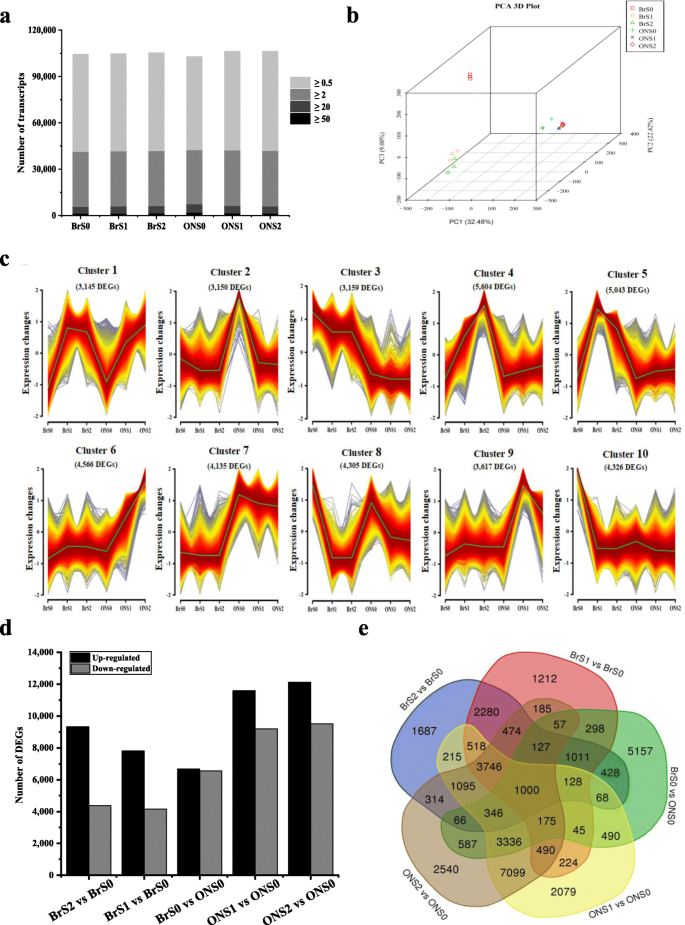
根据上述细胞学数据,细胞分裂在开花期停止,细胞从S1期或S2期开始急剧扩张。2和s3.)表明果实生长早期是影响蓝莓果实大小和重量的关键时期。为了阐明不同果实大小品种果实发育早期细胞增殖和扩张变化的可能分子基础,进行了RNA-seq分析。对‘O'Neal’和‘Bluerain’的S0、S1和S2期的托杯/果实进行了测序和分析(表S)1和s2).去除低质量reads、适配器序列和序列污染物后,每个库共获得7.64 ~ 9.99 Gb的洁净碱基。原始数据的Q30是高质量读取的一个指标,其范围为92.40 - 93.33%。组装的unigenes总长度为579,400,266 bp,平均长度为1069 bp, N50为1569 bp。高丛蓝莓“Draper”基因组的总序列和唯一序列的匹配率分别为87.79 ~ 91.30%和57.19 ~ 60.06%。此外,鉴定出约145,525个表达基因,包括110,765个注释基因和16,966个未在参考Draper转录组中注释的基因位点(图1)。3.一种)。
主成分分析显示转录组谱清晰聚类,与栽培品种和发育阶段相对应(图1)。3.b) 是的。18个文库主要按品种分为两类,而果实发育早期(S1期和S2期)的样本则聚在一起,表明果实发育分化的程序在S0期和S1期之间启动。为了验证转录组图谱的可靠性,通过qPCR验证了随机选择的15个基因的相对表达水平(图4).结果表明,所选基因的表达丰度与RNA-SEQ数据密切相关,表明转录组数据是可靠的。还进行基因表达聚类以鉴定具有相似表达模式的差异表达基因(DEGS)。通过这种分析,10个集群和大约41,000次在'o'neal'和'Bluerain'早期果实开发期间表现出动态表达变化(图。3.c),并且巨大的簇和不同的表达模式表明,早期阶段的果实生长和发育是一种复杂的生物过程。
DEGS功能分类及富集分析V. Corymbosum.水果早期发育
由FPKM值可以看出,3个生物重复间的表达存在相关性(Spearman相关系数= 0.73 ~ 0.84)(图S5)用来筛选转录差异。每个转录组基团中的大约40%的表达基因具有低于0.5的FPKM值,并且大于6.5%的表达基因具有大于20的FPKM值(图。3.a和表S2). 在本研究中,特异表达的基因具有平均FPKM的倍数变化表达率≥3(对数)2折叠更改 ≥ 1.58)和Padj< 每项比较中选择0.01进行进一步研究。根据该标准,与BrS0表达基因相比,从S1和S2期的“蓝雨”转录本中鉴定出11970、13503、13219、21054和21637个DEGs,与ONS0表达基因相比,从BrS0、ONS1和ONS2转录本中鉴定出11970、13503、13219、21054和21637个DEGs。除BrS0与ONS0比较相似外,上调DEGs的数目明显高于下调DEGs(图1)。3.d和e)。
然后通过KEGG富集分析筛选DEGs,以确定相关的功能和代谢途径,并将其分配到大约360个预测途径。在前10个路径中,注释的DEG在5个比较中共享(表S)3.和图.. s6)在“次生代谢物生物合成(ko01110)”、“糖酵解/糖异生(ko00010)”和“植物激素信号转导(ko04075)”途径中高度富集。此外,在GO分类词汇“对激素的响应(GO: 0009725)”、“对脱落酸的响应(ABA, GO: 0009737)”、“对细胞分裂素的响应(CTK, GO: 0009735)”和“茉莉酸介导的信号通路调控”(GO: 2000022)中,大量的DEGs被富集(图S)7).
DEGs与植物激素信号转导途径的关系
众所周知,低浓度的植物激素在协调植物生长发育的各个方面起着至关重要的作用。在本研究中,筛选出了与植物激素信号转导(ko04075)途径相关的约390个上调的DEG和167个下调的DEG,包括21个上调的和1个下调的DEG,它们在两个品种和不同发育阶段表达(表S)4,S.5).最代表性的激素信号转导相关的次数与养肝蛋白(103转录物)相关,然后是水杨酸(SA),ABA,CTK,乙烯(Eth),芸苔类固醇(BA),Jasmonate(JA)和吉布林素(GA)。
虽然参与生长素信号转导途径的DEG数最高,但它们的FPKM值相对较低(表S)5). 在S0和S1期的‘蓝雨’中,大多数与生长素相关的DEGs以及编码生长素反应性IAA(Aux/IAA)和吲哚-3-乙酸氨基合成酶GH3样基因的表达水平高于‘O'Neal’,表明‘蓝雨’托杯和果实中传递的生长素信号较少,因此限制了细胞增殖和种子发育。大多数GA-、ABA-、ETH相关信号转导基因在蓝雨托杯和果实中的表达水平也高于奥尼尔,特别是在S2期,表明这些激素信号可能通过细胞扩张而不是细胞分裂影响果实生长。
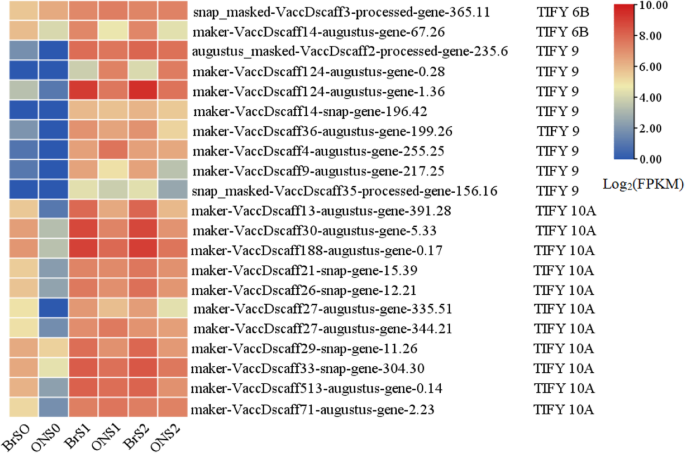
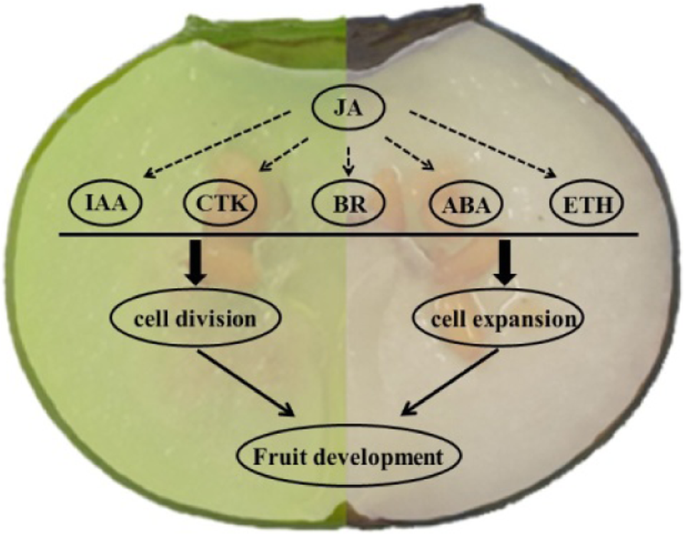
有趣的是,对JA信号传导的大多数参数的表达水平,尤其是编码(或茉莉酸Zim-域蛋白,jaz)亚家族成员第9条和tify10a.,明显高于与其他植物激素相关的含量,特别是在S1期和S2期的‘蓝雨’果实(图2)。4和表S5),建议JA可能是早期水果开发期间影响大小的关键植物激素,并且可能在策划其他植物激情骨中发挥中央作用,以提高果实生长和发展。
讨论
虚假的浆果V. Corymbosum.主要来自卵巢,萼片和效果[25].中果皮和小柱组织是主要的可食用部分。1b),类似于模型作物S. lycopersicum.. 近年来,蓝莓果实的研究主要集中在成熟过程,尤其是果实品质和贮藏方面[25,26,27,28,29,30]. 然而,有关栽培基因型间花芽和果实发育过程中的细胞学变异及其在果实发育早期的分子调控机制的研究却很少。在这项研究的情况下,一个全球性的时空分析细胞增殖和扩张过程中V. Corymbosum.'o'neal'和'Bluerain'花蕾和水果发育以及在花序和早期果实开发期间的比较转录组分析。这些结果说明了与蓝莓果细胞生细胞相关的特定的时空细胞增殖和膨胀模式,发现多种植物激素信号转导途径参与早期的蓝莓果实发育,可能影响品种中的果实尺寸/重量。
V. Corymbosum.Hypanthia /水果在整个发育中表现出复杂的组织或细胞层特异性细胞增殖和膨胀模式
在以往的研究中,果实在授粉和受精后立即开始细胞分裂,然后经历一个很长的细胞膨胀期直到成熟,品种间存在长/短的重叠[4,24,31].然而,“O’neal”和“Bluerain”hypanthia/fruits的细胞增殖和扩张没有遵循“常规”的趋势,表现出复杂的时空发展模式(Fig. 1)。5).开花前柱头细胞数量显著增加,开花后柱头细胞数量逐渐减少,受精后柱头细胞体积显著增加。这些结果表明,包括细胞增殖和扩张在内的程序化发育分化参与其中V. Corymbosum.果皮增长(图。2).张等人。据报道,大多数时尚表达基因与细胞分裂和胚胎形成相关,参与调节早期番茄果实发展[32].此外,番茄果的发展和成熟是由基因监管和结构网络的时序和分布来调节,并展示空间和发育梯度[33].这些研究表明,果实生长受到物种间复杂的时空调控机制和网络的精确调控。
开花前细胞数量是影响开花的基本因素V. Corymbosum.果子尺寸
16〜18 d在开花后,大概是为了应对授粉和施肥,'o'neal'和'bluerain'的脾植物/年轻果实表现出戏剧性的形态变化。通常,受精后,细胞分裂和膨胀是有序的,而成熟果实中的最终细胞数和体积由细胞数和在花序中的体积和细胞分裂和细胞扩张的速度和持续时间决定[34,35].遵循细胞层的趋势越来越大[22], the mean cell number present in hypanthia at stage I was approximately 59.7% (‘O’Neal’) and 82.8% (‘Bluerain’) of the final fruit cell number, even as these ratios reached 91.2% (‘O’Neal’) and 90.9% (‘Bluerain’) at anthesis, respectively, indicating that not only the initiated cell number, but also the cell proliferation ability in hypanthia before anthesis were vital factors determining final fruit size. Similar cell proliferation trends have been reported in apple, grape,rub, 肯定肋骨[35]和kiwifruit [36]花芽膨大过程中影响细胞增殖的因素对果实大小的影响尤为重要[23].虽然约翰逊等人。[37]表明,细胞数量主要促进果实大小的变化诉ashei基因型,成熟果实中的细胞数与绽放的细胞数没有显着呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈呈浓度和活性在开花前细胞增殖的幅度和活性是在蓝莓基因型中的最终细胞数和果实大小的中等因素确定了上级因素。
受精后的细胞扩张也在决定受精率方面起着重要作用V. Corymbosum.果子尺寸
虽然细胞数量符合有助于果实大小变异的重要因素,但一些研究人员表明细胞扩张对肉质果实的大小产生了更大的影响[1,23,35]. 在这项研究中,外、中、内中果皮和小柱的细胞面积从S1期到成熟期呈对数增长,而表皮、皮下和内果皮的最终细胞面积相对较小(图。2). 在诉ashei“贝蓝”果实,细胞膨胀是最终果实大小的主要因素,这与葡萄和黄瓜的结果一致[23]. 然而,对于苹果、草莓、桃、杏、梨和枇杷等多种水果品种而言,授粉后即刻产生的细胞数是影响最终果实大小的主要因素[7,23,31,38],表明施肥后涉及更复杂的调节机制涉及果实生长和大小。
外部Mesocarp是确定果实尺寸变化的关键组织V. Corymbosum.基因型
中果皮细胞数诉ashei果实占果皮细胞总数的75%,成熟授粉果实中果皮和内果皮的细胞尺寸显著大于成熟GA3.诱导的定律曲线植物,表明通过种子诱导或产生的更多植物激素[23].本研究中,S0期‘O’neal’和‘Bluerain’的中果皮组织(包括外中果皮、中中果皮和内中果皮)分别约占果实成熟组织的80.3和46.2%。中中果皮和内中果皮的细胞数量相近,但“O’neal”外中果皮的最终细胞数量是“Bluerain”的1.0倍,表明外中果皮是决定不同基因型果实大小差异的关键组织。事实上,“neal”成熟果实的种子数量大约是“Bluerain”果实的1.7倍[17],表明,可能促进或由种子诱导或产生的植物激素可能促进果实尺寸增加,特别是对于Mesocarp组织[39].
茉莉酸可能是协调和平衡其他植物激素和影响的关键植物激素V. Corymbosum.早期发展期间的果实大小
植物激素是协调细胞活动、模式形成、营养和生殖发育以及生物和非生物胁迫反应的有机信号分子。事实上,果实的生长是由一个复杂的激素调节网络控制的,植物激素对花和果实发育的重要性已经在模型植物中得到了很好的阐明拟南芥和番茄[40,41,42]. 然而,各种植物激素在蓝莓花芽膨大和果实发育过程中的具体生物学功能却鲜有报道。本研究采用比较转录组学方法分析了‘蓝雨’和‘奥尼尔’果实的三个早期发育阶段,发现参与植物激素信号转导途径的大部分基因表达水平存在明显差异。这些与植物激素信号转导相关的基因、蛋白质和转录因子在青油菜幼果中表现出较高的表达,除了S1和S2期的生长素相关基因,S0和S1期的CTK相关基因,花期的GA-、ABA-和ETH相关基因,表明生长素和CTK信号促进了幼果的细胞增殖,而成熟相关信号ABA和ETH不仅抑制了开花期的细胞分裂,而且抑制了幼果的细胞增殖。
JA是一种主要的防御化合物,它控制着细胞周期、根的伸展、叶片的生长和衰老、气孔的关闭、相互作用、次级代谢(尤其是花青素的积累)等[43,44,45,46,47]. 例如,表达式拟南芥在花药裂开中有缺陷1 (DAD1(编码JA生物合成初始酶)基因的雄蕊丝通过同步花药开裂、花粉成熟和花朵开放促进水分运输[48]和沉默DAD1通过改变麻疯树花和果实发育以及较低的内源JA和JA- ile水平[49]. 此外,S. lycopersicum.JA不敏感1–1(贾伊, 也叫coi1型在A.拟南芥)突变体延缓了花瓣、花柱和无毛子房的衰老[43]. 在本病例中,JA信号相关基因在一定程度上主要表达,特别是在幼嫩受精的“蓝雨”果实中,表明JA(主要由第9条和tify10a.)可能与其他植物激素协同调控果实中细胞的增殖和扩张,并在发育早期影响果实的大小(图)。6).
事实上,蓝莓的FPKM值VcFW2.2型,VcFW11.3,VcFW3.2型和VcENOorthologs(关键调节基因S. lycopersicum.但其表达量相对较低,甚至检测不到(表S5),表明这些基因不是蓝莓果实重量/大小的关键调控基因,或者取样的组织不是相似的时间点。
结论
根据个体遗传学和比较转录组学的证据,南方高丛蓝莓果实表现出复杂的时间和空间细胞增殖和扩张模式,开花前的细胞分裂和受精后的细胞扩张是主要的决定因素,外中果皮是决定基因型间最终果实大小/重量变异的关键组织。此外,多种激素信号转导途径参与了蓝莓果实的早期发育,JA可能是调控和平衡其它激素和影响果实大小的关键激素。这些数据将有助于更精确的物理和分子表征蓝莓果实的发育过程。
方法
植物材料
6或8岁V. Corymbosum.'o'neal'(在1987年北卡罗来纳州)和'Bluerain'(在2010年在大连理工大学确定)在本研究中使用了自然条件下的植物。据Yang等人说。[20.],不同发育阶段的花蕾和水果(图。1a) 随机标记、收集和处理。具体来说,花冠、雄蕊和雌蕊的花蕾从第四阶段到第0阶段被剥离,然后用于进一步的分析。在加工过程中,至少使用了三个生物复制体来最小化变异。
石蜡切片制备,细胞数及细胞面积测定
按照Yang等人的方法进行组织切片的制备和显微镜观察。20.]. 人工计数和ImageJ软件计数不同发育阶段特定层或组织的赤道细胞数。赤道细胞的平均面积是用细胞数除以分隔的区域来确定的。
RNA测序分析
在开花和早期发育期间(Novogene Science Co.,Ltd)期间对'O'neal'和'Bluerain'和'Bluerain'的脾脏和年轻果实进行了转录组测序和生物信息分析。起源生物医学技术有限公司)。简而言之,通过琼脂糖凝胶电泳,纳米光度计分光光度计(Imprecn,California,USA)和安捷伦生物分析仪2100系统(Agilent Technologies,California,USA)评估总RNA。通过使用Nebnext Ultra TM RNA文库预备试剂盒用纯化的mRNA产生测序文库,并在Illumina Hiseq-Xten平台上以配对端模式进行测序,读取长度为250〜300bp。首先通过去除包含适配器的读取,读取含有> 10%多N和低质量读取(≤20个核苷酸)来处理原始读取。
序列组件和注释是使用Hisat2和Stringtie软件完成的[50,51[参考蓝莓基因组'v1.0(疫苗的基因组数据库)[52].在R包中进行主成分分析(PCA),并用scatterplot3d库绘制[53].调整P- 使用Benjamini和Yekutieli控制虚假发现率(FDR)的方法来纠正多种测试的价值(Padj。<0.01)54].
通过脚本RSEM计算每Kb每百万片段的片段数(FPKM)[55]. 差异表达分析(DEGs,fold change)≥3和Padj< 0.01)用StringTie软件对BrS1与BrS0、BrS2与BrS0、BrS0与ONS0、ONS1与ONS0、ONS2与ONS0进行五对比较,并用京都基因和基因组百科全书(KEGG,www.kegg.jp/kegg/geg1.html.)和基因本体论(GO,http://geneontology.org/)数据库。用在线软件生成DEGs的Venn图(http://bioinformatics.psb.ugent.be/webtools/Venn/).Tbtools Softeware(V1.05)绘制了热爱图[56]应用R软件包Mfuzz(2.34.0版)对发育表达模式进行聚类分析[57].
定量实时PCR(QPCR)验证
根据我们之前的报道进行了总RNA提取和cDNA 1链合成[20.].合成的第一链CDNA被稀释3倍以进行QPCR验证。特定引物(表S.6)随机选取15个基因,用Primer-BLAST (https://www.ncbi.nlm.nih.gov/tools/primer-blast/), 和vcgapdh.用于样本间cDNA含量的标准化[58].对ABI Stealone Plus™RT-PCR系统进行QPCR反应(应用生物系统有限公司,中国北京)。如Liu等人所述进行PCR系统,程序和数据分析。[59].
统计分析
采用SPSS 17.0软件进行统计学分析。数据以平均值和标准差(mean±SD,n ≥ 3). 通过独立样本t检验(置信区间)评价统计显著性 = 采用SPSS17.0软件进行统计分析。除非另有规定,否则图形由Origin Pro.8.6软件绘制。
数据和材料的可用性
在本研究中,所有材料都是从浙江师范大学获得(浙江省金华,中国),并遵守了相关的机构,国家和国际指南和立法。
可以从NCBI序列读取存档(SRA)平台访问原始转录组数据(http://www.ncbi.nlm.nih.gov/sra/)under accession numbers SRX9831796 ~ SRX9831798 (BrS0), SRX9847572 ~ SRX9847574 (BrS1), SRX9862519 ~ SRX9862521 (BrS2), SRX9847944 ~ SRX9847946 (ONS0), SRX9854591 ~ SRX9854593 (ONS1), and SRX9956371 ~ SRX9956373 (ONS2).
缩写
- 美国律师协会:
-
脱落酸
- 比尔:
-
油菜素甾醇
- CTK:
-
细胞分裂素
- CO:
-
小柱
- 可见:
-
差异表达基因
- En:
-
Endocarp.
- Ep:
-
表皮
- eth:
-
乙烯
- FDR:
-
假发现率
- FPKM:
-
每千克/百万碎片的碎片
- GA:
-
赤霉素
- 开始:
-
基因本体论
- 马力:
-
皮下组织
- 我是:
-
内蒙古的
- 是:
-
茉莉酸
- Kegg:
-
京都基因和基因组百科全书直系数据库
- 毫米:
-
中间中果皮
- Om:
-
外中果皮
- PCA:
-
主成分分析
- qPCR:
-
定量实时聚合酶链反应
- 山:
-
水杨酸
- 提菲:
-
斋月齐域域蛋白
参考文献
- 1.
Pabon Mora,利特A。苹果干果与肉果的比较解剖与发育分析茄科.我是J机器人。2011; 98(9):1415-36。https://doi.org/10.3732/AJB.1100097..
- 2.
侯赛因Q,施杰Q,谢本A,詹杰普,王学福,刘国福,等.干果大小的遗传和信号传导途径:基于基因组编辑的作物改良目标。植物生物技术杂志。2020;18(5):1124–40.https://doi.org/10.1111/pbi.13318.
- 3.
坦克斯利SD。番茄果实尺寸和形状变异的遗传,发育和分子基础。植物细胞。2004; 16(SUPPLE_1):S181-9。https://doi.org/10.1105/tpc.018119.
- 4.
Azzi L,Gévaudantf,饮食饮食,俄罗斯人民币,C.番茄果实生长及其分子育种技术的修饰。在:Ezura H,Arizumi T,Garcia-Mas J,Rose J,编辑。茄科和葫芦科作物中的功能基因组学与生物技术,Vol。70.柏林:斯普林克;2016年。https://doi.org/10.1007/978-3-662-48535-4_8.
- 5.
Okello RCO,Heuvelink E,Visser Phb,Struik PC,Marcelis LFM。什么推动果实增长?Funct植物Biol。2015; 42(9):817-27。https://doi.org/10.1071/FP15060.
- 6.
何长云,王玲,闫立新,李庆荣,永斌,朱伟伟。果实起源和多样化背后的进化发育机制。生命科学。2019;49(4):301-19。https://doi.org/10.1360/n052018-00225.
- 7.
Van der Knaap E,Chakrabarti M,Chu Yh,Clevenger JP,Illa-Berenguer E,Huang Z等。是什么超出眼睛:分子机制调节番茄果实重量和形状?前植物SCI。2014; 5:227。
- 8。
伯廷N。番茄果实生长对温度和果实负荷的响应与细胞分裂、细胞扩增和DNA内复制的关系分析。安·博特。2005;95(3):439–47.https://doi.org/10.1093/aob/mci042.
- 9。
Munos S,Ranc N,Botton E,伯勒达A,Rolland S,Duffe P等人。番茄区号的增加由位于附近的两个单核苷酸多态性控制WUSCHEL.植物理性。2011; 156(4):2244-54。https://doi.org/10.1104/pp.111.173997.
- 10.
潘艳平,王艳红,麦格雷戈C,刘S,栾F-S,高M-L,等.瓜类果实大小和形状变异的遗传结构:比较研究。理论应用基因。2020;133(1):1–21.https://doi.org/10.1007/s00122-019-03481-3.
- 11.
Xu C, Liberatore KL, MacAlister CA, Huang Z-J, Chu Y-H, Jiang K, et al. .阿拉伯糖基转移酶的级联控制着番茄茎分生组织的大小。Nat麝猫。2015;47(7):784 - 92。https://doi.org/10.1038/ng.3309.
- 12.
Frary A、Nesbitt TC、Grandillo S、van der Knaap E、Cong B、Liu J等。FW2.2:番茄果实大小演变的定量性状轨迹段。科学。2000; 289(5476):85-8。https://doi.org/10.1126/science.289.5476.85.
- 13
Chakrabarti M,Zhang N,Sauvage C,Munos S,Blanca J,Canizares J等。细胞色素P450 CYP78A调节番茄的驯化特性(茄属植物lycopersicum).Proc Natl Acad Sci U S A. 2013; 110(42):17125-30。https://doi.org/10.1073/pnas.1307313110.
- 14
Mu Q,Huang Z-J,Chakrabarti M,Illa Berenguer E,Liu X-X,Wang Y-P,et al.成熟番茄果实中表达的一种新蛋白,其细胞大小调控因子控制果实重量。公共科学图书馆Genet。2017;13(8):e1006930。https://doi.org/10.1371/journal.pgen.1006930.
- 15
Van der Knaap E,Ostergard L。塑造果实:影响生长模式的发育途径。精细胞发育生物学。2018;79:27–36.https://doi.org/10.1016/j.semcdb.2017.10.028.
- 16
Yuste-Lisbona FJ, Fernández-Lozano A, Pineda B, Bretones, Ortíz-Atienza A, García-Sogo B,等。ENO通过花分生组织发育网络调控番茄果实大小。国家自然科学基金资助项目:国家自然科学基金资助项目;https://doi.org/10.1073/pnas.1913688117.
- 17
于莉,周妍,宗妍,张妍,邱杰琴,李妍琴,等。蓝莓中FWL/PLAC8家族的特征及相关表达模式。舞蹈学报。2021;48:336–46.
- 18。
尼罗士,公园SW。食用浆果:生物活性成分及其对人体健康的影响。营养。2014; 30(2):134-44。https://doi.org/10.1016/j.nut.2013.04.007.
- 19。
李晓燕,侯永明,谢霞,李红霞,李学东,朱勇,等。一个蓝莓MIR156a-SPL12模块协调果实成熟过程中叶绿素和花青素的积累。机器人学报。2010;30(6):729 - 736。https://doi.org/10.1093/jxb/eraa327.
- 20。
杨璐,陈敏敏,蔡康林,张丽娟,朱玉芳,叶青,等。VCFA公司,VcSUN公司,卵形对南高丛蓝莓花前和果实发育过程中的形态发育进行了协调。Sci Hortic。2018;240:109-15。https://doi.org/10.1016/j.scienta.2018.05.023.
- 21
谢Z-S,杜H-R,Xiang D-F,Qi Y-S。不同生长发育阶段蓝莓果实血管束和水运输解剖结构的变化。J植物理性。2018; 54:45-53(中文)。
- 22
杨磊,蔡康林,杭海英,张永华,宗勇,王松,等。解剖、基因表达的比较分析Vaccinium corymbosum在花蕾和水果组来的细胞周期蛋白和细胞周期蛋白依赖性激酶。SCI Hortic。2019; 251:252-9。https://doi.org/10.1016/j.scienta.2019.03.028.
- 23
卡诺梅德拉诺河,达内尔河。单性结实的细胞数和细胞大小与. 授粉蓝莓(兔眼蓝莓)水果。安·博特。1997;80(4):419–25.https://doi.org/10.1006/anbo.1997.0462.
- 24
Renaudin JP、Deluche C、Cheniclet C、Chevalier C、Frangne N。番茄果皮坐果和果实生长过程中细胞分裂和细胞扩张的细胞层特异性模式。J实验机器人。2017;68(7):1613–23.https://doi.org/10.1093/jxb/erx058.
- 25
红薯果实品质性状的发育及两种果实结构的比较Vaccinium corymbosum(L.)品种。SCI Hortic。2015; 194:79-90。https://doi.org/10.1016/j.scienta.2015.08.007.
- 26。
Zifkin M,Jin A,Ozga JA,Zaharia LI,Schernthaner JP,Gesell A,et al.发育中的高丛蓝莓果实的基因表达和代谢物谱表明类黄酮代谢的转录调控和脱落酸代谢的激活。植物生理学。2012;158(1):200–24.https://doi.org/10.1104/pp.111.180950.
- 27。
Gupta v,estrada广告,Blakley I,Reid R,Patel K,Meyer MD等。蓝莓基因组组件草案的RNA-SEQ分析和注释鉴定了参与果实成熟,生物活性化合物的生物合成的候选基因,以及特异性替代剪接。傻瓜。2015; 4(1):5。https://doi.org/10.1186/s13742-015-0046-9..
- 28。
李永东,裴建斌,孙海燕。全球蓝莓产业现状与展望。吉林农业大学学报2018;40:421-32。
- 29。
林勇,王义海,李斌,谭海,李德恩,李力,等。蓝莓花青素合成相关基因的比较转录组分析。植物生理生物学。2018;127:561–72.https://doi.org/10.1016/j.plaphy.2018.04.034.
- 30.
李晓波,金玲,潘晓红,杨玲,郭卫东。高丛蓝莓果实成熟过程中酚类生物合成的蛋白质表达和代谢产物图谱。食品化学。2019;90:216-28。
- 31.
苏文斌,朱永明,张玲,杨晓华,高永胜,林世强。枇杷的细胞生理(埃里替莫省粳稻主要研究细胞分裂和细胞扩张过程对柚子形态发生的影响。科幻电影。2017;224:142–9.https://doi.org/10.1016/j.scienta.2017.06.012.
- 32.
张世波,徐明,邱志科,王克特,杜英才,顾立夫,等。时空转录组研究为番茄早期果实发育提供了新的思路(茄属植物lycopersicum).SCI批准。2016; 6(1):23173。https://doi.org/10.1038/srep23173.
- 33.
Shinozaki Y,Nicolas P,Fernandez-Pozo N,MA Q,Evanich DJ,Shi Y-N等人。番茄果实发育和成熟的高分辨率时空转录组映射。NAT Communce。2018; 9(1):364。https://doi.org/10.1038/s41467-017-02782-9..
- 34.
张t-p,杨x-h。番茄果早期发展的分子与生理机制进展。Chin Bull Bot。2018; 53:856-66(中文)。
- 35.
Coombe BG。肉质水果的发展。Annu Rev植物理性。1976; 27(1):207-28。https://doi.org/10.1146/annurev.pp.27.060176.001231.
- 36.
克鲁兹·卡斯蒂略JG,伍利DJ,劳斯GS。猕猴桃大小和CPPU反应受开花时间的影响。Sci Hortic。2002;95(1 - 2):23-30。https://doi.org/10.1016/s0304 - 4238 (01) 00384 - 3.
- 37
Johnson LK、Malladi A、Nesmith DS。细胞数量的差异促进了兔眼蓝莓基因型果实大小的变异。美国社会科学杂志。2011;136(1):10–5.https://doi.org/10.21273/jashs.136.1.10.
- 38
张CX,Tanabe K,Wang S,Tamura F,Yoshida A,Matsumoto Ak。细胞分裂与细胞扩大对果实尺寸演变的影响Pyrus Pyrifolia.Ann Bot。2006; 98(3):537-43。https://doi.org/10.1093/aob/mcl144.
- 39
王文瑞,白英华,柯孔达,关力,诸葛Y-X,王善聪,等.葡萄种子和浆果发育过程中赤霉素代谢与信号转导(GA-MST)途径的全基因组鉴定与分析(葡萄L.)。BMC植物生物学。2020;20:384.
- 40。
Srivastava A, Handa AK。番茄果实发育的激素调控:一个分子的视角。植物生长学报,2005;24(2):67-82。https://doi.org/10.1007/S00344-005-0015-0..
- 41。
威廉姆斯告诉我。植物激素简介。植物生物学教学工具:课堂讲稿。植物细胞。2011;22:1–9.
- 42。
Kumar R,Khurana A,Sharma Ak。植物激素的作用及其在肉质果实的发展和成熟中的作用。J Exp Bot。2014; 65:4561-75。
- 43。
李磊,赵云峰,Mccaig BC, Wingerd BA,王建华,Whalon ME,等。coronatinate -insensitive1的番茄同源物是种子成熟、茉莉酸信号防御反应和腺毛体发育的母体控制所必需的。植物细胞。2004;16(1):126 - 43。https://doi.org/10.1105/TPC.017954.
- 44。
Thines B,Katsir L,Melotto M,Niu YJ,Mandaokar A,Liu G-H等。Jaz Repressor Proteins是SCF的目标COI1型茉莉酸信号传导过程中的复合物。自然。2007;448(7154):661–5.https://doi.org/10.1038/nature05960.
- 45
Santner A,Estelle M.植物激素信号传导中的最近进展和新兴趋势。自然。2009; 459(7250):1071-8。https://doi.org/10.1038/nature08122.
- 46
山x,张y,彭w,王z-l,xie d-x。百乙酸诱导花青素积累的植物激素机制拟南芥. J实验机器人。2009;60:849–60.
- 47
艾尔特人n,mendes mp,van wees scm。激素网络中的多级串扰调节植物防御。工厂J. 2021; 105(2):489-504。https://doi.org/10.1111/tpj.15124.
- 48
石黑一郎,田河井oda,上田J,西田一,冈田k花药开裂有缺陷的基因编码新的磷脂酶A1催化茉莉酸生物合成的初始步骤,其使花粉成熟,花药裂开和花开口同步拟南芥.植物细胞。2001; 13(10):2191-209。https://doi.org/10.1105/TPC.010192.
- 49
徐C-j,赵m-l,陈m-s,xu z-f。沉默的ortholog花药开裂有缺陷多年生木本植物的基因麻疯树改变花和果实的发育。中国生物医学工程学报,2014;https://doi.org/10.3390/ijms21238923.
- 50
Kim D,Langmead B,Salzberg SL.Hisat:低内存要求的快速拼接对准器。Nat方法。2015;12(4):357–60.https://doi.org/10.1038/nmeth.3317.
- 51.
Pertea M,Pertea GM,Antonescu CM,Chang TC,Mendell JT,Salzberg SL.Stringtie能够从RNA序列读取中改进转录组的重建。纳特生物技术公司。2015;l33:290–5。
- 52.
柯莉M,雷斯纳CP,韦CM,欧SJ,伯德卡,王杰,等。四倍体蓝莓单倍型阶段基因组与营养途径的进化。GigaScience公司。2019;8:2012年。
- 53.
Scatterplot3d -一个用于可视化多元数据的R包。统计软件2003;8:1-20。
- 54.
依赖条件下多重检测中错误发现率的控制。《数理统计》2001;29:1165-88。
- 55.
李B,杜威CB。RSEM:从RNA-seq数据中精确的转录定量,有无参考基因组。生物信息学。2014;12:323.
- 56.
陈长杰,陈洪,张勇,Thomas HR, Frank MH,何勇,等。Tbtools:一个用于交互分析大生物数据的集成工具包。摩尔。2020;13(8):1194 - 202。https://doi.org/10.1016/j.molp.2020.06.009.
- 57.
Kumar L,Futschik Me。MFUZZ:用于软阵列的软阵列数据软件包。生物信息。2007; 2(1):5-7。https://doi.org/10.6026/97320630002005.
- 58.
Die JV,罗兰LJ。优越的跨物种参考基因:蓝莓案例研究。Plos一个。2013; 8(9):E73354。https://doi.org/10.1371/journal.pone.0073354.
- 59.
刘文宁,叶青,金秀琴,韩凤琴,黄学忠,蔡绍华,等。一个自发芽突变体导致亲本关西柚汁囊中番茄红素和β-胡萝卜素的积累(植物(l)等)。Sci Hortic。2016;198:379 - 84。https://doi.org/10.1016/j.scienta.2015.09.050.
致谢
不适用。
资金
本课题是在浙江省科技厅重大专项(2018C02007)和浙江省科技厅重点研究项目(2016C02052-92016C32010)的支持下,进行的实验设计、资料收集、数据分析和稿件撰写等工作。
作者信息
隶属关系
贡献
L.Y.和w.d.g.构思和设计了研究。M.L.L.,Z.Y.W.,L.Y.,M.M.C.,K.L.C.和L.Y.进行实验。L.Y.,Y.Z.,Y.Q.L.,F.L.L和L.Y。分析了数据。M.L.L.和l.Y.写了手稿。 All authors read, reviewed and approved the manuscript.
相应的作者
道德声明
道德认可和参与同意
本研究中使用的品种“奥尼尔”是1987年在北卡罗来纳州培育的,而“蓝雨”是2010年在大连理工大学培育的。本研究使用的所有植物材料均种植在浙江师范大学(中国浙江省金华)的果园中。我们已经获得了为科学研究采集样品的许可,样品采集和后续方案符合相关机构、国家和国际准则和立法。
出版许可
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
附加信息
出版商的注意
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充信息
附加文件1:表S1。
转录组数据摘要V. Corymbosum.果实发育早期的‘奥尼尔’和‘蓝雨’。表S2。在早期转发组文件中表达基因的FPKM分布V. Corymbosum.“O’neal”和“Bluerain”水果开发。表S3。早期各比较的deg的KEGG功能分类(Top 10 pathway)V. Corymbosum.“O’neal”和“Bluerain”水果开发。表S4。每个比较所涉及植物激素信号转导(KO04075)途径的特定参数。表S5。与植物激素信号转导途径(ko04075)相关的特异性DEGs的表达水平及fold变化。表S6。本研究中使用的引物。图S1。赤道部分V. Corymbosum.‘O’Neal’和‘Bluerain’托杯/不同发育阶段的果实。图S2。外中果皮、中中果皮和内中果皮的总面积V. Corymbosum.“奥尼尔”和“蓝雨”的花蕾和果实发育。图S3。总细胞数和果实面积呈递增趋势V. Corymbosum.“奥尼尔”和“蓝雨”的花蕾和果实发育。图S4。由QPCR确定的15个随机选择的次数的相对表达水平。图S5。早期胚胎转录组谱的Spearman相关系数V. Corymbosum.“O’neal”和“Bluerain”水果开发。图S6。早期糖尿病相关DEGs的KEGG功能分类V. Corymbosum.“O’neal”和“Bluerain”水果开发。图S7。GO对早期参与生物过程的二烷基糖苷(DEGs)进行功能分类V. Corymbosum.“O’neal”和“Bluerain”水果开发。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非信用额度中另有规定。
关于这篇文章
引用这篇文章
杨璐,刘璐,王卓。et al。比较解剖学和转录组学的洞察Vaccinium corymbosum花蕾和水果在整个开发中。BMC植物生物学21,289(2021)。https://doi.org/10.1186/s12870-021-03067-6.
收到了:
接受:
出版:
关键字
- 细胞增殖
- 细胞扩张
- 水果发展
- 比较转录组
- 提菲基因
- 蓝莓