摘要
背景
Perilla frutescens.(l)布里特是一种在亚洲广泛种植的药用和食用植物。萜类、黄酮类和酚酸是药用成分的主要来源。具有多细胞结构的腺状毛被称为生物化学细胞工厂,可以合成特殊的代谢物。然而,目前关于这些成分的生物合成位点和机制的信息有限P. Frutescens..在此,我们研究了腺毛的形态特征,代谢谱和转录组通过不同的组织。
结果
光镜和扫描电镜的观察表明,根据形态特征,有三种不同的腺毛类型:盾形、头状和数字化腺毛。采用特制微管采集并经LC-MS和GC-MS分析的盾状腺毛状体油中主要成分为紫苏酮、异茄蔻酮、茄蔻酮,与叶片成分一致。应用代谢组学和转录组学研究了黄芪叶、茎、根中活性成分的生物合成p . frutescens。转录组测序谱分析结果与萜类,黄酮类,苯丙和生物合成基因的差异调节,分别与大多数基因在叶表示高度。影响毛状体的发展的基因进行了初步预测和讨论。
结论
本研究建立了不同类型的腺毛的形态和化学特征P. Frutescens.说明生物活性成分主要在盾状腺毛中合成。通过转录组研究,发现了与生物活性成分合成相关的基因,为阐明该药用植物生物活性成分的合成提供了依据。
背景
在植物界,毛状体是由表皮细胞分化而来的特殊组织,具有不同的结构和功能,在抵抗胁迫、紫外线辐射、分泌和特殊化合物积累等方面发挥着重要作用[1,2].其中一种毛状体,腺状毛状体(GTs),能够合成、储存或分泌各种具有生物活性的代谢物,如萜类、苯丙类、类黄酮、生物碱和酰基糖,因此被称为生化细胞工厂[3.].结果,GTS是研究植物中次生代谢物的合成和调节的主要靶标。对药用植物的GTS研究引起了科学家的兴趣,如GTSSchizonepeta tenuifolia,各种x、,青蒿.他们的GTs合成和储存精油,广泛用于香料工业、制药和化妆品[4,5,6].
Perilla frutescens.(l)布里特是一种可食用的蔬菜和药用植物,在化妆品中加工,如护肤霜、肥皂和皮肤医学制剂[7].上面有两种毛状体P. Frutescens.具多细胞结构的叶、花和茎:GTs(盾状腺状毛状体PGTs和头状腺状毛状体CGTs)和非腺状毛状体(NGTs) [8].之前的报告指出,GTsP. Frutescens.被认为是合成和积累精油的主要组织,尤其是PGTs。叶片中合成的挥发油成分的数量与PGTs的数量呈正相关[9,10].[14C]-蔗糖示踪实验表明,通过PGTs合成了挥发油中的单萜类和苯丙类成分[9].组织化学定位进一步表明精油的主要成分萜类化合物存在于PGTs中,而不存在于CGTs中[10].此外,PGTs的代谢谱P. Frutescens.尚未报道。除精油外,还有许多其他具有药物生物活性的次生代谢物被合成并积累在植物体内p . frutescens如酚酸(咖啡酸和迷迭香酸)、类黄酮和挥发物(单萜类和倍半萜类),这些物质赋予了这种植物令人愉悦的绿色和紫色,独特的香味和药用价值[11].一些研究集中在不同组织的次级代谢谱P. Frutescens.,但只有少数研究研究了它们的生物合成途径,特别是单萜[12].
在本研究中,我们在叶片上建立了PGT的形态和化学特征P. Frutescens..利用不同组织的代谢组学和转录组数据库鉴定了参与生物活性成分生物合成的候选基因,并对影响毛状体发育的基因进行了初步预测。这些结果增强了我们对植物中生物活性成分生物合成机制的理解P. Frutescens.为进一步研究毛状体,改善其保健功能,提高药用植物质量奠定了坚实的基础。
结果
叶的气生表面有三种腺状毛体
整个工厂P. Frutescens.密被短柔毛。它的叶片正面和背面分别为绿色和软紫色,被称为“重色”P. Frutescens..” The primary roots ofP. Frutescens.比侧根短(补充图)。1).我们研究的植物与465P和绿/红相似紫苏在以往的报告中[11,13].软毛的P. Frutescens.由多细胞GTs和NGTs组成[8].GTs包括PGTs、CGTs和其他形态GTs,均为指状,称为数字化腺毛(DGTs)。这三种类型的GTs都包含基底细胞、茎细胞和头细胞三个部分,类似于其他唇形科植物的GTs [4,5].这三种类型的GTs位于叶子和茎(图。1补充图。1),用扫描电子显微镜和立体显微镜捕捉。PGTs由多细胞头、一个茎细胞和一个基底细胞组成,成熟时呈球状穹隆状(图2)。1a, b).需要注意的是PGTs成熟时分泌物呈黄色。PGTs成熟时高度约42-47 μm,直径约56-60 μm(有4个和8个分泌细胞)。CGTs比PGTs小,球形头直径23-28 μm,高度31-34 μm,具有短茎、单细胞或双细胞头和一个基底细胞的特征(图2)。1dgt由一个头细胞、一个较长的柄细胞和一个基底细胞组成(图1)。1成熟时,高约61 ~ 69 μm,直径约10 ~ 13 μm(补充图)。2和3.).
PGTs和叶、茎、根的代谢物P. Frutescens.
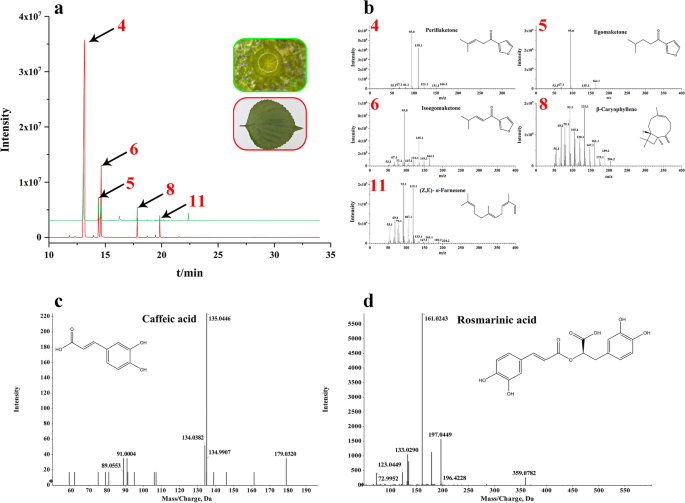
挥发油成分对香气的贡献最大P. Frutescens.以及药物中的有效成分。挥发油是中药材质量的初步评价标准中国药典(2015年版)。通过GC-MS测量叶片,茎,根和PGT挥发物,以研究挥发性成分。通过SDE从叶子(富含PGT),茎和根部的叶子收集精油。使用用溶剂稀释的微量化合物收集来自PGT的分泌物,然后通过GC-MS分析。PGT中有16个峰,叶片中的19个峰,茎中的7个峰,根部7峰。先前已经识别了13个峰,并且八个峰未知。所识别的峰的结果列于表中1,大多数峰值在10分钟后出现。化合物的GC-MS峰质谱见补充图。4.气相色谱-质谱联用结果显示,PGTs的油组分与叶馏出物相似(图2)。2a),表明这些PGTs是商品精油的主要来源。其中以萜类化合物为先导基团。主要化合物紫苏酮约占叶、茎和PGTs挥发油的50%,叶片中异茄酮的含量接近20%,说明紫苏酮的化学类型P. Frutescens.pk-II [14].此外,已知参与挥发油生物合成或积累的主要组织PGTs的挥发性成分与叶的挥发性成分惊人地相似,叶具有11种共同鉴定的化合物。主要化合物的质谱图如图所示。2B,含perillaketone(4),egomaketone(5),isoegomaketone(6),β-石竹烯(8),和(Z,E)-α-法呢烯(11)。
综合鉴定P. Frutescens.,采用LC-MS对化合物进行鉴定P. Frutescens.颜色和药用。因此,采用UPLC-ESI-Q-TOF-MS /MS,通过全扫描阴性和阳性ESI模式,初步研究4个器官的代谢物谱。在我们的研究中,不同器官的组成存在显著差异。补充表S1显示鉴定代谢物的保留时间、分子式和质谱数据(分子和片段离子)。化合物的LC-MS峰和质谱如图所示。5.我们鉴定了71种化合物P. Frutescens.通过阴性和阳性模式,其中类黄酮(16),苯丙醇吡喃(15)和萜类化合物(13)占大的比例。在PGT,叶,茎和根中鉴定了36,63,46和24种化合物。除根外,其他部分的前三种化合物是黄酮类化合物,苯丙醇丙烷和萜类化合物。作为主要代谢物检测到咖啡酸和rosmarinic acid [15].有趣的是,与GC-MS结果相似,PGTs中积累的化合物与叶片惊人的相似,共有30种常见化合物。
上述两种化合物的碎片行为如下所示。化合物10的产物离子质谱(TR = 3.2 min) showed a deprotonated ion [M-H]-在M / Z 179.0320。在MS / MS光谱中,在M / Z 135.0446处的独特产品离子([M-H]--44 amu)对应的是-COOH部分的丢失,确认为咖啡酸(10),其单质公式为C9H8O4(无花果。2c) (16].化合物27 (tR= 4.85 min)在m/z为359.0772时显示出一个去质子化的分子离子。MS/MS碎片模式为m/z 197.0455、179.0360和161.0243三个片段离子。m/z 162 (m/z 359-m /z 197;(mh)--162 amu),被确定为咖啡酰部分的特征[17].M / Z 161.0243的片段离子对应于去质子化的咖啡酰基残基。因此,将化合物27暂时分配给Rosmarinic acid(27)(C18H16O8)(图。2d).使用标准混合物的保留时间来确定所鉴定的咖啡酸和迷迭香酸(补充Fig。6使用标准混合物(补充Fig. A, B)用LC-MS鉴定紫苏酮和异egom酮。6C, D)。
RNA-seq和从头组装和注释结果
通过Illumina高通量测序的不同组织P. Frutescens.从叶、茎、根分别获得52.8、41.0和422亿干净reads(补充表)S2和表格S3).clean reads用Trinity组合成contigs和de novo组合成转录本,共得到315,005个转录本和117,939个unigenes (Supplementary Table)S4).使用CDD、KOG、NR、NT、PFAM、SwissProt、TrEMBL、GO、KEGG等常用数据库共注释了117,939条unigenes,其中分别占34.43%、28.8%、43.94%、31.45%、25.02%、42.73%、43.23%、46.03%、4.74%(补充表)S5).通过NR数据库中的同源物种比较,36.32%的unigenes与NR数据库中的同源性最高胡麻属indicum(胡麻科),紧随其后的是erythranthe guttata.(玄参科)(补充图。7).的GO和KEGG分析的细节示于补充图。8A和B。
deg的识别和注释结果
收集10696度的过滤标准| FoldChange | > 2和核反应能量< 0.05,其中包括4127调节基因和4088年L和R基因表达下调,2548年L和S调节和2574个表达下调,和3203年调节和表达下调2898年代与R,分别为(补充图。9在三次比较中有1126个共同的unigenes(补充图)。9b)。分配了S VS. R,L VS.S和L与L与R比较的参数。在补充图中所示的分类。10得了。生物过程中对刺激、代谢过程和细胞过程的反应在三种比较中得到了丰富;在分子功能方面的催化活性也在三次比较中得到了丰富。为了探索叶、茎、根间毛状体发育的分子基础,我们对大量unigenes进行了GO注释(128,GO:0,010,026;57、GO:0,010,091毛状分支;100, GO:0,010,090毛状体形态发生)(补充表S6).在上述基因中,多数在叶或茎中高表达。11),这与GTs在这些器官聚集的现象一致。KEGG通路分析途径,如植物激素信号转导和生物合成的糖类,类黄酮,monoterpenoids,萜类化合物骨干网、倍半萜类化合物,和常用药用浓缩在S与R和L和R L和S,只有phenylpropanoid,类黄酮,sesquiterpenoid,三萜的生物合成得到了丰富,与次生代谢产物的分布趋势相同(补充图)。10D-F)。
与次级代谢物相关的deg
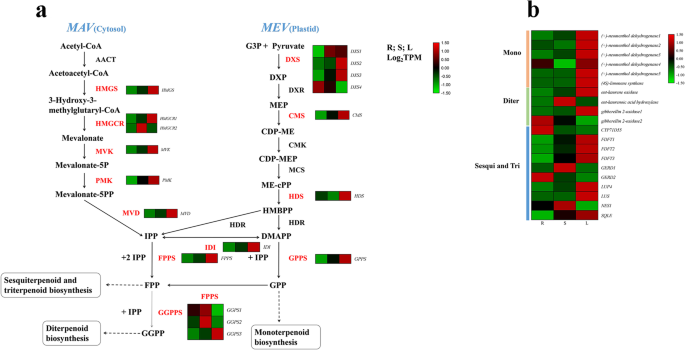
KEGG数据库中注释的途径涉及次生代谢产物的生物合成。我们结合转录组学和代谢组学数据,探索三种组织中涉及萜类、类黄酮和苯丙类生物合成的关键基因。萜类和多酮类的代谢包含8条途径,其中最多的DEGs(23个unigenes)被定位到萜类主链生物合成(补充图)。12).与代谢谱和萜类生物合成相对应,我们的目标是萜类主干、单萜类、二萜类、倍半萜类和三萜类生物合成。在这些unigenes中,鉴定出38个DEGs编码控制萜类生物合成的24种关键酶,详细信息列于Supplementary TableS7.这些unigenes主要定位于2- c -甲基- d -赤藓糖醇4-磷酸和甲戊酸途径(图)。3.).的四个DXS基因,DXS1,DXS2,DXS4显示出叶子中最高的表达,它们位于萜类生物合成的上游。这些结果表明DXS是生成2- c -甲基- d -赤藓糖醇4-磷酸途径的重要途径,值得进一步进行功能表征。与单萜生物合成相关的基因也呈现出同样的趋势,这可能导致单萜的积累[9].
萜类化合物的生物合成(一个)及热图(b)与单萜、二萜和倍半萜生物合成相关的二萜类化合物;AACT,乙酰辅酶a乙酰转移酶;邮政编码hydroxymethylglutaryl-CoA;HMGCR.,羟甲基戊族辅酶CoA还原酶合成酶;MVK.,甲羟戊酸激酶;两家公司phosphomevalonate激酶;MVD.,甲醛二磷酸脱羧酶;DXS,1-脱氧d木酮糖-5-磷酸合酶;DXR, 1-deoxy-D-xylulose-5-phosphate reductoisomerase;CMS2- c -甲基- d -赤藓醇4-磷酸胞苷转移酶;CMK4-diphosphocytidyl-2-C-methyl-D-erythritol激酶;MCS2- c -甲基- d -赤藓醇2,4-环二磷酸合酶;HDS4-羟基-3-甲基-2-烯基二磷酸合酶;HDR4-羟基-3-甲基-2-烯基二磷酸还原酶;伊蒂,焦磷酸异戊烯异构酶;gpp香叶酰二磷酸合酶;FPPS法尼基二磷酸合酶;GGPPS,天竺葵二磷酸二磷酸合成酶;CYP71D55premnaspirodiene氧化酶;FDFT1, farnesyl-diphosphate治疗;杰德, (-)-germacrene D合酶;LUP4beta-amyrin合成酶;逻辑单元羽扇豆醇合成酶;NES1(3 s, 6 e)橙花叔醇合成酶;SQLE角鲨烯单氧酶。Unigenes级别数据由TPM表示。红色字母代表deg。红色和绿色分别代表高低表达水平
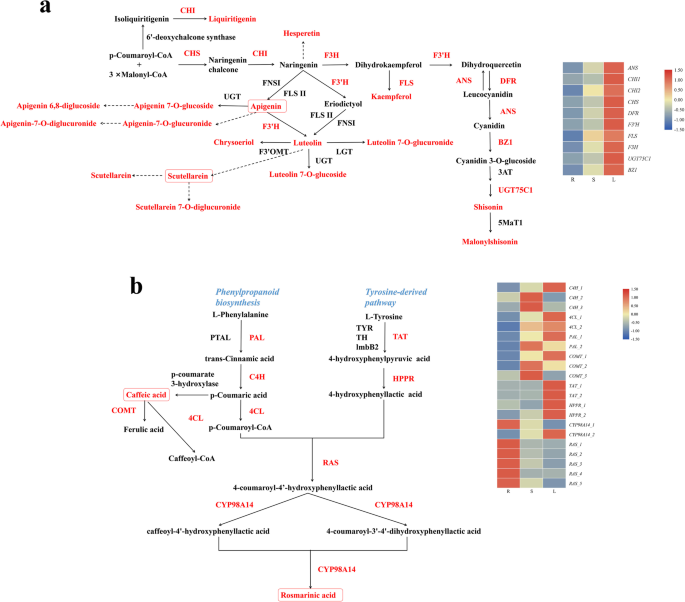
叶子和茎的P. Frutescens.显示令人愉快的紫色和绿色,其被遗传控制,以积累大量的花青素(特别是麦隆氏素)[18].在我们的研究中,有10个DEGs与类黄酮生物合成和花青素生物合成上游相关,均在叶片中高表达(图2)。4a).结合苯丙烷类生物合成和酪氨酸来源的途径,21个编码8个关键基因的unigenes被分配到迷迭香酸和咖啡酸的生物合成(图。4B)[19].在上述两种途径DEGS显示出类似的表达模式,不同之处在于拉被高度上调根。参与苯丙生物合成的代谢物和其他DEGS列于补充图。13.
DEG与毛状体发育
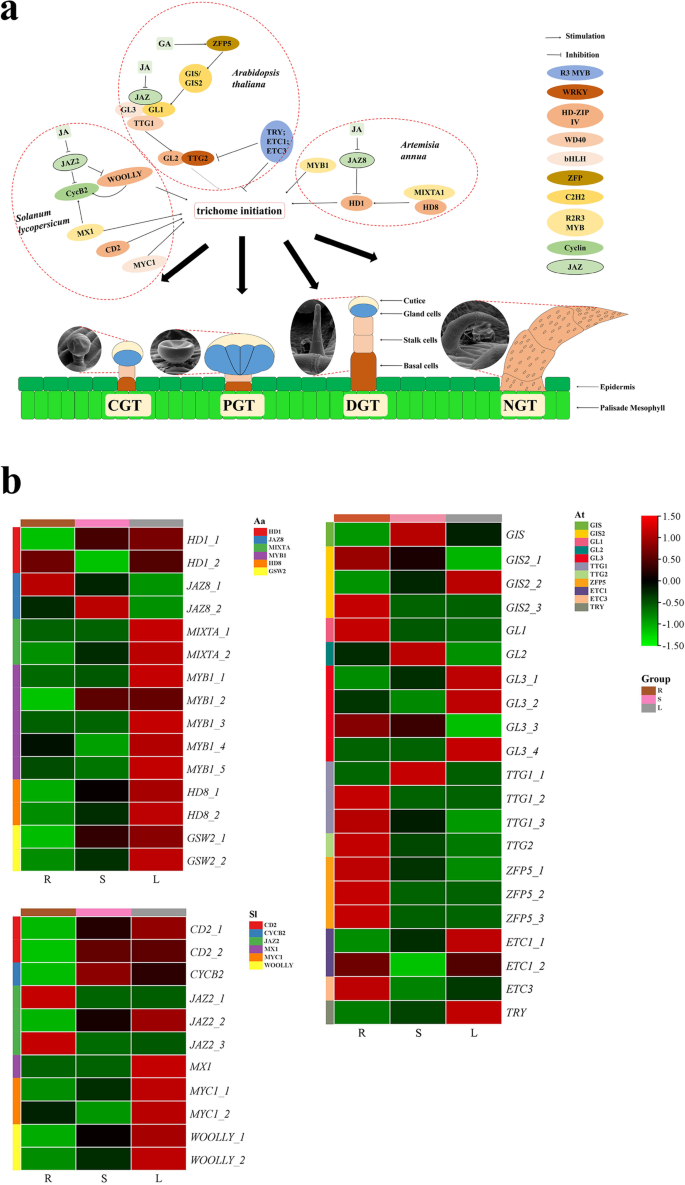
毛状体分为无腺的或腺的。拟南芥有单细胞非毛状体,而茄属植物lycopersicum和青蒿具多细胞腺毛。与毛状体起始和发育相关的基因已被广泛报道,包括TTG1.,GL1,GL3的答:芥;MYC1,mx₁,张的美国lycopersicum;和MIXTA,MYB1,即的黄花蒿。根据这些报道,我们在转录组中筛选了46个编码21个关键基因的unigenes(图。5).除了21个同源单基因答:芥,同源基因的表达模式黄花蒿(13个unigenes)与番茄(12个unigenes)相似。同源基因SlMYC1,SlMX1,SlCD2,SlWOOLLY, AaMIXTA,Aamyb1.,AaHD1,AaHD8,AAGWS2.据报道,据报道,促进胎儿的发展,所有人都表达了高度表达的叶子。在46个培养基的发展相关的未成年人中,大多数是属于R2R3 MYB,WD40,BHLH和HD-ZIP IV家族的TFS。
植物激素也已经报道以调节毛状体起始和发展,如赤霉素(GA)和茉莉酸(JA)6,20.].我们的转录组数据分析显示,将多种基因映射到活性信号通路。在GA和JA途径中,我们分别识别了24和37个unigenes(补充图。14).此外,16德拉18.JAZ在这些负调控毛状体生长发育的unigenes中进行了筛选[21,22].正如预期的那样,最德拉和JAZ在富含毛状体的叶子中下调。
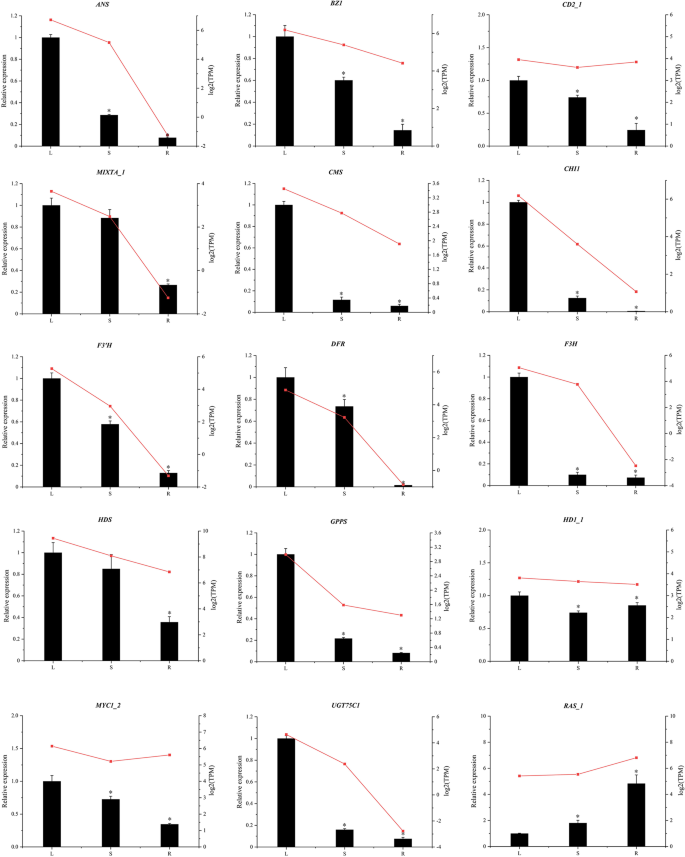
QRT-PCR验证的基因表达
选择十五度的视角,以验证使用qRT-PCR的转录数据的准确性。这些关键结构基因参与萜类化合物,类黄酮,和酚酸,和毛状体形成的生物合成途径。特异性引物使用Primer Premier 5.0软件(补充表设计S8).一般而言,表达模式来确定通过qRT-PCR显示出相似的趋势,以RNA-SEQ(图6及补充表S9),证实了本研究报道的RNA-Seq结果的准确性。
讨论
P.frutescens是一种众所周知的药用和食用植物,在亚洲已广泛种植了2000多年[23].叶子和茎通常呈绿色或紫色。挥发油是挥发油的主要成分之一P. Frutescens.,并根据精油的主要成分描述了不同的化学类型[24,25].化学类型在补充表中列出S10,推测的合成途径见补充图。15[14].P. Frutescens.在我们的研究中被鉴定为在中国广泛栽培的PK-II型。为了进一步挖掘营养和药用潜力,我们整合了不同组织的代谢物分析和转录组分析。此外,我们首次展示了PGT分泌的代谢谱。
毛茛属植物GTs的形态和分布
在以前的报告中,已经阐述了P. Frutescens.有两种腺毛状体(PGTs和CGTs), PGTs是精油生物合成和积累的主要组织,数量和大小都占优势[9,10].我们认证的另一根手指状形状的GT,名为DGT(图1和补充图。2I-L),类似于II型cgt,具有单细胞基部,两个伸长的柄细胞和一个头细胞[10].分泌细胞数量与发表论文一致(PGT多为8个细胞,CGTs多为1 ~ 2个细胞)[8,9,10].在立体显微镜下,将表皮与分泌细胞分离而形成的大的角质层下储藏空间中填充黄色精油,如薄荷中的PGTs [26].与pgt相比,cgt的存储容量受限于较小的体积和较少的分泌细胞。如图补充图所示。2E-G显示有两种类型的cgt,含彩色透明的腺头。cgt是否有两种类型,以及它们的发育顺序,还需要进一步研究。dgt中只有1个透明头细胞,尚不清楚其分泌能力。其基底细胞在发育过程中可能会扩大,如补充图所示。2i (k。PGTs、CGTs和DGTs主要分布在叶面和茎干上,在中心脉和叶基部附近分布最为丰富。综上所述,我们的数据中GTs的形态特征和发生情况与之前的报道相似P. Frutescens.,这也类似于GTs美国tenuifolia[5]和各种x、[27],属于Labiaceae。
PGTs、叶、茎、根的代谢物变化
PGTs,叶,茎和根的代谢物图谱表明,最富集的化合物是萜类化合物,类黄酮,酚酸,和脂肪酸(表1补充表S1),而PGTs在叶片中被证实的化合物极为相似。理论上,PGT所含化合物应在叶片中检测到,而叶片提取物比PGT分泌物更丰富。除了PGTs外,叶片中还含有其他类型的细胞和GTs,超声波提取过程中产生的能量和热量导致化合物的变化或丢失。该方法使用微吸管收集PGTs的分泌物,导致代谢谱更接近那些化合物在体内。egom酮是紫苏酮和异egom酮的前体。15).紫苏酮和异egom酮在PGTs中含量低于叶片。而egom酮含量则相反,因为PGT分析节点1(从茎尖到根)的叶片年龄小于提取节点1和节点2,这可能反映了叶挥发油成分的发育动态。根中单萜类和倍半萜类的相对含量极低或不存在。在LC-MS分析中P. Frutescens.,分别由类黄酮和苯丙素生物合成产生酚酸和黄酮类化合物[15].紫色的叶子富含花青素色素,如丙二酰草青素[18,28].与其他组织相比,在PGTs和叶片中检测到的强度最高。有趣的是,强度较高的PGTs为金,而叶片背面为紫色。花青素对光线、温度和pH值敏感[29].这些分析证实PGTs中含有大量累积的生物活性成分P. Frutescens..
代谢产物的生物合成的分子机制
单萜类和倍半萜类是黄芩挥发油的主要成分P. Frutescens..主要类型之间的交叉实验紫苏表明不同的化学类型受到严格的遗传控制[30.].这些趋化物中的挥发性油的主要成分由甲戊类和Shikimic酸途径产生(补充图。15).存在G基因是通过甲戊酸途径启动单萜类生物合成所必需的。当开始是由隐性基因控制时h,香叶酰焦磷酸催化转坦-柠檬醛,在多基因调控下最终生成紫苏酮[30.].虽然精油的生物合成途径紫苏但控制这些途径的关键基因仍不清楚。然而,缺乏的是紫苏基因组学的研究使单萜类化合物的完整生物合成途径成为一个巨大的挑战P. Frutescens..大量未注释的unigenes(44.03%,补充表S5)在我们的转录组中,需要进一步的探索,这可以作为在未来合成危明术的关键基因。
花青素的关键基因答,位于茎的表皮细胞中,花青素聚集于此[28].补充图中的杆横截面。16显示了类似的结果。答,DFR,BZ1.,UGT75C1是丙二酰胺的生物合成途径中的关键基因,这些叶片高度表达的叶片在LC-MS数据中的花青素强度一致。罗哌啶酸的生物合成由一般苯丙烷丙醇途径和酪氨酸衍生的途径产生[19].的拉将两种途径的产物偶联,然后羟基化CYP98A14形成迷迭香酸(图。4) [31].七台折腾被注释为拉(5)和CYP98A14(2),大部分在迷迭香酸浓度最低的根中高表达。这可能是由于预测基因可能参与了根的其他代谢途径。
与毛状体发育相关的基因和植物激素
与有浓密毛状体的叶片和无毛状体的根的转录组相比,可通过qRT-PCR对与毛状体起始发育相关的基因进行初步分析。从我们的数据中选择了一些与毛状体起始和发育相关的同源基因(图。6).在答:芥TTG1、GL3、GL1由WD40/bHLH/MYB复合物组成,调控下游GL2和TTG2.表达刺激表皮细胞分化成非毛状体[1,32].在黄花蒿,AaHD8与之交互AaMIXTA1并调节的表达AaHD1诱导GT启动[33].SlMX1,SlCD2,最接近的同源物AaHD8,长毛,SlMYC1,SlCycB2,正向规管GTs的启动[1,34,35].同源基因的表达模式黄花蒿和番茄是相似的,而大多数基因在叶片中高表达。然而,同源基因的表达答:芥是完全不同的。这些同源基因的功能将在未来得到进一步的研究P. Frutescens..由于它们的毛状体种类多样答:芥是一个单独的ngt,而黄花蒿番茄有多细胞的GTs,与番茄的GTs相似P. Frutescens.(无花果。5),提示GTs形成的基因调控网络不同于NGTs的形成答:芥。然而,一些基因可能在毛状体的起始调控中具有保守功能黄栌,黄栌,和番茄[2,32,36,37].例如,AtMYB61在答:芥是ortholog的黄花蒿AaMYB1, myb61突变体的NGT密度较低,提示AtMYB61正调控NGTs的起始答:芥[2,32,36,37];SlTRY是ortholog的AtTRY,是一种NGT启动的抑制剂答:芥.转换时SlTRY成答:芥,NGT的发展受到显着抑制[36].
此外,Ga和Ja激素通过转录调节调节毛状体发展ZFP和JAZ(补充图。14).上述三种植物的毛状体类型各不相同,但激素对毛状体发育的调控具有相似的规律。因此,在植物王国中,植物激素可能共享一个共同的调控网络。JA和GA除了能调节毛状体外,还能增加萜类等次生代谢产物的合成。JAZ和DELLA可通过外源施用JA和GA降解,进而转录活性提高MYC2的发布,促进了TPS提高三萜的合成率[38].JAR1和MYC2,被称为JA信号通路中的激活转录因子,在叶片中高度表达。它们的高表达可以增加苯丙素、萜类和生物碱的含量,在植物胁迫信号转导中发挥重要作用[39,40].因此,种植密集间隔的gtP. Frutescens.具有很高的药用和营养品质是未来的目标。对其分子基础的研究将会引起人们极大的兴趣P. Frutescens.毛状体发育和单萜生物合成的完整特征。
结论
在这项研究中,我们提供了pget积累的萜类(紫苏酮、异egom酮和egom酮)代谢谱的确凿证据,以及叶、茎和根的转录组和代谢谱,揭示了萜类、黄酮类化合物(丙二酰草胺素)、酚酸(迷迭香酸和咖啡酸)的生物合成。基因,如DER和答,与丙二酰草黄素生物合成相关的基因在叶片中高度表达,丙二酰草黄素的表达强度较高。属于R2R2-MYB和HD-ZIP IV家族的基因,如MIXTA例如和HD1类,可调节毛状体发育P. Frutescens..这项研究为主要化合物的形态、代谢谱和生物合成途径提供了新的见解。在今后的研究中,需要进一步揭示毛状体形成和单萜类生物合成途径中调控网络的新分子机制p . frutescens。
材料和方法
植物材料和样品制备
的种子P. Frutescens.(l)Britt品种购自中国河北省安国市药品市场,实验室4°C保存。2020年3月中旬,利用植物营养土壤(Miracle-Gro营养土壤,Scotts Miracle-Gro, Marysville, OH USA)在植物加速器中播种种子。在温室控制条件下(昼/夜,10/14 h, 30/25°C, 60% RH)在植物管中生长。当植株高度约为50厘米时,在2020年6月中旬分三次单独收获幼叶(节1和节2)、茎和根。这种植物材料是P. Frutescens.(L.)从药房的中国南京中医药大学学院,通过这篇文章(秦安吴教授)的通讯作者中鉴定。他们共收集RNA-Seq的,GC-MS和LC-MS分析。
样品制备
采用改进的同时蒸馏法(SDE,改进的Likens-Nickerson设备,Luxin, Shanghai, China)从叶、茎和根中提取挥发性化合物1 h。根据前期实验,准确称取30 g新鲜组织,在150ml圆底烧瓶中加入去离子水混合。然后,它被连接到一个改良的Likens-Nickerson仪器上。另一个装有50毫升正己烷的圆底烧瓶也连接到仪器上。圆底烧瓶两侧同时加热。水通过含有95%乙醇的冷凝器(中国南京科尔市DLSB-5L/25低温冷却剂循环泵)。在两个烧瓶中的溶剂开始沸腾后进行1 h,最后将提取物收集到一个棕色的瓶子中。Na2所以4加入到提取物中以进行脱水。将上清液离心并储存在-80℃。对于PGT中的挥发性油,我们使用了微量移植方法。拉伸10μL的毛细管,以形成锥形移液管的尖端(WD-1微电极绘图仪; Chendu,China)。它用于在立体显微镜下吸收来自幼叶(节点1)的叶子表面的波纹的波动油。然后,将毛细管的尖端分解成含有50μl正己烷的液相小瓶。根据初步实验,收集的PGT的数量约为240并储存在-80℃。
咖啡酸标准品购自德斯特(成都工业有限公司)。迷迭香酸标准品购自南京森倍佳生物科技有限公司。紫苏酮标准品购自TLC (TLC Pharmaceutical Standards Ltd, Newmarket, Ontario, Canada)。isoegomaketone标准购自CFWLABS (CFW Laboratories, Inc., Newark, DE, USA)。
气相色谱条件
Agilent 7893A气相色谱仪与Agilent 7000C质谱仪(Agilent Technologies,Santa Clara,CA,USA)相结合,用于挥发性化合物的定性和半定量测定。电离电压,喷射器温度和离子源温度分别为70eV,260℃和250℃。将质谱从30〜500 AMU扫描。Agilent 19091S-433 HP-5 MS(30米×250μm×0.25μm; Agilent Technologies,Santa Clara,CA,USA)用于分离挥发物。柱温最初为50℃(保持3分钟),然后以10℃/ min(保持3分钟)的速率升至100℃,最后在5℃/ min下升至200℃(持续3分钟)。用20:1分裂比以1.5ml / min的流速用作载气的载体气体以1.5ml / min的流速用作1μl的流速。定性地通过将样品的保留时间,保留指数和标准的质谱进行比较,在可用的标准和使用NIST 14.0(NIST,Gaithersburg,MD。,USA)图书馆的情况下进行定性分析化合物。化合物的相对含量通过根据以下公式计算的面积标准化方法测定:
(Ci:化合物i的相对含量;Ai:化合物i的峰面积)。
UPLC-ESI-Q-TOF-MS / MS条件
根据前期实验,我们称量叶、茎、根(5.0 g)(准确至0.01 g),加入80%甲醇共20 mL,利用超声波提取设备(中国昆山河川KH-300SP超声波提取设备)对组织进行提取,每次提取30 min,共3次。提取液稀释10倍。溶液在13000 rpm下离心10分钟,然后通过0.22 μm的过滤膜。PGT分泌物的收集与GC-MS相同,根据我们的初步实验,GC-MS在80%甲醇中收集了约500个PGTs [41,42,43].
在三倍TOF 5600上分析了代谢物型材+系统(AB SCIEX,Foster City,CA,USA)与ESI源耦合到UPLC系统(Shimadzu 30a Uhplc系统,Shimadzu,日本)。对于UPLC分析,将4μL样品注入分析反相柱(Agilent延伸-C18,100mm×2.1mm,1.8μm)中。用0.1%甲酸在水和乙腈中进行分离。总运行时间为34分钟,流速为0.3ml / min。柱子隔室保持在40℃。流动相使用梯度洗脱5%-70%乙腈(0-10分钟),70%-95%乙腈(10-28分钟),95%乙腈(28-30分钟),4分钟返回初始条件为5%乙腈。
TOF分析采用双喷雾源的阳性和阴性ESI模式,TOF - MS和TOF - MS/MS扫描的质量扫描范围均为m/z 50-2000。采用的参数如下:离子喷雾电压,5500/-4500 V;涡轮喷雾温度,550°C;帘气,35 psi;雾化器气体,55°C;碰撞压力,40v;碰撞能量扩散,20/-20 V;聚簇电位,60/-60 V;离子释放延迟,66.63;铁释放宽度24.92。 Analyst TF software (version 1.6, AB SCIEX, Foster City, CA, USA) combined with information-dependent acquisition packing was used to acquire MS/MS data. The spectra peaks were identified via the database from related literature of紫苏在中国知网、PUBMED、SciFinder中搜索。同时,使用Chemical Book、SciFinder和PubChem下载化合物的摩尔文件,并与Peakview软件(版本1.2,AB SCIEX, Foster City, CA, USA)进行比较。
扫描电子显微镜(SEM)和立体显微镜分析
使用立体显微镜(SetREO Discovery)评估了GTs的形态和分布。V20,蔡司,耶拿,德国)和SEM (SU3500,日立,日本东京)。用载玻片固定组织,用立体显微镜观察。扫描电镜:叶片在4℃下,在0.1 M磷酸盐缓冲液(pH 7.3)中,用2.5% (v/v)戊二醛固定12 h。然后用磷酸盐缓冲盐水溶液(赛默Fisher,上海,中国)洗涤3次,每次15分钟,然后用丙酮稀释系列(30、50、70、90和100%)脱水。丙酮一夜之间被叔丁醇取代。材料在冷冻干燥机(FreeZone 2.5升台式冷冻干燥系统,Labconco,堪萨斯州,美国)中干燥过夜。然后这些样品被镀金(EM ACE200, Leica Microsystems, Leica Microsystems, Wetzlar, Germany)。然后用扫描电子显微镜观察和拍摄涂层样品。
RNA延伸和转录组分析
从3个生物叶片重复中提取总RNA进行RNA- seq。从植物各部分(叶、茎和根)的四个生物复制体中提取总RNA进行qRT-PCR。使用1%琼脂糖凝胶监测RNA降解和污染。使用纳米光度计(Implen, Westlake Village, CA, USA)检测RNA纯度。使用Qubit RNA检测试剂盒在Qubit 2.0荧光仪(Life Technologies, Carlsbad, CA, USA)中测量RNA浓度。使用安捷伦生物分析仪2100系统(安捷伦技术公司,Santa Clara, CA, USA)的RNA Nano 6000检测试剂盒评估RNA完整性。用于测序、数据评估、质量控制和RNA-seq评估的cDNA文库制备在补充文件中提供1.
剩余的清洁读数是使用Trinity(版本2.0.6)的转录物组装到默认设置。聚集具有最小长度为200bp的转录物以最小化冗余。对于每个簇(表示同一基因的转录复杂性),保存最长序列并指定为unigenes。unigenes针对NCBI NR(NCBI非冗余蛋白数据库),Swissprot,Trembl,CDD(保守域数据库),PFAM和Kog(真核外科群组)数据库(E值<1E-5)爆炸。根据NR的最佳排列结果的优先顺序,根据密码表,Swissprot和Trembl确定未肢体ORF和CD和CD和相应的氨基酸序列。同时,转码器(3.0.1版)用于预测未对齐的unigenes的CDS序列。基因本体(GO)功能注释信息是根据Swissprot和TremBL的转录结果获得的。Kegg(基因和基因组的京都百科全书)用于KEGG注释,自动注释服务器(KAAS,版本2.1)。
的差异表达基因(DEGS)
每百万份转录本是用来计算RNA库中转录本的比例。它考虑了序列深度和基因长度以及样本对读取计数的影响。使用Salmon(版本0.8.2)来计算每百万unigenes的读计数和转录本。根据每个基因的读计数来计算DEGs。对于具有生物重复性的样品,使用DESeq(版本1.12.4)进行分析。为获得显著差异基因,筛选条件设定为q值< 0.05,差异倍数|FoldChange|> 2。deg的功能富集分析显示在补充文件中1.
验证QRT-PCR
为了验证转录组的准确性,我们选择了涉及类黄酮、迷迭香酸、萜类生物合成途径和毛状体发育的15个候选基因,并使用QuantStudio 3 (Thermo Fisher Scientific Inc., Waltham, MA, USA)进行了研究。qPCR方案为95℃30 s、95℃10 s、60℃30 s 40个循环,并进行熔化曲线分析。本研究使用的基因特异性引物列于补充表S8.β-actin (TRINITY_DN47478_c3_g1)作为内参[44].2-ΔΔCT方法计算基因的相对表达量。每个基因在qRT-PCR实验中使用4个生物学重复。
统计分析
基因表达的显著差异采用配对样本t检验,显著性水平为p< 0.05,使用SPSS版本24 (SPSS Inc., Chicago, IL, USA)。所有qRT-PCR表达分析均在4个重复中进行。数据以均数±均数标准误差表示。使用TBtools软件(版本1.064)构建热图。
数据和材料的可用性
叶、茎和根的原始RNA-seq数据可从NCBI序列读取档案(SRA;加入数量:PRJNA690131,https://www.ncbi.nlm.nih.gov/bioproject/PRJNA690131).
缩写
- GTs:
-
腺毛状体
- 页面表:
-
盾状的腺毛状体
- 年:
-
头状花序的腺毛状体
- 总局:
-
Digitiform腺毛
- NGTs:
-
Non-glandular毛状体
- SDE:
-
同时蒸馏萃取
- CDD:
-
保守域数据库
- 走:
-
基因本体论
- 度:
-
差异表达基因
参考文献
- 1.
陈志强,陈志强,陈志强,等。腺毛发育的遗传控制。植物科学进展,2020;25(5):477-87。
- 2.
不同的监管网络导致趋同结构。植物科学进展。2006;11(6):274-80。
- 3.
利用植物毛状体生物化学生产有用化合物。植物j . 2008; 54(4): 702 - 11所示。
- 4.
Lange BM, Mahmoud SS, Wildung MR, Turner GW, Davis EM, Lange I, Baker RC, Boydston RA, Croteau RB。利用代谢工程提高薄荷精油得率及成分。中国科学(d辑:地球科学)2011;108(41):16944-9。
- 5.
刘超,Srividya N, Parrish AN, Yue W, Shan M, Wu Q, Lange BM。日本猫薄荷腺毛的形态(Schizonepeta tenuifolia和它们分泌活动的发育动态。植物化学。2018;150:23-30。
- 6.
梅斯L,范Nieuwerburgh FC,张Y,里德DW,PollierĴ,范德CS,Inze d,Covello PS,Deforce DL,在抗疟疾化合物青蒿素毛状体形成和生物合成的phytohormonal调节Goossens的A.解剖青蒿植物。新植物。2011; 189(1):176-89。
- 7.
黄芪挥发油的含量、成分、总多酚和抗氧化能力的鉴定与定量分析Perilla frutescens.(l)布瑞特。食品化学2018;275(打算):730 - 738。
- 8.
闫霞,郑华。植物形态结构与发育研究Perilla frutescens.腺毛。ACTA牡丹BOREALI-Occiden仙。1997; 05:18-21。
- 9.
王志强,王志强,王志强,等。中华绒螯蟹腺毛形成的遗传控制Perilla frutescens..58足底医学。1992;(2):188 - 91。
- 10.
李伟:紫苏醛型的评价紫苏.,第99卷:北京协和医学院;2019.
- 11.
绿/红和绿紫苏营养重要代谢物分析(Perilla frutescens.栽培品种:比较研究。农业科学与技术。2020;151:112441。
- 12.
苏子酮、次生植物代谢产物和抗氧化能力的测定Perilla frutescens.L.品种。食品化学毒素。2010; 48(1):264-70。
- 13.
艾哈迈德HM。的Ethnomedicinal,植物化学和药理学研究Perilla frutescens.(l)布瑞特。分子。2019;24(1):102。
- 14.
王志强,王志强,王志强,等。白藜芦醇形成的遗传控制Perilla frutescens..生物化学麝猫。1994;32(5 - 6):155。
- 15.
Lee YH, Kim B, Kim S, Kim MS, Kim H, Hwang SR, Kim K, Lee JH。紫苏叶的代谢物特征(Perilla frutescens.)的超高效液相色谱-电喷雾电离四极杆飞行时间质谱联用,并筛选其抗氧化性能。食品药物肛管杂志。2017;25(4):776-88。
- 16.
Jun HI, Kim BT, Song GS, Kim YS。紫苏酚类抗氧化剂的结构表征(Perilla frutescens.var。acuta)叶子。食品化学。2014; 148:367-72。
- 17.
Olivier DK, Wyk BEV, Heerden FRV。酚酸的化学分类和药用意义Arctopus和Alepidea(伞形科亚科Saniculoideae).生化SYST ECOL。2008; 36(9):724-9。
- 18.
福岛A, Nakamura M, Suzuki H, Saito K, Yamazaki M.高通量测序和从头组装的红色和绿色形式Perilla frutescens.var。皱转录。公共科学图书馆之一。2015; 10(6):e129154。
- 19.
王波,孙伟,李强,李勇,罗华,宋军,孙超,钱军,朱勇,海华A,等。酚酸生物合成基因的全基因组鉴定丹参.Planta。2015; 241(3):711-25。
- 20.
博顿AJ,胡佛K,费尔顿GW。施用茉莉酸甲酯可增加番茄腺毛的密度Lycopersicon esculentum.化学学报。2005;31(9):2211-6。
- 21.
齐T,宋S,仁Q,吴d,黄H,陈勇,樊男,彭W,任C,谢D.茉莉酸类,ZIM结构域蛋白与WD重复/的bHLH / MYB复合物调节互动茉莉介导的花色素苷积累和皮毛开始在拟南芥.植物细胞。2011;23(5):1795 - 814。
- 22.
齐涛,黄华,吴东,严建军,齐勇,宋松,谢东东。拟南芥DELLA和JAZ蛋白结合WD-repeat/bHLH/MYB复合物调控赤霉素和茉莉酸信号的协同作用。植物细胞,2014,26(3):1118 - 33所示。
- 23。
Fujiwara Y,Kono M,ITO A,Ito M.花青素紫苏属植物和干燥的叶子。植物化学,2018;147:158 - 66。
- 24。
黄芪挥发油的含量、成分、总多酚和抗氧化能力的鉴定与定量Perilla frutescens.(l)布瑞特。食品化学。2019;275:730-8。
- 25。
小林,小林,吉田。栽培与野生植物精油的变异紫苏通过GC / MS进行分析。生化SYST ECOL。2006; 34(1):25-37。
- 26。
Turner GW, Gershenzon J, Croteau RB。薄荷正在发育的叶上盾状腺毛的分布。植物杂志。2000;124(2):655 - 64。
- 27。
植物腺毛:具有高生物技术价值的天然细胞工厂。植物杂志。2017;175(1):第6 - 22。
- 28。
Yamazaki M, Nakajima J, Yamanashi M, Sugiyama M, Makita Y, Springob K, Awazuhara M, Saito K.代谢组学和花青素化学品种形式的差异基因表达Perilla frutescens..植物化学。2003; 62(6):987-95。
- 29。
黄绿素、红色素的色稳定性研究紫苏(紫苏属ocimoidescrispa Benth)。食品化学,1983;10(1):69 - 77。
- 30.
陈志强,陈志强,陈志强,等。植物挥发油遗传变异的研究进展Perilla frutescens..生物化学麝猫。1995;33(9):341 - 8。
- 31.
迷迭香酸。植物化学。2003;62(2):121 - 5。
- 32.
杨超,叶志忠。毛状体作为植物细胞分化的模型。细胞生物学杂志。2013;70(11):1937-48。
- 33.
严涛,李丽,谢林,陈明,沈强,潘强,付旭,石鹏,唐勇,黄辉,等。一种新型HD-ZIP IV/MIXTA复合物促进腺毛的形成和角质层的发育青蒿.新植醇。2018;218(2):567 - 78。
- 34.
Nadakuduti SS,Pollard M,Kosma DK,Allen CJ,Ohlrogge JB,Barry CS。粘性果皮突变体的含磷表型为Cutin Devare2在番茄中表皮细胞功能中的作用提供了新的洞察。植物理性。2012; 159(3):945-60。
- 35.
徐杰,van Herwijnen Zo,Drager DB,Sui C,Haring Ma,Schuurink RC。SLMYC1在番茄腺细胞中调节型vi腺滴毛组形成和萜烯生物合成。植物细胞。2018; 30(12):2988-3005。
- 36.
Tominaga-Wada R, Nukumizu Y, Sato S, Wada T.番茄对植物毛和根毛发育的控制(茄属植物lycopersicum)R3 MYB转录因子。Plos一个。2013; 8(1):e54019。
- 37.
姜伟,杨克明,杨克明。AaMYB1及其同源基因AtMYB61对毛状体发育和萜烯代谢的影响青蒿和拟南芥.植物杂志2017; 90(3):520-34。
- 38.
洪国杰,薛学勇,毛奕波,王丽娟,陈小燕。拟南芥MYC2与DELLA蛋白相互作用调控倍半萜合酶基因表达。植物细胞,2012;24(6):2635 - 48。
- 39.
沈强,吕旭,严涛,付旭,吕志,张芳,潘强,王刚,孙旭,唐克勤。茉莉酸响应型AaMYC2转录因子对青蒿素生物合成的正向调控青蒿.新植醇。2016, 210(4): 1269 - 81。
- 40.
周勇,孙伟,陈静,谭华,肖勇,李强,季强,高胜,陈丽,陈胜,等。SmMYC2a和SmMYC2b对丹参酮和酚酸的生物合成具有相似但不可替代的调节作用丹参.SCI REP-UK。2016; 6(1): 22852。
- 41.
黄玲,苏琪,张旭,孙军,程旭,魏峰。迷迭香酸的测定Perilla frutescens.(l)马金和马金Perilla frutescens.(l)Britt.var.acuta(研究)。工藤在不同的收获时间点。中华肛管杂志。2012;32(10):1753-5。
- 42.
康强,李志,樊胜,荣锐,姜辉,姜旭,张军,龚磊Perilla frutescens.UPLC-Q-Exactive-Orbitrap-MS分析。中国中药方剂杂志。2020;26(13):156-62。
- 43.
田强,张旭,张智,梁智,方超,岳明。不同粒径的黄芪多糖含量及特征色谱图研究Perillae主茎.广东药学院学报。2020;36(03):345-51。
- 44.
宫志强,山崎敏,田中勇,齐藤。植物花青素合成相关结构基因的克隆与分子分析Perilla frutescens..植物学报。1997;35(6):915-27。
致谢
不适用。
资金
本工作得到了中国自然科学基金的支持(CL,81973435和81473313和QW的81473313),2017年中医公共卫生补贴项目“全国中医资源国家一般调查”(财务协会(2017年)第66号(2018年江苏省Dao-di草药种类研究质量特征研究QW。
作者信息
从属关系
贡献
PZ构思了这项研究。CL和QW指导了这项研究。PZ和MY进行了大部分实验,并对结果进行了分析。PZ、SD、KB和LS对田间试验有贡献。PZ撰写了手稿,并得到了所有作者的反馈。所有作者均已阅读并批准本稿件。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
两位作者宣称没有相互竞争的利益。
额外的信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1:补充图1
.叶片的形态(ZAAX,A和Adaxial,B表面),茎(D)和根(C)P. Frutescens.(酒吧= 1毫米)。
附加文件2:补充图2
.腺毛的形态P. Frutescens.(酒吧= 0.05毫米);A, B, C, D表示PGTs;E, F, G, H表示CGTs;I J K L表示dgt。
额外的文件3
:补充图3.中腺毛的测量P. Frutescens.(酒吧= 0.05毫米);A, B为PGTs;C, D表示dgt;E, F代表dgt。
附加文件4:补充图4。
.叶(A)、PGTs (B)、茎(C)、根(D)挥发油提取液的GC-MS峰及其重叠峰。
附加文件5:补充图5
.叶、茎、根、PGTs精油提取液的LC-MS峰,ESI模式为阳性和阴性;A表示叶pos, B表示叶负;C为阳性茎,D为阴性茎;E表示根pos, F表示根为负;G表示PGTs阳性,H表示PGTs阴性。
额外的文件6
:补充图6.标准混合物的LC-MS峰和标准混合物和提取物的质谱;咖啡酸标准峰(A)和质谱(B),咖啡酸提取物质谱(C);迷迭香酸标准峰(D)和质谱(E),迷迭香酸提取物质谱(F);紫苏酮标准峰(G)和质谱(H),紫苏酮提取物质谱(I);异烟茄酮标准峰(J)和质谱(K),异烟茄酮提取物质谱(L)。
额外的文件7
:补充图7.物种的分布P. Frutescens.针对NR数据库的同源物。
额外的文件8
:补充图8.GO(A)和KEGG(B)的分析p . frutescens。
额外的文件9
:补充图9.二氏barplot (A)和二氏venn (B)p . frutescens。
额外的文件10
:补充图10.S vs R (A, D)、L vs S (B,E)、L vs R (C, F)的GO分类及KEGG通路。
额外的文件11
:补充图11.毛状体分支(A)、毛状体分化(B)和毛状体形态发生(C)的热图。
额外的文件12
:补充图12.基于三萜和聚酮化酮的代谢的分类。
额外的文件13
:补充图13.苯丙类生物合成中的代谢物和其他DEGs (A, B)。
额外的文件14
:补充图。14.GA和JA途径中基因的表达。Unigenes级别数据由TPM表示。红色和绿色分别代表高表达和低表达水平。
附加文件15:补充图15
.可能的反应步骤由基因控制的假设生物合成途径的化学型P. Frutescens.(Yuba,Honda,Koezuka&Tabata,1995).
附加文件16:补充图16
.船首横截面P. Frutescens.在明亮。
附加文件17:表S1
.代谢物概况P. Frutescens.UPLC-ESI-Q-TOF-MS / MS分析。表S2.所有样本原始数据信息。表S3.所有样品干净的数据信息。表S4.清洁读数的装配结果。表S5.7个数据库的注释比率。表S6.氧化石墨烯与二甲基二苯醚的三种比较。表S7.中萜类生物合成途径的UnigenesP. Frutescens..表S8.qPCR特异性引物。表S9.qRT-PCR和RNA-Seq的详细信息。表S10.化学物质p . frutescens。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
周鹏,尹敏,戴森。et al。腺毛属生物活性成分合成的多组学分析Perilla frutescens..BMC植物杂志21,277(2021)。https://doi.org/10.1186/s12870-021-03069-4
收到了:
接受:
发表:
关键字
- Perilla frutescens.(l)布瑞特
- 腺毛状体
- 代谢产物的生物合成
- 转录组