摘要
背景
由进化选择和基因重组产生的自然变异,被认为对各种非生物胁迫具有重要的响应功能,可通过基因组选择提高抗旱性。
结果
在本研究中,nac编码基因ZmNAC080308对199个玉米自交系进行了克隆和测序。系统发育分析表明ZmNAC080308与其他已知的提高耐旱性的NAC基因紧密聚集在同一组。共鉴定出86个SNPs和47个indelZmNAC080308其中19个变异与不同环境下的产量有关。5'-UTR区的9种变异ZmNAC080308它们之间有着密切的联系,它们可能通过调控基因的表达,对干旱条件下的GY改善做出反应Sp1级-介导的反式激活。两个单倍型(Hap1和Hap2)在5'-UTR区域使用9个变异和含有插入变异的Hap2进行鉴定,结果显示15.47 % 干旱胁迫条件下GY含量较高。此外,本研究还开发了一个功能性标记来预测美国玉米自交系群体的耐旱性。携带Hap2的细胞株 > 10 % 在干旱胁迫条件下比携带Hap1的高GY。在拟南芥,超表达ZmNAC080308增强耐旱性。
结论
ZmNAC080308作为一个重要的抗旱性基因,通过对该基因的筛选,为提高玉米抗旱性开发了一个功能标记。
背景
随着人口增长,在有限的可耕地条件下,粮食产量方面的粮食安全将更加难以实现。作物产量受到不同的非生物胁迫,并将继续受到气候变化的挑战。粮农组织的最新报告显示,从2005年到2015年,环境灾害给农业造成了数十亿美元的损失。其中30%以上的损失是由干旱造成的,仅干旱就造成了290亿美元的农业损失(http://www.fao.org/news/story/en/item/1106977/icode/). 因此,提高作物对非生物胁迫特别是干旱胁迫的耐受性就显得十分迫切。
转录因子在植物抗逆的分子机制中起着重要作用[1]. 特别是,NAC是一个大的植物特异性TFs家族的成员,包括NAM、ATAF和CUC,具有重要的多种功能。在矮牵牛中发现了第一个NAC基因,即NAM(无顶端分生组织)[2]. 随后,在大肠杆菌中鉴定出CUC1和CUC2拟南芥,由于CUC2的n端与NAM和ATAF高度保守,因此这个n端区域被命名为NAC域[3.]. 如TF数据库所示(http://planttfdb.cbi.pku.edu.cn/),已经确定了超过500种NAC基因拟南芥这些基因被分为不同的亚群[4,5,6].因此,涉及植物应激响应性亚组的NAC被称为SNAC(应力响应NAC)[7,8,9,10].这些SNAC在包括ROS生成,激素功能,渗透调整,CA的植物中的许多压力响应性代谢途径。2+信令,次级代谢过程等[11]激活的NACs可以调控下游元件的表达。
近年来,nac在非生物胁迫响应中的作用,特别是在作物中的作用越来越受到研究者的关注。到目前为止,在主要作物中报告的大多数与干旱有关的nac都是积极的调节剂。过度的ZmNAC55在里面拟南芥与野生型线相比,可以增强耐旱性[12].塔纳克2小麦中的NAC TF能增强小麦对干旱、盐和冰冻胁迫的抗性吗塔纳克2-transcenic.拟南芥[13].根特异性表达水稻基因OsNAC10当它过表达时可以改善对非生物应激的抵抗力。此外,过表达OsNAC10水稻增加25–42 % 田间干旱胁迫条件下的GY[14].其他几个NAC TFs,例如国民账户体系1[15],ONAC045[16],SNAC2公司[17],OsNAC5[18],OsNAC6[19],OsNAP公司[20.],ZmNAC111型[21], 和塔纳克29[22]这些基因对非生物逆境胁迫具有重要的响应功能,有助于培育抗逆作物。
鉴定与靶性特征相关的基因的自然变化变得更加重要,特别是对于包括耐旱性的定量性状,如一些独联体- 或者trans-由于这些基因的自然变异,参与非生物胁迫耐受反应的调节功能可能丧失或获得[23]. 在玉米中,许多与耐旱性相关的自然变异已经被鉴定出来。长江上游地区的两个InDel变化zmvpp1.与玉米抗旱性显著相关。含有三个MYB结合域的插入变异体的单倍型具有比携带缺失变异体的单倍型更高的耐旱性[24].5'-UTR的另一个自然变体ZmPP2C-A10型删除一个ERSE(内质网应激反应元件),这个变体的丢失阻止了ERSE的表达ZmPP2C-A10型在ER应激。有趣的是,禁用ZmPP2C-A10型玉米抗旱性提高的表达结果[25]. 此外,还报道了玉米中的一些天然DREB(脱水反应元件结合蛋白)变体,它们与玉米的抗旱性密切相关,对提高玉米的抗旱性也有重要意义[26].
到目前为止,与耐旱性相关的自然变异只在国内有报道ZmNAC111型[21]其他与耐旱性相关的NAC基因的变异尚未被发现。在本研究中,我们使用玉米RNA-Seq数据来鉴定一个编码NAC-TF的基因,该基因与其他已知的干旱反应相关NACs具有较高的同源性。关联分析显示ZmNAC080308与玉米GY显著相关,尤其是在干旱胁迫条件下。单体型的ZMNAC080308变体本研究开发了一个功能标记,并在关联作图面板上进行了验证,可用于提高玉米的抗旱性。
结果
ZmNAC080308是非生物胁迫响应型SNAC TF亚家族中核定位的TF
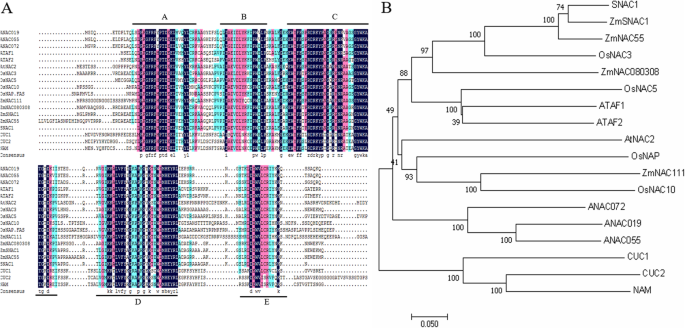
与其他NAC TFs相比,ZmNAC080308(A, B, C, D, E)。1A) 是的。系统发育分析表明,具有相似功能的基因趋向于聚集在一起,胁迫响应的SNAC-TFs与ATAF聚集成一个分支,而NAM和CUC则出现在其他分支中,后者与植物生长发育有关(图。1B) 是的。ZmNAC080308更密切相关OsNAC3,ZmNAC55,ZmSNAC1,和国民账户体系1,根据我们的系统发育分析。这四个基因与植物的干旱胁迫反应有关[5,12,15,27],表示ZmNAC080308也可能参与玉米的干旱压力反应。
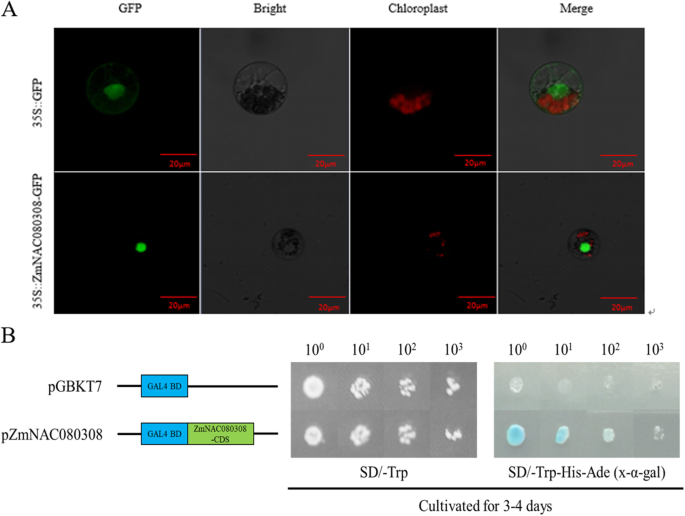
我们随后转变为ZmNAC080308-GFP进入玉米原生质体并检测转化细胞核中的强大GFP信号,表明ZMNAC080308-GFP融合蛋白的核定位(图。2A) 是的。接下来,我们使用两种杂交反式激活分析来研究ZmNAC080308蛋白是否能够激活报告基因AH109的表达。的全长CDZmNAC080308克隆到pGBKT7载体中,构建的载体和空载体分别转化酵母株AH109。如图所示。2B、 两个转化子在SD/-Trp培养基上生长良好,但只有含有pGBKT7的菌株生长良好-ZMNAC030803.生长在SD/-Trp/-His培养基上,表现出半乳糖苷酶活性。因此,ZmNAC080308转录因子在玉米中是具有转录活性的核定位蛋白。
的表达ZmNAC080308在穗和幼苗
首先,利用RNA-Seq数据分析了10个自交系在水分充足(WW)和干旱胁迫(DS)条件下收获的年轻雄穗的基因表达(Wang et al.,2018)。有趣的是,结果显示ZmNAC0803085个玉米品系(Tie7922、X178、Dan340、Ji81162和CA339)在DS条件下的错误发现率(FDR)与WW条件下的差异显著 ≤ 0.001和对数的绝对值2比率 ≥ 1.耐旱性较好的自交系铁7922、X178、单340的平均丰度为ZmNAC080308干旱治疗后转录物增加2.14倍,而JI81162和CA339的近交系后干旱治疗后它降低1.68倍(表1)结果表明,干旱胁迫信号可以引导转录物表达的差异。
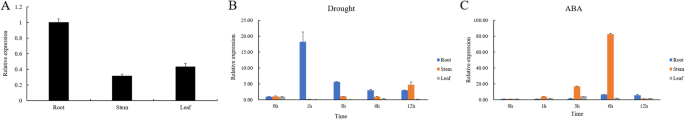
采用qRT-PCR (quantitative Reverse-Transcription Polymerase Chain Reaction)分析两者之间的关系ZmNAC080308玉米幼苗的表达与抗旱性。ZmNAC080308在根和茎的下部高表达(图。3.A) 是的。干旱胁迫处理后,水稻叶片中ZmNAC080308在胁迫处理后1 h,根系中有一个峰值。然而,经过外源ABA处理后,ZmNAC080308在茎中,转录因子的表达量增加了80倍以上。3.B和C)。这个结果假定ZmNAC080308在ABA途径中有一种调节非生物胁迫。
的遗传特征ZmNAC080308
然后我们对ZmNAC080308199个NLS的基因。从每根线获得总共3065bp的序列数据,包括三个外显子,两个内含子,645bp未转化的区域和1232-bp启动子序列(表2).在对齐序列之后ZmNAC080308共鉴定出86个SNPs和47个InDels。在所有这些snp和indel中,在启动子区发现了72个变异。除启动子和5’-UTR区域外,外显子III的SNP密度最高,平均每15 bp有一个SNP,内含子I的InDel密度最高,平均每26 bp有一个InDel。编码区未发现indel。外显子中发现的32个SNPs中,8个为非同义突变,24个为同义突变。133个变异的平均小等位基因频率(MAF)值为0.22 L,其中启动子区最小,为0.28,外显子I区最高,为0.50。
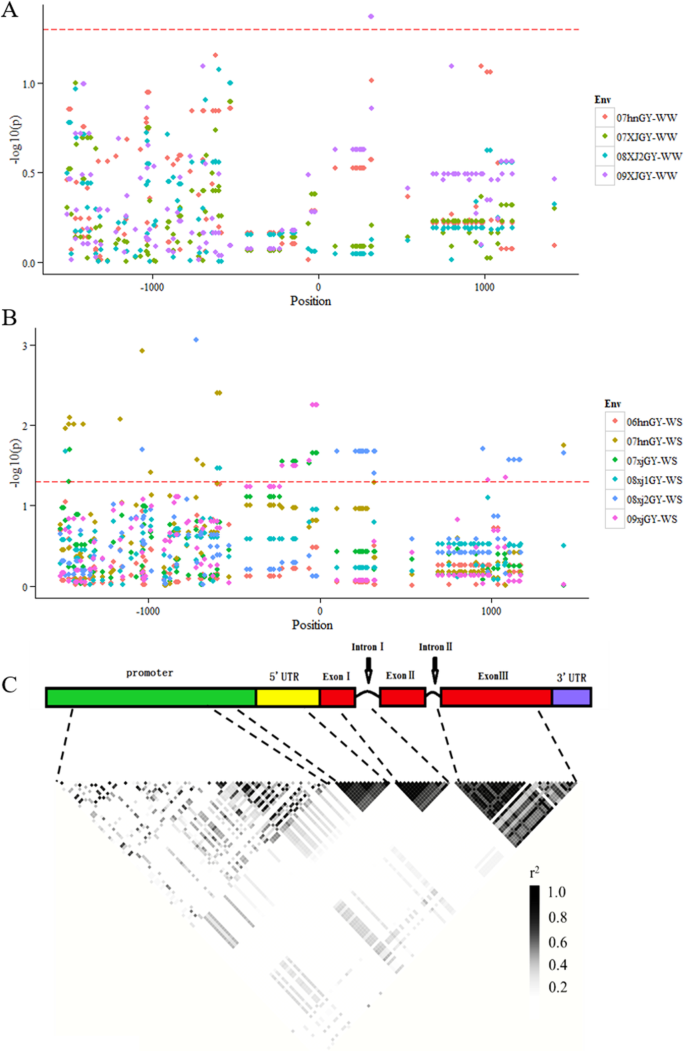
利用Haploview对133个变异体进行连锁不平衡分析。三个LD模块(r2 > 分别在5'-UTR区域、外显子I和内含子I区域的一部分以及外显子III中鉴定出(图。4C)启动子区域的几个变异体表现出强烈的LD,但大多数其他变异体之间没有紧密的连锁。
“的变化”ZmNAC080308玉米在WW和DS条件下与GY基因相关
一项候选基因关联研究用于检测变异ZmNAC080308这与玉米对干旱胁迫的耐受性密切相关。首先,考虑GY在评价干旱耐受性中的重要性,进行了变异株与GY的关联分析。采用混合线性模型(MLM)方法,在所有10个环境中检测到64个与GY显著相关的变异。在这64个变异中,只有4个内含子I区在WW条件下被识别出来,其余60个变异仅在DS条件下被识别出来(图1)。4A和B)。有七种变体P.其中4个标记位于启动子区,3个标记位于5′-UTR区,每个标记平均解释了6.10%的GY变异。
共检测到19个变异,包括5个indel和14个SNPs,这些变异与至少两种环境下的GY显著相关(P. < 0.05)(图。4A和B),每个变异解释了GY的表型变异的4.45%。所有与GY显着相关的变化都是非编码区域ZmNAC080308(5个在启动子,9个在5 ' UTR, 4个在内含子,1个在3 ' UTR)。强大的LD(右2在启动子区域的5 ' -UTR、InDel-600和SNP-586的变异之间,以及内含子I区域内的四个变异之间,均观察到> 0.8)。4C) 是的。
的5′-UTR的变化ZmNAC080308干旱胁迫条件下与GY显著相关
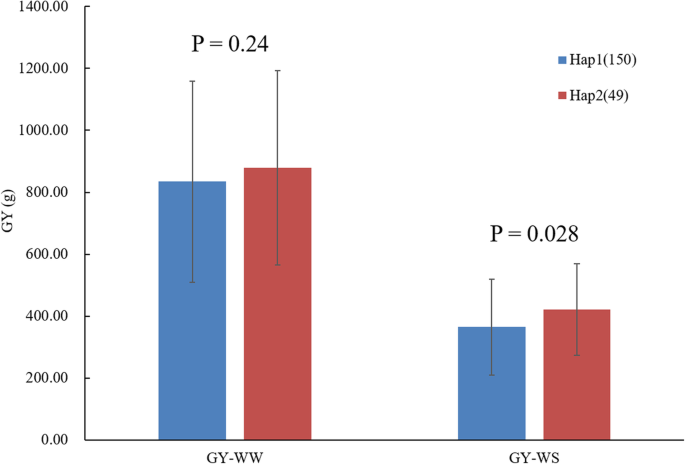
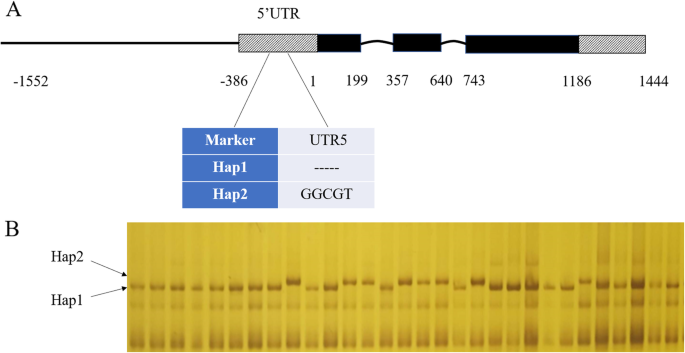
ZmNAC080308与GY显着相关,特别是在DS条件下,基因的非编码区域的变化在玉米干旱胁迫条件下调节GY发挥着重要作用。在所有的变化中ZmNAC080308与DS下的GY相关,5′-UTR中的9个变异,包括7个SNPs和2个indel,在高LD(表3.;无花果。4). 5'-UTR在基因表达调控中起着重要作用,所有的自交系被分成两个单倍型,其中5'-UTR有9个变异ZmNAC080308.两种单倍型在WW条件下具有相似的GY值,在DS条件下,HAP2的GY为421.17克/地块,比在相同条件下比HAP1高出15.47%(P. = 0.028) (Fig.5). 然后独联体-对两个单倍型的5'-UTR中的作用元件进行分析,以确定这些元件在变体之间的差异。正如所料,有几个独联体-与应激反应相关的作用元件存在于5'-UTR区ZmNAC080308(补充图S)1),包括ABRE(ABA反应元件)、DRE(脱水反应元件)、CGTCA序列基序(参与MeJA反应)和G盒(参与光反应)(补充图S)1一种)。这些主题的存在建议ZmNAC080308在干旱胁迫反应中可能受到调控。此外,一个额外的独联体表演元素,Sp1级(光响应元件),是由起始密码子上游42 bp的T到C的核苷酸变化引起的ZmNAC080308在Hap2基因型中鉴定(补充图S1B) 是的。有趣的是,在从HAP2的5'-Futr的控制下,相对荧光素酶活性显着高于Hap2,而不是在控制(P. = 1.69E-07)和ABA处理(P. = 2.99E-06)条件(补充图S1C) 是的。这些结果表明,5'-UTR突变ZmNAC080308可能在功能上调节这两个单倍型之间的基因表达。
抗旱性预测与选择功能标记的建立
区分两种单倍型ZmNAC080308根据5'-UTR区的两个InDel变异,建立了一个功能标记。该标记随后在另一个玉米自交系面板上进行了测试,该面板包含187个美国PVP自交系。通过SDS-PAGE筛选所有基因型,将这些自交系分为两个单倍型(图。6).在116个携带缺失变异的自交系中存在Hap1,在70个携带插入变异的自交系中存在Hap2。WS条件下Hap2的平均GY值为63.22 g/plot,高于相同条件下的Hap1,但差异不显著(P. > 0.05). 而Hap2的平均GY为11.30 % 显著高于Hap1(P. = 0.03)在DS条件下(表4). 这些结果与先前的实验结果一致,证明了5'-UTR的变异ZmNAC080308与玉米抗旱性有关。本研究建立的功能标记可用于抗旱自交系的筛选。
过度的ZmNAC080308提高转基因作物的抗旱性拟南芥
三个独立的转基因株系(OE1、OE3和OE4)ZmNAC080308过度表达拟南芥被选作进一步分析。在干旱胁迫过程中,绝大多数野生型植物在干旱胁迫的早期就已经枯萎,而野生型植物在干旱胁迫的早期就已经枯萎35 S :: ZMNAC080308转基因植株保持绿色状态(图。7A) 是的。截留水分3周后,野生型植株和转基因植株的大部分叶片开始干燥复水。生存率的进一步统计分析拟南芥干旱胁迫后,转基因植株约50%存活,而野生型植株约85%死亡。7B) 是的。这些结果表明ZmNAC080308转基因能否提高抗旱性拟南芥.
讨论
ZmNAC080308编码影响玉米抗旱性的NAC转录因子
NAC转录因子及其SNAC亚家族是参与植物非生物胁迫响应的重要基因群。系统发育分析表明,16个NAC基因属于玉米SNAC亚家族[6].在这16个SNAC基因中,三种NAC基因包括ZmNAC010312(GRMZM2G347043,ZmSNAC1) [27],ZmNAC050436(GRMZM2G336533型,ZmNAC55) [12], 和ZmNAC100475(GRMZM2G127379型,ZmNAC111型) [21还据报道,玉米的干旱胁迫耐受性也讨论了。在本研究中,我们克隆了另一个玉米Snac亚家族基因ZmNAC080308基于RNA-Seq数据分析,推测该基因对干旱胁迫有响应。退行性椎体滑移治疗后,转录因子丰度ZmNAC080308表现为中度至高度干旱胁迫的自交系,其幼龄玉米雄穗中的水分含量较高,而敏感自交系中的水分含量相对较低(表1)1). 的5'-UTRZmNAC080308进行了应力响应分析独联体-元素,如ABRE和DRE,被识别(补充图S1). 更进一步说,就像其他SNAC基因,如ZmNAC55[12],OsNAC3[5], 和ZmSNAC1[27].QRT-PCR分析还表明表达ZmNAC080308可以由ABA和茎中的干旱胁迫引起(图。3.),然而,表达ZmNAC080308在干旱和ABA胁迫下,根和茎之间存在差异。在词根中,表示ZmNAC080308对干旱更敏感,而ZmNAC080308ABA处理后,茎中上升更快(图。3.). 结果表明,该基因的表达ZmNAC080308在茎中aba依赖途径和根中aba独立途径响应干旱胁迫,这与我们之前的研究结果一致ZmNAC080308该基因在启动子中同时含有ABRE和DRE[6].过度的ZmNAC080308提高抗旱性的转基因拟南芥.转基因植株的存活率拟南芥的存活率没有预期的高,这可能是由严重的干旱胁迫造成的,尽管仍然远远高于WT的存活率ZmNAC080308通过ABA依赖和无关的玉米途径,变体发挥了重要作用。
共有32个单核苷酸多态性ZmNAC080308其中8个为非同义突变,位于外显子III区。关联分析显示,8个变异中有2个与退行性退行性退行性退行性退行性退行性退行性退行性退行性退行性退行性退行性退行然而,这两种变异的影响仅在5个检测环境(位置×年份)中的1个环境(2008年在新疆检测到SNP-118, 2009年在新疆检测到snp - 120)中得到证实,说明这两种关联的影响并不稳定。此外,转录因子可以参与多种途径,本研究发现的变异可能还与开花时间等其他性状有关。因此,需要进行进一步的分析来发现两者之间的联系ZmNAC080308和其他重要的农艺性状。
非编码区的变异ZmNAC080308影响干旱胁迫耐受性
基于候选基因的关联分析用于检测遗传多态性与目标性状之间的关联。与全基因组关联(GWAS)策略相比,候选基因方法需要较少的遗传标记,它可以最大限度地减少跨整个基因组的多重检测所引起的统计问题[28]. 首先利用候选基因关联分析方法分析了两个基因之间的关联矮人基因与玉米开花期[29],确定九个开花时间相关多态性。在先前的研究中,关联分析表明,5'-UTR中的删除变体ZmPP2C-A10型基因表达水平降低,导致玉米耐旱性改善[25].另一个耐旱性相关的基因,zmvpp1.通过GWAS分析和候选基因关联分析,在玉米的起始密码子上游检测到两个InDel变异,在CDS中检测到两个与玉米抗旱性显著相关的变异。此外,与抗旱性相关的单倍型zmvpp1.被确定了[24].启动子区域中的插入变体ZmNAC111型也与玉米的旱润有关。这种变体与较低的表达相关ZmNAC111型基因,影响DNA和组蛋白甲基化,导致玉米幼苗对干旱胁迫更敏感[21].在目前的研究中,9个高度连锁的多态性包括两个InDel变异在5 ' -UTRZmNAC080308在干旱胁迫条件下鉴定并与GY相关。双单倍型ZmNAC080308在干旱胁迫条件下,Hap2表现出比Hap1更高的GY。基因5′-UTR中的一个功能标记ZmNAC080308(图。6)基于诱导变体开发,偏离PVP玉米近交线面板是用这种功能标记进行基因分型。结果表明,携带这种功能标记物有利基因型的近交系的GY高出11.30%,表明该功能标记物可用于MAS以改善温带玉米的脱毒功能。
5'-UTR是调控真核基因表达的重要区域(Barrett等人,2012;Cenik等人,2011年)。本研究检测到一个SNP,位于基因起始密码子上游42bp处ZmNAC080308,创建独联体-作用元件Sp1级在Hap2基因型中(补充图S1B).之前的一项研究表明Sp1级与野生型的启动子相比,突变系的GUS表达降低了[30.].此外,Sp1级顺式元素是表达干旱反应基因的启动子区域中呈现的顺式元素之一[31].因此,我们假设这种突变ZmNAC080308可以调节玉米的干旱压力耐受性。此外,5'-UTR的ZmNAC080308在双荧光素酶报告基因检测系统中,Hap2基因型显示出比Hap1基因型更高的转录活性(补充图S)1D) 是的。因此,我们检测了ZmNAC080308不同单倍型基因的RNA-Seq分析。在我们测试的五个品系中,只有X178携带Hap2,其他四个品系携带Hap1(表1)1). 的RPKM(每千基每百万映射读取的读取数)值ZmNAC080308在WW和DS条件下,X178均高于其他4个品系Sp1级motif可以增加基因的表达ZmNAC080308这与玉米的抗旱性有关。最后,研究了玉米的抗旱能力35 S :: ZMNAC080308进行了转基因试验拟南芥. 转基因植株的存活率远高于野生型植株(图。7).这些结果证实ZmNAC080308作为干旱胁迫的正调控因子,可用于维持玉米在干旱胁迫条件下的GY。
结论
ZmNAC080308是对耐旱耐受性的重要基因,其来自变异的标记可以用作在干旱胁迫下改善玉米GY的功能标识符。
方法
井水(WW)和干旱胁迫(DS)条件下GY数据的收集
本研究收集并分析了2个关联面板389个株系的GY数据。199个中国常用的自交系组成了一个协会。2007年、2008年和2009年分别在海南三亚(18°14′N, 109°31′E)和新疆乌鲁木齐(43°54′N, 87°28′E)采集了WW条件下生长的NLs的GY数据。2006年和2007年分别在海南省三亚市(18°14′N, 109°31′E)、新疆乌鲁木齐市(43°54′N, 87°28′E)、2008年和2009年分别采集了2次和1次DS条件下NLs的GY数据。根据气候条件,在玉米开花前20 d左右暂停灌溉,人为施加干旱胁迫条件。关于这些数据的更详细信息可以在我们之前的研究中找到[32,33].
另一个协会面板由186名USF-PVP自交系(ALS;美国线路不再受专利)组成。该小组在海南和新疆的α-格子设计中种植,与2013年与NLS相同的位置,具有两个浇水处理(WW和DS条件)。实验设计和灌溉方法与用于NLS的实验和灌溉方法相同,这些方法已经在我们之前的研究中描述过[32]. 简言之,每个品系在4米长的单行地块上种植两个重复,株间20cm,每行21株。采后3周收集各处理下ALs的GY数据。
的mRNA表达模式ZmNAC080308
表达水平ZmNAC080308在正常和干旱胁迫条件下的年轻穗子中,[34].Ji81162、CA339、Dan340、X178、Tie7922等5个自交系的表达数据表现出不同程度的抗旱性(表1)1).
在本研究中,采用qRT-PCR技术来鉴定基因的表达ZmNAC080308经过干旱或ABA处理的苗期。自交系Tie7922的种子先种在温室的石英砂中,隔日浇一次水。在V1阶段除去胚乳,然后将大小相近的幼苗转移到装满Hoagland营养液的桶中继续生长。解决方案每2天更新一次,直到V2阶段。将幼苗移栽于含20% PEG-6000的Hoagland溶液中进行干旱处理,或移栽于含100µM ABA的溶液中进行ABA处理。根、叶和茎的材料处理和控制在0 h,治疗后分别取样1 h, 3 h, 6 h,和12 h。五个样品从每个治疗相同的样本收集涨跌互现同样复制,和两个复制被用于这项研究。
根据制造商的说明,使用Transzol Up(Transgen)的样品中分离出总RNA。FaxQualt RT试剂盒(天根,中国)用于逆转从1000 ng的总RNA转发第一链cDNA。然后使用IQ5(Bio-Rad,US)的超级预混料加套件(SYBR Green)(Sybr Green)(Sybr Green)(Sybr Green)进行QRT-PCR。相对表达水平ZmNAC080308是相对于玉米的表达水平计算的NADPH.基因使用2−ΔCt方法[35].
全长测序ZmNAC080308在NLs中
在温室中的三种72细胞萌发箱中种植了所有NL的种子。将一片叶子从V2阶段的每根中取样,使用CTAB方法从每根线中提取基因组DNA。基因序列ZmNAC080308从国家生物技术信息中心数据库(NCBI,https://www.ncbi.nlm.nih.gov/).的基因结构ZmNAC080308使用在线工具fgenesh预测(http://www.softberry.com)并对其5'-UTR进行了搜索独联体- 使用PlantCare数据库的监管元素[36].然后我们克隆了全长ZmNAC080308使用Prime STAR GXL DNA聚合酶(Takara,中国)和四对重叠引物(补充表1)进行PCR,从199个NLs中的每个NLs的基因组序列和大约1.5 kb上游起始位点作为其启动子区域1).扩增的基因片段由清科生物技术公司(中国)进行测序和组装。
使用DNAMAN和MEGA 7.0软件分别进行DNA序列和氨基酸序列的多次对准[37].目测发现snp和indel等位基因频率大于0.05。采用邻域连接(neighbor-joining, NJ)方法在MEGA 7.0中构建树,启动次数为1000次,对ZmNAC080308与其他NAC蛋白进行系统发育分析。进化距离使用p-distance方法计算,并从每个序列对中去除所有歧义位置[38,39].
连锁不平衡(LD)与关联分析ZmNAC080308
在确定ZmNAC080308使用Haploview软件进行LD分析[40].候选基因关联分析采用Tassel 5.0中的混合线性模型[41].既往研究的人口结构(Q)和亲属关系(K)数据[33,42用于改善GY相关的SNP检测的保真度[43].标记P.-Value <0.05(-Log10(P.)= 1.30)被认为与GY显着相关。
ZmNAC080308蛋白的亚细胞定位
用限制性内切酶对载体pRTL2进行酶切囊我和Kpn公司I(美国内布拉斯加州)for> 3小时。的编码区ZmNAC080308was cloned from Qi319, an NL inbred line, without the terminator codon (TGA) by PCR to include the corresponding 15-bp extensions homologous to the vector ends (sense: 5’-CCGGGAATTCCATGG-3’; antisense: 5’-CTCTAGAATGGTGAG-3’). The digested vector and the PCR product were recovered using a Zymoclean™ Gel DNA Recovery Kit (Zymo Research, USA). We then constructed the recombinant plasmid using an In-Fusion HD Cloning Kit (Takara, China) according to the manufacturer’s instructions. The recombinant plasmid and the empty vector plasmid were transformed into maize leaf protoplasts using the PEG method [44.]. 在黑暗中培养16小时后,使用LSM880荧光显微镜(蔡司,德国)观察GFP荧光。
反式激活分析
分析是否ZmNAC080308具有反式激活活性的酵母菌株AH109含有HIS3和拉茨报告基因被用来表达ZmNAC080308基因与GAL4-DNA结合域融合。的全长编码序列ZmNAC080308通过PCR使用底漆获得:5'-AtggcatGGagGCCGAATTCATGGCAATGGTGCGGCG-3'和5'-ATGCGCGCGCGCAGGTCGACTCAGACGGGCAAGAT-3'。将得到的PCR产物克隆在PGBTK7诱饵载体中的Gal4结合结构域下游粘附消化萨尔我(美国Neb,美国)。然后使用Matchmaker TM金酵母双混合系统(Takara,中国)转化重组质粒AH109,根据制造商的方案,将空向量分别转化为AH109作为阴性控制。转化菌株1:10稀释0, 1:101, 1:102, 1:103..稀释液分别镀于SD/-Trp和SD/-Trp/-His (x-gal)固体培养基上。
比较两者的转录激活能力ZmNAC080308在5′-UTR区域的单倍型,应用双荧光素酶报告基因检测系统(Promega, USA)。玉米泛素(无论在哪里)启动子和两个ZmNAC080308将5′-UTR单倍型插入到双荧光素酶报告载体pGreen II 0800中,该载体含有aRenilla.荧光素酶(REN)基因CAMV 35 S.作为对照的启动子(补充图1C).三种不同的重组质粒通过上述peg介导的方法共转化玉米原生质体。对于ABA处理,转染的原生质体首先在不含ABA的溶液中孵育[45.].孵育16小时后,使用荧光显微镜(Zeiss,德国)测定LUC(荧光素酶)和REN活性。
转基因拟南芥植物构造与应力处理
的编码区ZmNAC080308以玉米自交系Tie7922为材料,采用PCR技术进行扩增。然后将PCR产物插入pCAMBIA1303载体中CAMV.35s启动子。将重构向量引入到系统中农杆菌肿瘤术训练后测序,然后转移到拟南芥采用花浸法。在含卡那霉素的1/2 Murashige和Skoog (MS)培养基上筛选转基因植株T0代种子。然后将获得的阳性植株移栽到装满蛭石和营养土2:1的混合物的花盆中。
为了进行耐旱性试验,在二叶期,将T2植株从1/ 2ms培养基转移到装满2:1蛭石和营养土混合物的花盆中。在充足的水分条件下恢复生长三周后,开始进行三周不浇水的干旱胁迫处理。然后植物通过补水恢复。三天后,记录这些植物的成活率。
数据和材料的可用性
在当前研究期间使用和/或分析的数据集可从相应的作者获得合理的请求。
缩写
- 马斯:
-
分子标记辅助选择
- NAC编号:
-
NAM,ATAF和CUC
- 国民账户体系:
-
应激相关NAC
- 灰色:
-
粮食产量
- 苏格兰国家党:
-
单核苷酸多态性
- UTR编号:
-
未经翻译的地区
- TF:
-
转录因子
- ERSE公司:
-
内质网应激反应元件
- 含有DREB:
-
脱水响应元素结合
- NLS:
-
中国玉米自交系
- 肌萎缩侧索硬化:
-
我们off-PVP行
- QRT-PCR:
-
定量逆转录PCR
- 阿巴:
-
脱落酸
- 空气流量:
-
轻微的等位基因频率
- 新泽西州:
-
邻接
- 传销:
-
混合线性模型
- UBI:
-
泛素
- 吕克:
-
萤火虫荧光素酶
- 任:
-
Renilla.荧光素酶
- 绿色荧光蛋白:
-
绿色荧光蛋白
- cd:
-
编码DNA序列
- 身份证号码:
-
连锁不平衡
- 栈单:
-
有实力的
- 远景:
-
水强调
- HN:
-
海南
- XJ系列:
-
新疆
参考
- 1.
转录因子在植物防御和胁迫反应中的作用。植物生物学最新观点2002,5(5):430–436.
- 2.
Souer E,Houwelingen AV,Kloos D,Mol J,Koes R:矮牵牛的No顶端分生组织基因是胚和花形成模式所必需的,在分生组织和原基边界表达。细胞1996,85(2):159–170。
- 3.
Aida M, Ishida T, Fukaki H, Fujisawa H, Tasaka M:拟南芥中涉及器官分离的基因:杯状子叶突变体的分析。植物营养与肥料学报,1999,9(6):841-857。
- 4.
OOOKA H,SATOH K,DOI K,Nagata T,Otomo Y,Murakami K,Matsubara K,Osato N,Kawai J,Carninci P等人:综合分析Oryza Sativa和Arabidopsis Thaliana的NAC家族基因。DNA Res 2003,10(6):239-247。
- 5。
关键词:水稻,NAC,转录因子,全基因组分析2010年基因,465(2):30 - 44岁。
- 6。
李丽,马玉华,张世华,郝志发,李晓红:玉米NAC转录因子家族成员的基因组特征及其与干旱胁迫的关系。生物技术研究杂志2015,10(11):63–77。
- 7。
方yj,you j,谢克布,谢WB,Xiong LZ:NAC转录因子家庭中NAC转录因子家庭组织特异性或应激反应基因的系统序列分析及鉴定。Mol Genet Genomics 2008,280(6):547-563。
- 8。
Nakashima K,Takasaki H,Mizoi J,Shinozaki K,Yamaguchi Shinozaki K:植物非生物胁迫反应中的NAC转录因子。Bba基因调控机制2012,1819(2):97–103。
- 9.
Nuruzzaman M,Sharoni Am,Kikuchi S:NAC转录因子在植物中生物和非生物应激反应调控中的作用。Front Microbiol 2013,4。
- 10
NAC转录因子在植物多重非生物胁迫响应中的研究进展与展望。植物生态学报,2015,34(6):559 - 564。
- 11.
王志,丹恩F:不同胁迫下NAC(NAM/ATAF/CUC)转录因子及其信号转导途径。物理植物学报2013,35(5):1397–1408。
- 12.
毛厚德,俞立杰,韩瑞,李志杰,刘H:ZmNAC55是玉米胁迫应答的NAC转录因子,在转基因拟南芥中具有抗旱性。植物生理生物学2016,105:55–66。
- 13.
毛新光,张海英,钱XY,李娜,赵GY,景RL:拟南芥中NAC型小麦转录因子TaNAC2对多种非生物胁迫耐受性的增强作用。实验机器人杂志2012,63(8):2933–2946。
- 14.
Jeong Js,Kim Ys,Baek Kh,Jung H,Ha Sh,Do Choi Y,Kim M,Reuzeau C,Kim JK:在田间干旱条件下提高了水稻的耐旱性和籽粒产量。植物生理学2010,153(1):185-197。
- 15.
Hu Hh,Dai Mq,Yao Jl,Xiao Bz,Li Xh,Zhang QF,Xiong LZ:过表达NAM,ATAF和CUC(NAC)转录因子提高水稻的抗旱性和耐盐性。P Natl Acad Sci USA 2006,103(35):12987-12992。
- 16。
郑新恩,陈斌,卢国杰,韩斌:NAC转录因子的过表达提高了水稻的抗旱性和耐盐性。Biochem Bioph Res Co 2009,379(4):985–989。
- 17。
8 .胡焕华,蒋永军,方永军,朱晓燕,齐志勇,熊丽珍:水稻耐冷耐盐转录因子SNAC2基因的特性分析(vol . 67, p . 169, 2008)。植物营养与肥料学报,2010,28(4):461 - 468。
- 18。
Jeong JS, Kim YS, Redillas MCFR, Jang G, Jung H, Bang SW, Choi YD, Ha SH, rezeau C, Kim JK: OsNAC5过表达增加了水稻植株的根直径,从而增强了抗旱性,提高了水稻产量。植物生物技术学报,2013,11(1):101-114。
- 19.
中岛(Nakashima, Tran LSP), Van Nguyen D, Fujita M, Maruyama K, Todaka D, Ito Y, Hayashi N, Shinozaki K, yamaguchi Shinozaki K:转录因子OsNAC6参与水稻非生物胁迫响应基因表达的功能分析。植物学报,2007,51(4):617-630。
- 20
关键词:NAC家族转录因子,ABA, OsNAP,非生物胁迫植物生理学报,2014,55(3):604-619。
- 21
毛海红,王洪伟,刘世新,李忠,杨晓华,闫建军,李建军,陈建平,秦芳:NAC基因转座因子与玉米幼苗抗旱性的关系。Nat commen 2015, 6。
- 22
黄庆杰,王勇,李斌,常JL,陈美娟,李KX,杨GX,何勇:小麦NAC转录因子TaNAC29提高转基因拟南芥的耐盐性和耐旱性。BMC植物生物学2015,15。
- 23.
Waters AJ、Makarevitch I、Noshay J、Burghardt LT、Hirsch CN、Hirsch CD、Springer NM:玉米对非生物胁迫的基因表达反应的自然变异。Plant J 2017,89(4):706–717。
- 24.
关键词:玉米,ZmVPP1,遗传变异,抗旱性,抗旱性[10]
- 25.
关键词:玉米,ZmPP2C-A,内质网,抗旱性,抗旱性Mol Plant 2017,10(3): 456-469。
- 26.
刘SX,王XL,王鹤,xin hb,杨xh,yan jb,李杰,tran lsp,shinozaki k,yamaguchi-shinozaki k等:Zmdreb基因的基因组分析及其与抗旱性自然变化的关系在Zea的苗期Mays L. Plos Genet 2013,9(9)。
- 27。
鲁米,莹,张多夫,施益,宋益,王TY:玉米应激响应NAC转录因子ZMSNAC1赋予转基因拟南芥中脱水的耐受性增强。植物细胞报告2012,31(9):1701-1711。
- 28。
植物连锁不平衡的结构。植物生态学报,2003,23(4):457 - 461。
- 29。
关键词:矮8,开花时间,多态,遗传变异李建平,李建平,等。中国农业科学[m] .北京:科学出版社,2001。
- 30
Lopez-Ochoa L, Acevedo-Hernandez G, Martinez-Hernandez A, Arguello-Astorga G, Herrera-Estrella L:不同顺式作用元素之间的结构关系对rbc最小光调节单元的功能性质至关重要。生物技术学报,2007,28(5):439 - 442。
- 31
Shariatipour N, Heidari B:拟南芥(Arabidopsis thaliana)耐干旱、耐盐相关基因及其调控机制的研究。生物信息学学报,2018,11(1)。
- 32
Hao ZF,Li Xh,Su ZJ,谢CX,Li Ms,Liang XL,Weng JF,张DG,Li L,Zhang Sh:玉米多种环境的抗旱性抗旱选择标准。育种SCI 2011,61(2):101-108。
- 33
王,王ZP,梁XL,翁捷XL,张达,杨杰,永HJ,李女士,李福等:鉴定玉米滋生株式会玉米干旱耐受的基因组关联研究。Euphytica 2016,210(2):165-179。
- 34
王楠,李莉,高文武,吴勇,翁静,李明,张德,郝Z,李X:干旱胁迫下玉米早期发育雄穗的转录组揭示了玉米抗旱相关基因的差异表达。综合农业杂志2017,16:61777–61775。
- 35.
Livak KJ,Schmittgen TD:使用实时定量PCR和2(T)(-Delta-C)方法分析相关基因表达数据。方法2001,25(4):402–408。
- 36.
Lescot M,Dehais P,Thijs G,Marchal K,Moreau Y,Van de Peer Y,Rouze P,Rombauts S:Plantcare,植物顺式作用调节元件的数据库和用于启动子序列的硅分析的工具的门户网站。核酸研究2002,30(1):325-327。
- 37.
Kumar S,Stecher G,Tamura K:MEGA7:更大数据集的分子进化遗传学分析7.0版。分子生物学与进化2016,33(7):1870–1874。
- 38.
Felsenstein J:系统发育的置信限:一种使用引导的方法。进化论1985,39(4):783。
- 39。
Saitou N,Nei M:邻接法:一种重建系统发育树的新方法。分子生物学与进化1987,4(4):406–425。
- 40
Haploview: LD和单倍型图的分析和可视化。2005年生物信息学,21(2):263 - 265。
- 41
Bradbury PJ,Zhang Z,Kroon de,Casstevens TM,Ramdoss Y,Buckler ES:Tassel:各种样品中复杂性状的关联映射软件。Bioinformatics 2007,23(19):2633-2635。
- 42
刘克,郝·ZF,张达,谢CX,李女士,张XC,王HJ,张世,王捷捷,李Xh:遗传性质240玉米自交系和高密度SNP透露的逐个血液段标记。分子育种2015,35(7)。
- 43
Yu JM、Pressoir G、Briggs WH、Bi IV、Yamasaki M、Doebley JF、McMullen MD、Gaut BS、Nielsen DM、Holland JB等:一种解释多层次关联性的关联映射的统一混合模型方法。《国家遗传学》2006,38(2):203–208。
- 44
Cho HY,Lee C,Hwang SG,Park YC,Lim HL,Jang CS:编码漆酶前体的OsChI1基因的过度表达提高了转基因拟南芥对干旱和盐胁迫的耐受性。基因2014,552(1):98–105。
- 45
Kim N、Moon SJ、Min MK、Choi EH、Kim JA、Koh EY、Yoon I、Byun MO、Yoo SD、Kim BG:利用水稻原生质体中瞬时基因表达的ABA信号成分的功能表征和重组。前工厂Sci 2015,6。
致谢
我们要感谢编辑和裁判员的宝贵意见,以改善我们的稿件。
基金
本研究得到国家自然科学基金(31661143010)、中国国家重点研究开发项目(2020YEF02023)、中国农业大学启动基金(YJ20200—45)、中国北方作物改良与调控国家重点实验室(NCCIR2020RC-3)的资助。中国奖学金委员会。资助机构没有参与研究的设计、数据的收集、分析和解释,也没有参与手稿的撰写。
作者信息
从属关系
贡献
实验构思与设计:郝章芳、李心海。王楠,程明,刘博娟,王晓楠,张德桂,李明顺。陈勇、李国军、罗平、勇红军、周月恒。数据分析:王南和程明。撰写手稿:王南、郝转芳、李心海。语言编辑:张学才、Felix San Vicente、张颖。所有作者阅读并批准最终稿件。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版物
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
附加信息
出版商说明
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用本文
王楠,程敏,陈勇。等。非编码区的自然变化ZmNAC080308干旱胁迫下玉米籽粒产量的维持。BMC植物BIOL.21,305(2021)。https://doi.org/10.1186/s12870-021-03072-9
收到:
接受:
发表:
关键词
- 玉米(Zea Mays.l .)
- NAC转录因子
- 自然变异
- 非编码区
- 干旱宽容