摘要
背景
3-羟基-3-甲基戊芳基 - COA还原酶(HMGR)是甲戊酯(MVA)途径中的关键酶,其调节细胞质中萜类化合物的代谢,并确定下游萜类代谢物的类型和含量。
结果
结果表明,葡萄HMGR家族有三个成员,如VvHMGR1那VvHMGR2, 和VvHMGR3.表达VvHMGRs例如,Kyoho具有组织特异性,VvHMGR1保持较高的表达,VvHMGR2是最低的吗VvHMGR3随着果实发育而逐渐减少。VvHMGR3密切相关cshmgr1.和GMHMGR9.并与cshmgr2.和GMHMGR4.. 通过相互作用蛋白的预测,它可以与HMG-CoA合成酶、MVA激酶、FPP/GGPP合成酶、二磷酸甲戊酸脱羧酶相互作用,并参与萜类化合物的合成和代谢。VvHMGR3在表达类似的趋势与一些类胡萝卜素生物合成和MEP途径的基因。VvHMGR3响应各种环境和植物激素刺激,尤其是盐胁迫和紫外线(UV)处理。表达水平VvHMGRs葡萄品种多样,有不同的颜色和香气。VvHMGRs黄色品种明显高于红色品种,而玫瑰有气味的品种表现出明显高于草莓香气的表达。表达水平在黄色玫瑰香味品种中最高,以及红色草莓香味品种最低,特别是“夏天黑”和“富士吉人”。
结论
本研究证实了重要作用VvHMGR3在葡萄果实着色和香气形成过程中,并提供了一种新的想法来解释葡萄香气的损失和生产过程中的着色差。在HMGR表达方面,在颜色和香气之间可能存在添加效果。
背景
萜类化合物是广泛存在于自然界的天然物质,由不同数量的异戊二烯单元组成,在植物的生长发育中起着重要作用。首先,萜类化合物是植物中关键活性成分的合成前体,影响油菜素内酯(BR)、脱落酸(ABA)、类胡萝卜素等的合成[1那2].其次,它们有助于调节植物器官发展和能量新陈代谢,与芽休眠,器官脱落,生物膜系统建设和胚胎,种子和花发育密切相关。它还在植物光合作用和呼吸中起着重要作用[3.那4.那5.那6.].例如,植物甾醇的生物合成对于膜流动性和植物生长和发育至关重要[7.].六个主要的激素在植物中发挥重要作用,其中,ABA,胃纤维素(GA)和细胞蛋白(CK)是异戊二烯化合物,BR具有基于甾醇的结构[8.].第三,它是密切相关的果实品质的形成。萜类水果特有的香气的重要组成部分。萜类代谢途径是特殊的香味物质在玫瑰香味的葡萄合成[最重要的途径9.].类胡萝卜素,所述MEP代谢途径的产物,包含多个共轭双键,可形成番茄红素,辣椒红色素和其它物质环化反应后以显示颜色的宽阵列[10.].研究萜类化合物的合成及其调控机理是提高萜类化合物含量,实现果实品质改善的迫切需要。
在植物细胞中,两个不同的途径负责萜烯化合物的生物合成,胞质甲酸胞醇甲酸胞醛途径(MVA途径)和质量性2-C-甲基-D-赤藓糖醇-4-磷酸途径(MEP途径)[11.那12.].HMG-COA还原酶(HMGR,EC:1.1.1.34)是MVA途径的第一率限制酶,其可以催化来自HMG-COA的MVA的形成。它是MVA途径的重要调节部位,在细胞质三萜的合成中发挥关键作用[13.那14.].HMGR于1958年被发现,1986年被提纯[15.那16.].它是第一个被克隆的拟南芥1989年[17.].HMGR可以催化胆固醇生物合成中的速率限制反应,是最受控制的酶之一,因此在动物和酵母中深入研究了[18.].与动物相比,Terpenoids在植物中发挥更多作用,植物中HMGR活性的调节更加多样化。它不仅在植物的正常增长和发展中起着关键监管作用,而且还需要适应不同环境条件的植物[19.那20.那21].
迄今为止,已从马铃薯、拟南芥、水稻、梨、番茄等80多种植物中分离和克隆出HMGR基因[14.那22那23那24那25].然而,葡萄基因组中萜烯合成途径的关键酶的少量焦点和调节机制HMGR.葡萄果实发展过程中的基因[9.].因此,本研究的目的是识别和分析HMGR家族vitis.深入研究VvHMGRs的结构特征和进化关系,分析VvHMGRs的组织特异性表达模式VvHMGRs,并比较的变化VvHMGRs在不同颜色和香气类型的果实发育阶段,分析其响应模式VvHMGRs激素和渗透压力。
材料和方法
植物材料和治疗
选用五岁葡萄品种“Wink”、“Fujiminori”、“Kyoho”、“Summer Black”、“Red Globe”、“Jing早晶”、“Centennial无核”、“Yellow Italia”、“Red Italia”和“Shine-Muscat”作为试验材料,生长在南京农业大学(31°36′n, 119°10′e)的Baima实验葡萄园。本次抽样是在学校用地上进行的,我们确认土地所有人对此给予了许可,并对样本进行了正式鉴定。葡萄藤受到了常规管理。在果实发育的不同阶段,分别在开花后7、8、9、10、11、12、13、14周采集葡萄果实,剥去果皮(7WAF、8WAF、9WAF、10WAF、11WAF、12WAF、13WAF、14WAF)。盆栽2年的葡萄品种Kyoho也在试验田中种植。我们采集了葡萄的不同部位,包括幼根、茎、叶、卷须、花、肉、皮、种子和木质部汁液。26那27].收集样品并立即在液氮中单独冷冻。将所有样品储存在-80℃下进行后续分析。
生物信息学分析
我们用HMMER 3.0和Pfam蛋白质家族数据库(http://pfam.xfam.org),找到包括PF00368的域。利用结构域在葡萄基因组数据库(CRIBI)中搜索HMGR基因。http://genomes.cribi.unipd.it/Grape/,版本2.1。)。预测的基因进一步证实使用智能存在保守域(http://smart.embl-heidelberg.de/smart/set_mode.cgi?GENOMIC=1)及INTERPROSCAN (http://www.ebi.ac.uk/interpro/search/sequence-search)项目。HMGR序列拟南芥蒂利亚纳那甜橙那大豆那Populus trichocarpa,和Solanum lycopersicum从NCBI下载[28].
用Ex-PaSy (http://web.expasy.org/protparam/).TMPred (http://www.ch.embnet.org/software/TMPRED_form.html)和tmhmm(http://www.cbs.dtu.dk/services/tmmm/)用于进一步分析跨膜结构域,Gor4(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_gor4.html.)分析二级结构,瑞士型号(https://swissmodel.expasy.org/)预测三级结构。根据CRIBI数据库由MAPLNSPECT软件确定染色体分布。使用Mega 6(Sudhir Kumar,美国亚利桑那州立大学)的最大似然(ml)方法构建系统发育树。使用具有1000 repicate的引导标准测试所获得的树的可靠性。使用具有基因复制参数的McScanx与TBTOOLS软件(版本066)分析基因同联培养物[29].
基因结构显示服务器(http://gsds.cbi.pku.edu.cn/)并发现NCBI中的编码序列(CDS)和对应的全长基因序列。保守的主题是在MEME计划中构建的(http://meme-suite.org/tools/meme)使用全长氨基酸序列,因为图案数字为默认设置为20。我们认为上游1500 BPVvHMGRs作为启动子区域并进行CIS-COMMALOVATION元素分析(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/).使用在线软件字符串进行分析和预测VVHMGR的相互作用蛋白(https://string-db.org).
HMGR酶活性测定
根据Kim等人描述的方法,对“kyoho”葡萄的开发阶段中果实中HMGR的提取。[14.酶联免疫吸附试验(ELISA)试剂盒(绿野生物科技有限公司,江苏盐城,中国)。
香气成分确定
对10个品种成熟期的浆果皮和浆果果肉进行分离,测定香气成分。将研磨后的3 g物料溶于3 mL NaCl中进行测定。样品通过气相色谱仪(TRACE 1310, Thermo Scientific)和三重四极质谱仪(TSQ 9000, Thermo Scientific)进行分析。每个样品以分体模式(比例1:5)注入1微升,约17%的注入样品由载气输送到非极性色谱柱(TG-5MS, 30 m, 0.25 mm ID, 0.25 μm膜厚,Thermo Scientific)。通过质谱分析初步鉴定化合物,即样品的质谱与NIST质谱库中的数据库相匹配。3-辛醇用作内标准物质[9.那30.].
葡萄果实的激素和渗透胁迫处理
我们制备了不同浓度的乙烯(ETH, 200, 500, 2000 mg·L)-1)、茉莉酸甲酯(MeJA, 5、50和100 μmol·L .-1)、水杨酸(SA, 100、250、500 μmol·L-1)、生长素(IAA, 0.1、10、20 μmol·L .-1),NaCl溶液(20,60和100mm),聚乙二醇(PEG,-0.2,-0.4,-0.6MPa),NaOH(pH 5,7,9)。根据郑等人的方法。[31],将激素和渗透胁迫的‘巨峰’葡萄果实浸泡在该溶液中,抽真空3次,每次抽真空10分钟。由于乙烯处于气态,我们用乙烯利模拟乙烯的作用,处理后放入密封盒中。蒸馏水作为对照。每个处理重复3次,每组10个水果。取样保存在一个密封的盒子中,并在激素和渗透胁迫后的1、12、24和48小时,在光照和温度胁迫后的24、36、48、60小时进行取样。qRT-PCR检测基因的相对表达量,并用2-△计算机断层扫描方法使所有治疗方法可以在相同的水平进行比较。
HEML 1.0.3.7软件用于研究表达VvHMGRs在不同的葡萄期间在葡萄树的不同发展阶段。
葡萄果实的光、温胁迫处理
将葡萄果置于不同温度(4,25,37和-20℃)的不同培养箱中,使用室温(27℃)作为对照,并用254nm紫外-c辐射处理(UV-C)分别为60,90,120分钟,使用白光作为对照。在光和温度胁迫之后在24,36,48,60h下进行采样。
RNA提取,cDNA合成,qRT-PCR
使用西甲基三甲基溴化铵(CTAB)法通过固定植物总RNA分离试剂盒(中国)来提取总RNA(CTAB)方法。基于A260 / A A280吸光度比和1.0%琼脂糖凝胶电泳评估RNA纯度和完整性。使用HIFAIRII®第1链CDNA合成Supermix合成cDNA,用于QPCR(Yeasen,Shanghai,China)。
QRT-PCR包含5μLSYBR预混物EXQ™(YEASEN,上海,中国),每种引物(10μm),2μLCDNA的0.3μL,总体积为10μL。使用光环晶仪(Roche,Germany)进行该反应,在95℃下进行初步步骤30s,然后在95℃下进行35次,5℃,58℃。使用2计算与着色和香气形成相关的基因的表达-△计算机断层扫描方法。Oligo D(t)引物用于cDNA合成,并且在表S中列出了基因特异性引物1.
统计分析
所有数据(至少三次复制,N= 3)以标准误差(SEMs)表示。使用Microsoft Excel (Microsoft Corporation, Albuquerque, NM, USA)计算每个处理的平均值±SEM值。采用SPSS 17.0 (SPSS, Inc., Chicago, IL, USA)进行方差分析(ANOVA),邓肯多范围检验(Duncan's multiple range test, P < 0.05)。使用Heml 1.0.3.7和Origin Pro 9 (Origin Inc., Northampton, MA, USA)制作数据。
结果
植物的鉴定与进化分析VvHMGRs基因在葡萄
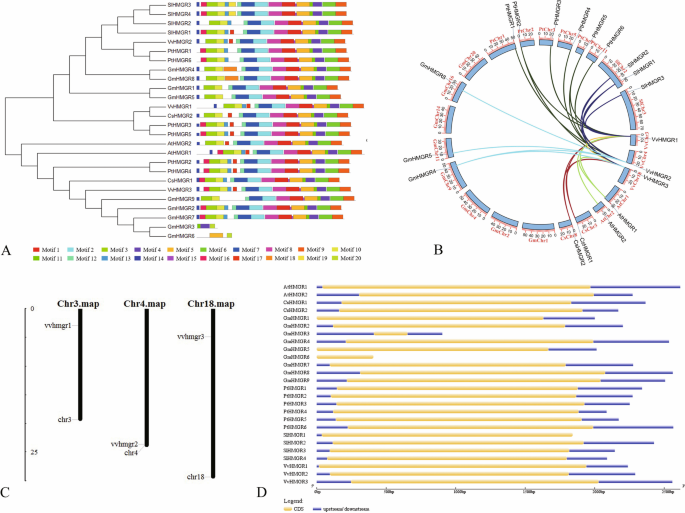
我们预测VvHMGR在黑皮诺葡萄基因组序列支架中,利用HMMER 3.0和Pfam蛋白家族数据库搜索葡萄基因组序列同源性。利用SMAT和INTERPROSCAN程序对预测基因进行验证,共3个VvHMGRs在葡萄中,VvHMGR1(XM_002283147),VvHMGR2(XM_002265602),VvHMGR3(xm_002275791)。三VvHMGRs分别位于第3、4和18号染色体上。1C),编码区长度在1710 ~ 1930 bp之间,与拟南芥,柑橘sinensis,甘氨酸max,populus trichocarpa,和Solanum lycopersicum.的信息hmgrs.7个物种的基因列于表S2.所有的二级结构hmgrs.基因是由α螺旋和随机卷曲为主,占80%(表S =3.),并且所有位于内质网(表S)4.).
根据进化关系的分析(图。1一个),VvHMGR1密切相关cshmgr2,pthmgr3.和Pthmgr5., 和VvHMGR2最靠近Pthmgr1.和Pthmgr6., 尽管VvHMGR3最靠近cshmgr1.和GMHMGR9.,它具有共同性cshmgr2.和GMHMGR4.(无花果。1b)。HMGR在不同的物种之间很受保守(图。1一个,图1).它包含14种常见的母题(图S2).VVHMGR1和VVHMGR2的结构一致。与其他成员相比,VVHMGR3具有MOTIF16。全部HMGR.来自所选物种的基因不包含内含子,并且至少有一个UTR区域,除了GMHMGR6.(无花果。1d)。基因结构VvHMGRs是一致的,具有相同数目和非编码区的不同的长度。
巨穗葡萄HMGR家族的组织表达
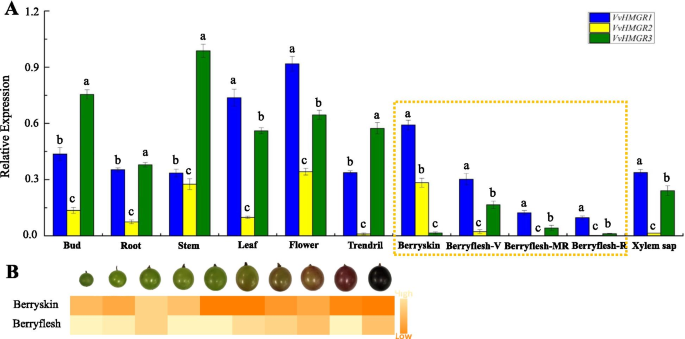
我们检测了3个HMGRs家族成员在‘巨穗’葡萄的芽、根、茎、叶、花、卷须、外果皮、果肉和木质部汁液中的表达水平。结果表明VvHMGRs“京穗”具有明显的组织特异性。如图所示。2一种,VvHMGR1一直高表达,在叶、花、外果皮中的表达量远高于其他组织。表达水平VvHMGR2三个成员中最低,茎,花和外豚的表达水平高于其他组织。表达水平VvHMGR3果皮和果肉含量较低,其他组织含量较高。随着果实的发育,基因的表达水平VvHMGR3正在逐渐下降。通过对果实发育过程中HMGR酶活性的测定,从整体上看,果皮和果肉中HMGR酶活性呈下降趋势,果肉中HMGR酶活性高于果皮(图2)。2b)。这种现象表明了VvHMGR3是更直接地与HMGR酶的酶活性,其表达极大地影响酶活性。因此,在剥离的酶活性比在纸浆低。
基因表达模式VvHMGRs中不同类型的葡萄的不同发育阶段
通过检测表达水平VvHMGRs在十个葡萄品种中,我们发现了VvHMGR1在所有品种的果实开发过程中一直保持相对高的表达水平,特别是在黄玫瑰香味品种中(图。3.).表达水平VvHMGR2总是很低,不受“夏天黑”的水果开发阶段的影响,在“夏天”的“景枣”和“百年无籽”,而其他品种逐渐下降。表达水平VvHMGR3在rose fragrance varieties (‘Shine Muscat’ and ‘Yellow Italia’) was higher than that of other varieties, and it showed a trend of first decreasing and then increasing during fruit development, which was related to the enlargement of early fruit and strong terpenoid metabolism as aroma formation in the later fruit. However, this phenomenon did not exist in strawberry fragrance fruits.
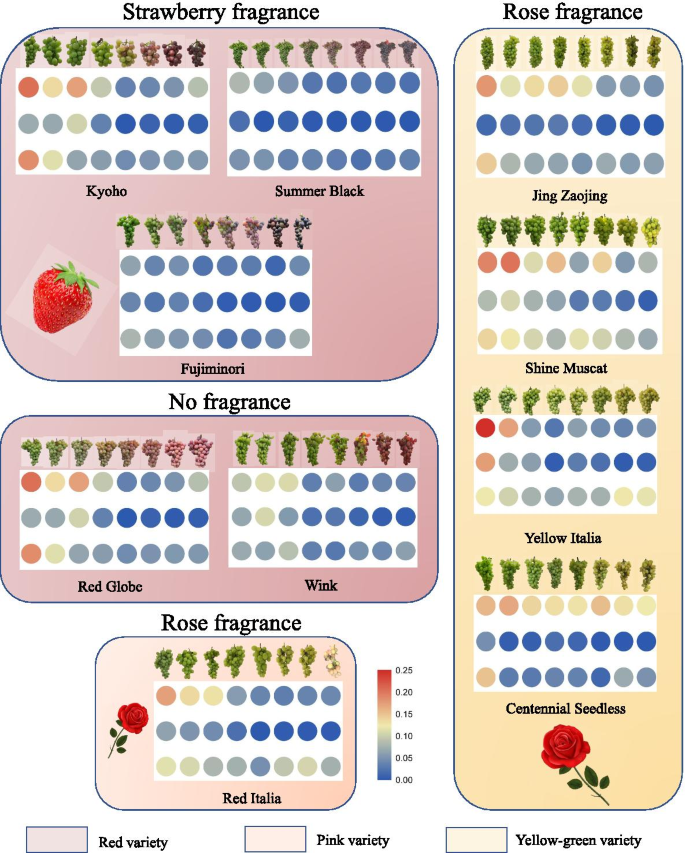
总体而言,表达水平VvHMGRs在不同颜色的水果是不同的,并以红色水果的表达水平较低,特别是在“夏黑”和“藤稔”。在黄色的品种有玫瑰香,表达水平VvHMGRs是最高的,并且在红色品种中,草莓香味是最低的。表达水平VvHMGR3以绿色为主的“鲜早净”和“百岁无籽”的表达量相对较低。在采样过程中,我们发现‘Red Italian’果实在发育初期黄色较深,成熟时呈淡粉色。的表达模式VvHMGR3类似于黄色的品种,这也证实了这一现象。
不同类型的葡萄中的香气成分
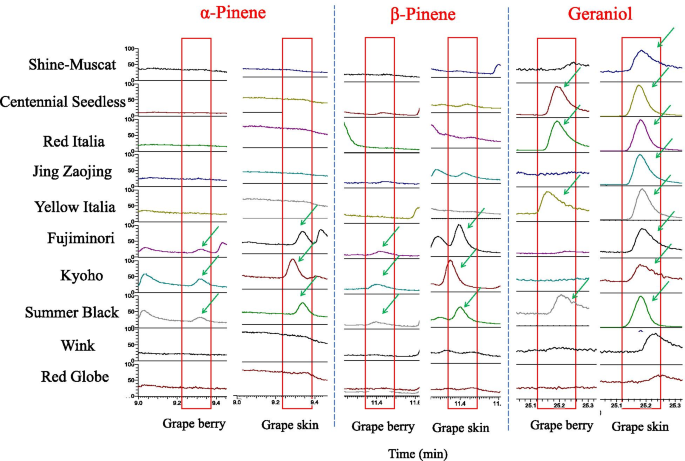
在成熟的阶段测量了浆果皮和浆果10种变种的香气组分,结果表明,浆果皮中的香气成分比浆果肉更丰富(图。3.,表S.5.).在浆果皮肤中有18,20,20,26,33种植物中的香气在玫瑰香味品种,29,37,39种,草莓味的品种,20,26种中的非芳香品种.葡萄中的主要萜烯香气包括Linalool和Geraniol,其中Geraniol主要在玫瑰流动的品种中。我们发现β-Pine烯和α-突烯主要是草莓味的品种中挥发性香气成分(图。4.).Linalool是葡萄萜烯芳香的关键组成部分,发现在不同的味道品种中,占据了很大的比例。“红色意大利”是一种红玫瑰香味品种,具有许多独特的成分,不同于红草莓香味品种,红珠和绿色玫瑰味的品种。D-柠檬烯富含浆果皮肤,并浆果肉体的“红Italia”,Cis-Linaloxide和Trans-玫瑰氧化物也在“红色Italia”中进行了专门检测。此外,我们还检测到胚芽酮D,属于“京枣晶”和“夏天黑”中的癫痫术芳香。
萜类化合物和花青素代谢相关基因表达的变化及其与VvHMGRs
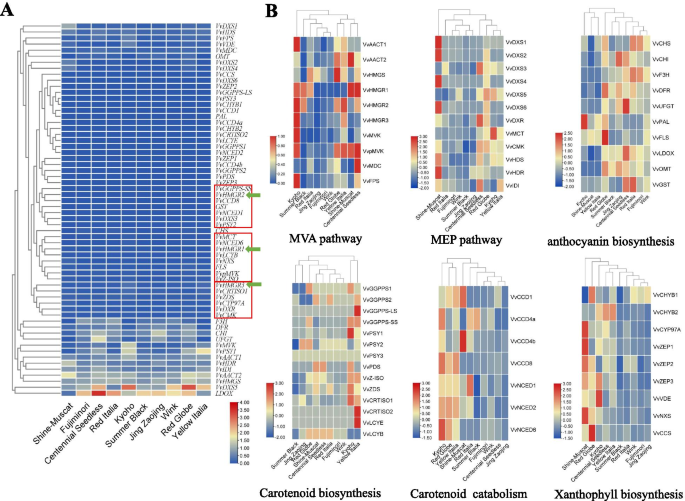
在成熟阶段的十个葡萄品种的皮肤中测试了香气形成和颜色相关途径的基因表达水平。在基因级聚类后(图。5.a),我们发现了VvHMGR3有类似的表达趋势VvCRTISO1, VvZDS, VvCYP97A, VvDXR,和vvcmk..VvHMGR1与的变化相似吗VvMCT VvNCED6,和vvlcyb..VvHMGR2是类似于vvggpps-ss.和vvccd8.,这意味着VvHMGRs可能与类胡萝卜素生物合成和MEP途径相关联。
由于隐藏其他基因变化的高表达基因,我们已经进行了基因的标准化,以最大程度地显示每个基因。通过采样级聚类(图。5.B),典型的黄色玫瑰品种“Shine-Muscat”的MVA通路基因表达模式与“Centennial Seedless”相同,并与“yellow Italia”聚集在一起。‘Shine-Muscat’的MEP通路基因表达模式不同,其花青素生物合成途径与‘Yellow Italia’的变化一致,类胡萝卜素生物合成与‘Centennial无籽’相似,但类胡萝卜素分解代谢和叶黄素生物合成不同。典型的红色品种‘Wink’和‘Fujiminori’在所有6个途径上都聚在一起,表明这两个品种在萜类合成、代谢和花青素生物合成方面非常相似。
HMGR在葡萄的生长发育中起着重要的作用
通过分析跨膜结构,VVHMGRS蛋白表现出跨膜性质。VVHMGR1在外部到外部(I-O)螺旋,9外部到内部螺旋(O-I),VVHMGR2有7个I-O和8 O-I,VVHMGR3有6个I-O和5 O-I(图)4.A). VvHMGRs的二级结构非常不同,由α -螺旋、延伸链和随机线圈组成,并分布在整个蛋白中(图S)4.b)。第三结构高度保守,其催化区含有L,N和S三个结合结构域。L结构域是最大的,具有两个HMG-CoA结合结构域和一个NADP(H)结合结构域,而小螺旋S结构域含有另一种NADP(H)结合域(图S4.C) 。
启动子中的顺式元素的计算预测VvHMGRs基因表明它们处于复杂的环境和植物激素调节网络中(图S4.d)。通过基于蛋白质结构的相互作用蛋白质预测,VVHMGR可能与HMG-COA合酶,MVA激酶,FPP / GGPP合酶和二磷酸二磷酸二磷酸酯脱羧酶相互作用,证实HMGR的最重要作用是参与萜类化合物的合成和代谢基于MVA途径(图S4.e)。
结合进化生物信息学分析(图。1,年代4.),组织表达模式(图。2)和表达模式VvHMGRs在不同类型的水果中(图。3.那5.),我们预测VvHMGR3在葡萄的生长发育过程中起着重要作用。
vvhmgr3响应外部条件
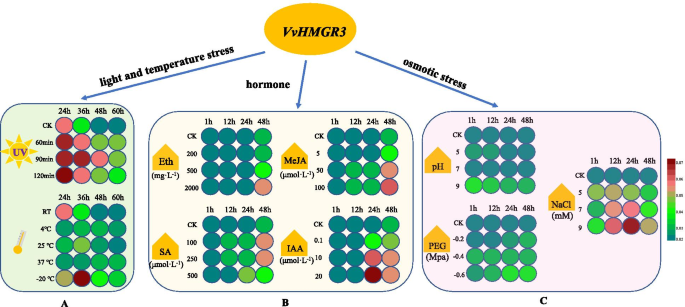
我们可以看到的变化VvHMGR3在图1的不同pH,渗透压,NaCl浓度,温度和UV处理时间下。6..总体上,VvHMGR3通过盐胁迫,温度胁迫,和紫外线辐射调节,并且它也有不同的响应到四个激素。的最终的表达VvHMGR3下的Eth,茉莉酸甲酯,SA和IAA治疗上调,并且响应时间不同,的Eth为48h,AA为24小时,茉莉酸甲酯和SA分别为12小时,分别。用于治疗的浓度,VvHMGR3受高浓度MeJA和中浓度SA的影响,除SA外,VvHMGR3的表达与激素浓度成正比。
在渗透胁迫处理中VvHMGR3对pH和PEG的影响低于NaCl,表现为相对碱性环境,渗透值高,含盐量高。表达VvHMGR3在24小时急剧增加,然后在正常情况下缓慢降低,而在紫外线处理下,表达VvHMGR3在24 h时显著高于正常葡萄,说明紫外线促进了VvHMGR3.在采后贮藏期间,超低温处理(-20℃)减缓了高表达VvHMGR3,而高温(25℃和37℃)和普通低温(4℃)降低了表达VvHMGR3.总之,VvHMGR3受激素,渗透压,光和温度应激,尤其是盐胁迫和紫外线治疗。
讨论
VvHMGRs在结构上是保守的,并且功能多样
HMGR蛋白由三个部分,跨膜结构域(N-末端),催化结构域(C末端)和连接结构域组成[32那33].跨膜结构域在进化过程中高度可变的,并且HMGR活性在植物中的负调控更多地取决于N端结构域[19.那33].催化结构域相对保守,由N结构域、L结构域和S结构域组成。L结构域包含两个HMG-CoA结合位点和一个NADP (H)结合位点,S结构域包含另一个NADP (H)结合位点[33].植物HMGR正在控制在转录和转录后水平的复杂机制。由于存在催化结构域中保守的丝氨酸位点,HMGR的活性变化是通过磷酸化调节的过程。SER577的ATHMGR1S的磷酸化状态对于调节拟南芥中的HMGR活性非常重要[34].二级结构HMGR.基因由α螺旋和随机线圈主导[35],这也在本研究中验证。
HMGR作为一个小型基因家族,其中包含拟南芥2个成员[36马铃薯[37],5橡胶树[38那39在大米中[23],4小麦[40],丹参4 [41],9件棉制。所有植物HMGR基因的基因结构和蛋白质结构都是高度保守的,源于一个祖先基因,最终发展成四个不同的类群[28].HMGR基因家族的功能和进化在整个植物界都非常保守[33那42].通过分析葡萄和其他物种之间的进化关系,我们发现了VvHMGR1密切相关甜橙和Populus Trichocarpa.那VvHMGR2最接近Populus Trichocarpa.和Solanum lycopersicum, 和VvHMGR3最接近甜橙和大豆,这与Li等人的观点一致[28].
HMGR基因家族不同成员的表达存在显著差异[39].服用丹参作为一个例子,SMHMGR1.和SMHMGR4.以鲜花高度表达,SMHMGR2.主要用叶子和茎表达,和SMHMGR3.在除花以外的其他组织中高表达[41].在一个物种的基因HMGR家族的不同成员具有不同的表达模式,调节特性和生理功能,共同调节MVA代谢途径来确定下游萜代谢物的类型和含量[25那41那43].hmgr1.参与甾醇的合成,而hmgr2.和HMGR3.涉及倍半萜烯的积累在马铃薯[37].在这项研究中,有三个成员HMGR.葡萄的基因家族。VvHMGR1总是处于高表达状态,并且VvHMGR2最低。表达水平VvHMGR3随着水果开发减少,这可能与不同HMGR家族成员的不同功能有关。
HMGR在植物生长和发展中发挥着重要作用
HMGR影响植物生长发育[44那45].MVA途径对细胞生长的调节作用,和细胞生长依赖于MVA和其衍生物[19.].在甜瓜果实发育早期阶段的皮肤中迅速积聚HMGR蛋白,在剥离中发生活性细胞分裂,这决定了甜瓜果实的尺寸[46].删除拟南芥基因ATHMGR1.导致植物缩短,过早衰老,雄性不育和低于野生型植物的甾醇含量[47].抑制具有Lovastatin的HMGR活性可以阻断MVA合成并导致IPP合成不足,这导致番茄果粒大小和发育的显着抑制。添加HMGR以催化MVA后,返回正常情况[3.].我们发现表达式模式VvHMGRs不同品种葡萄在发育过程中存在差异,这可能与葡萄在发育过程中对萜类化合物的需求有关。此外,HMGR可以积极调节萜类化合物的代谢,从而影响激素的合成,从而影响植物的生长发育[48].抑制的表达VvHMGR3能增加IAA、ABA和BR含量,降低GA3.和ZR目录[9.].
HMGR与Terpenoid生产正相关[44那49那50]. 在这项研究中,我们确认the expression level ofVvHMGRs在不同的组织中完全不同。它可以与HMG-CoA合酶,MVA激酶,FPP / GGPP合酶和二磷酸二磷酸二磷酸二磷酸二磷酸二卤酸脱羧酶相互作用,并参与合成萜类化合物,其与Dai等人一致。[25]和hedl等人。[51],谁报道,HMGR在植物中的主要功能是参与MVA途径萜类化合物的合成。调节的关键酶的基因的相对表达,例如通过生物方法HMGR可以改变生产相关萜类化合物[14.那52那53那54].过度的HMGR.可以分别增加烟草,瓜构,人参和蒿的甾醇,橡胶和树脂,皂苷和蒿素的含量[3.那13.那14.那55].沉默HMGR.在积雪草的三萜皂甙的影响的合成,和异源表达拟南芥HMGR1番茄基因可大大提高植物甾醇含量[56].
HMGR参与果实颜料和香气的形成
HMGR通过影响MEP途径和花青素的合成来调控颜色的形成[48那57那58].前人研究发现HMGR可以编码功能性蛋白质,并加速类胡萝卜素的生物合成Withania somnifera和azadirachta indica.[58那59].在这项研究中,还发现了VvHMGRs在表达中具有类似的趋势,具有许多类胡萝卜素生物合成和MEP途径的基因,以及表达水平VvHMGRs黄色品种通常高于红色品种。这些结果表示VvHMGRs与果实着色密切相关,这可能取决于它们对黄色品种中活性萜类代谢途径的影响。过表达HMGR.基因还可以增加番茄红素的含量青蒿[57],这也证实了积极作用HMGR.在异戊二烯生物合成中。因此,我们认为HMGR可能与类胡萝卜素的合成相关,但需要进一步研究机制。此外,Sesquiterpenes和Triterpenes的生物合成对花青素的积累进行了拮抗作用。下调HMGR.基因可以积极地诱导各种激素的表达,并影响花青素的积累[48].过度的VvHMGR3抑制草莓果实着色,抑制表达促进果实着色时VvHMGR3在草莓果实中表达,确认了HMGR和花青素合成之间的直接关系。也许它与来自苯基氨裂解酶途径的初级新陈代谢(甾醇,类胡萝卜素等)和二次产物有关。VvHMGR3影响草莓果实成熟过程。抑制后,IAA,ABA和BR的内容增加了[9.].结合这项研究的结果,我们证实HMGR在葡萄柚着色中发挥着重要作用。
HMGR参与香气形成的调节。萜类化合物是许多植物中合成主要香气物质的前体物质,并且表达了HMGR.基因可以通过影响萜类化合物的合成来影响香气[14.].已在葡萄中鉴定出超过70种萜烯,主要是单口,迪尔彭和塞基斯萜烯[60那61].MVA途径主要用于合成SesquiterPene和三萜类香气组分,其直接由HMGR调节。MVA和MEP途径的分离并不完全独立。MVA途径合成产品可以进入塑料以形成单波培和迪尔替索[6.那18.].表达HMGR.基因对香组合物过表达的效果,并VvHMGR3改善草莓果实香气成分类型,其中芳樟醇、α-松油醇、β-蒎烯含量显著增加[9.].玫瑰香味和草莓香味品种存在明显的萜类成分差异。玫瑰香味葡萄有许多类型和丰富的萜烯芳香成分含量[62]. 我们发现,香叶醇主要存在于玫瑰香品种中,而β-蒎烯和α-蒎烯主要存在于草莓香品种中。芳樟醇是葡萄的主要萜类香气,在不同类型的香气品种中也有很大差异。研究发现,黄色品种更容易携带玫瑰香气,这可能与类胡萝卜素的合成和玫瑰香气的形成都属于萜烯代谢途径有关。以及VvHMGR3与这两个特征的变化一致,这也证实它可能在颜色和香气形成中起重要作用。
HMGR转录对各种环境和植物激素刺激的反应变化
HMGR的酶活性受到植物生长和发育,光,温度,湿度,紫外线,病原体,外源生长调节剂,甾醇和机械损伤等因素的高度调节14.那20.那63]. 在这项研究中,我们确认VvHMGR3受激素、光温胁迫和渗透胁迫的影响。适当的应激可以增加HMGR的活性,促进萜类化合物的合成[20.].本研究表明,pH和PEG对此影响不大HMGR.,而盐胁迫可以有效地促进表达HMGR..HMGR的较高活性水平通常与植物的快速生长相关,并且在成熟组织中大大降低了活性[9.].光抑制HMGR活性,而暗诱导HMGR基因表达。HMGR对光的响应较低,这一过程是由GATA和SORLIP基序等光响应元件介导的[52那64].但是,在本研究中,紫外线上调表达VvHMGR3的,这意味着光和紫外光具有onHMGR活性不同调节作用。而且,这是HMGR.基因明显受ETH、MeJA、SA、ABA等诱导[65那66].ABA能使豌豆中HMGR的活性降低40%,而玉米素(ZT)和赤霉素(GA)能使其活性升高[67].这项研究证实了VvHMGR3在Eth,Meja,SA和IAA治疗下进行了上调,而响应时间是不同的,并且更容易受到高浓度的MEJA和中浓度的SA。表达VvHMGR3与Eth、MeJA、IAA激素浓度成正比。我们的发现与Pu等人的研究一致[63]和ma等人。[41]报道这一点HMGR.使用SA和MEJA后,基因表达上调。然而,植物激素是否对HMGR活性的影响是由于它们作为Terpenoids的反馈调节或生长调节剂的作用尚不清楚。
结论
通过分析结构和进化特性HMGR.葡萄基因家族,检测其表达水平VvHMGRs在不同组织和不同类型的葡萄中,我们证实了VvHMGR3在葡萄果实着色和香气形成过程中发挥的重要作用,在黄香和玫瑰香葡萄品种中表达量较高。VvHMGR3与一些类胡萝卜素生物合成和MEP途径相关联,其可以与MVA激酶相互作用,其表达通过激素,渗透胁迫和光和温度胁迫来调节。这些结果为形成葡萄果实质量和三萜素的合成机制提供了更多的理论支持(图。5.).
可用性数据和材料
本研究中生成或分析的所有数据均包含在本已发表文章及其补充信息文件中。如有要求,可联系通讯作者索取材料。当前研究期间生成的数据集可在GenBank存储库中获得,http://www.ncbi.nlm.nih.gov/genbank.注册号如下:VvHMGR1(XM002283147),VvHMGR2(xm00226562),VvHMGR3(XM002275791),ATHMGR1.(NM106299),Athmgr2.(NM127292),cshmgr1.(XM006473798),cshmgr2.(XM006486498),gmhmgr1.(XM003517069),gmhmgr2.(XM003519426),GMHMGR3.(XM014775260),GMHMGR4.(XM003534178),GMHMGR5.(XM003537651),GMHMGR6.(XM006596524),GMHMGR7.(XM003545508),GMHMGR8.(XM003547838),GMHMGR9.(XM006605513),Pthmgr1.(XM002300508),Pthmgr2.(XM002301862),Pthmgr3.(XM006384809),Pthmgr4.(XM024601892),Pthmgr5.(xm024607975),pthmgr6(xm002316990),SlHMGR1(NM001309881),SlHMGR2(NM001309190),SlHMGR3(XM004234541),SlHMGR4(xm010319372)..
缩写
- HMGR:
-
3-羟基-3-甲基戊齐芳基 - COA还原酶
- MVA:
-
甲羟戊酸
- MEP:
-
2-C-甲基-D-赤藓糖醇-4-磷酸盐
- BR:
-
芸苔类固醇
- 阿巴:
-
脱盐酸
- 乙:
-
乙烯
- Meja:
-
茉莉酸甲酯
- SA:
-
水杨酸
- IAA:
-
养阴
- UV-C:
-
紫外线辐射
- 挂钩:
-
聚乙二醇
参考
- 1。
al-babili s,bouwmeester hj。杂曲酮,一种新型类胡萝卜素衍生的植物激素。Annu Rev植物Biol。2015; 66:161-86。
- 2.
侯X,河流J,Leon P,McQuinn RP,Pogson BJ。植物中偶体藤蛋白信号的合成与功能。趋势植物SCI。2016; 21(9):792-803。
- 3.
Enfissi Em,Fraser Pd,Lois Lm,Boronat A,Schuch W,Bramley PM。甲戊二醇酯和非甲戊二醇酯异戊烯基二磷酸酯的代谢工程,用于生产健康促进番茄中的异戊二烯。植物Biotechnol J. 2005; 3(1):17-27。
- 4.
萜烯合成酶和萜烯代谢的调节、多样性和生物学作用。植物学报。2006;9(3):297-304。
- 5.
Suzuki M,Nakagawa S,Kamide Y,Kobayashi K,Ohyama K,Hashinokuchi H,等。完全封闭甲羟戊酸途径导致雄性的配子体致死。J Exp Bot。2009; 60(7):2055-64。
- 6.
Ferrero S, Grados-Torrez RE, Leivar P, Antolin-Llovera M, Lopez-Iglesias C, Cortadellas N, et al.;植物细胞内3-羟基-3-甲基戊二酰辅酶A还原酶膜结构域驱动内质网的增殖和形态发生。植物杂志。2015;168(3):899 - 914。
- 7.
廖P,哈梅林A,Bach TJ,Chye ML。甲醛途径的潜力,用于增强异戊二烯生产。Biotechnol Adv。2016; 34(5):697-713。
- 8.
植物中HMG-CoA还原酶活性的调控。中华内分泌杂志1994;35(7):1133-40。
- 9.
郑婷婷,董婷婷,海德女士,金华,贾华,方建军。油菜素内酯对3-羟基-3-甲基戊二酰辅酶a还原酶的调节作用及其对葡萄果实发育的影响。中国农业科学(英文版)。
- 10。
Bindu BV, Srinath M, Shailaja A, Giri CC.比较蛋白谱研究和在硅结构/功能分析HMGR (ApHMGR)andrographis paniculata.(发热管。f。)墙。交货需要雇。2017;6(1): 30 - 44岁。
- 11.
比克JA,兰格BM。跨过叶绿体被膜中间体的单向传输:类异戊二烯生物合成的胞质和质体途径之间代谢串扰。拱生物化学生物物理学。2003; 415(2):146-54。
- 12.
张海涛,王旭东,张海涛,等。类异戊二烯生物合成的胞质和质体途径之间的串扰拟南芥蒂利亚纳.P Natl Acad Sci USA。2003; 100(11):6866-71。
- 13.
Dong N,Ponciano G,McMahan CM,Coffelt TA,Johnson L,Creelman R,等。3-羟基-3-甲基戊二酰辅酶A还原酶在细胞中的过度表达占卜律镨(银胶菊)。作物学报2013;46:15-24。
- 14.
金yj,李或,哦,jy,jang mg,杨立德。三羟基-3-甲基uTaryl辅酶凝固酶编码基因的三羟基-3-甲基戊酰胺基因的功能分析。植物理性。2014; 165(1):373-87。
- 15.
Lynen F,Henning U,Bublitz C,Sorbo B,Kroplin-Rueff L.肝脏乙酸形成的化学机制。Biochem Z. 1958; 330(4):269-95。
- 16.
巴赫TJ。羟甲基戊齐芳基还原酶,植物甾醇合成中的关键酶吗?脂质。1986; 21(1):82-8。
- 17.
Caelles C,Ferrer A,Balcells L,Hegardt FG,Boronat A.编码拟南芥CDNA的分离和结构表征拟南芥3-羟基-3-甲基谷族辅酶还原酶。植物mol biol。1989; 13(6):627-38。
- 18.
Goldstein JL,棕色MS。调节甲戊二醇盐途径。自然。1990; 343(6257):425-30。
- 19.
Leivar p,antolin-llovera m,ferrero s,closa m,arro m,ferrer a等。蛋白质磷酸酶2a的拟南芥3-羟基-3-甲基戊齐亚酶辅酶酶的多晶型控制。植物细胞。2011; 23(4):1494-511。
- 20.
Morshedloo Mr,Craker Le,Salami A,Nazeri V,Sang H,Maggi F.延长水分胁迫对两种牛至的单次和筛选合成的精油含量,组合物和基因表达模式的影响(ovinganum vulgare.l .)亚种。植物生理生化学报。2017;111:119 - 128。
- 21.
王志强,王志强,王志强,等。干旱胁迫下水稻植物甾醇合成途径的调控。植物生理与化学学报。2018;29(4):429 - 434。
- 22.
Enjuto M,Lumbreras V,Marin C,Boronat A.拟南芥HMG2基因的表达,编码3-羟基-3-甲基戊齐律辅酶还原酶,仅限于共源性和花卉组织。植物细胞。1995; 7(5):517-27。
- 23.
Ha Sh,Lee SW,Kim Ym,Hwang Ys。水稻中含3-羟基 - 甲基戊族 - COA还原酶的HMG2基因的分子表征。mol细胞。2001; 11(3):295-302。
- 24.
王Y,Guo B,张F,姚h,苗z,唐k。榛子中氧化3-羟基-3-甲基谷辅酶的基因分子克隆与功能分析(Corylus Avellana.L. Gasaway)。J Biochem mol Biol。2007;40(6):861-869。
- 25。
戴志,崔刚,周顺峰,张旭,黄磊。一种新型3-羟基-3-甲基戊二酰辅酶a还原酶基因的克隆与鉴定丹参参与二萜蛋白丹参酮积累。J植物理性。2011; 168(2):148-57。
- 26。
郑笃,海德女士,张熊,贾赫夫,方jg。从葡萄(CV.ROSARIO BIANCO罗萨里亚河麦克风中Xylem SAP的生物学和功能性能。SCI Hortic-Amsterdam。2020;272。
- 27。
郑涛,张克,朱克,关L,九思,李X等。集成的metaTranscriptom和转录组揭示了在出血期间葡萄树在葡萄树上的微生物群落组成和生理功能。基因基因组学。2019; 41(9):1095-111。
- 28。
李伟,刘伟,魏华,何强,陈建军,张斌,等。植物3-羟基-3-甲基戊二酰辅酶A还原酶(HMGR)基因家族的种特异性扩展和分子进化《公共科学图书馆•综合》。2014;9 (4): e94172。
- 29。
刘Z,海德MS,汗N,方J.综合序列综合序列分析及其在葡萄树(葡萄虫)中的表达探讨。基因(巴塞尔)。2020;11(2)。
- 30.
贾浩,张志强,张胜,付伟,苏林,方军,等。甲基化水平对葡萄果实发育过程的影响。中国农业科学。2020;68(7):2099-115。
- 31。
郑涛,张kk, Sadeghnezhad E, Jiu ST,朱晓东,董天宇,等。几丁质酶家族基因在葡萄中以特定的方式表达,以响应果种灰葡萄孢.mol Biol rep. 2020; 47(10):7349-63。
- 32。
Friesen Ja,Rodwell大众。3-羟基-3-甲基戊芳基辅酶-A(HMG-COA)还原酶。基因组Biol。2004; 5(11):248。
- 33。
Darabi M,Izadi-Darbandi A,Masoudi-Nejad A,Naghavi Mr,Nemat-Zadeh G. BioinfinfinoItics的3-羟基-3-甲基丙酰基 - 辅酶(Hmgr)基因在禾本科中的研究。Mol Biol rep. 2012; 39(9):8925-35。
- 34。
Robertlee J,小林尊K,唐J,铃木M,Muranaka T。证据表明拟南芥蒂利亚纳3-羟基-3-甲基 - 甲基戊芳基-CoA还原酶1在植物区的Ser577磷酸化。植物生物科技(东京)。2018; 35(1):1-7。
- 35。
廖志强,谭强,柴勇,左坤,陈敏,龚玉英,等。HMG-CoA还原酶基因的克隆与鉴定Taxus Media及其在酵母中的功能鉴定。植物生态学报。2004;31(1):73-81。
- 36.
从RM, Fink GR.获得3-羟基-3-甲基戊二酰辅酶-a还原酶拟南芥蒂利亚纳在结构上与酵母和动物酶不同。P Natl Acad Sci USA。1989; 86(8):2779-83。
- 37.
Choi D,Ward Bl,Bostock RM。差异诱导和抑制马铃薯3-羟基-3-甲基戊芳基辅酶的辅助酶基因响应于Phytophthora Infestans.和其诱导花生四烯酸。植物细胞。1992; 4(10):1333至1344年。
- 38.
蔡敏敏,谭志华,蔡玉玲。3个基因编码3-羟基-3-甲基戊二酰辅酶A还原酶Hevea Brasiliensis.:HMG1.和HMG3.差异化表达。植物mol biol。1992; 19(3):473-84。
- 39.
3-羟基-3-甲基戊二酰辅酶a还原酶1的分子克隆与鉴定(hmgr1.)来自橡胶树的基因(Hevea Brasiliensis.Muell。精):类异戊二烯生物合成的关键基因。植物学报。2009;15(2): 133 - 143。
- 40.
Aoyagi K,Beyou A,Moon K,Fang L,Ulrich T. CDNA编码小麦3-羟基-3-甲基谷坐标酶的分离与表征。植物理性。1993; 102(2):623-8。
- 41.
MA Y,Yuan L,Wu B,Li X,Chen S,Lu S.基因组鉴定与参与三萜类生物合成中的新基因的特征丹参. J Exp机器人。2012;63(7):2809–23.
- 42.
ISTVAN ES,Deisenhofer J.人HMG-CoA还原酶的催化部分的结构。Biochim Biophys Acta。2000; 1529(1-3):9-18。
- 43.
罗伯茨SC。生产和植物细胞培养萜类化合物的工程。NAT CHEM BIOL。2007; 3(7):387-95。
- 44.
王益,景财,余鸣,陈毅,王t,刘p等。共同过度表达HMGR.和FPS基因增强了蒿素含量青蒿acta botanica yunnanica(云南植物研究);2011;5(15):3396-403。
- 45.
金YK,金JK,金YB,李S,金秀,公园SU。在毛状根植物甾醇和三萜类化合物的积累增强Platycodon Grandiflorum过度的人参3-羟基-3-甲基戊芳基 - 辅酶氧化酶还原酶。JAgric Food Chem。2013; 61(8):1928-34。
- 46.
小林T,加藤-荣盛S,富田K,3-羟基-3-甲基戊二酰辅酶A还原酶蛋白CM-HMGR的Ezura H.检测果实发育中瓜期间(Cucumis梅洛L.)。Al Appl Genet。2002;104(5):779-785。
- 47.
铃木男,Kamide Y,永田N,关H,大山K,加藤H,等人。的功能丧失3-羟基-3-甲基戊芳族辅酶还原酶1(HMG1)在拟南芥导致矮化,早衰和男性不育,降低胆固醇水平。植物j . 2004; 37(5): 750 - 61。
- 48.
李大,毛泽东,杨科学,郭紫,ma z,dawuda mm,等。花青素积累与“红美味”果皮中的激素与四代芽运动突变体相关联。BMC植物BIOL。2018; 18(1):363。
- 49。
Nafis T, Akmal M, Ram M, Alam P, Ahlawat S, Mohd A,等。通过HMG-CoA还原酶基因的组成型表达提高青蒿素含量青蒿L.植物Biotechnol Rep。2011; 5(1):53-60。
- 50。
Alam P,Abdin MZ。HMG-COA还原酶和氨基-4,11-二烯合酶基因的过度表达青蒿L.及其对青蒿素含量的影响。植物细胞代表2011;30(10):1919-1928。
- 51。
Hedl M, Tabernero L, Stauffacher CV, Rodwell VW。II类3-羟基-3-甲基戊二酰辅酶A还原酶。J Bacteriol。2004;186(7):1927 - 32。
- 52。
学过RM, Connolly EL。光调节3-羟基-3-甲基戊二酰辅酶A还原酶基因表达的空间模式拟南芥蒂利亚纳.植物j . 1997; 11(3): 499 - 511。
- 53。
温辛格,巴赫·特杰,马哈特曼。抑制烟草细胞中的角鲨烯合成酶和角鲨烯环氧化酶可触发3-羟基-3-甲基戊二酰辅酶a还原酶的上调。植物生理学。2002;130(1):334–46.
- 54。
近藤K,乌里塔尼I,奥巴K。马铃薯块茎和甘薯根组织中3-羟基-3-甲基戊二酰辅酶A还原酶的诱导机制。Biosci生物技术生物化学。2003;67(5):1007–17.
- 55。
Aquil S,Husaini Am,Abdin Mz,而不是通用汽车。HMG-CoA还原酶基因的过表达导致转基因中增强的蒿素生物合成青蒿植物。Planta Med。2009; 75(13):1453-8。
- 56。
Kalita R,Modi Mk,Sen P. RNai介导的3-羟基-3-甲基戊芳基 - COA还原酶(HMGR)介导的沉默积雪草的.基因报告。2018; 11:52-7。
- 57。
Ayora-talavera T,Chappell J,Lozoya-Gloria E,Loyola-Vargas VM。过度表达Catharanthus roseus也叫截短的仓鼠3-羟基-3-甲基戊二酰辅酶a还原酶基因的毛状根。应用生物技术。2002;97(2):135-45。
- 58。
Bhambhani S,Lakhwani d,舒克拉T,Pandey的A,达尔YV,阿西MH等人。基因编码的3-羟基-3-甲基戊二酰辅酶A还原酶(HMGR)基因家族的成员从azadirachta indica.与Azadirachtin生物合成的相关性。Acta physiol植物。2017年;39(2)。
- 59。
Akhtar N,Gupta P,Sangwan NS,Sangwan Rs,Trivedi PK。3-羟基-3-甲基戊齐亚酶的克隆和功能表征辅酶A还原酶基因Withania somnifera:一种重要的药用植物。原生质。2013;250(2):613–22.
- 60
葡萄汁和葡萄酒中的单萜。色谱学报(自然科学版);2000;
- 61
杨彩霞,王永军,梁志超,范鹏,吴炳辉,杨林,等。采用顶空固相微萃取-气相色谱-质谱联用技术对葡萄果实挥发物进行了种质水平评价。食品化学。2009;114(3):1106 - 14所示。
- 62
吴y,张w,song s,xu w,张c,ma c等。马斯喀特葡萄“闪亮马云”(VINIFERA)的发育过程中挥发性化合物的演变。食品化学。2020;309:125778。
- 63.
蒲国宝,马德明,陈建林,马立强,王辉,李发发,等。水杨酸能促进青蒿素的生物合成青蒿acta botanica sinica(云南植物学报);2009;28(7):1127-35。
- 64.
Kawoosa T,Gahlan P,德维AS,库马尔S的GATA和SORLIP基序在3-hydroxy-3-methylglutaryl-CoA还原酶启动子的Picrorhiza kurrooa用于光介导表达的控制。功能整合基因组学。2014;14(1):191-203。
- 65.
LV DM,张TT,邓S,张耶。功能分析Malus domestica mdhmgr2.转基因的基因启动子拟南芥蒂利亚纳.生物学植物。2016; 60(4):667-76。
- 66.
吕冬梅,张艳华。苹果MdHMGR1和MdHMGR4基因启动子的分离及功能分析拟南芥蒂利亚纳.植物细胞组织org。2017; 129(1):133-43。
- 67.
豌豆幼苗胞质HMG-CoA还原酶活性的调节:不同激素和激素产物相互作用的对比反应,表明激素调节活性。生物化学学报。1982;104(4):1537-43。
致谢
感谢南京农业大学作物遗传与种质创新国家重点实验室的田瑞平帮助我分析GC-MS数据。
资金
国家重点研发计划项目(no . 2019YFD1000101);国家自然科学基金项目(no . 31872047, no . 31872938);新疆联合基金项目(no . CXFZ202016);江苏省高校重点学科建设项目资助项目。
作者信息
从属关系
贡献
TZ设计了实验,分析了生物信息学,并完成了稿件;LG参与RT-PCR并分析数据;TL协调实验采样部位和有组织的抽样;ZL,KZ,SJ参与了生物信息学分析;KY,MS,MN参加了写作,审查和编辑手稿;HJ和JF提出了对实验设计的许多建设性建议,并多次修改了稿件。所有作者都读过并批准了稿件。
相应的作者
道德声明
伦理批准,指导方针和同意参加
关于葡萄的实验研究和实地研究,包括植物材料的收集,符合相关的机构,国家和国际指导方针和立法。
同意出版物
不适用。
利益争夺
两位作者宣称他们没有相互竞争的利益。
额外的信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充资料
附加文件1:图S1。
MEME分析中HMGRS基序的氨基酸序列。图S2。HMGRS推导氨基酸序列的多重对准。图S3。10个品种的浆果皮和浆果果肉香气成分。图S4。vhmgrs蛋白结构与功能分析。图S5。葡萄中主要萜类化合物的合成途径。
附加文件2:表S1。
用于在葡萄上用于QRT-PCR的底漆。表S2。关于HMGR基因的信息。表S3。蛋白质二级结构分析。表S4。亚细胞定位预测。表S5。10个品种的浆果皮和浆果果肉香气成分。
权利和权限
开放获取本文根据知识共享署名4.0国际许可证获得许可,该许可证允许以任何媒体或格式使用、共享、改编、分发和复制,前提是您给予原作者和来源适当的信任,提供知识共享许可证的链接,并说明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可证中,除非在材料信用额度中另有说明。如果文章的知识共享许可证中未包含材料,且您的预期用途未经法定法规许可或超出许可用途,则您需要直接获得版权持有人的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
郑,T.,Guan,L.,Yu,K。等葡萄3-羟基-3-甲基戊齐甲基 - COA还原酶的表达多样性(VvHMGR)在不同的葡萄基因型中。BMC植物杂志21,279(2021)。https://doi.org/10.1186/s12870-021-03073-8
已收到:
公认:
发表:
关键词
- 葡萄
- HMGR.
- Terpenoids.
- 颜色
- 香气