抽象的
Brassinosteroids(BRS)在植物生长和发展中起重要作用。虽然BR受体已经集中研究拟南芥,福克斯塔尔的人仍然很大程度上是未知的。在这里,我们表明,芸苔类固醇不敏感1(BRI1)的BR信号功能之间是保守的拟南芥和福克尾灯,是C4和胰腺的新模型物种。我们确定了福克斯特米尔基因组中的四个推定的Br受体基因:Sibri1.,Sibri1样受体激酶1(Sibr1.),Sibrl2.和Sibr3..使用系统发育分析将Dicots和单粒子的Br受体分类为三个分支。通过定量实时PCR(QRT-PCR)分析它们的表达模式表明,这些受体在叶,茎,深种幼苗,根部和非开花穗状鸟类中普遍地表达。GFP融合实验验证了局部化为细胞膜的Sibri1。我们还探索了Sibri1功能拟南芥通过互补实验。Sibri1的异位过度表达拟南芥BR受体失去功能突变体,Bri1-116,大多数逆转突变体的发育缺陷。当Sibri 1在粪码小米中过表达时,该植物显示下垂的叶片表型和根部发育抑制,横向根起始抑制,并且抑制BR合成基因的表达。我们通过免疫沉淀(IP) - 微量光谱法(MS)进一步确定了Bri1相互作用蛋白。我们的结果不仅证明SIBRI1在福克斯米特中的BR信号传导中发挥着保守的作用,而且还提供了对Sibri1的分子机制的洞察力。
背景
Foxtail Millet(意大利狗尾草)是二倍体C4胰腺作物。由于其显着的干旱和压力耐受性,水利用效率高,营养价值优异,福克尾部是世界上最重要的干旱和半干旱地区作物之一[1.].Foxtail小米基因组(423 MB)的测序于2012年完成[2.]为我们进一步研究了福克斯小米的农艺性状和生物学和非生物应激的进一步研究。
油菜素内酯(Brassinosteroids, BRs)是一种天然的多羟基类固醇,可调节植物的多种生理过程,包括生长促进、器官形态建成、器官边界形成、气孔发育、性别决定、维管分化、雄性育性、种子萌发、开花、衰老等。以及对各种非生物和生物胁迫的抗性[3.,4.,5.].BRS由膜局部亮氨酸(Leu) - 中等重复(LRR)受体样激酶(RLK),BRI1及其团簇BRI1-相关受体激酶1(BAK1)识别。BR结合促进BRI1与BAK1的关联,并能够在两种受体的细胞质激酶结构域之间进行转渗磷酸化[6.,7.].然后将Bri 1磷酸化两种类型的膜局部受体样细胞质激酶(RLCK),BR信号调速激酶(BSK)[8.]和组成型差异生长1(CDG1)[9],导致蛋白质磷酸酶Bri1抑制剂1(Bsu1)的激活。Bsu1去磷酸盐酸盐并抑制GSK3 /粗像激酶Br不敏感2(Bin2)[10.].在没有BRS的情况下,Bin2磷酸化转录因子铜胆碱抗性(BZRS)家族,防止它们调节下游靶基因的转录[11.].BR信号传导抑制bin2并允许BZR1通过蛋白质磷酸酶2a(pp2a)进行去磷酸化[12.].与它们的结合伴侣一起,去磷酸化的BZR1-族转录因子与BR反应元素或电子箱CIS元素结合,并调节许多BR响应基因的表达[13.] (数字1.). 然而,关于谷子BR信号转导途径的研究却很少。了解谷子中的BR信号可能有助于提高谷子的产量。
ATBri1,最重要的BR受体拟南芥,在N-末端,25LRR结构域和LRR XXI和LRR XXII之间的70氨基酸岛中具有膜局部信号肽,这对于对BRS的感知至关重要14.].ATBri1的突变拟南芥导致植株矮化,叶片小卷曲,深绿色,在黑暗中光形态建成,对外源BL处理不敏感,内源BRs积累,BR生物合成基因表达反馈调控[15.]. BRI1同源基因作为BR信号通路的重要受体,在单子叶植物和双子叶植物中都起着重要作用,包括拟南芥,玉米,番茄,甘氨酸最大,截形苜蓿,豌豆,奥雅萨苜蓿,Brachypodium distachyon, 和Hordeum Vulgare.[16.,17.,18.].值得注意的是,Gmbri1和MTBRI1可以拯救ATBri1的弱突变等位基因,布里1-5,在拟南芥[15.,16.,19.].玉米和B. Distachyon.,RNAi介导的BRI1的敲除及其同源基因导致BR不敏感的DWARF表型[18.,20.].BRI1突变在BRI1突变导致豌豆,番茄,米饭和大麦中相似的抗脂肪表型[21.,22.,23.,24.].这些结果表明,BRI1基因在不同物种间具有功能性保护作用。前期研究表明,DROOPY LEAF1 (DPY1)参与BR信号传导,抑制SiBRI1和SiBAK1的相互作用[25.]但尚未表征Foxtail Millet的Sibri1。
为了在C4模型物种Foxtail小米中获得BRS功能的见解,我们对Foxtail Millet Br受体进行了一种进化和功能检查。我们确定了福克斯米尔基因组中的四个推定的BR受体基因,Sibri1.,Sibr1.,Sibrl2.和Sibr3.,并分析了BR信号通路中的表达模式和角色。我们的研究结果表明,Sibri1可以拯救矮化表型Bri1-116,增强BZR1在体内的磷酸化以激活BR信号通路。当Sibri1在Foxtail小米中过表达时,植物显示下垂,根部发育抑制和Br合成基因的表达被抑制。此外,我们还发现128个Sibri1通过IP-MS进行相互作用的蛋白质,其为进一步研究Sibri1功能而奠定了基础。
结果
BRI1家族基因的系统发育分析
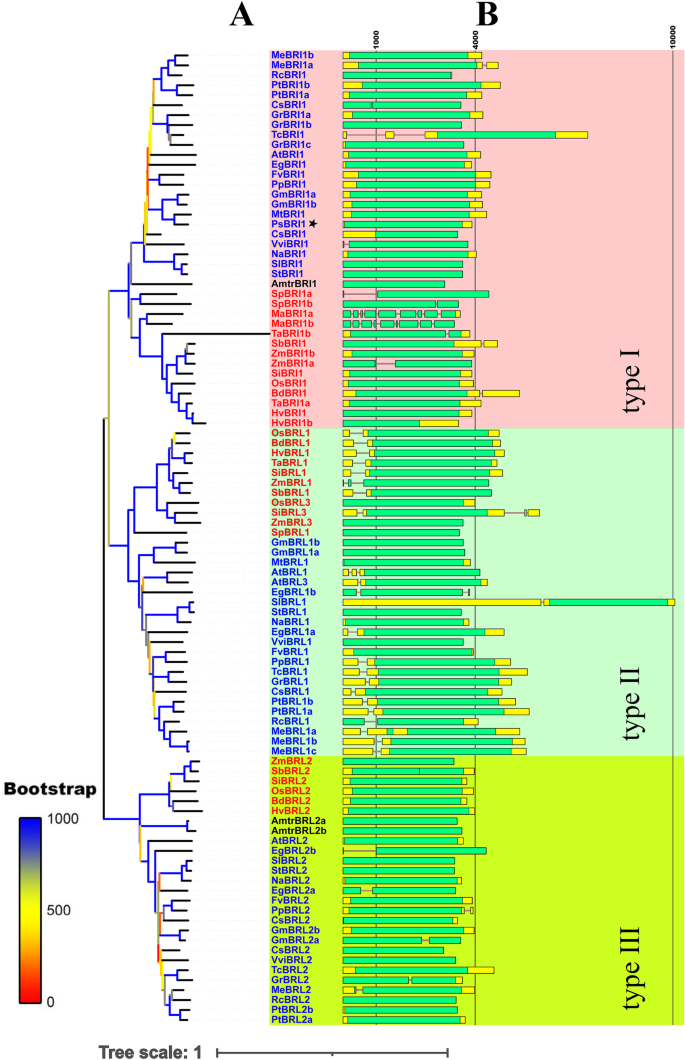
我们研究了福克尾部基因组是否编码规范BR信号转导通路的BR受体。通过使用植物血红蛋毒血珠和奥布里1蛋白序列,我们识别了Foxtail Millet Br受体。意大利狗尾草基于BLASTP算法的功能基因组数据库[26.].我们在福克斯米尔基因组中发现了四个推定的Br受体基因,其被命名为Sibri1,Sibrl1,Sibrl2和Sibrl3(表S1.).
我们进行了系统发育分析,包括Sibri家族,发表的BRI家族基因(表S1.)和具有相对完整的被子植物系统系统(APG)分类学(APG)分类学(APG)分类学(APG)分类学(APG)分类学的代表性植物[27.] (数字2.).因为BRI1属于RLK Superfamily,所以用单个隐藏的马尔可夫模型(HMM)搜索不能排除相当大的冗余。因此,使用已发表的Bri1蛋白序列来构建HMM,HMMer V 3.3 [28.用于搜索候选基因的候选基因,其具有之前没有粘附BRIS家族基因的物种的完整蛋白质序列数据。值得注意的是,我们仅在服从中找到了Bri1家族基因。最后,确定了98个BRI1基因家族成员并用于系统发育分析。为了映射这些构件中的系统发育关系,使用肌肉取向方法和邻近接合(NJ)系统发育推导方法。另外,单独分析全长BRI1序列(图。1.).
本研究中鉴定的植物BRI1基因家族成员(图。1.a)可以分为三个子组:I型,II型和III型。I型Bri 1家族基因亚组是最大的分支,占观察到的基因的38.8%,II型亚组占该基因的33.7%,而III型亚组占剩余的基因27.5%。BRI1属于I型,BRL1和BRL3属于II型,BRL2属于III型。I型Bri1基因的优势可能与这些基因有助于调节植物生长和发育的整个过程的事实有关,而BRL1和BRL3基因主要在根中致电[29.]. 值得注意的是,BRL1和BRL3属于同一类型,而BRL2属于单独的类型。这一结果与BRL2胞外区不能与BR相互作用的发现相符。此外,单子叶植物和双子叶植物进一步分为两个集群在每种类型(图。1.A) 是的。
SiBRI1与AtBRI1的同源性为53.96%,与OsBRI1的同源性为79.40%拟南芥和米饭。除OsBRI1外,ZmBRI1b、SbBRI1、ZmBRI1a、BdBRI1、HvBRI1、TaBRI1a、HvBRI1b与SiBRI1均属于系统进化树的一个分支,同源性分别为86.8%、86.7%、83.2%、81.3%、81.5%、81.5%、80.3%。BRI1基因的蛋白序列长度从827 aa (CsBRI1)到827 aa (CsBRI1)不等Cucumis Sativa)至1288 AA(玉米中的ZmBrl1),并且大多数BRI1基因没有内含子(图。1.B) 是的。在克隆和测序了SiBRI1的侧翼区域之后意大利狗尾草(玉谷1号)全长cDNA包含一个长开放阅读框,编码1118 aa蛋白。比对分析表明,SiBRI1与AtBRI1和OsBRI1具有保守的信号肽LRR、跨膜(TM)结构域和激酶结构域,并且AtBRI1激酶活性的关键氨基酸在SiBRI1中也保守,提示SiBRI1是一个活性激酶(图S)3.).
SiBRI1及其直系同源物的组织和亚细胞定位
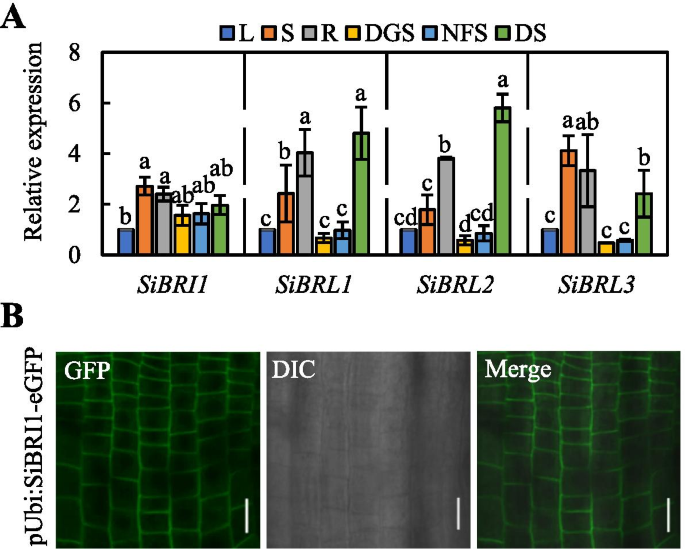
我们使用定量实时PCR(QRT-PCR)来确定粪码小米中的Sibri1及其正交结果的表达模式和转录性丰度。Sibri1在叶片(L),茎,深种幼苗(DGS),根(R),非开花穗(NFS)和粪尾米物中的干燥种子(DS)中普遍表达(图。2.A) 是的。Sibr1,Sibrl2和Sibr1在根,茎和干燥的种子中高度表达(图。2.A) 是的。我们推测Sibri1及其亲谬论基因可能在不同的组织中发挥不同的作用。
SiBRI1及其同源物在谷子不同组织中的表达及亚细胞定位分析。(A.),叶(L),茎,深种幼苗(DGS),根(R),非开花尖峰(NFS)和干燥的种子(DS)。误差条表示平均值±标准差(SD)。N = 3. Statistically significant differences are indicated by different lowercase letters (P < 0.05, one-way ANOVA with Tukey’s significant difference test). (B),共聚焦图像表明Sibri1-EGFP在过表达Sibri1的3天旧的深色幼苗的根中,用C-末端的GFP标签局部化。秤条=20μm
如上所述,预计N-末端和TM结构域中的信号肽存在于Sibri1中存在(图S3.).为了确定Sibri1的亚细胞定位,我们构建了由玉米泛素启动子驱动的融合蛋白,Sibri1 :: EGFP,并将其转化为Foxtail Mill。然后,通过激光共聚焦显微镜检查根系细胞中的质膜上的透明荧光信号(图。2.b)。结果表明,Sibri1是细胞膜蛋白。
SiBRI1基因的功能分析拟南芥
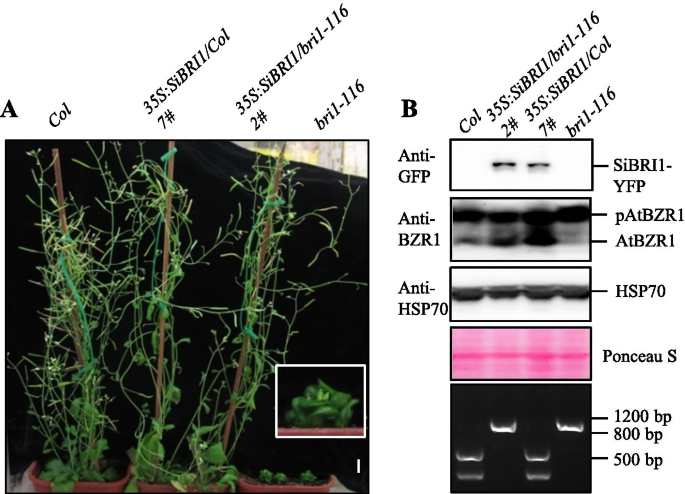
为了验证SIBRI1是否编码BR受体,我们将CAMV 35s启动子的控制下转换为CAMV 35S启动子的控制中的SIBri1编码序列拟南芥哥伦比亚 - 0(Col-0.)和一个不敏感的短暂性拟南芥变种人,Bri1-116.Bri1-116由在ATBri1岛结构域之前的21stLR在21stLR的位置583的谷氨酸点突变产生。这种突变导致肽链的早期终止和完全ATBri1缺失,严重植物侏儒症,缩短叶柄的表型,并缩小和圆形叶子[14.].在Sibri1过表达后,植物高度,硅质长度和叶片形态Bri1-116(Sibri1 /Bri1-116)观察到转基因素与Col-0.并且在Sibri 1过表达后,观察到BR激活植物的叶卷曲和伸长率Col-0.(Sibri1 /列)植物(图。3.A和S4)。以前的研究表明,当BR水平低时,培养物磷酸化并灭活BZR1以抑制植物生长;BRS通过诱导BZR1的去磷酸化,Active BR信号通知的标志来促进生长[11.].因此,我们在不同转基因植物中检测到ATBZR1的磷酸化水平。在Col-0.,在未磷酸化的AtBZR1中观察到弱条带,而在Bri1-116,用于不磷酸化的ATBZR1的乐队几乎无法察觉。当Sibri1转移到Col-0.背景或Bri1-116,用于不磷酸化的ATBZR1的带状带的强度显着增加(图。3.b),表明BR信号已被激活。
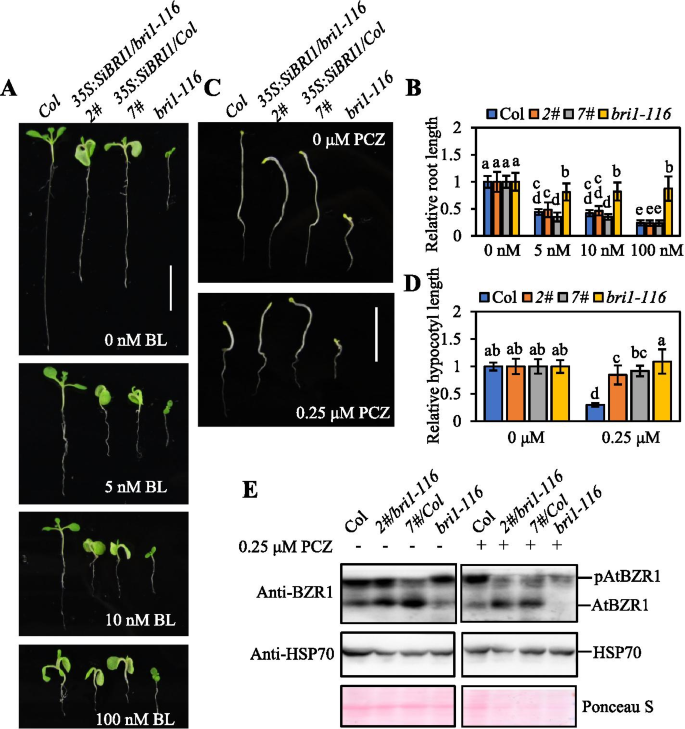
低水平生物活性芸苔(BL)的外源性促进植物生长。检查Sibri1过表达幼苗对外源BL应用的响应性,我们种植了种子1./2.Murashige and Skoog (MS)培养基中添加0、5、10和100 nM浓度的BL,连续培养7天,测定主根长度。未经BL处理,SiBRI1/Bri1-116明显大于Bri1-116但大约比普通人少38%Col-0.,以及SiBRI1的根长/列比那更短Col-0..Sibri1 /列表现出初生根略微缩短的表型,与施用BR后产生的表型相似,因为BR处理抑制了植物根系的延长(图。4.A)。SiBRI1 /列幼苗种植1./2.含有5和10nm BL的MS介质对BL的敏感性更大Col-0.幼苗和sibri1 /Bri1-116植物表现出对BL的敏感性Bri1-1165、10和100 nM BL处理下的植物,浓度依赖性(图。4.b)。这些结果表明Sibri1过度表达植物对BL表现出增强的敏感性。
SiBRI1的过度表达激活了细胞内的BR信号传导Bri1-116植物。(A.),表型Col-0.和Bri1-116过表达SIBRI1的突变植物在显示出明确的BL的BL存在下生长7天。秤杆= 1厘米。(B)中植物的相对根长(A.).误差条表示平均值±标准差(SD)。n> 30.统计上显着的差异由不同的小写字母表示(P < 0.05, two-way ANOVA with Tukey’s significant difference test). (C),表型Col-0.和Bri1-116过表达Sibri1的突变植物在表明浓度的PCZ的情况下生长7天。秤杆= 1厘米。(D),植物的相对幼杆长度(C).误差条表示平均值±标准差(SD)。n> 30.统计上显着的差异由不同的小写字母表示(P < 0.05, two-way ANOVA with Tukey’s significant difference test). (E),转基因植物中BZR1的免疫印迹分析过表达SIBRI1Bri1-116PCZ下的突变型或野生型背景。pAtBZR1为AtBZR1的磷酸化形式,AtBZR1为AtBZR1的非磷酸化形式。转基因植株中HSP70和AtBZR1的表达水平如图所示(C).HSP30的Rubisco大亚基的PONCEAU S染色和HSP70的表达水平被用作等加载控制
ProPiconazole(PCZ)是Br生物合成的特异性抑制剂,抑制在光线和黑暗条件下的胚缩伸长拟南芥和玉米[30.].确定Sibri1对PCZ的Sibri1对表达幼苗的反应,我们培养了发芽的种子1./2.MS培养基在黑暗中含有0.25μm的PCZ七天。在暗条件下,0.25μmPCZ将野生型幼苗的幼杆长度降低67%。Sibri1过表达幼苗的胚轴具有波浪,扭曲的表型。缺口长度Bri1-116PCZ处理和非PCZ处理的幼苗很短,没有显著差异。西伯利亚1/Bri1-116和SiBRI1/列幼苗对PCZ的不敏感性更大Col-0.幼苗(图。4.C,D和S4)。我们还测试了不同转基因植物中的ATBZR1的磷酸化水平,发现抑制了转基因植物中的ATBZR1的磷酸化(图。4.e)。所有这些结果表明SIBRI1转基因成功地补充了BR不敏感的表型Bri1-116.
Sibri1在Foxtail Millet中调节BR信号传导
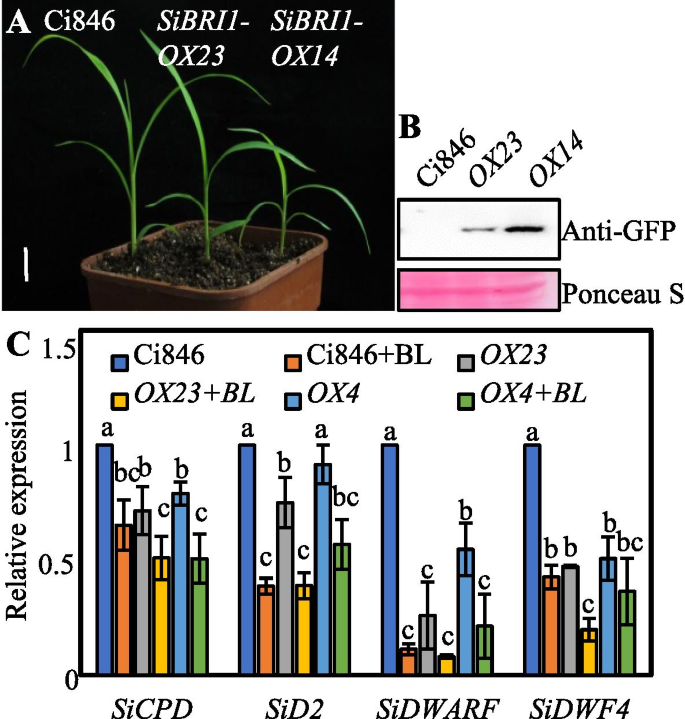
为了测试Sibri1是否在Foxtail小米中调节BR信令,我们在CI846中过度表达全长SIBRI1,这是一种易于转换的品种S意大利并产生pUbi:SiBRI1-eGFP转基因(Sibri1-ox)通过愈伤组织转型植物。在4叶阶段,Sibri1-ox幼苗在两个独立的株系,ox23.和ox14,具有比Ci846幼苗更大的叶角和下垂叶(图。5.一种);值得注意的是,据报道,大叶角和下垂的叶子是由BR控制的特定表型在FOXTAIL Millt中[25.].这两种表型都依赖于Sibri1的蛋白质表达水平(图。5.B) 是的。值得注意的是,在BR处理后,SiBRI1在叶和根中的转录水平均下调(图S)5.),与我们发表的RNA-SEQ数据一致[31.].
SiBRI1调控谷子的BR反应。(A.),光生长的4-叶阶段Ci846植物的表型和两个独立的线耻骨:SiBRI1-eGFP/Ci846 (Sibri1-ox);秤栏= 1.5厘米。(B),在转基因植物中的Sibri1-YFP的表达水平(A.). 胭脂红S染色的Rubisco大亚基被用作一个等负荷控制(C)定量实时RT-PCR分析SICPD.,SiD2型,Sidwarf.和SIDWF4SiBRI1在1μmbl浸泡1h后在8日龄幼苗根系中的表达。建立了三个生物重复。误差线表示平均值 ± 标准差(SD)。不同的小写字母表示统计上的显著差异(P < 0.05, one-way ANOVA with Tukey’s significant difference test)
已知通过反馈机制抑制BR信号通路的激活。为了验证Sibri1是Br的受体,用于检测BR合成基因的响应QRT-PCR测定SICPD.,SiD2型,Sidwarf.和SIDWF4在不同的根源Sibri1-oxCI846中的转基因素(图S6.).QRT-PCR结果表明,BR调节降低了这些基因的转录水平,并且这些基因的表达较低Sibri1-ox植物比Ci846植物(图。5.C)。总之,这些结果表明Sibri1过表达在Foxtail小米中激活BR信号通路,并且Sibri1是保守的BR信号通路中的受体。
Sibri1影响Foxtail Millet的根生长和侧根发育
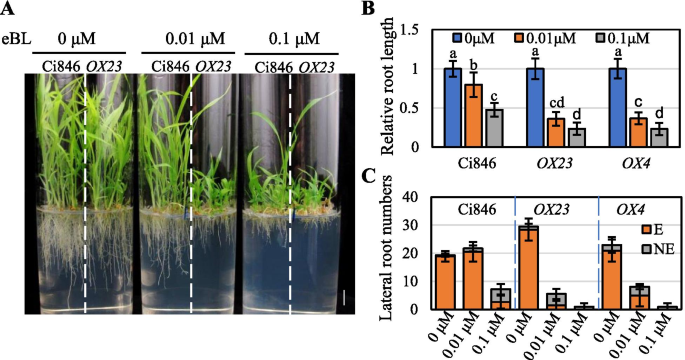
由于BRI1是BR信号通路中的重要阳性调制器,BRI1-OX公司植物对BL的生长反应非常敏感,即对根发育的抑制拟南芥和米[32.], 如上所述。为了确定Sibri1是否类似地在Foxtail Millet中发挥积极的监管作用,我们调查了两个独立的回应Sibri1-ox/CI846.在其表达水平的Sibri1至0.01和0.1μmBL的线路不同的线(图。6.A和S6)。浓度为0.01μm的BL显着抑制了根和叶生长ox23.和ox4.植物与野生型植物相比。当Bl浓度增加到0.1μm时,在野生型植物中也显着抑制叶和原发根生长,但抑制更明显ox23.和ox4.与野生型植物相比(图。6.a,b)。
我们还计算了横向根源Sibri1-OX / CI846用不同浓度的Bl处理植物。Sibri1-OX / CI846植物的侧根比Ci846植物多(图1)。6.C) 是的。在含有0.01µM BL的培养基上生长的幼苗初生根较短,但侧根比对照幼苗多(无BL),而Ci846植株的初生根长度和侧根数均随BL浓度的增加而减少(图。6.c)。这些结果表明,侧根发育对BR反应的敏感性不同于主根伸长;其中,主根伸长比侧根发育对BL更敏感Sibri1-OX / CI846植物急剧下降,并且当介质含有0.01μmBL时的对照植物中的低得多(图。6.C)。因此,我们得出结论Sibri1-OX / CI846植物对外源BR比对照植物更敏感。这些发现还支持BRI1作为FOXTAIL Millet中BR信号转导的正稳压器。
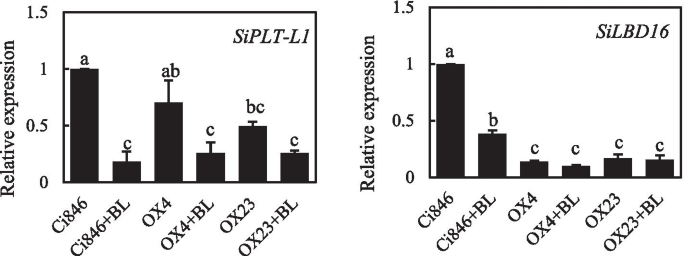
过多的1(PLT1)拟南芥在调节根系发育中起重要作用[33.],我们发现表达了血红蛋白1(SIPLT-L1,基于同源性AtPLTs公司)在FOXTAIL Mill Roots中,BR治疗后降低,并转录水平SIPLT-L1在里面Sibri1-OX / CI846显着低于Ci846(图。7.).横向器官边界Domain16(LBD16)在横向根起始中发挥关键作用[34.]我们还测试了转录SiLBD16型(基于同源性atlbd16)在树根下Sibri1-OX / CI846和QRT-PCR的CI846,发现SiLBD16型在BL治疗下显着降低,转录SiLBD16型在Sibri1-ox /CI846.低于CI846,其对应于表型Sibri1-OX / CI846在bl下(图。7.和6.C) 是的。总之,BR可能通过SiPLT-L1和SiLBD16影响根系生长和侧根发育。
Sibri1在Foxtail小米中的相互作用蛋白
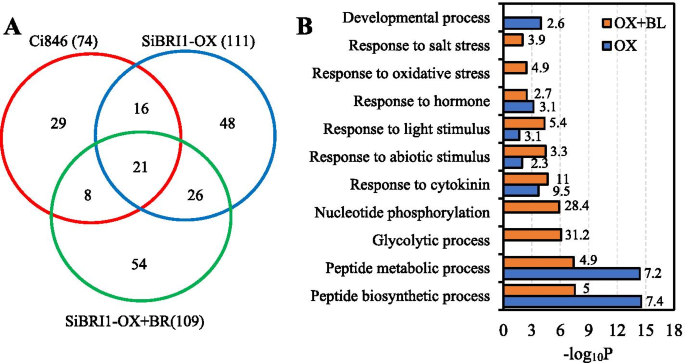
为了了解SiBRI1的功能和SiBRI1介导BR信号特异性的机制,我们对谷子SiBRI1相互作用蛋白进行了蛋白质组学研究。从细胞中提取微粒体蛋白Sibri1-OX / CI846使用GFP-Trap免疫沉淀,用Bl或非不作为阴性对照处理的植物,或非转基因CI846作为阴性对照和Sibri1-EGFP和相关蛋白质。液相色谱串联质谱(LC-MS / MS)分析鉴定了128个蛋白质,其在Sibri1-EGFP样品中是共免疫沉淀的,但不在非转基因CI846对照样品中,48个蛋白质从中免疫沉淀Sibri1-OX / CI846没有BL处理的植物,54个蛋白质仅来自植物免疫沉淀Sibri1-OX / CI846具有BL治疗的植物,以及26种蛋白质,其与之共沉淀Sibri1-OX / CI846植物无论BL治疗如何,都是如此(图。8.A、 表S2-4).
在BL处理下SiBRI1相互作用蛋白。(A.).鉴定的蛋白质的Venn图Pubi:Sibri1-EGFP/ CI846在BL处理下。8天老CI846和Pubi:Sibri1-EGFP/ CI846幼苗用1μmBL处理2小时,通过GFP-Trap用Sibri1提取相互作用蛋白的邻接组织。(B)对Sibri1相互作用蛋白的逐答分析Pubi:Sibri1-EGFP/Ci846,使用AgriGO (GO)在线进行基因本体(GO)注释。http://bioinfo.cau.edu.cn/agrigo/),与全基因组水平相比,条抛光中的数字表示富含富集
对BL处理与否的SiBRI1相互作用蛋白进行基因本体(GO)注释和富集分析。为了更准确地分析蛋白质的有效信息,利用AgriGO进行了GO的在线注释(http://bioinfo.cau.edu.cn/agrigo/).对于发现的74个相互作用蛋白Sibri1-OX / CI846没有BL治疗的植物,富集了蛋白质,蛋白质与发育,激素,肽项和生物合成的蛋白质进行了富集。当BL处理到幼苗时,Sibri1相互作用蛋白变为与核苷酸磷酸化,糖酵解工艺,激素,光刺激,非生物刺激等有关(图。8.B,表5.).我们还发现了AtBSK7的同源基因SiBSK7拟南芥并且已据报道,BSK是BR信号通路中BRI1的直接基板[8.].总之,我们的工作为未来的研究奠定了基础,占SIBRI1在FOXTAIL Millet中的功能。
讨论
在整个亚洲历史上,谷子有助于滋养人类文明,至今仍被视为主食。与其他主要作物(如水稻、小麦和玉米)不同,谷子可以生长在干旱或半干旱地区,那里的水供应和土壤肥力有限。随着全球气候变暖的影响和人类活动造成的耕地减少,谷子是未来人类社会保障粮食安全的优良替代作物。然而,与其他主要农作物相比,谷子的平均产量较低。这为将来利用现代近亲繁殖技术进行改良留下了巨大的机会。
通常,叶角,有效的分蘖数,每穗数的颗粒数量和千粒重量是最重要的性状,确定谷物作物的平均产量。大米的研究表明,BRS在调节这些与生产力相关的特征方面发挥着重要作用。尽管BR信号传导已经在几种物种中进行了广泛研究,但是Foxtail Millet中的BR信号传导仍然很大程度上是无表的。
在更多植物中识别BR受体并解密其功能是解密BR信令网络并理解其演变的重要初步步骤。在这项研究中,我们克隆了Foxtail Millet BR受体基因Sibri1并确认它用作Br受体拟南芥在生理,遗传和分子水平下粪小米。我们还确定了另外三个Foxtail Millet BR受体基因,Sibr1.,Sibrl2.和Sibr3.. 系统发育分析将被子植物的BR受体分为三类:Ⅰ(BRI1)、Ⅱ(BRL1和BRL3)和Ⅲ(BRL2)。我们的系统发育分析也为今后命名其它物种的BRI1家族基因提供了依据。BRI1及其同源基因在人体不同组织中发挥作用拟南芥蒂利亚纳和米[21.,35.].我们的QRT-PCR实验表明,Sibri1的表达模式及其寄生基因基因不同的组织不同,表明这些基因可能在不同组织中发挥不同的作用。由于Bri1的重要性,BRI1在调节植物开发中的作用最近研究过,文献对BRLS的具体作用相对恐吓。据报道,ATBRL3涉及植物干旱防御和ROSSoyostasis [36.,37.]. BRLs参与植物生长发育途径的研究,提高了对不同BRI家族基因具体作用的认识。
迄今为止,BR受体BRI1的同源物已在5个单子叶种中鉴定和研究:水稻,玉米,大麦,小麦和B. Distachyon.[18.,20.,21.,24.,38.,39.].BRI1同源物的功能B. Distachyon.在植物的研究中发现,BdBRI1和ZmBRI1分别被RNAi沉默[18.,20.].除了OSBRI1,OSBR1和OSBRL3还在米饭中表征。Bri 1的不同缺陷等位基因展示了水稻和大麦的典型Br缺陷表型[21.,24.].
但是,先前的研究B. Distachyon.未能确定BRI1的单子叶同系物是否能够在双子叶植物中作为BR受体发挥作用[38.]. 此外,在单子叶植物中,BR合成的最终产物和更活跃的BR似乎是蓖麻酮而不是BL。发现BRI1的结构在单子叶植物和双子叶植物之间是保守的,因此我们假设BRI1的功能在这些植物中是保守的。为了验证我们的假设,我们克隆了该基因并在大肠杆菌中异源表达Bri1-116植物。我们发现SiBRI1的全长编码序列完全拯救了小鼠的矮小表型布里1-116。布里1-5是AtBRI1的一个弱突变等位基因,其中包含一个点突变,导致BRI1胞外结构域的C69Y氨基酸替换[15.].虽然已经证明了一些Dicot植物中的BRI1,例如GMBRI1B,GMBRI1A和MTBRI1,但是恢复表型布里1-5植物 [16.,17.,19.],是否表型Bri1-116,ATBri1的零等位基因可以由异位表达引起尚不清楚。我们的研究证明,Sibri1可以完全拯救ATBri1的无效等位基因。这些发现提供了固体证据,即Sibri1可以完全替换ATBri1的功能。我们的结果证明了Dicot和单子偶像植物之间Bri1的保守功能和结构,并扩大了对作物植物中BR反应的理解。
BR信号通路在不同的植物中都是保守和特异性的。虽然我们识别福克斯小米,Sibri1和Sibzr1中涉及BR信令的两个关键组件[31.],双子叶植物和单子叶植物经BR处理后的表型不同。双子叶植物在光照条件下下胚轴长度和株高增加,根长减少。对于单子叶植物,如水稻和玉米,BR处理的主要结果是缩短根和增加叶角[18.,32.];在我们的研究中,在Foxtail Millet中也发现了下垂叶和增加的横向根系。已经发现BR信号传导突变体表现出较小的叶角和比野生型植物更直接的叶血管习惯,而繁殖突变体的增益突变体显示出增加的薄层关节弯曲[32.]. 这些结果为进一步研究单子叶植物中的BR信号途径奠定了基础。
作为RLK的Bri 1的磷酸化对于BR信号的精确控制非常重要,并且已经报道了其磷酸化位点拟南芥和番茄[40,41.].BRI1包括细胞外结构域,TM结构域和细胞质结构域[14.].细胞质结构域含有Juxtamembrane区(JM),丝氨酸/苏氨酸/酪氨酸激酶结构域(KD),C-末端(CT)结构域。ATBri1的大多数磷酸化位点位于Kd,例如Tyr-956,Thr-1039,Thr-1049,Ser-1044和Thr-1045中,并且在BR信号传导和植物生长中表现出强大功能[42.,43.,44.].Thr-1050在番茄SLBRI1的KD中负面调节SLBRI1的活动[40]. 通过体外激酶分析和质谱分析,我们还发现了OsBRI1的20个磷酸化位点(图S)2.).THR-963,SER-966,THR-969,SER-1087和SER-1091保存拟南芥和米饭。这些磷酸化位点首先在OSBRI1中发现,但它们的生物学功能需要进一步研究。我们还试图通过免疫沉淀联合质谱法鉴定体内Sibri1的磷酸化位点。不幸的是,在BL治疗下,我们没有发现Sibri1的任何翻译后修改;本主题可能需要进一步研究。我们还发现128个Sibri1相互作用蛋白,我们发现SIBSK7,ATBSKS的同源基因,有助于分析福克斯尾部的BR信号通路的组分。另外,抵抗力假单胞菌皂苷PV。maculicola.1(sirpm1)对防御的反应[45.],通过SIBRI1通过STING分析进行交互[46.],表明Sibri1可以参与抗病抗抗性。为了分析Sibri1和相互作用蛋白之间的机制对于阐明涉及多个信号通路中涉及的Sibri1的生物学功能具有重要意义。
总体而言,在本研究中,我们通过系统发育分析将BRI1家族基因分成三个分支,将BRI1家族基因分成三个分支。Sibri1的转化恢复了表型Bri1-116这种互补是BR信号通路恢复的结果。这些结果支持SiBRI1是谷子中一个新的BRI1基因。此外,SiBRI1的过表达被发现调节根系发育。需要进一步的研究来证实SiBRI1与植株结构的关系,这可能导致谷子产量提高策略的发展。
材料和方法
BRI1家族基因鉴定和系统发育分析
我们确定谷子通过爆破AtBRI1(AT4G39400)和OsBRI1(LOC_Os01g52050)的蛋白质序列在NCBI(SiBRI1(Si000117m / XP_004969763),SiBRL1(Si028727m / XP_004956489),SiBRL2(Si013131m / XP_004983438)和SiBRL3(Si033990m / XP_004973244)https://www.ncbi.nlm.nih.gov/gene/),植物血统12(https://phytozome.jgi.doe.gov/pz/portal.html#) 和意大利狗尾草功能基因组数据库(http://structuralbiology.cau.edu.cn/SIFGD/)具有BLASTP算法的网站。检索Sibri家族蛋白序列,全基因组和相应的编码序列(CDSS)。选择具有相对完整的注释基因组数据的二十四种代表性植物作为来自APG分类学的研究受试者[27.]和系统发育关系数据。使用Timetree在线工具可视化物种之间的分类学进化关系(http://www.timetree.org/)[47.,48.]. 基因组数据从Ensembl植物数据集下载(https://plants.ensembl.org)和植物血统v12.1中的JGI植物数据库(https:///phytozome.jgi.doe.gov/pz/portal.html.).对于Genome版本信息,请参阅表S.1..
从PFAM数据库下载BRI1蛋白的特征结构域的HMM(http://pfam.xfam.org.)[49.].hmmer v 3.3 [28.用于搜索具有每种不同物种的整个蛋白质序列的候选基因。因为Bri1家族属于RLK超家族,因为超家族的不同成员具有相似的域组成,因此难以与现有的PFAM模型直接搜索和识别其他物种中的BRI1成员。我们分析了两种多重对准方法(CLUSTALW和肌肉)的结果,并使用了三种系统发育推理方法(NJ,最大可能性(ML)和MEGA X中的最小进化(ME)[50.[1000个引导复制以选择稳定的系统发育树。由于需要功能性分析和阳性选择分析,因此使用全蛋白质序列来构建BRI1基因家族成员之间的系统发育关系。在讨论的植物物种中,只有血管植物在严格意义上表达了BRI1基因。
植物生长和BL治疗
我们收到了拟南芥线Bri1-116来自志勇王(卡内基科学机构,斯坦福)[8.], 这拟南芥生态型Col-0.来自拟南芥生物资源中心(Abrc,www.arabidopsis.org.). 河南省安阳区农业科学研究所获得的豫谷1号,中国农作物种质资源研究所获得的Ci846,http://www.cgris.net/cgris_english.html).Col-0.和Br删除突变体Bri1-116在BRI1过表达和恢复实验中使用,在SiBRI1过表达实验中使用Ci846。拟南芥植株在22°C的培养箱或培养箱中生长,光照16小时/8小时黑暗(16L/8D)周期,而谷子植株在28°C的培养箱或培养箱中生长,光照16小时/8小时黑暗(16L/8D)周期。
用氯气(100ml 5%NaClO和4ml HCl 6-8小时)灭菌后,它们分散在灭菌之后1./2.MS媒介(植物科学实验室,陆上公园,KS),蔗糖1%和0.3%Phytagel(Phytotechnology Laboratories,Overland Park,Ks),pH = 5.7。将板在28℃下在16L / 8D循环中保持2天。具有一致生长的幼苗被转移到6×20cm(高度)玻璃瓶中,含有几种浓度的BL中的BL中的MS培养基,以进一步生长6天,去除用于根长度和横向根系测量,或清除ASANA显微镜观察。使用图像J软件测量主要根的长度。8天Pubi:Sibri1-EGFP / CI846将幼苗浸入1μmBL中1小时,并在处理后立即将叶片和根部置于液氮中。然后,提取RNA以检测BR合成基因表达。
之后拟南芥用75%乙醇和0.1%Triton X-100灭菌的种子5分钟,它们生长在1./2.MS培养基,具有1%蔗糖和0.45%含有不同浓度的BL和PCZ的PHYTAGEL。将平板在22℃下在16L / 8D循环中保持7天。采用照片,使用图像J软件测量初级根的长度。为了清楚地呈现测量数据,我们示出了相对长度。我们在0μmPCZ下的0 nm bl或keycotyl下设置初级根部的长度,并且5-100nm bl或0.25μmpcz组分别计算相对值。
定量逆转录聚合酶链反应
根据赵(2021)提取总RNA[31.]. 使用M-MLV逆转录酶(Takara Bio,Inc.,Otsu,Japan)从约1µg总RNA合成第一链cDNA。使用Bio-Rad CFX Connect实时PCR机(Bio-Rad Laboratories,Hercules,CA,United States)和SYBR Premix Ex Taq,根据标准方案进行qRT PCR™ 系统(Takara生物公司)。表S中列出了所用的底漆6., 和Siacin.用作内部参考。给出了至少三个生物复制的平均值。
Sibri1的亚细胞定位
Pubi:通过使用重组克隆技术构建Sibri1-EGFP。首先,用PCR™8 / GW /TOPO®Ta克隆试剂盒(Invitrogen)克隆Sibri1 Cd,然后通过LR酶(Invitrogen)克隆到修饰的二元载体pcambia1305-EGFP中。PCAMBIA1305-EGFP含有玉米泛素启动子和C末端增强GFP标签。表达载体被纳入其中农杆菌肿瘤术菌株EHA105并用基于愈伤组织的基因转化程序转化为CI846。
Pubi:Sibri1-EGFP转基因植物在28℃下在16L / 8D循环下生长1./2.MS培养基3天。采集根尖,用FV3000共聚焦显微镜激发波长为488nm的GFP信号。发射信号在518nm波长下采集和传输。
免疫印迹
一周的年龄和两周大拟南芥幼苗和粪饼叶被研磨到液氮中的细粉末。然后使用抗GFP进行免疫印迹(蛋白质®抗GFP小鼠单克隆抗体,跨,北京,中国)和抗BZR1(CAT:YKZPK82,Yokzpk82,Youke Biotechnology,上海,中国)抗体。
基因型鉴定Bri1-116植物
三周后Bri1-116植物,DNA被提取。使用PCR引物Bri1-SEQ3(CCAATCTCTGCCAACCC)和BRI1-116GT-R(TACCTCATCAGGAATCGAACGACGACG),其产生尺寸的扩增子852bp。这Col-0.产品被切成两个频段(347 bp和505 bp)MSSI.酶。这个Bri1-116产品不能被裁切MSSI.酶导致点突变;因此,产品尺寸保持852bp。
免疫沉淀和LC-MS / MS鉴定
将CI846种子发芽,然后在28℃下在LD条件下在双蒸水中生长4天。选择具有相似根和小植物长度的幼苗并转移到1./2.力量的Hoagland溶液,并使其生长4天。然后将叶子浸入其中1./2.强度的Hoagland溶液用1μmBL或不2小时,将叶片置于液氮后立即置于液态氮气中,液体氮气中的细粉。使用含有25mM HEPES的研磨缓冲液,0.6%PVP,5mM VC,5mM EDTA,25mM NAF,1mM NA的研磨缓冲液提取组织2.Moo.4.,1 mm na3.vo.4.,在4℃下,5mM DTT,2mM咪唑和蛋白酶抑制剂鸡尾酒(Sigma),并在4℃下离心10分钟,2000×g。将匀浆物以10,000g离心45分钟,使用含有20mM HEPES(pH7.5)的NEB缓冲液(pH7.5),40mM KCl,1mM EDTA,1%TritonX-100和蛋白酶抑制剂来萃取沉积物,然后与GFP孵育在4°C下捕获琼脂糖(Ychromotek,GTA)2小时。将珠子在柱上洗涤,用20张床体积的NEB缓冲液洗涤,然后用SDS加载缓冲液洗脱(0.125M Tris-HCl(pH6.8),2%β-巯基乙醇,4%SDS,20%甘油,0.25%溴苯酚蓝色).从GFP-Trap洗脱的蛋白质被8-20%预制 - Glgel Tris-甘氨酸(BBI-rad,E919DA0304)分离,并根据蛋白质的分子量切成四片。蛋白质凝胶消化和LC-MS / MS鉴定根据我们发表的方法进行[51.,52.].
可用性数据和材料
从Setaria Italica功能基因组学数据库中收集了粪码小米,水稻和拟南芥Bri1基因的蛋白质序列和氨基酸序列信息(http://structuralbiology.cau.edu.cn/SIFGD/),NCBI(https://www.ncbi.nlm.nih.gov/gene/)以及拟南芥信息资源(https://www.arabidopsis.org/), 分别。从Ensembl植物数据集下载BRI1家族基因二十四种代表植物的基因组数据(https://plants.ensembl.org)和植物血统v12.1中的JGI植物数据库(https:///phytozome.jgi.doe.gov/pz/portal.html.). 蛋白质的维恩图是使用InteractiVenn在线进行的(http://www.interactionn.net.).基因本体论(GO)注释和富集分析在线使用Agrogo进行在线进行(http://bioinfo.cau.edu.cn/agrigo/).本研究期间生成或分析的所有数据都包含在本发布的文章及其补充信息文件中。本研究期间产生的植物材料和重组质粒可以从相应的作者获得合理的要求。
缩写
- BRS:
-
芸苔类固醇
- 提单:
-
芸苔
- PCZ:
-
propiconazole.
- rlcks:
-
受体样细胞质激酶
- Bri1:
-
芸苔类固醇不敏感1
- BRLS:
-
Bri1样受体激酶
- 第1部分:
-
BRI1相关受体激酶1
- BSK:
-
BR信号传导激酶
- CDG1:
-
组成型差异增长1
- BSU1:
-
BRI1抑制器1
- bin2:
-
BR不敏感2
- 第2a页:
-
蛋白质磷酸酶2a.
- BZRS:
-
铜唑抗性
- DPY1:
-
下垂的叶子1
- CPD:
-
组成型光致性矮化
- DWF4:
-
矮人4
- GSK3:
-
糖原合成酶激酶3
- PLT1:
-
血红蛋1
- LBD16:
-
侧琴边界Domain16
- QRT-PCR:
-
定量实时聚合酶链反应
- IP:
-
免疫沉淀
- 小姐:
-
质谱
- LC-MS / MS:
-
液相色谱-串联质谱法
- APG公司:
-
被子植物种系发生学组
- 隐马尔可夫模型:
-
隐藏的马尔可夫模型
- 布里1-5,Bri1-116:
-
Br - 不敏感突变体
参考文献
- 1。
胡,毛罗 - 赫雷拉姆,令人嗡嗡声。C4草模型的驯化和改进。Setaria前植物SCI。2018; 9:719。
- 2。
张克,刘X,Quan Z,Cheng S,Xu X,Pan S,Xie M,Zeng P,Yue Z,Wang W等人。Foxtail小米的基因组序列(意大利狗尾草)提供对草进化和生物燃料潜力的见解。NAT BIOTECHNOL。2012; 30(6):549-54。
- 3.
Clouse SD,Sasse JM。芸苔类固醇:植物生长和发展的必要调节因素。Annu Rev植物植物植物Mol Biol。1998年; 49:427-51。
- 4.
Clouse SD。芸苔类固醇。拟南芥书2011;9:e0151。
- 5。
杨cj,张c,鲁yn,金杰克,王xl。芸苔类固醇作用的机制:从信号转导到植物发育。莫尔植物。2011; 4(4):588-600。
- 6。
王志毅、塞托H、藤冈S、吉田S、乔里J。BRI1是植物类固醇质膜受体的重要组成部分。自然。2001;410(6826):380–3.
- 7。
李杰,文杰,李嘉,杜克JT,税务FE,沃克JC。BAK1是一种拟南芥LRR受体样蛋白激酶,与BRI1相互作用并调节油菜素类固醇信号。牢房。2002;110(2):213–22.
- 8。
唐W,Kim Tw,OS-Prieto JA,Sun Y,Deng Z,朱S,王R,伯灵县,王泽。BSK在拟南芥中,从受体激酶Bri1中调解信号转导。科学。2008; 321(5888):557-60。
- 9。
Kim T-W、Guan S、Burlingame AL、Wang Z-Y。CDG1激酶介导油菜素类固醇从BRI1受体激酶到BSU1磷酸酶和GSK3样激酶BIN2的信号转导。摩尔细胞。2011;43(4):561–71.
- 10。
Li J,Nam KH,Vafeados D,Chory J。拟南芥中一个新的油菜素类固醇不敏感位点BIN2。植物生理学。2001;127(1):14–22.
- 11.
Wang Z-Y、Nakano T、Gendron J、He J、Chen M、Vafeados D、Yang Y、Fujioka S、Yoshida S、Asami T。核定位BZR1介导油菜素类固醇诱导的生长和反馈抑制油菜素类固醇生物合成。开发单元。2002;2(4):505–13.
- 12.
唐伟,袁敏,王R,杨勇,王聪,Oses-Prieto-JA,Kim TW,Zhou HW,Deng Z,Gampala SS,等。PP2A通过去磷酸化BZR1激活油菜素类固醇反应基因表达和植物生长。自然细胞生物学。2011;13(2):124–31.
- 13。
孙y,风扇x-y,cao d-m,tang w,他k,zhu j-y,he j-x,bai m-y,zhu s,oh e等。乌乳甾类固醇信号转导与拟南芥植物生长调控转录网络的整合。DEV细胞。2010; 19(5):765-77。
- 14。
Friedrichsen DM、Joazeiro CA、Li J、Hunter T、Chory J。油菜素类固醇不敏感-1是一种广泛表达的富含亮氨酸的重复受体丝氨酸/苏氨酸激酶。植物生理学。2000;123(4):1247–56.
- 15.
Noguchi T,Fujioka S,Choe S,Takatsuto S,Yoshida S,Yuan H,Feldmann Ka,税费。拟南芥的芸苔类固醇不敏感矮种突变体积累了芸苔类固醇。植物理性。1999; 121(3):743。
- 16。
王M,Sun S,Wu C,Han T,王Q.从甘氨酸Max中分离和表征芸苔类固醇受体基因(Gmbri1)。int j mol sci。2014; 15(3):3871-88。
- 17。
彭S、陶平、徐福、吴A、霍W、王杰。大豆Glyma04g39610作为油菜素类固醇受体基因的功能特性及大豆油菜素类固醇受体的进化分析。国际分子科学杂志。2016;17(6):897.
- 18。
Kir G,Ye H,Nelissen H,Neelakandan Ak,Kusnandar As,Luo A,Inze D,Sylvester Aw,Yin Y,Becraft PW。玉米芸苔类固醇不敏感1的RNA干扰敲低揭示了在控制工厂建筑中的芸苔类固醇信号传导的新功能。植物理性。2015; 169(1):826-39。
- 19。
程X,GOU X,Yin H,Mysore Ks,Li J,Wen J.Micalago Truncatula铜豆甾类固醇受体MTBRI1的功能性鉴定。SCI代表2017; 7(1):9327-9327。
- 20。
冯y,尹y,Fei S.BDBRI1的下调,推定的芸苔类固醇受体基因产生令人沮丧的肺泡耐受耐旱性的矮化表型。植物SCI。2015; 234:163-73。
- 21。
Nakamura A、Fujioka S、Sunohara H、Kamiya N、Hong Z、Inukai Y、Miura K、Takatsuto S、Yoshida S、Ueguchi Tanaka M等。OsBRI1及其同源基因OsBRL1和OsBRL3的作用。水稻植物生理学。2006;140(2):580–90.
- 22。
Montoya T,Nomura T,Farrar K,Kaneta T,Yokota T,Bishop GJ。克隆番茄卷曲3基因突出了富含亮氨酸的重复受体激酶TBRI1 / SR160在植物类固醇激素和肽激素信号中的推定的双重作用。植物细胞。2002; 14(12):3163-76。
- 23。
野村T、毕晓普GJ、卡内塔T、里德JB、乔里J、横田T。LKA基因是豌豆的一个对油菜素类固醇不敏感的同源基因。植物J。2003;36(3):291–300.
- 24。
Chono M、Honda I、Zeniya H、Yoneyama K、Saisho D、Takeda K、Takatsuto S、Hoshino T、Watanabe Y。大麦uzu的一个半矮秆表型是由于编码一个可能的油菜素类固醇受体基因的核苷酸替换引起的。植物生理学。2003;133(3):1209–19.
- 25。
赵敏,唐松,张宏,何敏,刘杰,志宏,隋勇,刘鑫,贾刚,赵卓,等。下垂的LEAF1通过协调早期油菜素内酯信号来控制叶片结构。P美国国家科学研究院。2020; 117(35): 21766 - 74。
- 26。
你q,张l,yi x,张z,xu w,su z. sifgd:setaria iTalica功能基因组学数据库。莫尔植物。2015; 8(6):967-70。
- 27。
Angiosperm Phylogy G.对开花植物的订单和家族进行高原植物系统的更新:APG III。BOT J Linn SoC 2009,161(2):105-121。
- 28。
Johnson Ls,Eddy SR,葡萄牙E.隐藏马尔可夫模型速度启发式和迭代嗯搜索程序。BMC生物信息学。2010; 11:431。
- 29。
Cano Delgado A、Yin Y、Yu C、Vafeados D、Mora Garcia S、Cheng JC、Nam KH、Li J、Chory J。BRL1和BRL3是一类在拟南芥血管分化中起作用的新型油菜素甾体受体。发展。2004;131(21):5341–51.
- 30
Hartwig T,Corvalan C,Best NB,Budka JS,Zhu Jy,Choe S,Schulz B. ProPiconazole是一种特定和可访问的芸芸苔(Br)生物合成抑制剂,用于拟南芥和玉米。Plos 2012;7(5):E36625。
- 31。
Z Zhao,S Tang,W Li,x yang,r王,x刁,w tang。通过抑制Setaria Initia Inita的表达,铜胆唑抗性1同源物的过表达耐受耐受性耐受性。作物J. 2021;https://doi.org/10.1016/j.cj.2021.02.006.
- 32。
张B,王X,赵Z,王R,黄x,朱y,元l,王y,xu x,伯明名al,等。OSBri1通过防止OSBSK3的TPR和激酶结构域通过磷酸化来激活BR信号传导。植物理性。2016; 170(2):1149-61。
- 33。
Galinha C,Hofhuis H,Luijten M,Willimsen V,Blilou I,Heidstra R,Scheres B.血清蛋白作为拟南芥根系的剂量依赖性校长。自然。2007; 449(7165):1053-7。
- 34。
刘W,yu J,Ge Y,qin p,xu l。LBD16在根系中的枢转作用和根状器官启动。细胞mol寿命。2018; 75(18):3329-38。
- 35。
周A,王H,Walker JC,Li J.Brl1,富含亮氨酸的重复受体样蛋白激酶,在调节拟南芥芸苔类化信号传导中,用BRI1功能冗余。工厂J. 2004; 40(3):399-409。
- 36。
FabRegas N,Lozano-Elena F,Blasco-Escamez D,Tohge T,Martinez-Andujar C,Albacete A,Osorio S,Bustamante M,Riechmann JL,Nomura T等人。血管芸苔类固醇受体BR13的过度表达赋予抗旱性而不会惩罚植物生长。NAT Communce。2018; 9(1):4680。
- 37。
努力ozdemir m,琼斯am。BRL3和ATRGS1合作到微调生长抑制和ROS活化。Plos 2017;12(5):E0177400。
- 38。
Corvalán C, Choe S.二穗短柄草油菜素内酯基因的鉴定。植物生物学学报。2017;17(1):5。
- 39。
Singh A、Breja P、Khurana JP、Khurana P。小麦油菜素类固醇不敏感1(TaBRI1)与TaSERK基因家族成员相互作用,导致拟南芥开花早和种子产量提高。公共科学图书馆一号。2016; 11(6):e0153273。
- 40
王S,刘继,赵特,杜C,NIE S,Zhang Y,LV S,Huang S,Wang X.SlBri1苏氨酸-1050的改性调节BR信号传导,提高番茄的果实产量。BMC植物BIOL。2019; 19(1):256。
- 41
王S,胡T,田A,罗B,杜C,张S,黄S,张F,王X。SIBRI1的丝氨酸1040修饰通过提高番茄对热胁迫的耐受性而提高产量。国际分子科学杂志。2020;21(20):7681.
- 42。
哦,王x,clouse sd,huber sc。通过甘氨酸富含环中的自磷酸化α通过自身磷酸化停用拟南芥芸苔类化合物不敏感1(BRI1)受体激酶。Proc Natl Acad Sci USA。2012; 109(1):327-32。
- 43。
Oh MH,Wang X,Kota U,Goshe MB,Clouse SD,Huber SC.在拟南芥中,BRI1受体激酶的酪氨酸磷酸化作为油菜素类固醇信号传导的一个组成部分出现。美国国家科学院,2009;106(2):658–63.
- 44。
Oh MH,Sun J,Oh DH,Zielinski RE,Clouse SD,Huber SC.通过改造油菜素类固醇不敏感1受体激酶促进拟南芥叶片生长。植物生理学。2011;157(1):120–31.
- 45。
El Kasmi F,Chung Eh,Anderson Rg,Li J,Wan L,Eitas TK,Gao Z,Dangl JL。来自血浆膜局部植物免疫受体RPM1的信号传导需要全长蛋白质的自我关联。Proc Natl Acad Sci U S A. 2017; 114(35):E7385-94。
- 46。
Szklarczyk D,Gable AL,Lyon D,Junge A,Wyder S,Huerta Cepas J,Simonovic M,Doncheva NT,Morris JH,Bork P,et AL.STRING v11:覆盖率增加的蛋白质-蛋白质关联网络,支持全基因组实验数据集中的功能发现。核酸研究,2019年;47(D1):D607–13。
- 47。
对冲某人,达德利J,库马尔S。时间树:有机体间发散时间的公共知识库。生物信息学。2006;22(23):2971–2.
- 48。
Kumar S,SteCher G,Suleski M,Hedges SB。Timetree:时间表,时间表和分歧时间的资源。mol Biol Evol。2017; 34(7):1812-9。
- 49。
El-Gebali S,Mistry J,Bateman A,Eddy SR,Luciani A,Potter SC,Qureshi M,Richardson LJ,Salazar Ga,Smart A等人。PFAM蛋白质家族数据库2019年。核酸RES。2019; 47(D1):D427-D432。
- 50。
Kumar S,SteCher G,Li M,Knyaz C,Tamura K. Mega X:计算平台的分子进化遗传分析。mol Biol Evol。2018; 35(6):1547-9。
- 51
周H,王X,Huo C,王H,Z,Sun D,Liu J,Tang W,张B:二维差异凝胶电泳早期隔热蛋白的定量蛋白质组学研究鉴定OSUBP21作为负调节器水稻中热应激反应。蛋白质组学2019:E1900153。
- 52
Huo C,张B,王H,王F,刘M,高y,张W,邓Z,太阳D,Tang W.二维差凝胶电泳早期冷调蛋白的比较研究揭示了磷脂酶的关键作用Dα1在米饭中介导冷驯化信号通路。Mol细胞蛋白质组学。2016; 15(4):1397-411。
致谢
不适用。
资金
This work was supported by grant from the National Key R&D Program of China (2018YFD1000706/2018YFD1000700 to B.Z.), the National Science Foundation of China (31700242 to B.Z.), China Postdoctoral Science Foundation (2017M621097 to B.Z.), the Science and Technology Project of Hebei Education Department (BJ2021029 to B.Z., QN2018120 to R.W., SJ2016012 to Z.Z.), the Hebei Normal University Foundation (L2017B13 to B.Z.). The funding bodies played no role in the design of the study and collection, analysis, and interpretation of data and in writing the manuscript.
作者信息
隶属关系
贡献
W.T.,B.Z.和X.D.设计研究;Z Z。表演了大部分研究;英石。在CI846中构建了转基因植物;Y.Z.和Y.S.进行生物信息学分析;J.Y.和J.X.执行了IP和分析的MS数据; B.Z., Z.Z. and R.W. wrote the manuscript. All authors have read and approved the final manuscript.
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
提交人声明他们没有竞争利益。
附加信息
出版商的注意事项
斯普林格自然保持中立,就管辖权的要求,在出版的地图和机构的联系。
补充资料
附加文件1:图S1。
模型显示BR信号传导途径。BRS被BR受体Bri1及其团簇Bak1识别。BR促进BRI1与BAK1的关联,并能够在两个受体的细胞质激酶结构域之间进行转磷酸化。Bri1然后磷酸化BSK和CDG1,导致BSU1的激活。BSU1去磷酸盐酸盐并抑制BIN2。在没有BRS的情况下,Bin2磷酸化BZRS系列,防止它们调节下游靶基因的转录。BR信号传导抑制bin2的激酶活性,并允许通过pp2a去磷酸化。去磷酸化的BZRS与BR响应元件(BRRE)或E-Box CIS-元素结合并调节许多BR响应基因的表达。图S2。分类学关系28个代表植物之间的关系。图S3。. SiBRI1蛋白的特性。AtBRI1、OsBRI1和SiBRI1蛋白序列从Phytozome12网站下载(https://phytozome.jgi.doe.gov/pz/portal.html#)使用多重序列分析网络工具ClustalW(https://www.genome.jp/tools-bin/clustalw). 黑线表示一个保守的信号肽,一个假定的Leu拉链基序,两个保守间隔的半胱氨酸对和一个预测的TM结构域。黑框表示12个保守的蛋白激酶结构域(标记为I到XI),红色字母表示蛋白质中的磷酸化位点拟南芥和米饭。图S4。SiBRI1的过度表达激活了细胞内的BR信号传导拟南芥.(a),表型Sibri1-Ox / Col在表明浓度的PCZ浓度为7天内生长。酒吧= 1cm。(b),量化相对幼杆长度(a)。误差栏表示平均值±标准偏差(SD)。统计上显着的差异由不同的小写字母表示(P<0.05,双向ANOVA,具有Tukey的显着差异测试)。(c),在(a)中所示的转基因植物中Sibri1-yfp和AtbZr1的表达水平。庞卡的摩尔柯大亚基和HSP70表达的染色用作同等的加载控制。(d),浅色增长4周龄的表型Sibri1-ox / col。图S5。表达水平SIBR11在BL处理下。表达水平Sibri1.在1μm的叶片和根部浸没1小时。三个生物重复。误差栏表示平均值±标准偏差(SD)。统计上显着的差异由不同的小写字母表示(P<0.05,单向ANOVA,具有Tukey的显着差异测试)。图S6。表达水平SIBR11 / CI846..在图5C中过表达线的Sibri1的表达水平,庞卡的Rubisco大亚基的PONCEAT S染色用作等加载控制。
权利和权限
开放访问本文是根据知识共享署名4.0国际许可证授权的,该许可证允许以任何媒体或格式使用、共享、改编、分发和复制,只要您给予原作者和来源适当的信任,提供到知识共享许可证的链接,并指出是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可证中,除非在材料的信用额度中另有说明。如果材料未包含在文章的知识共享许可证中,并且您的预期用途不受法律法规的允许或超出允许的用途,您将需要直接获得版权持有人的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用本文
赵卓,唐松,张勇。等。Sibri1作为FOXTAIL Millet中芸苔类固醇受体基因的进化分析及功能表征。BMC植物BIOL.21,291(2021)。https://doi.org/10.1186/s12870-021-03081-8
已收到:
认可的:
发表:
关键词
- 芸苔类固醇
- 布里1
- Foxtail小米
- 系统发育分析