- 研究文章gydF4y2Ba
- 开放访问gydF4y2Ba
- 发布:gydF4y2Ba
响应感染的小麦转录组重新编程gydF4y2Baclaviceps purpureagydF4y2Ba,麦角的致病原gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba21.gydF4y2Ba, 文章编号:gydF4y2Ba316.gydF4y2Ba(gydF4y2Ba2021gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
麦角,引起真菌病原体gydF4y2Baclaviceps purpureagydF4y2Ba,感染了一系列谷物作物的女性花卉,包括小麦。了解之间的互动gydF4y2BaC. purpureagydF4y2Ba和六倍体小麦我们对小麦转录组的重新编程进行了广泛的检查,以响应gydF4y2BaC. purpureagydF4y2Ba通过花组织感染(即卵巢的耻辱,透射和卵巢的胚轴组织)和随时间。gydF4y2Ba
结果gydF4y2Ba
C. purpureagydF4y2Bahyphae were observed to have grown into and down the stigma at 24 h (H) after inoculation. By 48H hyphae had grown through the transmitting tissue into the base, while by 72H hyphae had surrounded the ovule. By 5 days (D) the ovule had been replaced by fungal tissue. Differential gene expression was first observed at 1H in the stigma tissue. Many of the wheat genes differentially transcribed in response toC. purpureagydF4y2Ba感染与植物激素有关,包括乙烯(ET)、生长素、细胞分裂素、赤霉素(GA)、水杨酸和茉莉酸(JA)的生物合成和信号通路。激素相关基因在24H时首先在柱头和基底组织中检测到,但在传递组织中未检测到。24H时柱头中发现GA和JA通路相关基因,24H时柱头中发现JA和et通路相关基因。此外,一些防御相关基因在应答中也有差异表达gydF4y2BaC. purpureagydF4y2Ba包括抗真菌蛋白、胞内/胞外相关蛋白、NBS-LRR类蛋白、程序性细胞死亡相关基因、受体蛋白激酶和转录因子。特别有趣的是,在真菌菌丝出现之前,小麦基因在基底组织中的差异表达被鉴定出来,这表明在定殖之前,一个移动的信号,无论是病原体还是植物来源的,已经传递到基底。gydF4y2Ba
结论gydF4y2Ba
多宿主激素生物合成和信号通路从小麦的早期阶段显着扰乱 -gydF4y2BaC. purpureagydF4y2Ba相互作用。在卵巢的基差异基因表达,超前的病原体的到达,所表示的信号的远距离修饰宿主基因表达的潜在存在。gydF4y2Ba
背景gydF4y2Ba
麦角,引起真菌病原体gydF4y2Baclaviceps purpureagydF4y2Ba,是一种禾草和谷物的穗病,感染许多经济上重要的谷类作物,包括小麦、大麦和黑麦[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba].麦角菌会导致重大的经济损失,谷物会因为麦角菌菌核(越冬真菌结构)的污染而被丢弃[gydF4y2Ba3.gydF4y2Ba].虽然巩膜通常可以通过标准清洁方法从晶粒中取出:颜色分选和重力表[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba],与种子相似尺寸的巩膜难以分离。肠菌含有一系列麦角生物碱,对人类和动物具有高毒性[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba7gydF4y2Ba].这些生物碱对偏爱的病症负责,在中世纪期间被称为圣安东尼的火灾。偏爱症状的症状包括恶晶四肢,惊厥,精神病和最终死亡。由于Rye的饮食饮食,爆发在中世纪的爆发特别普遍[gydF4y2Ba8gydF4y2Ba].此外,最近的研究结果表明,由真菌产生并在菌核中发现高浓度的麦角生物碱,可以通过它们的方式进入“健康”谷物[gydF4y2Ba9gydF4y2Ba].gydF4y2Ba
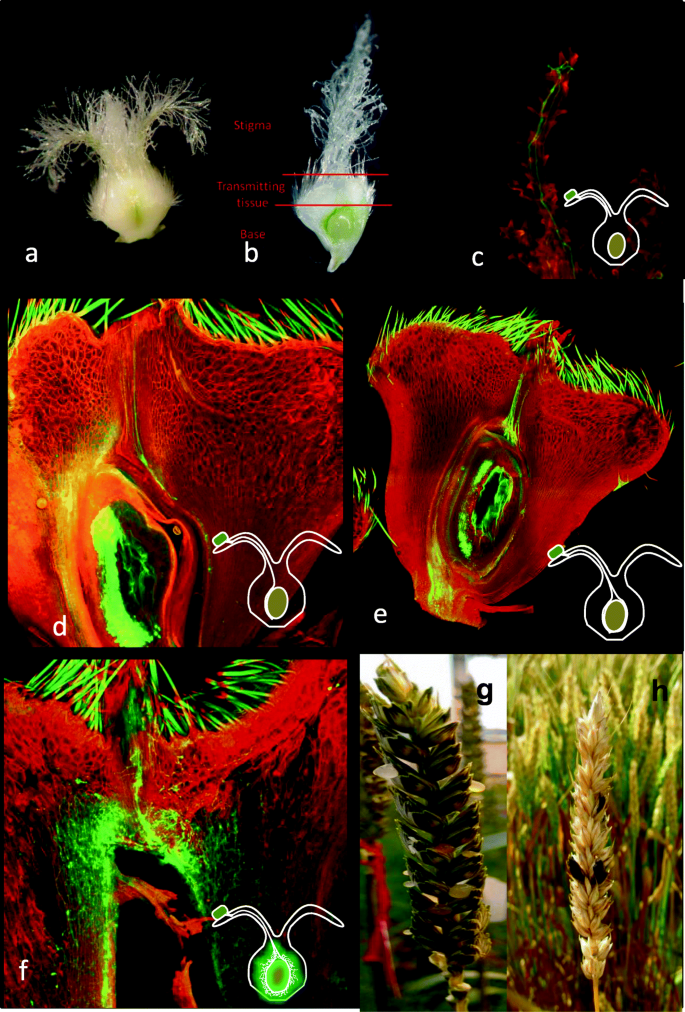
C. purpureagydF4y2Ba在开花期间进入,感染花的雌性组织,并用麦角菌核取代种子[gydF4y2Ba1gydF4y2Ba].因此,像黑麦这样开花的谷物尤其容易受到感染,像为大麦和小麦培育的杂交谷物种子生产系统也是如此[gydF4y2Ba10.gydF4y2Ba].gydF4y2BaC. purpureagydF4y2Ba被认为表现出一种生物营养的生活方式,在从植物中吸取营养的同时保持花组织存活,并且不会引起宿主组织坏死[gydF4y2Ba1gydF4y2Ba].孢子在耻辱上发芽,穿透耻发毛,并将风格延长到卵巢的透射组织(图。gydF4y2Ba1gydF4y2Ba).gydF4y2BaC. purpureagydF4y2Ba主要是细胞间的,尽管已经被宿主膜膜完全包围的侵入式菌丝已记录[gydF4y2Ba11.gydF4y2Ba].在孢子的三天内,着陆耻骨菌丝已经完全不堪重负卵巢并开始分支。在感染后5至7天之间,真菌进入斜隙阶段,表现为柔软的白色组织,开始产生无性刺激孢子。Conidiospores从叫做蜜露的含糖液中的小花中渗出[gydF4y2Ba1gydF4y2Ba].蜜汁使gydF4y2BaC. purpureagydF4y2Ba驱散分生孢子到其它接受鲜花,最有可能与病媒昆虫和雨水飞溅[的帮助gydF4y2Ba12.gydF4y2Ba,gydF4y2Ba13.gydF4y2Ba].大约2周后,在种子生长的地方形成了一种坚硬的、黑暗的菌核。这些菌核,也称为麦角菌,产生有性生殖结构,产生子囊孢子[gydF4y2Ba12.gydF4y2Ba].gydF4y2Ba
claviceps purpureagydF4y2Ba麦子感染。gydF4y2Ba一个gydF4y2Ba小麦卵巢。gydF4y2BabgydF4y2Ba子房的纵切面,显示柱头,传递和基部组织。小麦感染的共聚焦图像gydF4y2BaC. purpureagydF4y2Ba在gydF4y2Ba(C)gydF4y2Ba24小时,gydF4y2Ba(d)gydF4y2Ba48小时,gydF4y2Ba(e)gydF4y2Ba72小时gydF4y2Ba(f)gydF4y2Ba接种后5天。碘化丙啶和苯胺蓝染色。在24小时gydF4y2BaC. purpureagydF4y2Ba分生孢子已萌发,并有芽管沿柱头毛向下生长gydF4y2Ba(C)gydF4y2Ba.By 48 h hyphae had grown through the transmitting tissue and entered the base tissue(d)gydF4y2Ba,虽然72升胚珠被真菌菌丝包围gydF4y2Ba(e)gydF4y2Ba.接种5天后,胚珠完全被真菌组织所取代gydF4y2Ba(f)gydF4y2Ba.gydF4y2BaggydF4y2Ba麦穗挤出蜜露。gydF4y2BahgydF4y2Ba麦穗与菌核gydF4y2Ba
宿主工厂和入侵病原体之间的相互作用涉及连续的双向通信。初始植物识别病原体相关的分子模式(PAMPS)触发PAMP触发的免疫(PTI)。通过输送病原体效应器(效应器触发抑制 - ETS),可以抑制和/或避免PTI。通过防止主体检测纸板来思考效果仪来抑制PTI [gydF4y2Ba14.gydF4y2Ba]或影响下游PTI信号传导途径[gydF4y2Ba15.gydF4y2Ba].然而,它越来越明显,效果的作用超出了植物防御的抑制,在改变植物环境方面具有战略作用,以产生有利于病原体生长和繁殖的条件。因此,曾经认为防御需要的病原体感染诱导的许多植物基因实际上是病原体感染所需的感染[gydF4y2Ba15.gydF4y2Ba].gydF4y2Ba
作为第二道防线,植物已经进化出一个由宿主抗性(R-)基因介导的效应体识别系统,直接或间接地识别效应体,从而导致效应体触发免疫(ETI) [gydF4y2Ba16.gydF4y2Ba].通常与PTI和ETI相关的下游反应包括钙离子的快速内流,活性氧的爆发[gydF4y2Ba17.gydF4y2Ba],在企图病原体感染的部位沉积胼满癌细胞壁的环容,以及激活MAPK信号级联,触发腕式转录因子的表达,植物防御的关键调节器[gydF4y2Ba18.gydF4y2Ba].WRKY转录因子引发防御反应,例如一氧化氮,抗菌化合物的产生,以及过敏或编程的细胞死亡反应[gydF4y2Ba18.gydF4y2Ba].gydF4y2Ba
植物也建立了复杂的植物激素调节信号通路来控制防御反应[gydF4y2Ba15.gydF4y2Ba].作为回报,病原体已经开发了操纵植物激素调节的防御的策略,提供允许病原体逃避,劫持或破坏激素信号传导途径的效果[gydF4y2Ba15.gydF4y2Ba].该植物激素水杨酸(SA),茉莉酸(JA)和乙烯(ET)在植物防御的调控已经建立了良好的作用。SA是在对抗植物病毒的防御反应的激活和建立系统获得性抗性(SAR)的著名的作用[gydF4y2Ba19.gydF4y2Ba].JA和ET主要激活对坏死营养病原体和草食昆虫的防御反应,并被发现与SA相互拮抗[gydF4y2Ba20.gydF4y2Ba].植物素和葛根酸(GA)也已显示在植物防御中发挥作用,随着水稻中的养蛋白缀合蛋白GH3-8的过表达,导致细菌枯萎病的抗性增强[gydF4y2Ba21.gydF4y2Ba].gydF4y2Ba
在gydF4y2Ba拟南芥gydF4y2Ba通过JA和SA信号之间的平衡的变化来调节对生物营养和对坏症的易感性,这反过来取决于Della蛋白的GA依赖性降解[gydF4y2Ba22.gydF4y2Ba].有研究表明,DELLA蛋白能够与JA抑制因子JAZ1结合,阻止其与JA应答的关键转录激活因子MYC2相互作用,从而导致JA应答靶基因的激活[gydF4y2Ba23.gydF4y2Ba].由于DELLA蛋白的降解是依赖于GA的,因此GA被用于对ja响应的靶基因的控制。同时也发现了GA不敏感突变体gydF4y2BaGid1,gydF4y2Ba哪个超累积内源性Ga,显示出对稻瘟病的增强易感性[gydF4y2Ba24.gydF4y2Ba],发现在Ga生物合成中损害的水稻植物(即Ga的衰减)表现出增加的抗性gydF4y2BaM. Oryzae.gydF4y2Ba[gydF4y2Ba25.gydF4y2Ba].gydF4y2Ba
RNA测序(RNASeq)已经被成功地用于描述小麦转录组对多种病原体的反应变化,包括gydF4y2BaZymoseptoria triticigydF4y2Ba[gydF4y2Ba26.gydF4y2Ba,gydF4y2Ba27.gydF4y2Ba],gydF4y2Ba镰刀菌素graminearumgydF4y2Ba[gydF4y2Ba28.gydF4y2Ba],gydF4y2BaPUCCINIA Striformis.gydF4y2Ba和gydF4y2BaBlumeria茎gydF4y2Ba[gydF4y2Ba29.gydF4y2Ba].虽然最近释放注释,六倍倍麦参考基因组序列,Refseq [gydF4y2Ba30.gydF4y2Ba]意味着现在可以使用资源来支持响应于病原体感染的小麦基因表达的细节和全球探查。gydF4y2Ba
本研究的目的是确定小麦女性花朵中发生的分子遗传变化gydF4y2BaC. purpureagydF4y2Ba感染是通过卵巢组织进行的。将不育小麦雄性系的雌花接种具有攻击性的品系gydF4y2BaC. purpureagydF4y2Ba.在特定时间点对雌花进行显微观察gydF4y2BaC. purpureagydF4y2Ba接种以使感染过程通过柱头,卵巢传递组织,卵巢底座。在来自耻骨,透射和基础组织的同一时间收集组织样品,用于RNASEQ和差异基因表达分析。相对于阶段,将小麦基因表达的变化与花组织和时间点进行比较gydF4y2BaC. purpureagydF4y2Ba发展。gydF4y2Ba
结果gydF4y2Ba
微观检查gydF4y2Baclaviceps purpureagydF4y2Ba感染的小麦gydF4y2Ba
卵巢的百分比gydF4y2BaC. purpureagydF4y2Ba催化在耻辱,透射和基础组织横跨时间点(表gydF4y2Ba1gydF4y2Ba).接种后10min分生孢子gydF4y2BaC. purpureagydF4y2Ba在柱头上可见,但未观察到菌丝生长。观察到分生孢子已经发芽,菌丝在24H时向柱头生长(图。gydF4y2Ba1gydF4y2BaC)。在48h菌丝已经长长的透射组织并且已进入卵巢的底部(图。gydF4y2Ba1gydF4y2Bad)。在72h菌丝围绕着胚珠并占据了靠近边界的底座,其中脉管系统进入卵巢(图。gydF4y2Ba1gydF4y2Bae)。在图5D真菌菌丝体已经穿过出支链的胚珠组织(图gydF4y2Ba1gydF4y2BaF)。gydF4y2Ba
RNAseq库的质量检查gydF4y2Ba
测定小麦对感染的反应gydF4y2BaC. purpureagydF4y2Ba我们在特定时间点进行了对女性花组 - 耻辱,透射和基组织的RNAseq分析gydF4y2BaCPgydF4y2Ba- 入住,直到7d(表gydF4y2Ba2gydF4y2Ba).每个组织的时间点相互作用用至少两个生物复制RNA库表示。平均阅读覆盖率小于5×的图书馆被从研究中删除。因此,5 hgydF4y2BaCPgydF4y2Ba- 从随后的分析中除去和嘲弄地接种样品。剩余库的平均读取覆盖率为9倍,最高为29×。使用归一化读数的Pearson的相关系数用于比较每个组织和时间点的复制库。通常,在复制文库之间发现0.90-0.99的相关性。24h时的模拟透射组织的相关性最低为0.80至0.83。gydF4y2Ba
生成了带有黄土曲线的MA图,以确定归一化程序对库大小是否足够(附加文件gydF4y2Ba1gydF4y2Ba:图S1;图S2)。早期样品的MA曲线呈“中心”对称,表明归一化处理是适当的。然而,在5D和7D样本中,我们发现MA图中的点呈双峰分布,这是由于小麦和小麦这两种生物的RNA转录产物的存在gydF4y2BaC. purpureagydF4y2Ba.MA图中的表观不对称是由于小麦和小麦的转录活动形成鲜明对比gydF4y2BaC. purpureagydF4y2Ba在这些稍后的时间点,gydF4y2BaC. purpureagydF4y2Ba在较高的水平,因为小麦卵巢由真菌菌丝替换被表达的基因。gydF4y2Ba
建立小麦的参考转录组gydF4y2Baclaviceps purpureagydF4y2Ba
来检查小麦和gydF4y2BaC. purpureagydF4y2Ba转录我们计算小麦的读取比例映射到gydF4y2BaC. purpureagydF4y2Ba参考转录组,反之亦然。只有0.0016%的小麦能读取到gydF4y2BaC. purpureagydF4y2Ba转录组参考,而0.037%gydF4y2BaC. purpureagydF4y2Ba读取(从发芽处理制成librairesgydF4y2BaC. purpureagydF4y2BaConidia和gydF4y2BaC. purpureagydF4y2Ba体外种植的菌丝体上升到小麦转录组的参考。这些百分比表明,这两个物种的参考序列之间存在可忽略的交叉映射。面包小麦品种中国春季IWGSC Refseq V1和gydF4y2BaC. purpureagydF4y2Ba因此,CDNA(Ensembl释放35)转录om合并以产生在随后的基因差异表达分析中使用的单一参考转录组。gydF4y2Ba
使用该参考转录组95的114个文库(83%)将百分比对准率从70〜85%读取,特别是在早期的时间点。但是,使用5D和7D的库,对准速率降至低至36%的值(附加文件)gydF4y2Ba1gydF4y2Ba:表S1)。发现低读取对齐是由于高百分比gydF4y2BaC. purpureagydF4y2Ba读取在这些较晚的时间点,和大量的gydF4y2BaC. purpureagydF4y2Ba成绩单不代表gydF4y2BaC. purpureagydF4y2BacDNA参考转录组(Ensembl释放35)。从未渗透读取gydF4y2BaC. purpureagydF4y2BaConidia和gydF4y2BaC. purpureagydF4y2Ba在人工媒体图书馆上种植的菌丝被映射到gydF4y2BaC. purpureagydF4y2BacDNA(Ensembl发布35)转录om。未映射的读取来自两者gydF4y2BaC. purpureagydF4y2Ba提取图书馆,汇集了和De Novo组装以提供新的gydF4y2BaCPgydF4y2Ba- 引用转录组。5D和7D的对齐gydF4y2BaCPgydF4y2Ba- 这种新小麦的封装图书馆 -gydF4y2BaC. purpureagydF4y2Ba转录组参考现在给出了85-90%的百分比,从原来的36-39%的改善。这表明后一时间点的大百分比未映射读数来自gydF4y2BaC. purpureagydF4y2Ba未在所代表的成绩单gydF4y2BaC. purpureagydF4y2Ba转录组组装(ensemble release 35)。gydF4y2Ba
寄主的时空格局,小麦基因表达的响应gydF4y2Baclaviceps purpureagydF4y2Ba感染gydF4y2Ba
了解麦小女性花液发生的变化gydF4y2BaC. purpurea,gydF4y2Ba我们进行了一个时间过程实验,量化接种单分离株后10 min、1、24、48和72H以及5和7D小麦柱头、传代和子房基底组织中转录组的变化gydF4y2BaC. purpureagydF4y2Ba(桌子gydF4y2Ba2gydF4y2Ba).进行了两两比较,交叉条件差异表达分析gydF4y2BaCPgydF4y2Ba- 在每个组织和每个时间点进行嘲笑接种的样品。所有差异表达的基因(DEG)都可以在附加文件中找到gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba和gydF4y2Ba4gydF4y2Ba.gydF4y2Ba
观察到小麦基因在7天的7天的三个卵巢组织中差异表达gydF4y2BaC. purpureagydF4y2Ba感染(附加文件gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba和gydF4y2Ba4gydF4y2Ba).这些DEG的注释表明了许多功能类别的富集。其中突出的是与激素途径相关的古典防御相关基因和小麦基因。其他功能类别包括与光合作用的基因,参与氧化/还原过程和参与蛋白质磷酸化的基因的基因(附加文件gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba和gydF4y2Ba4gydF4y2Ba).gydF4y2Ba
接种10 min后,小麦转录组无明显变化gydF4y2BaC. purpureagydF4y2Ba.在1H中,在耻骨中检测到七个DEG,但在该时间点在透射或基组织中没有发现DEG。在上调七个柱塞中,作为叶绿素A-B结合蛋白的注释。叶绿素A-B结合蛋白形成植物的一部分,位于叶绿体中的植物的光收获络合物,其捕获并将激励能量捕获到光学系统I和II(附加文件gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba和gydF4y2Ba4gydF4y2Ba).但是,目前还不清楚为什么这种基因应该在耻辱中上调。gydF4y2Ba
在耻骨下在1小时内下调的六个基因中的两个是DNA结合转录因子(TFS)(附加文件gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba和gydF4y2Ba4gydF4y2Ba).这些tf的通用注释使得很难识别它们运作的途径,因此很难识别它们潜在的下游目标,但它们可能来自于gydF4y2BaCPgydF4y2Ba免疫抑制活动或主体防御反应。此外,在耻骨下在1H中下调为肌蛋白蛋白,以其在细胞质流中的作用而闻名[gydF4y2Ba31.gydF4y2Ba],类似kelch样蛋白质,DNAJ蛋白和蔗糖合成酶。Kelch蛋白质含有重复基序,形成β-螺旋桨结构域,其介导蛋白质 - 蛋白质相互作用,并且参与各种细胞活动[gydF4y2Ba32.gydF4y2Ba].DNAJ蛋白,否则称为HSP40s(热休克蛋白40),是HSP70S的保守的共伴侣家族,已知在应力响应和发育过程中发挥不同的作用[gydF4y2Ba33.gydF4y2Ba].蔗糖合酶在防御过程中快速调动碳水化合物中起作用[gydF4y2Ba34.gydF4y2Ba],所以可能表明早期尝试gydF4y2BaC. purpureagydF4y2Ba改变花组织内的碳水化合物谱,以支持真菌生长。gydF4y2Ba
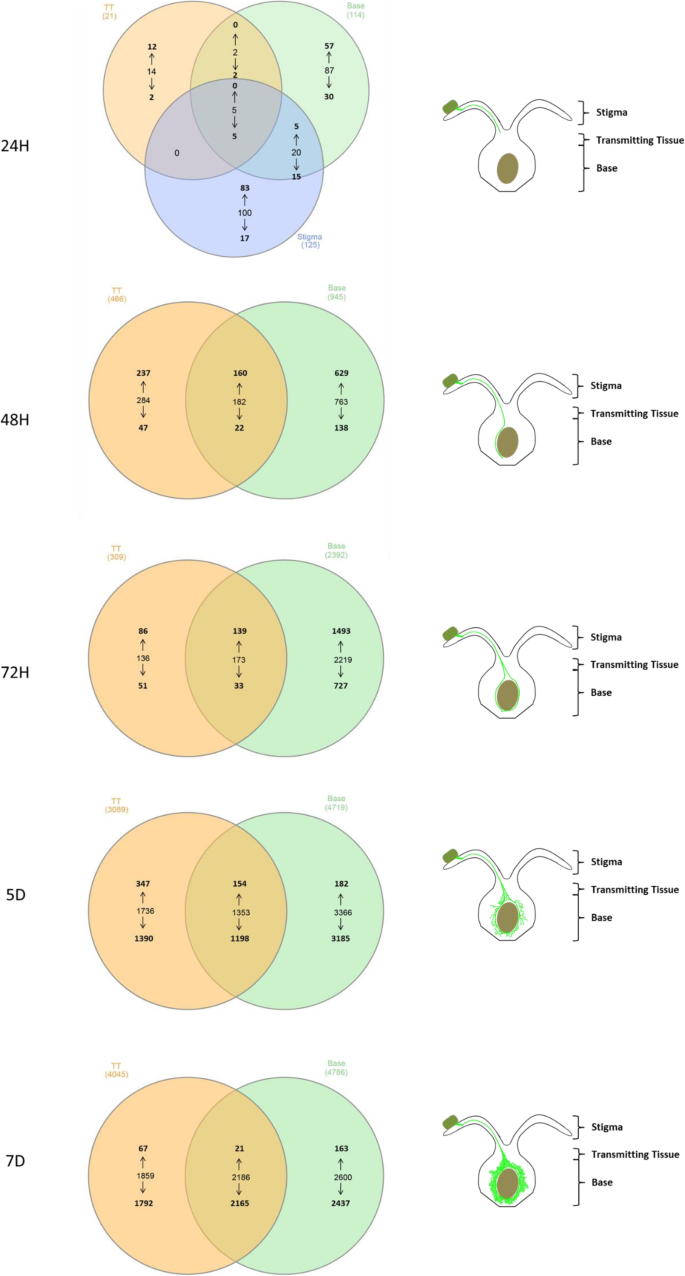
在卵巢组织之间观察到卵巢组织之间观察到差异表达的小麦基因数的差异,特别是在早期时间点(图。gydF4y2Ba2gydF4y2Ba).在24h时,更多的基因在耻骨(125℃,特异于耻辱的100个基因)和基碱(特异于碱基的114个基因)组织中的基因差异表达,而在透射组织中检测到几种差异表达的小麦基因(21°;14个基因特异于透射组织)。在24小时gydF4y2Bac . purpueagydF4y2Ba被观察到已经长成了耻辱柱,然而不是吗gydF4y2BaC. purpureagydF4y2Ba在该早期时间点在基础组织中观察到亚腿生长(图。gydF4y2Ba1gydF4y2Ba).因此,在真菌到达之前,卵巢基部的小麦基因表达的变化,提示潜在的移动信号,病原体或植物衍生,在其真菌定植之前递送到基础组织。gydF4y2Ba
在耻辱,透射和基础组织之间存在五℃,全部被测调节(24h;图。gydF4y2Ba2gydF4y2Ba).这些包括糖基水解酶(木聚糖酶),F盒家族蛋白质,肌球蛋白和囊泡相关膜蛋白,所有这些都可以与植物防御反应相关联,随着植物防御的早期抑制,造成植物防御反应gydF4y2BaC. purpureagydF4y2Ba(附加文件gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba和gydF4y2Ba4gydF4y2Ba).gydF4y2Ba
在24小时的耻辱和基础组织之间的20℃中,上调5个,包括酸性磷酸酶,细胞壁转化酶,谷氨酸毒素,RA样蛋白和VQ MOTIF家族蛋白质(24h;图。gydF4y2Ba2gydF4y2Ba;附加文件gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba和gydF4y2Ba4gydF4y2Ba).下调基因编码的蛋白具有多种功能,包括一个肉桂酰辅酶a还原酶、一个E3泛素蛋白连接酶、F-box家族蛋白、一个囊泡相关膜蛋白、一个组蛋白去乙酰化酶和一个半乳糖基转移酶家族蛋白(附加文件)gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba和gydF4y2Ba4gydF4y2Ba).传递和基础组织只有两个基因共享,都下调,编码复制蛋白a32kda亚基和信号识别粒子受体亚基家族蛋白(附加文件)gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba和gydF4y2Ba4gydF4y2Ba).在柱头和传播组织之间没有共享的DEG(图。gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
在48H和72H,表达上调的小麦基因比表达下调的小麦多(48H - 397上调/69下调,72H - 225上调/84下调)和基组织上调(48H - 789上调/160下调,72H - 1637上调/760下调)(图)。gydF4y2Ba2gydF4y2Ba).在发射(5D-3089和7D-4045)和基础组织(5D-4719和7D-4786)中,在5D和7D中进一步增加的DEG数量进一步增加(图。gydF4y2Ba2gydF4y2Ba),尽管在48H和72H观察到的上调和下调基因的比例在这些较晚的时间点被逆转,有更多的DEG下调。尽管小麦子房被压得喘不过气来gydF4y2BaC. purpureagydF4y2Ba5D和7D的亚酚组织检测到剩下的小麦基因,其保持上调。gydF4y2Ba
其中,在5D和7D的传递组织中,501和88 DEG基因表达上调,在5D和7D的基底组织中,有336和184个基因表达上调。这些上调的基因大部分属于与防御和激素途径相关的功能类别。5D时,传递组织中防御相关基因占24.75%,激素相关基因占6.19%,基组织中防御相关基因占23.51%,激素相关基因占4.46%。7D时,传递组织中38.64%的上调基因为防御相关基因,3.41%为激素相关基因,而基底组织中40.76%为防御相关基因,3.80%为激素相关基因。gydF4y2Ba
激素相关的小麦基因的差异表达gydF4y2Ba
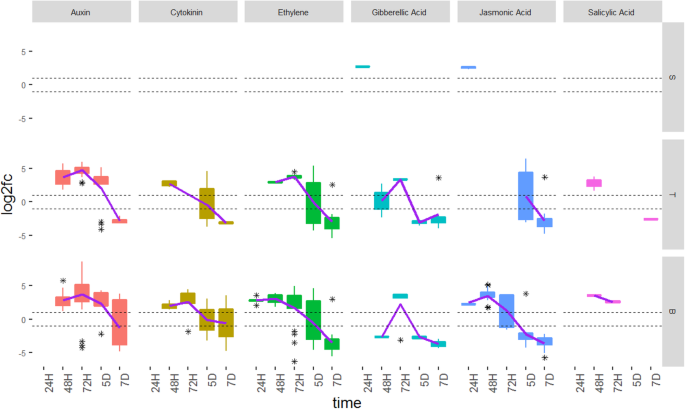
许多小麦基因差异转录gydF4y2BaC. purpureagydF4y2Ba侵染参与植物激素的生物合成和信号转导途径,包括ET、生长素、细胞分裂素、赤霉素(GA)、水杨酸(SA)和茉莉酸(JA)的生物合成和信号转导途径(Figs。gydF4y2Ba3.gydF4y2Ba和gydF4y2Ba4gydF4y2Ba).附加文件中列出了所有发现差异表达的激素相关基因gydF4y2Ba1gydF4y2Ba(表S2,S3和S4)。激素相关基因在24H时首先在柱头和基底组织中检测到,但在传递组织中未检测到。在24小时内在耻骨组织和JA和ET途径中看到与GA和JA途径相关的DEG,表明响应于的源于激素相关基因转录的非常快速的诱导gydF4y2BaC. purpureagydF4y2Ba感染,但在菌根到达之前,在基础组织中的激素相关基因表达的长距离触发。在与大多数主要植物激素相关的透射和基础组织中观察到48H℃。随时间越来越多地调节基因,通常在48h和72h之间达到峰,然后在5d和7d下进行下调,在透射和基组织中。作为JA相关基因的例外,其未被检测到在传递组织中差异表达,直到5D(图。gydF4y2Ba3.gydF4y2Ba和gydF4y2Ba4gydF4y2Ba).gydF4y2Ba
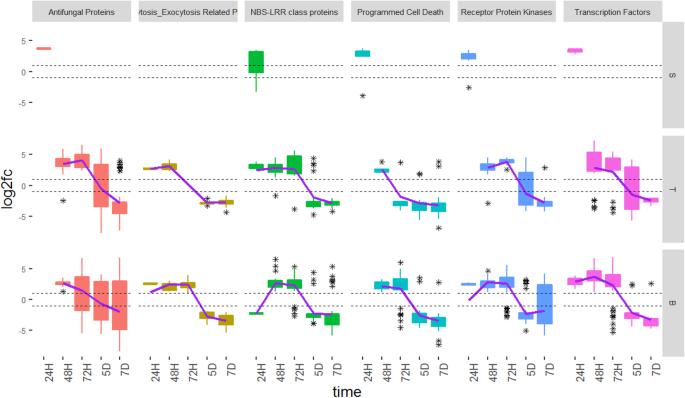
激素相关差异表达基因(DEG)跨越时间点和雌性花组织。每个盒子分别显示接种后24H、48H、72H、5D和7D柱头(S)、传递(T)和碱基(B)组织中各激素组所表达的DEG数量gydF4y2Baclaviceps purpureagydF4y2Ba,H = hours. D = days. The asterisks show the outliers beyond the upper and lower quantiles. The solid line is a regression line fitted to the data. The dotted line represents the fold change at − 1 and + 1, with genes considered not to be significantly differentially expressed if their fold change values fall between the dotted lines
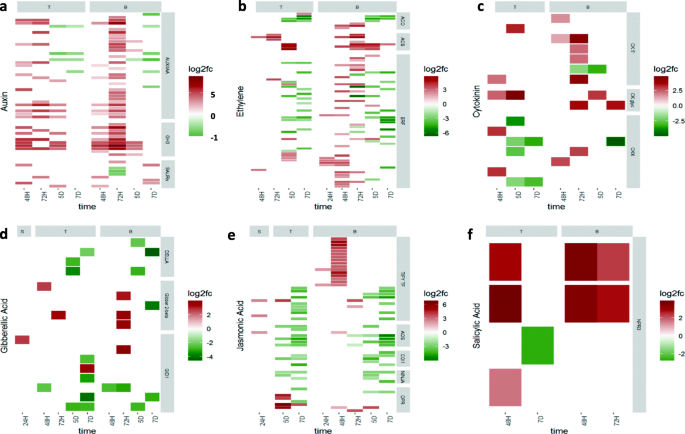
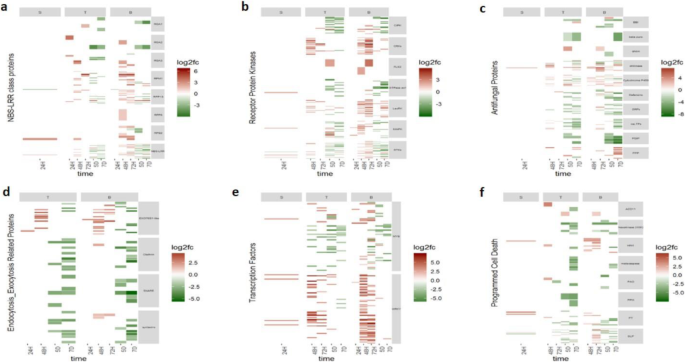
不同时间点和组织的激素相关差异表达基因(DEG)的热图。每个图显示了差异上调的激素相关基因(红色2倍变化)或被占用的小麦中的下调(绿色)gydF4y2Baclaviceps purpureagydF4y2Ba在接种后的24 h (24H)、48 h (48H)、72 h (72H)、5 d (5D)和7 d (7D),小麦子房柱头(S)、传代(T)和基部(B)组织中均表现出明显的差异。DEG是由功能类别定义的。gydF4y2Ba一个gydF4y2Ba营养素相关的基因((从上到下的类别:植物蛋白/吲哚-3-乙酸(Aux / IAA),糖苷水解酶3(GH3),小型胃辘RNA(Saurs));gydF4y2BabgydF4y2Ba乙烯相关基因((从上到下的类别:1-氨基环丙烷-1-羧酸氧化酶(ACO),1-氨基环丙烷-1-羧酸酯合酶(ACS),乙烯响应转录因子(ERF));gydF4y2BacgydF4y2Ba细胞分裂素相关基因((分类从上到下:细胞分裂素核苷5'-单磷酸phosphoribohydrolase(CK 5'),细胞分裂素特定糖基转移酶(CK GLYC),细胞分裂素氧化酶/脱氢酶(CKX));gydF4y2BadgydF4y2Ba胃酸类酸相关基因((从上到下的类别:Della,Gibberellin 2-β-氧化酶(Gibber 2-Beta),Ga-Inselsited dwarf1(GID1));gydF4y2BaegydF4y2Ba茉莉酸相关基因((从上到下的类别:Tify转录因子(Tify TF),甲基合酶(AOS),冠状苷,不敏感1(COI1),Jaz(忍者)的新型交流剂,12-氧代核苷酸还原酶(OPR)); 和gydF4y2BafgydF4y2Ba水杨酸相关基因((类别:PR3的非膨(NPR3))gydF4y2Ba
在每个激素类的某些基因是特别感兴趣的。在48h和72h,当真菌菌丝已达到胚珠和包围的胚珠,分别是在发送和碱二者组织中观察到生长素基因的上调(图gydF4y2Ba4gydF4y2Ba一个;附加文件gydF4y2Ba5gydF4y2Baa).这些基因主要属于AUX/IAA和IAA-酰胺合成酶(GH3)基因家族,在某些情况下,即使在5D时间点,GH3的上调时间也特别长。AUX/IAA基因编码已知的生长素反应基因转录抑制子,而GH3家族基因编码生长素结合酶,通过负反馈调节生长素库。AUX/IAAs和GH3s都是早期生长素应答基因,生长素调节它们的水平,在不同的稳定状态下重新平衡系统,这取决于生长素浓度[gydF4y2Ba35.gydF4y2Ba].因此,这些基因的上调点朝向生长素的水平升高的在花组织中的存在gydF4y2BaC. purpureagydF4y2Ba感染,以及疾病信号传导的潜在增加。在48H和72H的透射和基组织中也观察到蟾蜍蛋白相互拮抗的激素SA的NPR3受体的上调(图。gydF4y2Ba4gydF4y2Baf;附加文件gydF4y2Ba5gydF4y2BaF)。gydF4y2Ba
在ET基因中,表现出最高调节的两类基因是1-氨基环丙烷-1-羧酸合酶(ACS)和1-氨基环丙烷-1-羧酸氧化酶(ACO)(图。gydF4y2Ba4gydF4y2BaB;附加文件gydF4y2Ba5gydF4y2Bab)。这些形式的多基因家族和编码等生物合成酶,形成生物合成途径中的最终步骤[gydF4y2Ba36.gydF4y2Ba].在透射和基础组织中观察到上调。ACS基因在5D中保持上调,其中基因在7D上留下上调的基础组织中。ET响应转录因子(ERF),驱动许多信号级联响应于等[gydF4y2Ba37.gydF4y2Ba,也被发现在传播组织和基组织中上调。大多数这些ERF在基底组织的早期时间点持续上调,而下调仅发生在5D和7D。在ET的生物合成和信号通路中发现的基因的上调表明在过程中ET依赖的反应被激活gydF4y2BaC. purpureagydF4y2Ba感染。gydF4y2Ba
这回应了另一种激素组gydF4y2BaC. purpureagydF4y2Ba感染是细胞质素(图。gydF4y2Ba4gydF4y2BaC;附加文件gydF4y2Ba5gydF4y2Bac).涉及细胞分裂素稳态的三个功能基因类是我们感兴趣的。首先,在整个侵染过程中,细胞分裂素特异性糖基转移酶在传递组织和基底组织中均被上调,甚至在真菌菌丝淹没胚珠的后期(5D和7D),这种上调仍在持续。这些糖基转移酶通过与糖基结合使细胞分裂素失活而起作用[gydF4y2Ba38.gydF4y2Ba].第二种基因类,也参与细胞分裂素蛋白失活,是催化细胞蛋白的不可逆降解的细胞蛋白氧化酶/脱氢酶(CKX)[gydF4y2Ba38.gydF4y2Ba].然而,与细胞分裂素糖基转移酶相反,CKX并没有在所有时间点上上调,在传递组织中在48H上调,在基底组织中在48H和72H上调。最后,编码细胞分裂素核苷5 ' -单磷酸磷酸核糖水解酶(ck5 ')的LOG基因[gydF4y2Ba39.gydF4y2Ba]在大多数情况下,对单步活化的单步活化是在大多数情况下,在期间早期上调gydF4y2BaC. purpureagydF4y2Ba感染(48h和72h),大多数上调基因在基组织中被检测到。因此,涉及Cytokinin稳态的基因的差异表达表明细胞素水平的显着改变gydF4y2BaC. purpureagydF4y2Ba感染的女性花组。gydF4y2Ba
差分基因表达分析还表明在感染期间诱导GA途径(图。gydF4y2Ba4gydF4y2BaD;附加文件gydF4y2Ba5gydF4y2Bad)。在感染期间,发现胃肠杆菌蛋白2-β-氧化酶(Ga2Ox)基因非常清早上调,在耻辱,在透射中的48和72h处的24小时内发现,在碱基组织中为72h。Ga2ox参与Ga分解代谢和气体的失活,并响应于升高的GA信号和GA处理而上调[gydF4y2Ba40gydF4y2Ba].Ga受体GID1(Ga-Instepited dwarf1)基因在耻骨组织中24小时调节,然后在48h和72h的透射和基组织中下调。先前已经发现GID1在GA缺乏的条件下令人上调,或者Della积累[gydF4y2Ba41.gydF4y2Ba].占据这些发现可以表明小麦的反应去除来自花组织的Ga。gydF4y2Ba
涉及Ja的生物合成和信号通路的许多基因也被差异表达(图。gydF4y2Ba4gydF4y2Bae;附加文件gydF4y2Ba5gydF4y2Bae)。至于生物合成途径,12 oxophytodienoate还原酶(OPR)和丙二烯氧化物合酶(AOS),其催化在JA生物合成的第一步骤中,均发现为响应于被差异表达的gydF4y2BaC. purpureagydF4y2Ba感染。OPR在传递组织和基底组织中在48H至7D之间上调,但只有一个AOS基因在柱头24H和基底组织48H处上调,其余AOS编码基因下调。在JA信号转导方面,有两类功能基因值得研究。首先,在最后两个时间点发现F-box蛋白冠状蛋白不敏感1 (COI1)在传递和基底组织中下调。在JA存在的情况下,COI1结合茉莉酸ZIM域(JAZ)蛋白导致其泛素依赖性降解[gydF4y2Ba42.gydF4y2Ba].JA的响应基因JAZ蛋白质抑制转录[gydF4y2Ba23.gydF4y2Ba[所以取消COI1可能会限制Jaz蛋白质降解并允许继续抑制JA响应基因的转录。第二个信令组件受影响gydF4y2BaC. purpureagydF4y2Ba感染是含有Tify结构域的转录因子。在jaz家族中发现了转录因子[gydF4y2Ba43.gydF4y2Ba].研究发现,在柱头和基底组织中,TIFY转录因子在24H时上调。此外,这些转录因子在基底组织中的48H和72H均上调。这些观察结果表明,茉莉酸信号可能受到抑制gydF4y2BaC. purpureagydF4y2Ba感染。gydF4y2Ba
国防相关小麦基因的差异表达gydF4y2Ba
几个防御相关基因在小麦基因中有差异表达gydF4y2BaC. purpureagydF4y2Ba感染。一个完整的列表可以在其他文件中找到gydF4y2Ba1gydF4y2Ba(表S5,S6和S7)。这些DEG的预测功能非常多样化,范围从运输和信号传播到涉及各种代谢反应的基因。在确定的所有功能类别中,六个类别;抗真菌蛋白,内吞炎/卵尿精相关蛋白,NBS-LRR类蛋白,参与编程细胞死亡,受体蛋白激酶和转录因子的基因被选为最生物学相关,以及表现出最显着的差异表达模式的那些。首先在24小时和所有三个卵巢组织中检测到与防御相关的DEG(图。gydF4y2Ba5gydF4y2Ba).因此,类似于激素相关的基因,观察到与无菌相关的基因在通过真菌在这些组织定植之前在基础组织中差异表达。通常,在所有组织中,在24h和72h之间观察到所有功能类别中的DEG的上调,然后在5D和7D下进行下调。gydF4y2Ba
国防相关的差异表达基因(DEG)跨时间点和女花组织鉴定。每个框表示属于(T)在柱头(S)表示的每个防御相关的功能类别,传送和碱(B)在24H,48H,72H组织DEG的数量,5D和7D接种后gydF4y2Baclaviceps purpureagydF4y2Ba,H = hours. D = days. The asterisks show the outliers beyond the upper and lower quantiles. The solid line is a regression line fitted to the data. The dotted line represents the fold change at − 1 and + 1, with genes considered not to be significantly differentially expressed if their fold change values fall between the dotted lines
在功能类别类别中NBS-LRR基因中,大多数基因表现出类似的差异表达模式(图。gydF4y2Ba6gydF4y2Ba一个;附加文件gydF4y2Ba6gydF4y2Ba一种)。有趣的是,在基础组织中,在24小时时,NBS-LRR基因被下调。然后将这些基因在透射和基组织中以48小时上调,保持该状态直至72h,之后观察到下调。但是,一些NBS-LRR基因表现出高于其余的上调的LOGFC值。这些基因被鉴定为已发现在过敏阻力中起重要作用的RPM1和RGA3基因类别的成员[gydF4y2Ba44.gydF4y2Ba].gydF4y2Ba
跨时间点和组织的防御相关差异表达基因(DEG)的热图。每个图显示了与差异上调(红色的折叠变化)或被占用的小麦的差异上调(LOG2折叠变化)或下调的抗辩基因gydF4y2Baclaviceps purpureagydF4y2Ba在接种后的24 h (24H)、48 h (48H)、72 h (72H)、5 d (5D)和7 d (7D),小麦子房柱头(S)、传代(T)和基部(B)组织中均表现出明显的差异。DEG是由功能类别定义的。gydF4y2Ba一个gydF4y2BaNBS-LRR类蛋白(从上到下的功能类别:RGA1,RGA2,RGA3,RPM1,RPP13,RPP8,RPS2,NBS-LRR);gydF4y2BabgydF4y2Ba受体蛋白激酶()从上到下的功能分类:cbl相互作用蛋白激酶(CIPK)、富半胱氨酸受体样激酶(CRKs)、鞭毛蛋白感知2 (FLS2)、GTPase激活1、凝集素受体激酶(LecRK)、丝裂原活化激酶(MAPK)、丝氨酸/苏氨酸激酶(STKs);gydF4y2BacgydF4y2Ba抗真菌蛋白(从上到下的功能分类:Bowman-Birk型胰蛋白酶抑制剂(BBI)、- purothionins、几丁质诱导结合蛋白、几丁质酶、细胞色素P450、防御素、富含甘氨酸的蛋白(GRPs)、非特异性脂质转移蛋白(nsLTPs)、聚半乳糖醛酸酶抑制蛋白(PGIP)、植物发病蛋白(PPP));gydF4y2BadgydF4y2Ba内吞作用/胞外分泌相关蛋白;gydF4y2BaegydF4y2Ba转录因子;和gydF4y2BafgydF4y2Ba程序性细胞死亡相关基因(从上到下功能分类:细胞加速死亡11 (ACD11)、己糖激酶(HXK)、哈平诱导蛋白(HIN1)、metacaspase、多胺氧化酶(PAO)、多酚氧化酶(PPO)、钾转运蛋白(PT)、枯草杆菌素样蛋白酶(SLP))gydF4y2Ba
与NBS-LRR类别蛋白分开组分开组的受体蛋白激酶(RPK),响应于gydF4y2Bac . purpuereagydF4y2Ba感染(图。gydF4y2Ba6gydF4y2BaB;附加文件gydF4y2Ba6gydF4y2Bab).类似RPK的基因首先在柱头和基底组织中24H上调,然后在传递和基底组织中持续上调,直到72H。这类基因中最丰富的是丝氨酸/苏氨酸激酶(STK),而上调水平最高的两类RPK是富含半胱氨酸的受体样激酶(CRK)和凝集素受体激酶(LecRK)。它们的上调一直持续到5D,在基底组织中,每一类中都有一些成员在7D维持上调。这两类RPK在植物中发挥多种作用,包括在病原体识别过程中的下游信号传导[gydF4y2Ba45.gydF4y2Ba].gydF4y2Ba
诱导与抗真菌活性相关的基因gydF4y2BaC. purpureagydF4y2Ba在柱头组织中,第一次在24H表达上调(图。gydF4y2Ba6gydF4y2BaC;附加文件gydF4y2Ba6gydF4y2BaC)。大多数基因在48H和72H的时间点的透射和基础组织中上调。显示最大上调的抗真菌基因类是细胞色素P450s和几丁酶。细胞色素p450s代表植物中最大的超级蛋白质之一,并负责催化许多脂肪酸的氧合[gydF4y2Ba46.gydF4y2Ba].已发现由这些反应产生的许多化合物具有抗真菌性能[gydF4y2Ba46.gydF4y2Ba,gydF4y2Ba47.gydF4y2Ba].几丁质酶编码基因表现出最持久的上调gydF4y2BaC. purpureagydF4y2Ba感染,在所有三个组织。几丁质酶是负责甲壳素发现的特定债券的水解断裂的催化剂,从而在植物防御显著作用,对一系列的病原体[gydF4y2Ba47.gydF4y2Ba].gydF4y2Ba
防御相关DEG的一个特别有趣的功能类别是那些参与内吞/胞吐过程的DEG,在传递和基底组织中显示出早期诱导(图)。gydF4y2Ba6gydF4y2BaD;附加文件gydF4y2Ba6gydF4y2Bad).这类DEG包括SNARE蛋白、syntaxins和EXO70B1胞外复合物组分的同源物,所有这些都已被发现在细胞壁贴壁形成中发挥作用[gydF4y2Ba48.gydF4y2Ba].其中,表现出最高水平的上调水平的群体是外胚胎复合组分EXO70B1。gydF4y2Ba
差异表达的转录因子包括腕表和MYB转录因子,由上调gydF4y2BaC. purpureagydF4y2Ba在所有三种组织中24h和72h的感染(图。gydF4y2Ba6gydF4y2Bae;附加文件gydF4y2Ba6gydF4y2Bae)。认定为特别表现出较高的水平上调的WRKY类转录因子的基因。该WRKY和MYB转录因子家族都被牵连与植物的防御反应[相关的转录重新编程gydF4y2Ba18.gydF4y2Ba].gydF4y2Ba
分类为所涉及编程的细胞死亡的基因早期调节,在耻骨组织中在24h中看到,在48h的透射组织中达到峰值,并且在48h和72h之间的基础组织,之后这些基因被下调(图。gydF4y2Ba6gydF4y2Baf;附加文件gydF4y2Ba6gydF4y2BaF)。该类中的基因包括Harpin诱导蛋白1(Hin1)和枯草杆菌蛋白酶样蛋白酶(SLP)[gydF4y2Ba49.gydF4y2Ba,gydF4y2Ba50.gydF4y2Ba].HIN1已发现蛋白酶体介导的程序性细胞死亡过程中高度诱导[gydF4y2Ba49.gydF4y2Ba],而枯草杆菌蛋白酶样蛋白酶已在病原体识别中实施,并且在触发过敏反应中[gydF4y2Ba51.gydF4y2Ba].gydF4y2Ba
讨论gydF4y2Ba
麦角对谷物品质和产量造成严重后果,而且直接对人体健康由于高浓度的有毒生物碱的影响菌核找到。在中世纪,麦角生物碱负责称为圣安东尼火的人类疾病。彩色分选和重力表[:虽然菌核现在可以从污染颗粒负载通过物理清洗方法除去gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba],我们对小麦和麦田之间发生的相互作用很少了解gydF4y2BaC. purpureagydF4y2Ba在细胞和分子遗传水平上。利用RNASeq方法,我们报告了小麦转录组响应的第一次重编程检查gydF4y2BaC. purpureagydF4y2Ba在卵巢的定义组织中感染,即柱头,透射和基组织(图。gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
感染gydF4y2BaC. purpureagydF4y2Ba导致与激素代谢和信号传导相关的小麦基因表达的重大变化,以及与防御有关的广泛基因。存在相当大的证据表明,在对病原体的免疫应答调节中起着至关重要的作用激素[gydF4y2Ba52.gydF4y2Ba].复杂的协同和拮抗相互作用为植物提供了激活和微调防御的调节潜力[gydF4y2Ba52.gydF4y2Ba].我们的结果表明gydF4y2BaC. purpureagydF4y2Ba也能迅速改变荷尔蒙水平gydF4y2Ba在Planta.gydF4y2Ba,利用宿主的激素稳态和/或信号机制来促进感染。gydF4y2Ba
在本研究中差异表达的激素相关基因中,生长素相关基因尤为丰富。具体而言,AUX/IAA和IAA-酰胺合成酶(GH3)基因家族的基因在早期上调gydF4y2BaC. purpureagydF4y2Ba感染。在感染的黑麦胚珠中观察到这些营养素相关基因的这些家庭的上调gydF4y2BaC. purpureagydF4y2Ba[gydF4y2Ba53.gydF4y2Ba].作为gydF4y2BaC. purpureagydF4y2Ba能够产生和分泌大量的生长素[gydF4y2Ba54.gydF4y2Ba],有人认为,病原菌利用寄主的生长素稳态,以促进感染[gydF4y2Ba55.gydF4y2Ba].因此,通过AUX/IAA基因表达的上调,以及GH3蛋白将过量的生长素接合在一起,抑制生长素信号的传递,可能是宿主对其产生的生长素水平升高的直接反应gydF4y2BaC. purpureagydF4y2Ba.GH3的过表达也已被证明导致SA的累积升高[gydF4y2Ba55.gydF4y2Ba].虽然观察到SA受体NPR3的上调,但低亲和力SA受体需要高水平的SA诱导[gydF4y2Ba56.gydF4y2Ba],将支持小麦卵巢内SA的标高。gydF4y2Ba
SA扮演的反对活体营养化和半植物病毒的防御反应激活了至关重要的作用,与SA不敏感突变体显示到的病原体两组[易感性增加gydF4y2Ba57.gydF4y2Ba].还有人建议,SA以反对的方式造成植物地。SA可以通过稳定Aux / IAA疾病阻遏物来抑制病原体生长,通过限制其降解所需的植物蛋白受体来实现[gydF4y2Ba58.gydF4y2Ba].实际上,我们的数据显示了透射和基组织内的植物素结合蛋白(可能是一种生长素受体)的下调,其与AUX / IAA基因的上调相一致。gydF4y2Ba
ET和JA生物合成基因,gydF4y2BaACS.gydF4y2Ba和gydF4y2BaACO.gydF4y2Ba, 和gydF4y2Ba超载比gydF4y2Ba和gydF4y2BaAOS.gydF4y2Ba分别在感染时上调在传输和碱卵巢组织中gydF4y2BaC. purpureagydF4y2Ba,而Ja信号基因gydF4y2BaCOI1.gydF4y2Ba被抑制。小麦穗感染gydF4y2BaF. Graminearum.gydF4y2Ba,FHB的因果转剂,也导致JA生物合成基因AOS和OPR在FHB抗性品种王水海中的上调,而JA信号基因gydF4y2BaCOI1.gydF4y2Ba在感染时在易感小麦中下调gydF4y2BaF. Graminearum.gydF4y2Ba[gydF4y2Ba59.gydF4y2Ba].同样在ET基因的表达中的类似模式,即ET生物合成基因ACS和ACO的上调也观察到[gydF4y2Ba59.gydF4y2Ba,gydF4y2Ba60.gydF4y2Ba].在水稻中观察到ACS和ACO基因的上调(gydF4y2Ba奥雅萨苜蓿gydF4y2Ba),同时ET的释放增强,以响应半生物营养真菌的感染gydF4y2BaM. Grisea.gydF4y2Ba[gydF4y2Ba61.gydF4y2Ba]gydF4y2Ba.gydF4y2Ba在感染的早期阶段期间,ET响应转录因子(ERF)也上调。ERF在防御调节中发挥着重要作用,并且表达的变化已被证明导致抗抗性变化对不同类型的真菌的变化[gydF4y2Ba62.gydF4y2Ba].例如,在gydF4y2Ba拟南芥gydF4y2Ba,虽然ERF1的组成剖视表达增强了耐受性gydF4y2Ba灰霉病cinerealgydF4y2Ba感染 [gydF4y2Ba63.gydF4y2Ba] ERF4的过表达导致易感性增加gydF4y2BaF. oxysporum.gydF4y2Ba[gydF4y2Ba62.gydF4y2Ba].gydF4y2Ba
我们的数据显示Et生物合成基因的诱导gydF4y2BaACS.gydF4y2Ba和gydF4y2BaACO.gydF4y2Ba与两个参与JA生物合成的基因的诱导一致。研究表明,ET信号与JA信号协同作用,激活防御反应,特别是对坏死营养病原体的防御反应[gydF4y2Ba64.gydF4y2Ba].还要考虑JA / ET信号通知途径以相互拮抗的方式对SA作用,然而,其他研究表明ET和JA也可以以相互协同的方式起作用,这取决于病原体的性质[gydF4y2Ba65.gydF4y2Ba].gydF4y2Ba
Cytokinins也涉及gydF4y2BaC. purpureagydF4y2BaCKX和细胞分裂素糖基转移酶在转运组织和基组织中的表达上调。这两个细胞分裂素诱导基因都参与细胞分裂素稳态,并通过降解和结合细胞分裂素发挥作用[gydF4y2Ba57.gydF4y2Ba].细胞分裂素糖基转移酶通过与糖基结合使细胞分裂素失活,而CKX催化细胞分裂素的不可逆降解在一个单一的酶的步骤[gydF4y2Ba66.gydF4y2Ba].gydF4y2BaC. purpureagydF4y2Ba能分泌大量的细胞分裂素吗gydF4y2Ba在Planta,gydF4y2Ba为了促进感染[gydF4y2Ba67.gydF4y2Ba], 和gydF4y2BaM. Oryzae.gydF4y2Ba,稻瘟病病原菌也分泌细胞分裂素,被要求完全致病性[gydF4y2Ba68.gydF4y2Ba].这些细胞素素降解小麦基因的上调可能是响应升高的水平gydF4y2BaC. purpureagydF4y2Ba细胞分裂素和宿主的防御反应。gydF4y2Ba
在小麦耻骨组织中的GA受体GID1的早期诱导,以及随后的关键GA分解代谢酶的上调,例如GA2Ox,在透射和基组织中,表明GA累积响应gydF4y2BaC. purpureagydF4y2Ba感染。GA的积累可能导致GA信号,Della蛋白的负调节剂的降解。这种观察符合其中的研究gydF4y2Ba拟南芥gydF4y2Ba功能丧失四倍gydF4y2Ba德拉gydF4y2Ba突变体对生物养殖病原体耐药gydF4y2Ba太平洋标准时间gydF4y2BaDC3000和gydF4y2BaHyaloperonospora Arabidopsidis.gydF4y2Ba[gydF4y2Ba22.gydF4y2Ba].此外,最近的一项研究发现了一种对gydF4y2BaC. purpureagydF4y2Ba与DELLA突变体相关联,半矮化等位基因,gydF4y2BaRht-1BbgydF4y2Ba和gydF4y2Barht-1db.gydF4y2Ba[gydF4y2Ba69.gydF4y2Ba].gydF4y2Ba
植物免疫的复杂性从具有差异表达的植物防御中具有众所周知的作用的各种基因的复杂性是显而易见的。gydF4y2BaC. purpureagydF4y2Ba感染。除胞内/胞外相关基因外,所有防御基因在柱头组织中24H均上调。许多已知参与PAMP和效应识别的RPK和NBS-LRR类蛋白在早期上调gydF4y2BaC. purpureagydF4y2Ba感染,即使这个小麦-gydF4y2BaC. purpureagydF4y2Ba交互表示的易感相互作用,其中gydF4y2BaC. purpureagydF4y2Ba能够完成其感染生命周期。gydF4y2Ba
许多NBS-LRR蛋白检测通过与效应蛋白结合的病原体产生的效应分子,或间接通过这些效应器对宿主靶蛋白的修饰进行了结合[gydF4y2Ba70gydF4y2Ba].间接机制倾向于通过NBS-LRR蛋白与病原体的关键宿主靶标结合,并在这些靶标因感染而发生改变时触发防御。这些NBS-LRR蛋白在真菌菌丝到达这些组织之前的24H在传递组织和基底组织中上调,表明这些基因是对病原体或植物源的移动信号的响应。早期NBS-LRR蛋白的上调gydF4y2BaC. purpureagydF4y2Ba侵染可能表明寄主植物试图提高其识别能力gydF4y2BaC. purpureagydF4y2Ba效应器。这将导致特定防御反应的激活,如细胞壁修饰,次生代谢产物的产生,甚至是程序性细胞死亡,以对抗病原体的攻击。鉴定了已知NBS-LRR抗性(R-)基因的同源物,包括gydF4y2BaRGA2.gydF4y2Ba和gydF4y2BaRGA3.gydF4y2Ba,这是耐叶锈病所需的(gydF4y2Ba柄锈菌triticinagydF4y2Ba)在四倍体和六倍体小麦[gydF4y2Ba71.gydF4y2Ba].r基因的同系物gydF4y2BaRPM1.gydF4y2Ba和gydF4y2BaRPS2gydF4y2Ba已发现两者都被响应于生物养真菌而显着诱导gydF4y2BaExobasidium刺扰伊蚊gydF4y2Ba这会导致茶叶枯萎病变[gydF4y2Ba72.gydF4y2Ba].gydF4y2Ba
除了特定的NBS-LRR类RPK蛋白,其他RPK,即丝氨酸/苏氨酸激酶(STK)和富含半胱氨酸类受体蛋白激酶(CRK),被发现强烈诱导整个gydF4y2BaC. purpureagydF4y2Ba感染。与NBS-LRR蛋白质相反,这些RPK表现出在稍后的时间点持续的上调gydF4y2BaC. purpureagydF4y2Ba感染。STK是形成第一道防线的膜蛋白,识别PAMP,然后导致MAPK信号级联和最终其他防御相关基因的激活[gydF4y2Ba45.gydF4y2Ba].CRK是一个子成员类受体激酶和许多基因属于这个家族的蛋白质已经被发现是由多种病原体引起。一个这样的CRK被发现大麦响应活体营养真菌诱导gydF4y2Ba禾谷布鲁氏菌gydF4y2Ba,这导致大麦白粉病[gydF4y2Ba73.gydF4y2Ba].综上所述,这些结果表明小麦能够识别gydF4y2BaC. purpureagydF4y2Ba通过多个受体蛋白的激活,其随后触发的防卫反应的阵列,即使在这种小麦 -gydF4y2BaC. purpureagydF4y2Ba兼容的交互。gydF4y2Ba
对病原体感染的常见性早期反应是细胞壁改性。称为乳头的细胞壁防御性环容形成在许多生物营养和Hemi-Biotophic病原体的尝试病原体渗透位点下方[gydF4y2Ba48.gydF4y2Ba].在大麦中,这一过程已经被证明是通过基因的作用而促进的,如SNARE蛋白、syntaxins和EXO70B的胞外复合成分。突变体的遗传筛选,允许增加穿透gydF4y2BaB.菌gydF4y2Ba识别出syntaxins和SNARE蛋白在细胞壁修饰以应对真菌渗透的关键作用[gydF4y2Ba74.gydF4y2Ba].在早期阶段期间,这些基因的同源物在小麦中被上调gydF4y2BaC. purpureagydF4y2Ba感染,尽管就我们所知,乳突尚未在谷类中观察到gydF4y2BaC. purpureagydF4y2Ba交互。gydF4y2Ba
观察到在早期阶段的腕骨和MYB转录因子的诱导gydF4y2BaC. purpureagydF4y2Ba感染进一步指向小麦转录组的重编程。Wrky转录因子参与调节各种水平的防御基因表达,激活抗微生物化合物的产生并引发细胞死亡,而MYB转录因子也已发现参与过敏细胞死亡反应的诱导[gydF4y2Ba75.gydF4y2Ba,gydF4y2Ba76.gydF4y2Ba].在我们的数据集中,这些转录因子的作用是明显的,从抗真菌作用基因的诱导,细胞壁修饰和程序性细胞死亡的作用,以及次生代谢产物的产生。观察到的抗真菌化合物的早期诱导,如几丁质酶和防御素,已知的真菌生长抑制物[gydF4y2Ba77.gydF4y2Ba,gydF4y2Ba78.gydF4y2Ba],也被感染黑麦的通过过程中观察到gydF4y2BaC. purpureagydF4y2Ba[gydF4y2Ba53.gydF4y2Ba].gydF4y2Ba
结论gydF4y2Ba
ergot是许多商业谷物作物的严重疾病。污染核菌产生的种子批次为人类消费或甚至由于积聚在辛劳蒂罗斯积累的剧毒麦格白碱类生物碱而被丢弃[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba7gydF4y2Ba].随着杂交小麦和大麦市场的扩大,麦角菌在这些开放开花生产系统中的复苏[gydF4y2Ba10.gydF4y2Ba而最近的证据表明,麦角生物碱可以在原位污染健康的种子,因为它们在被感染的花的上下生长gydF4y2BaC. purpureagydF4y2Ba[gydF4y2Ba9gydF4y2Ba].因此,我们必须更好地理解gydF4y2BaC. purpureagydF4y2Ba重要谷物作物中的感染过程,如六倍体小麦。我们的数据表明感染gydF4y2BaC. purpureagydF4y2Ba小麦植物在感染的早期阶段激活几种防御机制。除了具有良好特征的防御相关基因,小麦激素稳态和信号通路相关基因也被诱导。这些激素相关基因可能作为宿主防御反应的一部分上调,但同样也可能被诱导gydF4y2BaC. purpureagydF4y2Ba创建适合的环境gydF4y2BaC. purpureagydF4y2Ba殖民和繁殖,以及破坏宿主的防御反应。远距离移动信号触发卵巢基部差异基因表达的证据,早在病原体到来之前,也同样可以得到gydF4y2BaC. purpureagydF4y2Ba,送去准备基底组织用于真菌菌丝的到达,或者从受感染的耻辱中源于植物衍生和派发,以引发系统防御反应。gydF4y2Ba
方法gydF4y2Ba
植物材料,gydF4y2Baclaviceps purpureagydF4y2Ba接种和取样gydF4y2Ba
由史蒂夫本特利(个人通讯)在NIAB开发的细胞质雄性不育六倍体小麦系在所有使用gydF4y2BaC. purpureagydF4y2Ba接种。植物在An18的玻璃厅生长gydF4y2BaogydF4y2BaC/16 h day and 15 °C/8 h night cycle, supplemented when needed by artificial light at 240 μmol m- 2gydF4y2Ba年代gydF4y2Ba- 1gydF4y2Ba.每只耳朵的中部小花香,第一分蘖,用单一接种gydF4y2BaC. purpureagydF4y2Ba当柱头开始接受(即外观呈蓬松状)时分离,如[gydF4y2Ba69.gydF4y2Ba].gydF4y2BaC. purpureagydF4y2Ba使用2mL注射器和细针进行接种,在每个小花圈的引理和宫颈之间递送分类血症。每只耳朵都接种了12种小花。每个接种的耳朵代表单个复制,每个时间点和组织采样都会收集五个复制。用超纯水注射嘲弄接种的小花香。gydF4y2Bac .紫竹(Cp)gydF4y2Ba- 在接种微观和RNAseq分析后,在10分钟,1,5,24,48和72h(h)和5和7天(d)中,在10分钟,1,5,24,48和72h(d)中拍摄和模拟接种的样品(表gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
的gydF4y2BaC. purpureagydF4y2Ba英国孤立04-97.1 [gydF4y2Ba79.gydF4y2Ba]被用于所有的接种。分离物04-97.1是在需要分生孢子前两周从-80℃保存的长期甘油砧木上接种到雄性不育系上获得的。采集新鲜分生孢子,以蜜露形式,在超纯水中稀释至1 × 10浓度gydF4y2Ba- 6gydF4y2Ba孢子ml.gydF4y2Ba1gydF4y2Ba.这些孢子被用来接种植物3天,在4°C保存。gydF4y2Ba
收集额外的真菌样品,包括来自蜜露的Conidia和菌丝体的复制gydF4y2BaC. purpurea。gydF4y2Ba在接种后10-12天收集来自单个接种耳的分类,重新悬浮在1ml蒸馏水中。孢子以6000rpm离心,然后重悬于50ml RNA中gydF4y2Ba晚些时候gydF4y2Ba(由Thermofisher Scientific提供的Thermofer Simporic)在20°C之前在液体幔介质中生长24小时,然后通过在50ml RNA中离心和重悬浮gydF4y2Ba晚些时候gydF4y2Ba并储存在-80°C。从两者中提取RNA用于RNA匹达分析gydF4y2BaC. purpureagydF4y2Ba菌丝和分生孢子。gydF4y2Ba
显微镜和RNA提取的花组织的制备gydF4y2Ba
全卵巢从每个接种的小花体中除去,并使用用RNASEZAP擦拭的双刃剃刀切断(由Thermofisher Scientific提供)。沿着每个卵形的背部凹槽制成纵向部分,允许易于识别耻辱,透射和基组织(图。gydF4y2Ba1gydF4y2Ba).将一半的卵巢置于甲醛中,用于固定和随后的渗流和共聚焦显微镜。将另一半置于30μl的RNA中gydF4y2Ba晚些时候gydF4y2Ba并留下24小时以允许完全渗透液体。gydF4y2Ba
显微镜检查程序gydF4y2Ba
用0.05%苯胺蓝溶液在pH为9.0的磷酸钾缓冲液中染色。在每个时间点,用荧光显微镜检查卵巢,并对柱头、传递组织和基底组织中染色菌丝的存在进行评分。在高分辨率共聚焦显微镜下,将卵巢半部分固定在1 M KOH中24小时,用水冲洗,然后用0.3 mg/ml淀粉酶在37°C下处理36-48小时。采用mPS-PI技术对卵巢进行染色[gydF4y2Ba80gydF4y2Ba].卵巢用希夫试剂(100mm焦亚硫酸钠和0.15 M HCL)和100 μg/ml碘化丙啶在室温下处理1-2 h,用水冲洗,然后用苯胺蓝修饰的SCALE溶液[gydF4y2Ba81.gydF4y2Ba];50 mM KgydF4y2Ba2gydF4y2BaHPOgydF4y2Ba4gydF4y2Ba,4m尿素,10%甘油,0.1%Triton X-100和0.05%苯胺蓝;ph 9.0)。卵巢安装在染色溶液中并用Leica SP5共聚焦显微镜(Leica Microsystems UK Ltd)成像。使用405nm的激发可视化苯胺蓝染色组织,并在415-490nm下检测,使用561nm的激发来观察415-490nm,并且在575-720nm下检测到碘化丙啶。gydF4y2Ba
RNA提取,图书馆施工和rNASEQgydF4y2Ba
每个卵巢一半(每只耳最多12个卵巢半部)收集gydF4y2BaCPgydF4y2Ba如果通过显微镜显示相应的卵巢半术,则汇集了封闭的耳朵,以感染gydF4y2BaC. purpureagydF4y2Ba感染。一只耳朵的半卵巢形成了RNA复制。将每个卵巢部分分成耻辱,透射和基组织。使用2mM RNase的钢球(球转转)进行植物和真菌组织的组织破坏。使用Trizol(Invitrogen)方法制备RNA。在使用NanoDrop定量之前,使用RNEasy 96孔柱进行DNA处理(QIAGEN),然后使用RNEASY 96孔柱清洗。使用Shimadzu Multina评估RNA完整性,以选择5个重复的RNA样品用于Illumina Truseq库制剂。gydF4y2Ba
三个复制的RNASEQ库是由模拟的gydF4y2BaCPgydF4y2Ba- 在每个时间点的三种组织中的每种组织,透射和基组织中的每一点的吞咽卵巢。对于颗粒可行组织不超过24小时。RNASEQ库也由未渗透组成gydF4y2BaC. purpureagydF4y2BaConidia(两个重复)和gydF4y2BaC. purpureagydF4y2Ba体外种植的菌丝体(三次重复)。RNASEQ库被源生物科学的准备和测序(gydF4y2Bawww.sourcebioscience.com.gydF4y2Ba):采用Illumina poly-T oligo-attached magnetic beads分离mRNA,经两轮纯化。mrna被片段化,用随机六聚体引物进行cDNA合成。文库按照Illumina TruSeq RNA样品制备指南(2010年11月,rev. A)用于Illumina单端多路测序。库被合用并在两个流单元上运行。gydF4y2Ba
生物信息学管道:预处理gydF4y2Ba
使用FastQC对fastq文件进行质量检查[gydF4y2Ba82.gydF4y2Ba].使用Fastx Clipper除去适配器序列[gydF4y2Ba83.gydF4y2Ba](参数:-M 15 -L 20 -A <适配器序列>)。序列以质量分数少于20分,修剪序列,除去短于35的序列(参数:-T 20 -L 35)使用FASTQ质量修剪器[gydF4y2Ba83.gydF4y2Ba].gydF4y2Ba
基因组导向组件gydF4y2Ba
面包小麦品种中国春天(IWGSC Refseq V1; Urgi Inra)cDNA版本1和gydF4y2BaC. purpureagydF4y2Ba合并cDNA(Ensembl释放35)以形成转录组FastA参考序列。两种模拟和gydF4y2BaCPgydF4y2Ba- 使用bowtie2与默认参数的偏标参考序列对齐,吞读读取[gydF4y2Ba84.gydF4y2Ba].使用samtools对齐文件以二进制格式转换(命令:查看-b)[gydF4y2Ba85.gydF4y2Ba]并使用低映射质量(选项:查看-b -Q 5)和PCR复制(选项:RMDUP)读取[gydF4y2Ba53.gydF4y2Ba百分比对齐结果在附加文件中提供gydF4y2Ba1gydF4y2Ba(表S1)。所有文库中除去的读数的平均比例为0.0093%。gydF4y2Ba
相互对应检查gydF4y2Ba
由于管道涉及小麦IWGSC Refseq V1的合并gydF4y2BaC. purpureagydF4y2BacDNA的参考(ENSEMBL释放35)序列我们检查是否有相互映射的小麦和之间读取gydF4y2BaC. purpureagydF4y2Ba转录om。我们映射了所有嘲弄接种的小麦样本gydF4y2BaC. purpureagydF4y2Ba参考序列。同样地,我们映射gydF4y2BaC. purpureagydF4y2Ba读(只有两名分子的两位代表,也是两位媒体成长的代表gydF4y2BaC. purpureagydF4y2Ba菌丝体)到小麦转录组的参考序列。如上所述执行去除低质量读取和映射。除去低质量读取和PCR复制后,我们计算了小麦读取映射的百分比对准gydF4y2BaC. purpureagydF4y2Ba转录组和gydF4y2BaC. purpureagydF4y2Ba读取到小麦转录组参考序列的映射。gydF4y2Ba
未映射的从头组装gydF4y2Baclaviceps purpureagydF4y2Ba读取gydF4y2Ba
读取映射到联合小麦-的百分比对齐gydF4y2BaC. purpureagydF4y2Ba参考转录组在5D和7D时间点下降,我们推测这是由于缺乏覆盖gydF4y2BaC. purpureagydF4y2BacDNA(Ensembl发布35)参考转录组。生成A.gydF4y2BaC. purpureagydF4y2Ba参考转录物更适合于本研究中使用的孤立物种,我们使用Trinity进行了De Novo组件。从未渗透读取gydF4y2BaC. purpureagydF4y2BaConidia(2代表)和gydF4y2BaC. purpureagydF4y2Ba在人工媒体(3次代表)库上成长为映射到gydF4y2BaC. purpureagydF4y2BacDNA(Ensembl发布35)转录组参考。使用samtools提取未映射的读取(命令:查看-b -f 4)。使用GATK标记并删除读取重复项(选项:MarkDuplicates [gydF4y2Ba86.gydF4y2Ba];和prinseq(选项:derep)[gydF4y2Ba87.gydF4y2Ba] 分别。这旨在减少内存空间并提高计算速度。这导致1.33米以FASTQ格式读取。三位一体用于使用相当于25的默认库长度执行de novo程序集(选项:--bflyheapspacemax -bflyheapspaceinit -bflycalculatecpu)。在组装之后,使用基于Web的ORF预测器进行了没有预测开放阅读框(ORF)的Contigs [gydF4y2Ba88.gydF4y2Ba].gydF4y2BaC. purpureagydF4y2BacDNA (Ensembl release 35)与新组装的参考文献合并,形成一个新的gydF4y2BaC. purpureagydF4y2Ba转录组的引用。读取所有麦子 -gydF4y2BaC. purpureagydF4y2Ba库被重新映射到合并小麦IWGSC以RefSeq v1和新gydF4y2BaC. purpureagydF4y2Ba转录组的引用。gydF4y2Ba
读数量化和差异基因表达分析gydF4y2Ba
使用Salmon的基于对齐模式(参数:--biaScorrect -SeErrormodel)来执行对准BAM文件中包含的读数的量化[gydF4y2Ba89gydF4y2Ba].提取了Salmon生成的注释名称和读取列的数量,并使用R(在Linux中)创建了一个计数数据矩阵。删除读取计数低的行(R命令:rowsum (CD@data) > ncol (CD)),以减少对象大小并提高计算速度。在去除近零读计数或低表达异构体之前和之后创建直方图,以评估数据集的分布曲线。gydF4y2Ba
要对库尺寸进行标准化数据集,使用M值(TMM)的BaySeq修剪平均值计算库缩放因子[gydF4y2Ba90gydF4y2Ba].ma图(其中m是日志表达式值的差异,a是平均值[gydF4y2Ba91gydF4y2Ba];被创建并用于确定标准化过程是否足够就库规模充足。黄土回归曲线[gydF4y2Ba92gydF4y2Ba,以确定归一化步骤是否使MA图居中。gydF4y2Ba
成对,交叉条件差异基因表达分析gydF4y2BaCP-gydF4y2Ba和模拟接种的样品使用baySeq [进行gydF4y2Ba93gydF4y2Ba,gydF4y2Ba94gydF4y2Ba,gydF4y2Ba95gydF4y2Ba].计算通过时间点样品计算每个组织的所有复制的平均归一化读数,递增1,以避免随后分析中的0分母。通过除去平均归一化计数来获得表达比gydF4y2BaCPgydF4y2Ba-在模拟接种样品(处理/控制或T/C)上,生成log (base 2)比率或fold changes (FC)。基因被认为在统计学上有差异表达gydF4y2BaCP-gydF4y2BaFC≥2(或|log)时,进行模拟接种处理gydF4y2Ba2gydF4y2BaFC|≥1),错误发现率(FDR)gydF4y2BapgydF4y2Ba-value校正< 0.05,显示绝对差值> 10 [gydF4y2Ba96gydF4y2Ba].gydF4y2Ba
使用R制作定制的热图和箱线图,以可视化跨组织和时间点的基因表达。拟合的回归线被叠加到箱线图上,以便于解释基因在不同时间的表达模式。gydF4y2Ba
差异表达基因的注释gydF4y2Ba
在一个或多个时间点上,在柱头、传递或基底组织中发现差异表达的基因被Blast2go (gydF4y2Bahttp://www.blast2go.com/b2ghome.gydF4y2Ba).对于功能性注释,基因对准国家生物技术信息(NCBI)NR蛋白质数据库的国家。BLASTX功能用于搜索针对瑞士 - PROM蛋白数据库的基因序列,在1E时用电子值截止设定gydF4y2Ba- 5gydF4y2Ba.基于顶级BLASTX命中的基因名称分配,具有最高的相似度分数。进一步,根据注释期间已分配给他们的名称,进一步手动探索与激素途径,防御和光合作用相关的基因。通过手动搜索科学文献数据库来调查这些潜在感兴趣的潜在基因的功能。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
在当前研究期间生成和分析的数据集可在ArrayExpress,登录号E-MTAB-9799处获得。gydF4y2Bahttp://www.ebi.ac.uk/arrayexpress/help/faq.html#cite.gydF4y2Ba).gydF4y2Ba
缩写gydF4y2Ba
- ACO:gydF4y2Ba
-
1-氨基环丙烷-1-羧酸氧化酶gydF4y2Ba
- ACS:gydF4y2Ba
-
1-氨基环丙烷-1-羧酸合酶gydF4y2Ba
- AOS:gydF4y2Ba
-
丙二烯氧化氮合酶gydF4y2Ba
- AUX / IAA:gydF4y2Ba
-
生长素/ indole-3-acetic酸gydF4y2Ba
- 中正:gydF4y2Ba
-
cytokinins.gydF4y2Ba
- ckx:gydF4y2Ba
-
细胞蛋白氧化酶/脱氢酶gydF4y2Ba
- COI1:gydF4y2Ba
-
冠菌素不敏感1gydF4y2Ba
- CRK:gydF4y2Ba
-
Cysteine-rich受体激酶gydF4y2Ba
- 度:gydF4y2Ba
-
差异表达基因gydF4y2Ba
- ERF:gydF4y2Ba
-
乙烯反应转录因子gydF4y2Ba
- 等:gydF4y2Ba
-
乙烯gydF4y2Ba
- ets:gydF4y2Ba
-
效应触发抑制gydF4y2Ba
- FHB:gydF4y2Ba
-
镰刀菌长枯萎gydF4y2Ba
- 遗传算法:gydF4y2Ba
-
赤霉酸gydF4y2Ba
- Ga2ox:gydF4y2Ba
-
Gibberellin 2-β-氧化酶gydF4y2Ba
- GID1:gydF4y2Ba
-
GIBBERELLIN-INSENSITIVE矮人1gydF4y2Ba
- GH3:gydF4y2Ba
-
糖苷水解酶3.gydF4y2Ba
- HIN1:gydF4y2Ba
-
Harpin诱导蛋白1gydF4y2Ba
- HSP40S:gydF4y2Ba
-
热休克蛋白的40gydF4y2Ba
- IAA:gydF4y2Ba
-
Indole-3-acetic酸gydF4y2Ba
- JA:gydF4y2Ba
-
茉莉酸gydF4y2Ba
- Jaz1:gydF4y2Ba
-
Jasmonate-zim-domain蛋白1gydF4y2Ba
- LECRK:gydF4y2Ba
-
凝集素受体激酶gydF4y2Ba
- MAPK:gydF4y2Ba
-
促丝糖型活化蛋白激酶gydF4y2Ba
- NBS-LRR:gydF4y2Ba
-
核苷酸结合位点富亮氨酸重复序列gydF4y2Ba
- NPR3:gydF4y2Ba
-
NON-EXPRESSOR PR3的gydF4y2Ba
- 超载比:gydF4y2Ba
-
12 Oxophytodienoate还原酶gydF4y2Ba
- pamp:gydF4y2Ba
-
病原体相关的分子模式gydF4y2Ba
- PTI:gydF4y2Ba
-
PAMP-Triggered免疫力gydF4y2Ba
- QTL:gydF4y2Ba
-
定量特质基因座gydF4y2Ba
- ROS:gydF4y2Ba
-
反应性氧气gydF4y2Ba
- RPK:gydF4y2Ba
-
受体蛋白激酶gydF4y2Ba
- 山:gydF4y2Ba
-
水杨酸gydF4y2Ba
- SAR:gydF4y2Ba
-
系统获得性耐药gydF4y2Ba
- 阿富汗二月:gydF4y2Ba
-
小型助流度rnasgydF4y2Ba
- SLP:gydF4y2Ba
-
枯草杆菌蛋白酶样蛋白酶gydF4y2Ba
- STK:gydF4y2Ba
-
丝氨酸/苏氨酸激酶gydF4y2Ba
参考gydF4y2Ba
- 1。gydF4y2Ba
Tudzynski P,Scheffer J.gydF4y2Baclaviceps purpureagydF4y2Ba:一种独特的致病生活方式的分子方面。莫尔植物途径。2004; 5(5):377-88。gydF4y2Bahttps://doi.org/10.1111/j.1364-3703.2004.00237.xgydF4y2Ba.gydF4y2Ba
- 2。gydF4y2Ba
Menzies JG,Turkington TK。ergot的概述(gydF4y2Baclaviceps purpureagydF4y2Ba)在加拿大西部问题:挑战和解决方案。可以j植物pathol。2015; 37:40-51。gydF4y2Bahttps://doi.org/10.1080/07060gydF4y2Ba661.2014.98652 7。gydF4y2Ba
- 3.gydF4y2Ba
陈志强,陈志强,陈志强,等。麦角生物碱的生物化学研究进展。生物技术与应用。2001;57(5-6):593-605。gydF4y2Bahttps://doi.org/10.1007/s002530100801gydF4y2Ba.gydF4y2Ba
- 4。gydF4y2Ba
Beuerle T,本福德d,布里默L,Cottrill B,Doerge d,Dusemund B,等人。上在食物链(CONTAM)污染物EFSA面板。关于食品和饲料中麦角碱的科学观点。EFSA J. 2012; 10:2798-956。gydF4y2Bahttps://doi.org/10.2903/j.efsa.2012.2798gydF4y2Ba.gydF4y2Ba
- 5。gydF4y2Ba
Byrd N,Slaiding IR,AHDB项目报告No.578最终项目报告:在麦芽,碾磨和动物饲料中使用的英国谷物中的霉菌毒素和其他污染物的监测。2017年。gydF4y2Bahttps://ahdb.org.uk/final-project-report-contaminants-onitoring-150517gydF4y2Ba.访问2020年2月6日。gydF4y2Ba
- 6。gydF4y2Ba
麦克唐纳德SJ,安德森WAC,AHDB项目报告No.575 A.一种办公室研究,用于审查目前关于麦木生物碱的知识及其对谷物污染的潜力。2017年。gydF4y2Bahttps://ahdb.org.uk/a-desk-study-to-review-current-knowledge-on-ergot-alloids-and-their-potential-for-contamination-togectectian-grains.gydF4y2Ba.访问2020年2月6日。gydF4y2Ba
- 7。gydF4y2Ba
谢尔比RA。农业中麦角生物碱的毒理学研究。在:Kren V, Cvak L,编辑。麦角毒理学。阿姆斯特丹:海外出版商协会;1999. p。46.9–77.
- 8。gydF4y2Ba
De Costa C. St Anthony的火灾和生活韧皮:ergometrine的短暂历史。柳叶刀。2002; 359(9319):1768-70。gydF4y2Bahttps://doi.org/10.1016/s0140 - 6736 (02) 08658 - 0gydF4y2Ba.gydF4y2Ba
- 9.gydF4y2Ba
Gordon A, Delamare G, Tente, Boyd LAgydF4y2Ba.gydF4y2Ba确定谷粒中麦角生物碱的传播途径。AHDB项目报告603. 2019年。gydF4y2Bahttps://cereals.ahdb.org.uk/media/1479196/pr603-final-project-report.pdf.gydF4y2Ba.gydF4y2Ba
- 10。gydF4y2Ba
Mette MF,Gils M,Longin FH,Reif Jc。小麦的杂种繁殖。在:小麦遗传学的进展:从基因组到田。Ed Ogihara,Y.等,2015. Doi:gydF4y2Bahttps://doi.org/10.1007/978-4-431-55675-6_24gydF4y2Ba
- 11.gydF4y2Ba
Tenberge K,Tudzynski P.早期感染黑麦卵巢gydF4y2Baclaviceps purpureagydF4y2Ba是国际米兰和细胞内。BioEng Sondernr。1994;十。gydF4y2Ba
- 12.gydF4y2Ba
tenberge kb。ergot-克拉夫米斯属。在:Kven C,编辑器。麦格特真菌的生物学与生命策略。荷兰:哈伍德学术出版商;1999. p。25-56。gydF4y2Ba
- 13。gydF4y2Ba
天鹅dj,地幔pg。小麦和急性坏死宿主反应克拉夫米斯紫癜菌株之间的寄生相互作用。Mycol Res。1991; 95(7):807-10。gydF4y2Bahttps://doi.org/10.1016/s0953 - 7562 (09) 80042 - 7gydF4y2Ba.gydF4y2Ba
- 14。gydF4y2Ba
De Jonge R,Van Esse HP,Kombrink A,Shinya T,Desaki Y,Bours R等。保守的真菌Lysm效应器ECP6可防止植物中的甲藻触发的免疫力。科学。2010; 329(5994):953-5。gydF4y2Bahttps://doi.org/10.1126/science.1190859gydF4y2Ba.gydF4y2Ba
- 15。gydF4y2Ba
黄志强,王志强,王志强,等。植物激素途径与病原菌效应的关系。植物细胞,2014,26(6):2285 - 309。gydF4y2Bahttps://doi.org/10.1105/tpc.114.125419gydF4y2Ba.gydF4y2Ba
- 16。gydF4y2Ba
琼斯JDG,Dangl JL。植物免疫系统。自然。2006; 444(7117):323-9。gydF4y2Bahttps://doi.org/10.1038/nature05286gydF4y2Ba.gydF4y2Ba
- 17。gydF4y2Ba
Dodds PN, Rathjen JP。植物免疫:植物-病原体相互作用的综合观点。[j] .地理科学进展,2010,27(8):539-48。gydF4y2Bahttps://doi.org/10.1038/nrg2812.gydF4y2Ba.gydF4y2Ba
- 18。gydF4y2Ba
奥伊尔格姆T,Somssich IE。在防御信号WRKY转录因子网络。CurrOp植物BIOL。2007; 10(4):366-71。gydF4y2Bahttps://doi.org/10.1016/j.pbi.2007.04.020gydF4y2Ba.gydF4y2Ba
- 19.gydF4y2Ba
格兰特M,羊肉C.全身免疫力。CurrOp植物BIOL。2006; 9(4):414-20。gydF4y2Bahttps://doi.org/10.1016/j.pbi.2006.05.013gydF4y2Ba.gydF4y2Ba
- 20.gydF4y2Ba
Kunkel BN,Brooks DM。在病原体防御中信号通路之间的跨谈。CurrOp植物BIOL。2002; 5(4):325-31。gydF4y2Bahttps://doi.org/10.1016/s1369 - 5266 (02) 00275 - 3gydF4y2Ba.gydF4y2Ba
- 21.gydF4y2Ba
丁x,cao y,huang l,zhao j,xu c,li x等。吲哚-3-乙酸-AMIDO合成酶GH3-8的活化抑制了扩张素表达并促进水稻中的水杨酸盐和淫秽的基础免疫力。植物细胞。2008; 20(1):228-40。gydF4y2Bahttps://doi.org/10.1105/tpc.107.055657gydF4y2Ba.gydF4y2Ba
- 22。gydF4y2Ba
等。della通过调节茉莉酸和水杨酸信号的平衡来控制植物的免疫应答。咕咕叫医学杂志。2008;18(9):650 - 5。gydF4y2Bahttps://doi.org/10.1016/j.cub.2008.03.060gydF4y2Ba.gydF4y2Ba
- 23。gydF4y2Ba
侯X,李莱克,夏k,yan y,yu h. dellas通过竞争对手的竞争绑定调节Jasmonate信号传导。发育细胞。2010; 19(6):884-94。gydF4y2Ba
- 24。gydF4y2Ba
Tanaka N,Matsuoka M,Kitano H,Asano T,Kaku H,Komatsu S. GID1,嗜酸盐素不敏感的矮种突变体,响应于冷应激和病原体发作,改变了探针诱导蛋白(PBZ1)的调节。植物细胞环境。2006; 29(4):619-31。gydF4y2Bahttps://doi.org/10.1111/j.1365-3040.2005.01441.x.gydF4y2Ba.gydF4y2Ba
- 25。gydF4y2Ba
关键词:赤霉素20氧化酶基因OsGA20ox3,水稻,株高,病害植物与微生物学报。2013;26(2):227-39。gydF4y2Bahttps://doi.org/10.1094/MPMI-05-12-0138-RgydF4y2Ba.gydF4y2Ba
- 26.gydF4y2Ba
杨F,Li W,JørgensenHJ。小麦的转录重新编程和血尿病病原体gydF4y2BaSeptoria triticigydF4y2Ba在兼容相互作用的两个阶段。Plos一个。2013; 8(11):E81606。gydF4y2Bahttps://doi.org/10.1371/journal.pone.0081606gydF4y2Ba.gydF4y2Ba
- 27.gydF4y2Ba
Rudd JJ,Kanyuka K,Hassani-Pak K,Derbyshire M,Andongabo A,Devonshire J,等。小麦唑虫病细胞感染循环的转录组和代谢物分析揭示了涉及鉴别病原体染色体贡献的植物免疫的双相相互作用和血统营养生活方式定义的变异。植物理性。2015; 167(3):1158-85。gydF4y2Bahttps://doi.org/10.1104/pp.114.255927gydF4y2Ba.gydF4y2Ba
- 28.gydF4y2Ba
Foroud N, Ouellet T, Laroche A, Oosterveen B, Jordan M, Ellis B,等。3个小麦基因型的差异转录组分析揭示了不同的宿主反应途径与镰刀菌枯萎病和抗孢粉。植物病理学研究。2012;61(2):296 - 314。gydF4y2Bahttps://doi.org/10.1111/j.1365-3059.2011.02512.x.gydF4y2Ba.gydF4y2Ba
- 29。gydF4y2Ba
张辉,杨勇,王超,刘敏,李辉,傅艳,等。大规模转录组比较揭示了小麦对条锈病和白粉病响应的独特基因激活。BMC基因组学,2014;15(1):898。gydF4y2Bahttps://doi.org/10.1186/1471-2164-15-898gydF4y2Ba.gydF4y2Ba
- 30.gydF4y2Ba
国际小麦基因组测序联盟(IWGSC)等。科学。2018; 17(361):eaar7191。gydF4y2Bahttps://doi.org/10.1126/science.aar7191gydF4y2Ba可在线获取:gydF4y2Bahttps://wheat- urgi.versailles.inra.fr/gydF4y2Ba.gydF4y2Ba
- 31。gydF4y2Ba
Tominaga M,ITO K.细胞质流媒体的分子机制和生理作用。CurrOp植物BIOL。2015; 27(10):104-10。gydF4y2Bahttps://doi.org/10.1016/j.pbi.2015.06.017gydF4y2Ba.gydF4y2Ba
- 32。gydF4y2Ba
蛋白质的凯尔奇重复超家族:细胞功能的推进器。细胞生物学杂志。2000;10(1):17-24。gydF4y2Bahttps://doi.org/10.1016/s0962-8924(99)01673-6gydF4y2Ba.gydF4y2Ba
- 33。gydF4y2Ba
Liu J,Whitham S.含大豆核局部型-III DNAJ域的HSP40的过表达揭示了其在细胞死亡和抗病性中的作用。植物J. 2013; 74(1):110-21。gydF4y2Bahttps://doi.org/10.1111/tpj.12108gydF4y2Ba.gydF4y2Ba
- 34。gydF4y2Ba
EssmannĴ,施米茨-汤姆I,舍恩H,Sonnewald S,韦斯E,细胞壁的Scharte J. RNA干扰介导的抑制在转化的烟草叶源防御也妨碍。植物理性。2008; 147(3):1288至1299年。gydF4y2Bahttps://doi.org/10.1104/pp.108.121418gydF4y2Ba.gydF4y2Ba
- 35。gydF4y2Ba
植物生长素信号。植物生理学报,2018;37(1):1 - 8。gydF4y2Bahttps://doi.org/10.1104/pp.17.00765gydF4y2Ba.gydF4y2Ba
- 36。gydF4y2Ba
杨SF,霍夫曼网站。乙烯生物合成及其在高等植物中的调控。Annu Rev植物理性。1984; 35(1):155-89。gydF4y2Bahttps://doi.org/10.1146/annurev.pp.35.060184.001103gydF4y2Ba.gydF4y2Ba
- 37。gydF4y2Ba
Stepanova A,Alonso JM。乙烯信号和响应途径:具有多种输入和输出的独特信号级联。physiol植物。2005; 123(2):195-206。gydF4y2Bahttps://doi.org/10.1111/j.1399-3054.2005.00447.xgydF4y2Ba.gydF4y2Ba
- 38。gydF4y2Ba
王j,ma xm,kojima m,sakakibara h,hou bk。N-葡萄糖基转移酶UGT76C2涉及拟南芥拟南芥中的细胞肝素稳态和细胞蛋白反应。植物细胞生理。2011; 52(12):2200-13。gydF4y2Bahttps://doi.org/10.1093/pcp/pcr152gydF4y2Ba.gydF4y2Ba
- 39。gydF4y2Ba
田志强,田志强,田志强,等。通过细胞分裂素激活酶直接控制茎分生组织的活性。大自然。2007;445(7128):652 - 5。gydF4y2Bahttps://doi.org/10.1038/nature05504gydF4y2Ba.gydF4y2Ba
- 40。gydF4y2Ba
舰队CM, Sun TP。赤霉素在植物形态发生中的作用。植物学报。2005;8(1):77-85。gydF4y2Bahttps://doi.org/10.1016/j.pbi.2004.11.015gydF4y2Ba.gydF4y2Ba
- 41。gydF4y2Ba
Hirano K,Ueguchi-Tanaka M,Matsuoka M. Gid1介导的植物中的吉布林素信号传导。趋势植物SCI。2008; 13(4):192-9。gydF4y2Bahttps://doi.org/10.1016/j.tplants.2008.02.005gydF4y2Ba.gydF4y2Ba
- 42。gydF4y2Ba
Katsir L, Schilmiller AL, Staswick PE, He SY, Howe GA。COI1是茉莉酸盐受体和细菌毒力因子冠状嘌呤的关键成分。中国科学院院刊。2008;105(19):7100-5。gydF4y2Bahttps://doi.org/10.1073/pnas.0802332105gydF4y2Ba.gydF4y2Ba
- 43.gydF4y2Ba
白益,孟Y,黄D,齐Y,陈M.植物特异性趋势转录因子家族的起源及进化分析。基因组学。2011; 98(2):128-36。gydF4y2Bahttps://doi.org/10.1016/j.ygeno.2011.05.002gydF4y2Ba.gydF4y2Ba
- 44.gydF4y2Ba
格兰特M,Brown I,Adams S,Knight M,Ainslie A,Mansfield J.该gydF4y2BaRPM1.gydF4y2Ba植物疾病抗性基因促进氧化突发和过敏细胞死亡所需的细胞溶质钙的快速和持续增加。工厂J. 2001; 23(4):441-50。gydF4y2Bahttps://doi.org/10.1046/j.1365-313x.2000.00804.x.gydF4y2Ba.gydF4y2Ba
- 45.gydF4y2Ba
afzal aj,木头aj,lightfoot da。植物受体样丝氨酸苏氨酸激酶:信号传导和植物防御中的作用。Mol植物微生物相互作用。2008; 21(5):507-17。gydF4y2Bahttps://doi.org/10.1094/MPMI-21-5-0507gydF4y2Ba.gydF4y2Ba
- 46。gydF4y2Ba
Pinot F,Beisson F.细胞色素P450在植物中代谢脂肪酸:表征和生理作用。FEBS J.2011; 278(2):195-205。gydF4y2Bahttps://doi.org/10.1111/j.1742-4658.2010.07948.xgydF4y2Ba.gydF4y2Ba
- 47。gydF4y2Ba
植物几丁质酶的调控和功能。细胞生物学杂志。2003;8(3):809-24。gydF4y2Ba12949620.gydF4y2Ba.gydF4y2Ba
- 48。gydF4y2Ba
Pecenkova T,Hala M,Kulich I,Kocourkova D,Drdova E,Fendrych M等。ExoCyst复合亚基EXO70B2和EXO70H1在植物 - 病原体相互作用中的作用。J Exp Bot。2011; 62(6):2107-16。gydF4y2Bahttps://doi.org/10.1093/jxb/erq402gydF4y2Ba.gydF4y2Ba
- 49。gydF4y2Ba
Kim M, Ahn JW, Jin UH, Choi D, Paek KH, Pai HS。通过抑制蛋白酶体功能激活植物细胞程序性死亡途径。中国生物医学工程学报。2003;27(2):241 - 241。gydF4y2Bahttps://doi.org/10.1074/jbc.M210539200gydF4y2Ba.gydF4y2Ba
- 50.gydF4y2Ba
植物病原学研究进展[j]。植物科学学报。2014;5:739。gydF4y2Ba
- 51.gydF4y2Ba
Vartapetian AB,Tuzhikov Ai,Chichkova NV,Taliansky M,Wolpert TJ。一种植物替代动物的木质酶:枯草杆菌蛋白酶样蛋白酶。细胞死亡分化。2011; 18(8):1289-97。gydF4y2Bahttps://doi.org/10.1038/cdd.2011.49gydF4y2Ba.gydF4y2Ba
- 52.gydF4y2Ba
Pieterse CM,范德不d,Zamioudis C,莱昂,雷耶斯A,凡Wees SC。植物免疫的激素调制。Annu启细胞发育生物学。2012; 28(1):489-521。gydF4y2Bahttps://doi.org/10.1146/annurev-cellbio-092910-154055gydF4y2Ba.gydF4y2Ba
- 53。gydF4y2Ba
黄志强,王志强,王志强,等。黑麦黑腐病菌与紫癜性黑腐病菌的互作研究。BMC基因组学。2017;18(1):273。gydF4y2Bahttps://doi.org/10.1186/s12864-017-3619-4gydF4y2Ba.gydF4y2Ba
- 54。gydF4y2Ba
同类,Schurack S,Hinsch J,Tudzynski P.gydF4y2BaBrachypodium distachyongydF4y2Ba作为Ergot真菌的替代模型主机系统gydF4y2Baclaviceps purpureagydF4y2Ba.莫尔植物途径。2018; 19(4):1005-11。gydF4y2Bahttps://doi.org/10.1111/mpp.12563gydF4y2Ba.gydF4y2Ba
- 55。gydF4y2Ba
张Z,李琦,李Z,Staswick Pe,Wang M,Zhu Y等。双重法规的GH3作用。5在拟南芥 - 假单胞菌中的水杨酸和生长素信号传导。植物理性。2007; 145(2):450-64。gydF4y2Bahttps://doi.org/10.1104/pp.107.106021gydF4y2Ba.gydF4y2Ba
- 56。gydF4y2Ba
傅ZQ,燕S,Saleh A,Wang W,Ruble J,Oka N等。NPR3和NPR4是植物中免疫信号水杨酸的受体。自然。2012; 486(7402):228-32。gydF4y2Bahttps://doi.org/10.1038/nature11162gydF4y2Ba.gydF4y2Ba
- 57。gydF4y2Ba
Bari R, Jones JD。植物激素在植物防御反应中的作用。acta botanica sinica(云南植物学报),2009;gydF4y2Bahttps://doi.org/10.1007/s11103-008-9435-0gydF4y2Ba.gydF4y2Ba
- 58。gydF4y2Ba
王D,Pajerowska-Mukhtar K,Culler Ah,Dong X.水杨酸通过抑制植物毒素信号通路抑制植物的病原体生长。Curr Biol。2007; 17(20):1784-90。gydF4y2Bahttps://doi.org/10.1016/j.cub.2007.09.025gydF4y2Ba.gydF4y2Ba
- 59。gydF4y2Ba
小伟宁,郑志勇,冯永刚,郭文忠,王学勇。的gydF4y2Ba镰刀菌素graminearumgydF4y2Ba毒力因子FGL靶向小麦的FKBP12免疫蛋白。基因。2013; 525(1):77-83。gydF4y2Bahttps://doi.org/10.1016/j.gene.2013.04.052gydF4y2Ba.gydF4y2Ba
- 60。gydF4y2Ba
丁L,徐H,易H,杨L,KONG Z,Zhang L等。对半衰期的抵抗力gydF4y2BaF. Graminearum.gydF4y2Ba感染与多种防御信号通路的协调有序表达有关。《公共科学图书馆•综合》。2011;6 (4):e19008。gydF4y2Bahttps://doi.org/10.1371/journal.pone.0019008gydF4y2Ba.gydF4y2Ba
- 61。gydF4y2Ba
Iwai T,Miyasaka A,Seo S,Ohashi Y.乙烯生物合成对幼儿植物抗菌性感染抗性的贡献。植物理性。2006; 142(3):1202-15。gydF4y2Bahttps://doi.org/10.1104/pp.106.085258gydF4y2Ba.gydF4y2Ba
- 62。gydF4y2Ba
CatinotĴ,黄JB,黄PY,曾MY,陈YL,顾SY等。乙烯反应因子96正调节到死体营养病原体拟南芥电阻通过直接结合的茉莉酮酸酯和乙烯 - 响应防御基因GCC元件。植物细胞环境。2015; 38(12):2721-34。gydF4y2Bahttps://doi.org/10.1111/pce.12583gydF4y2Ba.gydF4y2Ba
- 63。gydF4y2Ba
乙烯响应因子- 1在拟南芥中的组成性表达对几种坏死营养真菌具有抗性。植物j . 2002; 29(1): 23-32。gydF4y2Bahttps://doi.org/10.1046/j.1365-313x.2002.01191.xgydF4y2Ba.gydF4y2Ba
- 64。gydF4y2Ba
生物营养与坏死营养病原体防御机制的比较。植物病理学杂志。2005;43(1):205-27。gydF4y2Bahttps://doi.org/10.1146/annurev.phyto.43.040204.135923gydF4y2Ba.gydF4y2Ba
- 65。gydF4y2Ba
murr LA, Kenton P, Atzorn R, Miersch O, Wasternack C.浓度特异性相互作用的结果,水杨酸和茉莉酸信号包括协同、拮抗和氧化应激导致细胞死亡。植物杂志。2006;140(1):249 - 62。gydF4y2Bahttps://doi.org/10.1104/pp.105.072348gydF4y2Ba.gydF4y2Ba
- 66。gydF4y2Ba
SchmüllingT,Werner T,Riefler M,KrupkováE,Manns IB。玉米,水稻,拟南芥和其他物种细胞素蛋白氧化酶/脱氢酶基因的结构和功能。j植物res。2003; 116(3):241-52。gydF4y2Bahttps://doi.org/10.1007/s10265-003-0096-4gydF4y2Ba.gydF4y2Ba
- 67.gydF4y2Ba
王志强,王志强,王志强,等。植物细胞分裂素的合成及其在生物营养真菌中的应用。环境Microbiol。2015;17(8):2935 - 51。gydF4y2Bahttps://doi.org/10.1111/1462-2920.12838gydF4y2Ba.gydF4y2Ba
- 68.gydF4y2Ba
Chanclud E,Kisiala A,Emery NR,Chalvon V,Ducasse A,Romiti-Michel C,等。水稻毒素的细胞蛋白产生是全面毒力的关键要求。Plos病原体。2016; 12(2):E1005457。gydF4y2Bahttps://doi.org/10.1371/journal.ppat.1005457gydF4y2Ba.gydF4y2Ba
- 69.gydF4y2Ba
Gordon A,Basler R,Bansept-Basler P,Fanstone V,Harinarayan L,Grant PK等人。在六倍体小麦中鉴定QTL控制eRGot肠霉菌尺寸的核心致力于rhT矮化等位基因的作用。Al Appl Genet。2015; 128(12):2447-60。gydF4y2Bahttps://doi.org/10.1007/S00122-015-2599-5.gydF4y2Ba.gydF4y2Ba
- 70。gydF4y2Ba
DeYoung BJ, Innes RW。植物NBS-LRR蛋白在病原菌感知和宿主防御中的作用。Nat Immunol。2006;7(12):1243 - 9。gydF4y2Bahttps://doi.org/10.1038/ni1410gydF4y2Ba.gydF4y2Ba
- 71.gydF4y2Ba
loutre c,柳条t,travella s,galli p,scofield s,fahima t等人。在四倍体和六倍体小麦中,LR10介导的叶片耐锈性需要两种不同的CC-NBS-LRR基因。工厂J. 2009; 60(6):1043-54。gydF4y2Bahttps://doi.org/10.1111/j.1365-313X.2009.04024.xgydF4y2Ba.gydF4y2Ba
- 72.gydF4y2Ba
Jayaswall K,Mahajan P,Singh G,Parmar R,Seth R,Raina A等。转录组分析揭示候选茶叶枯萎病的候选基因(Camellia Sinensis(L)Kuntze)。SCI批准。2016; 6(1):30412。gydF4y2Bahttps://doi.org/10.1038/srep30412gydF4y2Ba.gydF4y2Ba
- 73.gydF4y2Ba
谷物中防御反应基因的性质和作用。见:Belanger RR, Bushnell WR,编辑。白粉病:一本综合性的专著。美国明尼苏达州圣保罗:APS出版社;2002.146 - 60页。gydF4y2Ba
- 74.gydF4y2Ba
Collins NC,Thordal-Christensen H,Lipka V,Bau S,Kombrink E,Qiu Jl等。植物细胞壁的陷阱蛋白介导的抗病性。自然。2003; 425(6961):973-7。gydF4y2Bahttps://doi.org/10.1038/nature02076gydF4y2Ba.gydF4y2Ba
- 75.gydF4y2Ba
Pandey SP,SOMSSICH IE。Wrky转录因子在植物免疫中的作用。植物理性。2009; 150(4):1648-55。gydF4y2Bahttps://doi.org/10.1104/pp.109.138990gydF4y2Ba.gydF4y2Ba
- 76.gydF4y2Ba
Ambawat S,Sharma P,Yadav NR,Yadav RC。MYB转录因子基因作为植物响应的调节因子:概述。physiolmol biol植物。2013; 19(3):307-21。gydF4y2Bahttps://doi.org/10.1007/s12298-013-01791.gydF4y2Ba.gydF4y2Ba
- 77。gydF4y2Ba
De Coninck B,Cammue BP,TheVissen K.抗真菌作用和植物防御素的植物函数和防御素样肽的模式。真菌BIOL REV. 2013; 26(4):109-20。gydF4y2Bahttps://doi.org/10.1016/j.fbr.2012.10.002gydF4y2Ba.gydF4y2Ba
- 78。gydF4y2Ba
植物几丁质酶。植物j . 1993; 3(1): 31-40。gydF4y2Bahttps://doi.org/10.1046/j.1365-313X.1993.t01-1-00999.xgydF4y2Ba.gydF4y2Ba
- 79。gydF4y2Ba
戈登A,McCartney的C,诺克斯RE,Ereful N,希尔伯特CW,Konkin DJ,等人。抗性遗传和转录剥离至gydF4y2Baclaviceps purpureagydF4y2Ba在硬粒小麦品种青柄中。中国科学(d辑:地球科学)2020;133(6):1873-86gydF4y2Bahttps://doi.org/10.1007/s00122-020-03561-9gydF4y2Ba.gydF4y2Ba
- 80.gydF4y2Ba
杜伯鲁q B,格兰让O, runion J, Barthelemy J,等。高分辨率的三维组织结构和基因表达的全覆盖成像使研究拟南芥韧皮部的发育和结构成为可能。植物细胞。2008;20(6):1494 - 503。gydF4y2Bahttps://doi.org/10.1105/tpc.107.056069.gydF4y2Ba.gydF4y2Ba
- 81.gydF4y2Ba
Hama H,Kurokawa H,Kawano H,Ando R,Shimogori T,Noda H,等。规模:荧光成像和透明小鼠脑重建的化学方法。Nat Neurosci。2011; 14(11):1481-8。gydF4y2Bahttps://doi.org/10.1038/nn.2928gydF4y2Ba.gydF4y2Ba
- 82。gydF4y2Ba
安德鲁斯S. FastQC:用于高通量序列数据的质量控制工具。2010年可在线获取:gydF4y2Bahttp://www.bioinformatics.babraham.ac.uk/projects/fastqc.gydF4y2Ba.2017年8月17日访问。gydF4y2Ba
- 83。gydF4y2Ba
Gordon A. FASTX-Toolkit: FASTQ/一个短读预处理工具。2009.可在线获取:gydF4y2Bahttp://hannonlab.cshl.edu/fastx_toolkit/gydF4y2Ba.2017年8月17日访问。gydF4y2Ba
- 84。gydF4y2Ba
Langmead B, Salzberg S.快速间隙读取校准与领结2。Nat方法。2012;9(4):357 - 9。gydF4y2Bahttps://doi.org/10.1038/nmeth.1923gydF4y2Ba.gydF4y2Ba
- 85。gydF4y2Ba
Li H, Handsaker B, Wysoker A, Fennell T, Ruan J, Homer N, et al. 1000基因组工程数据处理亚群。序列比对/映射(SAM)格式和sam工具。生物信息学。2009;25(16):2078 - 9。gydF4y2Bahttps://doi.org/10.1093/bioinformatics/btp352gydF4y2Ba.gydF4y2Ba
- 86。gydF4y2Ba
McKenna A,Hanna M,Banks E,Sivachenko A,Cibulskis K,Kernytsky A等人。基因组分析工具包:MapReduce框架,用于分析下一代DNA测序数据。Genome Res。2010; 20(9):1297-303。gydF4y2Bahttps://doi.org/10.1101/gr.107524.110gydF4y2Ba.gydF4y2Ba
- 87。gydF4y2Ba
宏基因组数据集的质量控制和预处理。生物信息学。2011;27(6):863 - 4。gydF4y2Bahttps://doi.org/10.1093/bioinformatics/btr026gydF4y2Ba.gydF4y2Ba
- 88。gydF4y2Ba
Min XJ,Butler G,Storm r,Tsang A. Orfpredictor:预测EST衍生序列中的蛋白质编码区。核酸RES。2005; Web服务器问题:W677-80gydF4y2Bahttp://bioinformatics.ysu.edu/tools/orfpredictor.html.gydF4y2Ba.gydF4y2Ba
- 89。gydF4y2Ba
Patro R,Duggal G,洛夫MI,Irizarry RA,金斯福德C.鲑鱼提供了快速和转录物表达的偏压感知定量。NAT方法。2017; 14(4):417-9。gydF4y2Bahttps://doi.org/10.1038/nmeth.4197gydF4y2Ba.gydF4y2Ba
- 90。gydF4y2Ba
Robinson MD,OSHlack A.一种缩放标准化方法,用于RNA-SEQ数据的差异表达分析。基因组BIOL方法。2010; 11:R25。gydF4y2Bahttps://doi.org/10.1186/gb-2010-11-3-r25.gydF4y2Ba.gydF4y2Ba
- 91。gydF4y2Ba
Dudoit S,杨YH,卡洛MJ,速度TP。统计方法用于识别与在复制的cDNA微阵列实验差异表达的基因。统计仙。2002; 12(1):111-39。gydF4y2Ba
- 92。gydF4y2Ba
克利夫兰WS,德夫林SJ,格罗斯E.回归由局部拟合。ĴECONOM。1988; 37(1):87-114。gydF4y2Bahttps://doi.org/10.1016/0304 - 4076 (88) 90077 - 2gydF4y2Ba.gydF4y2Ba
- 93。gydF4y2Ba
Hardcastle TJ,Kelly Ka。Bayseq:用于识别序列计数数据中差异表达的经验贝叶斯方法。BMC生物信息学。2010; 11:422。gydF4y2Ba
- 94。gydF4y2Ba
Hardcastle TJ。Bayseq:计数数据中差异表达模式的经验贝叶斯分析(小插图)。2017A。gydF4y2Bahttps://www.bioconductor.org/gydF4y2Ba.2017年8月17日访问。gydF4y2Ba
- 95.gydF4y2Ba
Hardcastle TJ。使用baySeq进行高级分析;通用分布定义(小插图)。2017 b。gydF4y2Bahttps://www.biocumon.org.gydF4y2Ba.2017年8月17日访问。gydF4y2Ba
- 96.gydF4y2Ba
Ÿ的Benjamini,霍赫贝格Y.控制的错误发现率:实用而强大的方式来多次测试。Ĵř统计志丝氨酸乙统计Methodol。1995; 57:289-300。gydF4y2Ba
确认gydF4y2Ba
我们感谢维克·范斯通的帮助gydF4y2BaC. purpureagydF4y2Ba麦花的接种和取样,以及史蒂夫·宾利供应雄性不育小麦线。gydF4y2Ba
资金gydF4y2Ba
该工作得到了生物技术和生物科学研究委员会(BBSRC)和环境食品和农村部门(DECRA)政府伙伴关系奖(BB / GO20418 / 1)的资助,题为“确定组织易感性的早期事件的整合转录组和遗传分析在里面gydF4y2Baclaviceps purpureagydF4y2Ba-小麦相互作用”的DOS和AG。资助机构在研究的设计、数据的收集、分析和解释以及手稿的撰写中没有作用。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
AG进行的所有接种,取样,花组织筹备和RNA提取。PG进行显微镜分析。生物信息学分析,用基因注释外,是由NE进行。ET进行了基因注释和解释RNA测序数据。ACR辅助与图发展。LAB和DOS管理的项目,并作出了数据的解释和稿件的起草作出了重大贡献。所有作者阅读并认可的终稿。gydF4y2Ba
通讯作者gydF4y2Ba
伦理宣言gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版物gydF4y2Ba
不适用。gydF4y2Ba
利益争夺gydF4y2Ba
提交人声明他们没有竞争利益。gydF4y2Ba
附加信息gydF4y2Ba
出版商的注意事项gydF4y2Ba
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:图S1gydF4y2Ba
:10分钟,1小时和24小时的小麦转录物的MA图。随着M = 0(黄色)的对称线绘制黄土曲线(红色/蓝色)。蓝色黄色黄土曲线是在族的平滑曲线设置=“对称”。红色是常规黄色曲线(m〜a)。在一些附图中,仅一个行可见由于两个/所有曲线可以重叠。gydF4y2Ba无花果S2。gydF4y2Ba:MA plots for wheat transcripts at 48 h, 72 h, 5 days, and 7 days. Loess curves (red/blue) were drawn along with the line of symmetry at M = 0 (yellow). The blue Loess curve are smoothened curves set at family = “symmetric”. The red is a regular Loess curve (M ~ A). In some figures, only one line is visible since two/all curves may overlap. To demonstrate the asymmetric distribution of points, MA plots were generated using both wheat (blue arrow) andC. purpureagydF4y2Ba(红色)记录。gydF4y2Ba表S1gydF4y2Ba:对对阵国际小麦基因组测序联盟(IWGSC)小麦品种中国春季的对抗和CP接种库的一对成对读数的对准率从114模拟和CP接种库中读取gydF4y2Ba30.gydF4y2Ba].gydF4y2Ba表S2gydF4y2Ba:所有激素相关基因的表差异在基组织中差异表达。红色代表上调基因和绿色下调基因。阶段的示意图gydF4y2Baclaviceps purpureagydF4y2Ba小麦子房在每个时间点的发育在表的顶部显示。gydF4y2Ba表S3gydF4y2Ba:在透射组织中差异表达的所有激素相关基因的表。红色代表上调基因和绿色下调基因。阶段的示意图gydF4y2Baclaviceps purpureagydF4y2Ba小麦子房在每个时间点的发育在表的顶部显示。gydF4y2Ba表S4gydF4y2Ba:在耻骨组织中差异表达的所有激素相关基因的表。红色代表上调基因和绿色下调基因。阶段的示意图gydF4y2Baclaviceps purpureagydF4y2Ba小麦子房在每个时间点的发育在表的顶部显示。gydF4y2Ba表S5gydF4y2Ba:与耻骨组织中差异表达的所有防御相关基因的表。红色代表上调基因和绿色下调基因。阶段的示意图gydF4y2Baclaviceps purpureagydF4y2Ba小麦子房在每个时间点的发育在表的顶部显示。gydF4y2Ba表S6gydF4y2Ba:差异表达在传递组织中的所有防御相关基因的表。红色代表上调基因和绿色下调基因。阶段的示意图gydF4y2Baclaviceps purpureagydF4y2Ba小麦子房在每个时间点的发育在表的顶部显示。gydF4y2Ba表S7gydF4y2Ba:与基础组织中差异表达的所有防御相关基因表。红色代表上调基因和绿色下调基因。阶段的示意图gydF4y2Baclaviceps purpureagydF4y2Ba小麦子房在每个时间点的发育在表的顶部显示。gydF4y2Ba
附加文件2gydF4y2Ba
在接种后,在时间点1和24小时在耻骨组织中差异表达的小麦基因gydF4y2Baclaviceps purpureagydF4y2Ba.gydF4y2Ba
附加文件3gydF4y2Ba
在接种后的时间点24,48和72h,5和7天在透过组织中差异表达的小麦基因gydF4y2Baclaviceps purpureagydF4y2Ba.gydF4y2Ba
附加文件4gydF4y2Ba
接种后24、48、72 h和5、7 d,小麦基组织中基因表达差异显著gydF4y2Baclaviceps purpureagydF4y2Ba.gydF4y2Ba
附加文件5gydF4y2Ba
不同时间点和组织的激素相关差异表达基因(DEG)的热图。DEG是通过功能分类来定义的:每一幅图显示了与激素相关的基因在接种小麦后差异上调(红色的log2倍变化)或下调(绿色的)gydF4y2Baclaviceps purpureagydF4y2Ba在接种后的24 h (24H)、48 h (48H)、72 h (72H)、5 d (5D)和7 d (7D),小麦子房柱头(S)、传代(T)和基部(B)组织中均表现出明显的差异。图(a)植物素相关的基因((顶部到底部的类别:植物素/吲哚-3-乙酸(Aux / Iaa),糖苷水解酶3(GH3),小型胃引入rnas(saurs))。图(b)乙烯-related genes ((Categories from top to bottom: 1-Aminocyclopropane-1-carboxylate oxidase (ACO), 1-Aminocyclopropane-1-carboxylate synthase (ACS), Ethylene responsive transcription factors (ERF)). Figure (c) Cytokinin-related genes ((Categories from top to bottom: cytokinin riboside 5′-monophosphate phosphoribohydrolase (CK 5′), cytokinin specific glycosyltransferases (CK glyc), cytokinin oxidase/dehydrogenase (CKX)). Figure (d) Gibberellic acid-related genes ((Categories from top to bottom: DELLA, gibberellin 2-beta-oxidase (Gibber 2-beta), GA-INSENSITIVE DWARF1 (GID1)). Figure (e) Jasmonic acid-related genes ((Categories from top to bottom: TIFY transcription factors (TIFY TF), allene oxide synthase (AOS), coronatine-insensitive 1 (COI1), Novel INteractor of JAZ (NINJA), 12-oxophytodienoate reductase (OPR)). Figure (f) Salicylic acid-related genes ((Categories: NON-EXPRESSOR OF PR3 (NPR3)). Traes number refers to the gene annotation provided by the International Wheat Genome Sequencing Consortium (IWGSC) wheat genomic reference from wheat variety Chinese Spring [30.gydF4y2Ba].(PPTX 7966 kb)
附加文件6gydF4y2Ba
跨时间点和组织的防御相关差异表达基因(DEG)的热图。DEG是由功能分类定义的:图中显示了接种了DEG的小麦中与防御相关的基因差异上调(红色的log2倍变化)或下调(绿色的)gydF4y2Baclaviceps purpureagydF4y2Ba在接种后的24 h (24H)、48 h (48H)、72 h (72H)、5 d (5D)和7 d (7D),小麦子房柱头(S)、传代(T)和基部(B)组织中均表现出明显的差异。图(a)NBS-LRR类蛋白(从上到下的功能类别:RGA1,RGA2,RGA3,RPM1,RPP13,RPP8,RPS2,NBS-LRR)。图(b)受体蛋白激酶()功能类别从上到下:CBL相互作用蛋白激酶(CIPK),富含半胱氨酸的受体样激酶(扣),鞭毛蛋白传感2(FLS2),GTP酶活化1,凝集素受体激酶(LECRK),丝裂剂激活激酶(MAPK),丝氨酸/苏氨酸激酶(Stks))。图(c)抗真菌蛋白((从上到下的功能类别:Bowman-Birk型胰蛋白酶抑制剂(BBI),β嘌呤硫菌素,甲壳素Elicitor结合,几丁质酶,细胞色素P450,防御素,富含甘氨酸富蛋白(GRPS),非特异性脂质转移蛋白(NSLTPS),聚乳糖醛酸酶抑制蛋白(PGIP),植物病原蛋白(PPP))。图(D)内吞作用/胞卵症相关蛋白。图(E)转录因子。图(F)编程细胞死亡相关基因((从上到下的功能类别:加速细胞死亡11(ACD11),六酮酶(HXK),Harpin诱导蛋白(Hin1),Metacaspase,多胺氧化酶(PAO),多酚氧化酶(PPO),钾转运蛋白(Pt),枯草杆菌蛋白酶-like蛋白酶(SLP))。特拉次数是指由小麦品种中国春季的国际小麦基因组测序联盟(IWGSC)小麦基因组参考提供的基因注释[gydF4y2Ba30.gydF4y2Ba]。(PPTX 9371 KB)gydF4y2Ba
权利和权限gydF4y2Ba
开放访问gydF4y2Ba本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.Creative Commons公共领域奉献豁免(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文中提供的数据,除非另有用入数据的信用额度。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
泰特,E.,埃雷弗,N.罗德里格斯,acgydF4y2Ba等等。gydF4y2Ba响应感染的小麦转录组重新编程gydF4y2Baclaviceps purpureagydF4y2Ba,麦角菌的致病因子。gydF4y2BaBMC植物BIOL.gydF4y2Ba21,gydF4y2Ba316(2021)。https://doi.org/10.1186/s12870-021-03086-3gydF4y2Ba
已收到gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
迪伊gydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-021-03086-3gydF4y2Ba
关键词gydF4y2Ba
- claviceps purpureagydF4y2Ba
- 麦角gydF4y2Ba
- 真菌病原体gydF4y2Ba
- 小麦gydF4y2Ba
- 小麦gydF4y2Ba