摘要
背景
植物代谢的灵活性通过过胱氨酸残基的后期改性酶的氧化还原调节来支持,特别是在塑性中。这里,半胱氨酸残基的氧化还原态部分与硫氧哌菌素系统部分偶联,部分含有谷胱甘肽库,用于还原。此外,几种参与活性氧(ROS)清除和损伤修复从谷胱甘肽的损伤粘液酶。此外,通过形成与谷胱甘肽的混合二硫化物(含量)可以翻译半胱氨酸残基可以翻译后改性(S-谷胱甘肽化),保护巯基免受进一步氧化,并能影响蛋白质活性。然而,陆生植物质体谷胱甘肽依赖的氧化还原网络的进化和半胱氨酸残基的保护正在进行中S-还不清楚谷胱甘肽化。
结果
我们分析了来自链子藻类的九种代表性模型物种的基因组,并发现属于血液谷胱甘肽依赖性氧化还原网络的抗氧化酶和氧化还原蛋白在很大程度上是保守的,除了Lambda-和密切相关的IOTA-谷胱甘肽S-转移酶。针对谷胱甘肽依赖的氧化还原修饰,我们筛选了文献中的目标巯基S-谷胱甘肽化,发现151个质体蛋白被鉴定为谷胱甘肽化靶点,而确切的半胱氨酸残基仅为17%(26个蛋白),每个蛋白有一个或多个位点,导致37个已知S-谷胱甘肽化位点质体。然而,从绿藻到开花植物的模式物种中,38%(14)的已知位点完全保守,22%(8)的非催化半胱氨酸位点完全保守。其余位点的变量保存表明陆地植物进化过程中同一位置半胱氨酸的独立得失。
结论
我们的结论是,链霉菌质体中谷胱甘肽依赖的氧化还原网络是高度保守的,在清除和损伤修复酶方面具有一定的可变性。我们对半胱氨酸守恒的分析表明S质体中的-谷胱甘肽化作用在氧化还原调节和应激反应中起着重要的作用,但研究不足。
背景
光合真核生物氧化还原调控的重要性
植物进化的根源在于两个主要的内共生事件,第一个导致了第一个真核细胞的形成,第二个产生了光合作用的真核生物[1.].在绿色系(叶绿体纲)中,陆生植物由链植藻类进化而来[2.].在叶绿体中,光合电子传输(PET)链允许通过Calvin-Benson循环(CBC)产生减少的等同物(例如NADPH)和ATP,燃料生物合成燃料。为了平衡光合作用过程,需要对电子磁通的紧张调节来协调光捕获与代谢活动,以及防止广泛的能量或电子转移到氧气,产生可损害DNA,脂质的反应性氧物质(ROS)或蛋白质[3.,4.].新生的ROS和损坏的分子由高容量清除和修复系统寻址,该系统从耦合到基质氧化还原蛋白的NADPH或PET中汲取电子[5.,6.,7.,8.].
为了平衡代谢过程的能量需求,植物细胞具有高度灵活的代谢,可快速切换光合和非光合模式。此外,细胞隔室可以含有有条件或反对活动的代谢酶,时间和空间的调节可能避免代谢物的徒劳的循环[9].这些复杂的调节过程部分是由蛋白质中半胱氨酸硫醇基团的氧化还原状态的改变所介导的,使受细胞内氧化还原状态影响的蛋白质功能和结构的可逆调节成为可能。
氧化还原级联中的电子通量
半胱氨酸硫醇影响蛋白质的结构和活性,因为它们的氧化还原状态可能影响蛋白质的折叠和寡聚、对活性氧的反应性或与氧化还原活性酶活性位点的底物结合[6.,9]. 在这方面,二硫醇/二硫键交换反应在蛋白质调控中起着关键作用。这种氧化还原修饰允许两个电子的可逆转移,这取决于氧化还原敏感蛋白质的相互作用和所涉及的巯基开关的中点电位。许多参与清除活性氧和脂质过氧化物或蛋白质修复的酶含有与氧化还原级联相关的活性位点或调节性半胱氨酸。但是,巯基的反应性(特别是硫酸根离子,−S−)也能促进与氧化剂分子的反应,如过氧化氢(H2.O2.)或自由基一氧化物(•NO)和无衍生的化合物(也称为反应性氮物质,RNS)。这导致通过可逆的硫醇部分氧化(S- - 磺酰化,S- 磺酸水合,S亚硝基化或S-谷胱甘肽化),甚至不可逆修饰(S-磺酰化),可以调节或阻断蛋白质功能[3.].
植物中的氧化还原网络由几种特殊的还原酶组成,这些还原酶将电子转移到含有半胱氨酸的三肽谷胱甘肽(GSH)或硫氧还蛋白(TRX)。在质体中,谷胱甘肽还原酶(GR)依靠NADPH作为电子源来保护高度还原的谷胱甘肽库,而铁氧还蛋白TRX还原酶(FTR)则从光合反应中提取电子来还原TRX。质体还含有一种特殊类型的TRX,即NTRC,它可以通过与TRX模块融合的NTR结构域被NADPH还原[10.,11.].在质体中36个trx调控的蛋白中,trx下游的硫醇开关的特征相对较好[5.而蛋白质组学研究表明,质体中大约有100种可能受trx调节的蛋白质[12.,13.].在叶绿体中,通过Trx依赖性二硫醇/二硫化物交换的氧化还原对照使酶活化通过降低在靶蛋白如CBC酶如CBC酶的靶蛋白上的降低酶活性[6.,14.].TRXs也可以将电子转移到过氧化物清除酶,如2-Cys过氧化物氧化蛋白(PRX) [15.]谷胱甘肽过氧化物酶样蛋白(GPXLs)[16.].因此,质体2-Cys PRX可作为H2.O2.硫醇的清除和氧化作用在一些靶蛋白上起着开关作用,如m- 和F-type trxs [17.,18.,19.]和葡萄糖-6-磷酸脱氢酶[20.].这种氧化还原相互作用分别支持CBC酶的失活和磷酸戊糖氧化途径的第一步的激活,促进质体碳代谢在光到暗过渡的紧密调控,以避免无效循环。
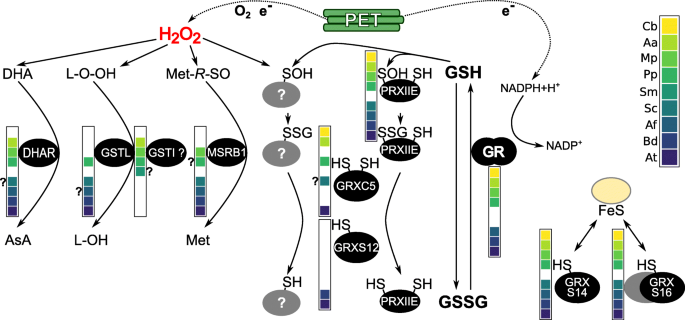
含有GR的细胞室中的谷胱甘肽池被高度还原(≥50,000:1 GSH:GSSG),只剩下nM浓度的谷胱甘肽二硫醚(GSSG)。这导致了高度负的谷胱甘肽氧化还原电位(E谷胱甘肽)范围从− 310至− 360 毫伏[21.,22.,23.].谷胱甘肽在潜在毒性有机亲电试剂的解毒过程中作为还原剂,以及在通过抗坏血酸-谷胱甘肽循环的抗坏血酸再生过程中[24.]. 此外,一些参与ROS清除和损伤修复的酶,如单半胱氨酸(非典型)甲硫氨酸亚砜还原酶B(AtMSRB1),完全依赖GSH还原[25.]而其他如Ⅱ型过氧还蛋白E(PRXIIE)可通过GSH/谷胱甘肽还蛋白(GRXs)再生,再生效率高于TRX[15.,26.].GSH在MSRB1和PRXIIE活性中的作用依赖于其对催化循环中形成的磺酰化活性位点半胱氨酸的亲核攻击。这种自发反应导致了混合二硫化物的形成。S-谷胱甘肽化)是由属于TRX超家族的grx酶具体控制的[27.].GRXs催化谷胱甘肽部分的去除(即去谷胱甘肽化),允许以谷胱甘肽作为电子供体的机制再生为还原酶和活性酶。因此,在局部ROS水平、局部解毒系统、谷胱甘肽氧化还原电位和蛋白质之间存在着一种未知的生物学意义上的相互关系S- 乙醇化酶。
TRX和GSH / GRX系统之间的串扰已被证明拟南芥在线粒体中缺乏细胞质GR1或GR2的突变体,在这些突变体中,TRX系统可以作为局部控制各自隔间中GSSG积累的备份系统[28.,29.].反之亦然,TRX氧化还原状态可以链接到GSH / GRX系统,因为Cytosolic TRX氧化还原状态可以通过谷胱甘肽系统救出[30.],以及一些trxs,如F-类型trx是S-glutathionylation目标(31].然而,研究答:芥和Physcomitrium(原Physcomitrella[32])金属盘已经证明TRX系统不能补偿质体中受到干扰的GSH/GRX系统[29.,33],提出了基质中氧化还原级联组织和串扰的问题。
进化形成了氧化还原调节
在光合作用中,CBC的几种酶的光依赖性调节已经进化以坐标与代谢相中碳固定的活性光反应。一些依赖于二硫醇/二硫化物交换的氧化还原浓度硫醇开关已经在成为endosymbiont的蓝藻细胞中建立,而其他人在藻类中出现[9,34,35].通过内共生获得的氧化还原调节蛋白通过氨基酸变化获得半胱氨酸或插入整个含有半胱氨酸的柔性调节环而扩大[9,34].在植物演化过程中,链光藻类能够殖民殖民栖息地和周围的土地,因为它们表现出一系列有利的形态学特征,如顶端细胞生长,双重制剂和分支[2.].早期的陆生植物体型简单,但面临着环境条件波动迅速的栖息地,如洪水、脱水、快速的温度变化和强光照射[36].这种生活方式反映在现存的非维管陆生植物中,如苔藓,它们能耐受长时间的浸没,并包含若干抵御光胁迫的保护机制[37,38]. 光照和温度的波动以及光抑制条件对叶绿体的代谢调节和ROS清除尤其具有挑战性,因为电子传递速率的巨大变化,以及酶活性的快速适应以维持生长和促进存活。
然而,陆生植物进化过程中氧化还原级联发生的进化适应在很大程度上是未知的。迄今为止,链藻的基因组(轮藻braunii),角蒿(灰花和斑花)及蕨类植物(黄瓜鼠尾草)已可用[39,40,41,42],补充现有的地苔基因组信息(Marchantia polymorpha),苔藓(P. Paten.)和淋巴瘤(江南卷柏)模型物种。这种前所未有的土地植物谱系和藻类姐妹集团的覆盖率使得对绿色谱系的氧化还原级联演变的比较调查在几个层面上,即关于不同的还原剂,氧化还原发射器以及代谢酶的靶硫醇开关。基于谷胱甘肽作为氧化还原缓冲液的重要性和降低抗氧化酶的等同物的来源,本研究研究了谷胱甘肽相关氧化还原网络的组分在链孔模型物种的塑性中。
值得注意的是,在植物演进期间,几个氧化还原相关蛋白质家族,例如TRX超家族,包括TRX和GXS9,35],支持功能的多样化已大幅扩大。此外,在种子植物中,ROS/RNS与生物防御反应紧密相关,例如通过NADPH氧化酶介导的质膜上的ROS爆发,或通过涉及NPR1的水杨酸信号通路[43].相比之下,氧化还原网络对代谢调节的组织和意义,非种子植物中的罗斯清除和发育仅仅是开始出现的[33,44]. 然而,了解氧化还原网络的演化可能有助于揭示应激恢复的祖先机制。对允许反向遗传的模式生物的研究表明,具有质体谷胱甘肽内稳态缺陷的突变体的表型是多样的,这表明在植物进化过程中氧化还原网络发生了改变。因此,缺乏质体GR对胚胎是致命的答:芥,而P. Paten.可以部分补偿这种损失,但变得光敏[29.,33].
为了评估质体中谷胱甘肽相关氧化还原网络的效应子和可能的靶半胱氨酸的进化,我们还研究了蛋白质S-Glutathionyzhation通过创建更新的已知靶星性半胱氨酸清单S- 乙醇化和它们的进化节约。
结果
链藻和陆生植物中谷胱甘肽依赖的氧化还原相关质体蛋白的系统发育分析
一方面,许多氧化还原级联组分的蛋白家族在陆生植物进化过程中不断扩大,并经历了功能多样化[9]. 另一方面,一些蛋白质在一个隔间中仅作为一个亚型持续保守,这表明一种潜在的重要生物学功能和基因拷贝数的紧密调控。为了鉴定与质体谷胱甘肽相关的氧化还原组分具有有趣的系统发育模式,我们首先利用链藻和非种子植物谱系的可用序列覆盖率进行了探索性的系统发育分析。我们包括所有已知的清除和损伤修复酶家族,其成员被报道为(1)定位于质体和(2)使用GSH并产生GSSG:脱氢抗坏血酸还原酶(DHAR)、谷胱甘肽S- 转移酶Lambda和IOTA(GSTL,GSTI),非典型甲硫氨酸亚砜还原酶B1(MSRB1),过氧化嗪IIE(PRXIIE),戊二酮(GRXS)以及谷胱甘肽还原酶(GR),其负责降低GSSG。表S1中列出了所有使用的蛋白质序列和基因进入(附加文件1.).
脱氢抗坏血酸还原酶
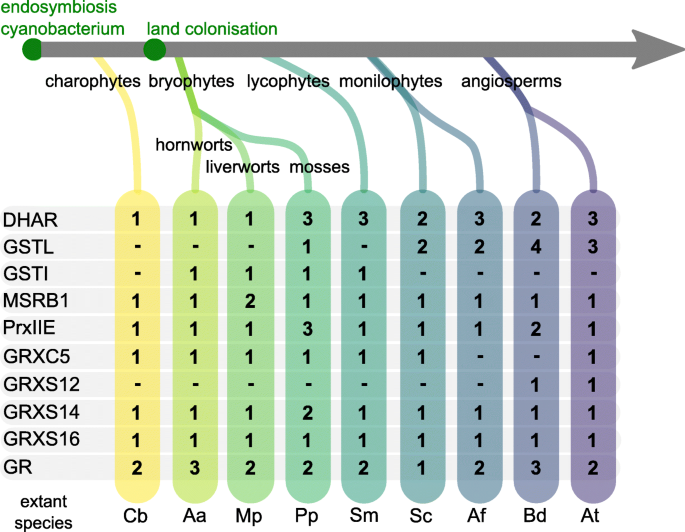
DHARs属于GST超家族,以GSH为电子供体,催化脱氢抗坏血酸还原为抗坏血酸。通过维持一个减少的抗坏血酸池,DHARs间接协助H的解毒2.O2.由抗坏血酸过氧化物酶(APXs)催化。植物DHARs的系统发育树(附加文件)2.)显示了几个独立的基因复制,每个物种会产生一到三个平行基因。目标预测(TargetP [45,46),定位器(47和PredAlgo [48),额外的文件1.表S1)以及n端序列延伸的存在或不存在表明亚细胞靶向具有高度的可变性。值得注意的是,只有一个单一的DHAR基因存在c . braunii两种苔藓植物(m . polymorpha,答:agrestis))(图。1.,附加文件2.).而c . braunii同源性被认为是细胞质的m . polymorpha和答:agrestis)直向理性具有N-末端延伸,预计将靶向塑性体。这表明在陆地植物演化中早期发生了基质DHAR。Dhar1来自P. Paten.(pp3c22_5470v3)[49,但蛋白质组学证据也表明它存在于线粒体中[49,这可能表明质体和线粒体具有双重靶向作用。所有陆生植物模式物种美国moellendorffii具有至少一个具有n端延伸和/或质体靶向预测的DHAR亚型(图。2.和额外的文件2.).在美国moellendorffii,情况仍然不清楚,因为至少有一个基因模型在N末端是不完整的。
蛋白质家族与血浆GSH依赖性氧化还原平衡有关的演变。数字表示基因组中存在的同种型数量。DHAR,脱氢血抗酸还原酶;GST,谷胱甘肽S-transferase, L: Lambda, I: Iota;MSRB1,甲硫氨酸亚砜还原酶B1 (1 Cys);插件可以,酶类;GRX glutatredoxin;GR,谷胱甘肽还原酶。模式种名称缩写为Cb =轮藻braunii; Aa级 = 灰花;议员=Marchantia polymorpha; 第页 = PhysComitrium Patens.;Sm =江南卷柏; 南卡罗来纳州 = Salvinia cucullata;af = 红萍filiculoides;Bd =Brachypodium distachyon; 在 = 拟南芥
陆生植物和链藻中质体谷胱甘肽相关氧化还原网络的进化综述。陆生模式植物和链植藻类质体gsh依赖的氧化还原网络概述c . braunii. 光合电子传递(PET)产生的电子参与ROS的产生,同时参与ROS的清除、损伤修复和氧化还原稳态。H2.O2.导致脂质过氧化(L-O-O-H)和蛋白质蛋氨酸(Met-R-SO),抗坏血酸(AsA)脱氢抗坏血酸(DHA)或蛋白质巯基氧化成各自的磺酸(RS-OH),可与谷胱甘肽反应形成S-glutathionylated加合物(RS-SG)。谷胱甘肽(GRX)可以(去)谷胱甘肽酸盐蛋白。还原性三肽谷胱甘肽(GSH)和谷胱甘肽二硫化物(GSSG)之间的平衡受到GSSG生成的影响,GSSG通过参与ROS/RNS清除或蛋白质和脂质修复的酶产生,如脱氢抗坏血酸还原酶(DHAR)、非典型(1 Cys)甲硫氨酸亚砜还原酶B1 (MSRB1)、lambda和iota-type (?(体外功能未证实)谷胱甘肽S-转移酶和II型过氧化蛋白(PRX)。谷胱甘肽还原酶(GR, nadph依赖)保护高度还原的谷胱甘肽池。模型物种中存在至少一种蛋白质质体靶向亚型(通过n端延伸的存在和靶向预测进行评估,见附加文件1.,2.,3.,4.,5.,6.,7.,8.)由蛋白质旁边的物种图例中的彩色框表示。带问号的彩色框表示靶向预测可能存在的异构体尚不清楚,但N-末端延伸表明存在靶向肽(见其他文件)1.,2.,3.,4.,5.,6.,7.,8.).缺少盒子可能意味着缺少该物种的同源物(见图。1.)或者所有同源物没有N末端延伸或基因模型是零碎片的(参见其他文件1.,2.,3.,4.,5.,6.,7.,8.). 物种传说:轮藻braunii(Cb),灰花(AA),Marchantia polymorpha(百万像素),PhysComitrium Patens.(PP),Selaginella Moellendorffii.(山猫),Salvinia cucullata(Sc),红萍filiculoides(af),Brachypodium distachyon(Bd)和拟南芥(在)
Iota(I)和lambda(L)型谷胱甘肽S- 转移酶
除DHAR外,还在GSTS(GSTL)的Lambda-亚类内报道了塑性靶向[50].虽然典型GSTS与亲电子化合物共轭GSH,但也显示出亚磷和TAU,依赖于释放GSSG的GSH依赖性过氧化物酶[50,51].由于据报道,由于塑体局部化的PPGSTL1也据报道了对DHA或氢过氢的类似的还原活性,我们研究了该子类的同种型[50].我们没有发现任何GSTL的同源物c . braunii,答:agrestis),m . polymorpha和美国moellendorffii但种子工厂模型中存在几种具有可变N-末端延伸并预测靶向塑体的同源物(附加文件3.).相反,iota-type gst (GSTI)的近缘亚科包含来自答:agrestis),m . polymorpha和美国moellendorffii,但在蕨类和种子植物模型中不存在(图。1.).gsti的功能尚不清楚[50]而我们的分析表明,它们也可能针对质体,在质体中,它们可能履行类似的功能,其姐妹分支GSTL(附加文件)3., 图。2.).我们没有确认c . brauniiGSTI,但C莱因哈特政府资讯科技及广播局已接获报告[50],表明GSTI亚科存在于绿藻中。
非典型蛋氨酸亚砜还原酶B
甲硫氨酸亚砜还原酶(MSR)催化甲硫氨酸亚砜(MetSO)的还原,修复ros诱导的蛋白质损伤。2.).甲硫氨酸的氧化可以产生两种非对映异构体,其由两种不同的无关酶家族减少,即MSRA(还原甲硫氨酸 -S-亚砜)和MSRB(还原蛋氨酸-R亚砜)[52].含有两个半胱氨酸的MSRA和MSRB蛋白依赖于TRX进行再生,而非典型的MSRA蛋白,如质体靶向的AtMSRB1 (AT1G53670),依赖于GSH/GRX进行再生[53].在AtMSRB1中,第二个半胱氨酸被一个苏氨酸(Thr132)取代。调查AtMSRB1同源物(附加文件4.a, c, d),我们发现一个完整的包含一个半胱氨酸的亚型,正如支持良好的MSRB1(1Cys)分支所包含的c . braunii,苔藓,石松和蕨类亚型。基于TargetP,质体靶向的保护尚不清楚,但可能是可变的[45,46],定位器(l) [47]和PredAlgo (P) [48预测(附加文件1.表S1)和n端扩展名是否存在(附加文件4.B,图2.).值得注意的是,m . polymorpha不具有MSRB2同源物,而MSRB1基因被复制,出现的两个亚型显示不同的n端延伸和靶向预测(附加文件4.).
过氧化物酶II E
PRXs是一种抗氧化酶,使用严格保守的半胱氨酸(即过氧化半胱氨酸)催化氢过氧化物还原为醇。质体包含典型的2-Cys PRXs具有两个活性位点半胱氨酸(过氧化和分解半胱氨酸),和一个非典型的2-Cys PRX称为PRXIIE(在[15.]). 而典型的2-Cys-PRX的再生是由质体TRX系统通过二硫醇/二硫键交换控制的,GRXS12在体外更有效地催化氧化杨树prxie的循环[26.]. GRXS12可以恢复还原的PRXIIE,因为在催化循环过程中,过氧化半胱氨酸经历谷胱甘肽化,突出了这个PRXII亚家族对GSH/GRX系统功能循环的依赖性(图。2.).
Prieie同源物是进化的保守[54我们的分析证实了一个单一的高度支持的PRXIIE同源分支,从charophytes到开花植物(附加文件5.).研究的大多数生物具有单一的PRXIIE同种型,所有完整的蛋白质模型都证实了N-末端延伸,该N-末端延伸主要预测为靶向塑性体(图。2.,附加文件1.表S1,附加文件5.).这美国moellendorffii同源物不允许靶向分析,因为蛋白模型的n端是片段的。我们发现基因复制b . distachyon有两种同种型和P. Paten.具有三种异构体,都具有保守的质体靶向性。基于系统发育分析(附加文件5.),质体grx依赖的PRXIIE同源物可能存在于所有分析的生物体中。
Glutaredoxins
GRXS是属于TRX系列的氧化还原酶,其在很大程度上参与了蛋白质氧化还原状态的控制。在光合真核中,GRX系列包括四个课程,这些类别在各种亚细胞隔间内,并通过其活动站点签名和域组织来区分[3.].这些GRX类的成员的命名为基于活性位点签名的最后位置的半胱氨酸或丝氨酸(CXXCS)含有与半胱氨酸或丝氨酸不同的残留物的有限数量的例外[3.].在模型植物中答:芥, GRX有6个I类异构体,4个II类异构体,2个IV类异构体,而III类GRX(又称cc型GRX或ROXY蛋白)已大幅扩展,由21个具有多种功能的成员组成。III类GRX功能的一个例子是与bZIP TGA转录因子的相互作用,影响植物发育和开花[55,56].质体通常包含属于I类和II类的GRX成员,即I类GRXS12和相近的GRXC5(在答:芥)和II类GRXS14和GRXS16 [57,58,59].
类我GRX
GRXC5和GRXS12包含单个GRX域,其中具有活动站点签名(分别为YCPYC和WCSYS),其与I类GRXS类的典型YC [P / S / G] [Y / F] C主题略有不同。GRX同种型两者都是氧化还原活性涉及体积素蛋白的蛋白质谷胱甘肽和抗氧化酶如MSRB1和PRXIIE的再循环(见上文)。氧化还原类I GRX的系统发育树的分析揭示了对应于靶向体积(C5 / S12 CLADE),细胞溶溶胶(C1 / C2 CLADE)和分泌途径(C3 / C4思工的异构型的进化古代曲线)(附加文件6.).我们发现,只有在两个被研究的被子植物模型物种中,活性位点的第二半胱氨酸被一个丝氨酸取代,从而产生GRXS12亚型。这种替代可以增加蛋白质的活性,因为可以避免内部二硫键的形成,从而阻止活性位点[58,60].GRXS12同源物在一些被子植物中占主导地位的事实强调了这种突变的相关性[61].虽然GRXC5基因模型美国moellendorffii和m . polymorpha我们在蕨类植物中没有发现任何高度保守的GRXC5/S12分支的C5/S12亚型聚类答:filiculoides(附加文件)6., 图。2.).
二类GRX
II类GRXS14和S16包含CGFS有源站点图案,通常在所有其他II类GRX成员中保存。如图所示,对于塑性等级I GRXS,GRXS14由单个GRX结构域形成,而GRXS16具有融合在一个GRX结构域的N-末端结构域(GIY-YIG内切核酸酶折叠)的模块化组织[3.,62,63].II类grx主要被认为参与了铁硫团簇的配位和转移[64,65](图。2.),但也可能在响应氧化信号失去铁硫配位后变得具有氧化活性[66]. 我们的系统发育分析表明,在所有研究的模式种中,GRXS14和GRXS16同源物都是保守的,在所有的模式种中只有一个重复的GRXS14亚型P. Paten.(附加文件)7.).只要完整的基因模型可用,N末端延伸和预测的塑性靶向确认在这些II类GRX亚类中的单层塑体靶向同种型的高度保存(附加文件1.表S1,附加文件7., 图。2.).
谷胱甘肽还原酶
GRS从酶促或非酶促生成的GSSG进行高效的NADPH依赖性恢复GSH(图。2.),保持GSSG低至纳摩尔含量[21.].结果是非常消极的E谷胱甘肽在植物细胞质中,过氧化物酶体、质体和线粒体基于两种亚型的活性,这两种亚型表现出对细胞质和过氧化物酶体(如AtGR1, AT3G24170)或质体和线粒体(如AtGR2, AT3G54660)的双重靶向[28.,29.].这两种亚型已经被证明是进化保守的,包括一种亚型的双靶向质体和线粒体P. Paten.[67].我们用我们的模式物种组推断了一个系统发育过程,发现两个进化支具有相同的保守性,代表了两个GR亚型,这表明这些亚型是在陆生植物出现之前建立的(附加文件8., 图。2.).这美国moellendorffii线粒体/塑体GR疏水板的基因模型在N-末端潜在偶然,不允许靶向预测。我们没有识别线粒体/塑料GR的同种型美国cucullata也不是为答:agrestis)(波恩)。BLASTN搜索发现了一个可能的地点美国cucullata在s0092支架上,但是没有基因模型。中存在一种质体/线粒体亚型答:agrestis)(牛津大学)的研究表明,该基因存在,但没有被正确预测答:agrestis)(波恩)。除了b . distachyon,每个被研究的物种在每个分支中都有一个单一的亚型。值得注意的是,一个答:agrestis)同种型(SC2YSWM_228.5258.1)确实显示比植物GRS更高的序列相似性。我们在另一种测序的化痰物种和菌株中识别出类似的同种型,即答:agrestis)(牛津)和答:各[40)(附加文件8.),表明在这些物种分裂之前发生了水平基因转移(HGT)。值得注意的是,与细菌序列相比,这些亚型具有n端延伸(附加文件8.b)。
质体蛋白质上假定谷胱甘肽化位点的进化保护
许多蓝藻或质体蛋白上的靶硫醇开关是在进化早期获得的,而其他的被报道在后来进化了调节半胱氨酸。例如,链植物中进化的质体甘油醛-3-磷酸脱氢酶异构体B (GAPB)的c端延伸,陆生植物中依赖nadph的质体苹果酸脱氢酶的n端半胱氨酸对[9,14.,68].
绝大多数这些酶由TRX通过TRX通过诱导构象变化的二硫/二硫化物相互调节蛋白质活性来调节蛋白质活性[5.,6.]. 除了TRX依赖性调节外,S-谷胱甘肽化是植物体内一种重要的调控机制。它参与抗氧化酶的循环,但也能保护蛋白质半胱氨酸免受不可逆氧化,调节蛋白质的功能/活性[3.,60,69].许多谷胱甘肽化的目标蛋白和确切的Cys发生S-谷胱甘肽化仍未知(图。2.).S- 在蛋白质组学实验中未经常检测到乙醇化酶,其中通常降低半胱氨酸,除去可逆修改,例如S-谷胱甘肽化,随后用半胱氨酸阻断剂作为质谱/质谱的标准修饰。然而,一些蛋白质组学研究已经开发出了具体的检测方案S-并鉴定了数百种推测的靶蛋白,突出了谷胱甘肽的作用S-谷胱甘肽化作为真核生氧光养生物硫醇转换调控机制[3.](以及其中的参考文献)。在蓝藻中进行了基于biogssg(生物素化谷胱甘肽二硫)的蛋白质组学研究集胞藻属pcc6803和383蛋白被鉴定为推测蛋白S-glutathionylated目标(70].这项研究支持这样的假设S-谷胱甘肽化可能在所有含氧光养生物中具有调节作用。由于这种翻译后氧化还原修饰的重要性,我们决定通过分析使用不同方法的蛋白质组学研究数据,即生物素化谷胱甘肽乙酯(biotinylated GSH ethyl ester (BioGEE))来研究其与质体蛋白的相关性[71],生物素化的GSSG(Beogssg)[72,73],抗GSH抗体[74]或放射性标记谷胱甘肽池使用35S-半胱氨酸[75].为了得到一个详尽完整的列表S- 乙醇化蛋白质,我们还考虑了在体外纯化蛋白质进行的研究研究[71,76,77,78,79,80,81,82,83,84,85,86,87,88,89,90,91,92,93](见附加文件9表S2)。结合所有这些研究,我们编制了一个已知的364个蛋白质的列表S- 绿色真核生物中的乙醇化酶(附加文件9表S2,无花果。3.).
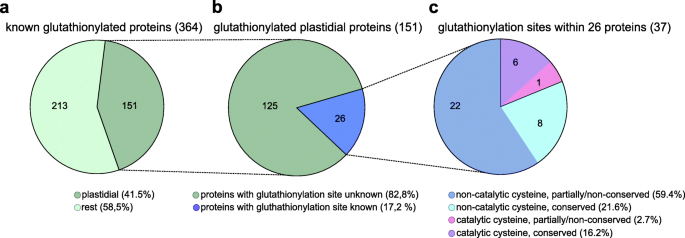
谷胱甘肽靶蛋白概述。A.概述了绿色真核生物中所有已知的谷胱甘肽化蛋白,其中以质体谷胱甘肽化靶蛋白为重点。B概述了所有已知的质体谷胱甘肽化靶蛋白与已知的谷胱甘肽化位点突出。C所有已知的叶绿体谷胱甘肽酰化位点的概述,包括进化保守和非/部分保守半胱氨酸位点的分类,以及催化和非催化功能的细分(关于补充、注释和参考文献,见附加文件9表S2)
我们确定基于生物功能和预测工具等谷胱甘肽化蛋白的亚细胞定位,例如Targetp [45,46]和suba(亚细胞定位数据库拟南芥[94])。在这364个蛋白质中,151个蛋白质定位于质体(附加文件9表S2,无花果。3.),对应于已知植物谷胱甘肽酶的c. 41%。随后,我们探索了哪些质体蛋白的确切位点S-glutathionylation决心。叶绿素中的蛋白质组学研究C莱因哈特结合使用生物素化标记的肽的链霉抗生物素蛋白富集的谷胱甘肽化靶的鉴定[73].这种方法允许建立确切的S- 如果所鉴定的肽仅含有一个CYS残留物,则乙醇化位点。在进一步的程度上进行分析,我们还考虑了对重组体积蛋白的研究,其中半胱氨酸残基进行S-谷胱甘肽化通过体外氧化剂处理结合质谱分析来鉴定[76,77,78,79,80,81,82]. 在151个质体蛋白质中,我们在26个不同的蛋白质中发现了37个谷胱甘肽化位点和已知的目标Cys(表1)1.和额外的文件9表S2),代表C.17%的已知的塑性谷胱甘肽(图。3.).
位点的数量超过了蛋白质的数量,因为一些谷胱甘肽化的蛋白质含有多个位点S码-glutathionylation网站(表1.和额外的文件9表S2)。更准确地说,7个蛋白质含有2个谷胱甘肽化的Cys, 2个蛋白质含有3个谷胱甘肽化的Cys(表1.和额外的文件9表S2)。已鉴定的蛋白质S码-谷胱甘肽化位点被认为参与多种细胞过程,如光合作用、碳水化合物代谢、生物合成途径、氧化还原调节、信号转导和蛋白质稳态(表)1.).
为了评估Cys进行谷胱甘肽化的进化保守性,我们构建了26个质体蛋白的多序列比对(附加文件10.)。我们在37个已知的S码-谷胱甘肽化位点7个位点参与了催化活性,其中6个位点从绿藻到开花植物完全保守(图。3.,附加文件9表S2,附加文件10.).在非催化性半胱氨酸上鉴定了三十谷胱甘肽化位点(图。3.或者,在所有调查的模型物种中,八个Cys仍然完全保守。其余22个Cys不是或仅部分保守的(附加文件10.),表现出不同的进化得失模式(图。3.和额外的文件9表S2)。
有趣的5个损失和推定损失的例子S码-谷胱甘肽化位点如图所示。4..在α -淀粉酶3 (AMY3)和SAL1(3 ' -磷酸腺苷5 ' -磷酸磷酸酶)两个S-在每一个细胞中都发现了谷胱甘肽化位点答:芥同系物。AMY3中的Cys499只存在于被子植物模型中。一个附加的序列比对,包括基本被子植物序列(见附加文件11.)发现了CYS499的存在Amborella trichopoda.和菠萝comosusAMY3同系物。AtSAL1的Cys119仅在约三分之一的双子叶和少数单子叶中保存[76],我们没有在任何非开花模式植物的同源位置识别出任何Cys。这些数据表明,在被子植物早期进化的最晚阶段,AMY3的Cys499位和SAL1的Cys119位是半胱氨酸的起源。相比之下,硫胺噻唑合成酶(THI1)的Cys106存在于C莱因哈特和所有调查的土地植物模型的同源物,除了答:芥,表明陆地植物进化的晚期损失。几个假定的S-谷胱甘肽化位点表现出不同的保守性模式,表明在陆地植物谱系中有几个独立的得失,如SAL1的Cys190,磷酸甘油激酶(PGK)的Cys159和Cys412以及铁氧还蛋白的Cys48。
已知系统的进化守恒S非催化半胱氨酸上的-谷胱甘肽化位点。5个具有非保守和非催化半胱氨酸的目标蛋白的示意图显示了关于进化保守的有趣模式S码-谷胱甘肽化位点(见附加文件10.对齐)。为了生成比对结果,BlastP结果通过基于系统发育树和额外的n端和TargetP长度的进化枝手工筛选[45,46]预测确定磷酸甘油酸激酶的细胞器亚型(A.)、α -淀粉酶(AMY3) (B),硫胺噻唑合酶(THI1)(C)、apoferredoxin (FDX) (D)3'phosphoadeNosine 5'磷酸磷酸酶(Sal1)(E).条形条表示蛋白质的总长度,并与谷胱甘肽化半胱氨酸的位置对齐。在两个半胱氨酸位置的情况下,蛋白质与在更多种类中保存的半胱氨酸对齐。该图中未指示对齐中的间隙。已知的谷胱甘肽化的半胱氨酸位点在各自的生物体中标记为红色正方形。星号表示推定的细胞溶质同种型(TargetP [45,46]关于PGK的预测。Synechocystis sp. (WP), Chara braunii (Chbra), Anthoceros agrestis (Aa), Marchantia polymorpha (maapoly), Physcomitrium patens (Pp), Selaginella moellendorffii (Selmo), Salvinia cucullata (Sacu), Azfi (Azfi), Brachypodium distachyon (Bradi)和拟南芥(在)
讨论
质体谷胱甘肽依赖的氧化还原网络在很大程度上是保守的
在氧化还原级联中,单个蛋白质半胱氨酸的稳态氧化还原状态受亲核细胞(即电子供体)的电子输入以及相互作用并表现为亲电体(即电子受体)的蛋白质或分子的存在的影响。因此,在细胞室中,巯基开关网络可受到动力学和热力学参数的限制,例如蛋白质组的组成、现有蛋白质相互作用的能力和所涉及的二硫化物的各自中点电位,以及单个半胱氨酸残基对ROS/RNS的反应性。谷胱甘肽依赖性反应可以被GSH生物合成酶的突变体所干扰[95,96]或者通过GR的突变体,将谷胱甘肽氧化还原电位转换为还原性较小的值[29.,33].报道的缺乏基质GR突变体的表型在答:芥和P. Paten.,因为胚胎发育在答:芥但完成于P. Paten..理论上,进化变化可以影响氧化还原活性蛋白的组成和活性,代谢酶上靶硫醇的存在和位置,或与质体谷胱甘肽氧化还原平衡相关的信号级联。我们整理了一份具有代表性的链霉菌模型物种中谷胱甘肽依赖的质体氧化还原网络的蛋白质成员列表(图。1.),其网络关系及其演化(图5)。2.).我们发现在过渡到陆地之前已经建立了几种GSSG生产酶的体积靶向,并且在土地植物演进中,Dhar,GSTL,GSTI,PRXIIE或I类和II类GRX中没有发生大的扩展。然而,ROS清除和损伤修复家庭(DHAR,GSTL,GSTI,MRSB1)的几种酶目前在链光藻藻中尚未在intextophyte inala中具有鉴定的体积靶向同种型c . braunii.然而,由于通过算法针对进化中的遥远物种进行预测,很容易导致假阳性和阴性[48,97,我们使用了三个不同的预测器,即两个最近改进的工具,基于最大的工厂训练集TargetP2.0 [46]及LOCALISER [47[训练有素的训练C莱因哈特序列。然而,由于(1)错误的预测和(2)片段基因模型不能正确预测n端序列,我们仍然可能低估了质体靶向蛋白的数量。本地化预测通常会产生不同的结果(附加文件1.表S1, sheet2)和不同于实验确定的位置(例如AtMSRB1)。因此,我们额外筛选了n端扩展的存在,以确定假定的靶向肽的存在或不存在(附加文件2.,3.,4.,5.,6.,7.,8.). 然而,不正确或残缺的基因模型仍然会导致对现有数据的误解。因此,可用的美国moellendorffii由于不完全性,蛋白质模型通常不允许预测N末端靶向信号或得出N末端延伸存在或不存在的结论(图。2.).
在研究的一些基因家族中,我们发现在陆地植物进化过程中,细胞器和n端延伸的存在或缺失具有可变的靶向性,而其他基因家族则表现出非常一致的靶向性。因此,我们观察了GST亚家族DHAR、GSTL和GSTI的可变靶点。在抗坏血酸/谷胱甘肽循环中,DHAR将脱氢抗坏血酸的再生与谷胱甘肽池结合,而单脱氢抗坏血酸还原酶以NADH为代价再生抗坏血酸[24.].在答:芥,基质DHAR不是生长所必需的,但在高光反应中发挥作用[98]. DHAR靶向性的变异性表明抗坏血酸氧化还原状态与受体结合的进化变异性E谷胱甘肽在不同的隔间,这可能影响信令响应。关于GSTL和GSTI,靶向可能是可变的,但这些GST亚属植物在陆地植物谱系中显示出几乎互补的分布,GSTI存在于苔藓中的苔藓植物和GSTL中P. Paten.、蕨类植物和种子植物。GSTI的体外功能尚未确定,但怀疑与GSTL类似,作用于过氧化物的解毒[50].在质体中,过氧化氢和过氧化脂解毒的几种途径共存(抗坏血酸过氧化物酶[8.,依赖trx的GPXL [99]和PRXs (PRXQ, 2-Cys PRX, PRXIIE [15.),这表明冗余可能是陆地植物进化过程中所研究的蛋白质家族独立获得和失去的原因之一。同样,关于氧化的蛋氨酸(蛋氨酸-R-亚砜),非典型MSRB与一个半胱氨酸(AtMSRB1同系物)以及两个半胱氨酸(AtMSRB2同系物)的作用是冗余的,再生的差异来自不同的氧化还原级联(即GSH/GRX和TRX,分别)。因此,如果物种缺乏质体的1-Cys-MSRB1同源物,2-Cys-MSRB2可以补偿并且仍然允许修复R美卓的非对映体。在链状植物进化过程中质体中清除和修复酶的可变组成的生物学意义尚不清楚,但提出了一个问题,如果唯一的原因是功能冗余,或者,如果与不同的电子供体耦合的平行氧化还原级联对于压力信号传递等过程很重要,或者与组织或光照条件之间的差异有关。
相反,在大多数物种中,PRXIIE、GRXC5/S12、GRXS14、GRXS16同源体作为单一质体亚型存在,表明其具有保守的质体特异性功能和严格的基因拷贝数控制。尽管过氧化氢解毒通过几个PRX (PRXQ和2-Cys PRX, [15.])通过GSH/GRX更有效地再生的质体亚型PrxIe可能在链状植物中完全保守(图。2.).PREXIIE同种型的严格保护表明,虽然丰富的PRXIIE虽然大幅低于PLSTID 2-CYS PRX [15.]. 它的特性包括PRXIIE是唯一一个与类囊体无关的PRX,它与GRX偶联以还原,并且它与RNS信号传导有关[15.,100.].
PRXIIE和MSRB1通过I类GRX的作用再生。此外,GRXC5可以结合[2Fe-S]簇,可能在氧化应激条件下发挥调节作用[66].我们发现了一个包含有质体靶向GRXC5/S12同源物的保守分支。作为一个例外,我们在该蕨类植物中没有发现GRXC5或GRXS12亚型答:filiculoides.然而,在C1/C2 (Azfi_s0158.g053892;Azfi_s0074.g037496)以及C3/C4 (Azfi_s0270.g061184;Azfi_s0004.g008860)的分支经历了重复,是重新靶向质体的候选体,以弥补质体靶向I类亚型的损失。在c . braunii而在非种子植物中,只有一种具有CPYC活性位点的亚型(GRXC5),表明CPYC是该GRX亚型的祖先活性位点基序,而GRXS12变种只出现在被子植物进化中。
Ⅱ类GRX亚型参与Fe-S簇在靶蛋白上的配位和转移[64,65],在失去配位Fe-S团簇后才变为氧化还原活性。没有Fe-S簇,它们可以催化S码-GSSG存在下的体外谷胱甘肽化作用,但不能去谷胱甘肽化靶蛋白,如氧化还原敏感的GFP [65].体内证据显示,GRXS14水平与拟南芥对非生物胁迫条件的耐受性相关[62,101.]或番茄[102.].此外,GRXS14和GRXS16是功能光合作用和叶绿素生物合成所必需的[62].在C莱因哈特,Ⅱ类GRX3是一个GRXS14同系物,被发现能催化光合GAPDH的脱谷氨酸酰化反应拟南芥(atgapa)使用来自psi-dreame的ferredoxin的电子[103.].然而,迄今为止,陆生植物GRXS14的同源物并没有显示出类似的功能。我们的分析证实了GRXS14和GRXS16同源物在所有模式生物的质体中都有严格的保存,除了P. Paten.具有两种GRXS14亚型。然而,II类GRX氧化还原活性的功能和生理相关性尚不清楚。
I类GRXs的还原由谷胱甘肽驱动,而GR保持高度还原E谷胱甘肽在质体基质中,再还原生成的GSSG。我们证实了链状植物中的两个GR分支可能含有细胞质/过氧化物酶体和线粒体/质体的双重靶向异构体。在所有陆地植物模式物种中,至少有一种线粒体/质体GR分支和一种细胞质/过氧化物酶体分支的亚型是保守的,而另一种来自水平基因转移(HGT)的亚型则存在于植物中Anthoceros物种。Uniprot中最接近的细菌序列[104.]来自蓝藻发菜(Uniprot ID P48638),表明该GR亚型是从蓝藻菌中获得的,蓝藻菌被认为是角苔的殖民地[40,42].来自HGT的GRs中假定的n端扩展的存在是有趣的(附加文件8.),因为它们可能赋予细胞器靶向性,提出了被研究的角苔中附加GR的生物学功能的问题。
对非催化半胱氨酸敏感S- 乙醇化酶是进化的保守
半胱氨酸对许多蛋白质的结构完整性和催化活性至关重要,而Cys残基的翻译后修饰控制着植物信号转导和代谢的主要步骤[105.,106.]. 生物作用S-谷胱甘肽化仅对一些典型的靶蛋白进行分解,范围从清除/修复酶活性位点Cys上的反应中间体到Cys过度氧化的过度保护到蛋白质活性的调节[3.,60,69].
迄今为止,将151种不同的体层蛋白鉴定为目标S-在不同的植物系统中通过不同的实验方法进行谷胱甘肽化,表明这种翻译后氧化还原修饰可能在质体中很常见。然而,在给定的生物体内,质体中在给定的时间点被谷胱甘肽化的蛋白质的确切数量仍然是未知的,并且由于一些原因可能相当低。
首先,用于识别的高吞吐量方法S-谷胱甘肽部分使用非生理反应条件。例如,BioGSSG被用来诱导蛋白质的合成S- 乙醇化酶。然而,这种机制不太可能(i)GSSG浓度在纳米摩尔范围内生理学上,而在体外使用毫米粒子的沼气浓度和(ii)大多数蛋白质K牛大约1意味着GSH和GSSG的等摩尔浓度需要达到50%的谷胱甘肽化蛋白[107.,108.].GSSG可以在其硫醇酸盐状态(-S)中的半胱氨酸反应−)通过硫醇二硫化物交换反应。然而,已知GSSG依赖性机制由于体内GSH / GSSG比率高,并且只显示了一些蛋白质物种能够进行S-谷胱甘肽化通过这个途径[60,109.]. 有些蛋白质会S- 暴露于已知为谷胱甘肽的亚硝基化对应后乙醇化酶化。S-亚硝基谷胱甘肽(GSNO)。而GSNO是一种亚硝化剂[110.],已经观察到诱导S-谷胱甘肽化作用可能取决于它们半胱氨酸的微环境[60,111.,112.,113.].另一个生理上可能的途径S- 乙醇化酶通过谷胱甘肽的亲核攻击发生S-蛋白质硫醇与H反应形成的亚砜化位点2.O2..采用0.1 - 20mmh外施2.O2.,在68和132之间,在易于识别出不同的体积蛋白质之间S-sulfenylation [114.,115.,116.]. 有多少蛋白质S-磺酰化和潜在的后续反应S-谷胱甘肽化作用下生理相关的H2.O2.质体的浓度尚不清楚。
其次,许多蛋白质可能在体内迅速去谷胱甘肽化。在质体中,去谷胱甘肽化需要与质体I类GRXC5/S12亚型相互作用(图。2.).基于实验证据,TRX和GRX之间没有功能性冗余,尽管它们的结构相似,但它们专门致力于蛋白质二硫化的氧化还原控制S分别-glutathionylation。到目前为止,谷胱甘肽化的胞质甘油醛-3-磷酸脱氢酶从拟南芥(AtGAPC)构成唯一的例外,因为两种酶都能有效催化其去谷胱甘肽化[87,117.].GSSG水平升高和/或间质谷胱甘肽氧化还原电位降低可能影响GSSG水平S-谷胱甘肽化作用在体内蛋白质上,例如通过降低去谷胱甘肽化速率。当我们发现基质谷胱甘肽氧化还原电位从亮到暗的动态氧化反应时[33],未来的研究需要调查这些氧化还原动力学的生物学相关性和对其可能的影响S-蛋白质的谷胱甘肽化水平。
不幸的是,只有37个Cys(26种不同的塑性蛋白)的确切位置易受影响S-谷胱甘肽化是已知的,代表了质体中不同鉴定的谷胱甘肽化蛋白的c. 17%。除AMY3中的Cys499外,催化Cys完全保守(图。4.,附加文件9:表S2)。在这里,作为催化Cys的注释是基于答:芥这在很大程度上缺乏催化活性[118.]. 然而,根据我们的分析,其机制尚不清楚,Cys499可能不是其他生物体中催化活性所必需的。值得注意的是,c。从绿藻到开花植物,非催化Cys上22%的已知位点是完全保守的。这表明这些Cys具有重要的调节作用,包括通过基因修饰的可能性S- 乙醇化酶。
假定谷胱甘肽化位点的独特保守模式
Cys植物保护的进化分析S-在至少一个物种中的谷胱甘肽化表明,在陆地植物进化中,一些调控Cys重新出现,表明这些位点的独立得失(图。4., fdx, pgk, sal1)。
关于磷酸甘油酸激酶(PGK),我们发现在进化过程中有一个降低的复杂调控。在绿藻中C莱因哈特二S-谷胱甘肽化位点(CrPGK1 Cys159和Cys412)被鉴定S-谷胱甘肽酰化在体外得到证实[73].有趣的是,Cys412在人类和小鼠中保存了[75但在大多数陆生植物中不是,尽管它在CrPGK1中与Cys278形成调节二硫键[81].Cys159在某些土地植物同源物中部分地保守。大多数研究的物种为几种同种型编码,其中至少一个同种型包含Cys159,除外m . polymorpha还有蕨类模型物种。在答:芥AtPGK3 (AT1G79550)为胞质糖酵解亚型,AtPGK1 (AT3G12780)为光合亚型,AtPGK2 (AT1G56190)为质体糖酵解亚型[119.].因此,AtPGK1和AtPGK2分别参与了加尔文-本森循环和质体糖酵解,但催化了逆反应。Cys159仅在质体糖酵解异构体中保守答:芥.推测这一点很诱人S码-谷胱甘肽化作用有助于质体中光合和糖酵解异构体之间的差异调控。
同样,高度保守的Cys也不存在于答:芥硫胺噻唑合酶(THI1)的同源(图。4.C)。硫胺素(维生素B1)的噻唑部分合成噻唑部分。它是经历单一催化转换的自杀酶,因为硫化物从保守的Cys转移[120.](对应于AtTHI1 Cys216)。一的CysS-谷胱甘肽化位点C莱因哈特)严格保守,除了答:芥(A98)。Cys106的位置在alpha 2螺旋[121.]在一个功能未知的高度保守的基序中。然而,单一转化酶潜在氧化还原调节的意义仍不清楚。
相比之下,α -淀粉酶3 (AMY3)的氧化还原调节在进化中似乎越来越复杂。而两个S- 鉴定乙醇化位点答:芥,只有一个Cys(Cys587)是严格保守的。第二个Cys(Cys499)只存在于被子植物模型中。已经表明,AtAMY3在其还原形式中更为活跃[118.],中点氧化还原电位 - 329mV(pH7.9),并且它由TRX F,M和Y最有效地减少。虽然单个Cys突变体C587S在氧化条件下保持活性,但Cys499突变体几乎无效[118.].Amy3在与气孔开口相关的淀粉代谢中起作用,参与对压力的反应[122.].在h的存在下2.O2.由于半胱氨酸的氧化,它经历了部分不可逆的失活,这是由S-谷胱甘肽化作用在至少三个不同的Cys上,包括Cys499和Cys587。一旦谷胱甘肽化,酶可以通过grx或TRX恢复到其活性状态,如果S-谷胱甘肽化通过形成分子内二硫键来分解[77].
类似地,两个S-谷胱甘肽化位点在答:芥在所有调查的模型物种的至少一个同源物种中,其中仅Cys190的3'-磷纳苷5'磷酸磷酸酶Sal1的邻羟磷酸酶Sal1。Cys119仅限于答:芥带正电荷的AA残基存在于大多数其他物种的相同位置。SAL1在PAP水平的调节中具有重要的进化保守功能,从而在质体到核的逆行信号传递中[123.(赵等,2019)。二次氧化还原感应的“兼职”信号功能已经描述了SAL1 [76]通过完全保守的Cys167,形成与Cys190的交叉β-链二硫键。Cys119或Cys190需要在氧化条件下停用答:芥Cys119参与分子间二硫键和二聚体的形成,促进了跨β链二硫键Cys167-Cys190的形成[76].氧化还原机制答:芥包括第一次二聚和随后的氧化失活。另外,S-谷胱甘肽化作用在Cys119或Cys190上确实降低了单体或二聚体的活性(中间氧化还原电位−308 mV单体,pH 7.5)。
最后,我们发现了变量守恒的假定S- 乙醇化位点,具有潜在的几个独立的增益和损失在Ferridoxins(FDX)中。虽然Cys69,即坐标半胱氨酸中的四个2F-2S之一,但严格保守,Cys48存在可变保护。Cys48S- 鉴定乙醇化酶C莱因哈特这种残留物存在于答:芥叶片型富铁氧化辛(FDX1(AT1G10960)和FDX2(AT1G60950)),但不含根型Ferredoxin FDX3(AT2G27510)和FDX4(AT5G10000)[124.].与根型FDX相比,PSI减少的叶片型FDX有可能的氧化还原调节是可以通过FNR降低的,并且更有效的电子供体对亚硫酸盐还原酶进行了更有效的[124.].然而,Cys48在蕨类模式物种和单子叶模式物种的FDX序列中均不具有保守性b . distachyon.这表明,在这些植物谱系中,要么是Cys48的独立丢失,要么是在陆生植物进化过程中,一个调节Cys在相同位置的独立重新出现。
结论
通过分析来自谷胱甘肽池的酶,并产生GSSG,我们发现克雷特藻类和土地植物模型物种之间的GR和GRX同种型在很大程度上是保守的,鉴定它们作为血液谷胱甘肽依赖性氧化还原级联的中央球员。这里,GRXC5可能参与蛋白质去谷胱甘肽化的祖先同种型。除Prxiie外,塑性中的清除和损伤修复酶的组成是进化的保守。这表明在不同物种之间的ros-scavenging和损伤修复的可变性,并突出的塑体氧化还原调节可能需要prighie。当我们发现了许多人的进化节约S-谷胱甘肽化位点在质体蛋白,包括非催化半胱氨酸,我们得出结论,蛋白质S质体中的-谷胱甘肽化作用在氧化还原调节和应激反应中起着重要的作用,但研究不足。未来的挑战是确定(i)新的目标S-谷胱甘肽化,(ii)的确切位置S-谷胱甘肽化作用在更多的目标蛋白,(iii)蛋白质的体内动力学S-谷胱甘肽化和由此产生的稳定状态水平S-目标蛋白的谷胱甘肽化部分和(iv)这种修饰对质体功能的生物学相关性。
方法
序列检索与对齐
为了重建质体和线粒体氧化还原级联组分的基因多样性,从OrcAE中检索了蛋白质序列轮藻braunii(http://www.bioinformatics.psb.ugent.be/orcae/overview/Chbra)、Phytozome v12.1 [125.]衣藻reinhardtii,Marchantia polymorpha,Physcomitrium(小立碗藓,卷柏和Brachypodium distachyon,fernbase(http://www.fernbase.org.) 为了Salvinia cucullata和红萍filiculoides,和TAIR10 (www.arabidopsis.org) 为了拟南芥.此外,细胞器基因组编码的蛋白质序列从Uniprot [104.].爆炸访问灰花和斑花基因组(42]由PeterSzövenyi教授提供。使用jalview构建对齐[126.]以及带默认设置的肌肉算法。
系统发育树的构建
系统发育树是由手动整理的比对生成的(见附加文件12.)使用贝叶斯推理和MrBayes(运行参数:混合蛋白质模型,比率 = invgamma,世代数:2*106., burnin = 20%,结束分裂频率< 0.01)[127.].作为补充方法,最大似然树(见附加文件13.)使用iqtree web生成[128.](运行参数:1000引导,标准设置)。
使用Figtree软件创建系统发生树的图形表示(v1.4.2, A. Rambaut,http://tree.bio.ed.ac.uk/software/figtree/).
编译谷胱甘肽化质体蛋白列表
在不同的蛋白质组学和体外研究中发现谷胱甘肽化的蛋白质[31,60,71,72,73,74,75,76,77,78,79,80,81,82,83,84,85,86,87,88,89,90,91,92,93]从文献中检索,并用于组装一个列表(附加文件9:表S2,表格1)。NCBI参考序列(www.ncbi.nlm.nih.gov)及TAIR (www.arabidopsis.org)加入号码用于明确识别蛋白质。
利用NCBI的BLASTP工具(https://blast.ncbi.nlm.nih.gov/Blast.cgi). 推测的拟南芥同源物的亚细胞定位是从SUBA(亚细胞定位数据库)检索的答:芥)[94]使用SUBAcon算法来识别质体蛋白。
催化半胱氨酸位点的鉴定
催化半胱氨酸被鉴定在那些发现谷胱甘肽化和属于质体蛋白(附加文件9表S2, sheet2)使用Uniprot [104.]以及引用的个别出版物中的信息。
数据和材料的可用性
本研究中产生或分析的所有数据均包含在本文及其补充信息文件中。所使用的数据库可公开访问并在线提供:https://bioinformatics.psb.ugent.be/orcae/,https://phytozome.jgi.doe.gov/pz/portal.html,https://www.fernbase.org,https://www.arabidopsis.org,https://www.uniprot.org/,https://suba.live/,https://www.ncbi.nlm.nih.gov/.
缩写
- ROS:
-
反应性氧气
- 加拿大广播公司:
-
卡尔文本森循环
- RNS:
-
反应氮物种
- 谷胱甘肽:
-
谷胱甘肽
- 硫氧还蛋白:
-
硫氧还蛋白
- 格:
-
谷胱甘肽还原酶
- 功能处理量:
-
Ferredoxin-thioredoxin还原酶
- NTR公司:
-
NADPH-dependent硫氧还蛋白还原酶
- 脉冲重复频率:
-
酶类
- GPXL码:
-
谷胱甘肽peroxidase-like蛋白质
- GSSG公司:
-
二硫化谷胱甘肽
- E谷胱甘肽:
-
谷胱甘肽氧化还原电位
- MSR编号:
-
蛋氨酸亚砜还原酶
- GRX:
-
glutaredoxin
- NPR1:
-
发病相关基因非表达
- 达:
-
dehydroascorbate还原酶
- GST:
-
谷胱甘肽S-转移酶
- APX型:
-
抗坏血酸盐过氧化物酶
- Cb:
-
轮藻braunii
- 机管局:
-
灰花
- 管理人员:
-
Marchantia polymorpha
- 页:
-
PhysComitrium Patens.
- Sm:
-
江南卷柏
- SC:
-
Salvinia cucullata
- AF:
-
红萍filiculoides
- 屋宇署:
-
Brachypodium distachyon
- 地址:
-
拟南芥
- 美卓:
-
甲硫氨酸亚砜
- 宠物:
-
光合电子传递
- AsA公司:
-
抗坏血酸
- 差距:
-
甘油醛-3-磷酸脱氢酶
- 女士/小姐:
-
串联质谱
- 生物节:
-
生物素化谷胱甘肽乙酯
- BioGSSG:
-
生物素化的二硫化谷胱甘肽
- 艾米:
-
α-淀粉酶
- 这:
-
硫胺素噻唑合成酶
- PGK:
-
磷酸甘油酸酯激酶
- FDX公司:
-
铁氧还蛋白
- 高度:
-
水平基因转移
- GSNO编号:
-
S-nitrosoglutathione
参考文献
- 1。
Dyall SD,Brown Mt,Johnson PJ。古代侵犯:从内氨苄酮到细胞器。科学。2004; 304:253-7。
- 2。
De Vries J,Archibald JM。植物演变:陆地生活的地标。新植物。2018; 217(4):1428-34。https://doi.org/10.1111/nph.14975.
- 3.
Zaffagnini M,Fermani S,Marchand CH,Costa A,Sparla F,Rouhier N等.光合生物中的氧化还原稳态:新的和建立的基于硫醇的分子机制。抗氧化氧化还原信号。2019;31(3):155–210.https://doi.org/10.1089/ars.2018.7617.
- 4.
关键词:植物,活性氧,信号转导,信号转导植物生物学杂志。2018;69(1):209-36。https://doi.org/10.1146/annurev-arplant-042817-040322..
- 5.
Geigenberger P,Thormählen I,Daloso DM,Fernie AR.植物硫氧还蛋白系统前所未有的多功能性。植物科学趋势。2017;22:249–62.
- 6.
氧化还原法规:一个广阔的视野。中国生物医学工程学报,2005;https://doi.org/10.1146/annurev.arplant.56.032604.144246.
- 7.
Dietz K-J,地狱R.硫醇在叶绿体中的氧化还原调节中的开关:平衡氧化还原状态,代谢和氧化应激。Biol Chem。2015; 396(5):483-94。https://doi.org/10.1515/HSZ-2014-0281.
- 8.
迪茨K-J。硫醇基过氧化物酶和抗坏血酸过氧化物酶:为什么植物在光合叶绿体中依赖多个过氧化物酶系统?摩尔细胞。2016;共39(1):20。https://doi.org/10.14348/molcells.2016.2324.
- 9
GÜLLDDD,RORET T,Hecker A,Reski R,Jacquot J-P。致氯化物酶的氧化钇调节响应进化和结构约束的二硫醇。植物SCI。2017; 255:1-11。https://doi.org/10.1016/j.plantsci.2016.11.003.
- 10。
吉田K,Hisabori T。两个不同的氧化还原级联共同调节叶绿体功能和维持植物的生存能力。美国国家科学院学报。2016;113(27):E3967–76。https://doi.org/10.1073/pnas.1604101113.
- 11.
Pérez-Ruiz JM,Cejudo FJ。一种提出的水稻NADPH硫化辛还原酶C,一种蛋白质二硫化物还原酶活性的酶。费用。2009; 583:1399-402。
- 12.
Lemaire SD、Michelet L、Zaffagnini M、Massot V、Issakidis Bourguet E。叶绿体中的硫氧还蛋白。当前Genet。2007;51:343–65.
- 13。
Hall M, Mata-Cabana A, Åkerlund H-E, Florencio FJ, Schröder WP, Lindahl M,等。硫氧还蛋白对植物叶绿体腔的作用及其对质体功能的影响。蛋白质组学,2010;10(5):987 - 1001。https://doi.org/10.1002/pmic.200900654.
- 14.
Michelet L, Zaffagnini M, Morisse S, Sparla F, Pérez-Pérez ME, Francia F,等。卡尔文-本森循环的氧化还原调节有旧有新。植物科学,2013;
- 15.
迪茨K-J。植物和蓝藻的过氧杂志。抗氧化氧化还原信号。2011; 15:1129-59。
- 16.
Navrot N, colin V, Gualberto J, Gelhaye E, Hirasawa M, Rey P等。植物谷胱甘肽过氧化物酶是分布在多个亚细胞内的功能性过氧化物蛋白,在生物和非生物胁迫中受到调节。植物杂志。2006;142(4):1364 - 79。https://doi.org/10.1104/pp.106.089458.
- 17.
Pérez-Ruiz JM,Naranjo B,Ojeda V,几内亚M,Cejudo FJ。光合仪器的最佳功能需要NTRC依赖的氧化还原平衡,以获得光合仪的最佳功能。Proc Natl Acad Sci U S A. 2017; 114(45):12069-74。https://doi.org/10.1073/pnas.1706003114..
- 18
等。关键词:量子力学,量子力学,量子力学,量子力学叶绿体2-半胱氨酸过氧还蛋白作为硫氧还蛋白氧化酶在叶绿体代谢的氧化还原调节中发挥作用。eLife。2018; 7:38194。
- 19
Yoshida K, Hara A, Sugiura K, Fukaya Y, Hisabori T. Thioredoxin-like2/2-Cys peroxiredoxin redox cascade支持叶绿体的氧化硫醇调节。Proc Natl academy Sci U S a 2018;115: E8296-304。
- 20。
Yoshida K, Uchikoshi E, Hara S, Hisabori T. Thioredoxin-like2/2-Cys peroxiredoxin redox cascade作为叶绿体中葡萄糖-6-磷酸脱氢酶的氧化激活剂。j . 2019; 476:1781 - 90。
- 21。
Schwarzländer M, Dick TP, Meyer AJ, Morgan B.使用荧光蛋白传感器解剖氧化还原生物学。抗氧化氧化还原信号。2016;24(13):680-712。https://doi.org/10.1089/ars.2015.6266.
- 22.
Schwarzländer M, Fricker MD, MüLler C, Marty L, Brach T, Novak J, et al.;活植物细胞谷胱甘肽氧化还原电位的共聚焦成像。J Microsc。2008;231:299 - 316。
- 23.
作者简介:Meyer j, Brach T, Marty L, Kreye S, Rouhier N, Jacquot J-P等。Redox-sensitive GFP在拟南芥是一种定量生物传感器的氧化还原电位的细胞谷胱甘肽氧化还原缓冲液。植物J。2007;52:973–86.
- 24
门厅CH, Noctor G.抗坏血酸和谷胱甘肽:氧化还原中心的心脏。植物杂志。2011;155:2-18。
- 25
植物蛋氨酸亚砜还原酶在氧化还原稳态和信号转导中的生理作用。瑞士巴塞尔,2018;7:114。
- 26
Gama F, Bréhélin C, Gelhaye E, Meyer Y, Jacquot J-P, Rey P,等。叶绿体Prx IIE的功能分析和表达特性。杂志。2008;133(3):599 - 610。https://doi.org/10.1111/j.1399-3054.2008.01097.x.
- 27.
谷氧还蛋白:谷胱甘肽依赖的氧化还原酶,其功能远远超过一个简单的硫氧还蛋白备份系统。抗氧化氧化还原信号。2004;6:63-74。
- 28.
Marty L,Siala W,Schwarzlander M,Fricker Md,Wirtz M,SweetLove LJ等。NADPH依赖性硫氧嗪系统构成拟南芥细胞溶质谷胱甘肽还原酶的功能备用。PROC NATL ACAD SCI。2009; 106(22):9109-14。https://doi.org/10.1073/pnas.0900206106..
- 29.
liu, liu, liu, et al., liu, liu, et al.;拟南芥谷胱甘肽还原酶2在质体中是不可或缺的,而线粒体谷胱甘肽则由额外的还原和运输系统保护。新植醇。2019;224(4):1569 - 84。https://doi.org/10.1111/nph.16086.
- 30.
Reichheld J-P,Khafif M,RIONDET C,Droux M,Bonnard G,Meyer Y.灭活硫昔林还原酶的灭活揭示了拟南芥开发中患有毒素和谷胱甘肽途径之间的复杂相互作用。植物细胞。2007; 19(6):1851-65。https://doi.org/10.1105/tpc.107.050849.
- 31.
等。中国生物医学工程学会,中国生物医学工程学会。叶绿体硫氧还蛋白f谷胱甘肽化是植物氧化还原信号的一种机制。国家自然科学基金资助项目:国家自然科学基金资助项目。https://doi.org/10.1073/pnas.0507498102.
- 32.
Rensing SA, Goffinet B, Meyberg R, Wu S-Z, Bezanilla M. The MossPhyscomitrium(Physcomitrella)金属盘:非种子植物的模式生物。植物细胞。2020;32:1361 - 76。
- 33.
Müller-Schüssele SJ, Wang R, Gütle DD, Romer J, Rodriguez-Franco M, Scholz M, et al.;叶绿体需要谷胱甘肽还原酶来平衡活性氧和维持有效的光合作用。植物j . 2020; 103:1140-54。
- 34。
Woehle C, Dagan T, Landan G, Vardi A, Rosenwasser S.氧化还原敏感蛋白组的扩增与质体内共生相一致。Nat植物。2017;3:17066。
- 35。
Balsera M、Uberegui E、Schürmann P、Buchanan BB。叶绿体氧化还原调控的进化发展。抗氧化氧化还原信号。2014;21:1327–55.
- 36。
仁瑟SA。进化中的伟大时刻:植物对土地的征服。植物生物学杂志。2018;42:49-54。https://doi.org/10.1016/j.pbi.2018.02.006.
- 37。
Yasumura Y, Pierik R, Fricker MD, Voesenek LACJ, Harberd NP。的研究肺孢子虫揭示乙烯介导的淹没反应在陆地植物进化中较早出现。中国生物医学工程学报,2012;
- 38.
关键词:光合电子传递,光合保护,光合效率,植物abstract:新植醇。2019;221:105-9。
- 39.
(1)西山(Nishiyama), Sakayama H, de Vries J, Buschmann H, Saint-Marcoux D, Ullrich KK等。性状基因组:植物地化的次级复杂性和含义。细胞。2018;174:448 e24——464.。
- 40。
李F-W,Nishiyama T,Waller M,Frangedakis E,Keller J,Li Z等人。Anthoceros基因组照亮了土地植物的起源和Hornworts的独特生物学。Nat植物。2020; 6(3):259-72。https://doi.org/10.1038/s41477-020-0618-2.
- 41。
李F-W,Brouwer P,Carretero-Paulet L,Cheng S,De Vries J,Delaux P-M等。蕨类植物基因组阐明土地植物演化和蓝藻共混物。Nat植物。2018; 4(7):460-72。https://doi.org/10.1038/s41477-018-0188-8.
- 42。
张杰,傅X X,李瑞Q,赵X,刘Y,李明海,等。金钱草基因组与陆生植物早期进化。天然植物。2020;6(2):107–18.https://doi.org/10.1038/s41477-019-0588-4.
- 43。
Noctor G,Reichheld J-P,Foyer Ch。ROS相关的氧化还原调节和植物信号传导。Semin Cell Dev Biol。2018; 80:3-12。https://doi.org/10.1016/j.semcdb.2017.07.013.
- 44。
张国强,张国强,张国强,等。MpTCP1控制细胞增殖和氧化还原过程Marchantia polymorpha.新植醇。2019;224(4):1627 - 41。https://doi.org/10.1111/3/16132.
- 45。
Emanuelsson O,Brunak S,Von Heijne G,Nielsen H.使用TargetP,SignalP和相关工具在电池中定位蛋白质。NAT PROTOC。2007; 2(4):953-71。https://doi.org/10.1038/nprot.2007.131.
- 46.
Almagro Armenteros JJ, Salvatore M, Emanuelsson O, Winther O, von Heijne G, Elofsson A等。利用深度学习技术检测靶向肽序列信号。生命科学联盟。2019;2:e201900429。
- 47.
Sperschneider J,Catanzariti A-M,Deboer K,Petre B,Gardiner DM,Singh Kb等。定位器:植物细胞中植物和效应蛋白的亚细胞定位预测。SCI批准。2017; 7(1):44598。https://doi.org/10.1038/srep44598.
- 48
关键词:神经网络,神经网络,神经网络,神经网络,神经网络一种新的亚细胞定位预测工具,专门用于绿藻。中国生物医学工程学报,2012;
- 49
Mueller SJ, Lang D, Hoernstein SNW, Lang EGE, Schuessele C, Schmidt A等。苔藓线粒体和质体蛋白质组的定量分析肺孢子虫揭示蛋白质宏观按摩和微量组分。植物理性。2014; 164(4):2081-95。https://doi.org/10.1104/pp.114.235754.
- 50.
刘英杰、韩晓明、任丽丽、杨海丽、曾庆丽。谷胱甘肽的功能分化S-转移酶表基因家族肺孢子虫揭示陆地植物大基因家族进化的复杂模式。植物杂志。2013;161(2):773 - 86。https://doi.org/10.1104/pp.112.205815.
- 51.
Dixon DP, Edwards R.谷胱甘肽转移酶。阿拉伯的书。2010;8:e0131。
- 52.
Rouhier N.Vieira Dos Santos C,Tarrago L,Rey P.植物甲硫醇亚砜还原酶A和B多烯型家族。Photosynth Res。2006; 89(2-3):247-62。https://doi.org/10.1007/s11120-006-9097-1.
- 53.
Tarrago L,Laugier E,Zaffagnini M,Marchand C,LeMaréchalP,Rouhier N等人。再生机制拟南芥甲硫氨酸亚砜还原酶B通过谷氨酸和硫氧化锡。J Biol Chem。2009; 284(28):18963-71。https://doi.org/10.1074/jbc.M109.015487.
- 54.
Pitsch NT, Witsch B, Baier M.叶绿体过氧化物酶系统的比较衣藻reinhardtii,苔藓植物肺孢子虫,肝脏江南卷柏还有种子植物拟南芥.BMC植物BIOL。2010; 10(1):133。https://doi.org/10.1186/1471-2229-10-133.
- 55.
谷氨酰基氧化酶(glutaredoxin)在花发育中的作用。植物生物学,2006;8:54 - 55。
- 56.
Gutsche n,Holtmannspötterm,maßl,o'donoghue m,busch a,lauri a等。具有TGA转录因子的Roxy谷氨酸依赖性DNA结合。植物直接。2017; 1:E00030。
- 57.
Couturier J,Koh CS,Zaffagnini M,Winger Am,Gualberto JM,Corbier C等人。用非典型WCSYS活性位点与叶绿素谷蛋白S12的结构功能关系。J Biol Chem。2009; 284:9299-310。
- 58.
Couturier J,Ströher E,Albetel A-N,Roret T,Muthuramalingam M,Tarrago L,et al.以拟南芥叶绿体谷胱甘肽C5为模型,探讨铁硫簇结合谷胱甘肽的分子决定因素。生物化学杂志。2011;286(31):27515–27.https://doi.org/10.1074/jbc.M111.228726.
- 59。
Bandyopadhyay S, Gama F, Molina-Navarro MM, Gualberto JM, Claxton R, Naik SG,等。叶绿体单硫醇谷胱甘肽蛋白作为[2Fe-2S]簇的组装和传递的支架蛋白。EMBO j . 2008; 27:1122-33。
- 60。
Zaffagnini M,Bedhomme M,Marchand Ch,Morisse S,Trost P,Lemaire SD。光合生物中的氧化还原调节:专注于谷胱甘肽。抗氧化氧化还原信号。2012; 16(6):567-86。https://doi.org/10.1089/ars.2011.4255.
- 61。
Rouhier N.植物谷胱甘肽:氧化还原生物学和铁硫中心组件的关键球员。新植物。2010; 186:365-72。
- 62。
关键词:拟南芥,glutaredoxin, S14,叶绿素含量植物细胞环境。2017;40:23 - 32。
- 63。
刘晓,刘松,冯勇,刘建忠,陈勇,范坤,等。拟南芥glutaredoxin AtGRXS16叶绿体n -末端GIY-YIG内切酶活性的结构研究国家自然科学学报2013;110(23):9565-70。https://doi.org/10.1073/pnas.1306899110.
- 64。
关键词:尼采;尼采;莫泽勒;线粒体单硫醇glutaredoxin S15是铁硫蛋白成熟的必要条件拟南芥.Proc Natl academy Sci usa 2015; 112:13735-40。
- 65。
Trnka D,Engelke Ad,Gellert M,Moseler A,Hossain MF,Lindenberg TT,等。用于氧化还原活性和转移谷氨酸氧化糖苷的不同功能的分子基础。NAT Communce。2020; 11(1):3445。https://doi.org/10.1038/s41467-020-17323-0.
- 66。
cocouturier J, Przybyla-Toscano J, Roret T, Didierjean C, Rouhier N. glutaredoxins连接Fe-S簇的作用:感知,转移还是修复功能?生物化学与生物物理学报。
- 67。
Xu L、Carrie C、Law SR、Murcha MW、Whelan J。陆地植物双靶蛋白的获取、保存和丢失。植物生理学。2013;161(2):644–62.https://doi.org/10.1104/pp.112.210997.
- 68。
GapA/B基因复制标志着链霉菌属(charpophytes and land plants)的起源。《生物学报》2006;23:1109-18。
- 69。
Zaffagnini M, Bedhomme M, Lemaire SD, Trost P. .叶绿体谷胱甘肽化的新作用。植物科学。2012;185 - 186:86 - 96。
- 70.
夏donnet S, Sakr S, Cassier-Chauvat C, Le Maréchal P, Chauvat F, Lemaire SD, et al.;第一个蛋白质组学研究S-蓝藻中的谷胱甘肽化。蛋白质组研究杂志,2015;14(1):59–71.https://doi.org/10.1021/pr500625a.
- 71.
ITO H,Iwabuchi M,Ogawa K.糖代谢酶醛糖酶和三糖 - 磷酸异构酶是谷胱甘肽中的靶标拟南芥:采用生物素化谷胱甘肽检测。植物生理学杂志。2003;44(7):655-60。https://doi.org/10.1093/pcp/pcg098.
- 72.
Dixon DP、Skipsey M、Grundy NM、Edwards R。应激诱导蛋白S在拟南芥-glutathionylation。植物杂志。2005;138(4):2233 - 44。https://doi.org/10.1104/pp.104.058917.
- 73.
Zaffagnini M,Bedhomme M,Groni H,Marchand Ch,Puppo C,Gontero B等人。光合模型生物中的谷胱甘肽衣藻reinhardtii:蛋白质组学调查。Mol细胞蛋白质组学。2012; 11: M111.014142。
- 74.
关键词:蛋白质组学,蛋白质组学,蛋白质组学S-nitrosylated和S-谷胱甘肽化蛋白在不同脱水耐性的小麦幼苗。植物生理学和生物化学。2016; 108:507-18。https://doi.org/10.1016/j.plaphy.2016.08.017.
- 75.
(1)米舍莱(Michelet)等。体内靶点S-thiolation衣藻reinhardtii.生物化学学报。2008;283(31):21571-8。https://doi.org/10.1074/jbc.M802331200.
- 76.
Chan KX, Mabbitt PD, Phua SY, Mueller JW, Nisar N, Gigolashvili T,等。通过失活SAL1磷酸腺苷磷酸酶来感知和传递叶绿体氧化应激。国家自然科学学报2016;113:E4567-76。
- 77.
Gurrieri L,Distefano L,Pirone C,恐怖D,Seung D,Zaffagnini M,等。硫杂辛毒素调节的α-淀粉酶3拟南芥是一个目标S- 乙醇化酶。前植物SCI。2019; 10:993。
- 78.
Storm AR, Kohler MR, Berndsen CE, Monroe JD。谷胱甘肽化作用抑制拟南芥β-淀粉酶3的催化活性,但不抑制拟南芥β-淀粉酶1的催化活性。生物化学。2018;57:711-21。
- 79.
关键词:水稻,光系统II,磷酸酶,氧化还原,选择性摩尔。2019;12:86 - 98。
- 80
López-Castillo LM, Jiménez-Sandoval P, Baruch-Torres N, Trasviña-Arenas CH, Díaz-Quezada C, Lara-González S,等。细胞质和叶绿体三磷酸异构酶氧化还原调控的结构基础拟南芥.植物科学与技术,2016;
- 81
Morisse S, Michelet L, Bedhomme M, Marchand CH, Calvaresi M, Trost P,等。硫氧还蛋白依赖性氧化还原调节的叶绿体磷酸甘油酸激酶衣藻reinhardtii. 生物化学杂志。2014;289(43):30012–24.https://doi.org/10.1074/jbc.m114.597997.
- 82。
Marri L、Thieulin Pardo G、Lebrun R、Puppo R、Zaffagnini M、Trost P等。CP12介导的对卡尔文-本森循环酶的氧化应激保护。生物化学。2014;97:228–37.
- 83。
Datta R,Kumar D,Sultana A,Hazra S,Bhattacharyya D,Chattopadhyay S.谷胱甘肽通过调节信使RNA稳定性来调节1-氨基环丙烷-1-羧酸合酶-1-羧酸氧化酶,通过调节信使RNA稳定性,以诱导乙烯合成期间诱导乙烯合成压力。植物理性。2015; 169:2963-81。
- 84。
Noguera-Mazon V, Lemoine J, Walker O, Rouhier N, Salvador A, Jacquot J- p等。谷胱甘肽化诱导解离1-Cys d -过氧化物还蛋白非共价同型二聚体。中国生物医学工程学报,2006;https://doi.org/10.1016/s0021 - 9258 (19) 84088 - 7.
- 85。
关键词:大麦,α -淀粉酶,转录后修饰,电喷雾质谱生物技术股份有限公司1993;11:1162-5。
- 86。
Castella C, Mirtziou I, Seassau A, Boscari A, Montrichard F, Papadopoulou K等。转录后修饰的截形苜蓿一氧化氮诱导谷胱甘肽过氧化物酶1。中国生物医学工程学报。2017;68:125-36。https://doi.org/10.1016/j.niox.2017.02.004.
- 87。
Bedhomme M,Adamo M,Marchand Ch,Couturier J,Rouhier N,Lemaire SD等。来自模型植物的胞质甘油糖醛-3-磷酸脱氢酶的谷胱甘肽拟南芥在体外被谷氧还蛋白和硫氧还蛋白逆转。j . 2012; 445(3): 337 - 47。https://doi.org/10.1042/BJ20120505.
- 88。
关键词:植物甘氨酸脱羧酶,s-亚硝基化,谷胱甘肽硫酰化植物杂志。2010;152(3):1514 - 28。https://doi.org/10.1104/pp.109.152579.
- 89。
Leferink NGH, van Duijn E, Barendregt A, Heck AJR, van Berkel WJH。半乳糖内酯脱氢酶需要氧化还原敏感的硫醇来生产维生素c。植物生理学。2009;
- 90
Ma T, Yoo M-J, Zhang T, Liu L, Koh J, Song W-Y, et al. .巯基氧化还原改性的表征芸苔属植物显著snf1相关蛋白激酶2.6-2C。FEBS Open Bio. 2018; 8:628-45。
- 91
Iglesias MJ,Terrile MC,Correa Aragunde N,Colman SL,Izquierdo-Álvarez A,Fiol DF,等。通过基因工程调控sFTIR1/AFBs E3连接酶组装S拟南芥SKP1样的 - 赤膜化对养肝信号传导的影响。氧化还原生物。2018; 18:200-10。https://doi.org/10.1016/j.redox.2018.07.003.
- 92
Calderón A, Lázaro-Payo A, Iglesias-Baena I, Camejo D, Lázaro JJ, Sevilla F, et al.;豌豆叶绿体2-Cys Prx和线粒体Prx IIF的谷胱甘肽化影响其结构和过氧化物酶活性,硫氧还蛋白去谷胱甘肽化仅影响2-Cys Prx。植物科学与技术,2017;
- 93.
等。中国生物医学工程学报(英文版)氯塑料甘油醛-3-磷酸脱氢酶不依赖硫氧还蛋白的异构体是由谷胱甘肽化选择性调节的。2月j . 2007; 274:212-26。
- 94.
Tanz Sk,Castleden I,Hooper Cm,Vacher M,小我,Millar HA。SUBA3:用于整合实验和预测的数据库,以确定拟南芥中蛋白质的亚细胞位置。核酸RES。2013; 41(数据库问题):D1185-91。
- 95.
Cairns NG, Pasternak M, Wachter A, Cobbett CS, Meyer AJ。拟南芥种子的成熟依赖于胚内谷胱甘肽的生物合成。植物杂志。2006;141:446-55。
- 96.
帕斯捷尔纳克M,林B,维茨M,地狱R,科贝特CS,迈耶AJ。限制谷胱甘肽生物合成到细胞质是足够的正常植物发育。植物J细胞分子生物学。2008;53:999–1012.
- 97.
大惊小怪j,liegmann o,krause k,rensing sa。绿色靶向预测指标和模糊靶向预测仪2:植物蛋白靶向预测和异源系统瞬态蛋白表达的缺陷。新植物。2013; 200(4):1022-33。https://doi.org/10.1111/nph.12433.
- 98.
拟南芥中抗坏血酸脱氢还原酶对抗坏血酸和谷胱甘肽的氧化还原调节是抗坏血酸和谷胱甘肽耐强光胁迫的必要条件。生物化学学报。2016;80(5):870-7。https://doi.org/10.1080/09168451.2015.1135042.
- 99.
关键词:碳源,碳源,碳源,碳源引用本文谷胱甘肽过氧化物酶样酶覆盖5个不同的细胞室和膜表面拟南芥:拟南芥GPXLs的亚细胞定位。植物细胞环境。2017;40:1281-95。
- 100
Romero-Puertas MC,Laxa M,MattèA,Zaninotto F,Finkemeier I,Jones Ame等。过氧化唑辛II E的S-亚硝基化促进过氧基硫酸盐介导的酪氨酸硝化。植物细胞。2007; 19:4120-30。
- 101。
程乃华,刘建忠,刘建忠。AtGRXcp是一种拟南芥叶绿体glutaredoxin,对于防止蛋白质氧化损伤至关重要。生物化学杂志。2006;281:26280-8。
- 102。
郭y,黄c,谢y,宋f,zhou x.番茄果酱毒素基因Slgrx1调节植物对氧化,干旱和盐胁迫的反应。Planta。2010; 232:1499-509。
- 103。
Zaffagnini M、Michelet L、Massot V、Trost P、Lemaire SD。大豆谷胱甘肽的生化特性衣藻reinhardtii揭示了叶片CGFS型谷氨酸毒素的独特性质。J Biol Chem。2008; 283(14):8868-76。https://doi.org/10.1074/jbc.m709567200.
- 104。
UniProt财团。UniProt:全球蛋白质知识中心。核酸研究2019;47:D506-15。
- 105。
Akter S,Huang J,Waszczak C,Jacques,Gevaert K,Van Breusegem F,等.植物中活性氧攻击下的半胱氨酸:蛋白质组学观点。J实验机器人。2015;66:2935–44.
- 106。
关键词:植物,硫醇,非生物胁迫,生物活性2013;14(4): 7405-32。https://doi.org/10.3390/ijms14047405..
- 107。
加洛利,嗯,斯塔克,米耶尔JJ。谷胱甘肽催化巯基二硫键交换的机理和动力学细节及潜在的调控机制。抗氧化氧化还原信号。2009;11:1059–81.
- 108。
吉尔伯特高频。硫醇/二硫键交换平衡和二硫键稳定性。方法Enzymol。1995;251:8-28。
- 109。
Michelet L, Zaffagnini M, Massot V, Keryer E, Vanacker H, Miginiac-Maslow M,等。硫氧还蛋白、谷胱甘肽还蛋白和谷胱甘肽酰化:有待探索的新交叉。Photosynth杂志2006;89:225-45。
- 110
植物中活性氧与一氧化氮之间的串扰:关键作用S-nitrosoglutathione还原酶。自由基生物医学。2018;122:110-5。https://doi.org/10.1016/j.freeradbiomed.2017.11.027.
- 111
Giustarini D, Milzani A, Aldini G, Carini M, Rossi R, Dalle-Donne I。S-亚硝化与S-蛋白质巯基的谷胱甘肽化反应S-nitrosoglutathione。抗氧化氧化还原信号。2005;7(7):930-9。https://doi.org/10.1089/ars.2005.7.930.
- 112
Niazi AK, Bariat L, Riondet C, Carapito C, Mhamdi A, notor G等。胞质异柠檬酸脱氢酶拟南芥是由谷胱甘肽化调节的。抗氧化剂。2019;8(1):16。https://doi.org/10.3390/antiox8010016.
- 113.
Zaffagnini M,De Mia M,Morisse S,Di Giacinto N,Marchand Ch,Maes A等人。蛋白质S光合生物中的-亚硝基化:综合综述和未来展望。生物化学与生物物理学报(英文版)
- 114.
De Smet B, Willems P, fernandez AD, Alseekh S, Fernie AR, Messens J等。体内质体中蛋白质半胱氨酸磺基化的检测。植物J细胞分子生物学。2019;97:765–78.
- 115.
黄杰,P,B,C,RB,N,等。蛋白质的挖掘S-sulfenylation在拟南芥中揭示氧化还原敏感位点。2019;116(42): 21256-61。https://doi.org/10.1073/pnas.1906768116..
- 116.
Akter S,Huang J,Bodra N,De Smet B,Wahni K,Rombaut D等.基于DYn-2的拟南芥亚砜组鉴定。分子细胞蛋白质组学。2015;14(5):1183–200.https://doi.org/10.1074/mcp.m114.046896.
- 117.
Zaffagnini M, Marchand CH, Malferrari M, Murail S, Bonacchi S, Genovese D等。谷胱甘肽酰化促进可溶性甘油醛-3-磷酸脱氢酶后期坍缩成不可溶性聚集体。2019;116(51): 26057-65。https://doi.org/10.1073/pnas.1914484116.
- 118.
Seung D, Thalmann M, Sparla F, Abou Hachem M, Lee SK, Issakidis-Bourguet E,等。拟南芥AMY3是一种独特的氧化还原调节的叶绿体α-淀粉酶。生物化学杂志。2013;288:33620-33。
- 119.
Rosa-Téllez S、Anoman AD、Flores Tornero M、Toujani W、Alseek S、Fernie AR等。磷酸甘油酸激酶共同调节新陈代谢和优化生长。植物生理学。2018;176:1182–98.
- 120.
Chatterjee A,Abeydeera ND,Bale S,Pai P-J,Dorrestein PC,Russell Dh等人。酿酒酵母酿酒酵母THI4p是一种自杀型硫胺噻唑合成酶。大自然。2011;478:542-6。
- 121.
Godoi Phc,Galhardo Rs,Luche DD,Van Sluys M-A,Menck CFM,Oliva G.噻唑生物合成酶的结构拟南芥.J Biol Chem。2006; 281(41):30957-66。https://doi.org/10.1074/jbc.M604469200.
- 122
Thalmann M, Pazmino D, Seung D, Horrer D, Nigro A, Meier T,等。脱落酸对叶片淀粉降解的调节是植物抗渗透胁迫的重要机制。植物细胞。2016;28(8):1860 - 78。https://doi.org/10.1105/tpc.16.00143.
- 123
Zhao C, Wang Y, Chan KX, Marchant DB, Franks PJ, Randall D,等。叶绿体逆行信号的进化有利于绿色植物适应陆地环境。中国科学:地球科学;2019;https://doi.org/10.1073/pnas.1812092116.
- 124
关键词:拟南芥,铁氧还原蛋白,后基因组特征植物杂志。2004;134(1):255 - 64。https://doi.org/10.1104/pp.103.032755.
- 125。
等。植物基因组:绿色植物基因组学的比较平台。核酸研究2012;40(数据库版本):D1178-86。https://doi.org/10.1093/nar/gkr944.
- 126。
Waterhouse AM, Procter JB, Martin DMA, Clamp M, Barton GJ。Jalview版本2——一个多序列对齐编辑器和分析工作台。生物信息学。2009;25(9):1189 - 91。https://doi.org/10.1093/bioinformatics/btp033.
- 127。
Ronquist F, Huelsenbeck JP。MrBayes 3:混合模型下的贝叶斯系统发育推理。生物信息学。2003;19(12):1572 - 4。https://doi.org/10.1093/bioinformatics/btg180.
- 128。
Trifinopoulos J, Nguyen L-T, von Haeseler A, Minh BQ。W-IQ-TREE:最大似然分析的快速在线系统发育工具。核酸杂志2016;44(W1): W232-5。https://doi.org/10.1093/nar/gkw256.
确认
我们感谢Peter教授Szövenyi提供的建议和BLAST-access to the灰花基因组。
资金
该研究通过DAD(PPP意大利57397466)和MIUR之间的联合移动计划部分资助。我们通过研究培训小组Grk 2064“水使用效率和干旱应激反应:从拟南芥到大麦的拟南芥(A.J.m.m.b.b.b.b.m.m.-s.)来支持Deutsche Forschungsgemeinschaft(DFG)的支持这些融资机构在研究和收集,分析和数据的描述方面没有作用,也没有在撰写手稿中的作用。开放访问资金支持,由Projekt交易组织。
作者信息
隶属关系
贡献
SJM-S和MZ构思了这项研究。FB、JR和SJM-S分析数据并编制数据。FB、JR、PT、AJM、MZ、SJM-S对数据进行讨论并撰写文章。所有作者阅读并批准最终稿件。
相应的作者
伦理宣言
道德认可和参与同意
不适用。
同意出版
不适用。
相互竞争的利益
作者声明他们没有相互竞争的利益。
附加信息
出版商的注意
斯普林格自然保持中立,就管辖权的要求,在出版的地图和机构的联系。
补充信息
附加文件1:表S1。
包含蛋白质模型信息和目标。
附加文件2:图S2
.DHAR系统发育树。(a) DHAR亚型的系统发育树(P. Paten.根据Liu et al. (2013) [50]使用MRBAYES,节点值和线权重描绘后验概率(RUN参数:混合蛋白质模型,rates = Invamma,几代人数:2 * 106.,烧伤= 20%,分流频率<0.01)。1.P. Paten.DHAR1在线粒体和质体蛋白质组中被鉴定和定量[49并被假定为双重目标。TargetP2.0 (T) (46],定位器(l) [47]和PredAlgo (P) [48预测(附加文件1.表S1)表明多个DHAR同源物的高度可变靶向(M,线粒体;P,质体;啊,其他;年代,分泌)。指示序列中N端扩展(ext. N)的存在(对号)或不存在(X);NA:没有被评估为可能不完整的序列。基因标识符是根据所使用的基因模型轮藻braunii(查布拉),灰花波恩应变(AaBonn),Marchantia polymorpha(马波利),PhysComitrium Patens.(PP),Selaginella Moellendorffii.(塞尔莫),Salvinia cucullata(Sacu),红萍filiculoides(Azfi),Brachypodium distachyon(Bradi)和拟南芥(在)并且另外作为图2中的颜色编码。1..颜色图例:Cb =轮藻braunii; Aa级 = 灰花;议员=Marchantia polymorpha; 第页 = PhysComitrium Patens.;Sm =江南卷柏; 南卡罗来纳州 = Salvinia cucullata;af = 红萍filiculoides;Bd =Brachypodium distachyon; 在 = 拟南芥.(b)蛋白质的n端部分对齐(Jalview)显示n端延伸的存在或不存在,表明假定的n端靶向肽。色系:ClustalX。
附加文件3:图S3。
lambda型和iota型GSTs的系统发育树。(a) lambda型和iota型谷胱甘肽系统发育树S-转移酶异构体(P. Paten.根据Liu et al. (2013) [50]使用MRBAYES,节点值和线权重描绘后验概率(RUN参数:混合蛋白质模型,rates = Invamma,几代人数:2 * 106.,烧成 = 20%,分频< 0.01). 目标P2.0(T)[46],定位器(l) [47]和PredAlgo (P) [48预测(附加文件1.表S1)表明GSTL和GSTI亚型对质体(M,线粒体;P,质体;啊,其他;年代,分泌)。指示序列中N端扩展(ext. N)的存在(对号)或不存在(X);NA:没有被评估为可能不完整的序列。基因标识符是根据所使用的基因模型衣藻reinhardtii(Cre),轮藻braunii(查布拉),灰花波恩应变(AaBonn),Marchantia polymorpha(马波利),PhysComitrium Patens.(PP),Selaginella Moellendorffii.(塞尔莫),Salvinia cucullata(Sacu),红萍filiculoides(Azfi),Brachypodium distachyon(Bradi)和拟南芥(在)并且另外作为图2中的颜色编码。1..颜色图例:Cb =轮藻braunii; Aa级 = 灰花;议员=Marchantia polymorpha; 第页 = PhysComitrium Patens.;Sm =江南卷柏; 南卡罗来纳州 = Salvinia cucullata;af = 红萍filiculoides;Bd =Brachypodium distachyon; 在 = 拟南芥.(b)蛋白质的n端部分对齐(Jalview)显示n端延伸的存在或不存在,表明假定的n端靶向肽。色系:ClustalX。
附加文件4:图S4
.系统发育树的甲硫氨酸亚砜还原酶B (MSRB) isoforms构建使用MrBayes,节点值和线权描述后概率(运行参数:混合蛋白模型,率= invgamma,代数:2*106.,烧成 = 20%,分频< 0.01). 目标P2.0(T)[46],定位器(l) [47]和PredAlgo (P) [48预测(附加文件1.表S1)表明MSRB1亚型针对质体的可变靶点(M,线粒体;P,质体;啊,其他;年代,分泌)。指示序列中N端扩展(ext. N)的存在(对号)或不存在(X);NA:没有被评估为可能不完整的序列。基因标识符是根据所使用的基因模型衣藻reinhardtii(Cre),轮藻braunii(查布拉),灰花波恩应变(AaBonn),Marchantia polymorpha(马波利),PhysComitrium Patens.(PP),Selaginella Moellendorffii.(塞尔莫),Salvinia cucullata(Sacu),红萍filiculoides(Azfi),Brachypodium distachyon(Bradi)和拟南芥(在)并且另外作为图2中的颜色编码。1..颜色图例:Cb =轮藻braunii; Aa级 = 灰花;议员=Marchantia polymorpha; 第页 = PhysComitrium Patens.;Sm =江南卷柏; 南卡罗来纳州 = Salvinia cucullata;af = 红萍filiculoides;Bd =Brachypodium distachyon; 在 = 拟南芥.(b)蛋白质的n端部分对齐(Jalview)显示n端延伸的存在或不存在,表明假定的n端靶向肽。色系:ClustalX。(c)在H2.O2.,蛋氨酸会被氧化,这种修饰可以通过MSRB来解决-R-亚砜。非典型(1Cys)MSRB的GRX依赖反应机制是通过S-glutathionylation中间(53].GRX依赖机制生成GSSG,反过来需要GR以减少GR。(PDF 156 KB)。(d)苏氨酸在与ATMSRB1 THR132(红色箭头)的相对位置。颜色方案:Clustalx。
附加文件5:图S5。
过洛昔洛蛋白II E.(a)使用MRBAYES,节点值和线重量构建的过洛昔洛蛋白IIE(PRXIIE)的体芽孢杆菌树的系统发育树(PREXIIE),节点值和线重量描绘了后验概率(RUN参数:混合蛋白质模型,Rates = Invamma,几代人数:2 * 106.,烧成 = 20%,分频< 0.01). 目标P2.0(T)[46]预测表明,PREXIIE同种型的保守靶向塑体,而定位器(L)[47]和PredAlgo (P) [48预测各不相同(M,线粒体;P,质体;啊,其他;S,秘书)(附加文件1.表S1)。指示序列中N端扩展(ext. N)的存在(对号)或不存在(X);NA:没有被评估为可能不完整的序列。基因标识符是根据所使用的基因模型轮藻braunii(查布拉),灰花波恩应变(AaBonn),Marchantia polymorpha(马波利),PhysComitrium Patens.(PP),Selaginella Moellendorffii.(塞尔莫),Salvinia cucullata(Sacu),红萍filiculoides(Azfi),Brachypodium distachyon(Bradi)和拟南芥(在)并且另外作为图2中的颜色编码。1..颜色图例:Cb =轮藻braunii; Aa级 = 灰花;议员=Marchantia polymorpha; 第页 = PhysComitrium Patens.;Sm =江南卷柏; 南卡罗来纳州 = Salvinia cucullata;af = 红萍filiculoides;Bd =Brachypodium distachyon; 在 = 拟南芥.(b)蛋白质的n端部分对齐(Jalview)显示n端延伸的存在或不存在,表明假定的n端靶向肽。色系:ClustalX。
附加文件6:图S6。
I类GRX系统发育树。(a)用MrBayes方法构建I类glutaredoxin (GRX)亚型的系统发育树,节点值和线权描述了后概率;支持度低于50%的节点被瓦解(运行参数:混合蛋白模型,率= invgamma,代数:4*106.,烧成 = 20%,分频< 0.01). 目标P2.0(T)[46],定位器(l) [47]和PredAlgo (P) [48]定位预测(附加文件1.表S1)表示(M,线粒体;P,质体;啊,其他;年代,分泌)。指示序列中N端扩展(ext. N)的存在(对号)或不存在(X);NA:没有被评估为可能不完整的序列。基因标识符是根据所使用的基因模型轮藻braunii(查布拉),灰花波恩应变(AaBonn),Marchantia polymorpha(马波利),PhysComitrium Patens.(PP),Selaginella Moellendorffii.(塞尔莫),Salvinia cucullata(Sacu),红萍filiculoides(Azfi),Brachypodium distachyon(Bradi)和拟南芥(在)并且另外作为图2中的颜色编码。1..颜色图例:Cb =轮藻braunii; Aa级 = 灰花;议员=Marchantia polymorpha; 第页 = PhysComitrium Patens.;Sm =江南卷柏; 南卡罗来纳州 = Salvinia cucullata;af = 红萍filiculoides;Bd =Brachypodium distachyon; 在 = 拟南芥.(b)蛋白质的n端部分对齐(Jalview)显示n端延伸的存在或不存在,表明假定的n端靶向肽。色系:ClustalX。
附加文件7:图S7
.质体靶向II类GRX的系统发育树。(a)用MrBayes方法构建了质体II类glutaredoxin (GRX) S14和S16亚型的系统发育树,节点值和线权描述了后概率;支持度低于50%的节点被瓦解(运行参数:混合蛋白模型,率= invgamma,代数:2*106.,烧成 = 20%,分频< 0.01). 目标P2.0(T)[46]预测表明GRXS14和GRXS16异构体保守靶向质体,而定位子(L)[47]和PredAlgo (P) [48预测各不相同(M,线粒体;P,质体;啊,其他;S,秘书)(附加文件1.表S1)。指示序列中N端扩展(ext. N)的存在(对号)或不存在(X);NA:没有被评估为可能不完整的序列。基因标识符是根据所使用的基因模型轮藻braunii(查布拉),灰花波恩应变(AaBonn),Marchantia polymorpha(马波利),PhysComitrium Patens.(PP),Selaginella Moellendorffii.(塞尔莫),Salvinia cucullata(Sacu),红萍filiculoides(Azfi),Brachypodium distachyon(Bradi)和拟南芥(在)并且另外作为图2中的颜色编码。1..颜色图例:Cb =轮藻braunii; Aa级 = 灰花;议员=Marchantia polymorpha; 第页 = PhysComitrium Patens.;Sm =江南卷柏; 南卡罗来纳州 = Salvinia cucullata;af = 红萍filiculoides;Bd =Brachypodium distachyon; 在 = 拟南芥.(b)GRXS14蛋白对准(JALVIEW)的N-末端部分(JALVIEW)显示指示推定的N-末端靶向肽的N-末端延伸的存在或不存在。色系:ClustalX。(c)GRXS16蛋白对准(JALVIEW)的N-末端部分显示存在或不存在指示推定的N-末端靶向肽的N-末端延伸。颜色方案:Clustalx。
附加文件8:图S8
. 谷胱甘肽还原酶(GR)的系统发育树(a) 利用MrBayes、节点值和线宽构建的谷胱甘肽还原酶亚型系统发育树描述了后验概率;支持率低于50%的节点被折叠(运行参数:混合蛋白质模型,速率) = invgamma,世代数:0.5*106.,烧成 = 20%,分频< 0.01). 目标P2.0(T)[46],定位器(l) [47]和PredAlgo (P) [48]定位预测(附加文件1.表S1)表示(m,线粒体; p,plastid; o,其他; s,secretory);GR2同种型保守双重靶向的实验证据:1.[67],2.[29.]. 指示序列中是否存在N端延伸(ext.N)。根据所使用的基因模型给出了基因识别码衣藻reinhardtii(Cre),轮藻braunii(查布拉),灰花波恩应变(AaBonn),Marchantia polymorpha(马波利),PhysComitrium Patens.(PP),Selaginella Moellendorffii.(塞尔莫),Salvinia cucullata(Sacu),红萍filiculoides(Azfi),Brachypodium distachyon(Bradi)和拟南芥(在)并且另外作为图2中的颜色编码。1..更多的物种:诺:发菜规格。;灰花牛津(Aaoxford),斑花(美联社),(40].颜色图例:Cb =轮藻braunii; Aa级 = 灰花;议员=Marchantia polymorpha; 第页 = PhysComitrium Patens.;Sm =江南卷柏; 南卡罗来纳州 = Salvinia cucullata;af = 红萍filiculoides;Bd =Brachypodium distachyon; 在 = 拟南芥.(b)GR蛋白对准的N-末端部分(JALVIEW)显示指示推定的N-末端靶向肽的N-末端延伸的存在或不存在。红条标记缺乏细菌和花青族缺乏的序列的突出典范,通过水平基因转移(HGT)支持起源。与细菌GRS相比,HGT获得的GRS具有推定的N-末端延伸。颜色方案:Clustalx。
附加文件9:表S2
.的列表S- 乙醇化位点和生物。
额外的文件10
包含用于评估已知保护的所有对齐的单词文件S-Glutathionylation在Fasta格式的塑性蛋白上的硫酸化位点。
附加文件11。
包含与其他被子植物序列AMY3对齐的字文件。
额外的文件12。
包含用于在Fasta格式构建系统发育树的所有对齐的单词文件。
附加文件13。
包含替代方法(最大可能性)产生的系统发育树的单词文件。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
Bohle, F., Rossi, J.;等等。质体氧化还原网络的可塑性:谷胱甘肽依赖的氧化还原级联和谷胱甘肽化位点的进化。BMC植物杂志21,322 (2021)。https://doi.org/10.1186/s12870-021-03087-2
收到了:
认可的:
发表:
关键词
- 蛋白质S-Glutathionylation
- 氧化还原调控
- 陆地植物进化
- 质体
- 半胱氨酸
- 谷胱甘肽
- 谷胱甘肽