摘要
背景
菠菜(菠菜叶长、叶宽、叶柄长等叶片相关性状是重要的经济性状。然而,潜在的基因仍然不清楚。对菠菜叶片相关性状进行QTL定位。
结果
八国派团1.利用群体构建2015年和2019年叶片长度、叶宽、叶柄长、叶宽比的连锁图谱,并进行QTL定位。利用特异性位点扩增片段测序(SLAF-seq)和竞争性等位基因特异性PCR (KASP)技术,分别构建了两种遗传连锁图谱1.人口在2015年。根据2015年的结果,使用BC生成检测到的特异连锁群(LG)1.共检测到13个与叶相关性状的qtl,只有5个qtl在多年或连锁图谱中被重复检测。有趣的是,叶长、叶柄长和叶长宽比的主要qtl与相同的SNP标记(KM3102838、KM1360385和KM2191098)高度相关。从41.470出发,在1号染色体上定位了叶宽的主效QTL−42.045兆。共鉴定出44个基因。GO分析结果表明,这些基因在核糖核酸酶、裂解酶活性、磷酸二酯键水解过程和细胞壁成分等方面都有显著的富集,从而可能通过改变细胞大小来决定叶片的形状。
结论
重复检测到叶叶相关性状的五个QTL至少两年或联系地图。叶片长度,叶柄长度和叶片长度与宽度的比例的主要QTL映射在同一基点上。和三个基因(SPO10792,SPO21018,Spo21019型)被鉴定为叶宽的重要候选基因。
背景
菠菜(菠菜L.)是一种经济意义重大的叶菜,在世界各地种植。它也被认为是最有营养的蔬菜之一,因为它含有大量对人体健康有益的物质,包括维生素A、E、C、K、叶黄素、叶酸、草酸、钙、铁、磷和钾[1.,2.,3.].菠菜起源于中东(可能是伊朗),已经种植了两千多年。中国早在七世纪就开始种植菠菜,比欧美早[4.].中国是最大的生产国,其次是美国和日本[2.]. 2014年,全球菠菜产量估计约为2430万吨,91 % 其中一种是在中国生产的[5.].
菠菜是一个属于苋菜科家族的二倍体物种,通常被定义为巨型,但偶尔是单一的物种[6.,7.].叶片特征,如叶片类型(萨沃伊,半浮雕,平滑型),叶子长度和宽度,叶片直立,叶柄长度和颜色,边缘形状被认为是重要的农艺特征,对菠菜育种产生重大影响。例如,直立的叶子更有可能适应高密度菠菜生产和机械收获。此外,Savoy和Semi-Savoy叶片类型的菠菜通常适用于新鲜市场消耗,而平滑类型对于冻结产品和沙拉普遍存存[3.,8.]. 这些性状是典型的由多基因控制的数量性状,同时也受到环境条件的显著影响[9].到目前为止,只有少数报告已在菠菜中公布与分子标志物相关的叶相关性状。马等人。(2016)[3.]利用测序(GBS)技术对菠菜的表面结构、边缘形状和叶柄颜色进行关联图谱分析,发现5、7和14个单核苷酸多态性(SNP)标记分别与表面结构、边缘形状和叶柄颜色相关。最近,蔡等人(2018)[5.]利用GBS技术和叶片颜色(红/绿)的QTL定位。结果表明,一个主效QTL占表型变异的69.3%。但叶片类型(长、宽)和叶柄长度的qtl仍不清楚。因此,qtl的定位对菠菜的改良具有重要的影响。
遗传联系地图是一种强大的基因组工具,已广泛用于QTL映射,基因映射,全基因组组装和标记辅助选择(MAS)[10.]. 迄今为止,已有5个菠菜遗传连锁图谱被报道。第一张遗传图谱包含101个扩增片段长度多态性(AFLP)和9个简单序列重复序列(SSR),它们是用PCR标记生成的[11.].将该地图分为七个连杆组,跨越585厘米,相邻标记平均为5.18厘米,用于分析性别判定基因座的位置[11.]. 第二张遗传图谱为433.6cm,由283个SNP标记组成[12.]. 将该图谱分为6个连锁群,与菠菜染色体数目一致,利用该连锁图谱鉴定了39个与菠菜氮素利用效率相关的qtl[12.].利用特异性位点扩增片段测序(SLAF-seq)技术和4,080个SNP标记构建了第三张遗传图谱,长度为11,125.97 cM,相邻标记间平均距离为0.31 cM [13.].第四个遗传图谱由Xu等人构成。(2017)[14.]并且它含有六个连杆基团,发现463 MB菠菜基因组支架用870个SNP标记锚定到遗传图谱。最近,Cai等人。(2018)[5.]构建更新的高密度遗传图谱,以映射叶子颜色(Ref / Green)。如使用GBS技术测量的,地图含有六个跨越1539.96cm的连杆组,并且平均标记间隔为0.4cm。
多态性DNA标记的类型和数量在构建高密度遗传连锁图谱中起着重要作用。迄今为止,已经发现了多种DNA标记,包括限制性片段长度多态性(RFLP)、随机扩增多态性DNA(RAPD)、AFLP、SSR和SNP[15.,16.].SNP是最常见的DNA标记类型,具有高丰度,可支持成本效益和快速筛选处理[17.]. KASP是一种基于PCR的同质荧光SNP基因分型技术,可以区分不同荧光(如FAM和HEX荧光)的等位基因[18.].随着成本效益,适应性和效率的优点,该技术广泛应用于许多物种,包括小麦[19.,番茄20.]和玉米[21.].
在研究中,高密度菠菜遗传图[13.用于映射叶片长度(LL),叶片宽度(LW),叶柄长度(PL)的QTL,以及叶长度与宽度(LR)的比率。此外,为了验证SLAF标记的真实性,我们使用基于KASP技术的SLAF标记构建了遗传联系地图,并试图使用联动地图来映射四个特征。我们的目标是为菠菜中的MAS开发DNA分子标记,可用于改善菠菜的作物和未来研究。
结果
鉴定SNP标记和基因分型
为了验证SLAF-seq技术4080个SLAF标记的准确性(表S1.)[13.[我们均匀地从六个高密度连杆组中选择了300个SLAF标记,以构建基于KASP技术的均匀分布标记的连杆图。标记用于基因型BC1.个人。在这300个标记中,有119个标记由于缺少分离、扭曲分离或信号而无法获得。因此,利用剩余的181个有效标记生成连锁图谱(图1)。1.).
施工联系地图
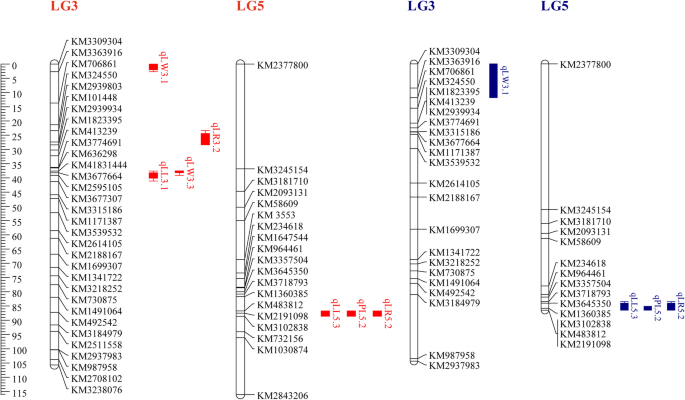
为了建立一个基于SNP的遗传连锁图谱,我们选择了181个信息性SNP标记和147个BC1.来自2015年的个人用于使用JoinMap4.0软件进行联系分析。将所有标记物映射到分为六个连杆基团(LG1至LG6)的遗传映射上,这与菠菜染色体的数量一致(图。1.和表S.2.).连锁图谱总大小为585.45 cM,平均区间为3.23 cM。标记数量最多的连锁群为LG1,共68个SNP标记,跨越96.29 cM。LG4的长度为109.911 cM,包含18个标记,是6个连锁群中标记数量最少的。由于缺乏足够的均匀分布标记,LG1、LG4和LG5存在一定的缺口,但也存在具有均匀分布标记的连锁群,如LG2和LG3。根据qtl的结果,利用BC1.从2015年起(图。2.和3.),利用位于LG3和LG5上的标记生成遗传图谱,并尝试利用BC对4个性状进行定位1.(表S3.).
BC表型资料分析1.人口
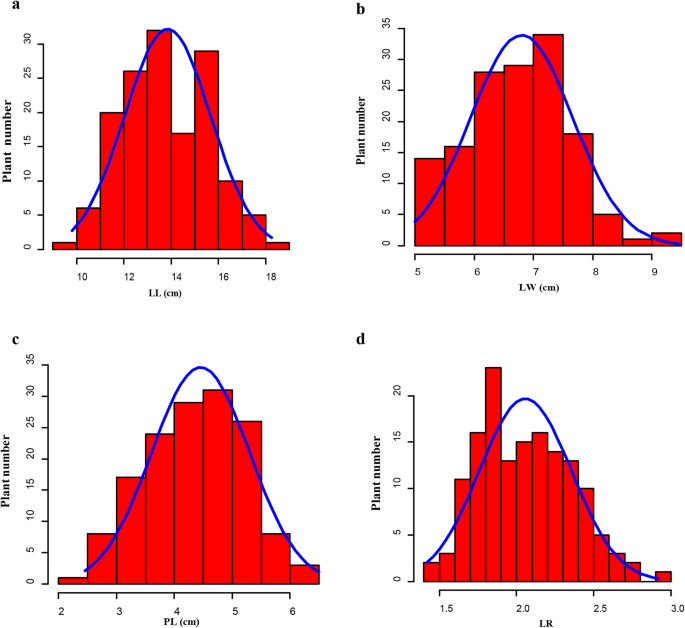
BC的叶子相关性状1.线条总结在表格中1.. 至于2015年的个体,LL差异很大,从9.80到18.25 cm不等,平均为13.85 cm。LW范围为5.00~9.45cm,平均6.80cm。PL值为2.45~6.50cm,平均4.45cm。不列颠哥伦比亚省1.2019年的线路在2015年相对于个人的LL,LW和PL分享了更高的价值(表S.4.).LL、LW、PL、LR在BC的频率分布1.2015年至2019年的人口持续分布(图。4.A、b、c、d;无花果。1.A, b, c, d),代表由多个基因控制的四种性状。此外,LL与PL呈显著正相关(R= 0.82)1.2015年人口,但2019年与LW(r = 0.73)相关(表2.),可能受到环境的影响。
叶子相关性状的QTL映射
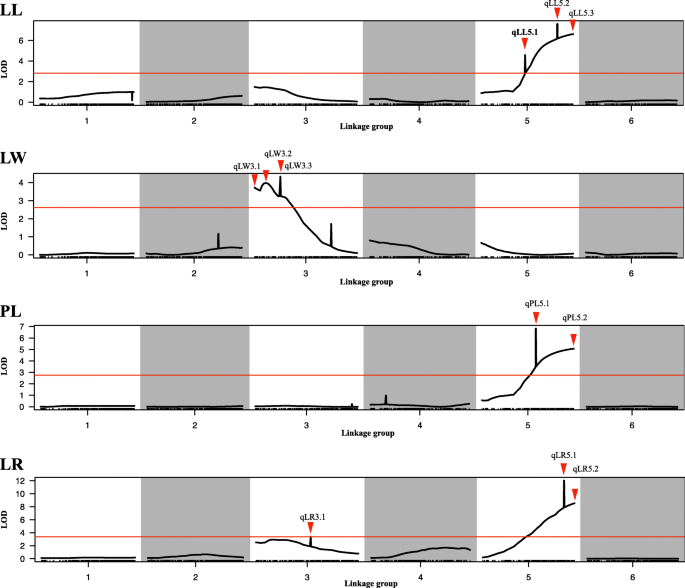
基于L1(2.8),LW(2.6),PL(2.8)和LR(3.4),检测到的四种性状的13个QTL的LOD阈值,发现使用三个联系地图在LG3和LG5上分布:由SLAF-SEQ产生的高密度遗传图(Qian等人2017),由BC构建的遗传地图1.2015 - 2019年分别使用KASP技术。(表3.)(图。2.和3.).
LL基因共鉴定出4个qtl (qLL5.1、qLL5.2、1LL5.3和qLL3.1),分布在LG5和LG3上。只有qLL5.3在3个连锁图谱上重复检测到,LOD值在6.61 ~ 24.58之间,能够解释14.2 ~ 50.7%的表型变异。根据3个连锁图谱的分析结果,3个最接近的标记Marker3102838、KM2191098和KM1360385位于76.692 ~ 77.340 cM区域,与qLL5.3显著相关(图3)。3.).
找到了三个QTL用于LW:QLW3.1,QLW3.2和QLW3.3。QLW3.3是一个主要的QTL,在2015年的两个联动地图上反复检测到,而在三张连杆地图上反复发现次要QTL QLW3.1。QLW3.3,靠近两个相邻标记Marker3677664和KM41831444,LOD评分为3.9-4.434,并解释了9-9.3%的表型变异。较小的LW QTL,靠近标记KM3309304(Marker3309304)的LOD评分为2.02-3.72,并解释了5.7-6.9%的表型变异。
在3个连锁图谱上均发现2个qtl (qPL5.1和qPL5.2),其中qPL5.2在3个连锁图谱上重复鉴定,LOD值为5.06 ~ 12.14。该QTL (qPL5.2)在LG5上检测到,在邻近的两个标记KM2191098和KM3102838 (Marker3102838)上有一个峰值,可解释16.5 ~ 31.6%的表型变异和0.67 ~ 1.84的加性效应。
对于LR,发现了四个QTL(QLR5.1,QLR5.2,QLR3.1和QLR3.2)。QLR5.2被发现是一个主要的QTL,LOD得分为8.53-14.76,并在三张联系地图上反复检测到。有趣的是,QLL5.3,QPL5.2和QLR5.2在三个联系地图上检测到,并在LG5的相同轨迹上映射,接近三个相邻标记KM1360385,KM2191098和KM3102838。
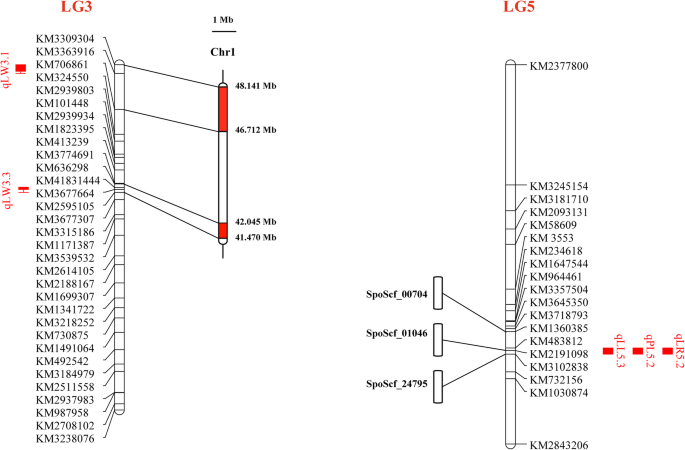
3个主要qtl (qLL5.3、qPL5.2和qLR5.2)与KM1360385、KM2191098和KM3102838高度相关,分别位于3个scaffold (SpoScf_00704 (321,888 bp)、SpoScf_01046 (226,571 bp)和SpoScf_24795 (1428 bp)上。主效QTL qLW3.3在41.470−42.045 Mb,次效QTL qLW3.1在46.712−48.141 Mb。5.). 以上菠菜参考数据库来自菠菜基地(http://www.spinachbase.org.).
候选基因的预测与分析
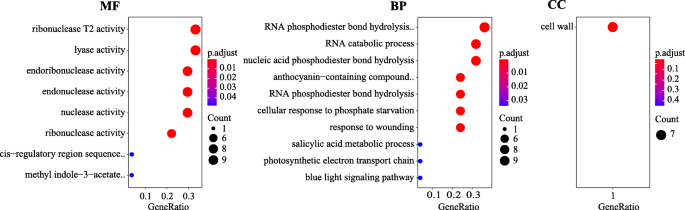
基于基于基因组注释信息,可以识别QTL置信区间内的基因。对于LL,LR和PL基因座,分别在支架SPOSCF_01046和SPOSCF_00704中鉴定出两个基因和九个基因,而在SPOSCF_24795中没有发现基因(表S.5.).所有基因编码编码BNR / ASP箱重复家庭蛋白质,富含亮氨酸的重复,蛋白激酶等(表S5.).至于LW,发现44个基因的主要QTL QLW3.3基因座,其位于染色体1至42.045 MB(表S.6.).在GO分析中,44个基因中27个富集于分子功能(MF)类,25个富集于生物过程(BP)类,只有7个富集于细胞成分(CC)类(P值< 0.05)。在MF类中,大部分基因与核糖核酸酶T2活性、裂解酶活性、内切酶活性等相关(图1)。6.). 在BP类中,大多数基因参与RNA磷酸二酯键水解、核内裂解、RNA分解代谢和核酸磷酸二酯键水解。在CC类中,这7个基因与细胞壁有关(图。6.).基于菠菜参考的注释信息,三个基因(SPO10792,SPO21018,Spo21019型),因为它们参与细胞扩张(表4.).
叶片相关性状连锁标记的研究进展
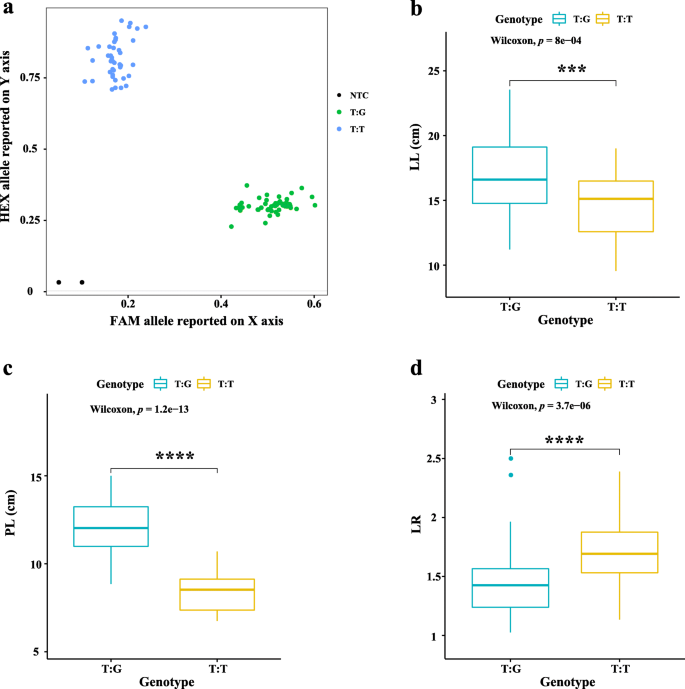
在本研究中,与4个主效qtl qLL5.3、qPL5.2、qLR5.2和qLW3.3紧密连锁的snp可以开发出MAS的KASP标记。例如,公元前90年1.在2020年种植的个体用于检查标记KM2191098的准确性,与LL,PL和LR相关联。如图1所示。7.A,KASP基因型测定分析(参见“材料和方法”)表明,90线可以明显分离两组:T:G和T:T基因型,表明KM2191098是可用标记。和基因型和表型的详细信息总结在表S中7..在表S中总结了标记KM2191098的引物序列8..另外,LL、PL和LR中T:G与T:G表型比较,两个基因型在三个性状上具有显著差异(图1)。7.以T:G基因型的个体为例,与T:T基因型的个体相比,具有更长的叶长。因此,这些结果表明,与LL、PL和LR相关的标记KM2191098可用于MAS。
讨论
叶状性状非常重要,因为它们会影响叶子如何捕获光合作用[22.]. 迄今为止,有关菠菜叶片和叶柄性状的研究还不多[3.,9,23.].然而,菠菜中与LL,LW和PL相关联的QTL保持未报告。
在研究中,由Qian等人构建的高密度遗传图谱。使用KASP基因分型测定产生的两种遗传贴图用于映射L1,LW,PL和LR的QTL。我们确定了与LL(QL15.1,QLL5.2,10015.3和QLL3.1)相关的四个QTL,与LW相关的三个QTL(QLW3.1,QLW3.2和QLW3.3),两个QTL相关PL(QPL5.1和QPL5.2),以及LR的四个QTL(QLR5.1,QLR5.2,QLR3.1和QLR3.2)。有趣的是,QLL5.3位于与主要QTLS QPL5.2和QLR5.2和QLR5.2的相同区域,建议LL与PL或LR相关,这与表中的相关性一致2.. 其中,只有5个QTL(qLL5.3、qPL5.2、qLR5.2、qLW3.3和qLW3.1)在至少两个连锁图谱上被重复检测到(图。2.和3.). 有两个原因可以解释只有少数qtl能够在不同的连锁图谱上检测到。一方面,QTL数目、位置的差异可能与环境效应有关。另一方面,不同的群体、不同的连锁图谱甚至不同的标记数目也会影响qtl[24.,25.].例如,QTL qLR5.1只在高密度连锁图谱上被检测到,而qLR5.2接近qLR5.1,在三种不同的连锁图谱上都能被重复检测到(图1)。2.和3.)因此我们推测,两个QTL可能是相同的。因此,这些QTL不能在多年或联系地图中重复检测到。
到目前为止,已经报道了许多与决定叶子形状和大小有关的基因。例如,在拟南芥蒂利亚纳,油菜素类固醇反应环-H2(BRH1)基因,含有高度保守的环形手指结构域,能够改变叶子形状[26.].大哥(BB型)能够大大减少叶子尺寸[27.].WOX5型,与wuschell相关的同源盒家族之一,可以起到多余的作用WOX1型和WOX3型控制叶形[28.]. 对水稻叶片的形状和大小也进行了许多研究。窄叶7(NAL7)编码一种含有黄素的单加氧酶,并导致由生长素介导的叶宽减小[29.].窄卷叶1 (nrl1.)编码纤维素合成酶样蛋白D4,Hu等人(2010)鉴定了三个隐性突变体(Nrl1-1, nrl1-2和nrl1-3)具有窄卷叶表型[30.].Qi等人(2008)研究了一个名为narrow leaf1的突变体(纳尔1.),通过影响静脉图案化和极性助线传输来减少叶宽[31.].窄卷曲基因NAL2和NAL3编码一个WUSCHEL相关同源盒转录激活子并控制水稻叶片宽度[9].
总之,参与器官生长、发育或激素运输的基因可能会改变叶片的形状。本研究以菠菜基因组组装不完全为特征,将LL、PL和LR的主效qtl定位在3个支架(SpoScf_00704、SpoScf_24795和SpoScf_01046)上。三个支架共鉴定了11个基因,详细信息列于表S5..此外,主要QTL QLW3.3位于染色体1的41.470-42.045mb,44个基因在该地区内鉴定出来(表S.6.).根据去分析,主要富集核糖核酸酶,裂解酶活性,磷酸二酯键水解和细胞壁(图。6.)因此,我们假设叶片宽度可能会因细胞膨胀而改变,如前所述,细胞膨胀可以决定叶片基本形状确定后的最终大小和形状[32.].此外,基于菠菜参考基因组的注释(http://www.spinachbase.org.),三个基因(SPO10792.,Spo21018型,Spo21019型(参与细胞膨胀)被选为潜在的候选基因(表4.).需要进一步的工作来验证此结果。
近年来,分子标记技术因其能提高育种效率、加速育种进程而在许多作物育种项目中得到广泛应用。因此,MAS是一种有效的育种方法[33.].本研究基于qLL5.3、qPL5.2、qLR5.2和qLW3.3这4个主效qtl,开发了MAS的有效KASP标记。例如KASP标记KM2191098,它与LL、PL和LR相关(图。7.).因此,与四个特征紧密相关的SNP对于筛选菠菜中的兴趣叶形和尺寸是有价值的。
结论
利用SLAF-seq和KASP技术对13个菠菜叶片相关性状的qtl进行了鉴定。在多年或连锁群中,只有5个qtl被重复检测到。qLW3.3主效QTL定位于1号染色体41.470~42.045mb。在候选区内鉴定出44个基因和3个基因(SPO10792,SPO21018,Spo21019型)被认为是潜在的候选基因,其参与生长调控或细胞膨胀。有趣的是,三个主要的QTLS QLL5.3,QPL5.2和QLR5.2与KM1360385,KM2191098和KM3102838高度相关。基于结果,开发了一种Kasp标记,其与LL,PL和LR显着相关。本研究中的研究结果对于叶叶相关的特征育种计划具有重要价值,进一步精细地映射菠菜中的特征。
方法
植物材料与DNA提取
公元前147年1.作图群体由自交系12S3、一个复发母本和一个父本(自交系12S4)杂交而来。所有植物材料均由中国农业科学院蔬菜花卉研究所(IVF)菠菜课课组生产。与自交系12S3比较(图。8.a) 12S4叶片和叶柄长较大,叶宽较小(图1)。8.b)。整个BC1.人口(图。8.C−e) 亲本分别于2015年春季和2019年春季在体外受精(IVF)实验场和CAAS实验场进行自然环境培养。另外,公元前90年1.用于验证与叶相关性状紧密相关的标记的个体也被种植在2020年春季IVF的实验领域。所有上述单个植物分开0.3米,并在图中排列0.5米。否则,在研究中使用和收集的植物材料符合中国的指导方针和立法。
BC的鲜叶1.收集个体和两个父母(直到6个真正的叶子)被收集,然后在液氮中冷冻直至DNA提取。使用Murray和Thompson(1980)所述的甲基三甲基溴化铵(CTAB)方法提取总基因组DNA [34].采用1.0 %琼脂糖凝胶电泳和ND-2000分光光度计(Thermo Fisher Scientific, Wilmington, DE, USA)检测DNA质量和浓度。
SNP分子标记的发现及基因分型
通过Qian等人来说,通过SLAF-SEQ鉴定了4,080个多态性SLAF标记物,使用如先前描述的方法。(2017)。为了验证使用KASP技术的SLAF标记的准确性,选择了300个SLAF标记,重命名为“km”,然后选择SLAF标记号,以设计KASP测定底漆,并由LGC公司(中国上海)设计了底漆。Kasp在体积5μl中进行,包括2.5μL2×kasp母混合物,0.07μlkasp测定混合物,0.07μlkasp测定混合物,2.5μldna,稀释至20-30ng /μl。将Kasp基因分型混合物排成384孔PCR板。每个板上都包含无模板控件(NTC)。
所有扩增均在Veriti 384 Well Thermal Cycler (Applied Biosystems, Foster City, CA, US)上进行,使用以下热循环条件:15分钟在94°C紧随其后的热循环94°C的20年代和60年代在61°C(每周期降低0.6°C), 26个周期94°C的20年代和60年代在55°C下,下面的板是读40°C QuantStudio 12 K Flex实时PCR系统(应用生物系统公司,促进城市、钙、美国)。如果在初始KASP热循环后没有获得充分定义的基因型簇,则需要进行额外的热循环(在94°C下进行3次20秒和在57°C下进行60秒)。进行额外的热循环和平板读数,直到获得确定的基因型簇。
施工联系地图
在偏析变形下滤出标记,然后使用BC进行可用的SNP标记进行连杆分析和地图结构1.2015年通过JoinMap 4.0软件的人口[35].采用回归作图法计算各连锁群,对标记进行排序。独立LOD的起始值更改为0.5,所有其他设置都设置为默认值。至于公元前1.从2019年开始的人口,位于连杆组上的SNP标记与2015年和高密度遗传图谱鉴定的QTLS鉴定,以构建遗传图以进一步映射四个特征。
表型评估
表型数据收集自BC1.2015年,2019年和2020年的个人。一旦个体含有六个真实的叶子,使用尺子测量外部两片叶的LL,LW和PL。使用R软件(3.5.1版)绘制LL,LW,PL和LR的频率分布和相关性。
QTL分析和候选基因识别
利用SLAF-seq构建的高密度遗传图谱,对4个叶片相关性状进行qtl分析[13.]由BC构建的遗传图谱1.分别为2015年至2019年。用mapqtl6.0进行QTL分析[36]使用间隔映射(IM)和多个QTL模型(MQM)方法。(1)在P < 0.05 (n = 1000)的全基因组显著性水平下,采用排列试验计算QTL的基本参数LOD阈值;(2)采用IM方法进行QTL定位,设置步长为1;(3)根据IM作图结果,得到最接近LOD峰且高于阈值的标记作为辅助因子,进行MQM作图分析;(4)检测最接近LOD峰的标记,并对辅助因子进行相应的调整。在第四步之后,我们重复MOM映射。(5)以LOD值最高的标记为QTL,选取峰值两侧LOD值降低1.5 LOD的区域,构造一个1.5 LOD支持区间作为置信区间。我们采用标准的QTL命名法:首先是“q”和性状的首字母,然后是连锁群的名称,然后是同一连锁群上的QTL的数量(例如,在连锁群3上的第二个叶宽QTL为qLW3.2)。
将QTL重复检测到至少两个连杆地图被定义为有价值的QTL。合并三个联系地图的置信区间,然后被认为是最终的置信区间。候选基因通过簇预防器通过基因本体学(GO)分析来分类[37].Boxplots使用BMK云平台进行(http://www.biocloud.net/).
可用性数据和材料
在当前研究期间生成和分析的数据集可在补充表中获得。
缩写
- AFLP公司:
-
:扩增片段长度多态性
- 国标:
-
Genotyping-by-sequencing
- 卡斯普:
-
竞争性等位基因特异性PCR
- 噢,
-
叶子长度
- 左后:
-
叶长宽比
- 长波:
-
叶宽
- MAS:
-
分子标记辅助选择
- PL:
-
叶柄长度
- RAPD:
-
随机扩增多态DNA
- RFLP:
-
限制片段长度多态性
- SLAF-SEQ:
-
特异性位点扩增片段测序
- SNP:
-
单核苷酸多态性
- SSR:
-
简单的序列重复
参考
- 1。
冯C,布卢姆BH,科瑞尔JC。菠菜细菌人工染色体(BAC)文库的构建为基因鉴定和标记开发提供资源。植物生物学学报。2015;33(6):1996-2005。
- 2。
Gol S、GoKtay M、Allmer J、Doganlar S、Frary A。新开发的SSR标记揭示了菠菜的遗传多样性和地理聚类。分子遗传学与基因组学。2017;292(4):847–55.
- 3.
马J,史A,牟B,埃文斯M,翁Y。菠菜叶片性状的关联作图。植物育种。2016;135(3):399–404.
- 4.
利用SSR标记分析菠菜种质资源的遗传分化和地理变异。植物遗传资源学报。2014;12(02):185-90。
- 5.
蔡X,徐C,王X,王S,张Z,费Z,王Q。菠菜叶色相关qtl的测序和基因分型构建遗传连锁图谱。大提琴。2018;214(12):229.
- 6.
冈崎Y、高阪S、平川H、铃木Y、小野寺Y。菠菜X和Y连锁基因对近期分化的分子证据。公共科学图书馆一号。2019;14(4):e0214949。
- 7.
Collins K,Zhao K,Jiao C,Xu C,Cai X,Wang X,Ge C,Dai S,Wang Q,Fei Z.Pindachbase:菠菜基因组学的中央门户网站。数据库。2019; 2019:Baz072。
- 8.
Chitwood J,Shi A,Mou B,Evans M,Hensley D.菠菜螺栓,植物高度和叶片竖立的人口结构和关联分析。Hortscience。2016; 51(5):481-6。
- 9.
唐X,Rong G,Sun W,Sun W,张C,yu S.稻叶叶片大小候选基因的遗传解剖与验证(Oryza Sativa L.)。理论应用遗传学。2018; 131(4):801。
- 10.
邱盖夫,熊LW,韩泽克,刘寨,冯·杰布,吴XG,燕益,沉H,黄L,陈L.第二代SNP和SSR集成的联系地图和中国手套蟹eriocheir sinensis的第二代SNP和SSR综合联系地图和QTL测绘。SCI批准。2017; 7:39826。
- 11.
Khattak JZK,Torp Am,Andersen SB。Spinacia Oleracea的遗传联系地图和性别测定基因座的定位。Euphytica。2006; 148(3):311-8。
- 12.
关键词:菠菜,氮素利用效率,QTL,遗传图谱,QTL分析Euphytica。2015;208(3):1 - 16。
- 13。
钱,风扇G,刘D,张H,王X,Wu J,XU Z.基于特定大规模标记的大密度遗传图和菠菜X / Y性测定基因映射的构建-Locus扩增片段测序(SLAF-SEQ)。BMC基因组。2017; 18(1):276。
- 14.
徐C,娇c,孙h,蔡x,王x,ge c,zheng y,liu w,sun x,xu y,deng j,张z,黄s,戴s,mou b,王q,fei z,王Q.菠菜草案和120种Spinacia access的转录组多样性。NAT Communce。2017; 8(1):15275。
- 15.
关键词:分子标记,植物生物技术,分子标记植物组学。2009;2(4):141 - 62。
- 16.
Nadeem MA, Nawaz MA, Shahid MQ, Doğan Y, Comertpay G, Yıldız M, Hatipoğlu R, Ahmad F, Alsaleh A, Labhane N, Özkan H, Chung G, Baloch FS。DNA分子标记在植物育种中的应用:基因组选择和基因组编辑的现状和进展。生物技术装备。2017;32(2):261-85。
- 17.
Thomson MJ,高通量SNP。基因分型加速作物改良。植物遗传资源学报,2014;
- 18.
Hannah G、Rayburn AL、Gonzalez Hernandez JL、Gyoungju N、Do Soon K、Lee DK。利用KASP分析验证美国前沿植物Sci草原灯心草(Spartina pectinata Link)种群的DNA多态性。2016;6:1271.
- 19.
高丽芬,贾建忠,孔祥祥。基于snp的普通小麦分子条形码。《公共科学图书馆•综合》。2016;11 (3):e0150947。
- 20.
Devran Z, G ?关键词:番茄,Mi-1基因,分子标记,KASP农业环境科学学报。2016;57(2):156-60。
- 21.
关键词:玉米品种,品质控制,基因分型,遗传多样性《公共科学图书馆•综合》。2016;11 (6):e0157236。
- 22.
关键词:同源盒基因,叶片多样性,耦合增强子,编码序列进化基因的发展。2016;30(21):2199。
- 23。
张Z,尚H,石y,黄l,李茹,葛q,龚j,刘A,陈t,王d。特定基因座的高密度遗传造影地图的构建(SLAF-SEQ)和ZH其在旱地棉(Gossypium Hirsutum中的棉铃重量(QTL)分析中的定量特性基因座(QTL)分析。BMC植物生物学。2016; 16(1):79。
- 24。
罗Z,崔R,查瓦罗C,曾YC,王J。栽培花生(Arachis hypogaea)抗茎腐病数量性状位点定位及上位性估计。理论应用遗传学。2020;133(4):1201–12.
- 25。
Liu Y、Salsman E、Wang R、Galagedara N、Li X。小麦赤霉病抗性的Meta-QTL分析。理论应用遗传学。2020;133(11):2363–75.
- 26.
在拟南芥(Arabidopsis thaliana)中,过表达BRH1基因(RING finger gene)改变了莲座叶形状。中国科学:生命科学。2018;61(1):79-87。
- 27.
Disch S,Anastasiou E,Sharma VK,Laux T,Fletcher JC,Lenhard M. e3泛素连接酶大哥以剂量依赖的方式控制拟南芥器官尺寸。目前的生物CB。2006; 16(3):272-9。
- 28.
Zhang Z,Runions A,Mentink RA,Kierzkowski D,Tsiantis M。一个WOX/生长素生物合成模块控制生长以形成叶形。当代生物学。2020;30(24):R1492–4。
- 29.
藤野K、松田Y、小泽K、西村T、高桥T、福瑞杰MW、色菊町H。窄叶7控制生长素介导的水稻叶片形状。分子遗传学与基因组学。2008;279(5):499–507.
- 30.
关键词:水稻,NARROW and roll LEAF 1,叶片形态,植株结构,基因鉴定植物遗传资源学报。2010;30(3):431 - 434。
- 31。
齐茹,钱Q,Bu Q,Li S,Chen Q,Sun J,Liang W,Zhou Y,Chu C,Li X.编码新型蛋白质的稻米窄叶片1基因的突变影响静脉图案和极性养蛋白运输。植物理性。2008; 147(4):1947-59。
- 32.
Barkoulas M,Galinha C,Grigg SP,Tsiantis M.从基因到造型:叶片发育中的调节互动。CurrOp植物BIOL。2007; 10(6):660-6。
- 33.
Devran Z,Kahveci E,Ozkaynak E,Studholme DJ,Tor M.使用下一代测序将分子标记与PVR4基因紧密相关的分子标记。mol品种。2015; 35(4):101。
- 34.
Murray Mg,Thompson Cl,Wendel JF。高分子量植物DNA的快速分离。核酸RES。1980; 8(19):432-26。
- 35。
Van Ooijen J.IningMap 4,实验群体中定量特质基因座的映射软件。kyazma bv。荷兰:Wageningen;2006年。
- 36。
van Ooijen J,MapQTL®6。二倍体实验群中定量特质基因座的映射软件。Kyazma。荷兰:Wageningen;2009年。
- 37。
于刚,王立国,韩勇,何庆毅。clusterProfiler:一个R包,用于比较基因簇之间的生物主题。组学。2012; 16(5): 284 - 7。
确认
作者感谢所有支持我们的实验室伙伴。
资金
本研究在中国北京农业重点实验室进行,获得了中国自然科学基金(31872102)、中国农业科学院创新工程(CAAS-ASTIP-IVFCAAS)、北京市科学技术委员会(Z1711001515014)的科学计划资助。国家重点研究发展计划(2018YFD0100805),中央公益性科研机构基础研究基金(Y2019XK12),农业部园艺作物生物学与遗传改良重点实验室,北京。这些资助机构在研究设计、收集、分析和解释数据或撰写手稿方面没有任何作用。
作者信息
从属关系
贡献
WQ、SZ和ZX设计了本研究。ZL和HS进行了实验。HS和ZL对数据进行分析。他写了手稿。WQ、SZ、ZX对稿件进行了修改。WQ、HZ、GL分别制备并采集样品。所有作者均已阅读并批准稿件。
相应的作者
伦理宣言
道德认可和同意参与.
不适用。
出版许可
不适用。
相互竞争的利益
我们声明,我们没有任何商业或联合会利益,这些利益与提交的工作有关的利益冲突。
附加信息
出版商的注意事项
斯普林格自然保持中立,就管辖权的要求,在出版的地图和机构的联系。
补充信息
额外的文件1:
表S1。147个BC个体4080个SLAF标记的信息1.(XLSX)。
附加文件2:
表S2。147个BC个体181个KASP标记的信息1.(XLSX)。
附加文件3:
表S3。147个kAsp标记的信息在147名BC中的信息1.(XLSX)。
附加文件4:
表S4。4个叶片相关性状的表型1.2015年至2019年的人口(XLSX)。
附加文件5:
表S5。与LL,PL和LR相关的三个支架上的基因数量(XLSX)
附加文件6:
表S6。1号染色体区域内的基因数为41.470~42.045mb(XLSX)。
附加文件7:
表S7。90 bc的基因型1.KM2191098 (XLSX)检测2020年的个体。
附加文件8:
表S8。KM2191098(XLSX)的引物序列。
附加文件9:
图S1。BC频率分布菠菜叶相关性状1.2019年人口。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
刘卓,佘慧,徐卓。等等。菠菜叶片相关性状的QTL分析(菠菜L.)。BMC植物杂志21,290(2021)。https://doi.org/10.1186/s12870-021-03092-5.
收到了:
认可的:
出版:
关键词
- 菠菜
- 卡斯瓦斯
- 叶子相关的特征
- 遗传连锁图谱