抽象的
背景
鉴定参与息核酰胺蛋白含盐耐药的基因二色补血草可以促进具有增强的耐盐性的作物。在这里,我们克隆了以前无表达的基因LbHLH并探讨了其在耐盐性中的作用。
结果
2,067-BP开放阅读框架LbHLH用典型的螺旋环 - 螺旋(HLH)结构域编码688-氨基酸蛋白。原位杂交表明LbHLH是在盐腺中表达的l二色的.lbhlh定位于核,LbHLH在盐腺发育期间高度表达,并响应NaCl治疗。为了进一步探索其功能,我们异常表达LbHLH在拟南芥在35s启动子下。过度表达线显示出显着增加的毛细胞数和根毛的减少。LBHLH可能与GLABRA1相互作用以影响毛细血管和根发发育,如酵母双杂交分析所揭示的。转基因系显示出比NaCl处理下的野生型更高的萌发百分比和更长的根。在含山梨糖醇的培养基上生长的幼苗分析,具有与100mM NaCl相同的渗透压,证明过表达LbHLH增强的渗透性。
结论
这些结果表明,LbHLH在NaCl胁迫下通过减少根毛发育和提高渗透阻力来提高耐盐性。
背景
根据联合国的粮食和农业组织(粮农组织),土壤盐度影响全球9.5亿公顷土地,占世界土地总面积的6.5%以上[1,2].全世界近一半的灌溉土壤受到盐渍化的影响[3.].盐渍化加剧导致可耕地面积减少,严重影响粮食生产和粮食安全[1,4,5].因此,迫切需要设计开发和使用盐水土地的方法[6,7].传统的盐渍土改良方法,如淡水压力和暗管排放,成本高,导致土壤次生盐渍化[8].因此,开发生物学方法至关重要,以改善盐水土地[9].
烟灰通常正常生长,并在含有≥200mmn1的盐水栖息地中完成它们的生命周期[4].基于用于离子积聚和运输的机制,烟疗分为三类:(1)Euhalophytes(稀释烟灰),如Suaeda Salsa.,在液泡中螯合盐离子[10.];(2)伪肋骨(盐疏盐烟灰),如芦苇公术,阻止盐进入细胞[11.];(3)再生盐生植物二色补血草和MESEMBRYANTHEMUM CRYSTLINUM,分泌盐到外面的环境[12.].与其他卤素物不同,中科咽部有专门的结构,包括盐囊和盐腺[13.],收集或分泌植物的盐以避免盐胁迫[14.].Bladders积累盐,而盐腺体积极排出过量的盐水[15.].
l二色的是一种典型的再盐植物,茎和叶上有盐腺,排泄过量的盐离子[16.,17.].l二色的被认为是改善盐渍土的先驱植物。在荧光显微镜下很容易观察到这种植物中的盐腺,因为它们表现出蓝色自发荧光[18.].第一个真实叶子的发展l二色的可分为5个阶段:未分化阶段(A)、盐腺分化阶段(B)、气孔分化阶段(C)、铺地细胞分化阶段(D)和成熟期(E) [19.].
这些阶段的叶片的转录组分析已经未覆盖盐腺分化中涉及的各种候选基因[13.,19.,20.].这些基因中的一些对与其他植物中的毛状体发育有关的基因具有高度同源的,例如格拉布拉1(GL1.),透明种皮(TTG1型),格拉布拉3(GL3.),Glabra的增强剂3(EGL3),超级敏感到ABA和DROURK2(SAD2),Triptychon.(试一试), 和任性(中国共产党)[19.].已经通过异源表达证明了一些这些基因的功能拟南芥蒂利亚纳。例如,异源表达LBTTG1.或者LbSAD2型增加拟南芥的毛状体发育和耐盐性[21.,22.],而表达LbTRY增加根毛发育和盐敏感性[23.].这些发现表明盐腺和毛状体可能是由同一祖先产生的同源器官。
这些转录组研究还发现了在不同阶段的盐腺发育中高度表达的一组不表达/未知功能的另一组候选基因。鉴于没有公开可用的基因组序列的植物具有盐腺,这些未注释的基因被认为是盐腺的独特,并且可能在盐腺开发中发挥重要作用。
在目前的研究中,我们调查了这一作用LB1G04899,一个功能未知的基因,在l二色的在早期盐渍腺发生期间,通过转录组分析确定[19.].没有发现该基因的其他家族成员,它只产生一种转录本。自LB1G04899用典型的螺旋环 - 螺旋域编码蛋白质,我们将此基因命名为此基因LbHLH.异源表达该基因的拟南芥植株的毛状体发育增加,根毛发育减少,耐盐性增强。LbHLH可能与AtGL1相互作用,如酵母双杂交试验所示。我们提出了这一未知基因在毛状体和根毛分化以及耐盐性中的作用机制。
方法
植物材料和生长条件
二色补血草在黄河三角洲(中国山东省)的盐水土壤(N37°20'; E118°36')中获得种子,据东营政府许可。作者宝山王已正式识别出来l二色的而且种子收获过程完全符合相关的政府准则。不幸的是,我们无法找到凭证标本l二色的储存在任何公众可获得的植物标本室。干燥的种子在4℃下至少保存6个月[24.].使用前,种子用70%乙醇表面消毒(5分钟),然后用6% NaClO (Sigma,美国)摇床消毒17分钟。种子用无菌蒸馏水洗涤5次,然后在MS基础培养基上播种。在28±3°C/23±3°C(昼/夜)、600 μmol/m光照条件下培养2/s(15小时光周期)和65%的相对湿度。
的拟南芥生态型Col-0 (Columbia-0)种子最初保存在我们的实验室。作者王宝山曾正式认定Col-0。该植物的种子收集和实验研究性能均符合国家的指导方针。拟南芥生态型Col-0(哥伦比亚-0)种子用70%醇灭菌,每次4分钟杀菌,每次3分钟,每次4分钟,每次3分钟。将灭菌的种子用无菌蒸馏水洗涤,并在1 / 2MS培养基上播种。在4℃下分三分层后,在22℃/ 18℃(日/夜)下植物在16 h / 8h光/暗循环下培养,浅水平为150μmol/ m2/ s和70%相对湿度[25.].促进感染和转型根癌土壤杆菌,幼苗在1/2载培养基上培养一周,移植到含有富含营养土壤(土壤:蛭石:珍珠岩,3:1:1)的罐中移植到罐(9cm高度×9cm直径)中。
克隆与生物信息学分析LbHLH
第一个真正的叶子l二色的在叶片发育的不同阶段,包括未分化期(A期;播后4-5天,5000叶),盐腺分化期(B期;播后6-7天,4000叶),气孔分化期(C期;播后8-10天,3000叶),铺面细胞分化期(D期;播后11-16天,千叶),成熟期(E期;播种后17天以上,千叶)据袁[19.].
使用固件植物总RNA分离试剂盒(RC401-01; Vazyme Biotech Co.,Ltd。)从每个阶段的合并叶中提取总RNA。根据制造商的说明,CDNA从RNA与RNA转录的RNA转录,REVERTRA ACE定量PCR(QPCR)RT试剂盒(Toyobo Co.,Ltd)。参考序列LbHLH从先前报道的转录组中从组装序列获得[19.].全长LbHLH是用引物克隆的吗LbHLH-沙LbHLH——(表S1),设计与底漆总理5.0。保守领域LbHLH使用在线工具SMART (http://smart.embl-heidelberg.de/).
LbHLH亚细胞定位
使用含有GFP表达载体的转化洋葱表皮细胞测定LBHLH的亚细胞定位[26.].用Sali消化了PCAMBIA1300载体以形成线性载体。获得LbHLHcDNA,引物LbHLHOE-S和LbHLHOE-A与SalI消化位点设计(表S1).的全长编码序列(CDS)LbHLH利用ClonExpress II一步克隆试剂盒(Vazyme Biotech Co., Ltd, China),在CaMV 35S启动子的控制下,将SalI酶切位点导入pCAMBIA1300载体。根癌土壤杆菌GV3101被用来转化pCAMBIA1300-LbHLH洋葱表皮细胞重组载体[27.].在光线培养两天后,在TCS S8MP2-Photon激光扫描共聚焦显微镜(Leica,Germany)下检测GFP标记的LBHLH的荧光信号。DAPI用于定位细胞核,并在358nm的激发下观察到[28.].FM4 - 64(N-(3-三乙基铵丙基)-4-(6-(4-(二乙基氨基)苯基)六烷基)吡啶二溴化物,Invitrogen)用于定位质膜并在559nm的激发下观察[29.].
基因表达分析及原位杂交l二色的
A-E期叶,茎,根,和老叶l二色的收集在MS培养基上生长以进行RNA提取。还收集在不同处理下生长的幼苗(100mM NaCl,0.04mg / L 6-Ba(6-苄基嘌呤嘌呤)和0.1mg / L ABA(脱离酸),以便RNA提取。定量RT-PCR引物LbHLH-rt-s和LbHLH-RT-A的设计使用Beacon Designer软件(7.8版)(表S1). RT-PCR在20μl反应体系中进行,包括10μl SYBR qPCR主混合物(Vazyme Biotech Co.,Ltd.)、0.2μM引物和300 ng cDNA在荧光热循环仪(Bio-Rad CFX96)中™ 实时PCR系统),在以下条件下:95°C 30 s,40个循环(95°C 5 s,60°C 30 s)。微管蛋白(底漆微管蛋白-rt-s和微管蛋白-rt-a,表S1)用作内部控制[18.].表达水平LbHLH在不同组织中相对于根中的表达量计算(设为1).进行三种生物重复(单独的实验)。使用公式2计算相对表达水平-ΔΔc(t).
进一步探索表达式模式LbHLH在l二色的,培养叶(发芽5-8天的第一个真实叶子)被隔离l二色的用于杂交。简而言之,将叶子固定在4%多聚甲醛中,嵌入石蜡中,并通过醇系列脱水。细致。用蛋白酶K处理(8μm)组织并在37℃下在6ng /μl杂交溶液中杂交过夜。地形翻译LbHLH探针(5’- dig - cucccuaacauuaaccuucagauccagcc -3’,经高效液相色谱纯化)呈蓝紫色。
克隆的LbHLH启动子和组织化学分析
基因组DNA从中提取l二色的使用FastPure Plant DNA Isolation Mini Kit (Vazyme Biotech Co., Ltd.)获得全长LbHLH启动子。的引用序列LbHLH启动子来自l二色的基因组(未发表的)和起始密码子上游的约2kb靶序列被保留以被认为是用于参考的启动子序列。使用引物克隆启动子序列LbHLH-p-s和LbHLH-P-A(表S1).使用PlantCare预测启动子中的元素(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/),并使用CSDS2.0绘制地图(http://gsds.gao-lab.org/).
用替换35s启动子LbHLH用pCAMBIA3301、HindIII和NcoI中的启动子从pCAMBIA3301中切下camv35s启动子,得到一个线性载体。用引物3301将启动子克隆到载体中-LbHLH-P-S和3301 -LbHLH-P-A(表S1)提前添加Hindiii和NCoi消化网站。线性矢量pcambia3301和插入的LbHLH使用In-Fusion HD Cloning Kit (Takara)将启动子连接在一起构建重组载体。
根癌土壤杆菌用重组质粒转化GV3101细胞进行感染拟南芥Col-0生成Col::pLbHLH-Gus。用除草剂连续筛选转基因幼苗(0.1%,v / v),对T3代的纯合植物进行组织化学染色。将十天幼苗浸入GUS染色溶液中,并在37℃下振荡孵育过夜。通过在70%乙醇中孵育2-3次,并在解剖显微镜(尼康,日本)下观察到染色的植物材料进行脱色30.].
Col-35的一代S::LbHLH公司植物
全长CDLbHLH使用引物克隆LbHLHOEAt-S和LbHLHoeat-a(表S1含有NCOI消化位点,用于克隆到不同的载体中。克隆克莱克斯II一步克隆试剂盒(Vazyme Biotech Co.,Ltd。)用于产生P35S ::LbHLH通过同源重组。p35区域:LbHLH被引入了根癌土壤杆菌GV3101细胞,用于拟南芥转化。用除草剂(0.1%,v/v)筛选三代后,Col-35S::LbHLH对过表达系进行生理测定。
三个Col-35S::LbHLH选择过度表达系以基于的生理特征LbHLH表达(低,中等和高)。具体地,首先使用引物鉴定阳性转基因植物LbHLHOEAt-S和LbHLH基于转基因系的基因组序列。然后从不同的COL-35s中提取mRNA ::LbHLH根据制造商的说明,使用固体植物总RNA隔离套件(Vazyme Biotech Co.,Ltd。)。LbHLH不同的Col-35s ::的表达水平LbHLH用qRT-PCR引物对品系进行分析LbHLHRT-S和LbHLHRT-A(表S1).鉴于没有同源物LbHLH在拟南芥中,LbHLH表达水平(OE35)用作对照(相对表达水平设置为1)以计算表达水平LbHLH在Col-35s ::LbHLH线条。对每组进行三种生物重复。保留具有高(OE40),培养基(OE26)和低表达(OE4)水平的线进行分析。
Col-35s ::滴毛瘤/根发相关基因的表型观察及表达分析::LbHLH
在三种过表达线(OE4,OE26和OE40)和野生型中测量滴毛体和根发发育。在解剖显微镜(日本尼康)下,计算一周幼苗的第一个真实叶子上的毛状体。距离5天幼苗的根尖的根毛0.5cm-1.5厘米。用ImageJ软件计算滴毛组和根头发。每条线检查二十个幼苗。
在1/2MS培养基上培养1周,提取幼苗RNA。利用qRT-PCR方法对涉及毛状体分化和根毛命运决定的10个基因的表达水平进行了检测ATTTG1.,阿特里,AtCPC公司,AtEGL3,AtGL1,AtGL3,阿特萨达2,GLABRA 2(AtGL2),MYB域蛋白23(AtMYB23), 和锌指蛋白5(AtZFP5).与根毛发育相关的基因的表达水平,包括根毛起始基因根毛缺陷6(atrhd6.)以及种子长寿的戒指1(AtRSL1型)和根毛伸长基因LJRHL1类1(AtLRL1)也通过QRT-PCR测量。QRT-PCR中使用的所有引物列于表中S1作为基因名称 - RT型感测(基因名称-TT-S)和基因名称-TT-反义(基因名称-TT-A)(例如,AtEGL3-rt-s和AtEGL3-RT-A)。attint.(用引物扩增Atactin-rt-s和Atactin-RT-A)被用作内部控制[23.];进行3次重复生物实验。
酵母双杂化测定检查LBHLH的自激活并鉴定候选LBHLH相互作用蛋白
全长CDLbHLH克隆到pGBKT7 (BD)中生成BD-LbHLH使用Ndei消化部位通过使用Clonexpress®II一步克隆试剂盒(Vazyme Biotech Co.,Ltd。)和引物BD-LbHLH-s和bd-LbHLH——(表S1).使用相同的方法来构建广告AtGL1和广告,AtGL3使用pgadt7(广告)和引物广告 -AtGL1-s,广告 -AtGL1——广告-AtGL3-s和Ad-AtGL3- 与ndei消化网站(表S1).
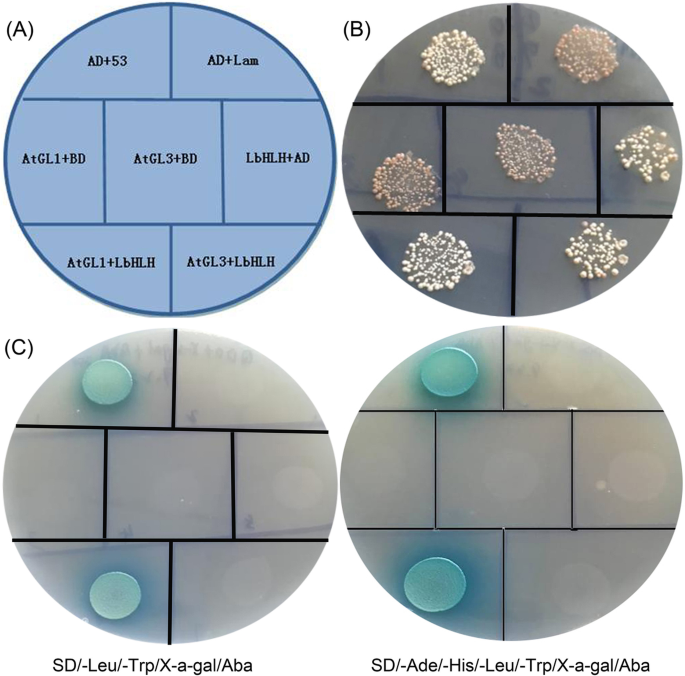
设计了七组来测试LbHLH和AtGL1或AtGL3之间的相互作用:BD-53和AD-T(阳性对照)、BD-Lam和AD-T(阴性对照)、BD和AD-AtGL1(验证AtGL1自激活)、BD和AD-AtGL3(验证AtGL3自激活)、BD-LbHLH和AD(验证LbHLH自激活),BD LbHLH&AD-AtGL1(验证LbHLH和AtGL1之间的相互作用)和BD LbHLH&AD-AtGL3(验证LbHLH和AtGL3之间的相互作用)。将质粒转化到Y2H金酵母中(酿酒酵母酿酒酵母)通过酵母酵母转换系统2(Clontech Code No.630439)分别使用酵母的指示。首先在SD / -LEU / -TRP培养基上培养所有基团,以基于菌落的存在来确定成功的转化。Further interaction experiments were performed on both SD/-Leu/-Trp/X-a-gal/Aba (200 ng/ml) and SD/-Ade/-His/-Leu/-Trp/X-a-gal/Aba (200 ng/ml) media. The self-activation of LbHLH and verification of possible interactions were determined based on the growth status and blue color of colonies after 2 days of culture.
测量LbHLH表达式l二色的在NaCl处理的一段时间内,耐盐指数和生理指标
l二色的幼苗在土壤中培养20天,并用100mM NaCl处理0,12,24,48和72小时,以产生用于时间过程分析的样品。从每种样品中提取总RNA,并用引物用于QRT-PCRLbHLH-rt-s和LbHLH-rt-a(表S1)分析表达式模式LbHLH经过100 mM NaCl处理的一段时间。
为了研究不同转基因系,OE4,OE26,OE40和野生型(WT)种子的耐盐性在1 / 2MS培养基(含有1%琼脂)上产生不同浓度的NaCl(0,50,100和150毫米)。每天计算发芽的种子五天:含有从种子涂层中出来的胚胎的种子> 1mm,被认为是发芽的。萌发百分比(%)计算为萌发种子/种子总数×100%的总数。每处理每行播种30粒种子,进行3个生物重复。绿色子叶的出现被用作子叶生长的指标。在萌发三天后测量每根线的子叶生长速率。子叶生长速率(%)=(种子的种子数量/所有测试种子的数量)×100%。
同时,为了避免不同NaCl治疗的不均匀萌发趋势的影响,所有线条的种子首次在1 / 2MS基础培养基上发芽,然后转移到不同的NaCl处理前4天(0,50,100,150 mm)5天。拍摄所有幼苗,使用imagej软件测量不同线的根长度。每个处理30个重复。将所有幼苗移植到土壤基质中,并在不同的NaCl处理中连续培养直至螺栓连接,看看NaCl对旧植物的作用。
为了研究NaCl对幼苗生理指标的影响,将幼苗在1/2MS培养基上生长5d后移栽到土壤基质中。适应一周后,用100mmNaCl(NaCl溶于Hoagland溶液,pH 6.2)处理幼苗。处理1周后,分别收获20日龄幼苗(0.5g)的叶片。Na+K+、脯氨酸和丙二醛(MDA)的含量如前所述[30.,31.].用火焰光度计(COLE-PARMER,USA)测量离子浓度。对每条线进行每次测量的五个重复。
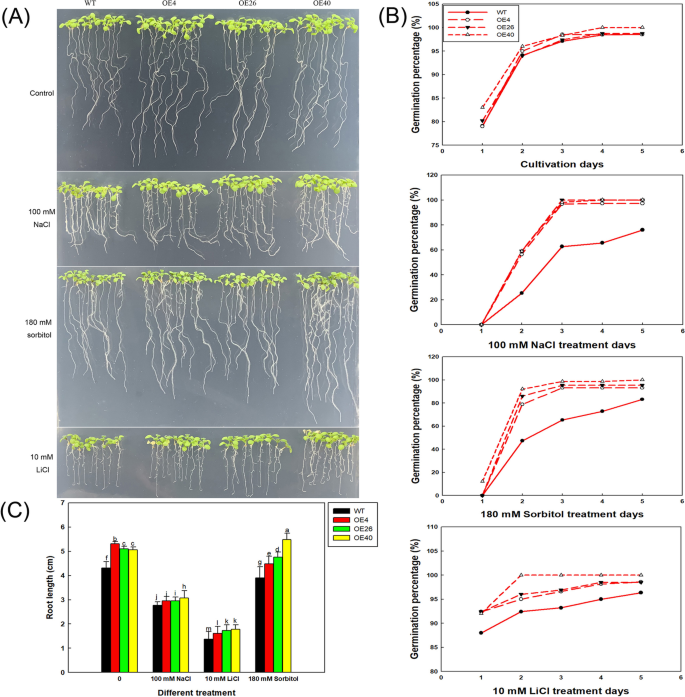
验证效果LbHLH在180 mM山梨醇(与100 mM NaCl具有相同的渗透压)和10 mM LiCl培养基(无渗透胁迫)中培养,以缓解盐胁迫。培养5天后,测定发芽率。每处理每行播种30粒种子,进行3个生物重复。同时,所有种子先在1/2MS基本培养基上萌发4天,然后转入不同处理(180 mM山梨醇和10 mM LiCl) 5天,利用ImageJ软件测定不同株系的根长。每个处理30个重复。同时拍摄幼苗生长照片,比较离子胁迫和渗透胁迫对不同株系的影响。
与转基因拟南芥中的盐胁迫有关的标记基因的QRT-PCR
为了研究盐胁迫下基因的表达,将所有线在含有0或100mM NaCl的1 / 2MS培养基中培养〜10天,并使用固件植物总RNA分离试剂盒进行RNA提取(RC401-01; Vazyme Biotech Co。,Ltd。)。RNA被反转转录为cDNA并用于QRT-PCR。
选择参与应激性的四个标记基因用于QRT-PCR分析:盐过度敏感1(atsos1)1 . 1-吡咯啉-5-羧酸合酶(AtP5CS1),和AtP5CS2(表S1).attint.被用作内部控制。进行3个生物重复。
统计分析
统计学意义的P使用SPSS确定= 0.05(Duncan的多个范围测试)。具有正交对比的ANOVA和平均比较程序用于检测治疗之间的显着差异。
结果
生物信息学分析及原位杂交LbHLH
我们克隆了LbHLH基于转录组数据中的全长序列[19.].LbHLH包含一个2067 bp的开放阅读框,编码一个688个氨基酸的蛋白(图S1一种)。LBHLH在氨基酸480和526和三个低复杂性区域之间存在典型的螺旋环 - 螺旋(HLH)结构域(图S1b)。没有基因分享超过30%的相似之处LbHLH通过NCBI-BLAST分析检测到(图S1C)。
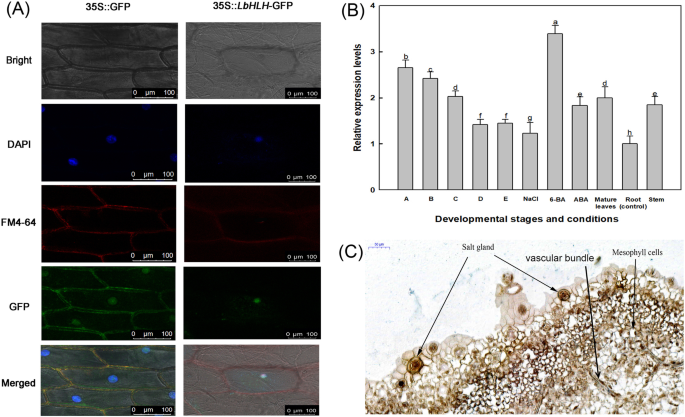
为了确定LbHLH的亚细胞定位,我们在洋葱表皮细胞中转化LbHLH根癌土壤杆菌携带p35s ::LbHLHgfp。如图所示。1A、 与DAPI和FM4-64染色部位相比,LbHLH-GFP仅位于核中,而未用的GFP位于细胞核和质膜中。我们还分析了表达式模式LbHLH在l二色的在不同的发育阶段和不同的处理下(图。1b)。LbHLH在舞台上的最高水平表达,在根部的最低水平。LbHLH表达高度诱导6-BA治疗。
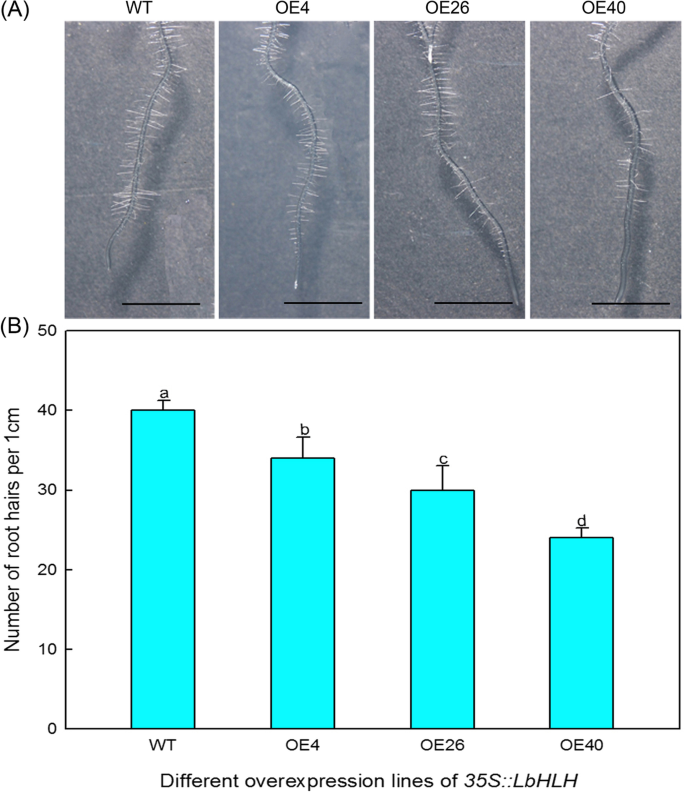
亚细胞定位和表达分析LbHLH在l二色的.一个洋葱表皮细胞35s :: LbHlH-GFP的亚细胞定位分析。GFP-LBHLH融合蛋白在细胞核中表达。35S :: GFP用作空向量控制。条=50μm。DAPI在细胞核中特别出现蓝色荧光,并且FM4-64在质膜上显示为红色荧光。BLbHLH叶片在不同发育阶段和不同治疗下的表达水平。- 答:A阶段,播种后4-5天的暂无差别;B:B阶段B,盐渍分化,播种后6-7天;C:阶段C,气孔分化,播种后8-10天;D:阶段D,表皮分化,播种后11-16天;E:阶段,成熟,播种后17天;成熟的叶子:完全扩张的叶子;NaCl:24小时后,从阶段E幼苗的成熟叶为200mM NaCl治疗;6-BA:来自阶段E幼苗的成熟叶片在0.04mg / L 6-Ba;ABA:成熟的叶片从0.1 mg / L aba种植的阶段幼苗。 Roots and stems were collected from stage E seedlings. Data are the means ± SD of three replicates; different letters indicate significant differences atP根据Duncan复程检验= 0.05。C原位杂交LbHLH使用开发叶子l二色的.LbHLH使用地高辛标记的反义探针检测转录本,该探针产生蓝紫色
鉴于LbHLH在早期盐腺发育过程中,LbHLH的高表达,我们进行了原位杂交来确定LbHLH是否定位于盐腺l二色的.在所有盐腺,部分叶蛋白细胞和血管束中检测杂交信号(图。1c),建议LbHLH可以在盐腺开发和分化中起作用。
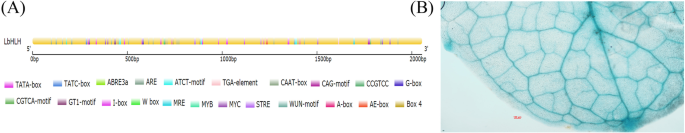
分析对LbHLHLBHLH的启动子和组织化学定位
在拟南芥中核实LBHLH的进一步定位。我们确定了2,055磅的BP启动子序列LbHLH基于其序列l二色的基因组。如图所示。2A,这LbHLH启动子富含典型的TATA-box和CAAT-box元件,含有ABRE和ARE等多种应激反应元件。MYB结合位点的鉴定表明LbHLH可能由MyB型转录因子调节。验证网站LbHLH表达,我们生成了pLbHLH●GUS和用这种结构转化的拟南芥。GUS染色模式分析显示LbHLH在拟南芥的叶脉中表达(图。2b)。
LbHLH参与拟南芥的毛状体和根发发育
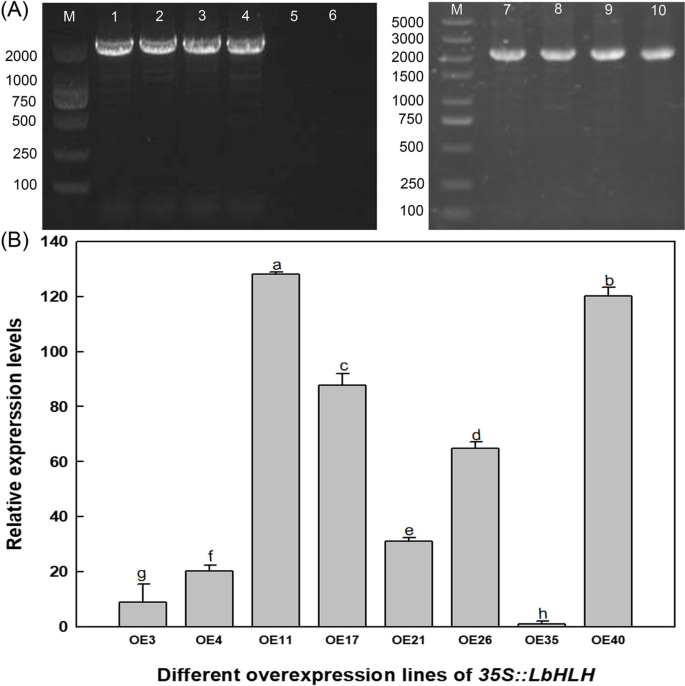
探讨作用LbHLH在毛状体和根毛的形成过程中,我们异质表达LbHLH在拟南芥生态型Col-0。8条线,包含Col-35S::LbHLH(图。3.A)通过qRT-PCR分析其基因表达水平(图5)。3.b)。线OE4,OE26和OE40,具有相对低,中等和高LbHLH选择表达水平分别用于表型观察。
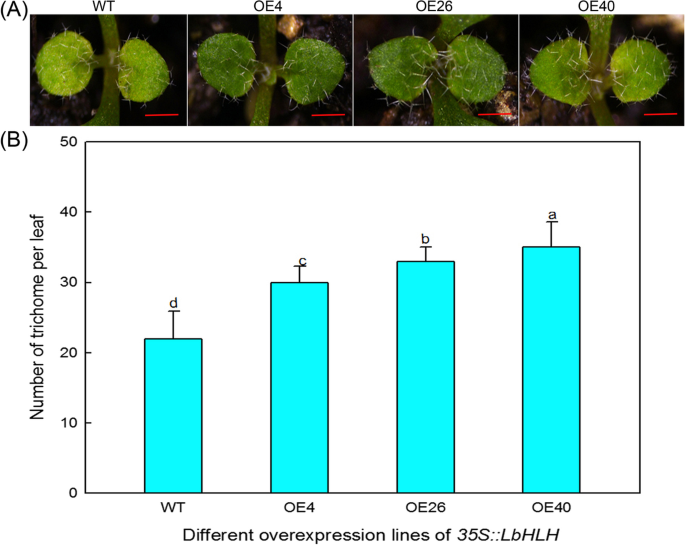
我们比较了野生型(WT)、OE4、OE26和OE40第一批真叶上毛状体的数量,发现Col-35S::LbHLH过表达系比WT含有更多的毛状体(图。4A) 是的。另外,表达水平LbHLH对毛状体的数量进行剂量效果(图。4b),即,表达水平越高LbHLH毛状体越多。这些结果表明LbHLH促进培养的发展。
同样的基因参与毛状体和根毛的发育,但它们在这些过程中起相反的作用。因此,我们计算每一行的根毛。Col-35S::LbHLH过表达系产生的根毛比WT少(图。5A),该表型也表现出剂量效应,根毛数量随着增加而减少LbHLH表达式(无花果。5b)。这些结果表明,LBHLH对根发发育具有抑制作用。
LbHLH与AtGL1相互作用,干扰根毛的发育
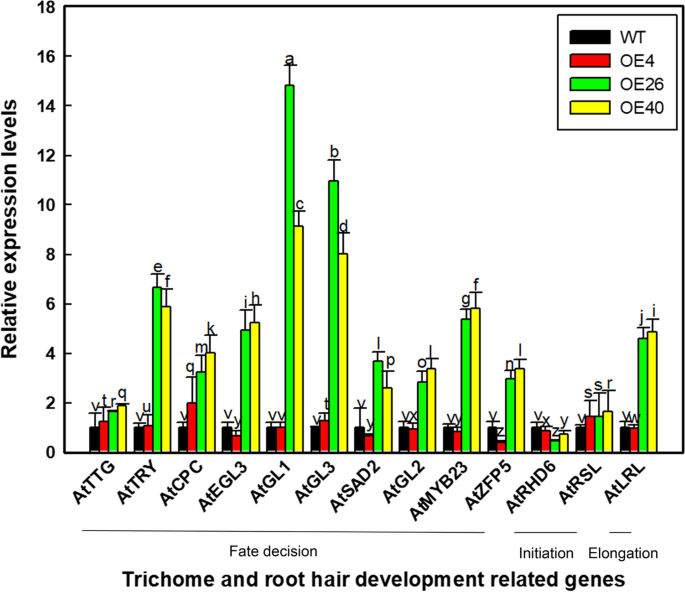
鉴于异源表达LbHLH增加胎儿的数量并减少了拟南芥中的根毛的数量,我们分析了与这些线条的滴毛组和根发引发和发育有关的基因的表达水平,包括ATTTG1.,阿特里,AtCPC公司,AtEGL3,AtGL1,AtGL3,阿特萨达2,AtGL2,AtMYB23,AtLRL1,atrhd6.,AtRSL1型,AtZFP5(图。6).大多数基因在OE40的最高水平下表达,而在WT和OE4之间没有检测到表达的显着差异。在这些基因中,AtGL1和AtGL3是在OE26和OE40 VS的中最高诱导的。因此,LBHLH最可能与ATGL1或ATGL3相互作用以影响毛状体和根发发育。
为了在体外测试LBHLH和ATGL1或LBHLH和ATGL3之间的相互作用,我们进行了酵母双杂化测定(图。7A).所有菌落在SD/-Leu/-Trp培养基上正常生长,说明酵母菌转化成功(图。7b)。在SD / -LEU / -TRP / X-A-GAL / ABA和SD / -RADE / -HIS / -LEU / -TRP / X-A-GAL / ABA媒体上时,只有正面控制和BD-LbHLH&AD-AtGL1呈蓝色,生长正常(图。7c),而BD-LbHLH&ad-atgl3没有产生信号。未检测到LBHLH的自激活。这些结果表明,LBHLH强烈与ATGL1相互作用,一种根发发育所需的MYB样蛋白,这可以解释为什么在转基因系中显着抑制根毛形成。
LbHLH与AtGL1或AtGL3相互作用的酵母双杂交分析。一个Y2H金酵母中自激活和相互作用的验证。广告+ 53:AD-T + BD-53(阳性控制);AD + LAM:AD-T + BD-LAM(阴性对照);ATG1 + BD:AD-ATG1 + BD(ATGL1自激活的测试);ATGL3 + BD:AD-ATGL3 + BD(ATGL3自激活的测试);LBHLH + AD:BD-LBHLH + AD(测试LBHLH自激活);ATGL1 + LBHLH:AD-ATGL1 + BD-LBHLH(相互作用1);ATL3 + LBHLH:Ad-ATGL3 + BD-LBHLH(相互作用2的试验)。BSD / -LEU / -TRP媒体酵母转化。CTests of self-activation and interactions on SD/-Leu/-Trp/X-a-gal/Aba (200 ng/ml) and SD/-Ade/-His/-Leu/-Trp/X-a-gal/Aba (200 ng/ml) media
LbHLH被盐压力诱导l二色的显著提高了拟南芥萌发过程中的耐盐性
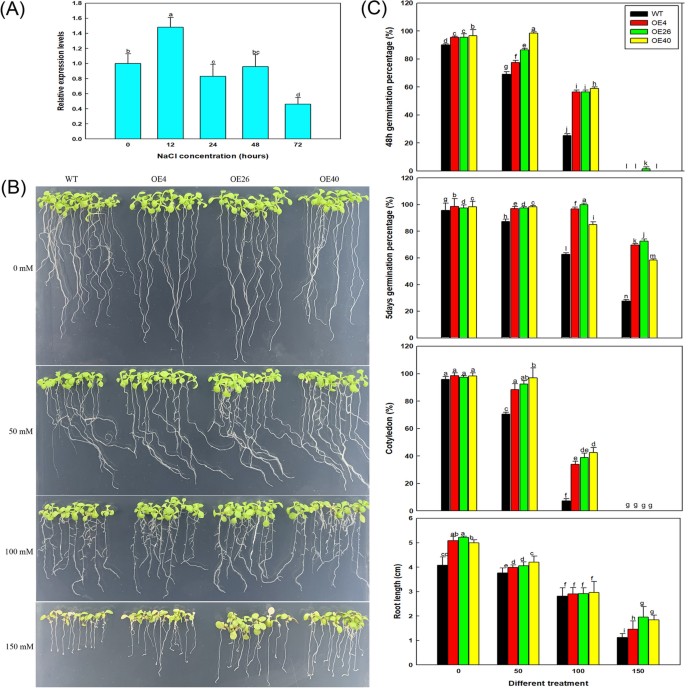
自异源表达以来LbHLH减少了拟南芥的根毛数量,我们想知道这种表型是否与耐盐性有关。因此,我们研究了LbHLH在l二色的在100 mm NaCl处理的时间内(图。8A) 是的。与LbHLH在NaCl处理12小时后表达NaCl处理的开始,表达明显增加,但在24小时后恢复到较低水平。这些结果表明表达了LbHLH可以由瞬时NaCl诱导。
坳35 s::LbHLH线材表现出增加的耐盐性。一个表达模式LbHLH在l二色的100mm NaCl处理不同时间(0、12、24、48、72 h)后;以0 h NaCl处理为对照(相对表达量为1)。B所有品系的种子先在1/2MS基本培养基上萌发4天,然后转入不同NaCl处理(0、50、100和150 mM) 5天。C不同NaCl处理下萌发和幼苗生长分析。萌发百分比在播种后48小时和5天测量。每条播种每条种子三十种种子,进行三种重复。发芽百分比数据是三个重复的平均值±SD。在播种在不同培养基后3天计算鼠李酮生长速率(表达为具有出现的子叶的植物的百分比)。每条播种每条种子三十种种子,进行三种重复。子叶生长速率数据是三种重复的平均值±SD。九天幼苗的根长度(B),用ImageJ软件进行测定。每品系分析30株幼苗。根长数据为30株的平均值±SD。不同的字母表示在的显著差异P = 0.05 according to Duncan’s multiple range test
接下来,我们将转基因拟南芥的种子在不同NaCl浓度梯度的培养基上播种,研究了转基因拟南芥在萌发和早期生长过程中的耐盐性。结果表明,在高盐条件下,转基因株系比野生株系表现出更好的生长。8b)和OE40(最高LbHLH表达水平)壮大。与wt相比,所有三个col-35s ::LbHLH线在播种后在48小时内显示出更高的萌发百分比(图。8c),特别是在100mM NaCl处理下,其中OE线的萌发速率大于WT的两倍。在150mM NaCl治疗下,效果更加明显,因为只有少数OE26种子发芽,而另一条线无。在5天培养后,0和50毫米NACL治疗中的线条无明显差异;然而,在100和150mM NaCl处理下,在转基因系中的萌发百分比显着高于WT中的萌发百分比(图。8C)。
子叶的生长速率显示出类似的趋势(图。8C)。在50和100mM NaCl治疗中,Col-35s :: Cootyledon生长更好LbHLH随着NaCl浓度的增加,根系生长受到抑制,但在每个NaCl浓度下,Col-35S的根系:LbHLH株系比WT根长。这一现象在150mm NaCl处理时尤为明显。8C)。在梯度NaCl处理下进一步培养较老的植物,表明过表达线具有比WT更好的增长(图S2).
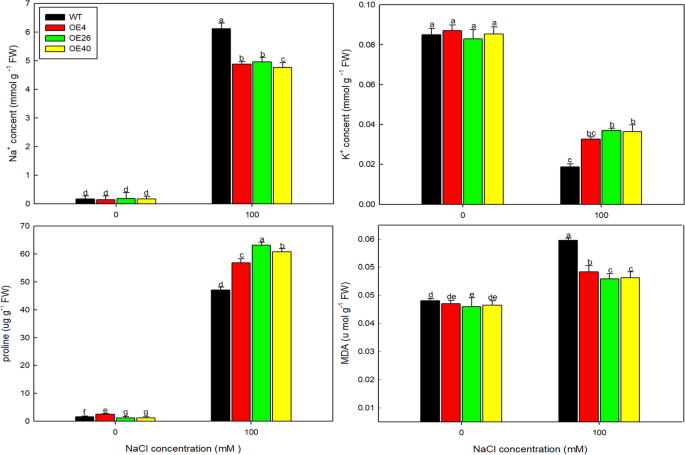
为了确定转基因株系耐盐性增强的可能原因,我们测定了0和100 mM NaCl处理下植株的各种生理指标(图1)。9).OE40积累了最少的NA+脯氨酸和K含量最高+MDA是膜脂过氧化的最终分解产物,其含量可以反映植物的胁迫损伤程度。NaCl处理下,转基因株系的MDA含量低于WT,说明过表达株系比WT受到的伤害小。
LbHLH通过增强抵抗渗透胁迫的能力来增强耐盐性
为了进一步探索LbHLH改善耐盐性,我们培养了含有180mM山梨糖醇的三种转基因拟南芥系和WT,其具有与100mM NaCl相同的渗透电位,含有10mM LiCl的培养基,其诱导相同的离子应力为100mM NaCl(图。10.A).在10 mM LiCl处理下,所有株系均表现出相似的生长抑制水平,转基因株系均未检测到生长优势。而在等渗山梨醇处理下,过表达系的生长趋势与100 mM NaCl处理下相同,即OE40的发芽率最高(图1)。10.b)和最长的根(图。10.C)。值得一提的是,与对照治疗相比,OE40几乎没有患渗透压力。这些结果表明,WT植物在NaCl处理下患有渗透和离子胁迫,而异源表达LbHLH显着改善对渗透胁迫的抗性,从而使转基因株在萌发阶段比WT更好。
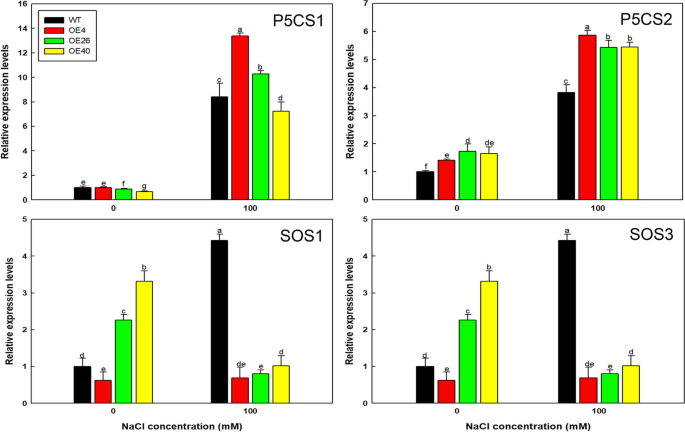
最后,探索为什么改变LbHLH在分子水平下显着改善了拟南芥的耐盐性,我们在盐胁迫下检查了这些植物中标记基因的表达。AtP5CS1和AtP5CS2Col-35S的表达水平要高得多::LbHLH线比在wt中,而表达atsos1和atsos3.转基因素中下降(图。11.);这些表达水平对应于脯氨酸积累的水平(图。9)、这些植物的抗渗透胁迫能力(图。10.)和NA的低积累+在拍摄中。
讨论
l二色的是一种典型的康全Halogalophyte,含盐腺。越来越多的基因l二色的已被证明参与耐盐性,但所有这些基因都是已知功能基因的同源物,例如LBTTG1.,LbTRY,LbSAD2型.目前还没有具有盐腺的植物的基因组序列。因此,鉴定盐腺发育过程中表达的功能未知基因的活性,对于了解盐腺发育和盐抗性具有重要意义。在本研究中,我们发现LbHLH蛋白是一个功能未知的蛋白,它通过与AtGL1相互作用诱导拟南芥中与毛状体和根毛发育相关基因的表达。此外,LbHLH提高了耐盐性,主要是通过提高高NaCl水平的渗透抗性。
生物信息学分析表明,LbHLH包含一个HLH (helix-loop-helix)结构域。HLH结构域主要在拟南芥OrbHLH2O和水稻SbHLH148等转录因子中被检测到[32.,33.].令人惊讶的是,在目前的研究中,我们确定LBHLH没有自激活活动(图。7).原位杂交表明LbHLH在盐腺中表达l二色的.因此,我们建议LBHLH与烟道中的其他转录因子或功能蛋白质相互作用l二色的调节盐腺发育。此外,在盐腺和维管束中均检测到原位杂交信号。1c),在拟南芥中由LBHLH启动子驱动的进一步组织化学染色也在叶静脉中发现高表达(图。2b)。鉴于木质素可能导致紫外线激发下的盐腺的自发荧光[16.[基于位置证据,从木质素的方面,盐腺和血管束之间可能存在一些常见的分化机制。
此外,异源表达LbHLH导致拟南芥的培养体形成增加。基于先前报告的转录组l二色的在不同的发展阶段[19.盐腺和毛毛细血管发育可能涉及具有类似的发育模式的同源基因。这些调查结果强烈建议LbHLH可能与盐腺发育有关,它们解释了为什么异源表达LbHLH影响拟南芥的毛状体发育。
体外酵母双杂交试验检测LbHLH与AtGL1的相互作用。AtGL1正向调控拟南芥的毛状体发育[34.,35.),GL1.突变体缺乏叶面上的毛状。这些发现表明,LBHLH通过直接与ATG1互动来调节毛状体和根发发育。有趣的是,该基因对地上胎儿和地下根毛的发展具有相反的影响;那是,LbHLH通过与AtGL1相同的相互作用促进毛状体的发育,抑制根毛的生长。为什么LbHLH在毛和根毛的发育中起相反的作用仍不清楚。然而,其他基因(AtTTG1、ATGL1、AtTRY、AtCPC等)[36.已经显示出在毛状体和根发引发中发挥相反的作用;潜在的机制将来值得调查。此外,在盐处理(未示出的数据)下也检测到LBHLH对根毛和滴毛体发育的相反效果,也就是说,在NaCl处理下仍然促进转基因系的滴毛体并抑制根毛,表明效果NaCl未消除表皮结构分化的LBHLH。此外,减少的根发可以有助于减少NA+吸收。
减少的根部头发有助于较少的na+因为根毛直接参与了离子的吸收。正如所料,Col-35S::LbHLH根毛数的减少使得Col-35S::LbHLH线吸收较少的na+,遭受更少的离子胁迫,积累更少的MDA比野生型,表型也观察到在拟南芥表达LBTTG1.[22.].此外,在转基因中观察到典型的剂量效果:表达更强LbHLH,耐盐性越强。此外,SOS1被认为是关键Na+/H+纳的交换者+排除[37.,38.]为了避免对细胞器的胁迫,在NaCl处理下,转基因株系中SOS1的表达比野生株低(图1)。11.),这可能与低Na有关+由于转基因素中的根毛减少的吸收而积累。此外,还有证据表明SOS1也在Xylem Na中发挥着重要作用+装载到屈服耐盐[39.,40,41.],所以推测LBHLH过表达也影响SOS1介导的NA+进入蒸腾流量并向拍摄交付。
鉴于根发的减少可能会损害植物占用矿物离子的能力,例如较少的NA+结果表明,转基因株系中K的含量高于转基因株系+增加了,这可以用更多的K+较低的钠含量导致的嫩枝保留+装。此外,K.+被认为是无机渗滤液[42.转基因系中的更多积累可以显着增强耐盐性。山梨糖醇和LiCL被广泛用于模拟渗透和离子应激,并且可以基于表型容易地确定这些物质的效果[30.].Col-35S::LbHLH线显示于山梨糖醇但不是LiCl的增强耐受性,表明转基因系中对NaCl应激的耐受性增加是由于渗透胁迫的耐受性增加。在l二色的,LbHLHNaCl处理12 h后,该基因的表达量显著增加,表明该基因对短期渗透胁迫有响应,可能参与了该盐生植物的耐盐性。
目前的研究考察了LbHLH主要通过模型植物拟南芥中基因的异源表达。但是,原位杂交和表达分析l二色的在开发过程中强烈暗示LbHLH可能在盐腺发育中起作用。考虑到转换系统已经为l二色的[18.]因此,利用CRISPR介导的基因编辑技术进一步研究CRISPR的功能是可能的LbHLH在l二色的及其在盐渍开发中的作用。在这里,我们证明了未知基因的功能l二色的为盐腺在盐渍土抗盐性和盐渍土利用中的作用研究奠定了基础。
结论
lbhlhl二色的经原位杂交鉴定,该蛋白定位于盐腺中,功能未知,在叶片发育早期表达量最高。在拟南芥中,LbHLH的过表达通过与AtGL1相互作用诱导与毛状体和根毛发育相关基因的表达。此外,LbHLH提高了耐盐性,主要是通过降低根毛的发育和提高高盐水平的渗透抗性。
可用性数据和材料
在当前研究期间使用和/或分析的数据集可从相应的作者获得合理的请求。
缩写
- HLH:
-
Helix-Loop-Helix
- GL1.:
-
格拉布拉1
- TTG1型:
-
透明种皮
- GL3.:
-
格拉布拉3
- EGL3:
-
Glabra的增强剂3
- SAD2:
-
超级敏感到ABA和DROURK2
- 试一试:
-
Triptychon.
- 中国共产党:
-
任性
- AtGL2:
-
GLABRA 2
- AtMYB23:
-
MYB域蛋白23
- AtZFP5:
-
锌指蛋白5
- atrhd6.:
-
根毛缺陷6
- AtRSL1型:
-
种子长寿的戒指1
- AtLRL1:
-
LJRHL1类1
- atsos1:
-
盐过度敏感1
- AtP5CS1:
-
DELTA1-PYRROLINE-5-CARBOXYLATE合酶1
- COL-0:
-
哥伦比亚 - 0.
- qPCR:
-
定量聚合酶链反应
- CD:
-
编码序列
- 双相障碍:
-
PGBKT7.
- 广告:
-
pGADT7型
- WT:
-
野生型
参考
- 1。
耐盐机理研究。植物生物学杂志,2008;
- 2。
Munns R.基因和耐盐性:将它们携带在一起。新植物。2005; 167(3):645-63。
- 3.
关键词:植物,盐胁迫,信号转导,信号转导植物科学。2015;241:109-19。
- 4.
鲜花TJ,Colmer Td。盐度盐度耐受性。新植物。2008; 179(4):945-63。
- 5。
Asano T,Hayashi N,Kobayashi M,Aoki N,Miyao A,Mitsuhara I,Ichikawa H,小松S,Hirochika H,Kikuchi S等人。赖氨酸依赖性蛋白激酶OSCPK12对立调节盐胁迫耐受性和抗癌性。工厂J. 2012; 69(1):26-36。
- 6。
李泽,李克,秦峰。谢阳盐水沿海盐水耐盐油厂的生态潜力预测。ECOL ENG。2010; 36(1):27-35。
- 7。
de Paz JM、de Paz JM、Visconti F、Zapata R、Sánchez J。在地理信息系统中整合两个简单模型,以评估西班牙巴伦西亚社区灌溉土地的盐碱化风险。土壤利用管理。2004;20(3):333–42.
- 8。
利用盐生植物了解耐盐性发展盐渍农业:Suaeda Salsa.作为一个有前途的模式。安·博特。2015;115(3):541–53.
- 9。
郭继,卢C,赵F,高S,王B.改善了Euhalophyte的繁殖生长Suaeda Salsa.盐度下与改变的植物激素生物合成和信号转导相关。Funct植物Biol。2020; 47(2):170-83。
- 10。
郭继,董X,李y,王b. NaCl治疗明显增强了euhalophyte的花粉活力和花粉保存时间Suaeda Salsa.通过上调花粉发育相关基因。植物保护学报(英文版);2011 - 01
- 11.
关键词:盐生植物;生殖生理;植物科学,1954;2018:9。
- 12.
袁F,LENG B,王B.研究盐腺盐分泌盐腺中的进展:植物如何分泌盐?前植物SCI。2016; 7:977。
- 13。
冯诗,孙Q,邓玉,孙某,张俊,王b.紫杉醇盐腺体分泌离子分泌途径与特征研究。acta physiol植物。2014; 36(10):2729-41。
- 14。
莫里斯L,yun k,鹿特A,Zeeb Ba。从重新核碱的排出盐的表征distichlis spicata.和Spartina pectinata.环境科学学报,2019;48(6):1775-80。
- 15.
卢C,冯Z,元F,韩克,郭继,陈M,王B:圈套蛋白LBSYP61参与盐分泌物二色补血草.环境BOT 2020; 176:104076。
- 16。
邓益,冯泽,元F,郭家,苏S,王B.自发荧光物质的鉴定与功能分析二色补血草盐腺。植物生理生化。2015;97:20–7.
- 17。
丁F,陈米,隋n,王bs。加利福尼亚州2+显着提高盐腺的发展和盐分泌率二色补血草在NaCl治疗下。S AFR J BOT。2010; 76(1):95-101。
- 18。
[15][袁芳,陈明,杨娟,冷波,王兵。再生盐植物转化与更新系统的研究。植物学报,2006,49 (5):657 - 664 .二色补血草.体外细胞驱散Biol植物。2014; 50(5):610-7。
- 19。
袁飞,吕明杰,冷柏,郑光,冯正涛,李ph,朱兴国,王伯斯。不同发育阶段的比较转录组分析二色补血草叶子产生洞穴分化的见解。植物细胞环境。2015; 38(8):1637-57。
- 20.
袁芳,吕明杰,冷BY,朱兴国,王宝生。nacl处理的转录组二色补血草叶子揭示了控制盐腺的盐分泌的基因。植物mol biol。2016; 91(3):241-56。
- 21.
徐y,jiao x,王x,张h,王b,元f:从reletohalophyte中的Importin-β二色补血草增强耐盐性拟南芥通过减少根发发育和脱落酸敏感性。前植物SCI 2021; 11:582459。
- 22.
关键词:盐生植物,wd40 -重复序列,蛋白质,生物信息学二色补血草在拟南芥中增强毛状体形成和耐盐性。前植物SCI。2019; 10:1456。
- 23.
LENG B,王X,元F,张H,LU C,陈M,王B.异源表达二色补血草MYB转录因子LbTRY-in拟南芥通过改变根发发育和渗透性稳态来提高盐敏感性。植物SCI。2021; 302:110704。
- 24.
Bao J,Sha S,张S.发芽性,脂质过氧化和梨库存中抗氧化酶活性的变化(Pyrus betulaefolia(Bge.)种子在室内和低温贮藏期间。植物生理学学报。2011;33(5):2035-40。
- 25.
Sui N,Tian S,Wang W,Wang M,风扇H.来自Suaeda Salsa的甘油-3-磷酸酰基转移酶的过表达改善了拟南芥的耐盐性。前植物SCI。2017; 8:1337。
- 26.
梁斧,韩兰,华gh,耿莉,桑,刘Xb,郭艾兹,杨lg。融合蛋白表达载体PGS / 2SS-M4GFP的构建而不具有抗生素抗性基因及其在不同细胞系中的亚细胞定位。生物学。2009; 37(1):37-43。
- 27.
关键词:洋葱,表皮细胞,亚细胞定位,农杆菌Biologia。2007;62(5):529 - 32。
- 28.
NG LC,Ramduny D,Airey Ja,Singer Ca,Keller PS,沉XM,Tian H,Valencik M,Hume Jr。Orai1与Stim1交互并介导电容CA2+进入小鼠肺动脉平滑肌细胞。am j j理发细胞生理。2010; 299(5):C1079-1090。
- 29.
Amnuaykanjanasin A, Epstein L.在Colletotrichum graminicola中,A类几丁质合酶定位于多种细胞类型的生长尖、新生的间隔以及菌丝破裂后间隔向端壁转变的过程中。原生质。2006;227(2 - 4):155 - 64。
- 30.
关键词:拟南芥,AtSIZ1,离子稳态,渗透平衡,耐盐性植物科学。2019;285:55 - 67。
- 31.
关键词:盐生碱蓬(Suaeda salsa),繁殖能力,盐胁迫植物生物学杂志。2018;45(3):350-61。
- 32。
SEO JS,JOO J,Kim MJ,Kim Yk,Nahm Bh,Song Si,Cheong Jj,Lee Js,Kim JK,Choi Yd。OSBHLH148是一种基本的螺旋环 - 螺旋蛋白,与奥斯妥甲酸蛋白在茉莉酸盐信号通路中相互作用,导致水稻的耐旱性。工厂J1111; 65(6):907-21。
- 33。
周杰,李飞,王建林,马勇,崇凯,徐艳云。来自野生稻的基本螺旋-环-螺旋转录因子(OrbHLH2)提高了拟南芥对盐和渗透胁迫的耐性。植物生理学杂志。2009;
- 34。
Bloomer RH, Juenger TE, Symonds VV。土壤中GL1的自然变异及其对毛状体密度的影响拟南芥. 摩尔经济。2012;21(14):3501–15.
- 35。
Eckstein A, Grzyb J, Hermanowicz P, Labuz J, Banas AK。GLABRA1在黑暗诱导衰老中的作用。生物化学学报。2019;66(3):243-8。
- 36。
杨C,Ye Z.滴注作为研究植物细胞分化的模型。细胞mol寿命。2013; 70(11):1937-48。
- 37。
邱QS,郭Y,迪特里希·马,舒克斯,朱JK。质膜Na-SOS1的调节+/H+换热器在拟南芥,由SOS2和SOS3。PROC NATL ACAD SCI。2002; 99(12):8436-41。
- 38。
朱家杰,巴马里奥。SIK1/SOS2网络:通过钙响应蛋白激酶途径解码钠信号。Pfluegers拱门。2009;458(3):613 - 9。
- 39。
Yadav NS,Shukla PS,JHA A,Agarwal PK,JHA B.的SBSOS1来自极端烟道的基因Salicornia brachiata增强Na.+在木质部的装载和赋予转基因烟草耐盐性。中国生物医学工程学报,2012;
- 40。
朱M,沙巴拉,Cuin Ta,Huang X,周M,Munns R,Shabala S. Nax Loci影响SOS1样NA+/H+小麦的交换剂表达和活动。J Exp Bot。2016; 67(3):835-44。
- 41.
朱M,周M,Shabala L,Shabala S.介导木质NA的生理和分子机制+大麦耐盐胁迫背景下的装载。植物细胞学报。2017;40(7):1009-20。
- 42.
朱M,周M,Shabala L,Shabala S.将渗透压调节和气孔特性与施力胁迫耐受性相连,对比较大的大麦。Funct植物Biol。2015; 42(3):252-63。
确认
不适用。
资金
这项工作得到了中国天然科学研究基金会的支持(NSFC,项目编号31600200和31770288)。
作者信息
从属关系
贡献
F.Y.设计了研究;x.w和y.x进行了研究;xy . w .、yz .对数据进行分析;x.w写了这篇论文;F.Y.和B.W.对论文进行了修订。所有作者均已阅读并批准稿件。
相应的作者
伦理宣言
伦理批准和同意参与
本文所有实验均在山东省植物逆境重点实验室进行,符合我国相关法律规定。
同意出版物
不适用。
利益争夺
提交人声明他们没有竞争利益。
附加信息
出版商的注意
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
王,X.,周,Y.,徐,Y.等等。来自盐生植物的新基因LbHLH二色补血草通过减少根毛的生长和增强渗透阻力来提高耐盐性。BMC植物BIOL.21,284(2021)。https://doi.org/10.1186/s12870-021-03094-3.
已收到:
接受:
发表:
关键词
- 异源表达
- 二色补血草
- 渗透压力
- 根发
- 毛皮组织
- 抗盐性