摘要
背景
干旱是世界范围内的普遍现象。它也是影响草莓生长和品质的主要非生物因素之一。无瓣a2 /乙烯响应元件结合蛋白(AP2/EREBP)超家族中的脱水响应元件结合蛋白(DREB)成员是植物中独特的转录因子,在非生物胁迫反应中发挥重要作用。
结果
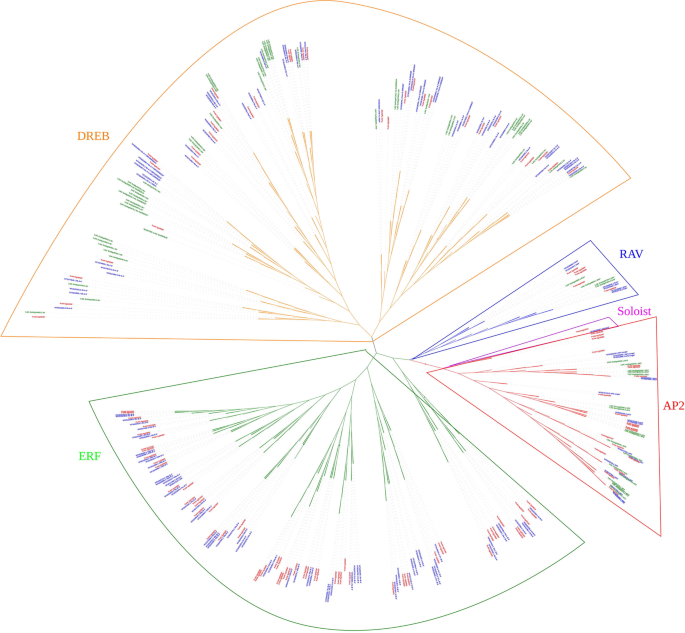
这里,总共有119个AP2 / EREBP基因是在Fragaria Vesca.将AP2/EREBP超家族分为AP2、RAV、ERF、DREB和soloist亚家族,分别包含18、7、61、32和1个成员。根据系统发育分析,将DREB亚家族进一步划分为6个亚群(A-1到A-6)。通过基因结构、保守基序、染色体定位和共线性分析等方法,全面研究了该基因的特征FvDREBs公司.此外,转录组分析显示不同的表达模式FvDREB干旱胁迫下草莓植株的基因。的表达FvDREB6型A-2亚组在旧叶子中下调,在幼叶中上调,以应对干旱。此外,QRT-PCR分析发现FvDREB8型A-2亚群在干旱胁迫下表达量最高。通过对其表达模式、系统发育关系、基序和启动子的分析表明FvDREB18可能在调节FvDREB1型和FvDREB2型表达式。
结论
我们的研究结果为fvdreb的特征和潜在功能提供了新的见解。这些FvDREB这些基因是改善草莓抗旱性的优良候选基因,有待进一步研究。
背景
栽培草莓(草莓属×ananassa)是世界上最重要和最年轻的农作物品种之一,起源于大约300年前[11].此外,草莓因其预防疾病和药用价值,以及其广泛的香味和口味而受到消费者的欢迎和青睐[8,58]. 基因组学上,f×ananassa是一种异八倍体(2n=8x=56)植物,来自四个不同的二倍体祖先。考虑到f×ananassa二倍体林地草莓(f . vesca, 2n = 2x = 14),具有一个小的完全测序的基因组(240mb),通常被用作研究特定基因功能和分子基因组分析的模型植物[49].最近关于八倍体草莓品种“Camarosa”中染色体规模组装的报告鉴定了一种来自的主要亚因子f . vesca主要控制某些代谢途径的祖细胞[11].草莓对由高盐或干旱胁迫引起的渗透压力非常敏感[44].而且草莓叶面积大,根系分布浅,干旱胁迫对其生长和产量影响很大[15]. 因此,干旱是影响草莓生长和品质的主要限制因素之一。了解草莓对干旱胁迫的调控机制,可以促进草莓在干旱胁迫下的生长发育和生产性能。
干旱作为一种普遍现象,预计将随着全球变暖而加剧[3.,5].植物在对干旱胁迫的响应和适应过程中,发生了一系列由胁迫相关基因重编程引起的分子、生理和生化变化[47].此外,据报道,许多转录因子(TFs)通过与靶基因的启动子区结合来调节应激基因[2,6].据报道,脱水响应元件结合(DREB)转录因子在应对干旱、低温或高盐胁迫中发挥重要作用[56].
DREB是Apetala2 /乙烯响应元件结合蛋白(AP2 / EREBP)超家族的亚家族,其根据遗传结构域分类为六个亚组(A-1至A-6)[37,43]. AP2/EREBPs是植物中唯一的转录因子,至少有一个高度保守的AP2结构域。AP2/EREBPs可分为AP2类,与ABI3/VP1(RAV)、乙烯反应因子(ERF)、DREB和soloist有关拟南芥还有米饭[46].一般AP2亚家族成员包含两个AP2域,RAV亚家族成员包含一个AP2域和一个额外的B3域,ERF和DREB亚家族成员都包含一个AP2域[40]. DREB和ERF之间的区别是基于AP2结构域与14个碱基的结合th缬氨酸(V14)和19thDREB成员中谷氨酸(E19), 14th丙氨酸(A14)和19thERF成员中的天冬氨酸(D19) [46].
随着许多植物全基因组序列的公布,越来越多的AP2/EREBP超家族,包括DREB亚家族被发现并在全基因组水平上进行研究[50].不同的DREB亚群在不同的植物中发挥不同的作用。例如,过度表达AtDREB1A提高抗旱性和抗冻性多年生黑麦草转基因菊花对高温胁迫的耐受性较强[20.,30.),而AtDREB1C(A-1)在植物的应激耐受中起着重要作用拟南芥作为消极调节器[42].几项研究还报告说表达了Dreb2a.和Dreb2b.,属于A-2亚群,在干旱胁迫下被诱导[31,45].
尽管最近的一份报告确认了91FveERF基因,作者使用了一个旧版本的基因组,主要集中在串联复制的扩张FveERF家庭(52].因此,缺乏对信息的表达废话以应对干旱。一个更新的注释版本,v4.0。a2,f . vesca基因组最近已经发表,增加了9029个新基因,修改了8342个现有基因[32]. 在本研究中,我们确定了AP2/EREBP成员在f . vesca基因组基于最新版本,v4.0。a2,并对DREB亚家族进行了全面的生物信息学分析,包括DREB分类和命名、基因结构和保守基序分析、染色体定位和共时性分析。的表达谱FvDREBs公司利用转录组和qRT-PCR数据,获得了干旱胁迫下的响应基因。我们的研究结果将提供新的见解的生物学作用FvDREBs公司这可能提高干旱胁迫下草莓的抗旱性。
结果
AP2/EREBP在Fragaria Vesca.
共119AP2 / EREBP通过HMM搜索、局部BLAST分析和结构域确认来识别基因。这些基因至少包含一个AP2结构域(补充信息). 先前的一项研究已经确定了115个AP2 / EREBP基因在f . vesca[52].该研究与本研究的区别在于,之前的研究使用的是较老版本的基因组,而我们的研究使用的是最新版本(v4.0.a2)。具体数量和基因id的差异见表S1.根据AP2/EREBP的分类拟南芥还有米饭[40,46],119AP2 / EREBP基因在f . vesca分为五组。基于337 AP2 / ereBP蛋白的对准构建系统发育树拟南芥米饭和f . vesca(图。1;高分辨率图1在补充材料)。系统发育树对AP2/EREBP蛋白进行了清晰的分类f . vescaAP2、RAV、ERF和DREB四个典型亚家族,分别由1个、18个、7个、61个和32个蛋白组成。RAV亚家族一般有一个AP2结构域和一个B3结构域,FvRAV亚家族包含两个成员(FvH4_5g19881和FvH4_6g29430),其中有一个AP2结构域,没有B3结构域。
鉴定和系统发育分析FvDREBs公司
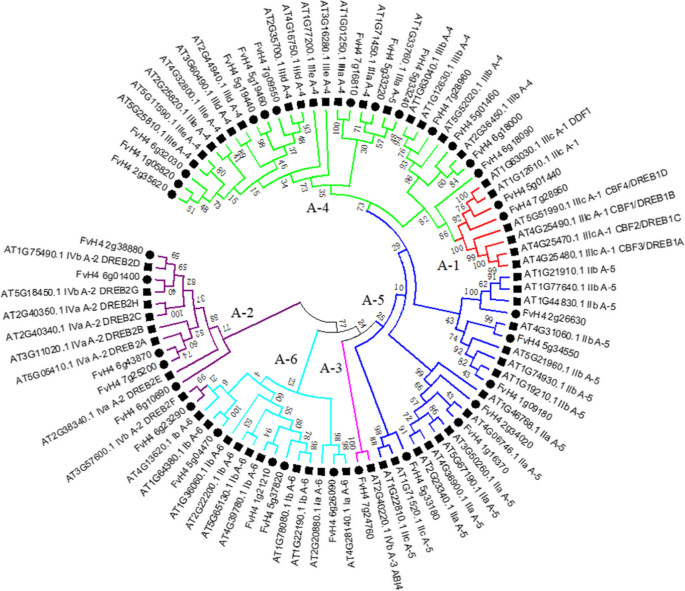
基于守恒的14thAP2域的缬氨酸(V14)(图S1), 32Dreb.从AP2/ERF基因中鉴定出基因f . vesca并根据其染色体位置命名(表1). 所鉴定的FvDREBs蛋白长度为150~579个氨基酸,理论等电点(pI)为4.63~9.48,分子量(MW)为16447.59~65304.13。亚细胞定位分析表明,大多数FvDREBs(26/32,81.25%)定位于细胞核,而其他成员(6/32,18.75%)定位于细胞质(表1)1).
为了研究草莓中DREB亚家族与其他植物之间的系统发育关系,利用DREB亚家族的全蛋白序列构建了一棵邻域连接的系统发育树f . vesca和答:芥. 如图。2系统发育树进一步划分为6个亚群(A-1 ~ A-6)拟南芥其中A-4亚群最大(13个成员),A-3亚群最小(1个成员)。根据AtDREB1/CBF与AtDREB2的相似性,A-1亚组和A-2亚组分别包括2个和6个成员。同时,共鉴定出7对同源染色体f . vesca和答:芥,其中一对是在f . vesca基于大于90的引导值(补充信息).
fvdres基因结构及保守基序分析
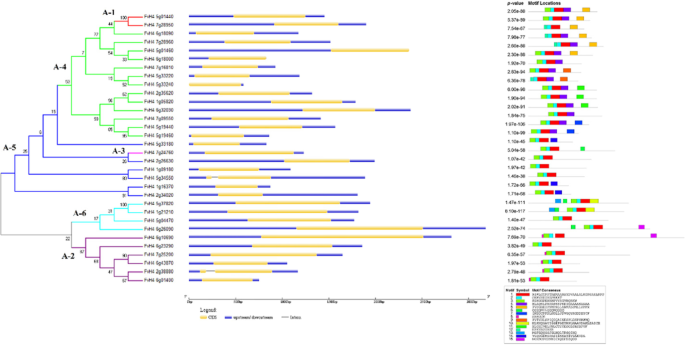
分析了外显子-内含子的结构,以便更好地了解基因的结构特征FvDREBs公司基因。除FvH4_2g38880 (FvDREB3)和FvH4_5g34550 (FvDREB28)只含有一个内含子外,几乎所有fvdreb(30/32, 93.75%)均不含内含子(图1)。3.).
利用模因对所有FvDREBs的保守基序进行了进一步研究。共预测出15个基序,命名为基序1~15。基序1和基序2存在于所有FvDREB蛋白序列中,并与AP2结构域相关。两个A-1亚群成员的蛋白质序列均含有基序5和11,基序8只在A-2亚群成员中发现,基序10只在A-6亚群成员中发现。其他一些基序,如基序15,分布在不同的亚群中。
fvdres的染色体定位和串联复制
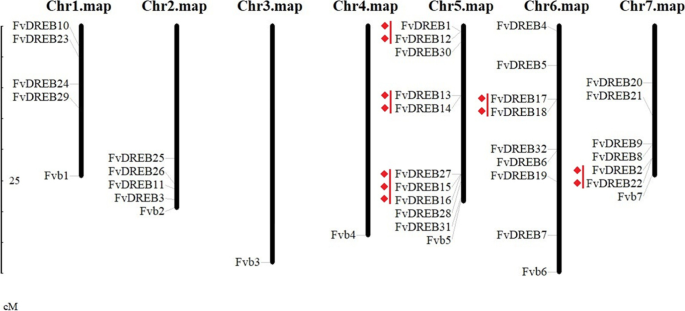
为了探究FvDREB成员的功能分化,我们利用最新的注释基因组(v4.0.a2)进一步研究了他们在染色体上的位置。如图所示。4其中5条染色体上有32个FvDREB成员分布不均,3、4号染色体上无成员,其中5号染色体上FvDREB成员最多(10,31.25%)FvDREB基因,包含一个A-1子组成员,五个A-4子群成员,两个A-5子组成员和两个A-6子组成员。染色体6和7具有25%(8/32)和18.75%(6/32)FvDREB分别是基因。其余25%(8/32)的成员平均分布在1号和2号染色体上FvDREB观察到基因,即,FvDREB1型和FvDREB12公司,FvDREB13公司和FvDREB14公司,FvDREB17和FvDREB18,FvDREB2型和FvDREB22, 和FvDREB27,FvDREB15,和FvDREB16.五个串联复制事件中的三个分布在染色体5上,包括具有串联重复的三个成员。
fvdres的共线性分析
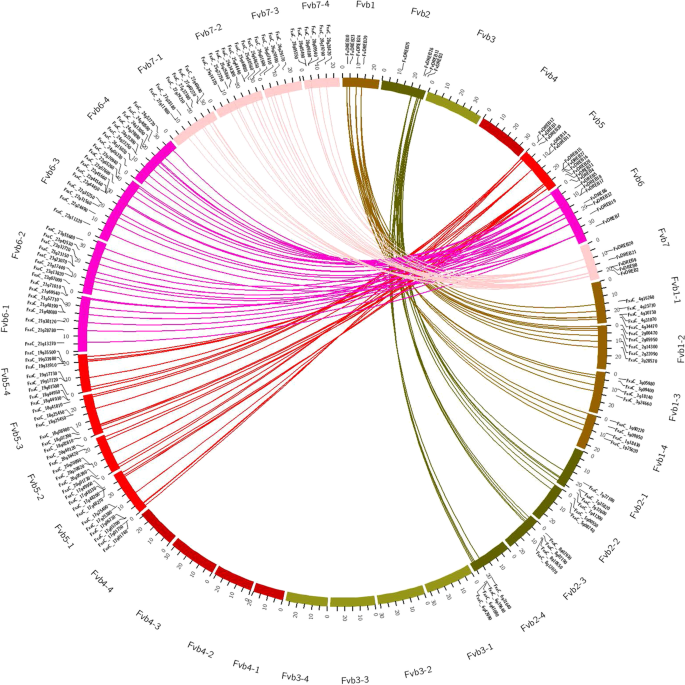
共有143对共线性基因对是同线性的f . vesca和f×ananassa共线性水平较高FvDREBs公司之间f . vesca他们的对象f×ananassa,除了FvDREB24(图。5). 而且,每个FvDREBsf . vesca染色体对应于染色体上的几个同线基因f×ananassa染色体。例如FvDREB10型基因在1号染色体上f . vescaFvb1-1、Fvb1-2、Fvb1-3、Fvb1-4染色体上的同源相关基因分别位于f×ananassa.
不同草莓叶片FvDREBs对干旱胁迫响应的表达谱
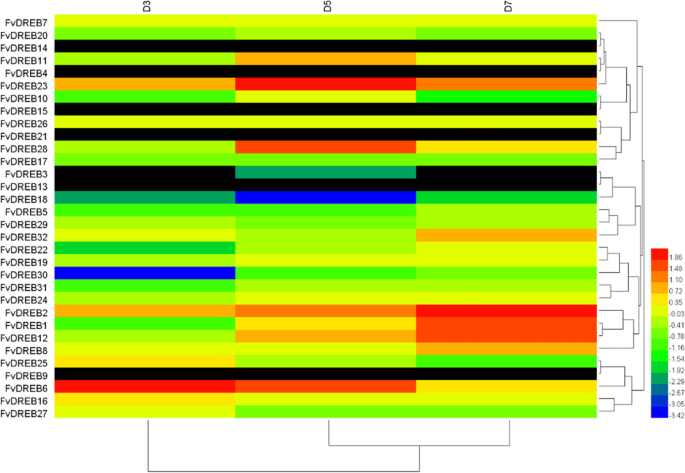
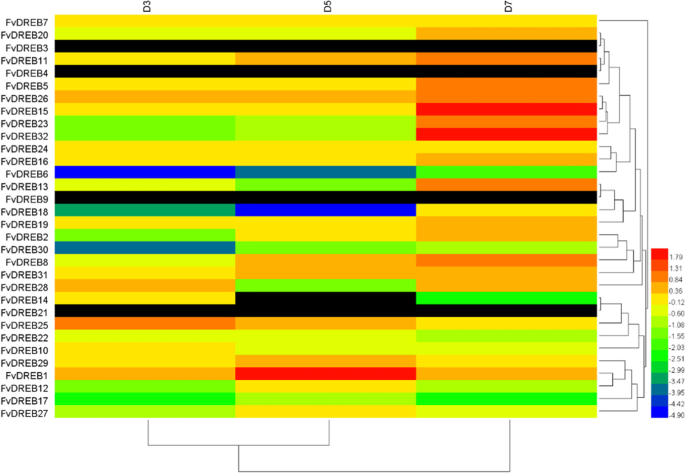
本研究小组先前从暴露于不同干旱胁迫条件下的老叶和幼叶中获得转录组测序数据,以研究这些基因的表达谱FvDREBs公司.总的来说,不同组织的不同亚组表现出不同的表达模式(fig .)。6和7),表明不同的子群体在功能上存在差异FvDREB成员。在老叶中,D5和D7表现出相似的聚类关系。6),而在幼叶中D3和D5表现出相似的聚类关系(图5)。7).两个基因(FvDREB1型和FvDREB2型)来自A-1亚组在干旱胁迫的后期高度表达,而表达FvDREB6型,属于A-2亚群,在干旱胁迫初期显著上调。的表达FvDREB30A-6亚组在干旱胁迫初期和干旱胁迫初期的含量较低FvDREB18A-4亚群在干旱胁迫中期较低。它们在老叶和幼叶中的表达水平相似(Figs。6和7)表明它们是干旱胁迫的负调控因子。
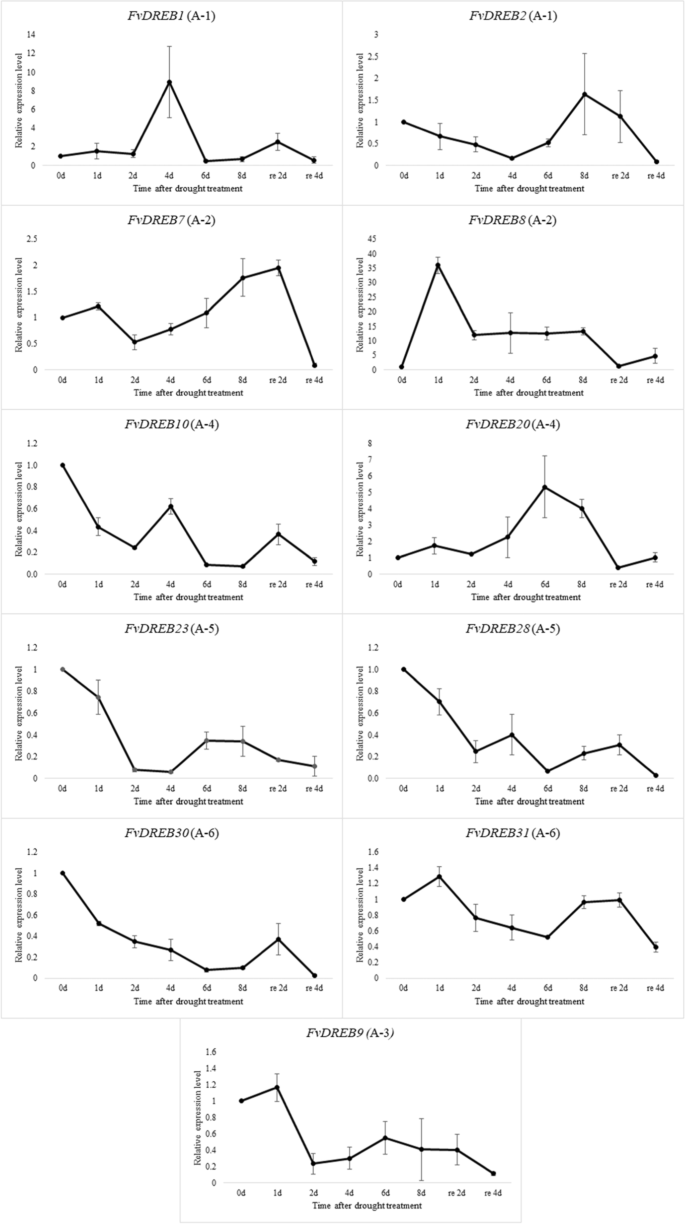
进一步验证这些基因的表达FvDREB基因,两个基因是随机选择的每个亚组的基因FvDREB基因家族(A-3亚群只有一个成员,因此只选择了一个基因)通过qRT PCR分析检测它们在不同干旱胁迫条件下的表达水平(图。8).结果表明FvDREB8型在干旱胁迫下,A-2亚组表达显著上调,在1d时表达最高(图。8).表达量逐渐下降,但所有基因的表达量均比对照组高10倍。的表达水平FvDREB1型A-1亚组在干旱胁迫4 d时达到最高水平,是对照组的8倍以上。8). 表达水平FvDREB20A-4亚组在干旱胁迫6 d时达到最高水平,是对照组的5倍以上。8).暴露在干旱胁迫的时间越长,下调越大FvDREB30来自A-6小组。语言表达的趋势FvDREB与RNA-Seq数据一致。可以看出,表情FvDREB不同亚群的基因在干旱胁迫下变化不稳定。
讨论
AP2/EREBP-TFs是植物特异性转录调节因子的一个大家族,调节植物的生长、发育和对各种胁迫的反应等过程。AP2/EREBP超家族随着植物全基因组序列的释放,在多种植物中得到了广泛的鉴定和研究。此外,高通量测序技术和生物信息学算法的不断改进使研究人员能够准确、快速地传递信息[1].在本研究中,我们鉴定了AP2/EREBP超家族,并对DREB亚家族进行了综合分析f . vesca基因组基于最新版本,v4.0.a2。此外,我们使用RNA-SEQ(转录组测序)和QRT-PCR表征差异表达FvDREB当植物受到干旱胁迫时的基因。本研究有助于进一步了解FvDREB蛋白,有助于草莓的生物技术育种,提高草莓对干旱的适应性和耐旱性。
DREB-TF家族在非生物胁迫反应中起重要作用。然而,知识FvDREB基因是有限的。基因结构分析FvDREBs公司发现93.75%的FvDREBs公司无内含子,高于水稻、玉米和其他植物[24,27]. 基序分析表明,所有FvDREB蛋白序列都有与AP2结构域相关的基序,表明AP2结构域在FvDREB中高度保守。结果还表明,不同的亚群有特定的基序(图。3.).一般情况下,DREB序列是根据含有14个AP2结构域的存在来确定的th缬氨酸(V14)和19th谷氨酸(E19) [46].比较fvdreb中AP2结构域的氨基酸序列发现,虽然14位的氨基酸序列都是缬氨酸(V14),但19位的氨基酸序列并不都是谷氨酸(E19)(图)S1).另外,81.25%的FvDREB蛋白被预测定位于细胞核,提示这些蛋白在信号转导和转录调控中的作用[48].这些结果表明,FvDREB蛋白的大部分结构域或基序高度保守,通过改变关键氨基酸可能发生功能分化。erf和dreb表现出不同的特征,erf被绑定到GCC盒子(AGCCGCC),而dreb被绑定到DRE (A/GCCGAC) [34].
全基因组复制、串联复制、片段复制或多倍体事件被广泛认为是植物进化的主要来源,它们也促进了基因家族的扩展[4,19,25].所有FvDREB蛋白在7条染色体中的5条上分布不均匀,可能是WGD的结果。串联重复和片段重复在fvdreb中也被检测到,这也有助于扩大FvDREB基因家族。此外,我们还进行了基因组间共时分析f . vesca和f×ananassa研究FvDREB的进化草莓基因组随着物种进化和多倍体化。二倍体的fvdreb与其对应的八倍体同源体之间的高度共线性,提示了两种基因组之间的密切关系草莓[11].
FvDREBs的表达模式反映了干旱胁迫下FvDREBs的生物学作用和基因功能。有趣的是,我们发现FvDREB1型A-1亚群的表达与干旱胁迫的早中期相关,而A-1亚群的表达与干旱胁迫的早中期相关FvDREB2型从A-1子组与干旱胁迫的中间和晚期相关(图。8). 这表明在整个干旱胁迫过程中,每个DREB的个体贡献和功能是不同的。DREBs的A-1,也称为C-重复序列结合因子(CBFs),在低温和渗透胁迫下首次被鉴定为TFs拟南芥[56]. 此外,越来越多的研究表明DREB1/CBF公司能提高对冰冻、干旱、盐和高温等环境胁迫的耐受性[16,18,23].我们之前的meta分析CBF/DREB公司过度表达对干旱胁迫反应的影响也证实了这一前提Dreb.过表达可以提高作物对干旱胁迫的耐受性,并反映胁迫处理的持续时间(胁迫时间)。作为调节因子,它对转基因植物的某些参数的反应有明显的影响[10].
同样重要的是FvDREB18在整个干旱胁迫下,尤其是在老、幼叶的干旱胁迫中期,结合表达模式FvDREB1型和FvDREB2型,和。非常相似CBF2 / DREB1C的负调节器CBF1/DREB1B型和CBF3 / DREB1A在拟南芥[42]. 包含FvDREB18在系统发育树中与a -1亚群分支最接近,bootstrap值为86。2),以及中保存的主题的数量FvDREB18是四幅,而保存的图案呢FvDREB1型和FvDREB2型是五(图。3.).这可能意味着FvDREB18在干旱胁迫下,通过精确控制FvDREB1型和FvDREB2型,因此,下游基因。此外,我们分析了这三个基因的启动子,发现它们之间存在不同的顺式调控元件(补充信息和图S2).顺式调控元件,如ABRE(参与脱落酸反应的顺式调控元件),ARE(厌氧诱导必需的顺式调控元件),MBS(参与干旱诱导的MYB结合位点),MYB和MYC,都存在于这三个基因的启动子区域。相比之下,CAT-box、TGA-element和HD-Zip 1只在FvDREB2型促进剂分别与分别与营养表达,生长素的响应性和普拉索德培养细胞的分化有关。中有三种TCA元素元素(顺式作用元素涉及水杨酸反应性)FvDREB2型发起人和一个FvDREB1型发起人,但没有FvDREB18发起人。不同类型和数量的顺式调控元件在决定基因的应激反应或组织特异性表达模式中起着重要作用[13,35],以及在FvDREBs公司可能表明有差异的调节网络。然而,其中的机制FvDREB18调节FvDREB1型和FvDREB2型其他监管机构的表达和参与有待进一步调查。
此外,FvDREB8型干旱胁迫对A-2亚群的生长有显著的正调控作用,且在早期诱导迅速。这表明FvDREB8型可能对干旱非常敏感。参与干旱响应基因表达的A-2亚群DREB成员,最初被称为DREB2,以区别于DREB1,而DREB1被认为是在寒冷响应基因表达调控中发挥作用[47].DREB2A和DREB2B作为8个dreb2型基因中的2个在干旱和盐胁迫条件下被诱导拟南芥,仅限OsDREB2A公司和OSDREBB公司在水稻中,5个dreb2型基因中有2个是由非生物胁迫诱导的[41,39,46].在这项研究中,除了FvDREB8型,FvDREB6型6个A-2亚组基因均表现出干旱胁迫诱导的表达f . vesca. 表达FvDREB6型在老叶中表达下调,在幼叶中表达上调以响应干旱,并且似乎具有组织特异性(图。6和7).值得注意的是,这个基因注释为DREB2-2在脱水的叶子中有下调吗显著,而其表达在根中增加[22,33]. 这些发现为草莓抗旱性的遗传调控提供了新的思路,为提高草莓的抗旱性提供了有益的选择。
结论
我们对中国的AP2/EREBP家族基因进行了全基因组分析f . vesca确认了119个FvAP2/EREBP公司基因。对这些fvdreb的分类、系统进化、结构、共连性和在不同组织中的表达谱以及对干旱胁迫的响应进行了详细的研究。我们的结果显示FvDREB8型A-2亚群在干旱胁迫响应的早期阶段起着重要作用。FvDREB6型似乎是组织特异性的FvDREB18可能在调节FvDREB1型和FvDREB2。总的来说,我们的发现为FvDREBs的特性和潜在功能提供了新的见解,并为更好地理解其在草莓干旱胁迫下的分子基础提供了帮助。
方法
识别和分类Dreb.草莓中的基因
最新版本的f . vesca基因组v4.0.a2从蔷薇科基因组数据库(GDR)下载(https://www.rosaceae.org/species/fragaria_vesca/genome_v4.0.a2)识别草莓DREB TFS。此外,53Dreb., 23AP2.,还有6个拉夫水稻基因(水稻)从密歇根州立大学水稻基因组注释项目数据库(RGAP) (http://rice.plantbiology.msu.edu//), 148年AP2 / EREBP基因来自拟南芥从拟南芥资讯资源(资讯资源)(https://www.arabidopsis.org/index.jsp)数据库。AP2域(PF00847)的隐马尔可夫模型(HMM)从Pfam蛋白分析网站(http://pfam.xfam.org/)用于识别具有规定的e值阈值<1e的AP2/eREBP−5.为了搜索所有可能的AP2/EREBPs,在local Basic local Alignment search Tool(BLAST)中使用了一些AtDREB成员作为查询序列。为了验证搜索结果,所有候选序列都通过一个简单的模块化架构研究工具(SMART)进行了检查和分析(http://smart.embl.de/) [29]以及保守域数据库(CDD)(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi) [38].
所有编码保守AP2结构域的AP2/EREBP候选序列均由MUSCLE以多种比对方式构建[12].使用MEGA 6.06的1000 bootstrap方法和Poisson模型生成了一棵邻域连接系统发育树[51]. 所有AP2/EREBP蛋白均与拟南芥和水稻AP2/EREBP蛋白进行分类。而这些dreb是基于仅存在一个AP2结构域与14th缬氨酸(V14)和19th谷氨酸(E19) [40,46].利用ProtParam工具(ProtParam Tool)分析了所鉴定蛋白的理论等电点(pI)和分子量(MW)。https://web.expasy.org/protparam/) [14].每个蛋白的亚细胞定位用Cell-PLoc 2.0 (http://www.csbio.sjtu.edu.cn/bioinf/cell-ploc-2/) [7].
基因结构及保守基序分析FvDREB基因
的编码序列(CDS)和全长序列FvDREB基因从NCBI获取,用GSDS (Gene Structure Display Server 2.0)图形化显示(http://gsds.cbi.pku.edu.cn/) [21]. 文化中的保守主题FvDREBs公司采用多重Em for Motif Elicitation Tool 5.1.1 (MEME) (http://meme-suite.org/tools/meme)使用默认参数。
染色体定位与共线性分析
染色体的位置FvDREBs公司从f . vesca基因组v4.0.a2,并用MapInspect图形表示(http://www.softsea.com/review/MapInspect.htm).为了研究基因组重复对DREB进化的影响,我们进行了基因组间共时分析f . vesca和f×ananassa.同步信息FvDREBs公司用MCScanX计算[54],用Circos (http://circos.ca/) [26].串联重复表征为多个成员FvDREBs公司发生在由10个或更少的非同源间隔基因分离的相邻基因间区域(距离<100kb)[19].从植物基因组复制数据库(PGDD) (http://chibba.agtec.uga.edu/duplication/) [28].
植物材料与应力处理
草莓(f . vesca亚种vesca)种子是美国农业部果蔬实验室Janet Slovin博士送的礼物。在光周期为16h/8h,温度为24±2°C的组织培养室中,用NaClO(20%,20min)消毒6周后,在1/2ms培养基上生长。轻(~200μmol m)−2年代−1)由LED供电。
通过将植物移栽到土壤中,然后保持水分来进行干旱胁迫。收集2月龄植株0 d、1 d、2 d、4 d、6 d、8 d及处理后2 d、4 d的叶片。所有样品立即放入液氮中,并在-80°C下保存。每个处理和对照均有3个生物重复。
草莓叶片总RNA的提取采用CTAB法,修改较少[17].使用RNeasy/QIAamp®色谱柱(QIAGEN, USA)的RNase-free DNase Set来消除污染的基因组DNA。用美国Applied Biosystems公司的高容量cDNA逆转录试剂盒(High Capacity cDNA reverse Transcription Kit, Applied Biosystems, USA)将总RNA逆转录成cDNA。所有cdna保存于-20°C。
干旱胁迫下草莓的转录组分析
转录组数据由本实验室成员王小龙提供,仅在其博士论文中进行分析,尚未发表[53].草莓在充分吸收水分1 d后进行干旱胁迫。D3、D5、D7分别在第三天(干旱处理2天后)、第5天(干旱处理4天后)、第7天(干旱处理6天后)采集。转录组数据是从旧叶(完全展开的成熟叶阶段)和新叶(完全展开的成熟叶之前阶段)收集的固定数量的RNA中获得的。log2转换的片段每千碱基每百万映射读取(Log2用FPKM法计算不同时期对照和处理植株的基因表达水平。不同的表达模式FvDREB基因(补充信息),由HemI (http://hemi.biocuckoo.org/down.php) [9].
QRT-PCR和表达模式分析
表达模式FvDREB利用QuantStudio应用实时定量聚合酶链反应(qRT-PCR)技术检测基因TMFlex 96-Well PCR系统(Applied Biosystems, USA)和SYBR®绿色试剂(Applied Biosystems, USA)。所使用的引物序列在补充信息.部分引物使用qPrimerDB (http://biodb.swu.edu.cn/qpremerdb.),其他则使用Beacon Designer 8.14设计。各反应混合物的总体积为10 μL;以1 μL cDNA为模板,5 μL PowerUp为模板TMSYBR®Green Master Mix (Applied Biosystems, USA),每种引物0.6 μL, ddH 3.4 μL2O。PCR循环条件如下:95°C 10 min,然后在95°C下进行40次循环扩增30 s,在58–60°C下退火30 s(取决于引物的退火温度),在72°C下延长20 s。熔融曲线条件为:72℃~95℃15s,60℃1min,95℃15s。在PCR后立即对每次扩增进行此操作。四种常用的参考基因(肌动蛋白,EF1型,GAPDH,菲律宾),检测表达基因在草莓中的稳定性。最后,EF1型之所以被用于本研究是因为它是四个内参基因中最稳定的。
相对表达量采用2-ΔCT(ΔCT=CT目标–CT参考;ΔΔCT=(CT靶点-CT参考)治疗-(CT靶点-CT参考)对照)方法[36].标准偏差(SD)由3个生物重复计算[57].
数据和材料的可用性
本研究期间生成或分析的所有数据都包含在本发布的文章及其补充信息文件中。支持本文结论的转录组数据来自小龙王的博士论文[53],该转录组数据的登录号为PRJNA733854。
缩写
- AP2 / EREBP:
-
无瓣a2 /乙烯反应元件结合蛋白
- 爆破:
-
基本的局部对齐搜索工具
- cbf:
-
C-repeat绑定因素
- 客户尽职调查:
-
保守域数据库
- 德雷布:
-
脱水反应元件结合蛋白
- 小块土地:
-
乙烯反应因子
- f×ananassa:
-
草莓属×ananassa
- f . vesca:
-
Fragaria Vesca.
- 德意志民主共和国:
-
蔷薇科基因组数据库
- GSD编号:
-
基因结构显示服务器
- 唔:
-
隐马尔可夫模型
- MEME:
-
多重Em主题启发工具
- 分子量:
-
分子量
- PGDD:
-
植物基因组复制数据库
- PI:
-
等电点
- qRT PCR:
-
定量实时聚合酶链反应
- Rav:
-
ABI3 / VP1有关
- RGAP公司:
-
密歇根州立大学水稻基因组注释项目数据库
- TAIR:
-
的拟南芥信息资源
- TFs公司:
-
转录因子
- WGD:
-
全基因组倍增
参考文献
- 1.
Afzal M、Alghamdi SS、Migdadi HH、Khan MA、Mirza SB、El Harty E。豆类基因组学和转录组学:从经典育种到现代技术。沙特生物科学杂志。2020;27(1):543–55.
- 2.
阿加瓦尔PK,Jha B。植物中的转录因子与ABA依赖和独立的非生物胁迫信号。生物植物。2010;54(2):201–12.
- 3.
Asadieh B,纽约Krakauer。21世纪气候变化下全球旱涝强度的变化。水文地球系统科学讨论。2017;21:1-22。
- 4.
植物多倍体的研究进展。中国生物医学工程学报,2004;
- 5.
Burke EJ, Brown SJ, Christidis N.用Hadley中心气候模型模拟全球干旱的近期演变和21世纪的预测。J Hydrometeorol。2006;7(5):1113 - 25。
- 6.
陈文杰,朱婷。转录因子网络在环境应激反应中的作用。植物科学趋势。2004;9(12):591–6.
- 7.
周凯奇,沈海斌。Cell-PLoc:一套网络服务器,用于预测各种生物体中蛋白质的亚细胞定位。Nat Protoc。2008;3(2):153。
- 8.
(1)研究方向:生物化学,生物化学,生物化学,生物化学,生物化学,生物化学栽培草莓中发现的主效候选基因(草莓属×ananassa为鞣花酸脱氧己糖苷和天麻精苷-3- o -丙二醛糖苷生物合成的关键多酚类化合物。Hortic杂志2020;7(1):17。
- 9
邓W,王Y,刘Z,程H,薛Y。HemI:一个用来说明热图的工具箱。公共科学图书馆一号。2014;9(11):e111988。
- 10.
董聪,马勇,Wisniewski M,程志明。过度表达的meta分析CBF/DREB公司干旱胁迫反应的家族基因。环境实验机器人。2017;142:1–14.
- 11.
Edger PP, Poorten TJ, VanBuren R, Hardigan MA, Colle M, McKain MR等。八倍体草莓基因组的起源和进化。51 Nat麝猫。2019;(3):541 - 7。
- 12.
埃德加钢筋混凝土。肌肉:高精度和高通量的多序列比对。核酸研究,2004年;32(5):1792–7.
- 13.
关键词:水稻,NAC转录因子,组织特异性,胁迫响应,系统序列分析中国生物医学工程学报,2008;
- 14.
Gasteiger E、Hoogland C、Gattiker A、Wilkins先生、Appel路、Bairoch A。ExPASy服务器上的蛋白质识别和分析工具。蛋白质组学协议手册。2005年。571–607.
- 15.
gaderi N、Siosemardeh a对干旱胁迫的响应。库尔德斯坦和热带雨林)。中国生物医学工程学报。2011;52(1):6-12。
- 16
Gilmour SJ、Sebolt AM、Salazar MP、Everard JD、Thomashow MF。过表达拟南芥CBF3转录激活剂模拟与冷驯化相关的多种生化变化。植物生理学。2000;124(4):1854–65.
- 17
Gonzalez-Mendoza D,Moreno AQ,Zapata-Perez O.一种从Avicennia Germinans叶中分离总RNA的改进方法。Z Naturforsch C. 2008; 63(1-2):124-6。
- 18
Haake V,Cook D,Riechmann J,Pineda O,Thomashow MF,张JZ。转录因子CBF4是干旱适应的调节因子拟南芥.植物杂志。2002;130(2):639 - 48。
- 19
Hanada K,Zou C,Lehti Shiu MD,Shinozaki K,Shiu SH.植物串联重复序列的谱系特异性扩增在环境刺激适应性反应中的重要性。植物生理学。2008;148(2):993–1003.
- 20.
洪B,马C,杨Y,王T,山口新崎K,高J。过度表达AtDREB1A菊花对热胁迫的耐受性增强。植物分子生物学。2009;70(3):231–40.
- 21.
胡b,金吉,郭艾,张h,罗j,高g. gsds 2.0:升级基因特征可视化服务器。生物信息学。2015; 31(8):1296-7。
- 22.
Janiak A、Kwaśniewski M、Szarejko I。干旱胁迫下根系基因表达调控。J实验机器人。2016;67(4):1003–14.
- 23.
Jaglo-Ottosen KR, Gilmour SJ, Zarka DG, Schabenberger O, Thomashow MF。拟南芥CBF1过度引发cor基因和增强抗冻性。科学。1998;280(5360):104–6.
- 24.
金建华,王明,张海星,汗阿,魏安,罗德新,等。辣椒AP2/ERF转录因子家族的全基因组鉴定(甜椒l .)。基因组。2018;61(9):663 - 74。
- 25.
Jiao Y,Wickett NJ,Ayyampalayam S,Chanderbali AS,Landherr L,Ralph PE,等。种子植物和被子植物的祖先多倍体。自然。2011;473(7345):97–100.
- 26.
Krzywinski M,Schein J,Birol I,Connors J,Gascoyne R,Horsman D等,《Circos:比较基因组学的信息美学》。基因组研究,2009年;19(9):1639–45.
- 27.
绿豆ap2/erf转录因子的全基因组鉴定绿豆)干旱胁迫下vrdreb亚家族的表达谱分析。牧草科学。2018;69(10):1009–19.
- 28.
李士泰,唐浩,王旭,阿派德森。PGDD:植物基因和基因组复制数据库。核酸杂志2012;41(D1): D1152-8。
- 29.
Letunic I、Khedkar S、Bork P。SMART:2020年最新更新、新发展和现状。核酸研究2021;49(D1):D458–60。
- 30.
李先生,李勇,李汉奎,吴国军。异位表达FaDREB2提高纸桑的渗透耐受性。综合植物生物学杂志。2011年a;53(12):951–60.
- 31。
李晓,程晓,刘军,曾红,韩磊,唐伟拟南芥DREB1A / CBF3基因增强抗旱性和抗冻性多年生黑麦草植物。Plant Biotechnol Rep. 2011b;5(1): 61-9。
- 32。
李Y,皮敏,高Q,刘Z,康C。野生草莓的更新注释Fragaria Vesca.V4基因组。Hortic Res.2019年;6(1):1–9.
- 33。
刘超,张欣,张凯,安浩,胡凯,文杰,等。比较分析甘蓝型油菜干旱胁迫下根和叶转录谱的变化。国际分子科学杂志。2015;16(8):18752–77.
- 34.
关键词:棉花,AP2/EREBP,扩展,胁迫,胁迫响应BMC基因组学,2017;18(1):1 - 16。
- 35.
刘忠,孔力,张明,吕勇,刘勇,邹明,等。基因工程的全基因组鉴定、系统发育、进化和表达模式AP2/ERF公司基因和细胞分裂素反应因子芸苔属植物拉伯ssp。学报。《公共科学图书馆•综合》。2013;8 (12):e83444。
- 36.
Livak KJ, Schmittgen TD。采用实时荧光定量PCR和2(-Delta Delta C(T))方法分析相关基因表达数据。方法。2001;25(4):402 - 8。
- 37.
马格纳尼E、舍兰德K、哈克S。从核酸内切酶到转录因子:植物ap2dna结合域的进化。植物细胞。2004;16(9):2265–77.
- 38.
Marchler-Bauer A,Lu S,Anderson JB,Chitsaz F,Derbyshire Mk,Deweese-Scott C,等。CDD:蛋白质功能注释的保守域数据库。核酸RES。2010; 39(SUPPLY_1):D225-9。
- 39.
Matsukura S, Mizoi J, Yoshida T, Todaka D, Ito Y, Maruyama K,等。编码非生物胁迫应答基因转录因子的水稻dreb2型基因的综合分析。基因组学。2010;283(2):185-96。
- 40.
NAKANO T,SUZUKI K,FUJIMURA T,Shinshi H.基因组广泛分析ERF.基因家族在拟南芥和米饭。植物杂志。2006;140(2):411 - 32。
- 41.
关键词:拟南芥,dreb2,重结合蛋白,脱水,高盐度植物生物学杂志。2000;42(4):635 - 639。
- 42.
Novillo F、Alonso JM、Ecker JR、Salinas J。CBF2/DREB1C是CBF1/DREB1B型和CBF3 / DREB1A在拟南芥的胁迫耐受中起核心作用。自然科学学报,2004;101(11):3985-90。
- 43.
Ohme Takagi M,Shinshi H。与乙烯反应元件相互作用的乙烯诱导DNA结合蛋白。植物细胞。1995;7(2):173–82.
- 44.
Perin EC,da Silva MR,Borowski JM,Crizel RL,Schott IB,Carvalho IR等。ABA依赖盐和干旱胁迫提高草莓果实品质。食品化学。2019;271:516–26.
- 45.
秦F,Kakimoto M,Sakuma Y,Maruyama K,Osakabe Y,Tran LSP等。ZMDREB2A对干旱和热应力的调节和功能分析玉米L植物J。2007;50(1):54–69.
- 46.
关键词:ERF/AP2, ERF/AP2, dna结合,特异性拟南芥DREBs,参与脱水和冷诱导基因表达的转录因子。生物化学与生物物理学报,2002;
- 47.
关键词:生物力学,生物力学,佐久间,秦芳,关健,筱崎,等。函数分析拟南芥转录因子,DREB2A,参与干旱响应基因表达。植物细胞。2006;18(5):1292–309.
- 48.
关键词:免疫细胞化学,蛋白原位定位,植物abstract:Nat Protoc。2006;1(1):98。
- 49.
Shulaev V,Sargent DJ,Crowhurst RN,Mockler TC,Folkerts O,Delcher等.林地草莓的基因组(Fragaria Vesca.).43 Nat麝猫。2011;(2):109 - 16。
- 50
无瓣a2 /乙烯响应因子在作物改良中的应用前景功能基因组学简报。2019;18(4):240-54。
- 51
Tamura K、Stecher G、Peterson D、Filipski A、Kumar S。分子进化遗传学分析6.0版。分子生物学。2013;30(12):2725–9.
- 52。
王鑫,林松,刘丹,丁静,李勇。表征与表达分析ERF.基因在Fragaria Vesca.提示串联ERF重复序列存在不同的差异。前基因。2019;10:805.
- 53。
王X.干旱胁迫下草莓中Bzip基因的进化和反应分析。南京农业大学的一篇论文,部分履行了散文中农学学博士学位的要求。2017年;93-112
- 54。
王y,唐,debarry jd,tan x,li j,wang x等。McScanx:一种用于检测和进化分析的工具包,对基因同步和共线性分析。核酸RES。2012; 40(7):E49。
- 55。
Wessler SR。ap2dna结合域的起源。植物科学趋势。2005;10(2):54–6.
- 56。
一种新的顺式作用元素拟南芥基因参与对干旱,低温或高盐胁迫的反应性。植物细胞。1994年; 6(2):251-64。
- 57。
席燕,刘杰,董聪,程志明。葡萄的CBL和CIPK基因家族(葡萄):全基因组分析和表达谱对各种非生物胁迫的响应。植物科学与技术,2017;
- 58.
严建文,班志军,陆海英,李丹,Poverenov E,罗志忠,等。草莓果实的香气挥发库综述。食品农业学报。2018;98(12):4395-402。
确认
我们感谢南京农业大学的萧龙望分享未发表的转录组数据。
资金
本项目由江苏省研究生培养创新项目(KYCX18_0688)、江苏省教育厅和美国田纳西大学农业实验站联合资助。作者感谢国家留学基金委给予的经济支持。
作者信息
从属关系
贡献
CD和ZMC构思了这个想法并设计了实验;CD分析数据,进行实验,并撰写手稿;YX帮助进行数据分析并提供建设性的讨论;XC对数据实验准备有显著贡献;ZMC为研究构想做出了贡献,并修改了手稿。所有作者都已阅读并批准了本手稿的最终版本。
通讯作者
道德声明
道德认可和参与同意
不适用
出版许可
不适用
相互竞争的利益
作者声明他们没有相互竞争的利益。
附加信息
出版商的注意事项
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
权利和权限
开放获取本文是根据知识共享署名4.0国际许可证授权的,该许可证允许以任何媒体或格式使用、共享、改编、分发和复制,只要您给予原作者和来源适当的信任,提供到知识共享许可证的链接,并指出是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可证中,除非在材料的信用额度中另有说明。如果材料未包含在文章的知识共享许可证中,并且您的预期用途不受法律法规的允许或超出允许的用途,您将需要直接获得版权持有人的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非信用额度中另有规定。
关于这篇文章
引用本文
Dong、C.、席、Y.、陈、X.等。AP2/EREBP的全基因组鉴定Fragaria Vesca.干旱胁迫下FVDREB亚家族的表达模式分析。BMC植物杂志21,295 (2021). https://doi.org/10.1186/s12870-021-03095-2
已收到:
接受:
出版:
关键词
- Dreb.
- 结构特点
- 复制
- 干旱胁迫
- Fragaria Vesca.
- 表达