- 研究
- 开放访问
- 出版:
河岸自交草本植物的群体、遗传结构和连通性Caulokaempferia coenobialis.亚热带季风林的小尺度地理水平
BMC植物生物学体积21., 文章编号:329.(2021.)
摘要
背景
河流和溪流促进了个体及其基因在景观中的移动,通常被认为是河岸植物的散布走廊。然而,一些作者报道了直接对比的结果,这可能归因于复杂的混合因素,例如繁殖体(种子和花粉)的交配系统和传播机制,使得很难预测河岸物种的遗传多样性和种群结构。在这里,我们研究了一种河岸自交的草本植物Caulokaempferia coenobialis.,这不使用种子分散的异色或Zoochory;这些研究可能有助于改善对河流遗传多样性和河岸植物遗传多样性和结构的影响的理解。使用多晶态ISSR和CPDNA基因座,我们研究了在亚热带季风林中的不同流系统(线性流,树枝状物流和复杂的横向水文系统)的微观图规模对遗传结构和连通性的影响C腔肠鼎湖山种群(DH)和南昆山种群(NK)。
结果
结果表明,最新单倍型(DH:H7,H8;NK:h6、h7、h11、h12)不属于C腔肠在每个流系统中。此外,下游本地种群不积累遗传多样性,无论是在DH的线性溪边本地种群(H:0.091 vs 0.136)或跨越NK的树枝状物流局部群体(H:0.079 Vs 0.112,0.110)。我们的结果表明,当地的连接C腔肠DH和NK的种群可归因于历史基因流动,导致缺乏空间遗传结构,尽管是自我施肥。自我C腔肠能保持较高的遗传多样性(H = 0.251;一世= 0.382)G装货单 = 0.5915;F装货单= 0.663),在微地理尺度上,局部适应、中性突变和/或遗传漂变强化了这一效应。
结论
我们建议溪流不是作为分散的走廊C腔肠维持自交物种遗传多样性的保护策略应侧重于保护所有生境类型,特别是生态系统过程中的孤立片段。
背景
植物物种的遗传变异是由交配系统、自然选择、进化史、生活史特征和基因流动机制(花粉和种子的传播能力)决定的,这些因素可以导致物种内部种群的复杂遗传结构[1那2].因此,植物种群的遗传多样性和结构可以揭示生态系统中野生种群内物种多样性和物种间物种多样性的重要信息,并被认为是生态系统中野生种群内物种多样性和物种间物种多样性的重要战略依据。3.那4.那5.].近几十年来的人类介导干扰的增加,如森林的破坏以及许多植物物种的栖息地破坏,导致生物多样性的快速丧失,随之而来的景观结构的变化[6.那7.那8.]. 因此,提高对高自然价值生境中物种的遗传变异和连接性的了解,是为小型和孤立种群制定保护战略的关键[9.那10.].森林支持世界陆地群的65%,为许多分类群体拥有最多的物种多样性;从而节省森林生物多样性是一项关键任务,正确地成为许多国家和国际森林管理协议的关键组成部分[11.].到目前为止,对森林植物遗传变异和种群遗传结构的研究大多集中在木本植物[12.那13.那14.那15.那16.那17.那18.那19.那20.],虽然对灌木丛草药的实证研究很少见[21.那22.那23.那24.那25.那26.].在后者中,在灌木丛中的河岸植物研究(例如Primula Sieboldii., [22.];Heliconia Metallica, [27.]),仍然仍然是。
河流或溪流促进个人和基因在景观中的运动,并且通常被认为是河岸植物的走廊[5.那28.].水(水质)的宣传被动运动是河岸植物物种的重要模式,对河岸植物社区的组成具有显着影响,通常促进物种丰富性[18.那29.那30.]. 水作为传播媒介的有效性意味着水生生物也负责高水平的基因流动,从而减少种群之间的遗传分化以及下游种群更大的遗传多样性[31那32那33那34那35].然而,一些作者报告了相反的结果,即,可以在河内的人群中找到标记的遗传分化和遗传不连续性,这表明河流不会充当分散的走廊[36那37那38那39那40那41].上述相反的结果可能归因于竞争因素(如河/流,山和碎片),可能是在某种程度上参与的历史或当前传播种子或植物繁殖体,导致难以预测河岸物种的遗传多样性和种群结构(41]. 山脊起着地理屏障的作用,可以阻碍基因流动,导致植物的遗传分化[42]并且栖息地碎裂可能破坏或降低基因流动并侵蚀植物的遗传变异[43].此外,花粉和种子的繁殖系统和传播能力是影响种内居群空间遗传结构和动态的最重要因素[44那45那46],在以往的滨水植物研究中未被考虑。在异交植物中,花粉传播有可能通过风或动物传粉者进行长距离的基因传递,因此通常是基因流通的重要组成部分[47那48那49].以前的研究表明,通过频繁的基因流动,植物可以保护遗传多样性,而当每一代的基因流量非常低时,可以有效地消除遗传分化[50那51].自交群落间缺乏花粉迁移,种子的运动是自交植物基因流动的主要组成部分。大量关于遗传变异的研究表明,相对于异交物种,自交物种的居群内多样性通常会减少,但居群间的遗传分化却会加强[52那53那54那55那56]. 事实上,种子的移动可能影响遗传多样性的空间分布,有利于自交和异交植物群体间的遗传连接。大多数种子散布在离源植物很近的地方,因此在大多数情况下,可以预期具有共享谱系的种子的空间聚集[57]. 然而,影响种子二次扩散和改变种子分布格局的因素有很多,如水生因素、滞水因素和动物因素[58那59那60那61]从而影响群体间遗传多样性和遗传连通性的空间分布。因此,由于这种复杂的混合因素,很难完全理解是什么驱动河岸植物的遗传多样性和种群结构。因此,需要研究一个没有花粉迁移(自交)和没有无花粉或动物群落种子传播的物种;这些研究有助于更好地了解河流或溪流对河岸植物种群遗传多样性和结构的影响。此外,以前对河岸植物的许多研究都是在宏观地理尺度上进行的,很少有研究是在精细地理尺度上进行的(例如。木槿moscheutos, [62];Primula Sieboldii., [22.];毛里塔尼亚flexuosa, [17.]). 然而,了解河流或溪流对小规模种群遗传模式的影响程度,特别是河流水流结构种群方向等因素对理解生境对河岸植物可能产生的影响至关重要。
Caulokaempferia coenobialis.(HANCE)K. Larsen(图。S1级)是一种落叶常年草药,沿着华南湿润季风森林的阴暗中的河流陡峭的悬崖上[63那64].该植物是非克隆的,通过滑动花粉自花受精[64那65]和种子被雨水溅散[65那66那67].因此,自交C腔肠代表一个良好的系统,可以调查河流或河流对河岸植物中群体遗传多样性和结构的影响,因为它可以解开对雌激素或Zoochory的花粉迁移和次级种子分散的相对影响。在这项研究中,我们评估了遗传变异和局部群体之间的差异水平C腔肠在使用CPDNA和ISSR(简单次序列重复)数据的微观影规规模上,重点关注以下问题:(1)自行自行C腔肠在微观地理尺度上表现出低的遗传多样性和显著的空间遗传结构(2) 溪流有利于水的扩散吗C腔肠沿着溪流纵向过程中当地群体中的种子,从而导致在地方群体中的遗传多样性积累,作为理论预测?
结果
ISSR、cpDNA特性与遗传多样性
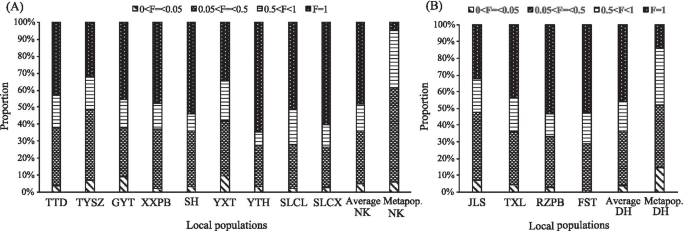
10个ISSR引物从集合种群DH和NK的13个地方种群中产生了218条可重复的条带(平均每个引物21.8条带),其中213条(97.7%)为多态性,6条(2.8%)为特异性(表1)1, 桌子2).在元群体水平上,Nei的遗传多样性平均值(H)还有香农指数(一世)的C腔肠分别为0.251和0.382。NK的遗传多样性指数大于DH(H:0.298比0.204;一世:0.450 Vs 0.313)。在当地人口水平,遗传多样性指数范围为0.058至0.136(H,平均值为0.098)和0.089至0.211(一世,平均值为0.152)。本地种群JLS(DH)和TYSZ(NK)的遗传多样性水平最高(H = 0.136,一世= 0.209;H = 0.136,一世 = 0.211, respectively), while local populations FST (DH;H= 0.091,一世= 0.138) and SLCX (NK;H = 0.058,一世 = 0.089) exhibited the lowest levels. Among all local populations except JLS (DH) and TYSZ (NK), common loci (i.e. found in all individuals/local population: gene frequency = 100%) accounted for the highest proportion of amplified fragments (34.3–60.4%), while low-medium gene frequency loci (5% < gene frequency ≤ 50%) accounted for a higher proportion of amplified fragments (23.6–41.9%) than medium–high gene frequency loci (50% < gene frequency < 100%) (13.2–24.1%) (Fig.1).稀有基因率(基因频率≤5%)在所有13个局部种群(0.0-9.5%)中表示非常低的比例。However, at the metapopulation level, both common loci and rare loci of DH and NK were less prevalent, i.e. 14.2% and 14.8%, and 4.8% and 5.8%, respectively, but loci with low-medium and medium–high gene frequency accounted for a higher proportion of amplified fragments, i.e. 37.2% and 33.9%, and 55.8% and 33.7%, respectively.
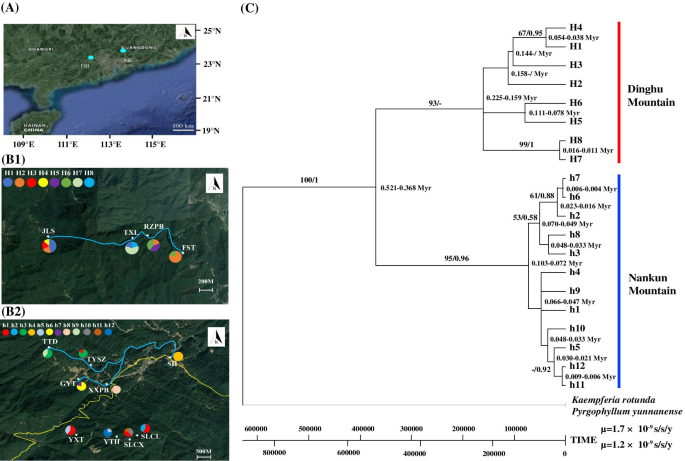
集合种群DH和NK的cpDNA序列长度分别为1262和1191个碱基对。多态性在DH和NK中鉴定出20个单倍型,其中8个单倍型(H1-H8)位于DH,12个单倍型(H1-h12)位于NK(表1)1,图。2).在比例水平,CPDNA数据显示出平均氯类型多样性的高估计数(H = 0.869) and average nucleotide diversity (π = 2.375 × 10–3).在当地人口水平,单倍型多样性和核苷酸多样性范围为0至0.800(平均0.489)和0到3.170×10–3(平均0.845 × 10–3), 分别。除SH和XXPB之外的所有本地种群是多态的,而当地群体JLS(DH)和SLCX(NK)分别含有四个和三种不同的单倍型。
(A)偏群体DH和NK的位置;(B)叶绿体(cp) DNA单倍型的地理分布Caulokaempferia coenobialis.在Metapopationation DH(1)和NK(2)内的当地群体中检测到。浅蓝色和黄线分别表示流和G355国家道路;(c)CPDNA单倍型的最大可能性(ML)树C腔肠。基于ML分析和后验概率值(BS / PP)的引导值(%)在分支的上方/下方指示,并且在节点处指示每个谱系的聚结时间。原始卫星图像是从谷歌地图获得的(地图数据©2019 Google;https://maps.google.com/)并使用adobeillustrator CS6 (adobesystems Incorporated, San Jose, CA, USA)进行修改
遗传分化与基因流
基于ISSR数据集(表3.)遗传分化值(G装货单)对于当地的人口C腔肠DH和NK的遗传变异分别为0.5034和0.6796,表明49.66%和32.04%的遗传变异分布在DH和NK本地群体中。估计的基因流量(N.m), DH和NK分别为0.4933和0.2357。在NK中,NK- ii横向水文系统局部居群之间的遗传分化大于NK- i树突状水系局部居群之间的遗传分化(G装货单: 0.6589 vs 0.5982);因此,平均估计的基因流(N.m) NK-II在当地人群中的分布低于NK-I(0.2588对0.3359)。AMOVA结果(表4.)的遗传分化统计结果与Nei的遗传分化统计结果一致,显示53.00%和69.00%的变异分布在DH和NK两种地方群体之间。NK的变异总量中有63.00%和71.00%分别分布在NK- i和NK- ii的地方群体中。
对于CPDNA,遗传分化系数(F装货单)在当地人口中,DH和NK分别估计为0.556和0.770(表1)3.).的N.在当地种群中,DH和NK分别为0.40和0.14 m。在朝鲜,F装货单在NK-II群中的群体中低于NK-I局部种群(0.477 Vs 0.863)。Amova(表格4.)发现,DH(54.63%)和NK(84.55%)的分子变异在当地群体中均有分布。NK-I的局部群体间存在86.5%的分子变异,而NK-II的局部群体间存在47.67%的分子变异。
cpdna haplotypes的关系
总共在DH和NK中鉴定了20个CPDNA单倍型,其中14个是私人单倍型限制为单一局部群体。在局部种群中共享六个单倍型,其中H1,H 2和H6在DH局部群体中共享,H1,H3和H5在NK本地人群中共享(表1,图。2B1,B2)。在后者中,H1在NK-I和NK-II之间共享,而H3和H5分别仅发生在NK-I和NK-II中(图。2B2)。
ML时序图来源于cpDNAC腔肠DH和NK的当地群体支持20个单倍型作为一个单系群,bootstrap值为100%,估计树冠年龄约为0.521 ~ 0.368 Myr(图1)。2C)。该单晶组进一步分为两个主要谱系:NK谱系(ML引导支持(BS)= 95%,PP = 0.96)和DH谱系(ML BS = 93%,PP = - )。DH谱系(0.225-0.159 MYR)的最新共同祖先早于NK谱系(0.103-0.072 MYR)。发散时间估计(约0.016-0.011 MYR)表明H7和H8是DH中出现的最新单倍型。H6,H7,H11和H12单倍型最近在NK中产生,具有CA的发散时间。0.009-0.004 MYR。
基因聚类和空间遗传结构在基础上
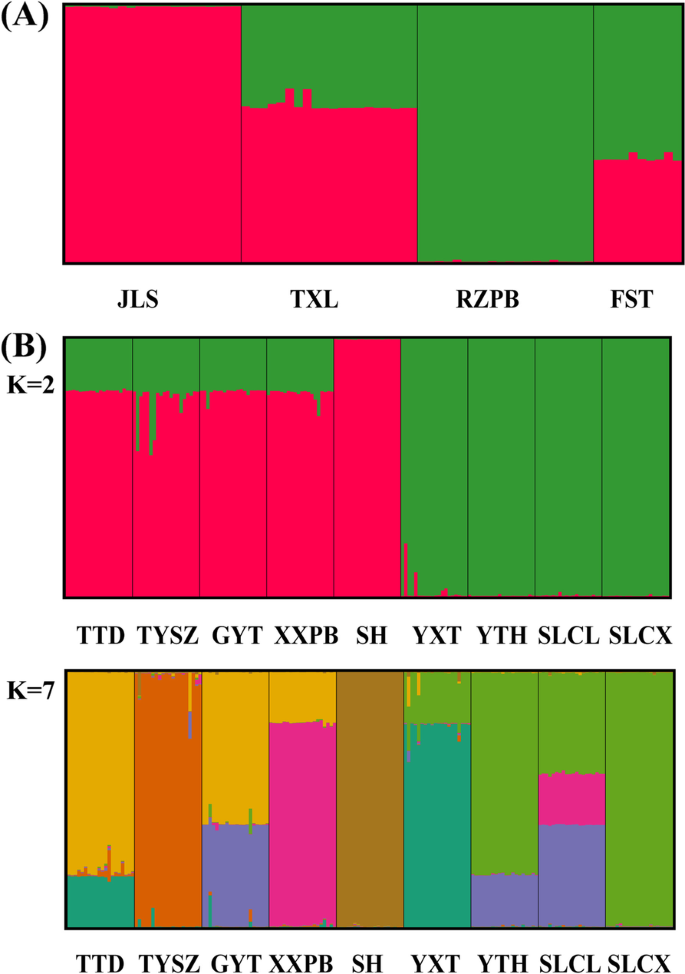
贝叶斯遗传结构分析显示,对数似然在K = 2时达到最大值,并将所有本地群体划分为两个遗传群(图1)。3.一种;图。S2级一种)。在当地人群JLS和RZPB中,将每个本地人口中的所有个人分配给同一遗传集群。然而,在当地群体TXL和FST中的所有个体中存在高度的两个基因池混合物。在NK中,用k = 2(第二最高ΔK值),将所有本地群体分配给两个基因簇(图。3.B;图。S2级b),除了NK-I的四个当地群体(TTD,Tysz,Gyt,XXPB)之外,几乎所有个体分配给当地群体中的相同遗传群;这表明这四种局部种群内的两个基因池中的较高级别。在最高的日志似然(k = 7)处,NK中的所有本地群体都可以分配给七种遗传簇(图。3.b)。除了三个当地人群(Tysz,SH和SLCX),每个本地人口内的所有个人都显示出遗传混合物的迹象。
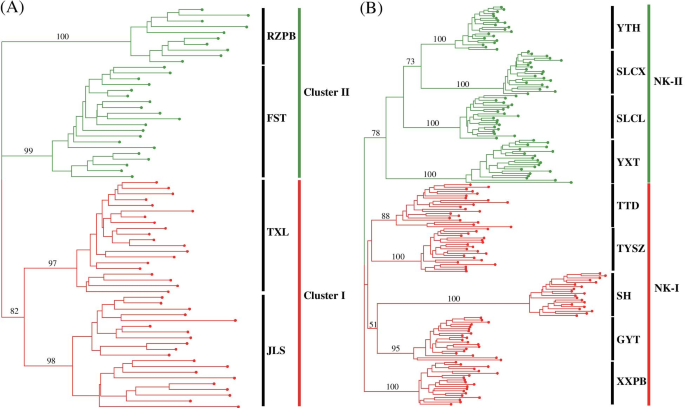
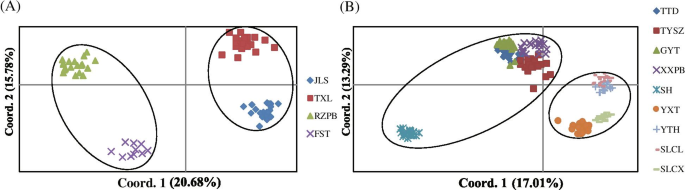
所有来自同一当地人口的人C腔肠在DH和NK基于ISSR Nei的遗传距离,在整个邻近的邻近(NJ)树中聚集在一起(图。4.).在DH中,将四个当地群体分为两个簇,其相似指数值为820 / 1,000(图。4.a),包括两个上游本地群体(群集I:JLS和TXL;突出显示红色)和两个下游本地群体(集群II:RZPB和FST;突出显示绿色)。在NK中,将九个局部种群分成两个簇,其相似指数值为780 / 1,000(图。4.b),其中一个集群(群集NK-i;突出显示的红色)包括五个树枝状物流系统本地群体,而另一个(群体NK-II;突出的绿色)分别包括四个横向水文系统局部种群。Cluster NK-I可以分为两个有三个分支的群体。一组仅包括当地人口XXPB的所有个人,另一组由两个具有低自举值的片断组成,其中当地人群Gyt和Sh形成了一个人,当地群体Tysz和TTD形成了另一个人。类似地,簇NK-II也形成了两组,其中具有三个良好的分离的碎片,其中一组包含来自局部种群YXT的所有个体。另一组由两个分支机构,当地人口SLCL和另一个包括当地人口yth和slcx的分支机构组成。UPGMA树枝图(图。S3级)基于Nei的相似系数,还表明,DH和NK中相同的本地群体的所有个人聚集在一起。然而,DH中的四个当地人口被分为两个具有三个良好的分离的枝条(图S3级A) ,与NJ树中的结果不同。此外,NK的9个本地种群在UPGMA树状图中被分为两个簇,4个分支,相似性指数值为0.54(图1)S3级B) ,结果与NJ树冲突。PCoA分析(图。5.)揭示了一种与大概一致的模式,与大型的NJ树和遗传基团结构一致,其中当地人口C腔肠将DH和NK的个体分别划分为两个群体,并将来自同一地方种群的个体聚在一起。
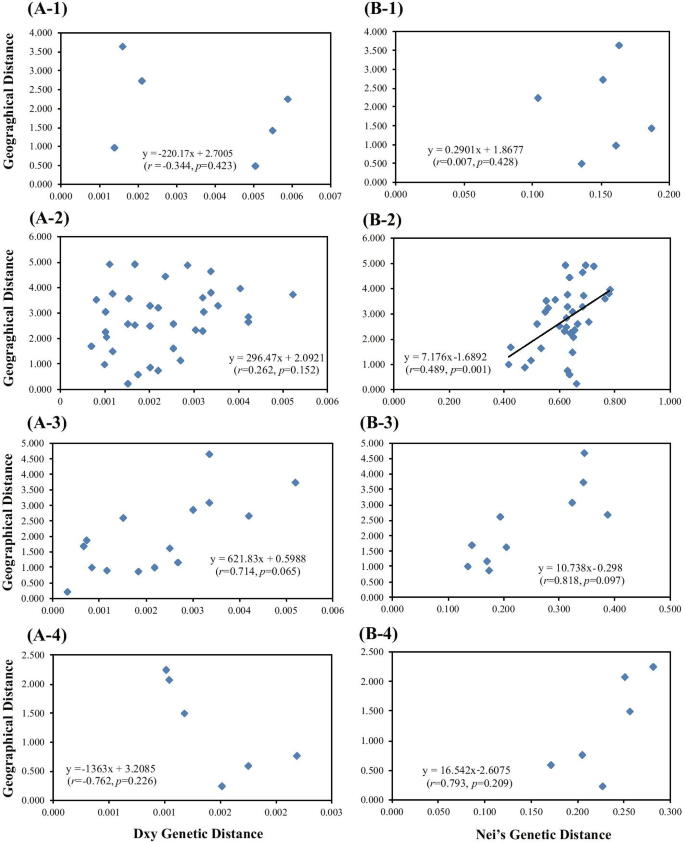
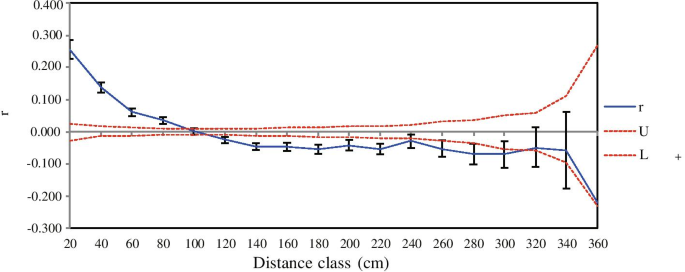
Mantel检验结果表明,基于cpDNA的DH地方种群间没有明显的距离隔离关系(R. = -0.344,P.= 0.423)和ISSR (R. = 0.007,P. = 0.428) data (Fig.6.A-1,B-1)。然而,基于ISSR数据的NK地区所有群体的遗传差异与地理距离的相关性较弱(R. = 0.489,P. = 0.001)(图。6.B-2),但使用CPDNA数据没有观察到这种相关性(R. = 0.262,P. = 0.152) (Fig.6.A2)。此外,当地人口之间的遗传和地理距离之间没有相关性C腔肠根据CPDNA的NK-I或NK-II(R.= 0.714,P. = 0.065;R. = -0.762,P. = 分别为0.226)或ISSR(R. = 0.818,P.= 0.097;R. = 0.793,P. = 0.209, respectively) data (Fig.6.空间自相关分析表明,20 ~ 92 cm处存在显著的正空间遗传结构(图5)。7.).
讨论
可以自交C腔肠在微观图规模上保持高遗传多样性?
交配系统是影响植物物种遗传变异性的主要因素。众多研究表明,自行式植物物种在人口和物种水平上具有较少的遗传多样性,而不是外交的物种[52那68那69那70].相比之下,对两个密切相关的自我和折叠的比较研究Zingiber两种宏地理和微观摄影水平的物种[55那56]结果表明,虽然自交群体/亚群体的遗传多样性水平不同Z珊瑚显着低于overcrossingz nudicarpum自交种/集合种群遗传多样性水平Z珊瑚与Outcrossing的相当z nudicarpum。我们的结果与上述比较研究的结果一致[56],即自行性中的遗传遗传多样性C腔肠与异交相当z nudicarpum(H = 0.251对0.2246,P.= 0.730;一世 = 0.382比0.3480,P. = 0.776) despite the within-population genetic diversity (Nei’sH = 0.098) being significantly lower than that in outcrossingz nudicarpum(H = 0.098比0.1464,P. = 0.003;一世 = 0.152 vs 0.2257,P. = 0.004). This implies that, similarly to outcrossing species, selfing plant species can maintain a high level of species genetic diversity—albeit by using different strategies—on both the microgeographic and macrogeographic scales.
与异交种不同,自交种的高物种遗传多样性水平可能是由于花粉迁移率低,从而导致种群间的高水平遗传分化[71那72].在自我中的当地人口的迁移中没有迁移C腔肠集合种群,任何在特定的本地种群中发生的突变都可能固定在该本地种群中,并且不能传播到其他本地种群。基于ISSR和cpDNA数据的研究结果证实,两个DH的地方群体间的遗传分化相对较高(G装货单 = 0.5034,F装货单= 0.556)和NK (G装货单= 0.6796,F装货单 = 0.770) metapopulations. The proportion of ISSR common loci was highest within local populations ofC腔肠而在DH和NK混合群体中,普通基因座和中低基因频率基因座所占比例最低,最高(图1)。1).这些结果表明,当地人群中,等位基因基因座在自我中的高水平遗传多样性C腔肠在微凝视(Metapopation DH和NK)上。进化理论预测遗传漂移将导致大量局部分化N.m <1 [73那74],因为种群间的基因流动受到花粉和种子传播范围的限制,不足以抵消随机漂变的影响[2那75]. 自拍就是这样C腔肠在我们的研究中。ISSR基因流的估计(N.M)在本地种群之间C腔肠平均仅为0.4933和0.2357 (N.M <1)分别归因于当地群体中缺乏花粉迁移[64那65]以及限制种子分散[66那67]在当地种群中,空间遗传结构的显著正自相关仅在0.20-0.92 m处检测到(图。7.).此外,大量的私有cpDNA单倍型来源于祖先单倍型(DH: H3、H4、H5、H7、H8;NK: h2, h4, h6-h12)居住在当地种群中,说明当地种群C腔肠是高度异质的,因此导致了遗传变异的增加[76]. 基于以上,我们建议自拍C腔肠可以通过局部适应和中性突变和/或通过局部群体对微量页规模的遗传漂移的随机力来保持高遗传多样性。因此,保护和改善自行物种遗传多样性的保护策略应重点关注保护所有栖息地类型,特别是生态系统过程中的隔离碎片。
当地居民C。coenobialis.在微观图规模上显示出大量的空间遗传结构,如最自行的人群?
自肥物种,其遗传有效的群体大小和基因流程过程应得较强的空间遗传结构[52那77那78那79].与预期相反,基于ISSR和cpDNA数据的Mantel检验表明地理距离和遗传距离之间没有显著相关性(ISSR:R. = 0.007,P.= 0.428;cpdna:R. = -0.344,P. = 0.423),这意味着历史传播和/或当代基因流可能通过种子传播和花粉运动在当地种群中发生[75那80].由于自我施肥机制C腔肠因此,在当地群体中缺乏花粉迁移,以及有限的种子分散,通过低基因流(N.M = 0.4933)当地人口C腔肠在DH中,当代基因流动不应发生在当地人口中。此外,我们的研究结果显示,一些原始单倍型(H1、H2和H6)在DH本地群体中是共享的,而最新的单倍型(H7、H8)则不是。这证实了历史的传播,而不是当代的基因流动,发生在当地的种群C腔肠穿过DH。
类似地,基于CPDNA数据的壁炉线测试表明,NK的当地群体中没有显着的空间遗传结构(R. = 0.262,P. = 一些祖先单倍型(h1,h3,h5)在当地人群中是共享的。这些结果也表明,历史上分散发生在当地人口在NK。然而,在ISSR数据中发现,当地人口之间的关系较弱(R. = 0.489,P.= 0.001),基因流很低(N.M = 0.2357),这意味着当地种群之间的当代基因流动受到限制的种子传播和花粉运动的缺乏[2那75].这是通过缺乏在当地的花粉迁移和当地群体C腔肠[64那65]有限的种子分散[66那67].我们的结果还表明,当地人群中缺乏最新的共用单型(H6,H7,H11,H11)。这些结果一起显示了当地的群体C腔肠整个NK可能经历了萎缩和碎片相对最近,这是伴随着大大减少基因流和增加遗传分化的地方人口。大量研究表明,在许多陆地生态系统中,破碎化降低了生境规模,增加了种群的生境隔离度,减少了基因流动和遗传变异,同时增加了种群间的遗传分化[81那82那83那84那85那86].基于ISSR和cpDNA数据的研究结果也证实了该地区群体间的遗传分化C腔肠整个朝鲜都很可观。事实上,由于朝鲜地区旅游业的增长,当地人口的栖息地连通性C腔肠已经被公路、农田和度假村所破坏,这很可能阻碍了繁殖体的传播。聚类分析和结构分析结果揭示了云南种群结构的一个清晰模式C腔肠,两个群集对应于NK,西北地区的两个区域(集群NK-I:树枝状物流排列系统本地人口TTD,Tysz,Gyt,XXPB和SH)和东南地区(群集NK-II:横向水文系统本地人群YXT,YTH,SLCL和SLCX)。这两个地区由G355国道沿着山谷分开。基于CPDNA和ISSR数据的Mantel测试分别应用于两个集群,表明树木统治流系统本地人群中的地理和遗传距离之间没有显着相关性(ISSR:R. = 0.818,P.= 0.097;cpdna:R.= 0.714,P. = 0.065)和横向水文系统当地人口(ISSR:R. = 0.793,P.= 0.209;cpdna:R. = 0.762,P. = 0.226). 这也与历史传播(历史基因流)相一致,但不是最近的基因流。
尽管在以上所有的施用C腔肠,我们知道,DH和NK跨越DH和NK的局部群体的连接可以归因于历史基因流,导致微图谱缺乏空间遗传结构。我们的研究结果还表明,共用单倍型全部出现在0.0158 Myr,全新世和先生之间,这意味着历史基因在当地人口中流动C腔肠可能发生在DH和NK的全新世之前,即在更新世,并且可能归因于这个时代的新推位活动的影响。地质研究[87那88] have shown that, as a result of neotectonic activity in the Pleistocene, the region of the Earth’s crust that included Dinghu Mountain and Nankun Mountain was lifted up intermittently, and that this was accompanied by the formation of steep terrain and deep-cut valleys in mountainous areas, the exposure of the bedrock in the valley floor, and the development of complex hydrological systems.
种子的次生扩散C腔肠沿着河流的纵向方向发生,从而导致下游当地种群遗传多样性的积累?
研究表明,种群间的基因流动与流域以及种群内和种群间的水流方向基本一致,这表明河流和溪流对种子传播很重要[89那90].事实上,河流和溪流栖息地长期被认为是河岸植物的走廊[35那38那91].“单向扩散假说”[36]预测遗传多样性的下游积累因种子和来自上游的升高而导致的遗传多样性导致下游群体引起的等位基因的连续涌入。一些研究表明,植物群沿河流纵向过程和这些人群中的遗传多样性之间的关系之间的关系[32那33那35那92].相比之下,基于CPDNA和ISSR数据的本研究表明,当地群体中的遗传多样性C腔肠在下游位置明显低于上游,无论是在DH的线性溪边当地种群(H:0.091 vs 0.136)或在NK的树突溪边当地人群中(H:0.079 Vs 0.112,0.110)。这意味着下游局部种群不会积累遗传多样性,我们归因于种子和繁殖的缺失,从上游到下游局部种群。This was confirmed by a lack of accumulation of particular cpDNA haplotypes in downstream local populations (e.g. DH: local population-FST; NK: local population-SH), whether in the linear streamside local populations across DH (haplotypes H7, H8) or in the dendritic streamside local populations across NK (h6, h7, h11, h12). In addition, the high degree of differentiation and low level of gene flow (N.m)当地人口C腔肠也表明,在DH和NK地区,种子在河滨当地种群间的传播受到了限制。有限的种子向内扩散C腔肠从仅在0.20-0.92米处检测到的空间遗传结构的显着阳性自相关是显而易见的。我们的田间观察表明,小种子C腔肠它附着在单眼囊中的轴性胎盘上,单眼囊通过上部的一个大椭圆形狭缝打开(图。S1级),可被雨滴驱散[66那67],同属其他物种一样[93那94].然而,山区的流地形是复杂的,其特点是不规则的地形和地理障碍物,防止了一分钟C腔肠种子沿着溪流的水长距离繁殖。因此,这减少了基因流动并增加了植物种群之间的遗传分歧。此外,该植物悬挂在季风森林中溪流附近的岩壁上,这意味着上游种子不太可能在下游局部种群中占用。我们建议,最近,至少,流盆地和水流方向对于种子分散并不重要C腔肠在当地居民;换句话说,这样的流并不充当传播的走廊。然而,DH (H1、H2和H6)和NK (H1、h3和h5)的同源单倍型表明了自交连通性C。coenobialis.学习的两个山区的当地群体可能归因于全新世和先进之间发生的历史基因流量。需要进一步研究来更详细地研究这些假设。
材料和方法
物种、研究地点和取样设计
Caulokaempferia coenobialis.(HANCE)K. Larsen(图。S1级)是一种落叶多年生非克隆草本植物,高达50厘米,在中国南方的广东、广西和云南省特有,生长在潮湿季风森林的岩壁上,通常沿着溪流生长,在溪流上方约1-4米。这种植物在5月到8月开花,通过油性乳状液使花粉滑到柱头上而自交受精[64那65那66].胶囊成熟22天内,爆裂开放或脱离[64那65那66]. 种子小(约1.65) ± 0.06毫米 × 0.59 ± 0.07毫米)和椭圆形卵球形,无假种皮和附属物,有助于风散,经雨淋散开,然后发芽发育成幼苗,在9月至11月植株死亡前长出根茎[64那66那67].
为研究亚热带季风林种群内和种群间的遗传多样性和结构格局,在鼎湖山国家级自然保护区(DH:23°09′21“-23°11′30”N,112°30′39“-112°33′41”E)对两个不同河畔地方种群系统的集合种群进行了研究,海拔1000.3米)和南昆山省级自然保护区(北纬23°35′14“-23°43′05”,东经113°48′41“-113°56′32”,海拔1210米),但相距近160公里(表1,图。2A). DH元种群包括沿着一条常年线性河流的四个河边本地种群(pop。图JLS、TXL、RZPB、FST。2B1),自然相隔300米-2.3公里(平均约583米),几乎不受人类活动的干扰。NK集合种群由九个当地种群组成,它们被分成两个亚群,即西北地区(NK-I)和东南地区(NK-II),沿着南昆山山谷的G355国道(图。2B2),并且受到人类活动的极大干扰。在西北地区的子集由5个沿着树枝状多年生河流(pop。TTD、TYSZ、GYT、XXPB和SH),由农田、村庄、公路和山地森林分隔1.2 ~ 5.9 km(平均约2.1 km)。在东南地区的子集包括四个溪边(流行。YXT, YTH和SLCX)或森林(流行。在复杂的横向水文系统中,平均333 m - 2.2 km(平均约541 m)的山地森林、农田、村庄、道路和度假别墅与当地居民隔离。在每个当地种群中,我们取样20个成年个体(pop除外。FST: 10只个体至少相距0.5 m)分布于每个本地种群的分布区域;每一当地人口约有500至10,000个成年个体(表1).个体之间的直线距离也直接估计在网站坐标的基础上,以测试当地群体内的空间自相关系数(R)。将叶片组织样品储存在硅胶中进行DNA分析。王羌王教授进行了常规鉴定植物材料。HerBarium凭证C腔肠(WYQ-HHDBJ-5和LGH-HHDBJ-81)沉积在华南师范大学(SN)生命科学学院的植物标本中。现场工作许可是从鼎湖山国家自然保护区和南村山省级自然保护区行政管理局获得的。样品收集工作和分子实验符合当地立法,国家和国际指导方针,并没有涉及受保护的物种。我们还遵守“濒危野生动物群和植物群”贸易公约。
DNA提取、叶绿体DNA测序和ISSR片段分析
采用改良的2%CTAB法从0.2~0.5g干叶中提取总基因组DNA[95].提取的DNA的质量和浓度估计在0.8%琼脂糖凝胶和纳米100分光光度计(Allsheng,China)上。
我们筛选了8个非编码质体DNA区域,这些区域基于叶绿体基因组序列显示了大量的多态性Zingiber Spectabile.[96然后选择用于分析的两个最可变的CPDNA区域,包括一个代亚基间隔区(PSBJ-PETA)和一个基因内含子(TRNL内含子)。在含有2.0μl10×PCR缓冲液的总体积为20μl的总体积,1.5mM MgCl2,0.2mM DNTPS,0.25μm正向引物,0.25μm反向引物,0.75单位Taq聚合酶,37.5ng模板DNA和双蒸水。在以下条件下在Bio-rad T100™热循环(Bio-rad,新加坡)上进行聚合酶链反应(PCR):在94℃下初始变性5分钟,然后在94°C下进行39个循环45秒,在底漆特异性退火温度下,在72℃下延伸90s,在72℃下进行10分钟的最终延伸步骤。用ABI 3730XL自动定序器(Applied Biosystems,Foster City,CA)测序PCR产物。
对于ISSR分析,从不列颠哥伦比亚省大学获得的100个ISSR引物中选择了10个多态性引物(807,808,810,835,836,840,815,847,859和887)。在含有2.0μl10×PCR缓冲液的总体积为20μl的总体积,1.5mM MgCl2,0.2mM DNTPS,1.0μm底漆,1.5个单元Taq聚合酶,50ng模板DNA和双蒸水。ISSR PCR病症与CPDNA PCR条件一致。扩增产物在1.8%琼脂糖凝胶中电泳分离,与100bp梯子一起作为尺寸标记,并在UV传输仪(Bio-rad Gel Doc XR +,America)上可视化。所有清除和可重复的扩增片段均被评分为存在(1)或不存在(0)并转换成二元数据矩阵。表中给出了CPDNA和ISSR引物的退火温度2。
数据分析
遗传多样性、遗传分化和基因流动
对于cpDNA数据集,序列数据使用MEGA X [97]在必要时手动调整。将连续的诱导被视为单一突变事件并编码为替换(A或T)[98].单倍型的数量,单倍型多样性(H)、核苷酸多样性(π)和基因流(N.m) 使用DNASP v5.1计算[99].PERMUT中的排列检验用于比较局部种群分化参数与有序等位基因(F装货单)基于1000个随机排列[100.].在MEGA x中计算当地种群间未校正序列差异的两两估计(Dxy, Kimura 2参数模型)。使用1000个bootstrap重复确定标准偏差。
对于ISSR DataSet,Nei的基因多样性(H)[101.],香农指数(一世)[102.]多态位点百分率(PPL),基因分化(G装货单)[103.]使用Progpogene版本1.32估计基因流程[104.]假设在当地人群中完全自行(F是 = 1) 因为C腔肠植物是自我施肥[64那65].在Popgene版本1.32中计算了当地群体中Nei遗传距离的成对估计。
为了量化cpDNA序列和ISSR基因频率在当地人群中的变化,我们在arlequinv3.1中进行了分子方差分析(AMOVA)[105.]和Genalex Ver.6.5 [106.] 使用R.- 和φ.- 分别。使用1,000和999排列测试固定指数的重要性[107.].
遗传结构和聚类分析
对cpDNA数据集构建系统发育树,揭示单倍型之间的关系。利用最大似然(ML)和贝叶斯推理(BI)重建了单倍型的关系。两个人的云南石斛和Kaempferia圆形大厅用作小组。使用MEGA X进行ML分析,使用Akaike信息标准(AIC)作为选择标准测定DNA取代的适当模型(T92 + G + I)。Phylosuite v.1.15中的Modelfinder [108.]被应用于查找F81 + F + 我为基于AIC的BI方法建模。BI分析在mrbayes3.2.6中进行[109.]以下设置:1,000,000耦合马尔可夫链蒙特卡罗(MCMC)代,1,000的样品频率和烧坏参数设定为2,500。然后,由于没有化石记录可用于校准属的基因间隔替换率Caulokaempferia,通过假设这些间隔子的替换率为1.2–1.7,将时钟约束ML树的分支长度转换为绝对时间 × 10–9这是对种子植物非编码叶绿体区域的替代率的粗略估计,可以用来估计同一研究区域内没有化石记录的类群的分化时间(如:汉鬼臼, [110.];罗莎灵魂, [111.]).
对于ISSR数据集,使用结构版本2.2实现贝叶斯群集[112.].对于每k,从k = 1至4对DH比例和k = 1至9进行,对NK比例进行五次独立运行。所有运行都是用掺合器模型进行的,分别燃烧和运行长度为100,000和1,000,000次迭代。遵循[中的指南)确定最佳簇(ΔK)的最佳数量112.]以及Evano等人的建议[113.].单个分配系数(问:),然后用Clumpp软件求出每个基因簇的平均值[114.]纠正运行之间的任何差异。为了进一步测试个人之间的遗传关系,我们使用Program达尔文6.0.9构建了基于Nei的遗传距离的邻居加入(NJ)树[115.[3.10116.]和基于Nei遗传距离的主坐标分析(PCoA)。6.5。
空间遗传结构分析
为了在微地理尺度上检验地理距离和遗传结构之间的关系,在GENALEX版本6.5中对ISSR数据进行了Mantel检验,在arlequinv3.1中对cpDNA数据进行了Mantel检验。利用GenAlEx中的空间自相关分析方法,分析了DH地区TXL群体中个体与其空间位置的遗传相关性。之所以选择偶数样本类,是因为当样本大小非常不均匀时,这对于减少噪声置信限特别有用。计算双尾概率值,并进行999次bootstrap重采样。
结论
使用多晶态ISSR和CPDNA基因座,我们研究了在亚热带季风林中的不同流系统(线性流,树枝状物流和复杂的横向水文系统)的微观图规模对河流结构的遗传结构和连通性的影响草本植物Caulokaempferia coenobialis.在鼎湖山和南昆山之间不利用风播或动物播种子的种群。这些研究有助于更好地了解河流或溪流对河岸植物种群、遗传多样性和结构的影响。我们的结果表明,河流并不是传播的走廊C腔肠尽管自施剂,局部种群的连接可以归因于历史基因流量,导致空间遗传结构缺乏。自我C腔肠可以通过遗传分化维持高遗传多样性,这通过局部适应和中性突变和/或局部群体的遗传漂移在微量页规模中加剧。
可用性数据和材料
本研究中分析的两个塑性数据沉积到NCBI数据库中(https://www.ncbi.nlm.nih.gov/nucleotide/)注册编号:MW849477-MW849520;INTEL简单序列重复(ISSR)数据Caulokaempferia coenobialis.可用作补充资料。
参考文献
- 1。
道森K,Simons AJ,Waugh R,Powell W.群体的多样性和遗传分化GlliciaIs sepium.通过基于PCR的分析显示。遗传。1995;74:10–8.
- 2。
韩玉成,滕哲,瓦希提,周MQ,胡ZL,宋玉成。云南自然种群的交配系统与遗传多样性Nelumbo Nucifera(Nelumbonaceae)由ISSR标记检测到。植物系统中的Evol。2009; 277:13-20。
- 3.
Schaal BA, Hayworth DA, Olsen KM, Rauscher JT, Smith WA。植物系统地理学研究:问题与展望。摩尔生态。1998;7:465 - 74。
- 4.
Govindaraj M,Vetriventhan M,Srinivasan M.作物植物遗传多样性评估的重要性及其最近的进展:其分析观点概述。Genet res int。2015年。https://doi.org/10.1155/2015/431487。
- 5.
关键词:河岸植物,遗传变异,双向基因流,遗传变异miscanthus lutarioriparius,其流行范围:对适应潜力的影响。GCB生物能源。2016;8:764–76.
- 6.
贝克WL。自然保护区设计与管理中大扰动的景观生态学。景观ECOL。1992年; 7:181-94。
- 7.
Barnosky Ad,Hadley EA,Bascompte J,Berlow El,Brown Jh,Fortelius M等。接近地球生物圈的状态转变。自然。2012; 486:52-8。
- 8.
Carvallo GO, Vergara-Meriño B, Díaz A, Villagra CA, Guerrero PC。在极度濒危的生态系统中,裸露的岩石保护了遗传多样性,并促进了受威胁的残树的再生。Biodivers Conserv。2019;28:2805-24。
- 9.
PicóFX,van Groenendael J.欧洲半自然草地大型植物保护:人口遗传观点。潜水员分销。2007; 13:920-6。
- 10。
Mijangos JL,Pacioni C,Spencer PBS,Craig MD.遗传学对生态恢复的贡献。摩尔经济。2015;24:22–37.
- 11.
Lindenmayera DB,Franklinb JF,Fischera J. General管理原则和指导森林生物多样性保护的策略清单。BIOL CAREN。2006; 131:433-45。
- 12.
Hardesty BD、Dick CW、Kremer A、Hubbell S、Bermingham E。植物的空间遗传结构Simarouba Amara.Aubl。(菊科),一种雌雄异株,动物散布的新热带树种,产于巴拿马的巴罗科罗拉多岛。遗传。2005;95:290-7。
- 13。
Zeng X,Michalski SG,Fischer M,Durka W.物种多样性和人口密度影响亚热带林灌中的遗传结构和基因分散。J植物ECOL。2012; 5:270-8。
- 14.
何杰,李XY,高DD,朱P,王志发,王志民,叶华,曹HL。中国小尺度空间成因结构的地形效应Castanopsis chinensis.Hance(Fagaceae)。植物规格BIOL。2013; 28:87-93。
- 15.
Duminil J、Daïnou K、Kaviriri DK、Gillet P、Loo J、Doucet JL、Hardy OJ。非洲雨林用材树种种群密度、小尺度遗传结构、交配系统与花粉传播的关系。遗传。2016;116:295–303.
- 16.
EwédjèEBK、AhanchédéA、Hardy OJ。受威胁食用树种的繁殖系统、基因扩散和小尺度空间遗传结构,pentadesma丁糖(clusiaceae)在贝宁。保守遗传。2017; 18:799-811。
- 17.
Sander Nl,Pérez-Zavala F,Da Silva CJ,Aruda JC,Pulido Mt,Barelli Maa,等。河流塑造人口遗传结构毛里塔尼亚flexuosa(槟榔科)。Ecol Evol公司。2018;8:6589–98.
- 18.
Murray BF、Reid MA、Capon SJ、Thoms M、Wu SB。植物的基因流与遗传结构狭叶相思(Fabaceae):水文连接的影响。j生物纪元。2019; 46:1138-51。
- 19.
Nagamitsu T,Shuri K,Kikuchi S,Koike S,Naoe S,Masaki T. Multiscale空间遗传结构,核基因型野生樱桃树和叶绿体单倍型的野生樱桃树的群体。ECOL EVOL。2019; 9:11266-76。
- 20。
Ony MA,Nowicki M,Boggess SL,Klingeman WE,Zobel JM,Trigiano RN,Hadziabdic D。生境破碎化对遗传多样性和分化的影响cercis canadensis.(东方紫荆属植物)。生态另一个星球。2020;10:3655 - 70。
- 21。
关键词:兰科植物,遗传结构,种子传播,花粉传播Spiralles spiralis.新植醇。2003;157:677 - 87。
- 22
Kitamoto N,Honjo M,Ueno S,Takeaka A,Tsumura Y,Washitani I,Ohsawa R.空间遗传结构中的空间遗传结构Primula Sieboldii.在单独的流旁边生长。Mol Ecol。2005; 14:149-57。
- 23
黄烨,张cq,李迪兹。低遗传多样性和危及危及的高遗传分化Omphalogramma souliei(Primulaceae):对其保护的影响。J Syst Evol。2009; 47:103-9。
- 24
Brzosko E, Ostrowiecka B, Kotowicz J, Bolesta M, Gromotowicz A, Gromotowicz M, et al.;在Biebrza国家公园(波兰东北部)六种陆生兰花的种子传播。Soc Bot Pol. 2017;86:3557。
- 25
Chung MY, Nason JD, López-Pujol J, Chung JM, Kim KJ, Maki M, Chung MG。春季短命草本植物种群的精细遗传结构白花蛇舌草(毛茛科)。弗洛拉。2018;240:16–24.
- 26
傅Q,卢GH,傅耶,王YQ。两种品种之间的遗传分化本特哈米奥利奥恰里斯(Gesneriaceae)在SympaTric和Allopatric地区。ECOL EVOL。2020; 10:7792-805。
- 27
Schleuning M,Becker T,Vadillo GP,Hahn T,Matthies D,Durka W.河流动力学形状克隆多样性和亚马逊人民币草本植物的遗传结构。j eco。2011; 99:373-82。
- 28
关键词:野生稻,遗传多样性,遗传多样性引用本文宽叶茭白在中国中部透露微卫星。Ann Appl Biol。2012; 161:192-201。
- 29
Jansson R,Zinko U,Merritt DM,Nilsson C. Hydrochory增加了河岸植物物种丰富性:自由流动和受监管河之间的比较。J ECOL。2005; 93:1094-103。
- 30
陈建平,李建平。湿地植物群落结构的研究进展。生态学报,2006,26(3):457 - 464。启杂志2010;85:837-58。
- 31
Akimoto M,Shimamoto Y,Morishima H.野生稻的人口遗传结构oryza glumaepatula分布在亚马逊洪水面积,受其生命历史特质的影响。Mol Ecol。1998年; 7:1371-81。
- 32
关键词:北方河流,植物,遗传多样性,繁殖扩散策略Hereditas。2001;135:75 - 83。
- 33。
伊姆伯特E,莱弗尔F。植物的扩散与基因流杨树黑质沿着动态河流系统。J ECOL。2003; 91:447-56。
- 34。
Kudoh H, Shimamura R, Takayama K, Whigham DF。木槿属草本植物的结果。植物规格生物学。2006;21:127-33。
- 35。
弗雷特,赫鲁多瓦兹。探测水的扩散Nuphar Lutea.在河流走廊使用微卫星标记。淡水biol。2008; 53:1409-22。
- 36。
里特兰K。山猴头花的遗传分化、多样性和近交(海狸)华盛顿瀑布。可以j bot。1989; 67:2017-24。
- 37。
Russell Jr,Weber Jc,展位A,Powell W,Sotelo-Montes C,Dawson Ik。遗传变异Calycophyllum spruceanum在秘鲁亚马逊盆地,通过扩增片段长度多态性(AFLP)分析揭示。摩尔生态。1999;8:199 - 204。
- 38.
Tero N,Aspi J,Siikamäki P,Jäkäläniemi A,Tuomi J。濒危植物集合种群的遗传结构和基因流鞑靼锡林Mol Ecol。2003; 12:2073-85。
- 39.
Markwith Sh,Scanlon MJ。多尺度分析冠膜壳虫(Amaryllidaceae)遗传多样性,遗传结构和单向流流量影响下的基因运动。我是J机器人。2007; 94:151-60。
- 40
魏XZ,孟HJ,宝直流,江MX。山地河岸树种的基因流动和遗传结构,Eutelea pleiospermum.(Eupteleaceae):流树状网络有多重要?树基因组。2015;11:64.
- 41
关键词:野生稻,景观尺度,遗传结构,河川,山脉,破碎化,遗传结构生态前沿,2017;5:17。
- 42。
Tsuda Y,Sawada H,Ohsawa T,Nakao K,Nishikawa H,IDE Y.景观遗传结构白桦日本中部的奇琴山脉。树遗传学基因组织。2010; 6:377-87。
- 43。
大坝和峡谷破坏了濒危河岸植物种群间的基因流动。淡水杂志。2014;59:2502-15。
- 44。
威廉姆斯CF,Ruvinsky J,Scott Pe,Hews DK。两个合并症中的授粉,育种系统和遗传结构德尔芬(毛茛科)物种。我是J机器人。2001; 88:1623-33。
- 45。
碎化生境中的繁殖成功:相容性系统和授粉特化重要吗?蔬菜科学,2002,13:885 - 92。
- 46
查尔斯沃思D。近交对群体遗传多样性的影响。Philos T R Soc B:生物科学。2003;358:1051–70.
- 47
Ennos RA。估计植物种群间花粉和种子的相对迁移率。遗传。1994;72:250-9。
- 48
Latta Rg,Linhart Yb,Fleck D,Elliit M.种子与花粉运动中的直接和间接估计在Ponderosa松树中。进化。1998年; 52:61-7。
- 49
Oddou Muratorio S、Klein EK、Osterlitz F。野树里的花粉流,花楸(L.)Crantz。II。在母体后代分析中推断出Pollen分散和异质性。Mol Ecol。2005; 14:4441-52。
- 50。
Jacquemyn H,Vandepitte K,Brys R,Honnay O,Roldán-Ruiz I.健身变异和遗传多样性的小,残留种群的食物欺骗性兰花紫罗兰生物保护。2007;139:203–10.
- 51。
Ohhayashi K,Hodoki Y,Kondo Ni,Kunii H,Shimada M.促进了近威胁植物物种的基因流动和增加的遗传多样性。SCI Rep-UK。2017; 7:10933。
- 52。
Hamrick JL,Godt MJW。生命史状特性对植物物种遗传多样性的影响。philos t r soc b:biol sci。1996年; 351:1291-8。
- 53
NYBOM H.不同核DNA标志物的比较估算植物内侵入性遗传多样性。Mol Ecol。2004; 13:1143-55。
- 54
瑞萨C,伯恩哈特-RömermannM。研究设计和寿命的影响对AFLPS测定的植物遗传变异的影响。植物ECOL。2014; 215:1493-511。
- 55
黄锐,褚庆华,陆光辉,王永强。两种近缘自交和异交群体遗传结构的比较研究Zingiber海南岛种。Sci代表英国。2019;9:17997.
- 56
黄岚,张泽,王烨,王yq。在两个密切相关的自行性和突出的过程中遗传变异和遗传结构Zingiber物种(姜科)。国内植物。2021; 13:1-15。
- 57。
Shimamura R,Kachi N,Kudoh H,Whigham DF。水质作为种子内遗传分布的决定因素木槿moscheutos(锦葵科)种群。我是J Bot。2007;94:1137–45.
- 58。
Hart KH,Cox PA.《生物的扩散生态学》Nuphar Luteum.(L.)Sibthorp&Smith:非生物种子分散机制。Biol J Linn Soc。1995; 119:87-100。
- 59。
Peakall R,Beattie AJ。蚂蚁分散种子吗?sclerolaena diacantha.(藜科)产生局部空间遗传结构?遗传。1995;75:351 - 61。
- 60
alvarez-buylla er,chaos a,piñerod,garay aa。先锋热带树种的人口遗传学:补丁动力学,种子分散和种子库。进化。1996年; 50:1155-66。
- 61
Kalisz S,Hanzawa FM,Tonsor SJ,Thiede A,Voigt S.蚂蚁介导的分散改变了Trillium Grandflorum群体中的相关性模式。生态。1999; 80:2620-34。
- 62
Kudoh,Whigham DF。小麦微地理遗传结构与基因流木槿moscheutos(锦葵科)种群。我是J Bot。1997;84:1285–93.
- 63
吴道林,陈淑珍。中国植物志,第16卷。北京:科学出版社;1981.
- 64
王一琦、张德祥、伦纳SS、陈志。一种新的自花授粉机制。自然。2004;431:39–40.
- 65
王毅,张德克,雷纳斯,陈泽。通过滑动花粉进行自粉Caulokaempferia coenobialis.(Zingiberaceae)。int j植物sci。2005; 166:753-9。
- 66。
王玉克。Zingiberaceae授粉生物学研究。博士论文。广州:中国科学院华南植物园;2005年。
- 67。
“大酒店”。生殖生态学的研究Caulokaempferia coenobialis.。学位论文。广州:华南师范大学;2008年。
- 68。
Sweigart AL, Willis JH。核苷酸多样性的模式在两种模拟受交配系统和不对称血液的影响。进化。2003; 57:2490-506。
- 69。
Glémins,Bazin E,Charlesworth D.交配系统对开花植物序列多态性模式的影响。P ROY SOC B:BIOL SCI。2006; 273:3011-9。
- 70。
圣东日KR,Källman T,Slotte T,Lascoux M,PalméAE。中国人口历史与人口结构的比较Capsella风疹和Capsella Grandiflora两个有着不同交配系统的近缘种。摩尔经济。2011;20:3306–20.
- 71。
惠特洛克MC,巴顿NH。细分群体的有效规模。遗传学。1997;146:427–41.
- 72。
Pannell JR,Charlesworth B. Metapopulation过程对遗传多样性措施的影响。philos t r soc b:biol sci。2000; 355:1851-64。
- 73。
斯拉金M。基因流与自然种群的地理结构。科学。1987;236:787–92.
- 74。
哈迪森DW,Templeton al。成对遗传和地理距离措施的相关性:推断基因流动的相对影响及漂移对遗传变异分布的影响。进化。1999年; 53:1898-914。
- 75。
真正的洛杉矶。生态遗传学。普林斯顿:普林斯顿大学出版社;1994年。
- 76。
NEVO ER,NOY R,LAVIE B,Beiles A,Mepttar S.遗传多样性和抵抗海洋污染。Bot J Linn Soc。1986; 29:139-44。
- 77
Vekemans x,Hardy OJ。植物种群微量空间遗传结构分析的新见解。Mol Ecol。2004; 13:921-35。
- 78
Duminil J,Hardy Oj,Petit RJ。植物特征与生成时间相关,直接影响近溴的抑郁和配合系统和间接遗传结构。BMC EVOL BIOL。2009; 9:177-90。
- 79
Bartkowska MP, Wong AYC, Sagar SP, Zeng L, Eckert CG。尽管高自花受精,但缺乏表型和遗传变异的空间结构Aquilegia canadensis.(毛茛科)。遗传。2018;121:605-15。
- 80。
关键词:河岸带,遗传多样性,空间尺度,空间格局Ainsliaea faurieana.(菊科)在屋久岛。日本Am J Bot。2010;97:101-10。
- 81。
杨永强,王永红,王永红,等。植物生境破碎化的种群遗传后果。植物学报,2006,40(1):1 - 5。趋势生态演变。1996;11:413-8。
- 82。
Rocha OJ, Aguilar G. dry forest tree生殖生物学肠胆酸辣酱牛皮脂(Guanacaste)在Costa Rica中:树木留在连续森林中牧场和树木之间的比较。我是J机器人。2001; 88:1607-14。
- 83
花粉和种子在分散植物中的传播。启杂志2005;80:413-43。
- 84
凯特尔CJ、霍林斯沃思PM、贾夫雷特、莫兰B、埃诺斯RA。确定高度受威胁热带针叶树栖息地退化的早期遗传后果araucaria nemorosaLaubenfels。Mol Ecol。2007; 16:3581-91。
- 85
手指A,水壶CJ,Kaiser-Bunbury CN,Valentin T,Doudee D,Matatiken D,Ghazoul J.从边缘回来:遗传救人在一个危险的树中的潜力。Mol Ecol。2011; 20:3773-84。
- 86
Toczydlowski Rh,Waller DM。漂移发生:珠宝种群的分子遗传多样性和分化(凤仙花反映了漫滩森林的破碎化。摩尔经济。2019;28:2459–75.
- 87
广东省地质与矿产资源局。广东省的地质地质。北京:地质出版社;1988.中文。
- 88
李先生。南昆山国家级保护生物水文地质特征。杰恩·吉尔。2007;15:465-70[中文]。
- 89
Kudoh H,Whigham DF。水文分散种子的遗传分析木槿moscheutos(Malvaceae)。我是J机器人。2001; 88:588-93。
- 90。
刘永福、王永元、黄华。中国高群体间遗传分化与单向线性迁移疏花水柏枝(柽柳科),长江三峡流域特有的河岸植物。我是J Bot。2006;93:206–15.
- 91。
魏学珍,蒋明霞。河滨树种的景观遗传结构Eutelea pleiospermum.(真蕨科):河谷和山脊的对比作用。公共科学图书馆一号。2013;8:e66928。
- 92。
Gornall RJ,Hollingsworth PM,Preston CD。水生植物种群空间结构和基因定向流动的证据Potamogeton coloratus.遗传。1998;80:414-21。
- 93。
拉森K,卡什,锯LG。产于马来西亚半岛和新加坡。婆罗洲:自然历史出版社;1999
- 94。
Larsen K,Saksuwan LS。泰国的刺刀。泰国:女王朱利克特植物园和植物园组织;2006年。
- 95。
Doyle JJ,Doyle JL。少量新鲜叶组织的快速DNA隔离程序。Phytochem Buart。1978; 19:11-5。
- 96。
Barretta CF,Davisa Ji,Leebens-Mackb J,Conranc JG,Stevensond DW。血肿单子宫植物植物血浆基因组和深层关系。克莱斯。2013; 29:65-87。
- 97。
Kumar S,SteCher G,Li M,Knyaz C,Tamura K. Mega X:计算平台的分子进化遗传分析。mol Biol Evol。2018; 35:1547-9。
- 98。
SIMMONS MP,Ochoterena H.差距在基于序列的系统发育分析中。系统中的生物学。2000; 49:369-81。
- 99。
Librado P,Rozas J。DnaSP-v5:DNA多态性数据综合分析软件。生物信息学。2009;25:1451–2.
- 100。
PONS O,PETIT RJ。测量和测试遗传分化与有序与无序等位基因。遗传学。1996年; 144:1237-45。
- 101。
Nei M.群体之间的遗传距离。我是nat。1972; 106:283-92。
- 102。
香农CE,韦弗W.沟通的数学理论。Urbana:伊利诺伊大学出版社;1949年。
- 103
Nei M.分子演化遗传学。纽约:哥伦比亚大学出版社;1987年。
- 104
Yeh FC、Yang RC、Boyle TBJ、Ye ZH、Mao JX。POPGENE,用于群体遗传分析的用户友好共享软件。阿尔伯塔:艾伯塔大学分子生物学与生物技术中心;1997
- 105
Excoffier L, Laval G, Schneider S. Arlequin ver。3.1:群体遗传学数据分析的集成软件包。伯尔尼:伯尔尼大学动物研究所计算和分子群体遗传学实验室;2006年。
- 106
Speall R,Smouse Pe。Genalex 6.5:Excel中的遗传分析。教学与研究人口遗传软件 - 更新。生物信息学。2012; 28:2537-9。
- 107
Excoffier L,Smouse Pe,Quattro JM。DNA单倍型中度量距离分子方差分析:对人体线粒体DNA限制数据的应用。遗传学。1992年; 131:479-91。
- 108
张D,Gao Fl,Li Wx,Jakovlići,Zou H,张j,王gt。文学:一种集成和可伸缩的桌面平台,用于简化的分子序列数据管理和进化系统研究。Mol Ecol Resour。2018; 20:348-55。
- 109
Ronquist F,Teslenko M,Van der Mark P,Ayres DL,Darling A,Höhna,Larget B,Liu L,Ma,Huelsenbeck JP。MRBAYES 3.2:高效的贝叶斯系统发育推理和跨大型模型空间的模型选择。系统中的生物学。2012; 61:539-42。
- 110。
李义,翟sn,邱yx,guo yp,ge xj,来自惠普。喜马拉雅 - 横断群山地区的“湄公河沙特队鸿沟西部冰川生存与西部透露,AFLP和CPDNA序列变异汉鬼臼(Berberidaceae)。mol phylocyet evol。2011; 59:412-24。
- 111。
Jian H、Tang K、Sun H。植物系统地理学罗莎灵魂横断山区蔷薇科:第四纪气候振荡中的避难所和熔炉。植物系统进化。2015;301:1819–30.
- 112。
Pritchard JK,斯蒂芬斯M,Donnelly P.使用多点基因型数据的群体结构推理。遗传学。2000; 155:945-59。
- 113。
埃万诺·G,雷格诺特·S,古德·J。利用软件结构检测个体聚类数:一项模拟研究。摩尔经济。2005;14:2611–20.
- 114。
雅各布森M,罗森博格NA。CLUMPP:一个聚类匹配和置换程序,用于处理群体结构分析中的标签切换和多模态问题。生物信息学。2007;23:1801–6.
- 115。
Perrier X,Jacquemoud Collet JP。达尔文软件;2006http://darwin.cirad.fr/darwin.
- 116。
Rohlf FJ。NTSYS-pc, 2.10版本。纽约:Exeter Software, Setauket;2000.
致谢
感谢鼎湖山国家级自然保护区管理局和南昆山省级自然保护区管理局允许我们采集植物样品。我们非常感谢两位匿名审稿人对改进手稿的出色建议。
资金
这项工作由中国和广东省政府国家自然科学基金(No.U1301213)和中国国家自然科学基金(30570116)和中国天然科学基金的重点项目提供资金,以及中国广东省自然科学基金的重点项目(7117864)。这些融资机构在研究和收集,分析和解释的设计中没有作用,以及编写手稿。
作者信息
隶属关系
贡献
Y.-Q。设计研究,收集现场样本,分析所有数据并撰写稿件;傅问参与了部分cpDNA和ISSR分子实验,分析了全部数据并撰写了论文;J. Deng进行了cpDNA分子实验,M. Chen进行了ISSR分子实验,Y. Zhong进行了图。7.和相关的分子实验和G.-h。Lu调查和收集的现场样品。所有作者阅读并认可的终稿。
通讯作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
作者们宣称他们没有相互竞争的利益。
附加信息
出版说明
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充资料
附加文件1:
图S1。Caulokaempferia coenobialis.。- 答:植物,花和栖息地;B:通过大椭圆形狭缝粘附在一个单目胶囊中的轴向仰卧的种子;C:被雨飞溅分散的种子。图。S2级. 集合种群DH(A)和NK(B)的遗传聚类(K)与Delta K的线形图。图。S3级. 基于Nei遗传同一性的个体UPGMA树状图Caulokaempferia coenobialis.在元群体中DH (A)和NK (B)。表S1。INTEL简单序列重复(ISSR)数据Caulokaempferia coenobialis.。
权利和权限
开放访问本文是根据知识共享署名4.0国际许可证授权的,该许可证允许以任何媒体或格式使用、共享、改编、分发和复制,只要您给予原作者和来源适当的信任,提供到知识共享许可证的链接,并指出是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可证中,除非在材料的信用额度中另有说明。如果材料未包含在文章的知识共享许可证中,并且您的预期用途不受法律法规的允许或超出允许的用途,您将需要直接获得版权持有人的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用本文
傅,Q.,邓,J.,陈,M。等。河岸自交草本植物的群体、遗传结构和连通性Caulokaempferia coenobialis.在亚热带季风森林中的微尺度地理层。BMC植物杂志21,329(2021)。https://doi.org/10.1186/s12870-021-03101-7
收到:
公认:
发表:
关键词
- 遗传变异
- 交配系统
- 精细尺度的空间遗传结构
- 基因流
- 传播种子