摘要
背景
乙醇酸氧化酶(GLO)不仅是光缺失的关键酶,而且是H的主要发动机2O.2植物生产。过氧化度(猫) - 依赖性2O.2据报道,分解过程与IAA生物合成的调控有关。然而,目前尚不清楚是哪种机制导致了H2O.2生产在IAA法规中。
结果
在这项研究中,我们发现了格洛米的突变体,如h2O.2IAA内容的水平显着增加,而高CO2废除了h的差异2O.2和IAA之间的内容格洛进一步的分析表明,色氨酸(Trp,在Trp依赖的生物合成途径中IAA生物合成的前体)也由于色氨酸合成酶β(TSB)活性的增加而累积。此外,参与Trp依赖的IAA生物合成和IBA到IAA转化的基因表达也相应上调,这进一步暗示这两种途径都参与了IAA生物合成,这是由GLO依赖的H2O.2。
结论
我们调查了Glo在IAA信号传导中的功能与转录,酶活性与代谢水平的不同水平。结果表明Glo依赖H2O.2基本上通过光抑制,传导信号赋予水稻植物中IAA生物合成的调节。
背景
在植物中光合作用后的光致原味是第二最高的代谢通量。它从氢氧化物-1,5-双磷酸羧酶/氧化酶(Rubisco)的氧合酶活性催化的2-磷酸糖酸酯(2-PG)的合成开始。将2-pg立即转化为叶绿体中的乙酸酯,并通过乙醇酸/乙酰甲酸乙酸酯/甘氨酸代谢步骤将乙酸盐滴血至甘氨酸中[1]。乙醇酸氧化酶(Glo,EC 1.1.3.15)是在光呼吸期间乙醇酸 - 乙醛酸酯转化率的关键酶,其催化乙酸盐氧化以产生乙酰氧化酯和H.2O.2[2]。据估计,光致炮h2O.2由Glo制作可能会占总H的约70%2O.2在C3植物中,对细胞氧化还原状态进行了重要贡献,并参与多个H.2O.2-相关流程[2]。据报道,Glo活动在干旱胁迫下在豌豆,豇豆和烟草中升级[3.那4.那5.]。更重要的是,Glo-errived h2O.2可以介导非健康抵抗和基因介导的抗性拟南芥蒂利亚纳和尼古利亚娜·宾夕法尼亚州[6.]那它也参与了大麦条纹马赛克病毒大麦的侵染及其对小麦的基础防御丁香假单胞菌在番茄中[7.那8.]。此外,通过Glo-ermived h介导的系统获得的植物表面上的Sysic获得的适应和形成铁斑块的启动2O.2[9.那10]。
H2O.2作为一种典型的活性氧物质,不仅是生物学毒性,而且还用作重要的信号分子。它的稳态由细胞生成和清除率之间的平衡来精心调节[11]。光致炮H.2O.2主要由过氧化物酶体过氧化氢酶(CAT,ec1.11.1.6)清除,GLO和CAT通常协同调节细胞内的光呼吸H2O.2植物体内的水平[11]. 据观察,猫依赖性H2O.2与其他植物激素信号通路交叉谈话。例如,ABA调节过氧血清猫的表达,从而调节H的水平2O.2在水中的拟南芥[12]。串扰的另一个潜在点是猫依赖的h之间2O.2和IAA信号通路,最近有很大的关注。高等人。[13发现不存在光呼吸主义CAT2导致光致炮H的积累2O.2. 此外,H2O.2抑制IAA合成拟南芥. 反过来,外源生长素激活IAA信号,抵消光呼吸H2O.2- 依赖细胞死亡拟南芥cat2突变体[14]。袁等。[15[进一步证明了积累的h2O.2在拟南芥CAT2抑制促进色氨酸合成酶β(TSB)亚基1的磺酸修饰,从而降低TSB活性,抑制IAA前体Trp的合成。而猫依赖H2O.2与IAA信号通路交织在一起的分解,该过程的分子细节仍然稀缺,更值得注意,目前尚不清楚glo是否依赖于h2O.2生产在IAA法规中发挥着重要作用。
作为H的重要发动机2O.2生产,Glo具有各种同种型,由植物中的多基因家族编码。Atgox1.和Atgox2.是涉及基本光呼吸代谢的主要同种型拟南芥蒂利亚纳[6.]. 我们早些时候已经证明了这一点osglo1.和osglo4.是水稻光呼吸的主要亚型[16那17]。在这项研究中,为了了解是否以及如何依赖H2O.2调节IAA信号,各种遗传修饰的稻米GLO1和GLO4.生成。发现IAA水平GLO1和GLO4敲除突变体显著上调,这与过氧化物酶体H的降低有关2O.2水平。进一步分析表明,IAA和TRP含量增加,并且CSB活性和与TRP依赖性IAA生物合成和IBA相关的基因也调节。结果表明Glo依赖H2O.2生产可以调节水稻中的IAA生物合成。
结果
水稻GLO突变体表现出光呼吸表型,并伴有过氧化物酶体H的降低2O.2
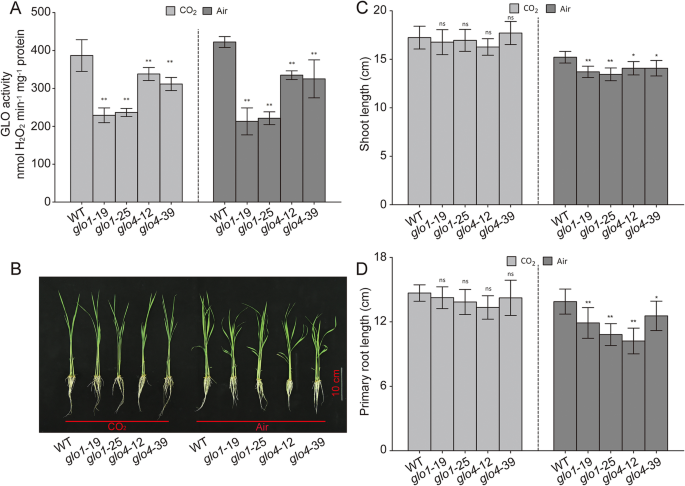
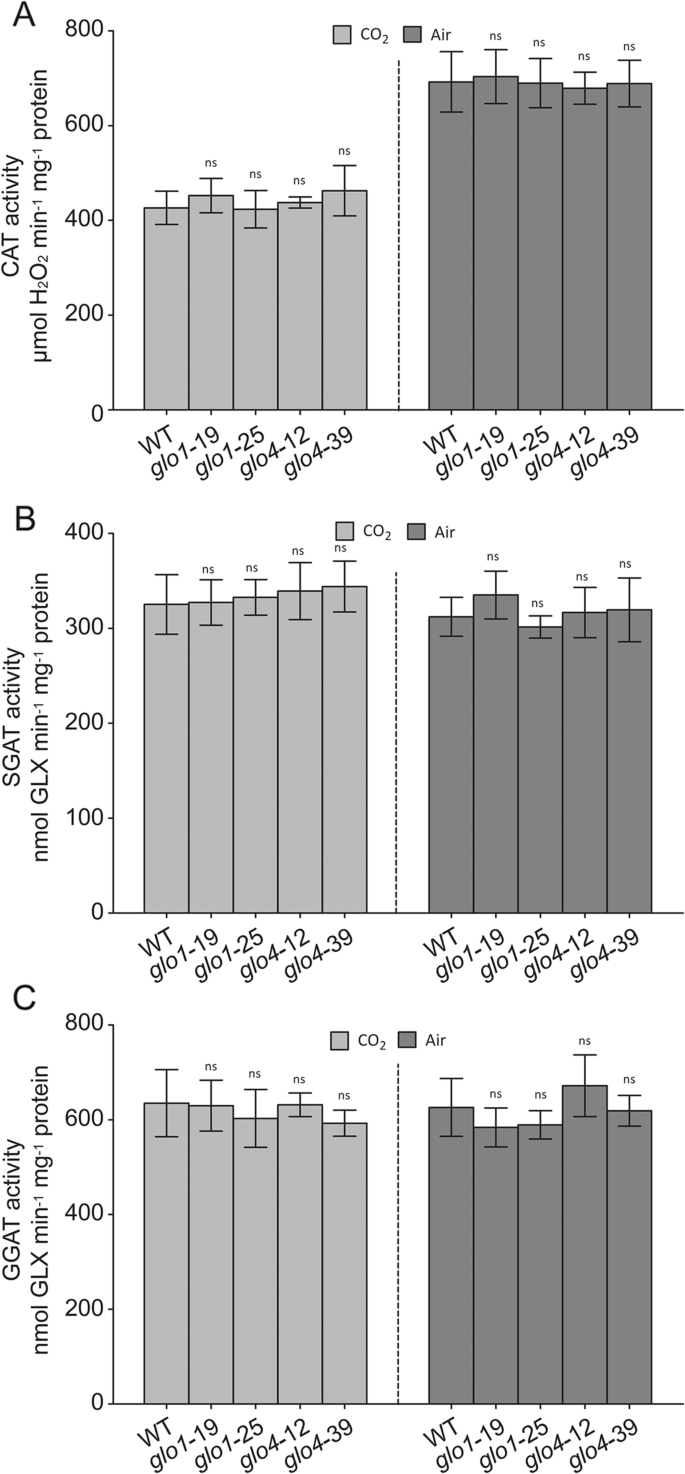
水稻基因组包含四个基因格洛同系物,即。,GLO1(OS03G0786100),GLO3.(OS04G0623500),GLO4.(OS07G0152900),和GLO5.(OS07G0616500)。GLO1和GLO4.是主要的格洛有助于光呼吸乙醇酸-乙醛酸代谢的基因[16那17]。在本研究中,淘汰和过度表达线GLO1和GLO4.在米饭中产生。Western印迹分析证实了GLO1和GLO4不存在GLO1和GLO4敲除突变体(附加文件1a,b)。Glo活动减少了约55%和30%GLO1和GLO4分别突变体。在格洛过度表达(格洛OE)行,GLO活动增加了60–95%GLO1OE线和40-55%GLO4.OE线(图。1文件和附加文件2一种)。两个幼苗GLO1和GLO4敲除突变体显示侏儒生长与WT相比,但在高CO下抑制光抑制时恢复到正常状态2条件(图。1B,C和D)。在我们以前的研究中,已经描述了这些过度表达系的生长表型。简而言之,增长格洛当Glo活性增加60-100%时,OE线条得到改善,而当Glo活性增加超过150%时,注意到增长降低[18]. 此外,在环境和高CO胁迫下,GLO的下游酶SGAT和GGAT在所有GLO修饰系中几乎没有变化2条件(图。2和附加文件2)。在高CO下,猫活动受到30%至40%的抑制2,但在环境和高CO下的各种GLO改性线路之间的猫活动没有区别2条件(图。2文件和附加文件2b)。这与先前的研究一致,表明光素下游步骤的影子下游步骤不会受到显着影响Glo修改的影响[19那20那21]。
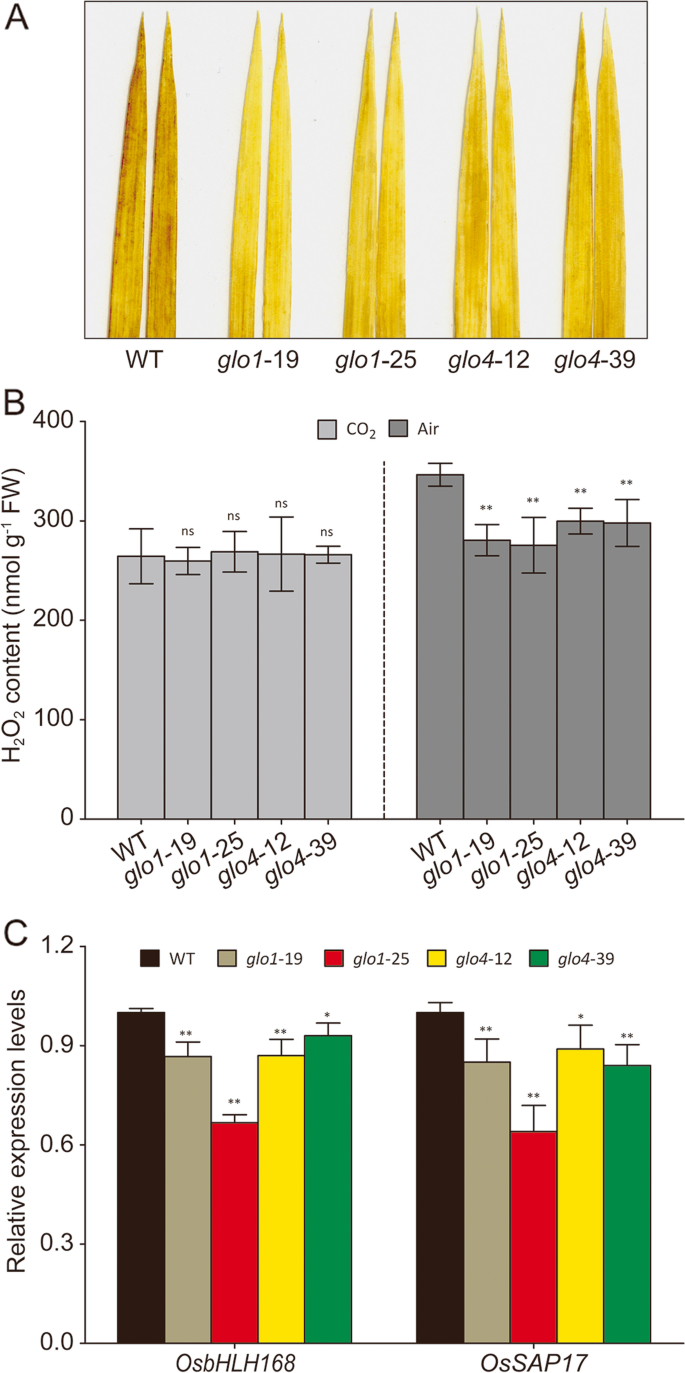
作为h的最快途径2O.2生产,光归机h2O.2主要由Glo催化的乙醇酸氧化反应产生[1那2]。的缺席GLO1和GLO4.可以显着减少h2O.2大气条件下稻壳水平(图。3.a,b),这种差异在高co下消失了2(图。3.b)。没有观察到重大变化GLO1和GLO4.大气和高CO下的过度表达线2条件(附加文件3.A、 (B)。进一步证明H2O.2水平出现在过氧化物酶体中,我们量化了两个先前确定的过氧化物酶体特异性H2O.2- 响应基因,OsbHLH168型(OS01G0108600)和奥萨普17(OS09G0385700)[22那23],通过qrt-pcr。如图1所示。3.C、 两者的转录水平OsbHLH168型和奥萨普17显着降低了GLO1和GLO4大气条件下的突变体。为了格洛过度表达线,这两个基因的表达水平没有显着差异(附加文件3.C)。这些结果表明H降低2O.2由于Glo活动减少了,过氧化血症中发生了水平GLO1和GLO4突变体。
GLO依赖的H2O.2生产规定的IAA和TRP水平
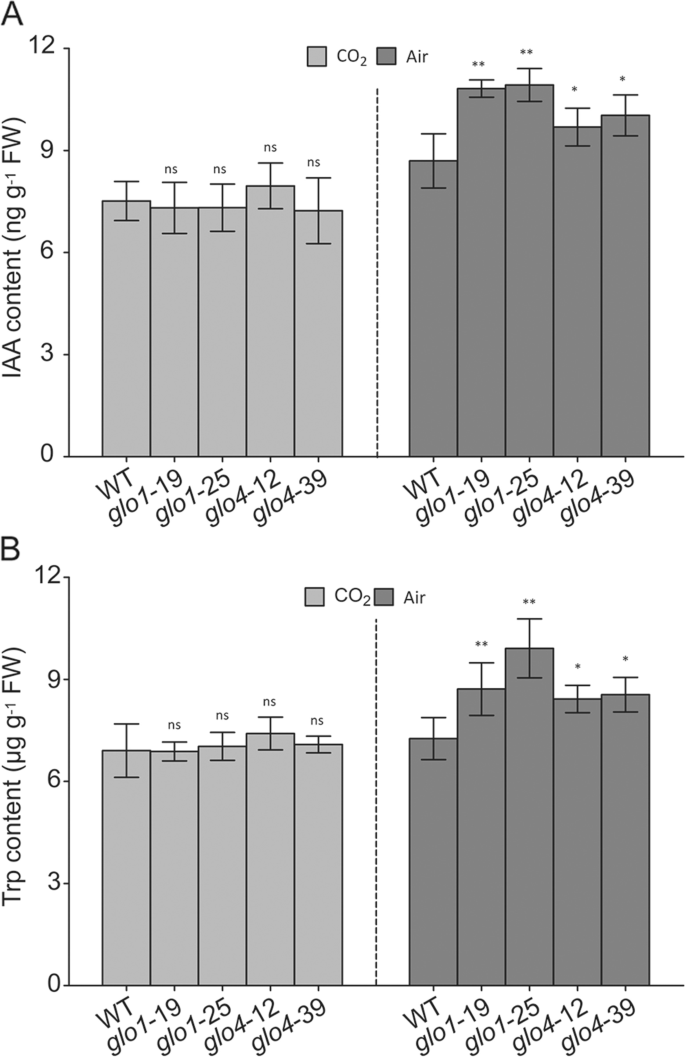
以前报道了猫依赖的h2O.2积累可以抑制体内IAA的合成拟南芥[13那15]. 因为CAT和GLO可以协同工作[11],进一步了解Glo是否参与其中感兴趣2O.2-IAA相声。作为过氧化物酶体H2O.2水平降低(图。3.),IAA含量增加25-30%和15-20%GLO1和GLO4敲除突变体(图。4.一种)。在过度表达行中观察到IAA的明显变化(附加文件4.A) ,其中H2O.2级别未更改(其他文件)3.). Trp是植物IAA生物合成的主要前体[24那25],所以我们进一步确定了TRP内容是否受到各种影响格洛转基因稻米。如图1所示。4.B、 Trp含量约为6.5µg-1以重量计的FW,增加至8.5–10.0µg-1fw in.GLO1敲除突变体和8.0–8.5µg-1fw in.GLO4敲除突变体。在过度表达行中未检测到明显的变化(附加文件4.b)。此外,TRP内容与IAA类似的趋势改变。当Glo依赖H时2O.2高浓度CO抑制了生产2条件,IAA和TRP内容的差异GLO1和GLO4敲除突变体消失了(图。4.A、 (B)。上述结果表明,光呼吸H2O.2由于GLO活性的降低与水稻中的IAA和TRP含量增加相关。
IAA的调节发生在生物合成水平
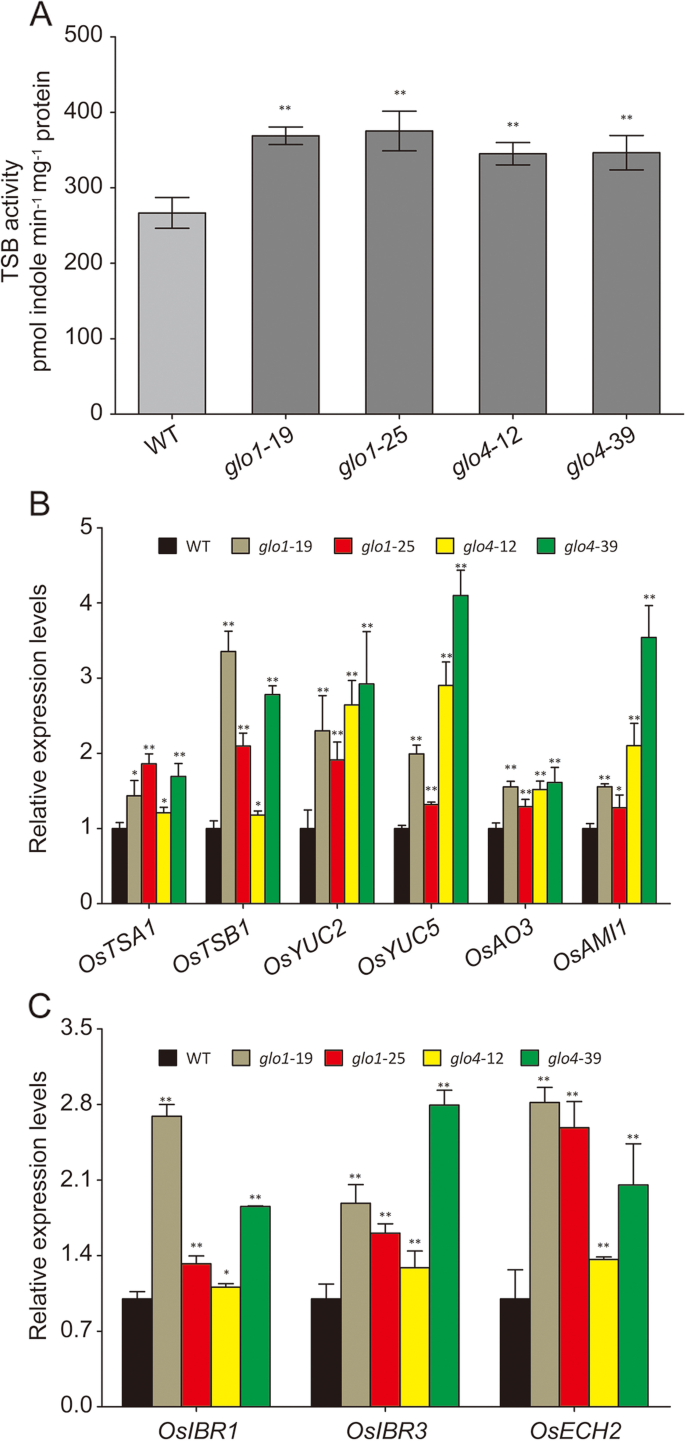
理论上,IAA含量可以在生物合成和封存的水平下调节[26]。已知TRP依赖性途径支配IAA生物合成,因此我们首先检测到负责IAA前体TRP的生物合成的TSB活动。如图1所示。5.A,TSB活动增加了40%和27%GLO1和GLO4分别是突变体。未观察到任何变化格洛过度表达行(附加文件5.). 相应地,色氨酸合成酶的两个亚单位(β亚单位1,TSB1型; α亚单位1,TSA1型)也显着增强格洛突变体(图。5.b)。此外,其他一些涉及TRP依赖的IAA生物合成的下游基因(附加文件6.), IE。osyuc2.(Os01g0732700),osyuc5.(OS07G0437000),osao3.(OS03G0790700),和osami1.(Os04g0118100),仍处于上调状态格洛突变体(图。5.b)。
IBA对过氧化物酶体发生的IAA发生的转化,这可以由过氧化合物的氧化还原状态紧密调节[27那28]. 因此,这些被认为与IBA转化为IAA有关的基因的表达水平被确定(附加文件)6.), IE。OSIBR3.(Os07g0675133),奥塞赫2(Os09g0544900),以及OSIB1.(OS09G0133200)。这些数据表明,所有这些基因都被上调格洛突变体(图。5.C)。
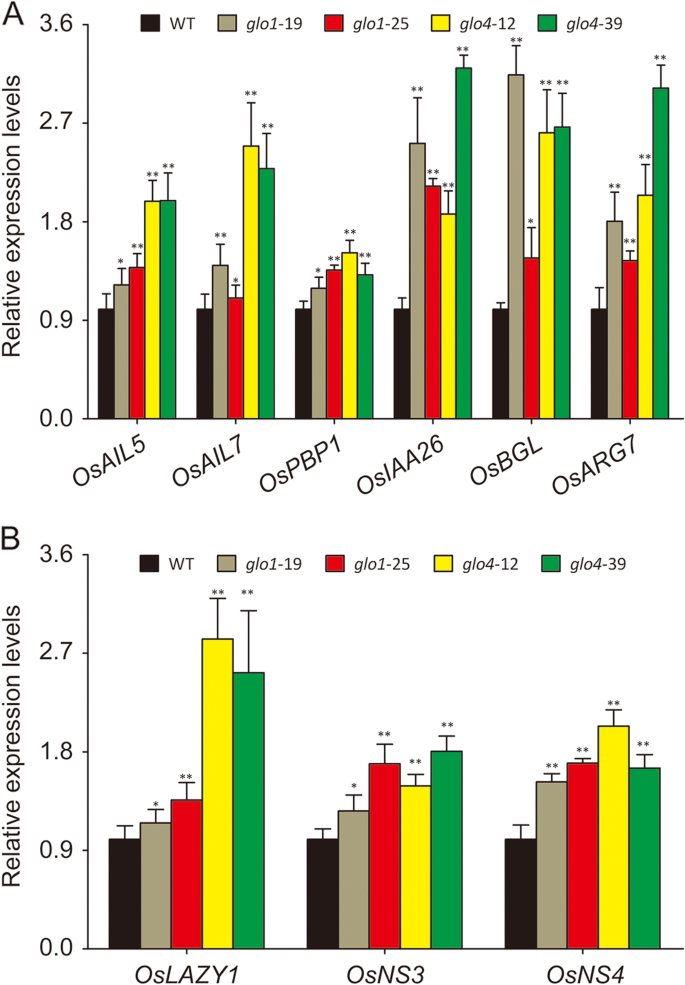
最后,分析了已知以IAA依赖方式调节的各种IAA应答/转运基因的表达水平(附加文件)7.). 正如所料,参与IAA反应和转运过程的基因。osai5.(OS04G0653600),奥泰7.(OS03G0313100),OsPBP1型(OS01G0783700),osiaa26.(OS09G0527700),和oslazy1.(OS11G0490600),OsNS3公司(Os10g0147400),OsNS4公司(OS11G0169200)在中调节上调格洛突变体(图。6.A,B),这些基因可以进一步在多种植物生长过程中起作用和应激反应。以上结果共同表明Glo依赖的H2O.2生产调节IAA生物合成在水稻中进行各种生物功能。
讨论
近几十年来,信息越来越多地提供,表明光抑制可以影响各种生物过程,例如碳代谢,能量学,氮素同化和呼吸[29那30那31]. 值得注意的是,光呼吸是H2O.2在光拍营养组织中,从而对蜂窝氧化还原状态和信令进行了重要贡献[2那11那30]。报告表明h2O.2与植物开发期间与IAA密切相关,IAA可以促进H.2O.2玉米、番茄和玉米根中的积累拟南芥调节根生长和祖食[32那33那34],而外源性和内源性H抑制IAA生物合成和信号。2O.2在拟南芥幼苗[35那36]. 然而,H2O.2生产和信号与IAA的相互作用仍然没有很好的理解。Gao等人[13]证明猫依赖H2O.2参与了IAA的监管,但没有提供直接证据是如何2O.2来自光呼吸,因为依赖于猫依赖h2O.2可以来自过氧化物组织中的其他来源,例如脂肪酸β-氧化和o的索赔2.−[37]。通过使用格洛敲除突变体,我们进一步证明了Glo依赖的h2O.2还调节了水稻中的IAA水平(图。3.还有无花果。4.A) 是的。然而,这两种基因的过度表达GLO1或者GLO4.授予H没有重大变化2O.2级别(附加文件)3.)或在IAA内容上(附加文件4.一种)。它已被同样注意到Glo的过度表达赋予对光致血管通量和H的增强影响2O.2制备,考虑到几种光致血管酶(例如Glo,2-磷酸糖酸酯磷酸酶)足够高,以在正常情况下管理光素的代谢助焊剂[18那38]而进一步的监管只有在某些压力环境下才是有益的[3.那4.那5.那8.]。总体而言,我们现在的结果表明Glo依赖H2O.2调节水稻中IAA的水平,不仅支持拟南芥cat2突变体[13那14]同时也提供了直接的证据表明猫依赖于H2O.2最终来自GLO催化的反应,基本上通过植物的光呼吸代谢。
植物中存在两种IAA生物合成策略,即TRP无关和TRP依赖性途径。吲哚-3-甘油磷酸盐和吲哚是TRP无关的IAA生物合成的可能前体,但其完整的生化途径尚未阐明。TRP是TRP依赖性IAA生物合成中的前体,已经提出了几种途径用于IAA生物合成策略,但仍未证实参与此类途径的关键酶的分子和遗传证据[24那25]。催化来自Ser和Indole的TRP形成的色氨酸合成酶β(TSB)是TRP生物合成中的关键限制因子。它还记录了H升高的H.2O.2内容拟南芥叶子减少了TSB活动,从而减少了TRP和IAA水平[15那39]。我们目前的研究表明,TSB活性增加(图。5.A) 以及负责Trp依赖性IAA生物合成的基因表达上调(图。5.b)与TRP和IAA的水平呈正相关格洛突变体(图。4.a,b)。这些证据界面表明TRP依赖性途径可能在由Glo依赖性H调节的水稻植物的IAA生物合成中占主导地位2O.2。此外,IAA的修饰可以改变其活性和螯合活性IAA [40]。例如,IBA是一种链形式的IAA,作为用于隔离IAA的游泳池的功能,这仍可能成为IAA在IAA转化为IAA的IAA调节的有效机制[27那40那41]。已知改变来自IBA的IAA池是导致一系列发育缺陷拟南芥[42那43]。IBA可能通过过氧化物酶体中的β-氧化途径转化为IAA [27那40],其中H2O.2可能是一个关键的监管机构[28]。虽然我们未能准确地确定IBA内容由于技术困难[27那44[涉及IBA对IAA转化率的基因的表达水平被证明是显着上调的格洛突变体(图。5.C)。因此,升高的IAA水平可能降低了2O.2水平格洛突变可能部分是由于IBA向IAA转化的增加。
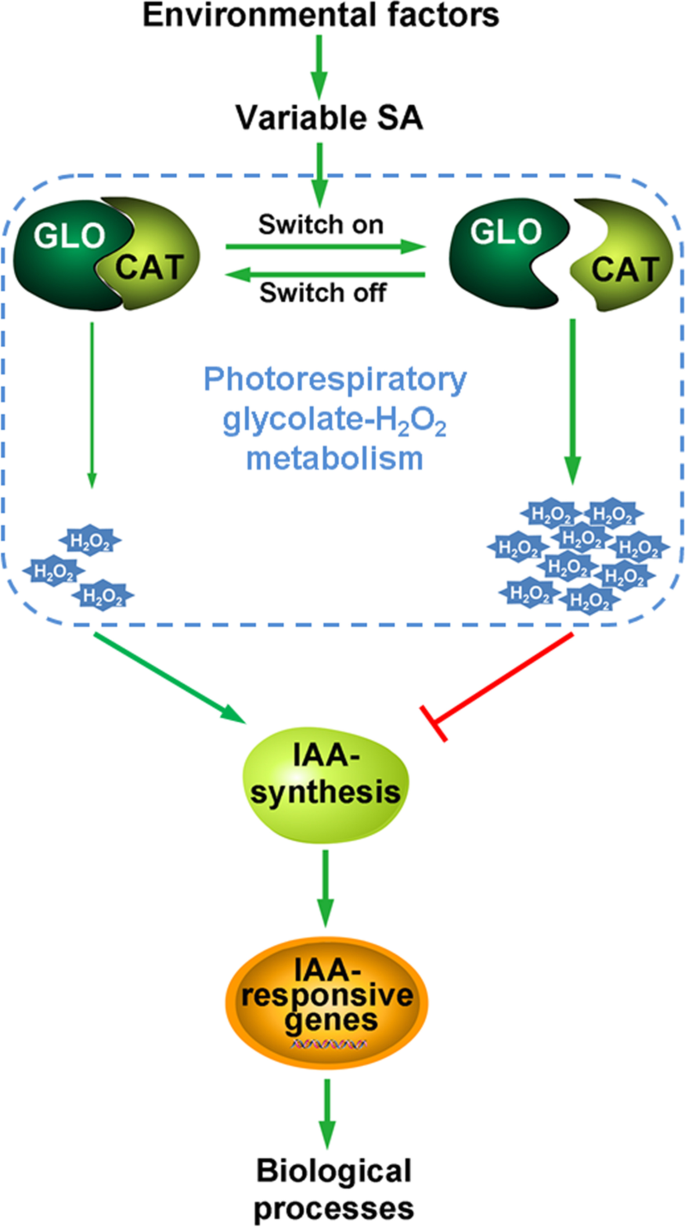
众所周知,IAA信号传导通过调节各种IAA响应因子/基因的表达来控制许多植物生长和发育过程。实际上,许多IAA响应/运输基因的表达(附加档案7.)在体内明显上调GLO1和GLO4突变体(图。6.A、 (B)。我们目前的数据,结合其他研究的结果[13那15]强烈支持植物体内IAA水平可由CAT或GLO调控。IAA是一种重要的植物激素,通过降低IAA水平来抑制植物生长是植物应对干旱和病原菌侵染的重要生理策略[45那46]。同时,Glo可以通过干旱,高温和病原体感染诱导[3.那5.那8.[这些应力还可以导致植物中的水杨酸(SA)积累[47那48那49]. 我们先前提出了一个开关模型,在这个模型中,GLO和CAT的物理结合-解离,对SA等刺激的反应,作为调节细胞H2O.2水平[11]。更有趣的是,已经记录了SA可以对IAA的合成和/或信号进行负面调节,它们在植物中以相互拮抗的方式作用[50那51那52那53]最近的一项研究进一步表明SA调节IAA由H介导2O.2[15]。因此,我们推测SA可以调节H.2O.2通过我们提出的开关模型,随后授予IAA监管。此外,H2O.2可能以波动的方式发生,因为Glo和猫的联合解离可以响应于环境应激或刺激,例如干旱和病原体感染而动态和瞬时发生。因此,我们在这里进一步修改了我们所提出的模型,其中开关调制的H.2O.2波动通过调节植物中的IAA水平来赋予生物学功能(图。7.)。
建议的模型如何通过光素SA链接到IAA。通过参考张等人来形成该模型,[11]. 当GLO与CAT相互作用时,光呼吸H2O.2CAT可通过底物通道机制快速去除GLO产生的光呼吸,否则光呼吸H2O.2将累积。GLO和CAT的动态相互作用作为分子开关,以响应环境变化感测变量SA水平。光致潮流H.2O.2由Glo和Cat联合解离产生的波动可以进一步调节IAA生物合成
结论
在这项研究中,我们发现Glo依赖性H降低2O.2血清中IAA和Trp水平随时间的延长而升高格洛米突变体,而高CO2取消了IAA的差异。随后对IAA代谢相关基因的转录水平和酶活性的分析表明,Trp依赖的IAA生物合成和IBA到IAA的转化都有助于IAA含量的增加。这一数据提供了有关GLO依赖于H2O.2基本上通过光素,调节植物中的IAA生物合成。此外,与我们先前报道的Glo和猫的联合解离机制一起,我们进一步考虑了H.2O.2SA通过这种机制调节的波可能是SA和IAA之间串扰的一个重要点。然而,这个信号通路的分子细节及其生物学意义仍然是我们未来研究的一个重要问题。
方法
植物材料、生长条件和处理
奥雅萨苜蓿简历。以本室保存的中华11号(粳稻品种组)为材料,进行了功能分析和鉴定格洛转基因线建设[20]。在天然条件下在Kimura B完全营养溶液中生长预发芽的水稻种子。达到四叶阶段后,移植幼苗,要么在植物生长室中连续生长在植物生长室中,光循环为14小时光/ 10 H黑色(分别为30°C / 25°C)在600μmol光子m-2S.-1平均,相对湿度60%-80%,或在自然条件下在稻田中生长。高浓度CO2治疗,预发芽的水稻种子在Kimura B中的植物生长室(Percival E-41Ho,USA)中的完全营养溶液培养,提供3500ppm Co2[30那54那55]。
生成转基因稻米
使用植物RNA纯化试剂(Magen Biotech)提取总RNA,根据建议使用HiScript®II逆转录酶(Vazyme)从1μg总RNA制备cDNA。产生格洛过度表达转基因线,每条格洛使用ClonExpress Ultra一步克隆试剂盒(Vazyme)将序列克隆到pYLox.5载体中[56]。用于生成CRISPR-CAS9淘汰线,特定的靶向序列GLO1和GLO4.(附加文件8.)合成并克隆到pYLCRISPR/Cas9Pubi载体中[57]。使用构建的载体使用转化为水稻愈伤组织农杆菌介导的感染(菌株EHA105.)。来自阳性T0系的T1种子萌发,然后移植到土壤中以生长,直至收获T2种子。之后,用于源自两个独立线的T2纯合植物用于随后的治疗和分析。
酶分析和蛋白质测定
GLO活性测定
在酶偶联测定中检测到GLO活性[16]。简而言之,从最小的完全膨胀的叶片(五叶阶段)分离0.1g叶子,在4℃下在1ml 50mM PBS(pH7.4)中均化,将匀浆在12 000g下在4℃下离心20分钟℃和上清液用作酶提取物。含有50mM PBS(pH7.8),1mM 4-氨基 - 反紫红素,0.1mM FMN,2mM酚,5个单位的辣根过氧化物酶和5mM乙酸乙酯的1ml反应混合物。通过加入酶开始反应,并以5秒的间隔记录520nm处的吸光度。使用Coomassie亮蓝G250测定蛋白质含量。
TSB活动试验
根据Last等人测定TSB活性[39]. 所有步骤均在4°C下进行,除非另有说明。植物提取物的制备方法是:用预先研磨的研钵和研杵将1g五叶期水稻幼苗的叶子研磨成糊状,研钵中含有1.5ml 0.1mk-磷酸盐(pH8.2)、0.3g石英砂和0.1g聚乙烯吡咯烷酮。然后将匀浆在12000g下离心两次,持续15分钟,并将上清液用作酶提取物。在30℃温和搅拌下制备含有60 mM L-丝氨酸、0.2 mM吲哚、80 mM磷酸钾(pH8.2)、10μg磷酸吡哆醛和0.4 mL植物提取物的1 mL反应溶液。90分钟后,通过添加0.1 mL 0.2 M氢氧化钠停止反应。通过轻轻旋转将残余吲哚提取到4 mL甲苯中(剧烈搅拌产生永久性乳状液)。在1500 g离心15 min后,将0.5 mL甲苯层添加到2 mL乙醇和1 mL埃利希试剂(Sigma)中。在室温下显色30min,在540nm处用分光光度法测定产物的吸光度。
SGAT和GGAT活性测定
通过检测根据YU等人的糖氧化腈化物的还原来测量SGAT和GGAT活性。[58]经过一些修改。简言之,将50 mg叶片(五叶期)在4℃下在1 mL 50 mM K-磷酸盐(pH 7.4)中均质化,然后将匀浆在12000 g和4℃下离心15 min。将上清液用作酶提取物。0.5 mL酶促反应混合物,含有50 mM K-磷酸盐(pH7.4)、50 mM乙醛酸盐、5.5 mM吡哆醛-5-磷酸盐和适当的酶提取物。在30℃下添加20mM L-丝氨酸(SGAT)或20mM L-谷氨酸(GGAT)20分钟开始酶促反应。添加0.1mL 2M HCl终止酶促反应,并用0.1mL 2M NaOH中和。然后加入0.1ml 0.33%苯肼盐酸盐,30℃孵育15min,最后加入0.5ml盐酸和0.1ml 1.65%铁氰化钾显色反应,在520nm处测得红色。
CAT活性测定
在含有50 mM PBS(pH 7.4)、25 mM H的反应混合物中,使用紫外分光光度计检测CAT活性2O.230℃时。H的消耗2O.2在240nm测量,使用H的消光系数计算CAT活性2O.243.6米-1厘米-1[11]。
3,3-二氨基苯甲酸(DAB)染色H.2O.2侦查
叶子H.2O.2用DAB摄取法原位测定丰度[11]. 将最年轻的完全展开的叶片(10厘米,在五叶期)分离,切端浸入DAB溶液(1毫克毫升)中-1在生长室中,pH 3.8)2小时(光强度为700μmolm-2S.-1温度25℃,相对湿度60%)。之后,将叶片用乙醇染色两次并拍摄。
H的测定2O.2内容
内源性H.2O.2使用Amplex Red H测量水稻叶片(在五叶阶段)的含量2O.2/过氧化物酶测定试剂盒(Invitrogen,USA)[11]。简而言之,将0.1g叶片分离并立即将液氮研磨,然后将粉末在1ml PBS(50mM,pH7.4)中萃取,并在4℃下以12000g离心15分钟。上清液用于确定h2O.2水平。
IAA的定量
对于IAA定量,从最小的完全膨胀的叶子(五叶阶段)脱离1g留下材料,并立即在液氮中冷冻。内源性IAA的提取和定量根据制造商的指示(武汉Meture Biotechnology Co.,Ltd。,武汉,中国)进行[59]. 简言之,将50 mg冷冻叶材料研磨成粉末,并用甲醇/水/甲酸(15:4:1,V/V/V)萃取。合并提取物在氮气流下蒸发至干燥,在80%甲醇(V/V)中重组,并在LC–MS/MS分析之前过滤(PTFE,0.22μm,Anpel)。采用超高效液相色谱-串联质谱(LC-MS/MS)系统(UPLC,Shim-pack UFLC SHIMADZU CBM30A系统,日本京都)对IAA进行定量;理学硕士,加利福尼亚州福斯特市应用生物系统公司)。采用外标法测定IAA含量,以ng/g鲜重(FW)表示。每个样本进行三次生物复制。
测定TRP含量
色氨酸含量的测量是基于先前报道的方法,并作了一些修改[60]。最小的完全扩张的叶子立即分离并在液氮中冷冻以进行后续分析。将收获的叶子在0.5g中取样,并在3ml 2%(w / v)磺酰水杨酸中均化。在25℃温育2小时后,将匀浆在12 000g以12000g离心20分钟,然后通过0.22μm尼龙膜过滤上清液。用高速自动氨基酸分析仪(日本东京,日本日本日本日本人)测定滤液中的TRP含量。
实时定量PCR(QRT-PCR)分析
如上所述制备总RNA和cDNA。量化与过氧血清硅基H相关的基因的表达水平2O.2不同品种叶片中IAA的产生和代谢格洛转基因水稻和WT,在具有Sybr Green I染料(Vazyme)的Bio-rad CFX96设备上进行QRT-PCR分析。使用以下程序在96孔板中进行PCR:在95℃下变性5分钟,然后在95℃下以95℃的10 s的40个循环,并在60℃下掺入30 s。用于QRT-PCR的引物在专用网站上设计(https://biodb.swu.edu.cn/qprimerdb/?tds-ourcetag=s\u pcqq\u aiomsg)。数据被标准化为扩增反义寡核苷酸基因(OS03G0718100)。所有实验均用每种生物重复三种生物学和三种技术复制进行。本文使用的引物序列在支持信息中呈现(附加文件9.那10)。
可用性数据和材料
本研究中产生或分析的所有数据均包含在本文及其补充信息文件中;当前研究中使用的数据集和登录号(Os03g0786100、Os04g0623500、Os07g0152900、Os07g0616500、Os01g0108600、Os09g0385700、Os01g0732700、Os07g0437000、Os03g0790700、Os04g0118100、Os07g0675133、Os09g0544900、Os09g0133200、Os04g0653600、Os03g0313100、Os01g0783700、Os09g0527700、Os11g0490600、Os10g0147400、Os11g0169200、,os03g071810)在Rice注释项目(RAP)存储库中可用(https://rapdb.dna.affrc.go.jp/index.html)。
缩写
- glo:
-
乙醇酸氧化酶
- 猫:
-
催化剂
- 国际律师协会:
-
吲哚-3-丁酸
- IAA:
-
吲哚-3-乙酸
- TSB公司:
-
色氨酸合成酶β.
- QRT-PCR:
-
实时定量PCR
工具书类
- 1.
Dellero Y,Jossier M,Schmitz J,Maurino VG,Hodges M.光致乙酰乙酸酯 - 乙醛代谢。J Exp Bot。2016; 67(10):3041-52。
- 2.
Noctor G,Veljoviv Jovanovic S,Driscoll S,Novitskaya L,Foyer CH.C3植物叶片中的干旱和氧化负荷:光呼吸的主要作用?安·博特。2002;89(7):841–50.
- 3.
Rizhsky L、Liang H、Mittler R。干旱胁迫和热激对烟草基因表达的联合效应。植物生理学。2002;130(3):1143–51.
- 4.
Mittlle R,Zilinskas Ba。豌豆细胞骨抗坏血酸过氧化物酶和其他抗氧化酶的调节在干旱胁迫下和干旱恢复后。工厂J.994; 5(3):397-405。
- 5.
Mukherjee SP,Choudhuri MA。水分胁迫诱导大鼠内源抗坏血酸和过氧化氢水平变化的意义Vigna.幼苗。physiol platararum。1983; 58(2):166-70。
- 6.
Rojas cm,Senthil-Kumar M,Wang K,Ryu C,Kaundal A,Mysore Ks。乙醇酸氧化酶在非健康抗性期间调节反应性氧物质介导的信号转导尼古利亚娜·宾夕法尼亚州和拟南芥. 植物细胞。2012;24(1):336–52.
- 7.
杨梅,李兹,张K,张X,张Y,王X,韩C,于J,许K,李D。大麦条纹马赛克病毒γ.B.与乙醇酸氧化酶相互作用并抑制过氧化物酶体活性氧的产生以促进病毒感染。摩尔植物。2018;11:338–41.
- 8.
Ahammed GJ,Li X,Zhang G,张H,Shi J,Shi J,泛C,Yu J,Shi K.番茄光致乙酰乙酸酯 - 氧化酶 - 衍生的H.2O.2生产有助于基础防御丁香假单胞菌. 植物细胞环境。2018;41(5):1126–38.
- 9
yu x,wu d,fu y,杨x,baluškaf,沉H.osglo4参与了在替代润湿和干燥条件下种植的水稻根表面的铁斑块。植物土壤。2018; 423(1):111-23。
- 10。
夏X,周y,Shi K,周J,Voyer Ch,Yu J.在植物发育控制中反应性氧物种和激素之间的相互作用。J Exp Bot。2015; 66(10):2839-56。
- 11.
张Z、徐Y、谢Z、李X、何Z、彭X。水稻乙醇酸氧化酶与过氧化氢酶的联合解离:调节细胞内H2O.2水平。莫尔植物。2016; 9(5):737-48。
- 12
叶恩、朱庚、刘烨、李烨、张杰。ABA控制H2O.2水分胁迫下水稻叶片诱导蓄积。植物细胞生理。2011; 52(4):689-98。
- 13
高X,Hong My,Hu YQ,Li J,Lu Y.突变拟南芥Catalase2通过植物素水平的变化导致解体叶。植物细胞环境。2014; 37(1):175-88。
- 14
Kerchev P、Mühlenbock P、Denecker J、Morreel K、Hoeberichts FA、Van Der Kelen K、Vandorpe M、Nguyen L、Audenart D、Van Breusegem F。生长素信号的激活抵消了光呼吸H2O.2- 依赖细胞死亡。植物细胞环境。2015; 38(2):253-65。
- 15
袁H、刘W、吕Y。过氧化氢酶2协调SA介导的植物防御中生长素积累和JA生物合成的抑制。细胞宿主微生物。2017;21(2):143–55.
- 16
张Z,李X,崔L,孟S,叶N,彭X。水稻乙醇酸氧化酶同工酶的催化和功能研究。BMC植物生物学。2017;17(1):110–35.
- 17
张Z、陆Y、翟L、邓R、江J、李Y、何Z、彭X。水稻乙醇酸氧化酶同工酶受GLO1和GLO4协同控制。公共科学图书馆一号。2012; 7(6):e39658。
- 18
崔L,Lu Y,Li Y,杨C,Peng X.乙醇酸氧化酶的过度表达赋予水稻高温和高温下的光合作用。前植物SCI。2016; 7:1165。
- 19
Zelitch I、Schultes NP、Peterson RB、Brown P、Brutnell TP。高乙醇酸氧化酶活性是玉米在正常空气中生存所必需的。植物生理学。2009;149(1):195–204.
- 20。
徐宏,张杰,曾杰,姜力,刘娥。乙醇酸氧化酶的诱导反义抑制揭示了它对水稻光合作用的强烈调控。J实验机器人。2009;60(6):1799–809.
- 21。
卢y,李y,杨q,张z,陈y,张某,彭x。抑制乙醇酸氧化酶的抑制导致甘油酯积累,通过去激活水稻来抑制光合作用。physiol platararum。2014; 150(3):463-76。
- 22。
Seamelam N,Jaspert N,Van der Kelen K,Tognetti VB,Schmitz J,Frerigmann H,Stahl E,Zeier J,Van Breusegem F,Maurino VG。空间H.2O.2信令特异性:H2O.2叶绿体和过氧化物酶体对植物转录组的调节不同。摩尔植物。2014;7(7):1191–210.
- 23
泰吉H、贾S、夏玛M、吉里J、泰吉AK。水稻sap对多种生物胁迫有反应,过量表达OsSAP1(A20/AN1锌指蛋白)可增强烟草对病原菌侵染的基础抗性。植物科学。2014;225:68–76.
- 24
di d,张c,luo p,c,guo g.植物蛋白的生物合成:真正导致IAA真正有多少路径?植物生长调节。2016; 78(3):275-85。
- 25
Mano Y,Nemoto K.植物中蟾蜍生物合成的途径。J Exp Bot。2012; 63(8):2853-72。
- 26
Spiess Gm,佐尔曼BK。过氧化血剂作为养肝信号传导分子的源。子细胞生物化学。2013; 69:257-81。
- 27
Frick Em,Strader LC。IBA衍生的植物中的植物开发中的角色。J Exp Bot。2018; 69(2):169-77。
- 28
Tognetti VB,Van Aken O,Morreel K,Vandenbroucke K,Van de Cotte B,De Clercq I,Chiwocha S,Fenske R,Prinsen E,Boerjan W等人。用UDP-葡糖基转移酶UGT74E2调节吲哚-3-丁基酸稳态的扰动拟南芥建筑和水胁迫耐受性。植物细胞。2010; 22(8):2660-79。
- 29。
Fernie Ar,Bauwe H.浪费,必需的,进化的垫脚石?光环途径的多个个性。工厂J. 2020; 102(4):666-77。
- 30.
Foyer Ch,Noctor G. redox稳态和信号在一个高等公司2世界。植物生物学年鉴。2020;71:157–82.
- 31。
Florian A,Timm S,Nikoloski Z,Tohge T,Bauwe H,Araujo WL,Fernie AR.糖尿病患者代谢改变分析拟南芥在二氧化碳和氧气压力的变化之后。J Intger Plant Biol。2014; 56(9):941-59。
- 32。
Ivanchenko MG、den Os D、Monshausen GB、Dubrovsky JG、BednářováA、Krishnan N。生长素增加过氧化氢(H2O.2)番茄中的浓度(Solanum lycopersicum.)抑制根系增长的根尖。Ann Bot。2013; 112(6):1107-16。
- 33。
Peer WA,Cheng Y,墨菲AS。生长素信号氧化衰减的证据。J实验机器人。2013;64(9):2629–39.
- 34。
joo jh,bae ys,lee js。生长素诱导的活性氧物种在根料中的作用。植物理性。2001; 126(3):1055-60。
- 35。
贾恩、吕TT、李MX、魏SS、李YY、赵CL、李B。J蛋白AtDjB1是线粒体复合体I活性所必需的,并通过ROS介导的生长素信号调节生长和发育。J实验机器人。2016;67(11):3481–96.
- 36
王电脑,杜伊,一个gy,周y,miao c,歌曲cp。全球表达概况分析拟南芥脱落酸和h下的基因2O.2应用。植物生物学杂志。2006;48(1):62–74.
- 37
Sandalio L,Rodríguez-serrano M,Romero-Puertas M,DelRíoL.过氧化物的作用作为反应性氧物种(ROS)信号传导分子的源。子细胞生物化学。2012; 69:231-55。
- 38
蒂姆S,哈格曼M。光呼吸是如何调节的,它是如何调节植物的整体代谢的?J实验机器人。2020;71(14):3955–65.
- 39
最后一个rl,bissinger ph,mahoney dj,radwanski er,fink gr。色氨酸突变体拟南芥:复制色氨酸合成酶β基因的后果。植物细胞。1991;3(4):345–58.
- 40。
Woodward AW,Bartel B.植物:调节,行动和互动。Ann Bot。2005; 95(5):707-35。
- 41。
Korasick DA,Enders TA,Strader LC。生长素生物合成和储存形式。J Exp Bot。2013; 64(9):2541-55。
- 42。
Strader LC,Bartel B.内源性增生前体吲哚-3-丁酸的运输和代谢。莫尔植物。2011; 4(3):477-86。
- 43。
Strader LC,Culler Ah,Cohen JD,Bartel B.内源性吲哚-3-丁基酸转化为吲哚-3-乙酸驱动细胞膨胀拟南芥幼苗。植物生理学。2010;153(4):1577–86.
- 44。
Novak O,Henykova E,Sairanen I,Kowalczyk M,Pospisil T,Ljung K.组织特异性剖析拟南芥蒂利亚纳生长素代谢组。植物J。2012;72(3):523–36.
- 45。
施H,陈L,叶T,刘X,丁K,陈Z。植物生长素含量的调控拟南芥赋予改善的干旱胁迫阻力。植物理性生物化学。2014; 82:209-17。
- 46。
傅杰、王S。植物-病原相互作用中生长素信号的研究。前植物科学。2011;2:74.
- 47
杨丽,李乙,郑×,李杰,杨梅,董×,何G,安C,邓×w。水杨酸生物合成增强,并有助于提高细菌对生物营养性病原体的抗性拟南芥杂交种。NAT Communce。2015; 6:7309。
- 48
Okuma E,Nozawa R,Murata Y,Miura K.内源性水杨酸的积累赋予耐旱性拟南芥。植物信号表现。2014;9(3):E28085。
- 49
Hara M,Furukawa J,Sato A,Mizoguchi T,Miura K.非生物应激和水杨酸在植物中的作用。在:植物中非生物应激反应:代谢,生产力和可持续性。由Ahmad P,Prasad MNV编辑。纽约:春家纽约;2012;235-251。
- 50。
Iglesias MJ,Terlime MC,CasalonguéCA。助生素和水杨酸信号抵消了对压力的适应性反应的调节。植物信号表现。2011; 6(3):452-4。
- 51。
喀山,吉咪。将发育与防御联系起来:植物-病原相互作用中的生长素。植物科学趋势。2009;14(7):373–82.
- 52。
王D,Pajerowska-Mukhtar K,Culler Ah,Dong X.水杨酸通过抑制植物毒素信号通路抑制植物的病原体生长。Curr Biol。2007; 17(20):1784-90。
- 53。
vlot ac,dempsey da,klessig df。水杨酸,一种对抗疾病的多方素激素。Annu Rev phytopathol。2009; 47:177-206。
- 54。
WINGLER A,LEA PJ,快速WP,LEEGOOD RC。光呼吸:代谢途径及其在应力保护中的作用。Phil Trans R SoC Lond B. 2000; 355(1402):1517-29。
- 55。
崔力,张C,李Z,冼T,王L,张Z,朱G,彭X。水稻叶绿体PLGG1的两个亚型共同运输光呼吸性乙醇酸盐和甘油酸盐。J实验机器人。2021; 第020页。内政部:https://doi.org/10.1093/JXB/ERAB020。
- 56。
张Z、梁X、陆L、徐Z、黄J、何H、彭X。两种乙醛酸还原酶亚型在功能上是多余的,但在水稻的高光呼吸条件下是必需的。BMC植物生物学。2020;20(1):1–12.
- 57。
马X,张Q,朱Q,魏L,严C,荣Q,王B,杨Z,李H,林Y。一个健壮的CRISPR/Cas9系统,用于单子叶植物和双子叶植物中方便、高效的多重基因组编辑。摩尔植物。2015;8(8):1274–84.
- 58。
Yu L,Jiang J,Zhang C,Jiang L,Ye N,Lu Y,Yang G,Liu E,Peng C,He Z,Peng X.甘油酯而不是抗坏血酸是在水稻中草酸生物合成的有效前体。J Exp Bot。2010; 61(6):1625-34。
- 59。
何Y、赵杰、杨B、孙S、彭L、王Z。吲哚-3-乙酸β-葡萄糖基转移酶OsIAGLU通过介导生长素和脱落酸之间的串扰来调节水稻种子活力。植物生物技术杂志。2020;18(9):1933–45.
- 60。
多布雷斯清真寺。谷氨酰胺合成酶-谷氨酸合成酶途径和谷氨酸脱氢酶在烟草库源氮循环中起着不同的作用。植物生理学。2006;140(2):444–56.
致谢
作者要感谢姚光刘刘刘教授(华南农业大学生命科学学院),用于提供幽门炉.5和Pylcrispr / Cas9向量。
资金
本研究得到了中国国家自然科学基金(32070265, 31770256)、广东省自然科学基金(2019A15150 11438)广东基础与应用研究(2019B030302006)的重大项目的支持。资助机构在本研究的设计、数据的收集、分析和解释以及手稿的撰写方面没有任何作用。
作者信息
隶属关系
贡献
ZZS设计了实验。LXY,LMM,HJY,XZ和LZQ大部分实验并分析了数据。YNH协助实验。ZZS和PXX写了稿件。所有作者阅读并认可的终稿。
通讯作者
道德宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
利益争夺
作者声明他们没有相互竞争的利益。
附加信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
权利和权限
开放存取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/. 知识共享公共领域放弃(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
Li,X.,Liao,M.,Huang,J.等等。乙酸乙酯氧化酶依赖性h2O.2生产调节水稻中的IAA生物合成。BMC植物生物学21,326 (2021). https://doi.org/10.1186/s12870-021-03112-4
已收到:
公认:
发表:
关键词
- 乙醇酸氧化酶
- H2O.2
- IAA公司
- 光镜
- 米