抽象的
背景
Pogoniopsis schenckiiCogn。是一种肌肤矫形兰,可用作模型,以了解肌肤萎缩对生殖周期不同阶段的影响。我们的目标是在生殖过程的每个阶段验证内生生物的真菌,并研究了育种系统如何与遗传结构和种群的多样性有关。在这项研究中,我们对生殖器官进行了解剖学和超微结构分析,现场试验以确认育种系统,以及评估遗传多样性和种群结构的分子分析。
结果
在花粉晶粒的发展期间,胚胎囊和胚胎发生,未观察到真菌侵染。在花茎茎和印度果实中观察到内生真菌菌丝的存在。除了确保促进种子萌发的真菌的存在,水果中的特异性真菌菌丝可能会影响其他过程,例如果实成熟。作为其他肌肤营养兰花,p . schenckii是自然的,这可以解释人群中的低遗传多样性和高遗传结构。
结论
我们讨论了一个有趣的相互作用:真菌菌丝在不开裂的果实。这些真菌菌丝似乎在果实组织中发挥着不同的作用,例如在果实成熟过程中起作用,甚至在扩散发生之前增加真菌和植物种子之间的接近。作为其他肌肤营养兰花,p . schenckii是自然的,这可以解释人群中的低遗传多样性和高遗传结构。完全,我们的研究结果提供了有关塑造型肌肤营养植物分散群体的生态和演变的重要信息。
背景
MycoHeterotrophy是植物和真菌之间的寄生关系,植物依赖于与真菌的相互作用来实现其营养需求的一部分[1].多年来,异养菌植物以一种非传统的生活方式引起了植物学的好奇[2].真菌异养型已经在几个谱系中独立进化,报道在10个被子植物科和大约515个物种中[3.].这些植物已经失去了它们的光合能力,整个生命周期都依赖于与真菌联系的碳[2].由于它们对依赖性相互作用的依赖性,这些物种具有限制性分布,通常小于被剥削的真菌的分布[4.].它们大多是在灌木丛的低光位置发现,光合植物将处于竞争劣势[1].
MyCoherTotoRophic植物表现出许多修饰。它们是小,草本植物,营养器官的减少,并且对于大多数生命周期来说,保持地下[2].真菌不仅存在于根部,也存在于地下器官,如根状茎和球茎。到目前为止,真菌在空气器官中的感染还没有被描述,这表明真菌在植物中繁殖似乎仅限于靠近土壤的器官[2].在种子中,感染通常在萌发后的短期内发生,但在某些情况下,例如用于肌萎缩植物,真菌感染是种子萌发的强制性感染[1那2那5.那6.].关于真菌异养物种的最初研究主要集中在植物和真菌之间的关系上,但最近有关发育、生殖生物学、遗传学和生态学的数据引起了人们的注意[1那2那3.].
由于肌营养性物种中发现的高水平专业,其中大部分与形态特征的降低有关[2和基因组[7.];与真菌的结合被认为是专性的。因此,Bidartondo [1]提出,对于已经参与的义务共生互动涉及的肌萎缩性物种来建立额外的义务协会,它将进化地不稳定。因此,这些物种预计将呈现较少依赖于生物载体,例如总体授粉,自发自我授粉和/或种子形成资源分配的生殖策略。
真菌异养如何影响这些物种的繁殖仍然是一个有争议的问题。事实上,自花受精在许多异养菌植物中都可以观察到[8.那9.那10.那11.那12.那13.].然而,可以观察到具有混合授粉系统的物种,例如具有自我和交叉授粉机制的物种[14.那15.那16.那17.]但我们还可以找到完全辛松物种,其中生殖成功取决于昆虫授粉[8.].考虑到真菌异养影响物种的生殖系统,我们也应该期待反映在这些种群的遗传结构。的确,遗传种群研究显示,真菌异养物种的多样性和种群间基因交换水平较低,这表明自花授粉很普遍[18.那19.那20.那21.那22.].
Orchidaceae是一个最多样化的Anviosperm家族之一,占大约235个Mycoheredotrophic物种[3.].MyCoheterotrophy在家庭内独立地发展了几次[23.[暗示通过与光合装置损失相关的缺乏形态和生理限制的广泛缺失实现的收敛功能演化。虽然兰科植物包含45%的肌萎缩物种,但已知的Angiosperms已知,但有一些研究旨在了解MyCoHeteroRophy的生态和进化后果(但看到[19.那24.那25.])。Pogoniopsis是巴西特有的属,由两个异养菌种组成。该属的繁殖数据表明,花的奖赏和自花受精的繁殖是不存在的[26.然而,尚未调查每个生殖阶段的细节以及该自动统计学影响如何影响遗传群体多样性。另一项研究报告说,在花茎和水果中存在真菌的存在p . schenckiiCogn。[27.],与其他物种的描述不同,其中互动仅发生在地下[2].在SISTI等人进行的这项研究中。[27.[鉴定了在物种的花茎和水果上发现的真菌属的属性未评估该相互作用对物种生命周期的影响。因此,Pogoniopsis可作为一种模型,以了解结构、生态和进化后果的真菌异养繁殖阶段和物种的动态。因此,我们回答以下问题:(a)真菌定植的结构模式是什么p . schenckii?(b)在花药,胚珠和胚胎发育期间发生与真菌菌丝的相互作用吗?(c)是Aruogamy这个物种的主要育种系统,以及种子和花粉运动在多大限制在这种稀有和地方兰花种类中的遗传结构?最后,我们讨论了真菌殖民如何影响该植物生殖器官的发育以及繁殖系统和授粉相互作用如何影响这种稀有兰花的遗传结构。
结果
花药结构、小孢子发生、小配子发生与花粉粒萌发
Pogoniopsis schenckii四孢花药(补充文件图S1一种)。在初始阶段,花药原始由共源组织组成。在幼芽雄蕊中,花药壁由表皮,内皮,中间层和Tapetum形成,所有人都是无敌的。表皮和内皮是由蠕虫扁平细胞形成的,并且在整个阳性配子上的开发过程中保持完整。中间层具有在整个发育中重新吸收的压缩细胞。Tapetum是腺体,由致密的细胞质和明显的细胞核细胞组成。在雄性配子细胞形成过程中,Tapetum细胞被吸收。
在年轻的花药中,孢子源细胞与微孔母细胞(MIMC)不同,其目前是明显的细胞核。MIMC的十日分裂的第一阶段,起源于细胞的二元(补充文件图。1b, c).在这个阶段之后,我们可以观察细胞壁的形成。二分体细胞经历减数分裂的第二阶段,形成四分体小孢子,小孢子保持统一,有不同的形态(补充文件图S1d)。
随后发生小配子体发生,小孢子发生不对称细胞分裂,胞质分裂后产生花粉粒。雄配子体由一个较大的营养细胞和一个较小的生殖细胞组成(补充文件图S1e)。在新打开的花朵中,花药呈现破裂表皮,并暴露成熟花粉粒(补充文件1f-h)。花粉粒在花粉囊内萌发,花柱向柱头方向生长,促进自花授粉。花粉管到达子房大约需要8天(补充文件图S1H)。在花粉谷物的发展期间,未观察到真菌侵染的证据。
胚珠发育、大孢子发生、大合子发生和胚胎发生
花粉管的开始后不久,由于强烈的有丝分裂活动,胎盘增殖发生(补充文件2a).自花授粉后2天胚珠开始分化。在胚珠原基中,来自胚层下的细胞分化为原孢子细胞,原孢子细胞直接产生大孢子母细胞(MMC),体积增大,并呈现明显的细胞核(附图S)2b). MMC减数分裂的第一阶段产生二分体大孢子(补充文件图S2B,D)。只有二元的山雀细胞经历了二十次的第二阶段,起源于巨型巨型巨头。小山巨人巨头变得稳定,而另一个巨型巨头堕落(补充文件图。2e)。
在MegAgameTogis的第一次有丝分裂后,细胞质中的细胞生成的兆甘油蛋白显示出几种小型液泡。随后,在核和每个核之间形成大的中央液泡,每个核移动到MegAgameTophyte的一个杆中(补充文件图。2f).巨配子体的两个核进行第二次有丝分裂,形成四核期(补充文件图S)24个核进行第三次和最后一次分裂,形成一个有8个核的巨配子体。
在MegAgameTophyte细胞化期间,两个合酶和蛋细胞是组织的,最常是三角形布置,以形成卵细胞设备。两个核迁移到MegameTophyte的中心,现在被识别为极核。三个剩余的丘脑区核心退化并且不形成抗脂肪性。物种胚珠是Tenuincellate和Ategmic(补充文件图)2一世)。受精发生在花开口后25天大约25天,可以通过密集的色细胞质和Zygote形成来证明(补充文件3.a, b).极核与配子核融合;然而,胚乳的初生核没有被分裂和吸收。受精卵经历不对称的横向分裂,产生一个顶端细胞和一个基底细胞(附图S3.c).基细胞不分裂,形成胚柄。顶端细胞经历更多的横向和纵向分裂,最初的胚胎最多有6个细胞(补充文件图S3.D-F)。在成熟胚胎中观察到蛋白质物质和淀粉颗粒(补充文件图。3.g,h)。在胚囊囊和胚胎发生过程中,未观察到真菌侵染的证据。
发育果实的形态
的水果p . schenckii具有黄色着色,其开发源于花卉开口的时刻,抑制了土壤上的水果,持续了大约四个月的时期(补充文件4.广告)。花卉开口大约六天,劣质卵巢区域的拉伸开始。花卉开口后,这种扩张持续大约三个月(补充文件图。4.大约3个月的果实开始呈现较深的颜色,花开放后4个月完全黑暗(补充文件图S4.罪犯)。然后,花的茎和果实在土壤上的衰减。水果腐烂后,种子被释放到土壤中。
水果个体发育
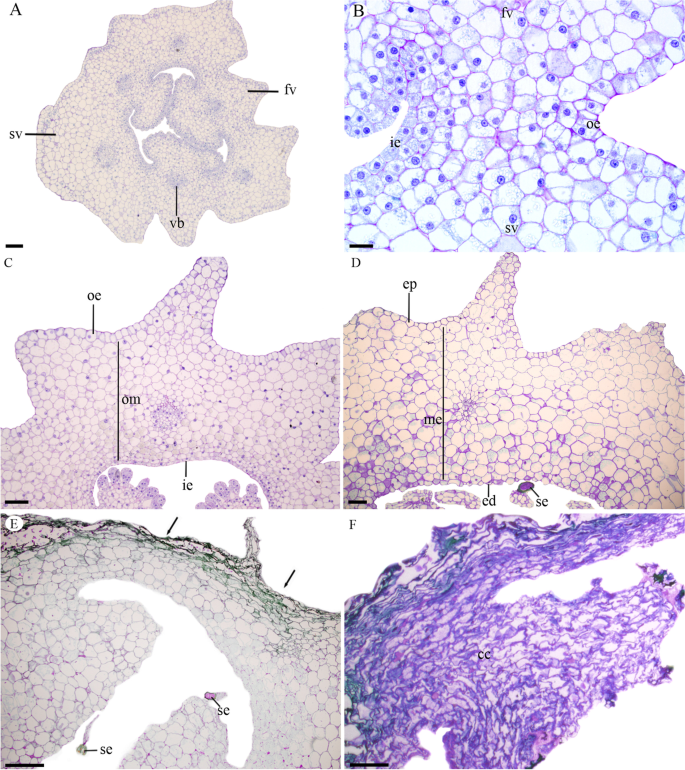
的花Pogoniopsis schenckii下单房的卵巢由3个心皮和6个瓣膜组成,即在胎盘区有3个可育瓣膜和3个不育瓣膜(图)。1a).卵巢的外表皮和内表皮是单列的(图)。1b)。卵巢叶肉由杀菌细胞组成,与内膜细胞相比,外表皮附近的细胞更大(图。1c)。在每个阀门中观察到单个血管束,并且在所有阀中,血管束靠近内表皮(图。1a).在可育瓣中,胎盘区未分化,仅呈突出(图)。1c)。
授粉后,每个可育瓣都有胎盘细胞的增殖,凸出物顶端有胚珠的形成。在果实发育过程中,果皮发生了一些解剖变化。1f)。在卵巢,在无菌瓣中可以发现约13层薄壁细胞(图1)。1C),为促进果实直径的生长而发生垂周分裂。在幼果中,无菌瓣内约有15层薄壁细胞。1D),细胞体积的增加是果实生长的主要因素。
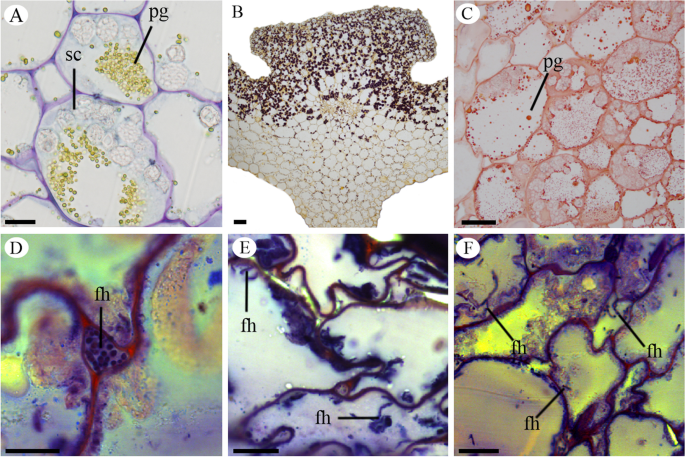
胚胎的耳静杀层p . schenckii果实呈现不同内容的细胞(无花果。2A-F和3.a,b)。我们观察到在花卵巢和幼果中积聚淀粉颗粒和蛋白质颗粒(图。2a - c)。在肥沃的阀门中,在胎盘区域中发现淀粉颗粒,并且在无菌阀中,它们总是靠近内圆锥细胞(图。2a,b)。在Mesocarp和胎盘区的杀菌细胞中发现蛋白质颗粒(图。2a,c)。在水果开发期间,我们可以观察囊泡的存在(图。3.c-e),这可以在细胞质的情况下发现(图。3.c),在液泡中(图。3.d)或将它们的内容物释放到细胞壁中(图。3.e)。
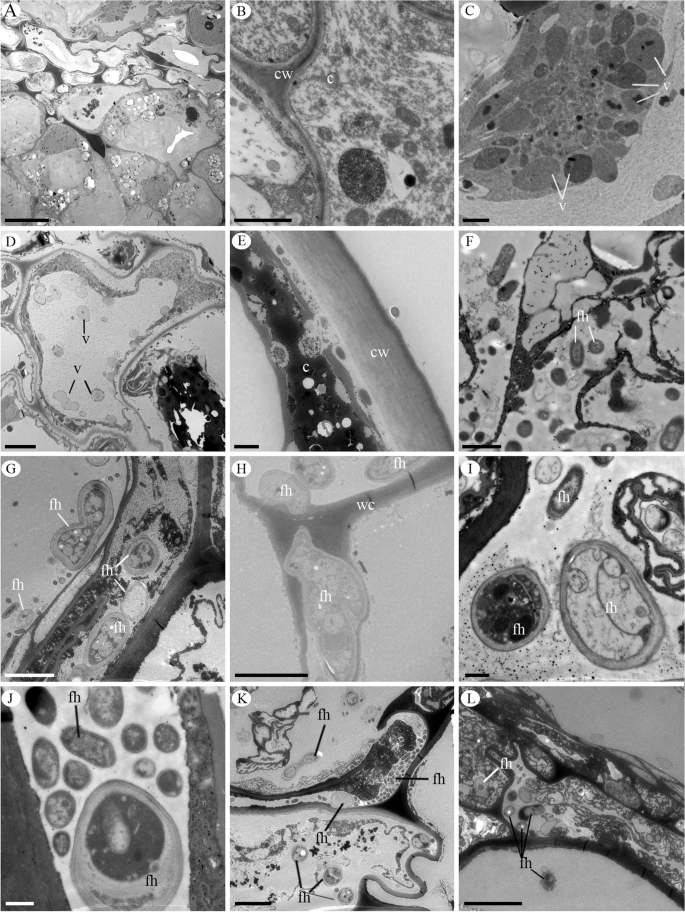
Mesocarp和胎盘区域的传输显微镜电磁Pogoniopsis Shenckii..一种具有高细胞质含量的水果细胞概述。B.致密细胞质的细节。C囊泡浓缩在细胞质中。D.小泡散在细胞空泡中。E.细胞质致密,分泌物在细胞壁附近释放。F-L.真菌菌丝。F胎盘区域细胞中的真菌菌丝。G中果皮细胞内的真菌菌丝。H真菌菌丝穿透细胞壁。I-J.真菌菌丝细节在Mesocarp细胞中的。K.成熟果实中果皮细胞中的真菌菌丝。L.成熟果实塌陷细胞中的真菌菌丝。c =细胞质;Fh =真菌菌丝;细胞壁;v =囊泡。规模酒吧:I, J = 500海里,E, F = 1µm B, C = 2µm, D, G, H, K = 5µm = 20µm, L = 500µm
在成熟果实中,邻近的外果皮和中果皮细胞开始塌陷。1e,f)。该过程在整个果实中进行,总是从Epicarp朝向内皮焊,并且当果实成熟时,倒塌蛋白酶和Mesocarp细胞,从而降低Pericarp的厚度(图。1f).在这个发育阶段,果皮是黑色的(补充文件图S4.C,D)。此时,花茎落下,留下土壤中的水果,分解开始。我们没有观察到果实的任何发育阶段的开放线的形成,将其表征为担心。我们还观察到梅萨普的最内层的真菌菌丝和胎盘p . schenckii水果(图。2D-F和3.F-L)。真菌菌丝在细胞内发生(图。2D-F和3.G-I),并且能够穿过细胞壁(图。3.h).在这些感染细胞中,除了真菌菌丝外,我们还观察到细胞质和空泡中存在小泡。这些菌丝从果实发育的第二个月观察到,在成熟的果实中发现了更多的数量(图。3.j-l)时,所有细胞都已塌陷(图。1f和3.k,l)。
育种系统、多样性和遗传结构
所有的花蕾都在自发的自我授粉治疗中,以及所有花卉在天然授粉治疗中发育成水果。鲜花上没有发现花卉奖励。事实上,我们没有观察到任何花卉游客的存在p . schenckii花在监视。
每个基因座的等位基因数量(一种),居群范围为20 ~ 29。预期的(HE.)及观察(HO.)每种群体的杂合子分别为0.428至0.66,分别为0.197至0.328。近亲繁殖的系数(F)从0.42到0.54(见表1).3个居群均有克隆,其中Pirapitinga居群有4个克隆,Poço do Pito居群有3个克隆,São Lourenço居群有1个克隆。大多数克隆源于多基因型。Pirapitinga由G/N比最低、Nei多样性最低(Div)和有效基因型数均匀性最低(Eve)的群体组成(表1)1).
群体间的分子方差分析(AMOVA)显示为高和显著(P.< 0.001)分化,具有全局F圣,D.ST值分别为0.233和0.312。Mantel测试并不重要(P.= 0.163),表明种群没有表现出距离隔离。在用MAVERICK程序进行的分配试验中,我们鉴定出三个不同的遗传群(K = 3)对应于分析的群体(补充文件图S5.).尽管鉴定了三个遗传群,我们在人口中发现了混合的个体。
讨论
在这项研究中,生殖器官发展的分析表明,这种肌室营养植物中的不寻常相互作用,真菌菌丝在果实果实成熟期间存在真菌菌丝,在果实成熟过程中允许真菌和种子之间的邻近。袋装花的缺乏持有人员参观和高水果套装水平表明果实是通过自身形成的。实际上,遗传标记表现出高水平的血液繁殖和遗传结构,表明所有人口中的自身患病率。这些数据通知我们关于生殖组织的广泛植物/真菌关联,它还包含有关塑造肌肤营养植物小和碎片群体遗传结构的机制的重要信息。
生殖器官解剖
微孢子发生和微酰胺发生的阶段导致形成可行的花粉颗粒,其在家庭中具有其他物种的发育模式[28.].在开花的时候,p . schenckii只有胚珠原基出现在胎盘区。这是兰科植物的一个共同特征,只有在授粉刺激后胚珠才会发育[29.那30.那31那32].
大孢子发生和巨合发生过程产生一个有8个核的胚囊,其中5个发生细胞化蓼属植物,类型的发展。据报道,该科的一些物种的胚囊细胞数量减少[33那34那35那36那37那38那39[如本研究中观察到的,可能与细胞分裂过程中的异常或丘脑杆的核的快速变性有关,如本研究所观察到的[28.那40那41].自发自花授粉后大约一个月,会有受精和未分化胚胎和初生胚乳核的形成,并随后退化。这些特征在兰科植物中很常见,但也适用于不同科的异养菌。在不同科的异养菌物种中,观察到的单一胚胎没有上皮-下胚轴和子叶区域的分化,胚乳减少或缺失[2那37那39那42].
Pogoniopsis schenckii呈现由三个心皮和六个阀门组成的卵巢,例如到目前为止已经研究过的其他兰花种类[43那44那45那46].无菌瓣对应于心皮基部对应萼片基部,可育瓣对应于两个心皮半部分对应花瓣基部[46].在P. Schenckii,子房壁与托杯之间有一个极端的融合;此外,本种呈现不规则形态的子房和果实,这阻碍了心皮和瓣的界限。
中果皮薄壁层体积的增加是果实直径增长的主要因素,这已经在一些兰花中得到了描述[47那48].在果实中果皮中存在厚壁组织细胞是迄今为止研究过的兰科物种的描述,除了我们的研究[39那47那49那50那51那52那53].没有观察到的SCLERIZEp . schenckii可能与果实有关,并且不需要呈现刚性Mesocarp;此外,它可以促进分解过程,这是种子分散的必要因素。兰科的水果是解剖胶囊[46然而,失去裂缝线的丧失表征了果实作为上的果实。
在成熟的印第安人水果中,Mesocarp中的细胞死亡是常见的[54].在发展期间p . schenckii结果表明,中果皮细胞的细胞质和液泡中存在分泌囊泡,提示发生了程序性细胞死亡。囊泡可能有不同的功能,包括携带溶解酶,一旦细胞物质被释放就负责降解[55那56那57].这一过程被描述在不同的阶段,如水果成熟,水果掉落[58],发展种子整容[59,在花衰老期间[57].在果实成熟过程中,细胞塌陷总是从EPICAR朝向内圆锥形发生。在该物种中观察到的这种模式不同于在接受果实的成熟期间观察到的模式,其中细胞崩解首先发生在菌根的核心细胞中,如Solanaceae和仙人掌的种类所示[54那60].
水果与真菌菌丝之间的相互作用
分析结果表明,在花药、胚囊和胚胎发生的发育过程中,没有观察到真菌侵染,这种相互作用仅局限于花的茎和果实(图1)。4.a - c)。在花茎上发现的真菌菌丝生长并接种果实。4.a-e),并在果实发育过程中被观察到,在成熟的果实上发现更多的数量(图。4.C-E)。因此,它们似乎在生命周期中具有不同的功能p . schenckii.它们可以在果实成熟、细胞程序性死亡过程中发挥作用,促进细胞解体和促进种子萌发。
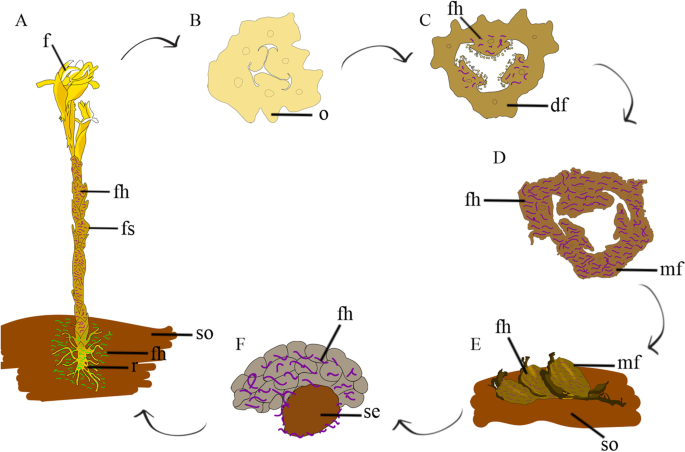
真菌菌丝参与整个生命周期的示意图模型Pogoniopsis schenckii。一种个体与真菌表现出不同的相互作用。紫色的是与花茎相互作用的真菌菌丝。在与根相互作用的绿色真菌菌丝中。B.花卵巢。注意尚未与真菌菌丝相互作用。C发展中的果实。在该阶段,可以观察胎盘区域中水果和真菌菌丝细胞之间的相互作用。真菌菌丝为紫色。D.成熟的果实显示真菌菌丝。真菌菌丝为紫色。E.成熟的水果在地上掉了下来。真菌菌丝为紫色。F果实解体后,种子脱落。此时此刻,它已经与促进其发芽的真菌有关。真菌菌丝为紫色。Df =正在发育的果实;f =花;Fh =真菌菌丝;Fs =花茎;Mf =成熟果实;o =卵巢;r =根; se = seed; so = soil
由于相互作用的性质,水果中的真菌被认为是内生的,因为定植是谨慎进行的,最初是无症状的[61那62].然而,内生真菌在宿主衰老期间可能成为致病性[63,这种情况似乎发生在该物种的成熟果实中。在果实中观察到的菌丝具有半生物营养真菌的特征。最初,它们在不杀死宿主的情况下建立食物关系,但随后它们的生活方式发生了改变,通常通过分泌毒素杀死宿主细胞[64].因此,在该品种果实成熟过程中观察到分泌囊泡(图。3.C,D)可以是对组织内真菌存在的植物反应。在物种中观察到的植物病原体相互作用表明,由于表观遗传重编程,果实中编程细胞死亡的过程发生。最近的研究表明,内生真菌的基因表达可以充当表观遗传调节剂[65那66],激活能够改变内生真菌次生代谢物的沉默基因的表达,从而触发宿主植物的表观遗传变化[67那68那69].在此背景下,未来的研究应研究真菌在果实发育过程中产生哪些代谢物,特别是哪些激素和遗传信号可能参与了果实发育过程中的程序性细胞死亡过程。
兰花种子很小,胚和胚乳减少,需要与真菌结合才能发芽[2那70].为p . schenckii研究结果表明,该种花茎和果实中发现的真菌属于子囊菌门- 3属镰刀菌素那colletotrichum和Clonostachys.- [27.].在本研究中,从水果和根分离的真菌接种到该物种的种子。其中,真菌属于属镰刀菌素那Clonostachys.和木霉属,能够打破种子包络,和Clonostachys.能够刺激原球茎的发育[27.].有些研究表明,对于兰科,许多特异性真菌协会和不相容的菌根,可能会刺激种子萌发,但不会支持幼苗发展[71那72].这种情况被观察到P..Schenckii.,由于只有促进种子包络破裂的真菌之一能够启动原子变量的发展[27.].因此,对于这种MycoheTrootrophic物种,胎盘区域中的真菌菌丝可以允许真菌之间的近似,其可以提供种子萌发的初始阶段。以这种方式,可能这些菌丝涉及种子并将其分散在土壤上(图。4.e,f),有利于种子萌发和激素发育的启动。未来的研究可能澄清哪些真菌协会与Protocorv发育和Plantule建立有关。
育种系统、多样性和遗传结构
Pogoniopsis schenckii提出有性生殖与自花受精,由自发自花传粉。自花授粉似乎是该物种的主要繁殖策略,因为我们在整个研究过程中没有观察到访客/传粉者。我们的结果证实了Bidartondo提出的假设[1他认为,对于一个真菌异养物种来说,它在进化上是不稳定的,因为它已经参与了一种专性的共生关系,以建立额外的生态互动,如动物传粉。因此,p . schenckii引导其能量资源用于自花传粉,促进种子生产而不是花的回报。这可以被认为是一种生殖保证,允许植物的繁殖不依赖于动物传粉者[73],如本研究所述。
育种系统是植物遗传变异的最大决定因素[74那75].为P. Schenckii,遗传变异低,近交系数高(F).获得的数据证实了低遗传变异,已描述在真菌异养兰花Corallorhiza和胃脂种,除近交系数高外胃脂物种 [20.那21.那22.].这些结果可以用一系列因素来解释,如与自花授粉相关的传粉者的缺乏、花粉流量低和种子传播受限。
稀有和通常小物种的低遗传多样性,例如p . schenckii,可能因丧失等位基因而导致遗传漂移的结果[18.那76].虽然p . schenckii呈现出低遗传变异性,与其他自身的肌肌营养性物种相比,它可以被视为高[20.那21.那22.].近似,这可以通过罕见的交叉授粉事件或发生突变的发生来解释。在拟南芥,研究人员观察到,突变可能在自身谱系中的较高频率下发生,遗传多样性的值增加[77,这个过程也可能发生在P. Schenckii。进行自花传粉的物种的进化可能与进行异花传粉的物种不同。内婚制可以减少种群的遗传多样性,但也可以略微增加显性突变的可能性[78那79].群体中无性系数量较少,说明自花受精可为该物种提供繁殖保障。
获得的结果显示出强大的人口结构(F圣 = 0.233 andD.圣 = 0.312), and the presence of three genetic groups, which may be explained by the high rate of inbreeding and low pollen flow between populations. This pattern is commonly observed in mycoheterotrophic orchids [19.那21.].Pogoniopsis schenckii呈现不开裂的果实,当成熟时在地上潮湿,随后开始分解。因此,萌发过程和原球茎的建立可能发生在母植物附近。这可能是另一个过程,当与自配子结合时,加强了每个种群的遗传结构。
值得强调的是,异养菌物种的生存必须依赖于真菌的联合[1那2].因此,其群体自然是碎片化,因为它们的分布取决于他们的菌根伴侣的发生[2那80].而且,监测p . schenckii种群表明,在每个繁殖季节,许多个体没有开花,只能在地下的营养形态中找到。因此,在每个繁殖季节,只观察到种群总数的一个样本,而种群规模很容易被低估。后一种限制可能与资源稀缺有关,可能导致低水平的遗传变异和种群间的遗传分化增加[18.].然而,相对较低的遗传多样性甚至可以促进物种果实中内生真菌的定殖。研究表明,在肌室,来自粉授粉的种子具有植物和真菌之间的高频率不匹配,降低萌发率[4.].因此在P..Schenckii.Autogamy和低遗传多样性可以提供物种的进化优势,这将补偿肌营养植物共同的约束。
结论
异养菌被认为是研究植物和真菌相互作用的模型。由于高度形态,生理和基因组变化,多学科的方法是必要的了解生态和进化的结果真菌异养。我们的结果显示真菌异养物种与真菌定植在地上器官。此外,传粉者的缺乏和自花受精的盛行对这种罕见的异养菌植物的遗传结构有着深刻的影响。事实上,传粉和种子传播独立于生物媒介发生,支持Bidartondo的假说[1],这预期低水平的生物相互作用在真菌异养植物已经参与了专性共生相互作用。自花受精和靠近母植物的种子传播有助于植物体内高水平的遗传结构p . schenckii;这一策略可能与植物-真菌资源有关,在这种情况下,来自凋落物的碳分散在森林林下层。需要进一步研究哪些真菌谱系参与了植物定植,提供种子萌发的真菌是否共生,以及异养菌植物是否有其他营养来源,这可能间接寄生于邻近的光合植物。
材料和方法
植物材料和取样地点
Pogoniopsis schenckii是巴西大西洋森林特有的异养菌。它是一种陆生植物,无叶绿素,具有修饰的叶在苞片覆盖的茎,花与淡黄颜色,和不开裂的果实(无花果。5.a, b).样本采集自Parque Estadual da Serra do Mar (Núcleo Santa Virgínia), São Luiz do Paraitinga市,São保罗州,以及São Lourenço da Serra市,São保罗州(补充文件图S6.).该系列于2015年12月至2018年3月举行。在植物采样后,在无菌条件下研究了真菌定植。COTEC(林业研究所技术和科学委员会,São Paulo,巴西;许可编号597/2014)和SISBIO(巴西生物多样性信息与授权系统,许可编号44155-6)。样品的正式鉴定是由Juliana Lischka Sampaio Mayer进行的。凭证存放在坎皮纳斯大学植物标本室(UEC 196921;205046)。
解剖分析
为了分析植物生殖器官的发育、胚胎的发生和果实的发育p . schenckii,花芽被标记并从第一天在花开口后的第一个至第八天收集。此外,在花开口后收集果实15,20,25,30,60和90天。在卡诺夫斯基的溶液中固定样品[81],在乙醇的连续稀释液中脱水,并用甲基丙烯酸羟乙酯渗透[82].使用Leica RM2245旋转切片机对样品进行3 ~ 5 μm的切片,在pH 4.5的磷酸盐缓冲液中用0.05%的甲苯胺蓝染色[83],并使用Entellan®合成树脂(默克®,达姆施塔特,德国)安装。在水果和胚胎中发现的物质的化学性质是通过以下组织化学测试来确定的:我们使用二甲苯胺Ponceau测试蛋白质[84];测试钌红色,用于多糖和果胶[85.];测试氯化铁的酚类化合物;检测苏丹III类脂质;测试Lugol中淀粉的含量[86.].为了验证水果细胞中真菌菌丝的存在,不同阶段的果实的载玻片与棉蓝根5%的棉绿5%染色,1%的水溶液-O [87.].在Olympus BX51光学显微镜下分析幻灯片,并用Olympus DP71数码相机拍摄。
透射电子显微镜分析
为了分析果实发育过程中细胞发生的主要变化,将不同发育阶段的果实在0.2 M碳酸钠缓冲液(pH为7.25)中置于2.5%戊二醛中固定24 h [88.].用锇十六甲烷进行后固定(OSO4.)在黑暗中为12小时的Cacocylate缓冲液中1.0%[89.].根据制造商的说明,将该物质在含量浓度的丙酮溶液(富含LR级别的浓度)中浸泡的丙酮溶液脱水。使用金刚石刀用Leica Ultramicrootome制备超细部分。这些部分与乙酸铀酰形成鲜明对比[90.]和柠檬酸铅[91.,然后在80kv的Philips em100透射电子显微镜下进行了检测。
育种系统、结构和遗传多样性
为了验证自花传粉的发生,在开花前对10个有5个花蕾的花序进行标记,套袋,并进行监测,直到可能的果实形成(N = 50 in Pirapitinga and Poço do Pito populations). To document the efficiency of natural pollination, 10 inflorescences with five open flowers were marked and not bagged (N= 50在两个种群)。对授粉处理中使用的花进行监测,直至果实成熟或衰老。用一台相机(索尼DCR SR21E)观察赏花的游客。17个个体共观察27个花,时间为168 h。
共有来自三个人群的79人,其中两个人位于Parque Estadual Serra Do Mar - NúcleoSantaVirgínia,圣保罗州(Pirapitinga -N= 31 and Poço do Pito -N = 37), and one located in the municipality of São Lourenço da Serra, São Paulo –N = 11 (Supplementary file Fig. S6.).DNA提取采用改进的CTAB方法,遵循[92.) (补充文件).我们选择其中一个个体进行Illumina测序,以获得100 bp的对端测序reads。这些reads被用来寻找微卫星位点,在测试20个引物后,我们发现了7个多态性微卫星标记用于我们的样本基因型。有关微卫星基因座的测序及鉴定详情载于(补充文件).利用MSA v. 4.05计算的等位基因数、等位基因丰富度、期望杂合度和观察杂合度以及近交系数估算各群体的遗传多样性[93.]和HP-罕见的v。1.0 [94.)项目。使用Genepop V.4.0计划估算来自每种人群内的近亲繁殖的Hardy-Weinberg均衡的偏移。4.0计划[95.].
为了量化群体的克隆发生,按照Meloni等人的建议使用了三种不同的方法。[96.]:群体中基因型数与总个体数的比值(G/N)、Nei多样性指数和基因型均匀度指数。接近0的值表示高无性系繁殖值,而接近1的值表示有性繁殖。
对种群的遗传结构进行了两两估计F圣和D.圣在种群中,使用风格喹和Genodive [97.)项目。采用分子方差分析(AMOVA)方法在GENODIVE软件中对不同层次的遗传变异分布进行分析。通过Mantel测试评估了按距离隔离的存在,该测试在GENEPOP v. 4.0程序中实施。使用MAVERICK v. 1.0.4软件实现的贝叶斯方法分析群体间存在的不同遗传集群和遗传混合模式[98.].
数据和材料的可用性
在当前研究期间使用和/或分析的数据集可从合理的请求上从相应的作者获得。
参考
- 1。
真菌异养的进化生态学。新植醇。2005;67:335-52。
- 2。
微生物异养(腐生)植物生物学。新植醇。1994;127:171 - 216。
- 3.
Merckx VSFT,Freudenstein JV,Kissling J,Christenhusz MJM,Stotler Re,Crandall-Stotler B等。分类和分类。摘自:Merckx VSFT,编辑。Mycoheterotrophy。植物植物的生物学。柏林:斯普林斯,2013. p。19-101。
- 4.
陈建平,李建平,李建平,等。异养菌植物的种间相互作用及其潜在后果。植物学报,2011,40(1):1 - 5。摘自:Merckx VSFT,编辑。Mycoheterotrophy。真菌植物生物学。柏林:施普林格;2013.267 - 29页
- 5.
Leake JR, McKendrick SL, Bidartondo MI, Read DJ。Germinação simbiótica e desenvolvimento dosHipopótamosde.单调Mico-heterotróficosnatureza e sua必将de tricholoma spp。新植物。2004; 163:405-23。
- 6.
Yagame T,Yamato M,Mii M,Suzuki A,IWase K.肺泡兰花的发育过程,Epipogium玫瑰花:用菌根真菌的共生培养下的种子萌发。j植物res。2007; 20:229-36。
- 7.
Graham SW, Lam VKY, Merckx VSFT。边缘质体:真菌异养质体基因组的进化分解。新植醇。2016;214:48-55。
- 8.
Klooster Mr,Culley TM。生殖生态学单调和单调的比较分析:单调薄膜(Ericaceae)中的两种Mycoheterotrop属。我是J机器人。2009; 96:1337-47。
- 9。
亨特里希·H,凯泽·R,戈茨伯格·G.生殖生物学Voyria(龙莲科)法国圭亚那的物种。分类。2010; 59:867-80。
- 10。
周X,林H,范XL,高JY。一种嗜酸甘露花的自主自治和昆虫探索Epipogium玫瑰花(d)采用。机器人。2012;60:154-9。
- 11.
真菌异养兰花自花受精座果Cyrtosia septentrionalis.植物系统中的Evol。2013; 299:481-6。
- 12.
部分和完全真菌异养种的自花授粉和昆虫访虫兰花(兰科)。植物学报2015;128:115-25。
- 13。
Suetsugu K。Gastrodia Amamiana(兰科; epidendroideae; Gastrodieae),来自日本的新完全克莱焦族。Phytotaxa。2019; 413:225-30。
- 14.
Takahashi H,Nishio E,Hayashi H.皂苷物种的授粉生物学Petrosa ViaSakuraii.(Makino)Van Steenisin。j植物res。1993年; 106:213-7。
- 15.
Lehnebach Ca,Robertson Aw,Hedderley D.四个新西兰陆地兰花的授粉研究以及保护保守的含义。n z j bot。2005; 43:467-77。
- 16.
张德兴,桑德斯RMK。异养菌的繁殖生物学Burmannia Wallichii.(Burmanniaceae)。Bot J Linn Soc。2000; 132:359-67。
- 17.
真菌异养兰花的雌蕊单胞生殖eulophia zollingeri.有自交的雌雄同体花和可能异交的雌花。PeerJ。2020; 8: e10272。
- 18.
Klooster Mr,Culley TM。岩白藻类的群体遗传结构Monotropa hypopitys L.(杜鹃花科)以及红色和黄色形态的区别。植物学报,2010;
- 19。
Bret CF,Freudenstein JV。稀有但广泛的肌肤营养兰花中划定物种的一种综合性方法。Mol Ecol。2011; 20:2771-86。
- 20。
霍普金斯SE,泰勒DL。MyCoheterotrophic的微卫星基因座Corallorhiza maculata.(兰科西)扩增C. Mertensana..我是J机器人。2011; 98:E253-5。
- 21。
关键词:药用兰花,遗传多样性,群体结构,种群结构胃脂榆树通过微卫星分析透露。生物学习系统系统。2014; 54:182-9。
- 22。
Tsai CC,Wu Py,Kuo CC,Huang Mc,Yu Sk,Hsu Tw等。脆弱兰花微卫星分析天麻flavilabella:微卫星标记的发展和跨物种扩增胃脂.机器人钉。2014;55:72。
- 23。
李YX,李zh,斯希特曼A,追逐MW,李杰,黄WC等。基于塑体和线粒体基因组的兰科的植物核糖学。mol phylocyet evol。2019; 139:1-11。
- 24.
Suetsugu K.种子分散在Mycoheredotophic兰花中Yoania粳稻:进一步的证据表明,骆驼蟋蟀的内生动物。植物医学杂志。2018;20:707-12。
- 25.
(Suetsugu K, Matsubayashi J, Tayasu I.)新植醇。2020;225:1-8。
- 26.
中国兰花科(兰科:香兰科)传粉系统:报偿花与无报偿花的进化假说。植物。2012;207:849 - 61。
- 27.
Sisti LS, Flores-Borges DNA, Andrade SAL, Koehler S, Bonatelli ML, Mayer JLS。非菌根真菌在异养菌兰萌发中的作用Pogoniopsis schenckiiCogn。前植物SCI。2019; 10:1589。
- 28.
哲人BGL。兰科的胚胎学研究。孢子体。1949年中期;41:184-201。
- 29。
邓肯雷,柯蒂斯JT。果实的间歇性生长蝴蝶兰.兰花水果生长阶段与内部发展的相关性。公牛托雷机器人俱乐部。1942; 69:167-83。
- 30.
哲人BGL。兰科的胚胎学。Curr SCI。1943; 12:13-7。
- 31.
杨欧,法律SK。胚胎学Epidendrum ibaguenseI. Ovule Development。可以j bot。1989; 67:2219-26。
- 32.
张奇,奥尼尔SD。在授粉后,卵巢和配子体发育通过毒素和乙烯进行协调。植物细胞。1993年; 5:403-41。
- 33.
胚胎囊的发育Epipogium Hehyllum..Sven Bot Tidskr. 1954; 48:513-20。
- 34。
斯卡尔·吉尔,克兰奇嘉。胚胎学Epipogium玫瑰花(兰科)。植物系统演化。1981;138 - 7。
- 35。
罗士基,杨英德。胚胎学Calypso.bulbosa.I. Ovule Development。我是J机器人。1989; 76:1668-74。
- 36。
罗士基,杨英德。胚胎学凤仙花passerinum(兰科):胚珠发育。林德利纳。1993年; 8:139-47。
- 37。
Krawczyk E,Rojek J,Kowalkowska Ak,Kapusta M,Znaniecka J,Minasiewicz J.稀有欧洲肌营养型兰花中的混血性和无性繁殖的证据Epipogium Hehyllum.,兰科(幽灵兰花)。Ann Bot。2016; 118:159-72。
- 38.
李莹莹,陈晓明,郭淑娴,李颖,两种异养菌兰科植物的胚胎学研究,植物学报胃脂榆树和天麻nantoensis:胚珠和胚胎发育。机器人螺柱。2016; 57:1-10。
- 39.
Duarte MO, Oliveira DMT, Borba EL。子房和果实的个体发生Acianthera Johannensis.(侧柏属,兰科)揭示了一个特殊的雌性胚胎学。植物。2019;259:151462。
- 40.
杨欧,法律SK。胚芽胚芽和兆甘油癣发育。在:Arditti J,Pridiceon Am,编辑。兰花生物学:评论和观点。DONDRECHT:KLUWER;1997. p。31-68。
- 41.
Kodahl N,Johansen BB,Rasmussen FN。胚胎囊香草帝国(兰科)为六核,未观察到双受精和胚乳形成。中国生物医学工程学报,2015;
- 42.
Maas PJM, Ruyters P。Voyria和Voyriella(腐生龙胆科)[专著41]。Fl Neotrop monor . 1986; 40:1-93。
- 43。
兰科和抱蒴科受精器官和受精方式的观察。伦敦:理查德·泰勒;1831.
- 44。
邓肯雷,柯蒂斯JT。Cattleya和Charidacea在兰科的成长果实的生长。公牛托雷机器人俱乐部。1943; 70:104-19。
- 45。
克里布疯狂PJ。Morfology。在:Pridgeon AM, Cribb PJ, Chase MW, Rasmussen FN,编辑。兰科:第1卷:总论、花蒴科、杓兰科。牛津:牛津大学出版社;1999.13-23页。
- 46。
Rasmussen FN, Johansen B.兰花的动物学。Selbyana。2006;27:44-53。
- 47。
Mayer JLS,Carmello-Guerreiro Sm,Appezzato-da-glóriab.终食发展和种子的解剖学发展金蝶兰属植物flexuosum西姆斯(兰科)。植物。2011;206:601-9。
- 48.
Dirks-Mulder A,Ahmed I,Broek M,Krol L,Menger N,Snier J等人。兰花水果发育的形态学与分子特征。前植物SCI。2019; 10:1-18。
- 49.
子代配子体、珠被的发生和胚胎的发生Microstylis cylindrostachya(兰科,epidendreae)。Proc Natl Acad Sci India A. 1985; 95:379-87。
- 50.
斯福克。胚胎学和系统地位Liparis.(兰科)。植物系统中的Evol。1989; 166:1-9。
- 51.
斯福克。胚胎学malaxis saprophyta,评论系统的位置malaxis.(兰科)。植物系统演化。1992;
- 52.
苏候,饶王。配子蛋白,胚胎源性和果皮microstylis wallichii.Lindl。(兰科)。Bot Mag Tokyo。1986; 99:351-9。
- 53.
苏候,饶王。辅导兰花的胚胎学研究塞浦哌克丁(Cypripedieae,Orchidaceae)。植物系统中的Evol。1988; 160:159-68。
- 54.
罗斯I.植物植物的果实 - 植物解剖学的被包封。柏林:Geburüder咆哮者;1977年。
- 55.
在花衰老过程中,花的超微结构、蛋白酶和caspase-like活性发生了变化百合longiflorum.植物SCI。2011; 180:716-25。
- 56.
植物细胞死亡过程中液泡的作用。细胞死亡不同。2011;18:1298-304。
- 57.
在可见衰老之前,细胞膜与细胞壁之间存在囊泡鸢尾花和芽筋花。植物生理学杂志。2015;
- 58。
bardror T, Dermastia M, Kladnik A, Znidaric MT, Novak MP, Meir S等。番茄在脱落过程中发生不对称的程序性细胞死亡。植物细胞。2011;23:4146 - 63。
- 59。
Soares EL, Lima MLB, Nascimento JRS, Soares AA, Coutinho IAC, Campos FAP。种子的发展麻风树图L.(euphorbiaceae):整合解剖学,超微结构和分子研究。植物细胞代表2017; 36:1-10。
- 60.
Almeida Ojg,Souza La,Paoli Aas,Davis A,Cota-Sánchezh.Pericarp在果皮果仙果实果实中发育:对仙人掌果实分类和大分子理的影响。植物学。2018; 96:621-35。
- 61.
Wilson D.Endophyte:颗粒的演变和澄清其使用和定义。oikos。1995年; 73:274-6。
- 62.
石jk,培根cw,白色jf。内生微生物的概述:定义内皮肌病。在:培根CW,白色jf,编辑。微生物内心细胞。纽约:DEKKER;2000. p。3-30。
- 63.
经过4亿多年的进化,一些植物仍然不能独立生存:植物通过真菌共生来抵抗逆境。实验机器人。2008;59:1109-14。
- 64.
Horbach R, Navarro-Quesada AR, Knogge W, Deising HB。何时及如何杀死植物细胞:植物病原真菌的感染策略。植物生理学杂志。2011;168 - 62。
- 65.
Brosch JW,Loidl P,Graessle S.组蛋白修饰和染色质动力学:专注于丝状真菌。有限元微生物。2008; 32:409-39。
- 66.
毛XM,徐W,李德,尹WB,Chooi Yh,Li Yk等。Endogytic真菌的表观遗传基因组挖掘导致天然产物的脂肪术生物合成。Angew Chem。2015; 54:7592-6。
- 67。
Sun J,Awakawa T,Noguchi H,Abe I.诱导来自药用植物的内心真菌中的霉菌毒素的生产曼佗罗L. Bioorg Med Cheal Lett。2012; 22:6397-400。
- 68。
Menendez vz,Bonilla MP,Victoria LP,Martin J,Munoz F,Reyes F等人。真菌内生细胞中次级代谢物谱的差异诱导的多组分分析。分子。2016; 21:234。
- 69。
Gupta S, Kulkarni MG, White JF, Staden JV。植物内生真菌领域的表观遗传学研究进展。中国生物医学工程学报,2010;
- 70。
巴贾杰yp。IV. In: Bajaj YPS, editor。农林生物技术。纽约:斯普林格出版社;1992.424 - 40页。
- 71.
Bidartondo Mi,读DJ。兰花萌发和发育过程中的真菌特异性瓶颈。Mol Ecol。2008; 17:3707-16。
- 72.
孟益,邵静,刘SJ,高JY。与成人植物根源相关的真菌支持种子萌发吗?案例研究石斛兰流亡(兰科)。球果实守恒。2019; 17:E00582。
- 73.
巴雷特SC。了解植物生殖多样性。Philos Trans R SoC Lond B Biol Sci。2010; 365:99-109。
- 74.
Hamrick JL,Godt MJW。生命史状特性对植物物种遗传多样性的影响。philos trans r soc。1996年; 351:1291-8。
- 75.
关键词:有花植物,交配系统,序列多态性,遗传多样性[16]刘文汇。中国社会科学。2006;
- 76.
葛晓军,洪克雄,柯永芝,徐道辉,龚X,蒋泰泰,等。植物的遗传分化和生物地理格局Amentotaxus argotaenia.物种复杂。植物MOL BIOL REP。2014; 33:264-80。
- 77.
Kronholm I,扬声o,Meaux J.突变率对遗传分化估算的影响 - 课程拟南芥.BMC麝猫。2010;11:2-14。
- 78.
部分自花受精物种的进化速率。Nat。1992;140:126-48。
- 79.
近交繁殖对群体遗传多样性的影响。中国生物医学工程学报,2003;
- 80。
Bidartondo Mi,Bruns Td。Monotropoideae(Ericaceae)的细水分菌根特异性:真菌物种群体的特异性。Mol Ecol。2002; 11:557-69。
- 81。
Karnovsky乔丹。戊二醛固定剂电子显微镜中使用的高渗透压的甲醛戊二醛固定剂细胞生物学杂志,1965;1965(27):137-8。
- 82。
GERRITS PO,SMID L.一种新的毒性聚合体系,用于嵌入乙二醇甲基丙烯酸甲酯中的软组织和随后的序列部分制备。J MicroSC。1983; 132:81-5。
- 83.
Sakai WS。甲藻氨酸蓝O.染色植物对石蜡嵌入式植物材料差动染色的简单方法。1973年; 48:247-9。
- 84.
比达尔BC。二甲苯胺Ponceau染色胶原束的二色性。安Histochmist。1970;15:289 - 96。
- 85.
詹森佤邦。植物组织化学:原理与实践。旧金山:WH Freeman;1962.
- 86.
约翰森大植物MicroTechnique。纽约:麦格劳山;1940年。
- 87.
Marques JPR,Soares MKM,令人诗状的植物组织新染色技术。Turk J Bot。2013; 37:784-7。
- 88.
MC Dowell Em,特朗普B.诊断光和电子显微镜的组织学固定剂。Arch Pathol Lab Med。1976; 100:405-14。
- 89.
加布里埃尔BL。生物电子显微镜。纽约:Van Nostrand Rechold公司;1982年。
- 90。
Bozzola JJ, Russel LD,电子显微镜。生物学家的原理和技术。波士顿:Jones & Bartlett出版社;1998.
- 91。
Hanaich T, Sato T, Iwamoto T, Malavasi YJ, Hoshiro M, Mizuno NA。佐藤法改性稳定铅。电子显微学报1986;1986(35):304-6。
- 92。
Doyle JJ,Doyle JL。从新鲜组织中分离植物DNA。重点。1990; 12:13-5。
- 93。
C.微卫星分析仪(MSA):一个平台独立的大型微卫星数据集分析工具。Mol Ecol Notes. 2003; 3:167-9。
- 94。
kalinowski st。HP-MARE 1.0:用于对等位基因丰富度进行稀疏进行稀疏的计算机程序。Mol Ecol Notes。2005; 5:187-9。
- 95.
Raymond M, Rousset F. GENEPOP(版本1.2):用于精确测试和普世主义的群体遗传学软件。J在这里。1995;86:248-9。
- 96.
Meloni M,Reid A,Caujapé-Castells J,Marrero A,Fernández-Palacios JM,Mesa-Coelo Ra,等。克隆性对罕见的遗传变异性的影响。占地面积:案例太阳之microcarpa来自加那利群岛。生态另一个星球。2013;3:1569 - 79。
- 97.
梅里亚人pg,van tienderen ph。基因型和Genodive:两种用于分析一种遗传多样性的无性生物。Mol Ecol Notes。2004; 4:792-4。
- 98.
Verity R,Nichols Ra。估算结构化人群中的亚步骤(k)的数量。遗传学。2016; 4:1827-39。
确认
我们感谢MarcosAuréliodaIleva在植物位置和Raquel Moura Machado的帮助领域和实验室工作。我们感谢JoãoFonsoMartins为Carmo做了帮助,为准备地图和Diego Graciano提供帮助准备原理图。我们还感谢Espaçodaescrita-pró-reitoria de pesquisa-unicamp-为提供的语言服务以及电子显微镜实验室提供的设备和援助(LME / Unicamp)提供。我们感谢Instituto Florestal(Parque Estadual da Serra Do Mar,NúcleoSantaVirginia ENúcleoPicinguaba)为受保护公共土地的研究发展。
资金
本研究部分由CoordenaçãoPeerfeiçoamentodePessoaldevelfe-Brasil-Finance Code 001供融资.MFA由Conselho Nacional desenvolvimentoCientíficoetecnolóógico(CNPQ)部分支持。FP感谢CNPQ(300927 / 2016-9)和FundaçãodeAmparoàPesquisa做Estado deSãoPaulo(FAPESP; 2016/22785-8)。JLSM感谢CNPQ(447453/2014-9和310184/2016-9),FAPESP(2015/26479-6)和Faepex 0944/14。
作者信息
隶属关系
贡献
MFA收集了材料,进行了实验室工作,进行了分析并写了稿件。CEPN收集了材料,进行了现场工作并修改了手稿。CF,FPR和DSS计划illumina测序,提取读取,搜索SSR Loci并修改了稿件。JLSM和FP计划和设计了研究,监督了实验室工作并修改了手稿。所有作者都读过并批准了稿件。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
作者们宣称他们没有相互竞争的利益。
额外的信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1
:图S1.花树的纵向和横向部分Pogoniopsis schenckii.四孢子囊花药的概述。箭头表示小孢子囊。B.小孢子母细胞。C.小孢子二联体。D.小孢子四分体。成熟花粉粒,有两个细胞。通过表皮破裂释放成熟花粉粒。胃肠道。花粉粒的萌发和花粉管在胎盘区到达。 G. Detail of the germination of the pollen grain. H. Detail of the pollen tube reaching the placental region. I. Growth of the pollen tube along the column.; dmi= dyads of microspores; e= epidermis; gc= generative cell; mimc= microspore mother cell p= placental region; pg= pollen grain, pt= pollen tube; tm= tetrad of microspores; vc= vegetative cell. Scale bars: C-F= 20µm, B, H= 50µm, A,G,I= 100µm
附加文件2:图S2
.的胚珠的纵向切片Pogoniopsis schenckii.分化初期带有胚珠的胎盘全貌。B.大孢子母细胞。C.大孢子母细胞减数分裂过程。卡拉扎尔大孢子扩大和退化珠孔大孢子。f .双核megagametophyte。双核巨配子体,核进入第二个有丝分裂周期。巨型子体有三个可见核。即megagametophyte成熟。厘米= calazal胚囊; dm= degenerating megaspore; ec= egg cell; md= megaspore dyad; mmc= megaspore mother cell; ngm= nuclei of megagametophyte; p= placental region; pn= polar nuclei; s= synergid. Scale bars: B-I=20µm, A=100µm
附加文件3:图S3
.的胚珠和种子的纵向切片PogoniopsisSchenckii..A.渗透和未渗透的协同效应。受精卵。C.胚胎有两个细胞。D.三个细胞胚胎。E.五个细胞胚胎。F.六个细胞胚胎。Lugol证明在胚胎中存在作为储备的淀粉。在胚胎中存在蛋白质,证明是二甲苯胺。ac =顶端细胞; bc= basal cell; e= embryo; ec= egg cell; f=funiculus; ps= penetrated synergid; s= synergid; z= zygote. Scale bars: A-E,G= 20µm, F,I=50µm
附加文件4.
:图S4.发展的果实Pogoniopsisschenckii。A,果实在不同阶段的发展阶段,细节果实。B,果实在成熟的开始,细节果实。C,成熟的水果。D,细节成熟水果。秤条= 1cm。
附加文件5.
:图S5.马弗里克软件的基因结构PogoniopsisSchenckii.基于八个核微卫星基因座。
附加文件6:图S6
.地图显示了抽样的人口Pogoniopsis schenckii.分布图是使用ArcMap 10.7软件创建的,该软件是Esri的知识产权,在本协议许可下使用。黑色种群为São Lourenço da Serra, SP.;红色种群为Parque Estadual Serra do Mar, Núcleo Santa Virgínia, SP. TPi = Trilha da Pirapitinga;TPP = Trilha do Poço do Pito。
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
阿尔维斯,m.f., Pinheiro, F. Nunes, C.E.P.et al。肌营养型兰花的生殖开发与遗传结构Pogoniopsis schenckii圣徒BMC植物杂志21,332(2021)。https://doi.org/10.1186/s12870-021-03118-y
收到了:
公认:
发表:
关键字
- 自动加工
- 胚胎学
- 真菌的菌丝
- 遗传多样性
- mycoheterotrophy.
- 兰花