摘要
背景
叶绿体通过产生具有特定信号传递能力的活性氧(ROS)来应对环境中的压力和变化。ROS单线态氧(1O2)的独特之处在于它可以发出信号启动细胞降解,包括受损叶绿体的选择性降解。这一叶绿体质量控制途径可以监测拟南芥芥突变体质体铁螯合酶2(fc2)有条件地积累叶绿体1O2在昼夜光照循环条件下导致叶绿体快速降解并最终导致细胞死亡。然而,参与这种退化的细胞机制仍然未知。最近,研究表明,整个受损的叶绿体可以通过自噬体和自噬机制的核心成分运输到中央液泡。这一过程被称为噬绿,与降解之间的关系1O2受胁迫的叶绿体和细胞仍未被探索。
结果
为了进一步理解1O2-诱导细胞降解并确定自噬可能发挥什么作用,监测自噬相关基因的表达1O2强调fc2发现苗木被诱导。尽管自噬体存在于fc2细胞,它们不与叶绿体相关联1O2压力。影响核心自噬机制的突变(atg5,atg7,atg10)无法压制1O2-诱导的细胞死亡或叶绿体突出到中央液泡,提示自噬体的形成是不可缺少的1O2-介导的细胞退化。然而,这两个atg5而且atg7导致叶绿体超微结构和光合效率的特定缺陷,提示核心自噬机制参与保护叶绿体免受光氧化损伤。最后,预测参与微自噬的基因被证明是在应激下诱导的fc2幼苗,表明一种可能的作用,另一种形式的自噬在分解1O2受损的叶绿体。
结论
我们的结果支持假设1O2依赖性细胞死亡独立于自噬体形成、典型自噬和噬绿作用。此外,不依赖自噬体的微自噬可能参与降解1O2受损的叶绿体。与此同时,典型自噬可能仍然在保护叶绿体免受1O2诱导的光氧化应激。总之,这表明叶绿体的功能和降解是一个复杂的过程,利用多种自噬和降解机制,可能取决于所引起的应激或损伤的类型。
背景
植物已经进化出了复杂的信号系统,使它们能够感知环境压力并随后做出反应。植物达到这一目的的一种方法是利用它们的叶绿体(专门的光合质体细胞器)作为多种类型的非生物和生物压力的传感器。这部分是由于叶绿体中独特的光化学作用导致产生活性氧(ROS)超氧化物和单线态氧(1O2),分别在光系统I (PSI)及光系统II (PSII) [1].即使在理想条件下,这种ROS的产生也会发生,植物已经进化出了对抗它的机制,包括非光化学猝灭(NPQ), ROS猝灭色素和酶的产生,以及调节能量捕获和光合活性的系统[2,3.,4].然而,叶绿体ROS可在包括过量光(EL)在内的各种胁迫下进一步积累[5],干旱[6],盐度[7],而病原体攻击[8].在这种情况下,这些ROS可能会破坏保护机制,并通过蛋白质、DNA和脂类的氧化导致叶绿体和光系统损伤[5].同时,叶绿体ROS也作为信号分子[6,9].双氧水(超氧化物变性后产生)和1O2已被证明可以诱导单独的信号来控制数百个核基因的表达[10].此外,1O2已被证明可诱导程序性细胞降解,包括选择性叶绿体降解[11,12].
的能力1O2诱导这样的细胞退化已从多个方面推断出来拟南芥芥特定地、有条件地积累大量叶绿体的突变体1O2[12].一个这样的突变体,质体铁螯合酶2(fc2),在血红素合成所需的两种保守的叶绿体酶中的一种存在缺陷。在昼夜光照循环条件下,该突变体积累FC2酶的底物,原卟啉IX (PPIX),四吡咯(如叶绿素和血红素)生物合成途径的中间体[13].像其他未结合的四吡啶一样,自由PPIX的积累导致快速生产1O2在灯光下[14].几个小时内,如此高1O2该水平导致大量叶绿体降解,随后细胞死亡。这在幼苗或成年植物中很容易分别通过子叶的快速漂白和叶片的坏死病变来观察到[15,16].即使fc2突变体在允许的24小时恒定光照条件下生长,避免细胞死亡,仍然观察到叶绿体在细胞质内降解。有时可以观察到这些退化的叶绿体突出或起泡进入健康细胞的中央液泡。综上所述,假设在该突变体中某些叶绿体被选择性降解[15,16].然而,细胞死亡与叶绿体降解之间的关系尚不清楚。细胞死亡可能是叶绿体过度降解的结果,也可能是叶绿体严重受损的独立信号。在任何一种情况下,控制这种降解和随后的叶绿体物质运输到中央液泡的机制也是未知的。
1O2在EL和其他抑制光合作用的环境压力下,PSII自然产生[5,17].在这种条件下,PSII中的叶绿素无法将能量转移到光合反应中心,激发到三联体状态,并与分子氧相互作用生成1O2.与在大多数压力下同时产生的过氧化氢不同,1O2半衰期极短(在细胞内0.5-1 μ秒[18])和大部分1O2可能局限于产生它的同一叶绿体中(1O2可传播< 200 nm,但叶绿体宽度为5-10 μm)。一部分1O2可从叶绿体中排出(1O2已在轻胁迫拟南芥细胞的外质体中检测到[19]),但由于其高反应性,预计控制核基因表达和/或叶绿体降解的次级信号响应1O2累积可能存在[15,20.].以确定这些信号因素涉及1O2-诱导的叶绿体退化,一种遗传筛选铁螯合酶二抑制剂(罚球)突变,阻止细胞死亡和叶绿体降解fc2已执行突变[15].三个罚球突变体已被证明有影响pentatricpeptide - repeat - containing protein 30(PPR30)和”线粒体”转录终止因子9(mTERF9) [16].这两个基因都编码叶绿体定位蛋白,预计参与转录后基因调控;PPR30属于p类PPR蛋白,通过直接影响RNA转录稳定性、加工、编辑和/或翻译来调节基因表达[21]而mTERF9已被证明是叶绿体中30S核糖体亚基组装所必需的[22].因此,这些结果表明,一个(目前尚未确定的)叶绿体基因组编码因子(s)可能需要启动1O2信号。
第四个罚球发现该突变体影响了细胞质泛素E3连接酶Plant U-Box 4 (PUB4),这表明细胞泛素化机制参与了针对受损叶绿体的降解[15].与这一假设一致的是,蛋白质与1O2-胁迫的叶绿体在降解前泛素化。这种降解大部分被阻止在fc2 pub4-6双突变体,表明PUB4或另一种E3连接酶标记受损的叶绿体泛素化周转[15].就这样,叶绿体产生了1O2可诱导叶绿体质量控制系统,使细胞感知和周转受损的叶绿体,以维持健康的叶绿体群和维持有效的能量生产。然而,哪些细胞机制参与了这些叶绿体的靶向降解和清除,仍然未知。有趣的是,pub4-6突变还在允许的恒定光照条件下阻止叶绿体的选择性降解fc2背景)。这表明(至少部分)罚球突变块1O2-通过减少叶绿体降解诱导细胞死亡[15].另外,叶绿体1O2信号可分别诱导叶绿体降解和细胞死亡,每一种都涉及不同的细胞降解机制。
细胞质量控制系统是生物学中的基本机制,允许生物体保持分子过程的最佳功能。在蛋白质、细胞组分甚至整个细胞器受损的情况下,自噬通常在这些过程中发挥作用[23,24].自噬在真核生物中是一个保守的过程,它允许细胞降解和循环大分子和更大的细胞成分,如整个细胞器[25,26].在哺乳动物中,ros诱导的线粒体降解(线粒体吞噬)由E3泛素连接酶PARKIN调节,导致线粒体自噬去除到溶酶体[27].
在真核细胞中,使用两种主要类型的自噬;宏自噬和微自噬。巨自噬是一个经过充分研究的基本过程,在真核生物王国中具有很强的保守性[28].在植物中,典型的大自噬通常被描述为一个过程,其中细胞质成分被包裹在一个双膜囊泡中,称为自噬体,然后被运输到中央液泡进行周转,并最终重新动员营养物质[29,30.].这一过程是维持细胞内稳态、营养储存以及细胞毒性成分和功能失调蛋白质降解的基础[31,32].这种形式的自噬已经被很好地描述,并且需要核心自噬(ATG)蛋白,如自噬5 (ATG5)和自噬7 (ATG7)。这些蛋白质在Autophagy 8 (ATG8)偶联系统中发挥关键作用,这是自噬体形成和成熟所需的过程,自噬体包裹和包装细胞质成分[33].或者,在类似于微自噬的内吞作用的过程中,可以通过泡泡内陷来去除细胞质成分[34,35].与大自噬相比,我们对微自噬的了解要少得多,尤其是在植物中[34].然而,尽管名字如此,微自噬过程几乎能够降解任何细胞成分,包括细胞器。此外,根据目前的定义,微自噬可能代表至少两种类型的细胞降解过程;一种依赖于核心自噬蛋白和自噬体形成(依赖于atg),另一种独立于这些蛋白和结构(不依赖于atg) [36].
最近的研究表明,整个叶绿体在受到UVB损伤后,也会通过类似于巨自噬或微自噬的过程,被运输到中央液泡进行降解[37]或过量光[38),分别。在UVB胁迫下,受损的叶绿体完全被自噬体吞噬,这是巨自噬的标志。然而,在EL胁迫下,只有部分自噬体与受损的叶绿体有关。这一过程类似于依赖atg的微自噬,其中细胞质成分被运输到中央液泡中,只与自噬体部分接触[38],这让人想起酵母中过氧化物酶体细胞器的atg依赖性微自噬降解(微自噬)[36].这些过程(统称为噬绿)涉及的具体机制尚不清楚,但很明显,两者都依赖于核心自噬蛋白。在UVB和EL胁迫下,受损叶绿体向中央液泡的运输被阻断atg5而且atg7突变体,提示自噬体或吞噬体是进行和完成噬绿所必需的[38,39].最近的研究表明,在EL胁迫下,PUB4对于噬绿作用是可可可无的,这表明E3连接酶对于自噬体的形成或噬绿作用不是必需的[40].然而,自噬与叶绿体质量控制之间的关系1O2压力仍未被探索。
在本研究中,我们试图进一步了解涉及的机制1O2诱导叶绿体质量控制和细胞死亡fc2通过确定自噬在这些途径中可能发挥的作用来改变突变体。尽管在应激状态下诱导了大量的自噬相关基因fc2幼苗,自噬体不与这些相互作用1O2强调叶绿体。此外,影响核心自噬机制的突变不能完全阻止叶绿体周转或细胞死亡fc2突变体。最后,我们的基因表达分析指出了atg独立微自噬的潜在作用1O2诱导叶绿体质量控制。这些结果表明,植物系统中可能存在多种叶绿体降解途径,叶绿体质量控制本身是一个复杂的过程,由多种类型的细胞自噬机制调节。
结果
自噬在应激状态下被转录诱导fc2突变体苗
在fc2突变,积累1O2导致其选择性降解并最终导致细胞死亡[15].在这种情况下,降解的叶绿体似乎与中央液泡相互作用,在那里它们可能进一步降解和回收。虽然UVB和EL损伤的叶绿体已被证明以自噬依赖的方式运输到液泡[38,39],即参与运输的细胞机制1O2-受损的叶绿体fc2-1变种人未知。
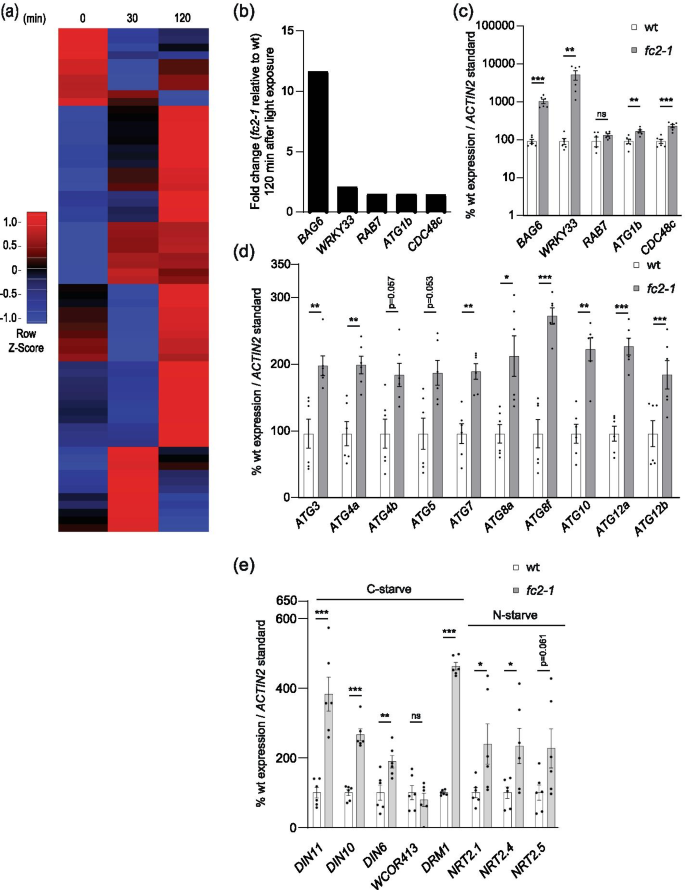
研究自噬是否也参与了植物叶绿体的降解和/或细胞死亡fc2突变体,我们首先测试了核心自噬和自噬相关基因是否被转录诱导1O2积累。为了做到这一点,我们求助于先前发表的黄化(深色生长)野生型(wt)和微阵列数据集fc2-1光照前及光照后(30及120分钟)的幼苗[15].在这种植物从黑暗转向光明的条件下,fc2突变体积累1O2并引发细胞退化。然后,我们分析了人工筛选的71个(微阵列数据集中包括65个)核心自噬和自噬相关基因的表达(表S1).120 min时,65个基因中有13个(20%)被显著诱导fc2-1与wt相比(fold change≥1.25,false discovery rate (FDR)≤0.05)。热图分析显示了这些自噬相关基因在两个时间点诱导的一般(但温和)模式。1a).在120 min时,诱导自噬相关基因最多的前5个是BAG6(AT2G46240),WRKY33(AT2G38470),RAB7(AT1G22740),ATG1B(AT3G53930),CDC48C(AT5G03340)(图。1b).特别有趣的是BAG6,一种强保守的细胞程序性死亡正调控因子[41]和我们手动策划的列表中诱导差异表达最强的基因(在120分钟)。来确定fc2-1幼苗在光循环条件下的反应相似,我们在6小时光照/18小时黑暗循环光照条件下生长的4天树龄幼苗中监测了这5个基因的表达。在这样的光照条件下,1O2的叶绿体中积累fc2-1突变体,导致叶绿体退化和细胞死亡[15,16].与wt相比,五个基因中有四个(除了RAB7)显著诱导fc2-1表明这些表达模式在去黄化后仍能保持(图;1c)。
自噬相关基因在应激状态下被转录诱导fc2-1幼苗。监测细胞自噬相关基因的表达fc2-1突变体。一个黄化苗在(0分钟)之前和去黄化(30分钟和120分钟)期间自噬相关基因表达(相对于wt)的热图。微阵列数据以前是通过在黑暗中生长4天的黄化幼苗,并在指定的时间内暴露在光照下产生的[15].表S列出了所考虑的基因列表1.B从A组开始120分钟,上调最多的5个核心自噬和自噬基因的表达折叠变化(相对于wt)。C,D,ERT-qPCR分析了在6小时光照/18小时暗光循环条件下生长的4天龄幼苗的自噬相关、核心自噬和饥饿(碳和氮)标记转录本。所示为平均值±SEM (n = 6个生物重复)。通过学生的t检验进行统计分析。*, **, *** 表明假定值≤0.05,≤0.01,分别和≤0.001。在所有条形图中,闭圆表示单个数据点
自噬相关基因在应激状态下似乎具有普遍的诱导模式fc2-1我们检测了构成atg8偶联系统的10个核心自噬基因,以探索是否可能通过转录诱导巨自噬或自噬体的形成。在6 h光照/18 h黑暗循环光照条件下,我们再次看到了这些基因诱导的类似趋势。所有10个基因(8个显著,p值≤0.05)均被诱导fc2-1与wt相比(图;1d).总之,这些数据证明了自噬相关基因的子集,包括那些组成atg8偶联系统的基因,在转录中被诱导1O2强调fc2-1在去黄化期间和之后的幼苗,并提示巨自噬被激活以响应叶绿体1O2压力。
因为光合作用可能会受损fc2-1苗(13,15]由于碳(C)和氮(N)饥饿已被证明在诱导自噬中发挥作用[42,我们探讨了这种可能性fc2-1幼苗表现出饥饿反应。为此,我们研究了C-和n -饥饿标记基因的选择[42]在6 h光照/18 h黑暗循环光照条件下生长4天大的幼苗。与wt相比,c -饥饿标记基因(DIN11(AT3G49620),DIN10(AT5G20250) [43),DIN6(AT3G47340),DRM1(AT1G28330) [44])显著诱导fc2-1苗(无花果。1e).一个标记基因的表达,WCOR413(AT4G37220),在wt和之间无显著差异fc2-1.为了研究氮饥饿反应,我们监测了三个标记基因;AT1G08090(NRT2.1),AT5G60770(NRT2.4),AT1G12940(NRT2.5) [45].其中两个基因,NRT2.1而且NRT2.4,均显著诱导fc2-1与wt相比(图;1e).总之,这些结果表明,压力fc2-1幼苗正在经历C-和n -饥饿反应,这可能有助于自噬相关基因的转录诱导。
ATG8与胁迫的叶绿体无关fc2突变体
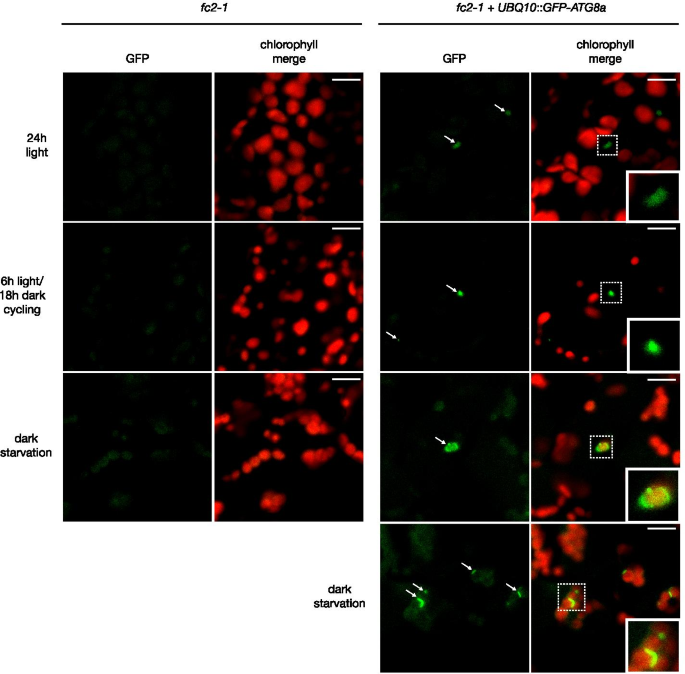
由于自噬相关基因被转录诱导1O2强调fc2-1突变体,我们接下来试图确定是否规范的宏自噬本身是活跃的fc2-1幼苗与自噬体是否相关1O2强调叶绿体。这种反应可以通过跟踪ATG8蛋白的定位来监测,ATG8蛋白是自噬体形成、大自噬和atg依赖的微自噬的转录后调控标志[46].在拟南芥中,观察到GFP融合的ATG8蛋白在诱导自噬时形成点状和圆形结构[47].例如,在噬绿过程中,在UVB或EL胁迫后,GFP-ATG8a可以观察到与叶绿体相互作用的管状形成[37,39].
确定ATG8和自噬体是否也相互作用1O2受胁迫的叶绿体fc2-1变种人,我们引进了一个UBQ10::GFP-ATG8a构造到fc2-1背景和使用共聚焦显微镜监测的GFP结构。在24 h恒光和6 h光/18 h暗循环光照条件下,观察到GFP斑点fc2但在任何一种条件下都不与叶绿体相互作用(图2)。2).GFP和叶绿素荧光的图剖面分析证实了这种空间分离(图S1ab)。为了确定GFP-ATG8a融合蛋白是否有时能与叶绿体相互作用fc2-1在突变体中,我们在黑暗饥饿条件下(4天光照和6天黑暗)监测GFP。类似的处理已被证明可诱导叶绿体的自噬依赖性翻转[48] GFP-ATG8a在自噬过程中与叶绿体有关[49].事实上,在这些饥饿条件下,GFP-ATG8a确实与叶绿体密切相关,这证实了它是自噬依赖的叶绿体降解的标志。2和S1ab)。总之,这些结果表明自噬体存在于fc2-1幼苗叶肉细胞,但不直接与1O2强调叶绿体。
阻断atg依赖的自噬不能抑制细胞死亡fc2幼苗
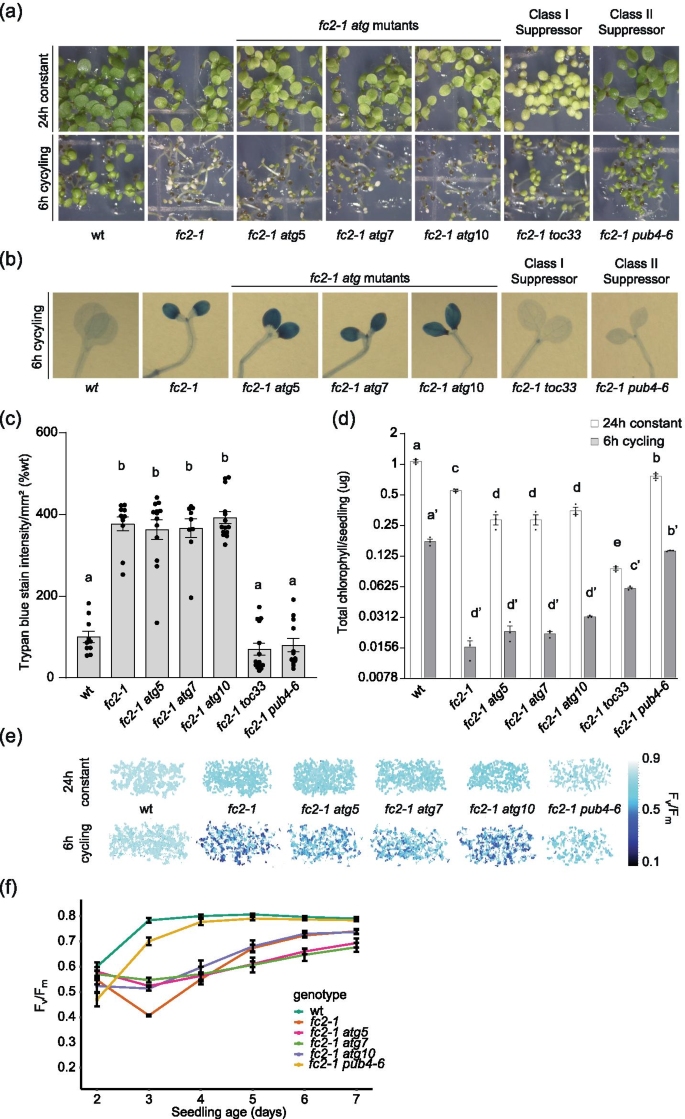
以上结果提示自噬体在fc2细胞,但不直接靶向1O2-胁迫的叶绿体降解。然而,也有可能这种相互作用太短暂而无法检测,或者只有一小部分自噬体参与了叶绿体应激。因此,为了进一步研究atg依赖性自噬在1O2我们检测了在叶绿体质量控制和核心自噬机制之间是否存在遗传相互作用fc2幼苗。在拟南芥,核心自噬(ATG)蛋白,如ATG5、ATG7和自噬10 (ATG10),已被证明是自噬体形成所必需的,因此是典型的大自噬所必需的[50,51,52].此外,ATG5和ATG7已被证明是噬绿作用所特别需要的[38,39].因此,我们引入了nullatg5-1,atg7-2,atg10-1突变到fc2-1背景(经PCR基因分型证实)2))。RT-qPCR分析证实了这三种病毒fc2-1 atg双突变体缺乏各自的ATG转录本(图S2b)并表现出由这些突变引起的预期的早期衰老表型(图S2c) (50,52,53].
虽然叶绿体退化与细胞死亡之间的联系fc2突变体不是很清楚,这些表型是遗传相关的(抑制细胞死亡也抑制叶绿体降解)。因此,如果自噬是必需的1O2-诱导的叶绿体降解,也可减少细胞死亡fc2循环光照条件下的突变体[15,16].因此,我们接下来测试了这些能力atg突变来抑制fc2-1细胞死亡表型,可以通过减少1O2积累(如已知的I类突变体,如toc33/fts4其中有缺陷的是外包膜的一个组成部分质体蛋白的导入机制)或通过阻断1O2信号(如已知的II类突变体,如pub4-6/fts29) [15].在6小时光照/18小时黑暗循环光照条件下,fc2-1突变体遭受细胞死亡,不能绿色(图。3.a).这是由toc33而且pub4-6,但不是三个人中的任何一个atg突变。这种细胞死亡依赖于光循环,因为这些突变体在允许的24小时恒定光照条件下表现出健康。此外,在wt背景下,所有三个atg单个突变体看起来健康,这表明细胞死亡依赖于fc2-1背景(图S3.a).细胞死亡本身是通过对幼苗进行台盼蓝染色来确认的(图。3.b c S2B和c)之间无显著差异fc2-1和fc2-1 atg轻循环条件下的双突变体。
阻断atg依赖的自噬并不抑制1O2-诱导细胞死亡fc2幼苗。atg研究人员测试了基因突变抑制细胞死亡的能力fc2-1突变体。一个7天大的幼苗在恒光(24小时)或6小时明/18小时暗(6小时)循环光照条件下生长。Ba板上的幼苗台盼蓝染色,深蓝色表示细胞死亡。C图B (n≥10株幼苗)台盼蓝信号均值(±SEM)。D在24 h光照或6 h循环光照条件下(n = 3个生物重复)生长的6天大幼苗组的平均叶绿素含量(µg/苗)(±SEM) (y轴为对数2规模)。EPSII最大量子产额的代表图像(Fv/ F米)是用在指示光团中生长的3天大的幼苗测量的。FF的变化v/ F米在6小时循环光照条件下生长超过7天的幼苗。平均值为±SEM (n = 3个生物重复)。采用单因素方差分析(one-way ANOVA)进行统计学分析,然后采用Tukey's HSD。柱状上方不同字母表示差异显著(p值≤0.05)。对于D组,对不同的光照处理进行单独的统计分析,6小时循环值的显著性用字母ʹ表示。在所有条形图中,闭圆表示单个数据点
此外,叶绿素含量低fc2-1在循环光照下生长的幼苗不受这三种物质的显著影响atg突变,进一步证明了它们无法抑制fc2-1细胞死亡表型(图;3.d).与fc2-1然而,fc2-1 atg在24 h恒定光照条件下,双突变体的叶绿素水平显著降低,这可能表明自噬在叶绿体发育或应激反应中起作用。这对叶绿素含量的影响部分独立fc2-1背景,作为单一atg与wt相比,突变体的叶绿素含量降低(图S3.d).这些数据共同证明atg突变不抑制fc2-1表明核心自噬蛋白ATG5、ATG7和ATG10在细胞死亡表型中是不可或缺的1O2-介导的细胞死亡在苗期。
为进一步研究atg生理上的突变fc2-1然后测定PSII (Fv/ F米),是光抑制和植物胁迫的指标[54],同样的幼苗。在24 h恒光条件下,光合效率略有下降fc2-1突变体与wt相比,但在5天后逐渐增加到wt水平(图;3.e和S3.a).在6 h光照/18 h暗循环光照条件下,光合效率为fc2-1突变体在第3天减少,然后在接下来的4天逐渐恢复(图。3.e和f).这可能反映了发生在这些突变体中的细胞退化水平。
而细胞死亡和叶绿体降解抑制pub4-6主要恢复光合效率fc2-1在循环光照条件下变异,这三个atg突变则没有(图;3.e).然而,仔细观察时间过程分析发现,三个fc2-1 atg双突变体受1O2第三天的压力与fc2-1(无花果。3.F),但随后恢复较慢fc2-1在接下来的四天里。这种效果是特定的循环光作为fc2-1 atg双突变体几乎完全相同fc2-1在24小时恒定光照下(图S4a).而且,这种效应是特定于fc2-1背景,作为单一atg在这两种情况下,突变体与wt几乎没有区别(图S4罪犯)。总之,这些结果进一步支持核心自噬机制和atg依赖的自噬不发挥积极作用1O2诱导细胞死亡fc2-1突变体。然而,复杂的影响atg光合效率的突变1O2提示atg依赖的自噬可能在光氧化应激下维持光合效率方面发挥作用。
阻断atg依赖的自噬不抑制细胞死亡或生长抑制fc2成年植物
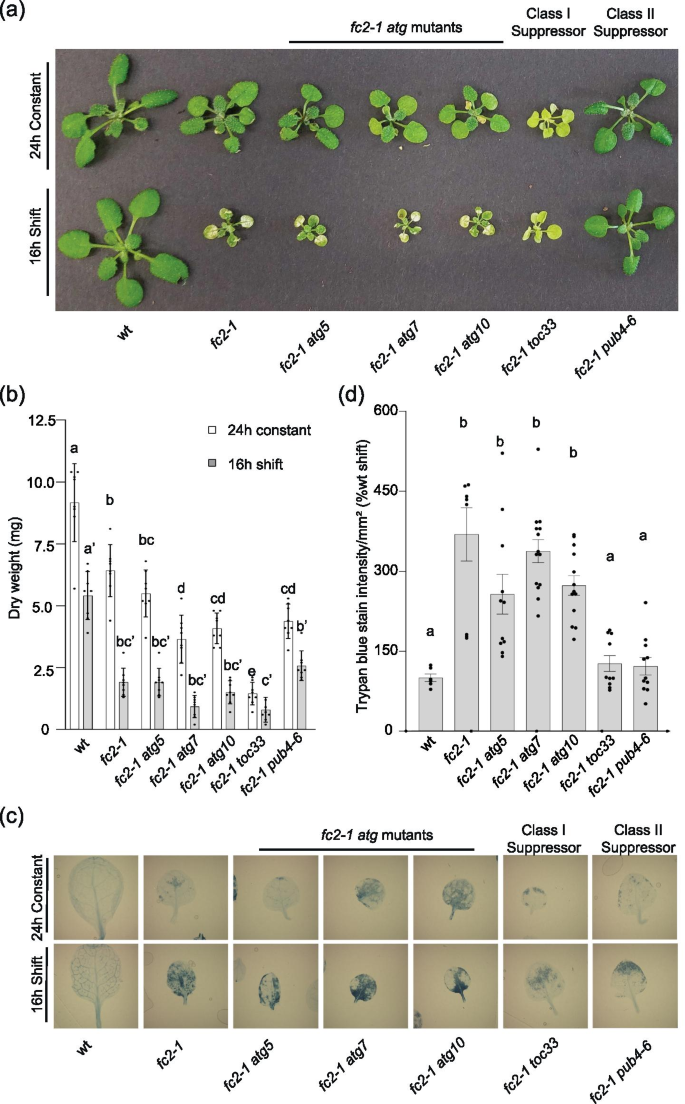
先前已证实,在UVB和EL胁迫后,成年植物叶片会发生噬绿现象[38,39].因此,我们通过评估植物的表型来测试核心自噬机制是否可能在植物发育中发挥阶段特异性作用fc2-1 atg双突变成体植物。为此,我们在24小时恒定光照下种植植物两周,然后将它们转移到16小时光照/8小时黑暗循环光照条件下。作为对照,另一组植物在24小时恒定光照下持续第三周。而fc2-1植物比wt小,但即使在24小时恒定光照下3周后仍然健康,在循环光照下1周后,它们的叶片出现坏死病变,生长(干重生物量)明显下降(图2)。4a和b)。通过对叶片进行台盼蓝染色,证实这些坏死病灶为细胞死亡区域(图。4c和d).成熟两周时fc2-1 atg双突变体暴露在循环光胁迫下,三种突变体的叶片坏死、细胞死亡和生长受损的数量相似fc2-1单突变体。三单atg突变体的表现与wt相似,表明上述应激表型依赖于fc2-1背景(图S5模拟)。总之,这些数据表明1O2-诱导的细胞死亡在苗期和成体期都不依赖于核心自噬机制。
阻断atg依赖的自噬并不抑制1O2-诱导细胞死亡fc2成年植物。表型fc2-1 atg双突变体植株在成体阶段进行了评估。一个在24小时恒定光照或胁迫条件下(两周在24小时恒定光照下,一周在16小时光照/8小时黑暗循环光照条件下)生长3周。B同一植物(n = 8株)的平均生物量(±SD)。C同一植物单叶的代表性台盼蓝斑点。深蓝色表示细胞死亡。D在16 h光照/8 h暗循环光照条件下(单株叶片n≥6片)植株平均台盘蓝信号(±SEM)的定量。采用单因素方差分析(one-way ANOVA)进行统计学分析,然后采用Tukey's HSD。柱状上方不同字母表示差异显著(p值≤0.05)。对于面板B,对不同的光照处理进行了单独的统计分析,光胁迫组的显著性用字母ʹ表示。在所有条形图中,闭圆表示单个数据点
依赖于atg的自噬在传递1O2逆行信号fc2突变体
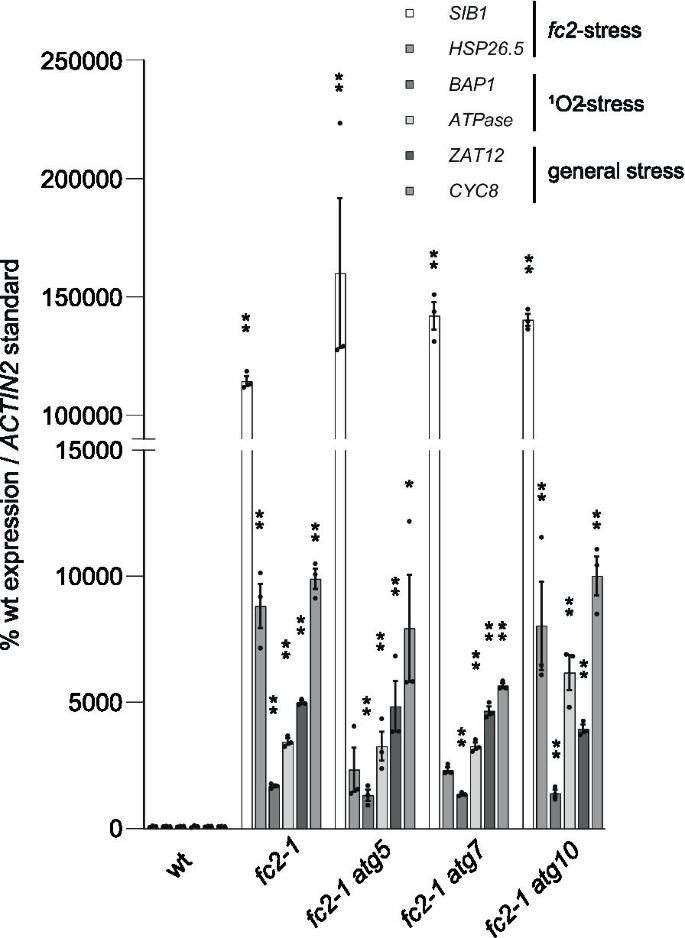
除了叶绿体退化和细胞死亡,1O2也会导致逆行信号,调节细胞核中的数百个基因[11].在骑行灯光下,强调fc2突变体已被证明有一个明确的诱导多个核应激标记基因(特异性1O2反应的基因;BAP1(AT3G61190),腺苷三磷酸酶(AT3G28580) [10],一般ROS反应基因;ZAT12(AT5G59820),CYC81D8(At4g37370) [55],以及压力特有的基因fc2-1幼苗;SIB1(AT3G56710),HSP26.5(AT1G52560) [15])。
由于应激的生理表型没有明显的抑制作用fc2-1在fc2-1 atg双突变体,我们接下来询问核心自噬基因的突变是否会导致这些关键应激标记的诱导变化。为此,我们从在6小时光照/18小时黑暗循环光照条件下生长的4天大的幼苗中提取RNA,并使用RT-qPCR监测这6个标记基因的转录水平。不出所料,fc2-1与wt相比,突变体显著诱导所有6个基因(图;5).这三个fc2-1 atg与wt相比,双突变体也诱导了所有6个基因,与单突变体几乎没有区别fc2-1突变体。总之,这些数据表明,核心自噬蛋白不是必需的叶绿体逆行信号诱导fc2-1幼苗。
叶绿体降解fc2-1突变体不依赖于atg依赖的自噬
以上结果表明atg突变不会导致罚球表型和不能阻止细胞降解fc2-1轻循环条件下的突变背景。测试核心自噬机制和宏自噬是否在分解中起特定作用1O2-受损的叶绿体fc2-1,我们使用透射电子显微镜对在允许的24 h恒定光照条件下生长的4天大的幼苗进行成像。在这种情况下,fc2-1突变体避免了细胞死亡,但仍有一部分叶绿体退化,有时可以观察到它们凸出或冒泡进入中央液泡[15].
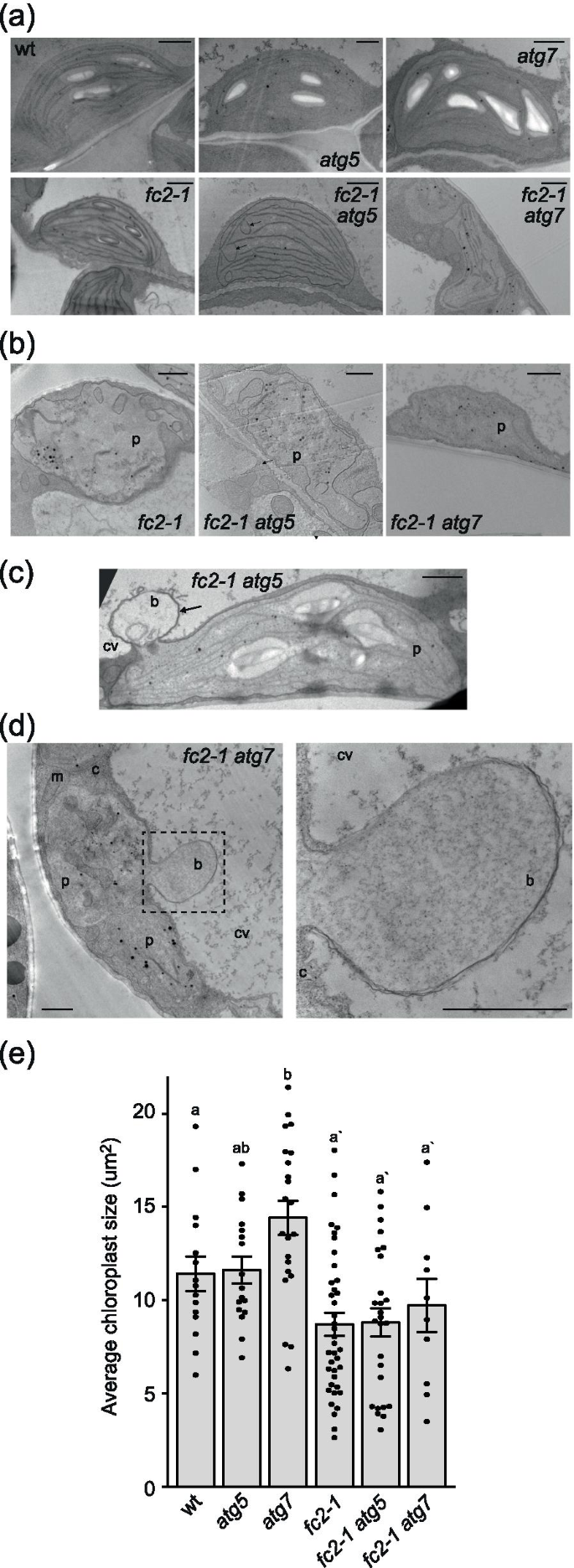
不出所料,大部分叶绿体都在fc2-1幼苗看起来完好无损,但有一个亚群正在退化(图2)。6a和b,表1)(18.6%的总叶绿体成像)。这些退化的叶绿体可以通过其异常的形状、严重无序的细胞膜和压缩的类囊体来识别。大多数叶绿体在fc2-1 atg5而且fc2-1 atg7突变体也完好无损,但更大比例的突变体被降解(39.0%和45.3%)fc2-1 atg5而且fc2-1 atg7)(图;6a和b,表1).在某些情况下,可以观察到这些双突变体中的叶绿体突出或起泡进入中央液泡(图。6C和d)类似于先前在单一fc2-1突变体(15].这种结构在15年中观察到2次fc2-1 atg5细胞,13年2次fc2-1 atg7细胞,15年零次fc2-1细胞。这些结果表明atg5而且atg7是否不能减少降解叶绿体的数量或阻止叶绿体起泡fc2-1突变体。在wt,atg5,atg7,未观察到叶绿体起泡,且仅鉴定出单个降解叶绿体atg7.
atg依赖的自噬在叶绿体选择性降解中是不需要的fc2突变体。用透射电镜(TEM)观察了叶片叶绿体的超微结构atg突变体。所示为有代表性的一个完好无损,B在24小时恒光条件下生长的4天大树苗叶绿体退化。箭头表示不寻常的马蹄形膜结构。所示为与中央液泡相互作用的泡状叶绿体Cfc2-1 atg5而且Dfc2-1 atg7突变体。箭头指示向中央液泡突出的泡样结构。右侧面板是框内区域的放大图像。b;水泡,c;细胞质,简历;中央液泡,m;线粒体,p;质体。Bars = 1µm。E同一苗(n≥10株)平均叶绿体面积(±SEM)。采用单因素方差分析(one-way ANOVA)进行统计学分析,然后进行Tukey's HSD。柱状上方不同字母表示差异显著(p值≤0.05)。分别进行了wt和幼苗的统计分析fc2-1研究的背景和意义fc2-1背景组由带有ʹ的字母表示。闭圈表示单个数据点
除了增加降解叶绿体的百分比外atg突变也影响叶绿体的超微结构fc2-1背景。在很多情况下,fc2-1 atg5而且fc2-1 atg7叶绿体具有不规则的形状或含有不寻常的马蹄形膜/囊泡(图。6a和b).该异常在单个中未观察到atg5而且atg7突变体。平均叶绿体面积未因处理而减少atg在wt或fc2-1这表明叶绿体的发育并没有因核心自噬机制的丧失而严重延迟(图2)。6e).因此,atg依赖的自噬在光氧化胁迫下仍可能在维持叶绿体结构和/或功能方面发挥作用。
完整的和退化的叶绿体的数量是通过4天大的幼苗的透射电子显微镜图像来量化的。降解叶绿体的形态异常,细胞膜严重紊乱,类囊体压缩。这种叶绿体的代表性图像如图所示。6b.监测其他细胞以识别泡变叶绿体,但不包括在本分析中。
编码微自噬相关蛋白的基因在应激条件下被诱导fc2突变体
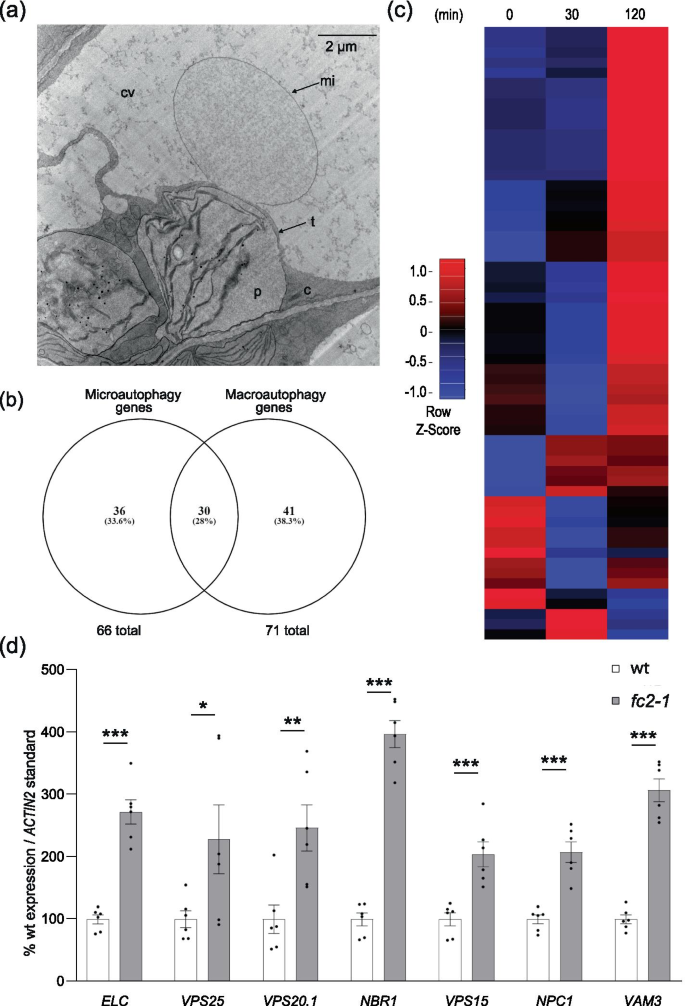
观察到1O2-介导的叶绿体降解和泡泡进入中央液泡仍然发生fc2-1 atg双突变体表明自噬体的形成对于这种降解途径是可有可无的。这导致我们考虑其他形式的自噬可能在其中发挥作用1O2-介导的叶绿体选择性降解。由于在这一过程中观察到的叶绿体起泡似乎涉及到中央液泡的内陷(在双突变体中(图2))。6C和d)和在fc2-1[15]),我们旨在研究不依赖atg的微自噬是否在这一机制中发挥作用。事实上,这种结构在fc2-1 atg双突变体似乎独立于叶绿体(图;7A),提示微自噬在这些细胞系中仍然活跃。然而,微自噬或叶绿体起泡事件的定量是困难的,因为它们在二维显微照片中很少出现[15].这可能是由于叶绿体泡/液泡结构与细胞质之间的连接点很小。
微自噬相关基因在应激条件下被转录诱导fc2研究了植物微自噬的诱导作用fc2-1幼苗。一个所示为有代表性的TEM图像,空泡膜内陷,与退化的叶绿体相邻fc2-1 atg5突变体。c;细胞质,简历;中央液泡,mi;微自噬结构,p;质体、t;液泡膜。B维恩图显示了本研究中假定的微自噬相关基因和自噬相关基因的重叠(表S1和S2).C黄化苗在(0分钟)之前和去黄化(30分钟和120分钟)期间微自噬相关基因表达(相对于wt)的热图。微阵列数据之前是通过在黑暗中生长4天的黄化幼苗在光照前后的时间点生成的[15].表S列出了所考虑的基因列表2.DRT-qPCR分析6 h光照/18 h暗光循环条件下4日龄幼苗微自噬相关转录本。所示为平均值±SEM (n = 6个生物重复)。通过学生的t检验进行统计分析。*, **, *** 表明假定值≤0.05,≤0.01,分别和≤0.001。在所有条形图中,闭圆表示单个数据点
因此,确定微自噬是否可能与叶绿体降解相关的结构有关fc2-1突变体,我们监测了基因的表达,这些基因被预测在微自噬中发挥作用,因为它们与微自噬和微自噬相关过程的同源性酿酒酵母[34].从这项工作中,我们列出了66个基因进行研究fc2-1(表2).由于微自噬本身并没有很好的定义,特别是在植物中[34],我们首先确定了这个微自噬基因列表与我们手动策划的图中使用的一般自噬基因列表共享哪些基因。1a和表S1.两份列表中共有30个基因,几乎全部是核心ATG基因(图2)。7b).由于大多数预测的微自噬相关基因是唯一的,我们使用先前发表的相同的黄化野生型(wt)和微阵列数据集生成了热图fc2-1光照前及光照后的幼苗[15].在这66个基因中,有60个被纳入了数据集。120 min时,60个基因中有8个(13%)被显著诱导fc2-1与wt相比(折叠变化≥1.25,FDR≤0.05)。热图分析再次显示了一种轻度诱导模式,这表明这一预测的微自噬相关基因子集在小鼠体内上调fc2-1突变,主要发生在光照后120分钟(图;7c)。
由于这些微阵列数据来自光照前后的黄化幼苗,我们再次选择在4天大的幼苗中验证这些模式fc2-1采用RT-qPCR法在光照6 h /暗光循环条件下生长。在这里,我们从多个功能基因类别中选择了一些基因进行了探测[34]: ESCRT-I,AT3G12400(语言学校的);ESCRT-II,AT4G19003(VPS25);ESCRT-III,AT5G63880(VPS20.1);液泡选择性泛素受体,AT4G24690(NBR1);PI3K复杂,AT4G29380(VPS15);尼曼挑选型C蛋白(NPC),AT1G07230(NPC1);陷阱,AT5G46860(VAM3).在所有情况下,转录本丰度均显著增加fc2-1总之,这些数据表明微自噬是在转录上诱导的fc2-1下的幼苗1O2模型的条件。根据已知与之相关的结构类型1O2这可能表明atg不依赖的微自噬在这一机制中可能发挥作用1O2-受损的叶绿体在fc2突变体。
讨论
叶绿体ROS在各种环境胁迫下积累,并具有启动多种信号通路的能力。然而,通常会同时产生一种以上的ROS,因此很难了解每种ROS的信号传导作用[1,56].因此,利用特定地、有条件地只积累一种ROS类型的突变体,对于理解单个物种的信号传导能力和机制非常重要。的fc2突变体,专门积累叶绿体1O2在昼夜信号条件下,已成为一个非常有用的系统,以解剖该ROS在启动叶绿体质量控制和细胞降解途径中的作用。基因抑制筛选已经确定了叶绿体基因表达和细胞泛素化机制在这些过程中发挥重要作用,提供了如何深入了解1O2启动应激信号以及个体叶绿体如何被识别为翻转[15,16].虽然这样的叶绿体降解似乎是一个有针对性和有序的过程,细胞机制所涉及的仍然是模糊的。为了进一步了解这种降解背后的机制,我们在这里测试了自噬参与的可能性1O2-介导的细胞死亡途径或清除1O2受损的叶绿体。描述的fc2抑制器(罚球)突变表明这两种表型是相关的[15,16].
先前的研究表明,依赖atg的自噬可参与将UVB或el损伤的叶绿体转移到中央液泡中,这一过程被称为噬绿[37,39].两种胁迫下,自噬体/叶绿体相互作用不同。UVB引起了典型的自噬样大反应,自噬体完全包裹受损的叶绿体[37].另一方面,EL涉及一种微自噬样反应,自噬体部分包围受损的叶绿体,被液泡体吞噬[39].在这两种情况下,噬绿完全依赖于核心自噬机制和叶绿体留在细胞质atg5而且atg7突变体。我们假设,如果广泛的噬绿作用是细胞死亡的原因fc2在轻度循环条件下生长的突变体,这些atg突变(类似于罚球突变)可以抑制这种细胞死亡。然而,当同样的突变(包括影响核心自噬蛋白ATG10的第三个突变)被引入fc2背景,他们没有压制1O2-诱导细胞退化。所有三个fc2 atg当在昼夜循环光照下生长时,双突变体作为幼苗或成体仍然经历细胞死亡(图2)。3.一个和4a).综上所述,这些结果表明噬绿作用并没有直接参与1O2-诱导细胞死亡。相反,核心自噬机制和宏自噬是可有可无的。
而1O2-诱导的细胞退化可发生在fc2没有核心自噬机制的突变体,似乎仍有关系。在昼夜循环光照条件下产生叶绿体1O2,fc2幼苗通过转录诱导自噬相关基因做出反应,包括那些编码核心自噬蛋白的基因。1a和d).另一种诱导自噬相关基因,6 . bcl2相关的致病因子(BAG6),特别有趣的是,它编码一种哺乳动物凋亡调节因子的同源物,并与中央液泡有关。当它在拟南芥中过表达时,会导致叶片坏死,这表明选择性叶绿体降解与液泡介导的细胞死亡信号之间可能存在联系[41,57,58].
含有ATG8a的自噬体也存在于fc2细胞,即使他们似乎不直接相互作用与叶绿体降解(图。2).相反,这种表型可能与诱导的饥饿反应有关fc2碳和氮饥饿标记基因的诱导证明了这一点(图2)。1e).可能是叶绿体功能障碍和细胞退化1O2强调fc2幼苗对细胞代谢具有多效性,导致自噬体的诱导和营养物质的再动员。因此,自噬体和一般自噬基因的诱导可能在一定程度上是在研究中观察到的细胞降解的结果,而不是原因fc2幼苗。此外,ATG8也可以是自噬独立蛋白水解途径的一部分,至少在衰老过程中是这样[59],暗示了这些蛋白质的其他可能性。
这很容易得出结论,规范的自噬也是可有可无的1O2-诱导叶绿体降解。至少,这种降解发生在没有自噬体的情况下。当fc2 atg5而且fc2 atg7双突变体在允许的24 h恒光条件下生长,其降解叶绿体的积累量大于突变体fc2.叶绿体突出/起泡进入中央液泡,一个特征1O2-介导的叶绿体选择性降解fc2[15],在双突变体中也仍然存在。然而,atg突变确实影响了fc2叶绿体对光氧化应激有反应,提示自噬和氧化应激之间存在复杂的关系1O2压力。在轻度循环条件下生长3天,可以得到atg5,atg7,atg10突变似乎稍微保护fc2光抑制突变(增加Fv/ F米价值与fc2-1).然而,相比之下fc2-1,在接下来的4天里,双突变体的光合作用恢复得更慢(图2)。3.E和3f)这些对光合作用的影响取决于fc2-1背景,atg单个突变体与wt几乎没有区别。这一结果表明,自噬的丧失改变了叶绿体对光氧化损伤的敏感性。事实上,对叶绿体超微结构的分析表明,双突变体中的叶绿体形状不规则,含有不寻常的细胞膜结构(图2)。6a和b).在双突变体中,降解叶绿体的数量也比fc2-1.因此,自噬可能仍然是重要的维持叶绿体稳态和功能1O2压力。这可能是由于间接原因(例如,营养物质的再动员或一般的细胞健康),也可能是通过自噬依赖的蛋白质质量控制途径直接调节叶绿体蛋白质水平。这种途径可涉及含rubisco的体(RCB’s) [60]和atg8相互作用蛋白(ATI)体[61]以零碎的方式将叶绿体蛋白质打包在中央液泡中降解。因此,这种自噬的减少可能导致降解叶绿体的增加,如在fc2-1 atg双突变体。
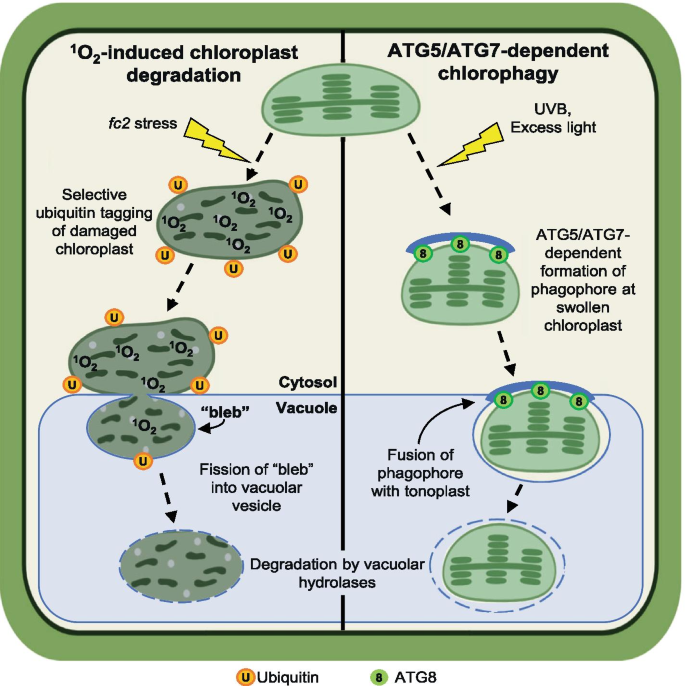
如果噬绿和巨自噬不直接参与1O2-诱导的叶绿体降解,那么使用了什么过程?这些过程之间存在一些差异,表明它们代表了根本不同的事件类型(图。8).例如,EL发生后1 - 3天才开始噬绿[38]及UVB应力[37),分别。相反,1O2-诱导的叶绿体降解在光氧化应激后3小时内开始[15].1O2-诱导叶绿体降解fc2细胞在视觉上也很明显。叶绿体中fc2突变体在突出或“泡”进入中央液泡之前似乎已经处于降解状态,没有明显的自噬体膜存在(图。6D和[15])。这种结构在视觉上类似于微自噬,包括围绕细胞质组分的中央液泡内陷[34,62].然而,与el诱导的噬绿作用不同的是1O2-受损的叶绿体进入中央液泡是独立于自噬体和核心自噬机制。由于这提示atg独立的微自噬,我们监测了预测的微自噬相关基因的表达,并发现了一个明确的诱导模式fc2突变体(无花果。7d)。
植物叶绿体选择性翻转的两个微自噬样过程模型。描述所提出的假设模型1O2-诱导叶绿体质量控制[15](左侧)和依赖ATG5/ atg7的噬绿作用[38,39,40(右侧)。在1O2-诱导的叶绿体降解,受损的叶绿体被泛素标记并开始在细胞质中降解,然后被“泡泡”进入中央液泡,进行叶绿体成分的最终翻转。这种泡泡的空泡泡化可能通过自噬体独立的裂变样机制“掐断”而进行[36].相反,依赖ATG5/ atg7的噬绿作用通过一种机制进行,该机制需要吞噬团的形成和与肿胀的、膜损伤的叶绿体的结合。在这一过程中,最终的液泡泡化可能是通过叶绿体相关吞噬团与液泡膜的融合而实现的36.在这两个过程中,叶绿体成分的最终降解然后被液泡水解酶降解
虽然存在几种特定类型的微自噬,但有人提出在酵母和动物细胞中可以通过两种一般方法进行微自噬:融合型和分裂型微自噬[36].融合型微自噬依赖于核心ATGs和部分自噬体的形成,最终在最终囊化时与溶酶体膜融合[36].另一方面,裂变型微自噬是独立于核心自噬机制的。相反,它涉及到运输所需的核内体分选复合物(ESCRT)的招募,这些蛋白质释放到溶酶体内陷的“夹断”,形成溶酶体内囊泡[36].这两种液泡运输方式如果在植物中是保守的,并且适用于中央液泡,则与噬绿过程中观察到的两种不同的液泡运输机制密切相关[39] (fusion-type)和1O2-诱导叶绿体降解([15和本研究)(裂变类型)。因此,我们目前倾向于这样一种假设,即这种不依赖atg的微自噬可能专门参与清除1O2-细胞受损的叶绿体。然而,目前还没有明确的方法来明确地阻断这些微自噬途径,这使得他们的研究非常具有挑战性[36].
在酵母中,这种不依赖atg的分裂型微自噬参与内质网成分的降解(Micro-ER-phagy) [63]和脂滴[64,65].在拟南芥中,这种类型的微自噬可能参与花青素色素簇从细胞质到液泡的运输[66].在这种情况下,液泡体突出到细胞质中与货物接触,这可能使其与降解背后的过程不同1O2受损的叶绿体。对选择性空泡转运机制的进一步研究1O2-受损的叶绿体fc2突变体可能有助于定义参与这种尚不清楚的自噬形式的途径。
结论
在这项工作中,我们已经证明了1O2-诱导的细胞降解和选择性叶绿体降解fc2突变体通过一个不同于噬绿的过程发生,并且可以在缺乏atg依赖的自噬或核心自噬机制的情况下进行(图。8).之前的一份报告支持了这一观点,该报告证明了PUB4蛋白在叶绿体选择性降解中所必需的fc2突变体(15],在EL胁迫后,对于噬绿是可有可无的[40].总之,这些结果表明叶绿体降解的替代途径可以在细胞中使用,可能取决于所经历的应激或损伤的类型。这样的模型可以解释改变饥饿反应和严重的早期衰老表型pub4 atg5而且pub4 atg7双突变体可能缺乏两种独立的叶绿体分解途径[40].进一步的工作仍然是必要的,以了解这些途径在胁迫下的不同作用,它们如何识别受损的叶绿体,以及这些叶绿体如何最终运输到中央液泡。深入了解这些途径背后的机制对于理解细胞如何在动态和应激条件下维持叶绿体功能和稳态至关重要,并可能有助于提供分子工具来控制农业重要作物物种的光合作用和产量。
方法
生物材料、生长条件和处理
收集植物材料不需要许可。拟南芥生态型哥伦比亚(Col-0)为本研究使用的野生型(wt)系。T-DNA系GABI_766H08 (fc2-1)和GABI_655B06 (atg7-2)来自GABI-Kat系列[67], salk_084434 (atg10-1)来自SALK(索尔克研究所基因组分析实验室)收藏[68和SAIL_129_B07atg5-1)来自SAIL集合[69]均来自拟南芥生物资源中心(哥伦布,OH),并在之前描述[33,50,52,70].突变体的pub4-6而且toc33储存在我们的实验室,并在前面描述[15].附加信息列在表S中3..通过交叉产生双突变系,并通过提取基因组DNA(遵循基于ctab的协议[71]),并使用基于pcr的标记进行基因型确认(图S2a)(引物列于表S4).
用于生长实验的种子用氯化物气体消毒一夜,然后在0.1%的琼脂溶液中重悬。然后将重悬的种子散布在含有Linsmaier和Skoog培养基pH值5.7 (casisson Laboratories North Logan, UT)的0.6%超繁1型琼脂粉的培养皿上。然后将板分层3 - 5天,然后在光强为~ 100光子μ mol m的条件下,在恒定光(24小时白天)或昼夜循环光(6小时白天/18小时晚上)条件下发芽和生长−2年代−1在21℃的温度下。对于成年植物实验,在恒定光照条件下生长的7天大的幼苗被小心地转移到土壤中,并在类似的条件下在植物生长室中继续生长。在黑暗饥饿实验中,用铝箔包裹四天大的幼苗三次,然后放回生长室。六天后,在昏暗的光线下打开这些板,用共聚焦显微镜对幼苗进行成像。光合有效辐射采用LI-250A光度计和LI-190R-BNC-2量子传感器(LiCOR)进行测量。
根癌土壤杆菌在含有1.5%琼脂(w/v)的液体Miller营养肉汤或固体培养基中培养。细胞在28°C和适当的抗生素下生长,液体培养基以225转/分的速度摇晃。
转基因拟南芥系的构建
向量包含UBQ10::GFP-ATG8a构造(At4g21980.1 [72])被改造成农菌株GV3101,随后用花浸法转化拟南芥。T1植物被选择在basta浸泡的土壤上生长的能力,并繁殖到下一代。T2对单次插入的株系进行监测(对Basta抗性:敏感性进行3:1分离),并将株系传播给下一代。最后在T3.基于100% basta抗性的一代。
T-DNA突变系的PCR基因分型鉴定
引物采用SIGnAL (http://signal.salk.edu/) T-DNA引物设计工具。引物对fc2-1,atg5-1,atg7-2,atg10-1,用于确定单、双突变体的基因型(表S4图S2)。所有PCR进行使用Promega GoTaq®大师,与最初的变性步骤93°C 3分钟,其次是30年代变性步骤在93°C, 30年代退火步骤60°C,和一个1分钟15秒伸长在72°C,步骑35次,然后得出最终伸长一步72°C 7分钟。这些thermocycler设置用于所有底漆集,除了磅+ RP: JP286/1169atg7-2,这需要较低的退火温度(54°C)来实现放大。结果得到长度在0.5-1.0 kb之间的DNA片段,这些片段在1%琼脂糖凝胶上分离用于成像。
生物量测量
为了测量干重(DW)生物量,每个品系和生长条件分别称重8个重复,然后储存在包膜中干燥。组织在65°C的烘箱中干燥48小时,然后重新测量以记录干重。
叶绿素荧光测量
为了测量最大PSII量子产额(Fv/ F米),在24 h恒光或6 h/18 h明暗循环光照条件下萌发。Fv/ F米每天主观黎明后2小时测量,连续六天。将Plates放在FluorCam chamber (Closed FluorCam FC 800-C/1010-S, Photon Systems Instruments)中15分钟,在没有Plates盖的情况下进行黑暗适应,然后按照制造商提供的手册进行测量。每种基因型分别在不同的平板上播种三份v/ F米每个重复连续进行测量。
叶绿素测量
用100%乙醇从7天大的幼苗中提取总叶绿素。细胞碎片在4°C下,12000 × g压粒3次,30分钟。在Biotek Synergy H1 Hybrid Reader中,用分光光度法在100 μl体积中测量叶绿素,路径修正根据[73].叶绿素水平归一化每苗(~ 50-130每株,并在发芽前计数)。
细胞死亡测量
如前所述,使用台盼蓝染色评估细胞死亡[16].简单地说,在7天收集种子,然后转移到台番蓝溶液中(甘油:1.25 ml,台番蓝溶液:0.625 ml, ddH2O: 0.625 ml,乳酸:1.25 ml,苯酚:1.25 ml, 100%乙醇:10 ml)。然后将溶液煮沸1分钟,孵育过夜,然后用饱和水合氯醛溶液(每1毫升水2.5 g)去除水合氯醛,在解剖镜成像前将幼苗保存在30% (v:v)甘油溶液中。对于每个重复,使用ImageJ软件测量整个子叶(幼苗)或叶片(成年植物)的染色强度。
RNA提取和RT-qPCR
使用RNeasy Plant Mini Kit (Qiagen)从整个幼苗中提取总RNA,并按照制造商的说明使用Maxima第一链cDNA合成试剂盒使用DNase (Thermo Scientific)进行RT-qPCR合成cDNA。实时PCR使用iTAQ Universal SYBR Green Supermix (BioRad)与SYBR Green荧光团和CFX Connect实时PCR检测系统(BioRad)。所有RT-qPCR均采用以下两步热谱:95°C持续3分钟,95°C持续10秒,60°C持续30秒,循环40次(根据制造商说明)。对所有表达式数据进行规范化处理ACTIN2表达式。RT-qPCR所用引物均列于表S4.
透射电子显微镜
制备4天大的幼苗,用透射电镜成像,如前所述[16].用ImageJ分析叶绿体面积。
体内蛋白质定位
在蔡司880倒置共聚焦显微镜上对4天大的幼苗(或10天大的幼苗进行暗饥饿实验)进行成像。苗木小心地放置在含有半浓度液体LS介质的载玻片上,并小心地用覆盖物(no。1.5)。叶绿素自发荧光和GFP使用单独的轨迹进行监测,以最大限度地提高荧光检测并消除潜在的串扰。用488 nm激光激发GFP,收集500-570 nm之间的发射数据。用633 nm激光激发叶绿素,在640-720 nm之间收集发射数据。来检测未转化的荧光渗漏fc2-1每种条件下的幼苗在相同的设置下成像,如图所示。2.使用488 nm激光检测到极少的绿色荧光背景。用63 ×物镜,外加2 ×或3 ×数码放大镜对幼苗进行成像。产生的图像使用Zen Blue(卡尔蔡司)软件进行处理。由于不同的光照处理对叶绿素水平的影响,叶绿素自发荧光在每个样品中进行了调整,以清楚地识别叶绿体细胞器。实验进行了三次,并展示了代表性图像。利用ImageJ/Fiji进行地块剖面图分析。
基因表达元分析
目的:监测叶绿体控制的自噬相关基因的表达1O2信号,我们使用了之前发表的数据集的微阵列分析4天的黄化wt和fc2-1光照前后(30和120分钟)的幼苗(120 μ mol光子m−2年代−1) [15].差异基因表达和FDR值使用edgeR差异基因表达包https://galaxyproject.org/[74,75].手工策划的核心自噬和自噬相关基因列表(表S1)编译自拟南芥信息资源(TAIR)网站(https://www.arabidopsis.org/).收集到父基因(24个位点)和子基因(60个位点)。重复和未定义的基因座被移除。一个假定的微自噬相关基因的列表(表S2)及相关基因座由[34],并从TAIR获得了其他信息。一个反映微阵列表达式数据的数据矩阵,然后为每个这些列表编译。没有检测到表达数据或没有相关微阵列探针的基因从数据矩阵中移除。使用热图包生成热图(https://github.com/WishartLab/heatmapper)http://www.heatmapper.ca/[76].聚类方法采用平均连锁,距离测量方法采用Pearson相关。维恩图由维尼图(https://bioinfogp.cnb.csic.es/tools/venny/) [77].
图形模型创建
图中描述叶绿体降解途径的模型。8使用在线BioRender软件创建(https://biorender.com/).
数据和材料的可用性
本研究分析的微阵列数据集已提交到基因表达Omnibus数据库,登录号为。GSE71764 (https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE71764).在研究过程中产生和分析的所有其他数据都包含在这篇发表的文章及其补充信息文件中。
缩写
- 1O2:
-
单线态氧
- 质量控制:
-
质量控制
- ROS:
-
活性氧
参考文献
- 1.
浅田。叶绿体中活性氧的产生和清除及其功能。植物科学进展。2006;32(2):391-6。
- 2.
Poljsak B, Šuput D, Milisav I.实现ROS和抗氧化剂之间的平衡:何时使用合成抗氧化剂。《氧化医学细胞》2013;2013:956792。
- 3.
Müller P,李XP, Niyogi KK。Non-photochemical淬火。这是对多余光能的反应。植物科学进展。2001;25(4):344 - 344。
- 4.
杨晓东,张晓明。光系统II光收集天线的分子设计:光合作用和光保护。中国植物学报,2005;26(4):344 - 344。
- 5.
Triantaphylidès C, Krischke M, Hoeberichts FA, Ksas B, Gresser G, Havaux M,等。单线态氧是参与植物光氧化损伤的主要活性氧。植物科学进展。2008;48(2):960-8。
- 6.
陈凯欣,马贝特,彭世华,缪俊伟,李志伟,等。通过失活SAL1磷酸腺苷磷酸酶对叶绿体中氧化应激的感知和信号传递。中国科学:自然科学,2016;29(1):1 - 7。
- 7.
索娟,赵强,陈松,戴松。叶绿体盐度响应的基因表征。国际分子化学杂志,2017;18(5):1011。
- 8.
陆勇,姚洁。叶绿体在光合作用、病原侵染和植物防御的十字路口。中华分子化学杂志,2018;19(12):3900。
- 9.
王建忠,王建忠,王建忠。逆行信号:细胞间通讯的集成器和植物发育的协调器。植物学报,2017;68:85-108。
- 10.
Op Den Camp RGL, Przybyla D, Ochsenbein C, Laloi C, Kim C, Danon A,等。单线态氧释放后快速诱导的不同应力响应拟南芥.植物科学进展。2003;15(10):2320-32。
- 11.
多格拉V,金C.单态氧代谢:从起源到信号。植物科学进展2020;10:1640。
- 12.
伍德森JD。叶绿体胁迫信号:细胞降解和叶绿体周转的调控。《植物生物学》2019;52:30-7。
- 13.
Scharfenberg M, Mittermayr L, Von Roepenack-Lahaye E, Schlicke H, Grimm B, Leister D,等。两种铁螯合酶的功能研究拟南芥.植物细胞环境学报。2015;38(2):280-98。
- 14.
Fernandez JM, Bilgin MD, Grossweiner LI。光动力剂产生单线态氧。光化学与生物工程学报,2001;26(1):1 - 4。
- 15.
Woodson JD, Joens MS, Sinson AB, Gilkerson J, Salomé PA, Weigel D,等。泛素促进了去除受损叶绿体的质量控制途径。科学。2015;350(6259):450 - 4。
- 16.
Alamdari K, Fisher KE, Sinson AB, Chory J, Woodson JD。叶绿体定位的五肽重复蛋白30和“线粒体”转录终止因子9在叶绿体质量控制中的作用。植物学报,2020;36(3):344 - 344。
- 17.
González-Pérez S, Gutiérrez J, García-García F, Osuna D, Dopazo J, Lorenzo Ó,等。强光条件下拟南芥细胞悬浮培养的早期转录防御反应。中国生物医学工程学报。2011;36(3):344 - 344。
- 18.
单线态氧:太阳底下确实有新的东西。化学学报,2010;39(8):3181-209。
- 19.
Dmitrieva VA, Tyutereva EV, Voitsekhovskaja OV。单线态氧在植物中的产生、检测和信号作用。中华分子化学杂志,2020;21(9):3237。
- 20.
Wagner D, Przybyla D, Op Den Camp R, Kim C, Landgraf F, Keun PL,等。单线态氧胁迫反应的遗传基础拟南芥.科学。2004;306(5699):1183 - 5。
- 21.
Barkan A, Small I.植物中的五肽重复蛋白。植物科学进展。2014;35(5):415 - 42。
- 22.
Méteignier LV, gandour R, Zimmerman A, Kuhn L, Meurer J, Zoschke R,等。拟南芥mTERF9蛋白在体内通过建立核蛋白相互作用促进叶绿体核糖体组装和翻译。中国生物医学工程学报(英文版);
- 23.
植物选择性自噬——仍然是一个未知的领域,有很多隐藏的宝石。中国生物医学工程学报,2010;26(1):344 - 344。
- 24.
Izumi M, Nakamura S, Li N.叶绿体自噬翻转在糖饥饿响应中的作用和调控机制。中国植物科学,2019;10:287。
- 25.
国王JS。真核生物的自噬:是酿酒酵母谁是异类?自噬。2012;8(7):1159 - 62。
- 26.
Anding AL, Baehrecke EH。清洁室:细胞器的选择性自噬。生物工程学报。2017;41(1):10-22。
- 27.
泡菜S, Vigié P,有乐RJ。线粒体维持的线粒体自噬和质量控制机制。中国生物医学杂志,2018;28(4):R170-85。
- 28.
张志刚,张志刚,张志刚,张志刚,等。植物发育中的自噬与胁迫响应。自噬。2006;2(1):2 - 11。
- 29.
刘勇,Bassham DC。自噬:植物细胞自食的途径。植物科学进展。2012;
- 30.
文X, Klionsky DJ。酵母巨自噬研究综述。中国生物医学杂志,2016;428(9 pt A): 1681-99。
- 31.
自噬:细胞内稳态和生命的基本退化程序。细胞。2018;7(12):278。
- 32.
杨震,Klionsky DJ。自噬的分子机制综述。微生物免疫学杂志,2009;335:1-32。
- 33.
王晓明,王晓明,王晓明,等。细胞自噬在抗疾病和超敏反应相关细胞死亡中的作用。细胞死亡分化。2011;18(8):1257-62。
- 34.
谢秀科,李志强,李志强。植物微自噬的分子机制研究。细胞。2020;9(4):887。
- 35.
苏涛,李霞,杨敏,邵强,赵颖,马超,等。自噬:调节植物生存和胁迫反应的细胞内降解途径。植物科学进展2020;11:164。
- 36.
微自噬-独特的分子机制处理许多大小的货物。中国生物医学工程学报,2015;29(3):344 - 344。
- 37.
Izumi M, Ishida H, Nakamura S, Hidema J.整个光损伤的叶绿体通过自噬运输到中央液泡。植物学报。2017;29(2):377-94。
- 38.
泉,中村。全受损叶绿体的液泡消化拟南芥是由噬绿作用完成的。自噬。2017;13(7):1239 - 40。
- 39.
中村勇,李志强,李志强,李志强,等。微自噬对植物叶绿体膜损伤的影响。中国生物医学工程学报,2018;29(3):344 - 344。
- 40.
杨菊池,李志强,李志强,等。叶绿体自噬和泛素化结合管理氧化损伤和饥饿反应。中国生物医学工程学报。2020;44(4):531 - 544。
- 41.
姜超,郑卫文,姜永华,金志勇,金东哲,郑志昌,等。AtBAG6是一种新型钙调素结合蛋白,在酵母和植物中诱导程序性细胞死亡。细胞死亡分化。2006;13(1):84-95。
- 42.
任超,刘娟,龚强。自噬在植物碳氮代谢中的作用。植物科学进展(英文版);
- 43.
藤木Y,吉川Y,佐藤T,稻田N,伊藤M,西田I,等。暗诱导基因来自拟南芥与叶片衰老有关,并被糖抑制。植物科学。2001;111(3):345-52。
- 44.
李文杰,李志强,李志强,李志强,等。糖调控基因的鉴定及其在体内糖感的研究进展拟南芥.中国植物学报,2006;26(2):344 - 344。
- 45.
李志强,李志强,李志强,等。的拟南芥硝酸盐转运蛋白NRT2.5在缺氮植物中硝酸盐的获取和再转运中发挥作用。植物学报(自然科学版);2014;30(2):344 - 344。
- 46.
杨敏,卜峰,黄伟,陈磊。植物自噬活性的多重调控水平。中国植物科学,2019;10:532。
- 47.
吉本K,花冈H,佐藤S,加藤T,塔巴塔S,野田T,等。ATG8s(泛素样蛋白)的加工过程以及ATG4s对其解凝作用对植物自噬至关重要。植物学报。2004;16(11):2967-83。
- 48.
和田S,石田H,泉M,吉本K,大隅Y,梅T,等。自噬在叶片衰老过程中对叶绿体的降解起着重要作用。植物科学进展。2009;29(2):344 - 344。
- 49.
石田H,吉本K,泉M,赖森D,矢野Y,牧野A,等。通过ATG基因依赖的自噬过程将Rubisco和叶绿体间质定位的荧光蛋白动员到液泡中。植物科学进展。2008;38(1):344 - 344。
- 50.
汤普生AR, Doelling JH, Suttangkakul A, Vierstra RD.自噬营养循环拟南芥由ATG8和ATG12共轭通路引导。植物科学进展。2005;38(4):344 - 344。
- 51.
Doelling JH, Walker JM, Friedman EM, Thompson AR, Vierstra RD. apg8 /12激活酶APG7是营养循环和衰老所必需的拟南芥.中国生物医学工程学报,2002;27(3):339 - 344。
- 52.
Phillips AR, Suttangkakul A, Vierstra RD. atg12偶联酶ATG10是自噬囊泡形成的必要条件拟南芥.遗传学。2008;178(3):1339 - 53年。
- 53.
Hofius D, Schultz-Larsen T, Joensen J, Tsitsigiannis DI, Petersen NHT, Mattsson O,等。自噬成分有助于超敏性细胞死亡拟南芥.细胞。2009;137(4):773 - 83。
- 54.
Maxwell K, Johnson GN。叶绿素荧光-一个实用指南。中国植物学报,2000;26(4):529 - 529。
- 55.
Baruah A, Šimková K, Hincha DK, Apel K, Laloi C.多向响应位点1 (PRL1)蛋白对1o2介导的逆行信号的调节,应激和能量信号的中心积分器。植物学报,2009;30(1):344 - 344。
- 56.
罗森华瑟,鲁福尔,乔西,利维坦,瑟拉,赫茨罗尼,等。ROSMETER:一种生物信息学工具,用于识别与活性氧种类和起源相关的转录组印迹,为应激反应提供了新的见解。中国生物医学工程学报,2013;29(2):344 - 344。
- 57.
李艳,刘伟,孙晓明,孙晓明。天冬氨酸蛋白酶介导的BAG6蛋白在植物自噬和抗真菌方面的作用。植物学报。2016;28(1):233-47。
- 58.
Kabbage M, Kessens R, Dickman MB.植物bcl -2相关的致病因子被蛋白水解激活以授予真菌抗性。微生物细胞。2016;3(5):224-6。
- 59.
贾敏,刘旭,薛辉,吴勇,石林,王锐,等。非典型ATG8-ABS3相互作用控制植物衰老。植物学报。2019;5(2):212-24。
- 60.
千叶A,石田H, Nishizawa NK,牧野A, Mae T.小麦自然衰老叶片叶绿体中核酮糖-1,5-二磷酸羧化酶/加氧酶的特异性排除。植物生理学报。2003;44(9):914-21。
- 61.
Michaeli S, Honig A, Levanony H, Peled-Zehavi H, Galili G。拟南芥atg8相互作用蛋白1参与自噬依赖的质体蛋白到液泡的囊泡运输。植物学报。2014;26(10):4084-101。
- 62.
王志刚,王志刚。植物细胞自噬的超微结构研究进展。自噬。2013;9(12):1922 - 36。
- 63.
Schuck S, Gallagher CM, Walter P. ER-phagy介导内质网选择性降解独立于核心自噬机制。中国生物医学工程学报,2014;29(4):344 - 344。
- 64.
奥库M,前田Y,鹿桥Y,近藤T,山田M,藤本T,等。ESC RT和网格蛋白依赖微自噬的证据。中国生物医学工程学报,2017;29(4):339 - 344。
- 65.
岩间R,大sumi Y.自噬在酵母细胞碳源可用性变化中激活的分析。中国生物医学工程学报,2019;29(4):539 - 539。
- 66.
张志刚,张志刚,张志刚,张志刚,等。花青素液泡包体是通过微自噬机制形成的。植物学报。2015;27(9):2545-99。
- 67.
Kleinboelting N, Huep G, Kloetgen A, Viehoever P, Weisshaar B. GABI-Kat SimpleSearch的新特性拟南芥T-DNA突变体数据库。核酸决议2012;40(数据库issue): D1211-5。
- 68.
Alonso JM, Stepanova AN, Leisse TJ, Kim CJ, Chen H, Shinn P,等。全基因组插入突变拟南芥.科学。2003;30(5633):653 - 7。
- 69.
会议A, Burke E, Presting G, Aux G, McElver J, Patton D,等。一个高通量拟南芥逆向遗传系统。植物学报。2002;14(12):2985-94。
- 70.
王晓明,王晓明,王晓明,等。铁螯合酶合成血红素对植物核基因表达的调控作用。生物工程学报,2011;21(10):897-903。
- 71.
希利A,费塔多A,库珀T,亨利RJ。协议:一个简单的方法,提取下一代测序质量基因组DNA从顽固的植物物种。植物学报。2014;10:21。
- 72.
中村S, Hagihara S, Otomo K, Ishida H, Hidema J, Nemoto T,等。自噬在叶片线粒体质量控制中的作用。中国生物医学工程学报,2017;29(2):329 - 329。
- 73.
用微孔板阅读器快速测量叶绿素。植物营养学报,2008;31(7):1321-32。
- 74.
Robinson MD, McCarthy DJ, Smyth GK。edgeR:用于数字基因表达数据差异表达分析的Bioconductor包。生物信息学,2009,26(1):139 - 40。
- 75.
Afgan E, Baker D, Batut B, Van Den Beek M, Bouvier D, Ech M,等。用于可访问、可复制和协作生物医学分析的银河平台:2018年更新。核酸研究,2018;46(W1): W537-44。
- 76.
杨晓东,杨晓东,杨晓东,等。热图仪:所有人的网络热图。核酸研究,2016;44(W1): W147-53。
- 77.
Oliveros JC。VENNY。比较维恩图列表的交互式工具。http://bioinfogp.cnb.csic.es/tools/venny/index.html.2021年7月14日访问。
确认
作者感谢泉正典博士(日本理化研究所)的分享UBQ10::GFP-ATG8aDavid Baltrus博士(亚利桑那大学)为叶绿素测量提供了平板阅读器,Kamran Alamdari(亚利桑那大学)为生成转基因提供了技术援助拟南芥植物。
资金
作者承认化学科学、地球科学和生物科学部,美国能源部基础能源科学办公室授予DE-SC0019573,授予j.d.w.的UA核心设施试点项目授予,以及授予M.D.L.的Richard A. Harvill研究生奖学金。资助机构在研究设计、数据收集、分析和解释以及撰写手稿中没有发挥任何作用。
作者信息
从属关系
贡献
MDL, KEF, MAK, DWT和JDW计划并设计了这项研究。MDL进行了所有RT-qPCR、生理生长实验和植物处理。KEF完成了所有的显微实验和样品制备。MAK开发并完成了所有的叶绿素荧光实验。DWT开发并进行叶绿素测定。项目最初的范围由JDW构思并负责管理。MDL和JDW撰写了手稿。所有作者都对数据分析、收集和解释做出了贡献。所有作者都审阅了手稿并批准了最终版本。
相应的作者
道德声明
伦理批准并同意参与。
不适用。
发表同意书。
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:figure1。
GFP-ATG8a与叶绿体共定位。FigureS2。的验证atg5,atg7,atg10的空突变fc2-1背景。图S3。表型的atg5,atg7,atg10单突变苗。图S4。植物光合效率的评价atg单身,fc2 atg双突变体。图S5。表型的atg5,atg7,atg10单个突变成体植物。
附加文件2:表S1。
热图生成中使用的自噬相关基因和表达数据列表。表S2。用于热图生成的预测微自噬相关基因和表达数据列表。表S3。本研究中使用的突变体。TableS4。本研究使用的引物。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
Lemke,医学博士,Fisher, k.e., Kozlowska,医学硕士et al。核心自噬机制在叶绿体单线态氧介导的细胞死亡中不是必需的拟南芥质体铁螯合酶2突变体。BMC植物生物学21,342(2021)。https://doi.org/10.1186/s12870-021-03119-x
收到了:
接受:
发表:
关键字
- 非生物胁迫
- 自噬
- 细胞退化
- 叶绿体
- Microautophagy
- 氧化应激
- 光合作用
- 活性氧
- 信号
- 单线态氧