抽象的
背景
TLPs在真核生物中广泛存在,在动植物中高度保守。TLP参与了许多生物过程,如生长、发育、生物和非生物胁迫反应,但其潜在的分子机制尚不清楚。在本文中,我们对黄瓜(Cucumis巨大成功l .)在拟南芥.
结果
在黄瓜中,表达丁香蛋白的表达CsTLP8NaCl处理诱导,PEG(聚乙二醇)和ABA(脱落酸)处理降低。亚细胞定位和转录激活活性分析表明,CsTLP8具有经典转录因子的两个特征:核定位和反式激活活性。酵母双杂交实验显示CsTLP8与CsSKP1a和CsSKP1c相互作用,提示CsTLP8可能是E3泛素连接酶的一个亚基。异位表达酵母的生长活性CsTLP8低于NaCl和甘露醇治疗的对照。在渗透和盐胁迫下,过表达CsTLP8抑制种子萌发和生长拟南芥幼苗生长过程中,MDA(丙二醛)含量升高,SOD(超氧化物歧化酶)、POD(过氧化物酶)和CAT(过氧化氢酶)活性降低拟南芥幼苗。过度的CsTLP8在种子萌发和ABA介导的气孔关闭过程中也增加了对ABA的敏感性。
结论
在渗透胁迫下,CsTLP8通过影响抗氧化酶活性抑制种子萌发和幼苗生长。CsTLP8在渗透胁迫中起负调控作用,其作用可能与ABA有关。
背景
tubby.是在肥胖的肥胖小鼠的菌株[1,2].tlp在真核生物中广泛存在[3.].TLP含有约270-氨基酸的官域在CoOH末端,其结构含有12个抗平行β桶和中间疏水性α螺旋[4].北半球2TLPs的-末端序列在动物中差异很大,但在植物中是保守的,大多数植物TLPs在NH中含有一个保守的F-box结构域2终端(3.].SKP1 (s相激酶相关蛋白1)、CUL (Cullin)、RBX1 (RING-box蛋白1)和F-box蛋白可形成SCF复合物[5,6是E3泛素连接酶的重要组成部分。在拟南芥和小麦,已确认attlps和tatulps与特定的skp1样蛋白相互作用[7,8,9,10这些发现表明植物TLPs可能作为SCF复合物的亚基发挥作用。在哺乳动物中,tubby样蛋白构成了一个独特的转录调控家族[4],作为Tubby结合双链DNA的cooh末端区域,和NH2Tubby和TULP1的-末端区域激活转录。在植物中,attlp和CaTLP1缺乏自动激活活性[7,11],但CaTLP1与双链DNA结合[11,提示CaTLP1可能是一个转录因子。
以前的研究已经评估了TLP在植物中对生物和非生物胁迫的反应的效果。在米饭中,所有OsTLPs可能涉及植物与病原体的相互作用[12],此外,OsTLP2可以结合到OsWRKY13,它编码了一种在水稻抵抗细菌感染中很重要的激活剂[13,提示OsTLP2可能作为一个转录因子调控生物的耐受性。在咖啡和甘蔗中张力腿平台在应对生物压力方面发挥作用[14,15].
据报道,在苜蓿、大麦、玉米、木薯、苹果和鹰嘴豆中,TLPs在响应非生物胁迫处理或激素处理中发挥作用[11,16,17,18,19,20.].Ectopically表示MdTLP7增加的生长活性大肠杆菌在NaCl, KCl,冷却和热处理下[21,过度表达全长或截短MdTLP7(只含管状域)增强了对应力的耐受性拟南芥非生物应激[22),这表明MdTLP7响应非生物应激和托管域的功能MdTLP7在这一反应中起着关键作用。的表达CaTLP1由脱水、高盐度和ABA [11].过度的CaTLP1增加了对烟草的耐受性拟南芥非生物压力[11,23].进一步的研究表明,CaTLP1通过与蛋白激酶相互作用调控aba介导的基因表达和气孔关闭[23].attlp3从甘露醇,NaCl或H下的血浆膜释放2O2,提示AtTLP3在应对渗透胁迫中起作用[7,24].
TLP除了应对生物和非生物胁迫外,还在植物的生长发育中发挥作用。AtTLP9在种子萌发过程中起作用,参与ABA信号通路[9], AtTLP3与AtTLP9在ABA和渗透胁迫介导的种子萌发中存在冗余功能[7].过度的CaTLP1改善了茎和根的结构,表明了一个关键的作用CaTLP1在植物发育中[11].AtTLP2调节同半乳糖酸的生物合成[25的主要多糖成分拟南芥种子外套粘液[26],可能是通过正向激活udp -葡萄糖4-异丙基酶1 [25].ATTLP11与ATNHL6互动,AtTLP11和AtNHL6在种子萌发过程中表现出拮抗基因表达[27].AtNHL6在非生物胁迫诱导的ABA信号转导和生物合成中的作用,特别是在幼苗发育和种子萌发早期[27,28], AtTLP11可能通过调控AtNHL6发挥作用。SCTLP12.被认为是黑麦中负责叶卷的基因[29].张等人。探索了表达SLTLPS.在番茄水果中发现的SlTLP1,SlTLP2,SlTLP4和SlTLP5, SlTLP1和SlTLP2可能在乙烯依赖的果实成熟过程中发挥作用[30.].我们以前的作品意味着SlTLFP8通过核内复制调控气孔密度及其对缺水抗性和水分利用效率的影响[31].
种子萌发是高等植物生命周期的关键过程,并且在植物中发挥作用作用适应各种环境条件,同时,通过外部和内部线索如诸如光,温度,水,氧气,植物如外部和内部提示严格调节种子萌发激素aba和ga [32,33,34].其中,植物激素脱落酸(ABA)是抑制种子萌发的重要信号[35].干旱和盐胁迫是常见的限制种子萌发的因素。干旱和盐胁迫通过减少水的吸胀,包括活性氧(活性氧)的积累,改变酶的活性,并导致激素失衡,从而影响种子的萌发过程[36,37,38].
在这项研究中,我们发现CsTLP8对PEG、NaCl和ABA处理的转录反应。过度的CsTLP8NaCl和甘露醇处理对酵母细胞生长有抑制作用。过度的CsTLP8抑制种子萌发和生长拟南芥在渗透和盐胁迫下的幼苗,并增加了ABA敏感性拟南芥。在ABA、甘露醇和NaCl处理下,大豆的过表达CsTLP8增加了MDA含量,降低了SOD、POD和CAT活性拟南芥幼苗。这些结果表明,CsTLP8通过影响抗氧化酶活性,在盐胁迫和渗透胁迫反应中起负调控作用。亚细胞定位和反式激活实验表明CsTLP8是一个转录因子,酵母双杂交实验表明CsTLP8与CsSKP1a和CsSKP1c相互作用,提示CsTLP8可能也是E3泛素连接酶。
结果
CsTLP8表达对非生物胁迫有反应
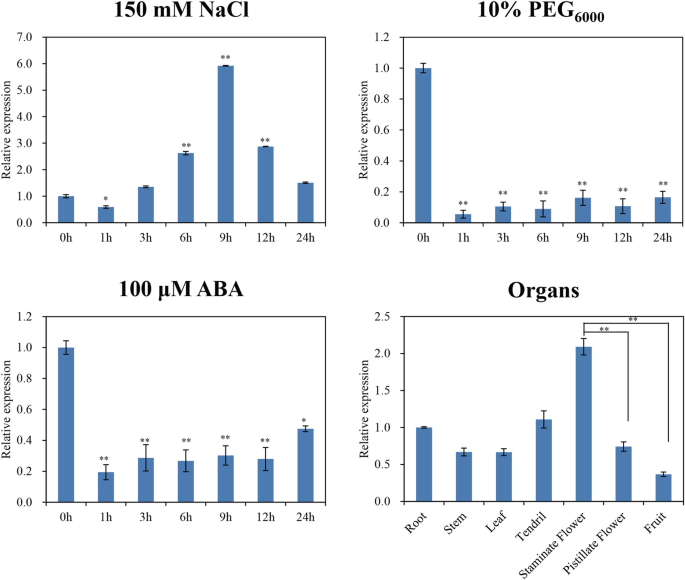
研究…的作用CsTLP8对黄瓜在非生物胁迫下的表达进行了分析CsTLP8在NaCl、PEG和ABA处理下。的表达水平CsTLP8在NaCl处理后9小时上调约六倍(图。1a),并在两种PEG处理下均降低(图。1b)和ABA处理(图。1c).有趣的是CsTLP8ABA和PEG处理的差异无统计学意义。接下来我们探讨的表达模式CsTLP8在七个器官(根,茎,叶,雄蕊花,雌蕊花和果实)。结果表明,CsTLP8在所有被测器官中均有表达,CsTLP8雄蕊花中表达量最高,果实中表达量最低,而CsTLP8在营养器官中差异显著,而在生殖器官中差异显著。1d)。
CsTLP8的结构特点
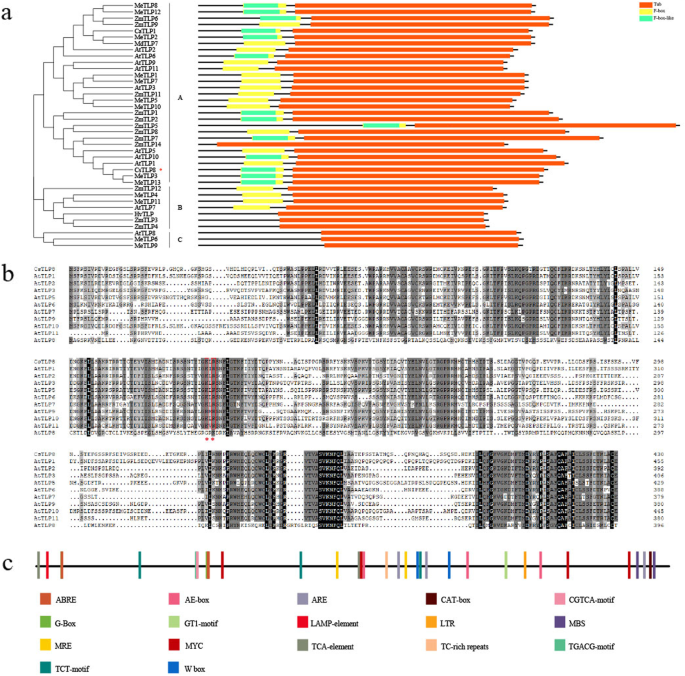
为了更好地理解其转录调控CsTLP8的上游序列提取2000 bpCsTLP8并搜索PlantCare数据库以识别CIS-Elements。这CsTLP8启动子中含有多种顺式作用元件,包括应激反应元件:TC-rich repeats(防御和应激反应)、MBS(干旱反应)、GT-1 motif(盐反应)、LTR(温度反应)、ARE(厌氧诱导);激素反应元件:tca -元件(水杨酸反应)、ABRE(脱落酸反应)、TGACG/CGTCA-motif(茉莉酸甲酯反应);光响应元件:G-Box、MRE、AE-box、TCT-motif和lamp -元件(图1)2c)。
为了更好地了解CsTLP8的功能,我们分析了其结构特征。保守结构域分析表明,CsTLP8在NH中存在一个F-box结构域2-末端区域和cooh末端的管状结构域(图。2a). CsTLP8的三维模型显示了一个高度保守的管状结构域,由一个封闭的12股β桶和一个中心的α螺旋组成(图S)1),Tubby域的典型结构。系统发育分析表明,CSTLP8属于A组,并在具有METLP3和METLP13的疏水板中聚集(图。2a). NH中F-box区域的存在2-末端区提示CsTLP8可能是SCF复合体的一个亚基。CsTLP8与attlp的多序列比对显示,CsTLP8含有一个保守的PIP2磷脂酰肌醇4,5 -二磷酸)结合位点(Lys188./参数190)(图。2b),其先前显示在Tubby的质膜定位中发挥核心作用[39]和attlp3 [24],提示CsTLP8可能位于质膜。
CsTLP8的亚细胞定位和反式激活活性
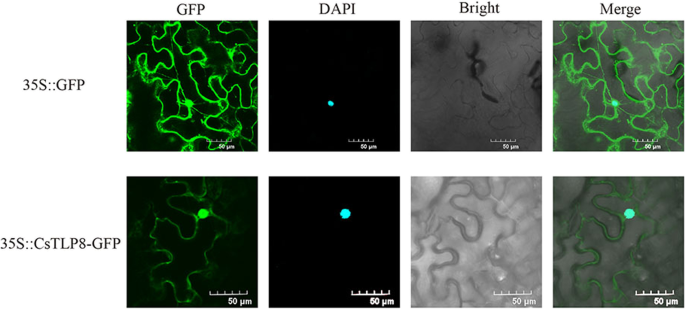
为了进一步研究CsTLP8的功能,我们检测了CsTLP8在烟草叶片中的亚细胞定位。CsTLP8- gfp融合蛋白在质膜和细胞核中可见荧光,表明CsTLP8定位于质膜和细胞核(图。3.),这与我们的猜想一致。
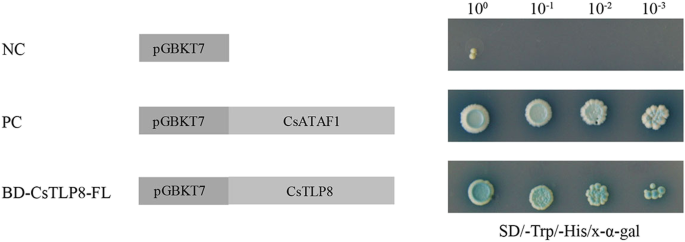
为了检测CsTLP8是否具有转录激活功能,我们采用酵母单杂交法分析了CsTLP8的潜在转录激活活性。培养3 d后,pGBKT7-转化酵母细胞CsTLP8或pGBKT7 -Csataf1.(阳性对照)在SD/-Trp/-His/X-α-gal培养基中存活良好,呈蓝色,表明报告基因被激活(图2)。4).这一结果表明CsTLP8具有自激活活性,结合CsTLP8的核定位,CsTLP8可能在黄瓜中发挥转录因子的作用。
携带CSTLP8的酵母菌株的生长性能在渗透和盐胁迫下降低
评估CSTLP8在渗透和盐胁迫下的作用,CsTLP8在渗透胁迫和盐胁迫下,通过斑点试验检测了转基因酵母细胞的生长性能。正常条件下,pYES2-转化酵母细胞的生长性能无显著差异CsTLP8或空向量pyes2(控制)(图。5一种)。但是,增长CsTLP8-过表达酵母细胞在添加250 mM NaCl或300 mM甘露醇的培养基上比对照弱(图2)。5B-c),表明过度表达CsTLP8显著降低了酵母细胞的非生物胁迫耐受性。
过度的CsTLP8降低了种子萌发过程中对渗透和盐胁迫的耐受性拟南芥
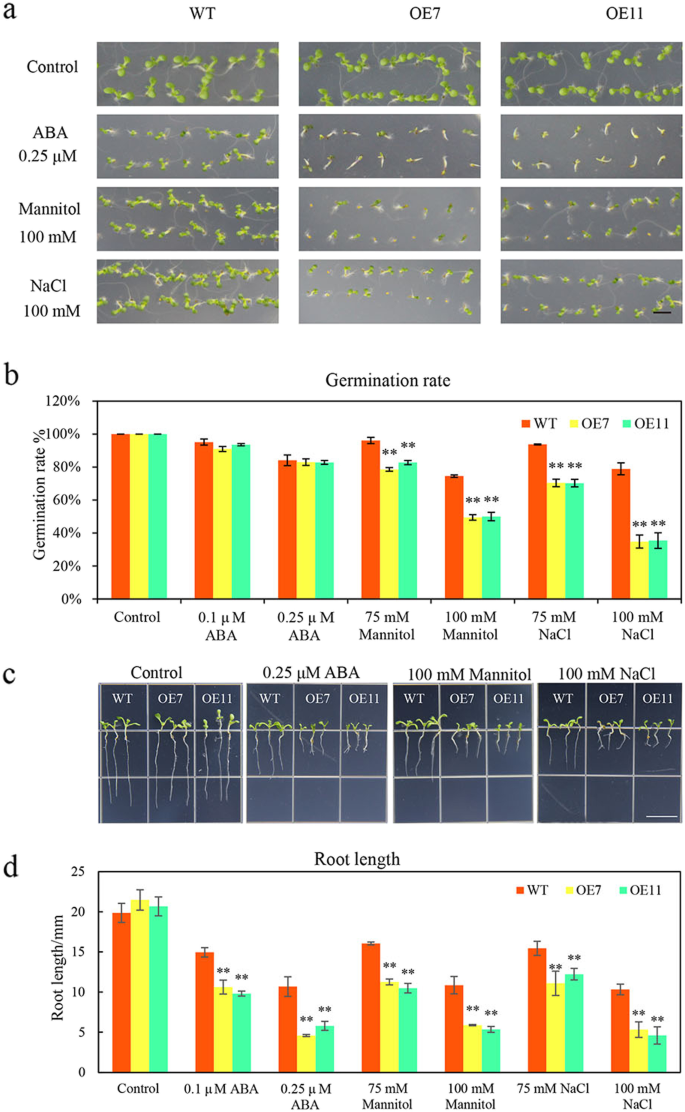
为进一步研究其生物学功能CsTLP8,异位表达的编码序列CsTLP8在野生型拟南芥(Col-0)。选择转基因株系OE7和OE11进行进一步研究(图S2).如上所示,表达CsTLP8对PEG和NaCl处理有响应,异位表达CsTLP8在渗透和盐胁迫下酵母细胞的生长性能下降。因此,我们在添加了不同浓度甘露醇和NaCl的MS培养基上测定了野生型植物和转基因株系的种子萌发和幼苗根长。在正常条件下,转基因株系的幼苗生长和种子发芽率与野生型相似。6).在甘露醇和NaCl处理下,转基因株系对种子萌发和幼苗生长的抑制比野生株系更显著。在含75 mM甘露醇的培养基上,野生型和2个转基因品系的发芽率分别为96%、78%和82%(图S3和图。6b),根长分别为16.0 mm、11.3 mm和10.5 mm(图S3.和无花果。6c - d)。随着甘露醇浓度的增加,对种子萌发的抑制作用增强。在含100 mM甘露醇的培养基上,野生型和2个转基因品系的发芽率分别为74%、49%和50%(图2)。6a-b),根长分别为10.7 mm、5.9 mm和5.3 mm(图3)。6c - d)。在75 mM NaCl处理下,野生型和转基因株系的发芽率分别为93%、70.4%和70.2%(图S3和图。6b),野生型和转基因株系根长分别为15.5 mm、11.0 mm和12.2 mm(图S3.和无花果。6c - d)。在100mM NaCl,34%-38%的转基因系种子发芽,而78%的野生型种子发芽(图。6A-B)和野生型和转基因系的根长度分别为10.3mm,5.3mm和4.6mm(图。6c - d)。所有这些结果表明,CSTLP8在种子萌发过程中发挥作用和幼苗生长拟南芥.
过度的CsTLP8增加ABA的敏感性拟南芥
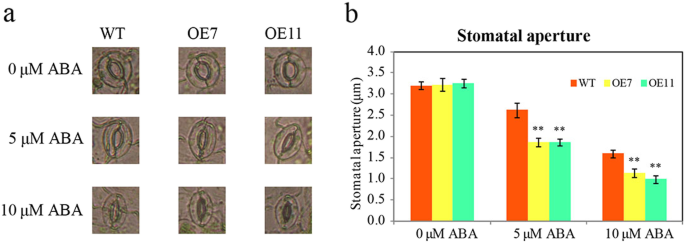
作为CsTLP8对ABA处理的响应,接下来我们测量了转基因株系对ABA的响应。我们以种子发芽率、幼苗根长和气孔孔径作为ABA敏感性的指标。野生型和转基因系种子在添加不同浓度ABA的MS培养基上萌发。在正常条件下,转基因株系的种子发芽率和幼苗生长与野生型相似。随着ABA浓度的增加,种子发芽率降低,对幼苗生长的抑制作用增强。转基因株系与野生型幼苗生长差异显著,但种子发芽率差异不显著CsTLP8过表达植物和野生型(图。6A-B和图4. S3.).在0.1 μM ABA下,野生型的根长是转基因株系的1.4 ~ 1.5倍(图S3.和无花果。6c - d)。0.25 μM ABA时,幼苗生长差异更显著,野生型根长是转基因株系的1.8 ~ 2.3倍(图2)。6c - d)。为了进一步检查CSTLP8至ABA反应的功能,我们在转基因植物中测量了对转基因植物的气孔孔,以及伴随ABA的野生型植物。在没有ABA的情况下,所有线条的气孔孔隙孔都没有差异,但ABA治疗导致转基因素中的气孔闭合增加,在5μmaba存在下,野生型气孔孔径为1.4-1.5倍转基因素;在10μm的Aba存在下,野生型气孔孔径为转基因素的1.5-1.6倍(图。7).这些数据表明CSTLP8积极调节ABA依赖的气孔运动。这些结果表明过表达CsTLP8增加了对ABA的敏感性拟南芥。
过度的CsTLP8降低体内抗氧化酶活性拟南芥在渗透和盐胁迫下幼苗
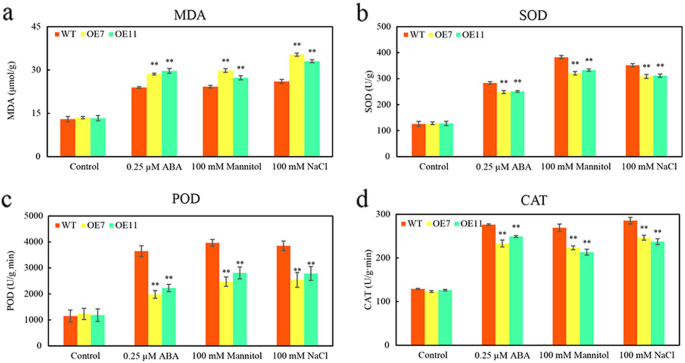
通过测定ABA、甘露醇和盐处理后的MDA含量及SOD、POD、CAT活性,探讨其生理变化。正常条件下,野生型与转基因株系MDA含量无显著差异;在ABA、甘露醇和盐处理下,野生型和转基因株系的MDA含量均有所增加,且野生型的MDA含量显著高于转基因株系(图2)。8a).正常条件下,野生型与转基因株系SOD、POD和CAT活性无显著差异;在ABA、甘露醇和盐处理下,所有品系的SOD、POD和CAT活性均升高,且转基因品系的SOD、POD和CAT活性显著高于野生型(图2)。8b-8c)。
过度的CsTLP8降低体内抗氧化酶活性拟南芥渗透和盐胁迫下的幼苗。(一个) 0.25 μM ABA、100 mM甘露醇和100 mM NaCl处理下野生型和转基因株系丙二醛(Malondialdehyde)含量的变化。(b)野生型和转基因株系在0.25 μM ABA、100 mM甘露醇和100 mM NaCl处理下SOD(超氧化物歧化酶)活性。(c)在0.25μmaba,100mm甘露醇和100mM NaCl处理下的野生型和转基因系中的荚(过氧化物酶)的活性。(d)在0.25 μM ABA、100 mM甘露醇和100 mM NaCl处理下,野生型和转基因品系CAT(过氧化氢酶)活性的变化。值为平均值±标准差(n= 3), *P< 0.05或**P< 0.01,多次试验邓肯氏试验
CsTLP8与CsSKP1a和CsSKP1c相互作用
我们对酵母双杂交测定进行了询问CSTLP8是否可以与CSSKP1S作为F型盒蛋白相互作用。结果表明,CSTLP8可以与CSSKP1A和CSSKP1C交互(图。9),提示CsTLP8可能是SCF复合物的一个亚基F-box蛋白,参与了靶蛋白的降解。
讨论
CsTLP8此前被鉴定为干旱相关基因,在干旱敏感品种中表达较高[40].在我们的研究中,我们发现CsTLP8对盐和渗透胁迫的反应(图。1),过度CsTLP8显著降低了酵母细胞对盐和渗透胁迫的抗性(图。5),抑制种子萌发和幼苗生长CsTLP8盐和渗透胁迫下的过表达植物(图。6和无花果。3.).这些发现暗示着CsTLP8参与种子萌发和育苗过程中的非生物胁迫反应。种子萌发过程分为三个主要阶段,分别受激素、活性氮和ROS的调控[41].ROS作为信号分子调控植物的生长发育,但过量的ROS会破坏种子中的DNA、蛋白质、脂质等大分子结构。因此,清除ROS是胁迫条件下种子萌发的关键[42,43].ROS可诱导脂质过氧化,导致MDA的产生。在我们的研究中,MDA的含量作为氧化应激的标志,我们发现过表达CsTLP8增加了体内的氧化应激水平拟南芥渗透和盐胁迫下的幼苗。另一方面,过度表达CsTLP8降低抗氧化酶的活性拟南芥渗透和盐胁迫下的幼苗。这些结果表明CsTLP8可能通过影响抗氧化酶活性来调控非生物胁迫下种子的萌发。ABA作为一种重要的植物激素,在植物种子休眠和萌发、根系生长、幼苗发育以及对环境胁迫的适应性响应等诸多方面发挥着关键作用。过度的CsTLP8增加了对ABA的敏感性拟南芥,如幼苗根长较短,气孔孔径较小(图2)。6,7和无花果。3.).
顺式调控元件在基因表达调控中起着关键作用CsTLP8启动子区包含各种胁迫和激素反应元件(图。2c).盐和PEG处理下观察到的不同表达模式(图。1A-1b)表示CsTLP8在不同的胁迫信号下,可以被不同的转录因子通过结合不同的顺式作用元件来调控。在拟南芥,AtTLP3和AtTLP9种子萌发和幼苗早期发育的冗余功能[7].的表型AtTLP3基因敲除突变体和AtTLP3和AtTLP9双突变体在ABA和渗透胁迫下萌发与植物过表达相反CsTLP8,这意味着CsTLP8在种子萌发过程中起着类似的作用AtTLP3和AtTLP9.系统进化树分析将CsTLP8与MeTLP13和MeTLP3聚在一个分支中,有趣的是,CsTLP8的表达模式CsTLP8在NaCl处理下(图1A)与…相似metlp3.正如Dong等人所描述的[19].
结构特征分析和三维模型显示,CsTLP8是一个典型的植物TLP(图。2a)、多重序列比对显示CsTLP8具有一个保守的PIP2结合位点(图2)。2b),说明CsTLP8可能位于质膜上,如图所示的结果证实了这一点。3..Tubby- pip2的结合是可逆的,因为Tubby可以与Gα相互作用问G-蛋白的子集,导致从质膜中释放Tubby并使其转向核[39].在拟南芥,AtTLP2可与NF-YC3 (Nuclear Factor Y subunit C3)相互作用,并易位入核[25].在甘露醇、NaCl和H2O2治疗 [7],脱水胁迫诱导CaTLP1在细胞核内积累[11].
在我们的研究中,我们证实了CsTLP8具有反式激活活性(图。4),并结合CsTLP8的核定位(图。3.),推测CsTLP8可能在黄瓜中起转录因子的作用。大多数植物TLPs包含一个F-box结构域,如CsTLP8。以往研究表明,大多数attlp (AtTLP1、3、6、9、10、11)和TaTULP1、TaTULP3、TaTULP4)都能与特定的ask (拟南芥skp1样蛋白)/ TaSKPs [8,10].与这些发现一致的是,我们的研究表明CsTLP8可以与CsSKP1a和CsSKP1c相互作用(图2)。9),提示CsTLP8可以作为SCF复合物的一个亚基,在靶蛋白的转录后调控中发挥作用。综上所述,CsTLP8不仅参与转录调控,还参与转录后调控。这并不是唯一的,因为MAP激酶ERK5在NH中有一个激酶结构域2-末端区域和cooh末端区域的转录激活域和核定位信号,使该蛋白通过磷酸化或与转录因子的相互作用来调节细胞核上的转录[44].在小鼠中,UBE3A被称为E3泛素连接酶,已经确定了几个靶标,UBE3A还通过与IRF(干扰素调节因子)的相互作用作为核受体家族的转录调节因子[45].
在棉花中,表示GhERF38由盐和干旱治疗令人抑制,并过度表达GhERF38在拟南芥减少植物对盐和干旱胁迫的耐受性[46].的表达Abi4.ABA信号通路的关键转录因子ab4在盐胁迫下被诱导,ab4负调控ABA的耐盐性拟南芥(47].的表达式GmLHY1a和GmLHY1b均由干旱胁迫诱导,GmLHY1a和GmLHY1b负调控大豆耐旱性[48].以上结果表明,胁迫反应基因在胁迫条件下表达上调,可能是负调控因子。这与我们的研究结果一致,即CsTLP8但过表达系对盐胁迫的敏感性增加。WRKY25,WRKY26,和WRKY33通过积极调节HSPs和MBF1c通路之间的合作,介导热应激反应[49而WRKY33-PIF4调控环也介导H2O2表明WRKY33通过不同的信号通路对不同的应激反应[50].同样,CsTLP8可能作为转录因子或F-box蛋白发挥作用,这可能使CsTLP8参与不同的信号通路,响应不同的胁迫。
结论
在研究中,我们发现CsTLP8ABA胁迫和渗透胁迫对种子萌发的影响。进一步证实CsTLP8通过影响抗氧化酶活性调控渗透胁迫介导的种子萌发,并参与ABA信号通路。此外,我们还发现CsTLP8可以作为一个转录因子和SCF复合物的一个亚基。我们的工作为研究CsTLP8响应非生物胁迫的分子机制提供了新的思路。我们的工作为研究CsTLP8响应非生物胁迫的分子机制提供了新的思路。我们将进一步探索CsTLP调控种子萌发和响应干旱和盐胁迫的分子机制。
材料和方法
样品制备及总RNA提取
黄瓜幼苗(Cucumis巨大成功L. Jinyan 4,天津黄瓜研究所,中国天津。本试验使用的所有材料均已获得许可)在山崎培养基中生长,在生长室中(光周期:16 h光照/8 h黑暗;温度:24°C亮/18°C暗;光强:约125 μmol m−2年代−1;相对湿度:约60%)。研究…的表达CsTLPs在非生物胁迫下,用150 mM NaCl、10% PEG处理3周龄黄瓜幼苗6000,或100 μM ABA处理0 h, 1 h, 3 h, 6 h, 9 h, 12 h和24 h。收集3个单株植株的叶片,根据我们之前公布的方案提取总RNA [51].
定量实时聚合酶链反应
采用赵等人的方法进行实时定量PCR (qPCR) [52].基本上,在7500个实时PCR系统(Applied Biosystems)上进行QPCR,2−△△CT使用量化方法,和CsActin作为内控基因。
克隆和序列分析CsTLP8
的全长编码序列CsTLP8引物对黄瓜cDNA进行PCR扩增,引物列于Supplementary Table S1.用MEGA5进行系统发育分析。用DAMAN进行多次对准分析。使用PFAM数据库进行分析保守域(http://pfam.xfam.org/).使用TBtools重新绘制系统发育树和保守结构域。CsTLP8的三维模型采用SWISS-MODEL (https://swissmodel.expasy.org).利用在线程序PlantCARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/search_CARE.html).
CsTLP8的反式激活分析
CsTLP8编码序列插入pGBKT7载体(Addgene, Cambridge, MA, USA)。酵母菌株Y2H Gold [53]转化为pGBKT7-CsTLP8pGBKT7 -Csataf1.(积极的控制)54,或空载体pGBKT7(阴性对照),如Ma等[55].在SD/-Trp/-His/X-α-gal平板上进行标记。
CsTLP8的亚细胞定位
编码序列CsTLP8(无终止密码子)将CaMV 35S和GFP插入pCAMBIA1302载体(Addgene, Cambridge, MA, USA)。将重组载体和空载体pCAMBIA1302(对照)导入根癌土壤杆菌然后转移到烟叶中。采用荧光共聚焦显微镜(FV1000, Olympus)对转基因烟草的下轴表皮进行了亮场分析。细胞核用DAPI (Sigma-Aldrich, D9542)染色。
酵母2台混合动力分析
编码序列CsTLP8和CsSKP1s分别插入pGADT7 (Addgene, Cambridge, MA, USA)和pGBKT7载体,pGADT7- cstlp8 + pGBKT7- csskp1、pGADT7- t + pGBKT7-53(阳性对照)和pGADT7- cstlp8 + pGBKT7(阴性对照)共转化酵母Y2H Gold细胞[56].在DDO培养基(SD/-Leu/-Trp)上筛选转化的酵母菌落。将生长在DDO培养基上的转化菌单菌落转移到添加X-α-gal的QDO培养基(SD/-Trp/-Leu/-His/-Ade)中。
酵母异位表达试验
编码序列CsTLP8插入pYES2载体(Addgene, Cambridge, MA, USA)。酵母株W303 [57]用重组载体或空载体pYES2转化。生长试验按照Ye等人的描述进行[58],在添加250 mM NaCl或300 mM甘露醇的YPDA(酵母蛋白胨葡萄糖腺嘌呤)培养基上滴下不同稀释倍数的10 μl酵母培养物。30℃培养72 h后,观察并记录酵母细胞的生长情况。
质粒建设和拟南芥转型
的开放式阅读框架CsTLP8将重组质粒插入pBI121载体(Addgene, Cambridge, MA, USA),然后将重组质粒整合到哥伦比亚野生型拟南芥(Col-0)根癌土壤杆菌(C58)介导的转换。通过对卡那霉素的抗性和PCR扩增鉴定转基因株系(图S2).选择转基因株系OE7和OE11进行进一步研究。
表型分析
如前所述进行种子萌发[59].在不添加或添加不同浓度ABA、NaCl或甘露醇的半强度MS培养基上播种50粒不育种子。种子在4℃黑暗条件下层积3 d后转入生长室(光周期:16 h光照/8 h黑暗;温度:22°C亮/18°C暗;光强:80 μmol m−2年代−1;相对湿度60%)。在萌发7天后,计算种子的发芽率。将种子在半强MS培养基上播种4 d后,转移到含不同浓度ABA、NaCl或甘露醇的半强MS培养基上播种7 d,然后测定根长。
丙二醛含量及抗氧化酶活性测定
拟南芥种子在半强MS培养基上播种4 d后,转入添加不同0.25 μM ABA、100 mM NaCl或100 mM甘露醇的半强MS培养基,7 d后采集幼苗,测定MDA含量和抗氧化酶活性。根据Qi等的方法测定脂质过氧化指标丙二醛(MDA)的含量[60,简单地说,样品在磷酸盐缓冲溶液中均质,然后上清液与5% TBA(硫代巴比妥酸)在100℃下孵育10分钟。在600、532和450 nm处分析吸光度。根据Zhang等人的方法,通过监测NBT (Nitro-blue Tetrazolium)在560 nm处的吸光度降低来测定SOD活性[61].通过监测H的消失来确定猫活动2O2在240 nm处,根据Zhang et al. [61].根据Zhang等人的方法,通过监测Guaiacol的氧化来确定POD活性。(61].
气孔孔径生物测定
气孔孔径的测量如前所述[54].简单地,收集3周龄植株完全展开的莲座叶片,在缓冲溶液(50 μM CaCl)中培养2,10mM KCl,10mM MES(2-(正质氨基)乙磺酸),pH6.0)为2.5小时。然后用aba治疗叶子2小时。随后,在光学显微镜(OLYMPUS-IX71)下剥离并观察到亚轴表皮。使用图像J测量气孔孔,针对每个样品测量100个气孔。
引物列表
本研究使用的引物列于附录表S1.
统计分析
每个试验重复3次,采用SPSS 18.0软件(IBM Corp. Armonk, NY, USA)对数据进行邓肯多范围检验(Duncan 's multiple range test, P < 0.05)。
数据和材料的可用性
本研究中描述的基因的序列数据可以使用补充表S中列出的登录号来获得2.本研究过程中产生或分析的所有数据均包含在本发表的文章及其补充信息文件中,并可在合理要求下由通讯作者提供。
缩写
- 阿坝:
-
脱落酸
- 问:
-
拟南芥Skp1样蛋白
- 猫:
-
过氧化氢酶
- CUL:
-
Cullin
- DAPI:
-
4, 6-Diamidino-2-phenylindole
- IRF:
-
干扰素调节因子
- MDA:
-
Malonaldehyde
- 市场经济地位:
-
(2) - N-morpholino ethanesulfonic酸
- NBT:
-
硝基蓝四唑鎓
- NF-YC3:
-
核因子Y亚基C3
- 挂钩:
-
聚乙二醇
- PIP2:
-
磷脂酰肌醇4,5-bisphosphate
- 圆荚体:
-
过氧化物酶
- QPCR:
-
定量实时聚合酶链反应
- RBX1:
-
戒指盒蛋白1
- ROS:
-
活性氧
- SOD:
-
超氧化物歧化酶
- SKP1:
-
s相激酶相关蛋白1
- TBA:
-
硫代巴比土酸
- 张力腿平台/教授:
-
Tubby-like蛋白质
参考文献
- 1.
李俊杰,李俊杰,吴勇等。小鼠肥胖基因tubby的鉴定和特征:一个新基因家族的成员。细胞。1996;85:281 - 90。
- 2.
NobenTrauth K, Naggert JK,北马,西奈总理。小鼠突变的候选基因。大自然。1996;380:534-8。
- 3.
刘QP。水稻粗球样基因的鉴定及其进化。2月j . 2008; 275:163 - 71。
- 4.
基于结构和功能分析的蛋白质作为转录因子的意义。科学。1999;286:2119-25。
- 5.
白C,Richman R,EllEdge SJ。人体cyclin-f。Embo J. 1994; 13:6087-98。
- 6.
F-box蛋白在植物生物学中的作用。足底。2020;251:31。
- 7。
包勇,宋伟,金勇,姜超,杨勇,李波,等。拟南芥胞状蛋白及AtTLP3和AtTLP9在植物对ABA和渗透胁迫应答中的冗余功能中国农业科学(英文版)。
- 8。
赖志强,王志强,王志强。拟南芥管状蛋白与ASK蛋白的互作分析。机器人钉。2012;53:447-58。
- 9。
赖清平,李春林,陈鹏飞,吴绍生,杨春成,邵建华。拟南芥tubby样蛋白基因家族的分子分析。植物杂志。2004;134:1586 - 97。
- 10.
小麦Tubby-like蛋白与SKP1-like蛋白的相互作用。基因学报。2015;90:293-304。
- 11.
等。鹰嘴豆中CaTLP1的过表达(中投arietinumL.),提高抗压能力。植物营养与肥料学报。2012;29 (4):429 - 434
- 12.
寇y,邱d,王l,李X,王S.水稻类蛋白基因家族的分子分析及其对细菌感染的反应。植物细胞代表2009; 28:113-21。
- 13.
Cai M,邱D,元T,丁X,李H,Duan L等。鉴定新型病原体响应性CIS-元素及其在OSWRKY13启动子中的结合蛋白,该基因调节水稻抗性抗性。植物,细胞环境。2008; 31:86-96。
- 14.
Albuquerque E,Petitot A,Da Silva J,Grossi-de-SA M,Fernandez D.咖啡免疫相关基因的早期响应到根结线虫感染。physiol mol植物疗法。2017; 100:142-50。
- 15.
Muthiah M,ramadass A,Amalraj Rs,Palaniyandi M,Rasappa V.甘蔗x中转录因子(TFS)的表达分析刺盘孢属falcatum交互。植物化学学报。2013;22:286-94。
- 16.
Gharaghani F,Rafiei F,Mirakhorli N,Ebrahimie E.TLP,ERF1和R2R3MYB的差异表达,在盐度条件下的每年Medicago物种。genet mol res。2015; 14:10152-64。
- 17。
Janiak A, Kwasniewski M, Sowa M, Kuczynska A, Mikolajczak K, Ogrodowicz P, et al.;轻度干旱胁迫下大麦根的转录组研究及基因表达调控机制国际分子生物学杂志。2019;20:6139。
- 18。
陈Y,戴W,太阳B,赵Y,马问:全基因组鉴定和比较分析TUBBY-like蛋白基因家族的玉米。基因与基因组学。2016;38:25-36。
- 19。
董敏,范晓东,庞晓东,李玉霞。木薯多功能蛋白基因家族的解密。AoB植物。2019;11:plz075
- 20.
徐继,兴S,张Z,陈X,王X.Malus domeiventa基因组中丁香样蛋白家族的基因组鉴定及表达分析。前植物SCI。2016; 7:1693。
- 21.
关键词:苹果,肥胖样基因MdTLP7,非生物胁迫,抗逆性生物化学学报。2014;445:394-7。
- 22.
徐军,邢胜,孙强,詹超,刘旭,张胜,等。本研究通过表达一种球形的家蝇蛋白(MdTLP7),增强了家蝇对非生物胁迫的耐受性拟南芥.BMC植物BIOL。2019; 19:60。
- 23.
鹰嘴豆转录因子CaTLP1与蛋白激酶相互作用,调节ROS积累,促进aba介导的气孔关闭。Sci众议员2016;6:38121。
- 24.
等。Tubby-Like蛋白的亚细胞定位和mutual - alist参与胁迫信号和根定植Piriformospora籼.植物杂志。2012;160:349 - 64。
- 25.
王M,Xu Z,Ahmed R,Wang Y,Hu R,Zhou G,Et,Al。像丁香样蛋白2调节同源肌炎生物合成拟南芥种皮粘液。acta botanica yunnanica(云南植物研究)
- 26.
Mohnen D.果胶结构和生物合成。CurrOp植物BIOL。2008; 11:266-77。
- 27.
宋伟,程志华,郭旭东,于超,王辉,王军,等。NHL6过表达影响转基因种子产量拟南芥植物。植物生长调控。2019;88:41-7。
- 28.
宝啊,歌曲w,pan j,江c,srivastava r,li b等。NDR1 / hin1样基因NHL6的过表达响应脱离酸和非生物胁迫而改变种子萌发拟南芥.《公共科学图书馆•综合》。2016;11:e0148572。
- 29.
黑麦叶片滚动的候选基因(Secale cerealel .)。BMC遗传学。2018;19:57
- 30.
张勇,何旭,苏东,冯勇,赵辉,邓辉,等。番茄圆管状蛋白表达的综合分析揭示成熟相关TLP基因(茄属植物lycopersicum).int j mol sci。2020; 21:1000。
- 31.
李胜,张建军,刘林,王铮,李勇,郭玲,等。SlTLFP8通过核内复制调节细胞大小和气孔密度来减少水分流失,提高水分利用效率。植物学报。2020;43(11):2666-79。
- 32.
郭g,刘x,sun f,ca j,hu n,wuda b等。小麦MiR9678通过产生分阶段的siRNA和调节脱落酸/嗜酸盐素信号传导来影响种子萌发。植物细胞。2018; 30(4)。
- 33.
胡颖,韩旭,杨敏,张敏,潘俊,于东。CBF EXPRESSION1转录因子诱导子与aba inscisic ACID INSENSITIVE5和DELLA蛋白相互作用对种子萌发过程中脱落酸信号的调控作用拟南芥.植物细胞,2019,31(7)。
- 34.
陈胜,王涛,戴胜。种子萌发对环境因子响应的蛋白质组学研究。蛋白质组学,2013;13(12 - 13)。
- 35.
干旱胁迫下核桃种子萌发的综合生化研究。Sci Hortic。2019;250:329-43。
- 36.
白益,肖思,张z,张y,孙h,张k等。褪黑素通过在种子涂层中打开毛孔来提高干旱胁迫下的棉花种子的发芽率。同行J. 2020; 8。
- 37.
李春华,韩玉梅,李春华。大麦萌发期耐盐基因的克隆与表达分析。浙江大学学报(自然科学版)2020;21(2):93-121。
- 38.
Karimi S, Karami H, mokhtassii - bidgoli A, Tavallali V, Vahdati K.通过调控盐胁迫诱导温室栽培核桃的耐旱性:渗透调节的作用。Scientia Horticulturae、2018、239。
- 39.
Santagata S, Boggon TJ, Baird CL, Gomez CA, Zhao J, Shan WS。等。g蛋白信号通路通过管状蛋白。科学。2001;292:2041-50。
- 40.
王明,姜波,彭庆伟,刘文荣,何学明,梁志军,等。不同黄瓜品种的转录组分析为干旱胁迫反应提供了新的见解。国际分子生物学杂志。2018;19:15。
- 41.
Ma Z, Natalia VB, Abir UI。大麦种子萌发和休眠的细胞信号机制及代谢调控。作物学报。2017;5(06):459-77。
- 42.
植物细胞成分的氧化修饰。植物学报2007;58:459-81。
- 43.
Vahdati K.核桃耐受性的耐受性:方法和前景。Acta Hort。2014; 1050:399-406。
- 44.
埃斯皮诺萨-吉尔S,迪格斯-马丁内斯N,戈麦斯N,利兹卡诺JM。SUMOylation是ERK5核易位和ERK5介导的癌细胞增殖所必需的。国家自然科学基金项目:国家自然科学基金。
- 45.
UBE3A调控IRF的转录,是一种抗病毒免疫机制。Hum Mol Genet. 2019; 28:47 - 58。
- 46.
马磊,胡丽,范建军,张立东,郑勇,等。棉花GhERF38基因参与植物对盐/干旱和ABA的响应。Ecotoxicol。2017;26(6)。
- 47.
黄锐,王军。拟南芥抗坏血酸对盐胁迫的调控作用。(1).植物生态学报。
- 48.
王k,bu t,cheng q,dong l,su t,chen z等。通过压制脱落酸反应,两个同源LHY对对大豆耐受的负面控制。新的植物学家2020,229(5)。
- 49.
李松,傅强,陈磊,黄伟,于东。拟南芥WRKY25、WRKY26和WRKY33协同诱导植物的耐热性。足底。2011;233:1237-52。
- 50。
孙宇军,刘志新,郭建国,朱志南,周永平,郭春霞,等。H调控需要WRKY33-PIF4环路2O2体内平衡。生物化学学报。2020;527:922-8。
- 51。
曹媛媛,齐秀东,李士泰,王志荣,王学勇,王建峰,等。褪黑素通过改善黄瓜铜螯合和清除活性氧来减轻铜毒性。植物生理学杂志2019;60:562-74。
- 52。
赵立,李米,徐cj,杨x,李dm,zhao x等。GMGBP1启动子的自然变化会影响大豆中开花时间和成熟度的光周期控制。植物J. 2018; 96:147-62。
- 53。
王勇,李勇,何绍平,高原,王宁宁,卢锐,等。棉(陆地棉WRKY转录因子(GhWRKY22)参与调控花药/花粉发育。植物生理生化学报。2019;42(4):451 - 457。
- 54.
王j,张l,cao y,qi c,li s,liu l等。CSATAF1积极调节ABA依赖性途径的干旱胁迫耐受性,并通过促进黄瓜中的ROS清除。植物细胞生理。2018; 59:930-45。
- 55.
马洪志,刘超,李志新,冉启杰,谢国能,王博博,等。ZmbZIP4通过调控ABA的合成和根系发育,促进玉米抗逆性。植物杂志。2018;178:753 - 70。
- 56.
李晨,蒋长平,杨建勇,马CJ,陈永昌,严贺。环型泛素连接酶McCPN1催化ubc8依赖的蛋白泛素化,并与盐生冰植物中的Argonaute 4相互作用。植物生理生化。2014;80:211-9。
- 57.
Fiorentini P, Huang KN, Tishkoff DX, Kolodner RD, Symington LS。酿酒酵母外切酶I在体内和体外有丝分裂重组中的作用。细胞生物学杂志1997;17:2764-73。
- 58.
叶媛媛,林瑞燕,苏海霞,陈海峰,罗敏,杨丽霞,等。富甘氨酸的TtASR的功能鉴定Tetragonia tetragonoides(幕)。与植物抗非生物胁迫有关的昆兹。植物生理与化学学报。
- 59.
赵锐,孙海林,梅超,王新军,闫磊,刘锐,等。拟南芥的植物分类及鉴定2+-依赖蛋白激酶CPK12负调控种子萌发和萌发后生长中的脱落酸信号。新植物学家。2011;192:61 - 73
- 60.
齐超,张洪,刘永强,王旭东,张宁,等。CsSNAT通过促进褪黑激素的生物合成,正向调控黄瓜的耐盐性和生长。环境植物学研究。2020;175。
- 61.
张伟,夏旭,王军,朱丽,王军,王刚,等。nitenpyram对蚯蚓的氧化应激和遗传毒性(艾西尼亚菲迪达).臭氧层。2021;264 (P2)。
确认
我们感谢园艺作物繁殖和传播工程研究中心的支持。
资金
国家重点研发计划项目赵兵(no . 2019YFD1000300);李凤菊(no . 18ZXZYNC00170);郭阳东(no . BAIC07, no . LJNY201812)。关键词:岩石力学,蠕变,蠕变特性,蠕变特性论文资助机构承担了本研究的实验费用,但没有参与研究的设计、数据的收集、分析、解释和手稿的撰写。
作者信息
从属关系
贡献
SL, NZ, BZ和YG构思了这个项目并设计了研究。实验以SL、ZW、FW和HL为主。MC, FL, XY和HW参与了这项工作。BZ, XL和SL分析了数据。文章由SL, NZ和YG撰写。所有的作者都讨论了手稿。作者阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者声明没有利益冲突。
额外的信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
李绍华,王志强,王福林。et al。CsTLP8蛋白参与ABA信号通路,负调控种子萌发过程中的渗透胁迫耐性。BMC植物杂志21日,340(2021)。https://doi.org/10.1186/s12870-021-03126-y
收到了:
接受:
发表:
关键字
- Cucumis巨大成功l
- E3泛素连接酶
- 盐胁迫
- 渗透压力
- 转录因子
- Tubby-like蛋白质