摘要
背景
周皮是陆生植物生存的重要保护屏障,但有关其发育和调控的遗传因素知之甚少。在栎树中使用转录组学方法(问:木栓)周皮,我们之前确定了一个rs2相互作用的kh蛋白(里克)功能未知的同源基因,含有K同源(KH)结构域rna结合蛋白,作为周皮中的调节候选基因。
结果
为了深入了解RIK在表皮的功能,马铃薯(美国tuberosum)块茎周皮为模型:块茎的全长编码序列里克,以下简称斯特里克在马铃薯中进行基因沉默,分析沉默对马铃薯表皮解剖和转录组的影响。的斯特里克转录本在所有被研究的营养组织中积累,包括周皮和其他subsubized组织,如根和损伤组织。Downregulation的斯特里克通过RNA干扰(斯特里克-RNAi对块茎周皮解剖没有明显影响,但与野生型不同,转基因植株开花。的全球文本分析斯特里克-RNAi表皮确实显示出与RNA代谢、胁迫和信号传导相关的基因表达的改变,这反映了在拟南芥同源同源的硅共表达网络中发现的丰富的生物过程。
结论
无处不在的表达斯特里克转录本、花相关表型及差异表达斯特里克-RNAi周皮表明strike在植物发育过程中起着普遍的调控作用。转录组分析表明,StRIK可能在周皮的RNA成熟和应激反应中发挥作用。
背景
植物应对不断变化的环境因素,这些因素有时是不利的,阻碍了它们的生存。为了应对这些不利的环境,植物依靠发育解决方案和调节网络来保护它们的身体结构,优化它们的新陈代谢和生理机能。在陆地植物的适应中,防水屏障的形成对于防止不受控制的水分流失至关重要[1]和病原体攻击[2].在次生器官、块茎和损伤组织中,这种保护是通过一种称为周皮的外部屏障来实现的。周皮由内向外分为薄壁木栓层、分生木栓层和木栓层。木栓木通过在细胞壁内沉积木脂质、木质素和相关蜡质来保护周表皮[3.].尽管表皮个体发生对陆生植物的生存至关重要,但调控其形成和分化的分子网络却鲜为人知。一些转录组学研究使用了软木组织[4,5,6,7,8,9,10,11,12]从而获得了大量的候选调控蛋白,包括植物激素相关蛋白、信号转导蛋白和转录调控蛋白。有几种转录因子被证明与表皮层胶质层沉积有关:StNAC103,QsMYB1而且ANAC046[13,14,15,16].StNAC103被认为是马铃薯块茎周皮中软木素和相关蜡质的抑制因子[15,16),而QsMYB1而且ANAC046作为栓皮栎木胶皮沉积的诱导剂(问:木栓)树皮和拟南芥根周皮,[13,14].
在先前的一项转录组学研究中,发现了一种与玉米同源的基因rs2相互作用的kh蛋白(里克) [17]在软木中比木质部组织中表达上调[7].RIK蛋白与玉米基因相互作用粗糙sheath2(平日),是拟南芥的同源植物不对称叶1(AS1),形成保守复合体不对称叶2(AS2)和组蛋白伴侣希拉[17].AS1/AS2/HIRA复合物通过抑制染色质状态维持I类KNOX基因的沉默,促进干细胞活性和分生组织维持以形成确定的侧部器官[17,18,19,20.].据推测,RIK可能有助于表观遗传抑制诺克斯通过调控rna的结合,在AS1/AS2/HIRA复合体中的基因[17],尽管RIK蛋白的功能仍有待实验确定。序列分析显示,RIK含有一个k同源(KH) RNA结合结构域和一个类似解旋酶结构域(LHD) [17].含有KH结构域的蛋白是已知参与剪接、转录后基因表达调控、mRNA稳定性、miRNA生物发生和异染色质沉默的RNA结合蛋白[21,22].RIK蛋白在拟南芥、玉米和水稻中由单基因编码,具有一个类似剪接因子1的KH结构域,尽管KH结构域的典型核心序列在RIK蛋白中是弱保守的[23].系统发育树显示,RIK蛋白形成了一个不同的分支,区别于所有其他sf1样的KH和KH蛋白。虽然里克转录本在玉米的所有组织中都有积累,在茎尖分生组织中mRNA的积累水平较高,而在老叶中mRNA的积累水平较低[23].在植物中,多项研究表明KH结构域蛋白影响花的发育[24,25,26]、营养生长[27]、应力耐受性[28]和茉莉酸信号[29].
在这里,更接近土豆的功能斯特里克表皮基因,斯特里克稳定沉默,并对块茎表皮解剖结构和转录组进行分析。斯特里克调控下调影响块茎周皮中RNA代谢、胁迫反应和信号转导相关基因的表达。
结果
strike及其同源物显示两个SF1_like-KH结构域
StRIK蛋白序列,由分离的cDNA序列翻译而成美国tuberosum组Tuberosum cv Désirée,与PGSC0003DMG400025145位点编码的4种蛋白异构体(分别对应PGSC0003DMP400043638、PGSC0003DMP400043639、PGSC0003DMP400043637、PGSC0003DMP400043640)同源性显著(98.82、97.85、97.85、98.13%)美国tuberosumPhureja类群基因组[30.].保守域数据库[31]鉴定出两个sf1样的KH (cd02395)结构域位于127-203氨基酸之间(e值1.38 e−04)和216-291 (e-value 1.77 e−04)(图。S1).如图所示。S1, KH结构域核心序列在该序列中包含的所有RIK蛋白中高度保守(V/IRGPNDQYI),但由于它发生在玉米RIK蛋白中[23],它与KH结构域的典型IIGxxGxxI核心序列弱保守[21].
斯特里克转录本无处不在
学生成绩单简介斯特里克RT-qPCR分析的马铃薯组织中,根、茎、叶、块茎肉和块茎周皮的转录水平较高(图2)。S2A).这些结果证实了在RNA-seq数据中发现的基因的普遍表达美国tuberosumPhureja群[30.结果表明,在花器官(花、叶柄和雄蕊)、根和分生组织(茎尖、块茎芽)中也有中度的基因诱导。S2此外,B)。S. phureja RIK非生物胁迫如甘露醇(渗透胁迫)、水分胁迫叶片、盐和脱落酸(ABA)处理诱导,而热和细胞分裂素(BAP;苄基腺嘌呤)处理(图;S2B).损伤对转录丰度的影响(见植物材料小节)斯特里克进行了分析。根据回归分析,有高度显著的线性增加斯特里克受伤后的水平(p< 0.001)(图S2C)。
strike位于细胞核中
StRIK蛋白的亚细胞定位n benthamiana通过瞬态农杆菌属-介导的叶片转化产生带有RFP的StRIK到n端。感染72小时后,一个红色荧光,表明StRIK蛋白的积累,被检测到集中在一个点上,显示了核定位蛋白的典型模式,与核仁对应的间隙没有标记(图2)。1) [32].
斯特里克沉默不影响木栓的解剖结构,但诱导开花
评价…的贡献斯特里克对于木栓系的形成,斯特里克用RNAi沉默(图;S3).一个246 bp的片段,横跨核苷酸758到1003斯特里克使用编码序列(Genbank登录号:MT622318),该编码序列与基因的8、9和10外显子部分或完全重叠(图。S4).为了检查脱靶沉默的可能性,我们使用沉默RNAi序列作为对马铃薯基因组数据库的查询,进行了BLASTN分析[30.]将期望的阈值参数设置为1。分析鉴定了具有代表性的PGSC0003DMT400064730转录本和两种转录本亚型里克PGSC0003DMT400064729和PGSC0003DMT400064731为rnai -靶点,而第四个也是最短的里克转录本亚型(PGSC0003DMT400064735)没有被识别出来,因为它不是RNAi片段的目标(图2)。S4和表S1).BLASTN分析鉴定的其他转录本显示在18个或更少的连续核苷酸中部分匹配,因此交叉沉默不太可能。
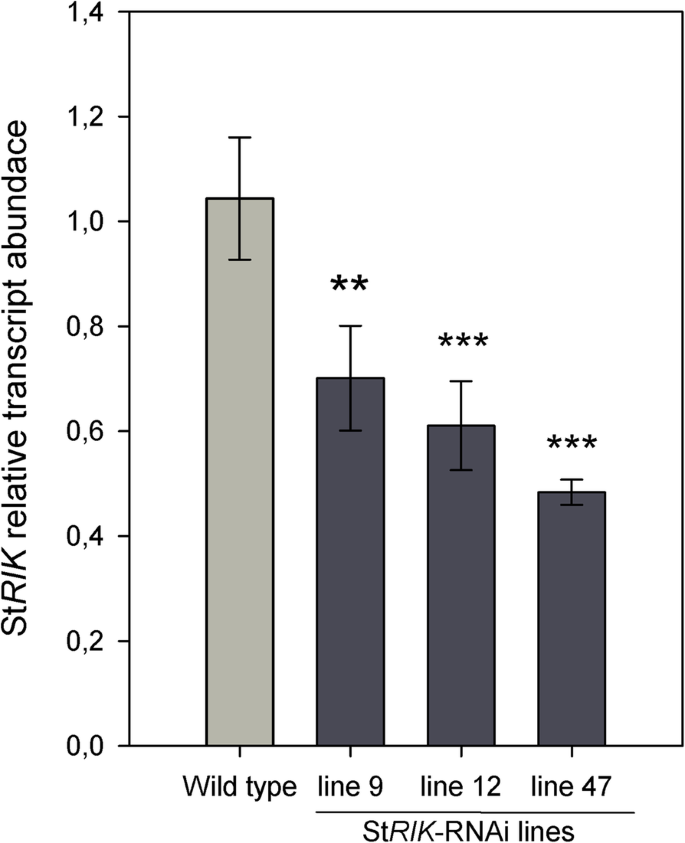
产生20个独立的转换事件斯特里克采用RT-qPCR对-RNAi耐卡那霉素马铃薯植株进行分析。5个转基因株系显示基因表达减少斯特里克叶片转录水平(图;S5a)和块茎周皮(图;S5b)。斯特里克-RNAi系9、12和47被繁殖以产生足够的块茎,用于后续的表型和转录组分析。RT-qPCR在这3个系中重复,沉默斯特里克在周皮炎中被证实(图;2).当五斯特里克3个品系(品系9、品系12和品系47)的-RNAi植株在长日照条件下(光照12小时/暗12小时)的土壤中生长,53.3%的植株开花,而正如预期的那样,野生型(10个中0个)没有开花,因为Désirée品种在我们的生长条件下不开花(图。3.a).茎尖分生组织有明显的花性转变斯特里克-RNAi系与Wild型不同(图;3.b与图相比。3.a),发育完全的花形成(图。3.d与图相比。3.c).用野生型和野生型研究了马铃薯表皮的解剖结构斯特里克21天贮藏块茎的沉默系。扫描电子显微镜(SEM)没有显示出细胞层数或一般细胞结构的明显差异(图。4).
表皮转录组比较表明斯特里克沉默影响RNA代谢,转座子和压力相关基因
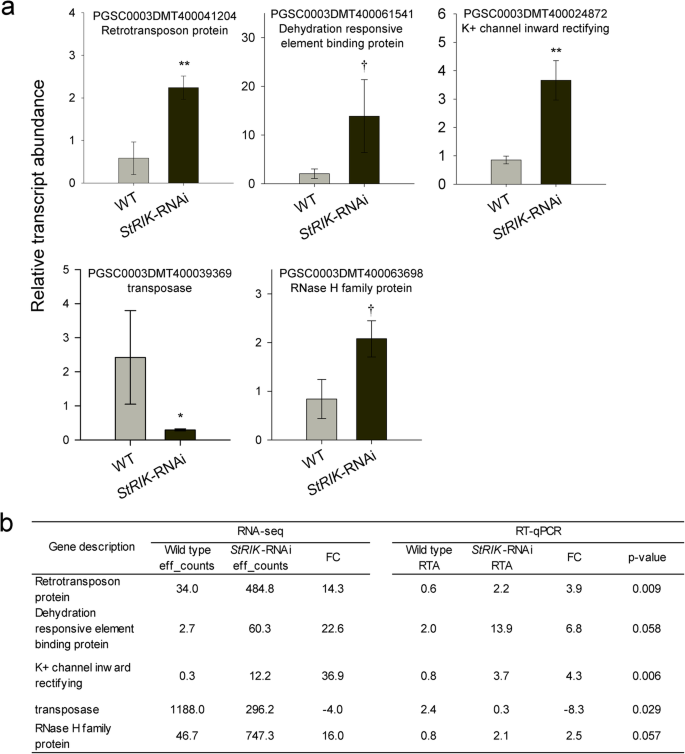
的影响斯特里克在全球转录谱上沉默,从三个重复中每一个的周皮RNA斯特里克-RNAi系(第9、12和47行)和野生型马铃薯块茎提取和测序使用Illumina HiSeq2000。将Reads映射到马铃薯转录组,并对每个转录本的Reads数量进行量化。以确定那些基因之间的表达差异斯特里克沉默型和野生型植物,我们用了六种斯特里克-RNAi库斯特里克丰度低于野生型的三分之二(第9行)n= 1,第12行n= 2;线47n= 3)。共鉴定出101个差异表达基因(DEGs), 66个基因上调,35个基因下调斯特里克-RNAi系(表S2).利用马铃薯基因标识符Uniref100(下载于16/06/2017)(Suzek等人,2007)和TAIR(拟南芥信息资源(https://www.arabidopsis.org/)),功能注释通过Spud DB马铃薯基因组资源(http://solanaceae.plantbiology.msu.edu/pgsc_download.shtml) [30.].利用这些基因组资源中的信息,deg被手动分类为功能类别。显示日志的deg2确定的主要官能团FC值≤- 2和≥2见表1.基因主导的生物过程在斯特里克-RNAi系是RNA代谢、蛋白水解和代谢,而胁迫、转座因子和信号转导系是基因表达上调和下调数量相近的生物过程斯特里克-RNAi系(表S2).
为了验证RNA-seq结果,我们用RT-qPCR方法分析了5种DEGs的相对表达量斯特里克-RNAi(第12行和47行)和野生型块茎生长的时间与用于RNA-seq的块茎不同(图。5a). RT-qPCR分析的基因表达差异得到证实(图;5a) RNA-seq结果(图;5b)。
RT-qPCR分析斯特里克-RNAi和野生型块茎表皮的5个deg。一个的相对转录丰度(RTA)逆转录转座子蛋白,脱水反应元件结合蛋白,K+通道向内整流,转座子酶而且RNase H家族蛋白,在StRIK缺陷型和Wild型中显示。数值为Wild型的平均值±SD(3个生物重复,n3)和斯特里克-RNAi第12和47行(每一行2个生物重复,n= 4)。使用单向对比方差分析对这三个系进行比较,结果显示两个沉默系对五个基因中的任何一个都没有统计学上的显著差异。但在Benjamini-Hochberg调整多重检验后,这两个沉默系与野生型的平均值之间的差异在所有5个基因中均具有统计学意义(2个星号(**,P< 0.01),一个星号(*,P< 0.05)和匕首(†,P< 0.06))。b比较这些基因在RNA-seq和实时PCR分析中的结果。结果显示了每种方法估计的转录丰度(RNA-seq的有效计数和RT-qPCR的RTA计数)以及获得的log2 Fold Change (FC)
拟南芥共表达网络中确定的生物学过程里克与转录组相关斯特里克rnai周
我们探索了拟南芥的共表达网络里克通过选择与之共表达最多的300个基因进行基因分析里克基于ATTED-II的蛋白质(https://atted.jp/ [33];)。在前50个共表达基因中,有剪接因子(如PWI结构域含蛋白,CC1-like),两个开花时间基因(葬礼,EDM2)、发育基因(TTL, cyclin-related,REV1)、其他含有KH结构域的蛋白(如At3g32940、At4g10070)和一个microRNA (MIR834a)(表S3).PlantGSEA数据库中这300个共表达基因的基因本体(GO)富集[34]强调了与RNA代谢相关的过程(例如“mRNA加工”、“RNA代谢过程”、“聚(A) RNA结合”)、RNA剪接(例如“RNA剪接”、“mRNA剪接,通过剪接体”、“RNA剪接,通过酯交换反应”)、调控(例如“基因表达的调控”、“生物过程的调控”)、基因沉默(例如“基因沉默”、“RNA沉默基因”)和发育(例如“胚胎后发育”),“分生组织从营养到生殖的阶段转变”,“花的发育”)。与细胞核和剪接体相关的几个GO术语在细胞成分类中被确定(表2)S4).
讨论
马铃薯斯特里克基因及其在拟南芥(At3g29390)和玉米中的同源基因是功能未知的基因。它们可能是具有k同源(KH)结构域的rna结合多肽。我们的结果显示斯特里克在不同植物组织中普遍表达,表达水平相似(图;S2),以符合S. phureja RIK从PGSC提取的RNA-seq数据[30.],并与玉米同类的转录谱相结合[23].尽管Soler等人。[7报告说,栓皮栎的产量上升了QsRIK与木质部相比(FC = 5),表明该基因的作用并不局限于木质部或亚亚化组织。马铃薯和拟南芥里克在花的转变过程中,花、果和茎尖花序中的基因上调。S2).我们发现斯特里克-RNAi植物在茎尖分生组织中表现出花的转变,并且大多数形成了完全发育的花,而野生型植物尽管在相同条件下平行生长(图2)。3.模拟)。这种表型表明斯特里克可能是器官规格或组织分化所必需的,因此是阻遏作用斯特里克花的发育可以被假设。一些含有K同源(KH)结构域的蛋白质已被证明影响拟南芥的开花[35].特别是蛋白质HEN4参与了无性生殖的花同源基因[24];FLK失活了方法上调,可能通过调节转录后基因调控方法[25];和胡椒kh结构域蛋白影响雌蕊发育[27].它的过表达引起的方法转录水平和开花延迟,可能是通过转录和转录后调节机制[36].然而,S. phureja RIK在匍匐茎和块茎芽等年轻生长组织中诱导。S2).这和无处不在的基因表达(图S2)表明斯特里克除开花外,在植物发育中起调节作用。
有一个上调斯特里克在马铃薯块茎椎间盘损伤后(图S2)。和S. phureja RIK在渗透胁迫(甘露醇)、盐胁迫、ABA处理和叶片衰老过程中,转录本积累增加,但在热处理和损伤(叶片损伤24小时后)下转录本积累被抑制(图S2)。相反,在拟南芥中,损伤诱导温和里克损伤后3、6、12、24 h根系转录物的积累[37].
类似地,当应激反应基因的表达发生改变时斯特里克在块茎周围被消音了。拟南芥同源基因参与ABA和水分剥夺反应的6个基因(马铃薯注释:脱氢酶、11S球蛋白、脱水响应元件结合蛋白、K+通道向内整流、核酮糖二磷酸羧化酶大链、液泡H + -焦磷酸酶,表1、表S2,无花果。5)在斯特里克rnai周皮。例如,在拟南芥中,脱水响应元件结合蛋白与干旱、盐和热胁迫反应有关[38], k通道参与钾细胞稳态和ABA信号转导[39,40].相反,其他非生物胁迫基因下调,如创伤反应蛋白、热休克结合蛋白、金属硫蛋白和LOB结构域包含蛋白41(已知在拟南芥中由缺氧诱导的转录因子)[41)(表1、表S2).最后,三个生物应激基因在这些系中被上调:一个与发病机制相关,两个与Kunitz胰蛋白酶抑制剂(KTI)成员(At1g17860)同源(表2)S2它们在对食草动物的防御反应以及对伤害和茉莉酸甲酯的反应中发挥着突出的作用[42,43,44].值得注意的是,在马铃薯块茎周皮的转录组学和蛋白质组学方法中发现了生物和非生物胁迫反应[45,46],最近有报道称ABA触发了真皮内垫脂素的积累[47]并与周皮发育有关[8].综上所述,strike可能对与生物和非生物胁迫信号相关的软木发育具有重要意义。
值得注意的是,大多数与RNA代谢相关的基因上调斯特里克沉默的周皮。有几种RNase H蛋白在植物中功能未知,但在哺乳动物细胞生理和健康中起着关键作用,与基因组稳定性和细胞活力有关[48,49].其他上调的基因是一种rna结合蛋白,编码一种参与rRNA成熟和内含子循环的叶绿体酶(At3g13740, [50]),一个参与剪接的基因(At2g16860, [51])和几种rRNA内含子编码的归巢内切酶(表1,无花果。5、表S2).据此,拟南芥共表达网络里克基因在几个与RNA代谢和剪接相关的本体论中富集(表S3而且S4).共表达基因包括葬礼,一种控制开花的基因[52]和一个拼接因子U2AF65A,参与植物内含子识别[53,54]并能调节花期[55].此外,RIK与两种kh -结构域RNA结合蛋白SHINY和HOS5共表达,这两种蛋白介导胁迫下应激相关基因的正确pre-mRNA加工[28,56].综上所述,拟南芥RIK基因中与胁迫和RNA代谢相关的deg和共表达网络表明斯特里克可能通过干扰基因组稳定性和/或mRNA成熟/稳定性以及应激信号通路在周表皮中发挥作用。
在这些基因中,值得注意的是几个与DNA转位相关的基因在基因表达上同时上调或下调斯特里克-RNAi系(表1,无花果。5和表S2).转座因子(Transposable elements, TE)是基因组中丰富的可移动遗传因子,一旦被激活,可改变基因表达[57]植物生理、发育或胁迫反应的触发效应[58].由于不受控制的转座子通常是有害的,植物已经进化出抑制转座子的机制[59]通过负责rna定向DNA甲基化(RdDM)的小干扰rna (siRNAs) [57].考虑到RIK可能结合调控rna [17基因沉默是一个丰富的过程里克共表达网络(表S4),很容易推测strike可能有助于植物发育和胁迫条件下TEs的表观遗传控制。
StRIK在木栓lem中的作用仍然未知,因为它的沉默不影响木栓lem的解剖结构(图。4)或已知的素胶蛋白基因[60].然而,CYP87A2在斯特里克-RNAi表皮,也被认为是木栓形成的候选物,因为与木材相比,它在软木中表达上调[7].此外,CASPL4D2也被下调,其功能未知斯特里克-RNAi周(表S2)。有趣的是,与CASPL4D2非常相似的CASPL4D1是病原体诱导木质化所必需的[61].值得注意的是,与CASPL4D2同属基因亚家族的CASPL4C1 [62],敲除后开花时间较早,对冷胁迫的耐受性较强[63].
结论
基于软木对软木橡树木材的上调里克本文采用逆向遗传方法研究了StRIK在马铃薯表皮中的功能。结果表明,StRIK基因在马铃薯、拟南芥和玉米中均为单基因编码,含有两个sf1样k同源RNA结合域,并具有核定位。该转录本在马铃薯块茎的各组织中积累,并在损伤诱导下形成。斯特里克基因下调仅在转基因株系中与花发育相关,而在周表皮解剖结构上未发现明显变化。尽管如此,转录组分析强调了101个基因的差异表达斯特里克-RNAi和Wild型周系,属于与RNA代谢、应激、转座因子和信号通路相关的功能。总的来说,结果表明斯特里克可能通过胁迫信号通路和RNA代谢在马铃薯块茎周皮中发挥调控作用。
方法
植物材料
马铃薯品种(美国tuberosumTuberosum cv。Désirée)由Salomé Prat教授(农业基因组学研究中心:CRAG,巴塞罗那,西班牙)提供。杂交获得了四倍体马铃薯品种DésiréeUrgentaxDepesche荷兰ZPC育种品种。Désirée品种的资料可于马铃薯系谱数据库(https://www.plantbreeding.wur.nl/PotatoPedigree/lookup.php?name=DESIREE:%20identifier%2011213(德国瓦赫宁根大学)和欧洲栽培马铃薯数据库(ECPD:https://www.europotato.org/varieties/view/Desiree-E).利用马铃薯块茎周皮进行分离斯特里克全长编码序列,以产生斯特里克沉默植物进行逆转录,然后进行定量PCR(RT-qPCR)和RNA-seq实验。获取Désirée块茎,如Serra等人所述,在离体植株中繁殖。[64然后转移到土壤中,在块茎收获前在步入式室内种植3个月。用无菌手术刀人工解剖马铃薯块茎皮,立即冷冻于液氮中。当栓状根活跃时,它很容易破裂,因此皮肤很容易被去除,恢复的组织主要含有栓状根,但也含有栓状根。从现在起,我们将用“周皮”一词来指代收获的含有木栓和木栓根的马铃薯皮。马铃薯块茎美国tuberosumTuberosum cv。蒙娜丽莎是在当地超市买的用来研究斯特里克对伤害的反应。为此,用软木钻从土豆果肉(薄壁组织)中获取块茎圆盘(3毫米厚,13毫米直径),并将其放在室温、黑暗和饱和湿度条件下的塑料盒中,直到样本采集。
克隆和测序的全长斯特里克
为了获得完整的编码序列,使用SuperScript III逆转录酶(Invitrogen,http://www.invitrogen.com/),寡核苷酸(dT)18表皮组织引物和总RNA [65之前用DNAse处理过。引物用于克隆马铃薯的全长编码序列斯特里克基因(表S5)基于土豆表达序列标签组件(TC127409和TC155463)的信息进行设计。采用块茎周皮cDNA和高保真PrimeSTAR®HS DNA聚合酶(Takara)进行PCR。PCR产物克隆到pCR4-TOPO (Invitrogen)中,用BigDye进行测序[66终结者3.1套件(应用生物系统公司)。的GenBank登录号斯特里克全长编码序列为MT622318。
土豆的转换
发夹RNAi构建斯特里克通过PCR扩增得到基因沉默(表S5246 bp的特定片段(图;S3).扩增产物先克隆到pENTR/D-TOPO载体(Life Technologies)中,然后反向转移到二元目的载体pBIN19RNAi [67LR克隆酶II酶(生命科技)。马铃薯植物转化如Fernández-Piñán等所述。[66].简而言之,农(GV2260)用重组pBIN19RNAi载体转化,用于感染叶片外植体,经植物激素处理诱导器官发生过程,从而产生耐卡那霉素马铃薯植株斯特里克基因表达下调。
逆转录和定量PCR分析(RT-qPCR)
总RNA按照Logemann等人报道的方案进行分离。[65].使用高容量cDNA逆转录试剂盒(Applied Biosystems)从2 μg DNAse酶切RNA合成第一链cDNA。实时PCR分析在LightCycler®96 Real- time PCR系统(Roche)中进行。基因特异性引物采用Primer3 0.4.0软件设计(https://bioinfo.ut.ee/primer3-0.4.0/),然后用NetPrimer (http://www.premierbiosoft.com/netprimer/).每20 μl qPCR反应含有SYBR Green Select Master Mix (Applied Biosystems) 10 μl,正向和反向对应引物各300 nM,稀释100倍的cDNA 5 μl。所使用的热循环程序是第一步95°C持续10分钟,然后95°C持续10秒,60°C持续15秒,72°C持续10秒,循环40次。最后一步是分离,以验证单个扩增子的存在。对于每一对引物,使用Wild型周表皮cDNA模板5倍稀释系列(1/5、1/25、1/125、1/625和1/3125)的标准曲线来确定扩增效率,E= 10(−1 /坡).每个基因的mRNA丰度计算为相对转录丰度= (E目标)ΔCt目标(对照样本)/ (E参考)ΔCt参考资料(对照样本)[68].用于原生组织分析的cDNA控制样本是一个包含等量所有样本的池,用于损伤应激试验的cDNA控制样本是一个包含144小时损伤后重复的池,用于转基因系和RNA-seq验证的cDNA控制样本是一个包含野生型周皮重复的池。管家基因腺嘌呤磷酸核糖转移酶(APRT)对结果进行归一化,但在损伤实验中,构成基因延伸因子1 α(EF1α)使用[69].基因特异性引物序列见表S5.
蛋白质序列比对分析
氨基酸多序列比对使用欧洲生物信息学研究所(EBI)的Clustal Omega程序进行。https://www.ebi.ac.uk/Tools/msa/clustalo/).对齐是使用BOXSHADE 3.21版本编辑的https://embnet.vital-it.ch/software/BOX_form.html.
rfp - strike融合蛋白的亚细胞定位和周皮镜检
斯特里克用5 '端attB重组序列的特异性引物扩增基因编码区(表S5)使用PrimeSTAR®HS DNA聚合酶(Takara)。扩增子被克隆到GATEWAY供体载体pDONR207™(Life Technologies),然后转移到目的载体pK7WGR2.0 [70]将RFP融合到StRIK (pK7WGR2.0- . n端里克).农细胞(GV3101)用pK7WGR2.0-转化里克载体和HcPro沉默抑制剂[71]在添加了适当抗生素的YEB液体培养基中28°C平行生长过夜。培养物以4000 g离心,细胞颗粒在浸润缓冲液(10 mM MES (pH 5.6), 10 mM MgCl中重悬2500 μM乙酰丁香酮)2单位OD600/ml,室温孵育2 h。在农业渗透之前,两者都有农杆菌属样品(RFP-RIK和HcPro)以1:1的比例混合得到1个单位OD600/ml每个培养物。该混合物用于农用渗透的背面n benthamiana.3天后,在NIKON Ti Eclipse荧光倒置显微镜下观察转化细胞,共聚焦单元NIKON A1R。为了检测红色荧光,在543.5 nm波长激发叶片,在595 nm处收集发射物。显微镜成像软件为NIKON NIS-Elements AR v 4.10。如Serra等人先前报道的那样,使用扫描电子显微镜(SEM)分析周皮解剖。[67]使用储存21天的块茎。
RNA-seq高通量测序
周皮(皮肤)是从新鲜收获的土豆块茎中分离出来的,避免了下面的皮层薄壁组织(见植物材料小节)。总RNA用PureLink®植物RNA试剂(Ambion)纯化,通过对标准方案进行修改,重复该方案的第4步和第5步两次,并添加KOAc 2m (pH 5.5)沉淀步骤以去除多糖。最终RNA沉淀使用糖蓝共沉淀剂(Ambion)进行。根据制造商的说明,使用TURBO DNA-free kit (Ambion)去除基因组DNA。RNA样本使用Agilent 2100 Bioanalyzer进行分析,RNA完整性数(RIN)大于7的RNA进行测序。对每个品系(野生型和野生型)进行3个生物重复测序斯特里克-RNAi行9,12和47)。cDNA文库使用TruSeq RNA文库准备试剂盒(Illumina)按照制造商的协议制备,然后在Illumina HiSeq 2000仪器(华大基因香港)中运行。RNA-seq数据质量使用FastQC v0.11.2进行分析(https://www.bioinformatics.babraham.ac.uk/projects/fastqc/).读数与领结2对齐[72反对,反对美国tuberosum由基因组组装v4.03生成的Phureja组转录组[30.]使用最新版本的GFF3基因组注释文件(PGSC_DM_V403_genes.gff.zip)和Cufflinks包中的程序gffread [73].转录本丰度的定量采用eXpress 1.5.1 [74].从eXpress输出中获得的标记为' eff_counts '的列被作为输入传递给baySeq [75]进行微分表达式分析。对于每个拟合模型,假发现率(FDR)小于0.05的转录本被认为是差异表达。所有测序数据均可在NCBI的基因表达综合库中获得,登录代码为GSE153641。
数据和材料的可用性
StRIK全长编码序列在GenBank中:登录号MT622318 (https://www.ncbi.nlm.nih.gov/genbank/).在当前研究中产生的RNA-seq数据已存放在NCBI的基因表达综合库中,登录代码为GSE153641 (https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE153641).本研究使用的数据库和程序如下:拟南芥信息资源(https://www.arabidopsis.org/)、Spud DB马铃薯基因资源(http://solanaceae.plantbiology.msu.edu/pgsc_download.shtml), atted-ii (https://atted.jp/Plant GeneSet Enrichment Analysis Toolkit数据库(http://structuralbiology.cau.edu.cn/PlantGSEA/index.php) FastQC v0.11.2 (https://www.bioinformatics.babraham.ac.uk/projects/fastqc/),欧洲生物信息学研究所(EBI,https://www.ebi.ac.uk/Tools/msa/clustalo/), BOXSHADE 3.21版(https://embnet.vital-it.ch/software/BOX_form.html)、primer30.4.0软件(https://bioinfo.ut.ee/primer3-0.4.0/)、NetPrimer (http://www.premierbiosoft.com/netprimer/)、马铃薯谱系数据库(https://www.plantbreeding.wur.nl/PotatoPedigree/lookup.php?name=DESIREE:%20identifier%2011213)和欧洲栽培马铃薯数据库(ECPD:https://www.europotato.org/varieties/view/Desiree-E).所有这些数据库的公开访问都是开放的。本研究中使用的材料将在合理要求下与通讯作者共享。
缩写
- AS1:
-
不对称叶1
- 度:
-
差异表达基因
- 走:
-
基因本体论
- KH:
-
K-homology
- 平日:
-
粗糙sheath2
- 里克:
-
rs2相互作用的KH蛋白
- SF1:
-
拼接因子1
- 招标书:
-
红色荧光蛋白
参考文献
- 1.
Lendzian KJ。植物二次生长的生存策略:木栓和皮孔对水、氧和二氧化碳的屏障特性。中国机械工程学报,2006;26(11):553 - 553。https://doi.org/10.1093/jxb/erl014.
- 2.
Campilho A, Nieminen K, Ragni L.周皮的发展:植物和环境之间的最后边界。《植物生物学》2020;53:10-4。https://doi.org/10.1016/j.pbi.2019.08.008.
- 3.
Ranathunge K, Schreiber L, Franke R. Suberin在基因组学时代的研究-对旧聚合物的新兴趣。中国植物科学,2011;18(3):369 - 369。https://doi.org/10.1016/j.plantsci.2010.11.003.
- 4.
王晓明,王晓明,王晓明,等。跨茎的组织特异性研究揭示了桦树皮的化学和转录组动力学。植物学报。2019;222(4):1816-31。https://doi.org/10.1111/nph.15725.
- 5.
杨晓东,杨晓东,杨晓明,等。一种比较转录组学方法来理解软木塞的形成。中国生物医学工程学报,2018;29(1):344 - 344。https://doi.org/10.1007/s11103-017-0682-9.
- 6.
杨晓明,杨晓明,杨晓明。杨树树皮组织的化学和转录组学分析。树物理学报,2018;38(3):340-61。https://doi.org/10.1093/treephys/tpx060.
- 7.
索勒尔,Serra O, Molinas M, Huguet G, Fluch S, Figueras M.软木木生物合成和软木分化的基因组方法。植物科学进展。2007;44(1):419-31。https://doi.org/10.1104/pp.106.094227.
- 8.
陈志伟,陈志伟,陈志伟,陈志伟,等。激光显微分离技术对栎树斑纹形成细胞转录谱的影响。足底。2018;247(2):317 - 38。https://doi.org/10.1007/s00425-017-2786-5.
- 9.
Teixeira RT, Fortes AM, Pinheiro C, Pereira H.优质软木塞和劣质软木塞的比较:浊生组织高通量测序的应用。中国科学(d辑),2014;26(3):344 - 344。https://doi.org/10.1093/jxb/eru252.
- 10.
外阴VKR, Fogelman E, Faigenboim A, Shoseyov O, Ginzberg I.马铃薯块茎木栓的转录组揭示了软木形成层的细胞功能和参与周皮形成和成熟的基因。科学通报2019;9(1):10216。https://doi.org/10.1038/s41598-019-46681-z.
- 11.
李文杰,李文杰,李文杰,等。马铃薯皮发育相关基因的鉴定。中国生物医学工程学报,2017;44(4):481 - 482。https://doi.org/10.1007/s11103-017-0619-3.
- 12.
李志强,李志强,李志强,等。木栓与木质部:全基因组转录组分析揭示了栓皮栎软木形成的新调控因子。树物理学报。2020;40(2):129-41。https://doi.org/10.1093/treephys/tpz118.
- 13.
卡波特T,巴博萨P, Usié A,拉莫斯AM, Inácio V, Ordás R,等。ChIP-Seq揭示了QsMYB1直接针对软木橡树(Quercus suber)木质素和木脂素生物合成途径中的基因。中国生物医学工程学报。2018;18(1):198。https://doi.org/10.1186/s12870-018-1403-5.
- 14.
Mahmood K, Zeisler-Diehl VV, Schreiber L, Bi Y-M, Rothstein SJ, Ranathunge K. ANAC046过表达促进拟南芥根中Suberin生物合成。国际分子生物学杂志,2019;20(24):6117。https://doi.org/10.3390/ijms20246117.
- 15.
Soler M, Verdaguer R, Fernández-Piñán S, Company-Arumí D, Boher P, Góngora-Castillo E,等。对马铃薯StNAC103保守的NAC结构域进行沉默,揭示了新的NAC候选结构域,可抑制木栓类中与蜡质相关的蜡质。植物科学通报2020;291:110360。https://doi.org/10.1016/j.plantsci.2019.110360.
- 16.
Verdaguer R, Soler M, Serra O, Garrote A, Fernández S, Company-Arumí D,等。马铃薯StNAC103基因的沉默增强了块茎表皮中脂质脂和相关蜡的积累。中国科学(d辑),2016;29(3):344 - 344。https://doi.org/10.1093/jxb/erw305.
- 17.
费尔普斯·杜尔,托马斯·J,瓦哈布·P,蒂默曼斯MCP。玉米粗鞘2及其拟南芥同源物不对称LEAVES1与预测的组蛋白伴侣HIRA相互作用,在器官发生过程中维持Knox基因的沉默和确定性。植物学报。2005;17(11):2886-98。https://doi.org/10.1105/tpc.105.035477.
- 18.
郭敏,Thomas J, Collins G, Timmermans MCP。拟南芥非对称LEAVES1复合体对KNOX位点的直接抑制。植物学报。2008;20(1):48-58。https://doi.org/10.1105/tpc.107.056127.
- 19.
李忠,李斌,刘杰,郭忠,刘勇,李勇,等。转录因子AS1和AS2与LHP1相互作用抑制拟南芥KNOX基因。中国生物医学工程学报,2016;32(12):959-70。https://doi.org/10.1111/jipb.12485.
- 20.
Lodha M, Marco CF, Timmermans MCP。不对称叶片复合物通过直接招募polycomb - repression complex2维持对KNOX同源盒基因的抑制。基因工程学报,2013;27(6):596-601。https://doi.org/10.1101/gad.211425.112.
- 21.
伯德CG,德莱弗斯G. rna结合蛋白的保守结构和功能多样性。科学。1994;265(5172):615 - 21所示。https://doi.org/10.1126/science.8036511.
- 22.
张志刚,张志刚,张志刚,等。拟南芥RNA识别基序(RRM)和K同源性(KH)结构域RNA结合蛋白的基因组分析。中国生物医学工程学报,2002;30(3):623-35。https://doi.org/10.1093/nar/30.3.623.
- 23.
Buckner B, Swaggart KA, Wong CC, Smith HA, Aurand KM, Scanlon MJ,等。玉米RIK基因的表达及核苷酸多样性。中华医学杂志。2008;99(4):407-16。https://doi.org/10.1093/jhered/esn013.
- 24.
程燕,Kato N,王伟,李娟,陈霞。拟南芥AGAMOUS pre-mRNA的两个RNA结合蛋白HEN4和HUA1在加工过程中起作用。科学通报。2003;4(1):53-66。https://doi.org/10.1016/s1534 - 5807 (02) 00399 - 4.
- 25.
林明辉,金杰,金永生,郑克生,徐永华,李毅,等。拟南芥新基因FLK通过开花位点c编码RNA结合蛋白并调控开花时间。植物细胞学报,2004;16(3):731-40。https://doi.org/10.1105/tpc.019331.
- 26.
Vega-Sánchez梅,曾磊,陈松,梁宏,王国良。SPIN1是一个受E3泛素连接酶SPL11负调控和泛素化的K同源结构域蛋白,参与水稻开花时间的控制。植物学报。2008;20(6):1456-69。https://doi.org/10.1105/tpc.108.058610.
- 27.
Ripoll JJ, Ferrándiz C, Martínez-Laborda A, Vera A. PEPPER是一个新的k同源结构域基因,调控拟南芥的营养和雌蕊发育。生物工程学报。2006;289(2):346-59。https://doi.org/10.1016/j.ydbio.2005.10.037.
- 28.
姜娟,王斌,沈艳,王红,冯强,石慧。拟南芥RNA结合蛋白SHINY1与c端结构域类磷酸酶1 (CPL1)相互作用抑制胁迫诱导基因表达。公共科学图书馆,2013;9(7):e1003625。https://doi.org/10.1371/journal.pgen.1003625.
- 29.
撒切尔LF, Kamphuis LG, Hane JK, Oñate-Sánchez L,辛格KB。拟南芥kh -结构域rna结合蛋白ESR1在茉莉酸信号的组成部分中起作用,解除生长抑制和对胁迫的抗性。公共科学学报。2015;10(5):e0126978。https://doi.org/10.1371/journal.pone.0126978.
- 30.
马铃薯基因组测序联盟。块茎作物马铃薯基因组序列分析。自然。2011;475(7355):189 - 95。https://doi.org/10.1038/nature10158.
- 31.
马奇勒-鲍尔A,郑C, Chitsaz F, Derbyshire MK, Geer LY, Geer RC,等。CDD:保守结构域和蛋白质三维结构。中国生物医学工程学报,2013;41(D1): 348-52。https://doi.org/10.1093/nar/gks1243.
- 32.
伊万诺夫S,哈里森MJ。一组基于荧光蛋白的标记物,由组成型和丛枝菌根诱导启动子表达,用于标记截叶苜蓿细胞器、膜和细胞骨架元件。植物学报(自然科学版);2014;30(6):344 - 344。https://doi.org/10.1111/tpj.12706.
- 33.
Aoki Y, Okamura Y, Tadaka S, Kinoshita K, Obayashi T. ATTED-II在2016:一个面向谱系特异性Coexpression的植物共表达数据库。中国生物医学工程学报,2016;29(1):344 - 344。https://doi.org/10.1093/pcp/pcv165.
- 34.
易鑫,杜震,苏忠。植物群落基因集富集分析工具箱。中国生物医学工程学报,2013;41(W1): 98-103。https://doi.org/10.1093/nar/gkt281.
- 35.
Rodríguez-Cazorla E, Ripoll JJ, Andújar A, Bailey LJ, Martínez-Laborda A, Yanofsky MF,等。k同源核核糖核蛋白调控拟南芥花器官的同一性和确定性。公共科学图书馆,2015;11(2):e1004983。https://doi.org/10.1371/journal.pgen.1004983.
- 36.
Ripoll JJ, Rodríguez-Cazorla E, González-Reig S, Andújar A, Alonso-Cantabrana H, Perez-Amador MA,等。拟南芥k -同源结构域基因之间的拮抗作用揭示了PEPPER作为中央花抑制因子开花位点的正向调控因子。植物生理学报,2009;33(2):251-62。https://doi.org/10.1016/j.ydbio.2009.06.035.
- 37.
温特D,醋B,纳哈尔H,阿玛尔R,威尔逊GV,普罗瓦特NJ。一个“电子荧光象形文字”浏览器,用于探索和分析大规模生物数据集。公共科学图书馆,2007;2(8):e718。https://doi.org/10.1371/journal.pone.0000718.
- 38.
Sakuma Y, Maruyama K, Qin F, Osakabe Y, Shinozaki K, Yamaguchi-Shinozaki K.拟南芥转录因子DREB2A在水胁迫响应和热胁迫响应基因表达中的双重功能。中国科学院学报(自然科学版),2006;26(3):344 - 344。https://doi.org/10.1073/pnas.0605639103.
- 39.
Pilot G, Lacombe B, Gaymard F, Cherel I, Boucherez J, Thibaud JB,等。拟南芥中保护细胞向内K+通道活性涉及双通道亚基KAT1和KAT2的表达。中国生物医学工程学报,2001;26(5):516 - 516。https://doi.org/10.1074/jbc.M007303200.
- 40.
Sutter JU, Sieben C, Hartel A, Eisenach C, Thiel G, Blatt MR.脱落酸触发拟南芥KAT1 K+通道的内吞作用并将其循环到质膜。中国生物学报。2007;17(16):1396-402。https://doi.org/10.1016/j.cub.2007.07.020.
- 41.
Klok EJ, Wilson IW, Wilson D, Chapman SC, Ewing RM, Somerville SC,等。拟南芥根培养物低氧响应的表达谱分析。植物学报。2002;14(10):2481-94。https://doi.org/10.1105/tpc.004747.anaerobiosis.
- 42.
徐Botella M, Y, Prabha TN,赵Y,纳史木汗ML,威尔逊KA,等。大豆半胱氨酸蛋白酶抑制剂基因在发育过程中的差异表达以及对损伤和茉莉酸甲酯的反应。植物科学进展。1996;32(3):339 - 339。https://doi.org/10.1104/pp.112.3.1201.
- 43.
Bradshaw HD, Hollick JB, Parsons TJ, Clarke HR, Gordon MP。杨树系统创伤反应基因编码类似甘薯孢素和豆类库尼茨胰蛋白酶抑制剂的蛋白质。植物分子生物学。1990;14(1):51-9。https://doi.org/10.1007/BF00015654.
- 44.
Haruta M, Major IT, Christopher ME, Patton JJ, Constabel CP.一个来自震颤白杨(Populus tremuloides Michx.)的Kunitz胰蛋白酶抑制剂基因家族:克隆、功能表达和通过伤害和草性诱导。植物分子生物学,2001;46(3):347-59。https://doi.org/10.1023/A:1010654711619.
- 45.
Barel G, Ginzberg I.马铃薯皮肤蛋白质组富含植物防御成分。中国机械工程学报,2008;39(12):337 - 344。https://doi.org/10.1093/jxb/ern184.
- 46.
M Soler, Serra O, flourh S, Molinas FM。一个马铃薯皮肤SSH文库产生了新的候选基因,用于苏皮素的生物合成和表皮的形成。足底。2011;233(5):933 - 45。https://doi.org/10.1007/s00425-011-1350-y.Epub2011Jan20.
- 47.
Barberon M, Vermeer JEM, De Bellis D, Wang P, Naseer S, Andersen TG,等。养分诱导的内胚层分化可塑性对根功能的适应。细胞。2016;164(3):447 - 59。https://doi.org/10.1016/j.cell.2015.12.021.
- 48.
赛瑞泰利SM,克劳奇RJ。核糖核酸酶H:真核生物中的酶。中华医学杂志,2009;36(6):344 - 344。https://doi.org/10.1111/j.1742-4658.2009.06908.x.
- 49.
真核生物核糖核苷酸切除修复缺陷的分子和生理后果。EMBO J. 2020;39(3):e102309。https://doi.org/10.15252/embj.2019102309.
- 50.
Hotto AM, Castandet B, Gilet L, Higdon A, Condon C, Stern DB。拟南芥叶绿体小核糖核酸酶III参与rRNA成熟和内含子循环。植物学报。2015;27(3):724-40。https://doi.org/10.1105/tpc.114.134452.
- 51.
田勇,陈明明,杨建峰,Achala HHK,高斌,郝广峰,等。跨不同植物物种的SYF2/NTC31/p29剪接成分的全基因组鉴定和功能分析足底。2019;249(2):583 - 600。https://doi.org/10.1007/s00425-018-3026-3.
- 52.
Macknight R, Bancroft I, Page T, Lister C, Schmidt R, Love K,等。FCA是一种控制拟南芥开花时间的基因,编码一种含有rna结合结构域的蛋白质。细胞。1997;89(5):737 - 45。https://doi.org/10.1016/s0092 - 8674 (00) 80256 - 1.
- 53.
张晓明,张晓明,杨晓明,杨晓明,等。U2AF亚基在植物中表达的研究进展。中国生物医学工程学报,1998;29(5):528 - 528。https://doi.org/10.1074/jbc.273.51.34603.
- 54.
张玉华,朴海,李kc, Thu MP, Kim SK, Suh MC,等。剪接因子SF1的同源物对发育至关重要,并参与拟南芥中pre-mRNA的选择性剪接。植物学报(自然科学版);2014;26(4):344 - 344。https://doi.org/10.1111/tpj.12491.
- 55.
朴海燕,李ht,李志华,金继科。拟南芥U2AF65调控开花时间和花粉管生长。中国植物科学,2019;10:569。https://doi.org/10.3389/fpls.2019.00569.
- 56.
陈涛,崔鹏,陈红,阿里生,张松,熊磊。拟南芥中一个与FIERY2/CTD磷酸酶样1和剪接因子相互作用的dh -结构域rna结合蛋白在pre-mRNA剪接中起重要作用。公共科学学报,2013;9(10):e1003875。https://doi.org/10.1371/journal.pgen.1003875.
- 57.
植物小rna和转座子沉默。发展差异性增长。2012;54(1):100-7。https://doi.org/10.1111/j.1440-169X.2011.01309.x.
- 58.
Oliver KR, McComb JA, Greene WK。转座因子:被子植物进化和多样性的有力贡献者。中国生物医学工程学报,2013;5(10):186 - 901。https://doi.org/10.1093/gbe/evt141.
- 59.
植物转座因子的表观遗传调控。植物学报。2009;60(1):43-66。https://doi.org/10.1146/annurev.arplant.59.032607.092744.
- 60.
李志强,王志强,王志强,等。一种新型细胞外屏障的生物合成、调控和聚合物组装。植物细胞学报,2015;34(4):573-86。https://doi.org/10.1007/s00299-014-1727-z.
- 61.
李敏,全辉,金帅,郑俊华,罗波洛D,李华,等。木质素屏障将病原体限制在感染部位,使植物具有抗性。中国生物医学工程学报。2019;38(23):38。https://doi.org/10.15252/embj.2019101948.
- 62.
Roppolo D, Boeckmann B, Pfister A, Boutet E, Rubio MC, Dénervaud-Tendon V,等。CASPARIAN膜结构域蛋白家族的功能和进化分析。中国生物医学工程学报,2014;29(4):379 - 379。https://doi.org/10.1104/pp.114.239137.
- 63.
杨娟,丁超,徐波,陈超,R Narsai, J Whelan,等。Casparian带状结构域样基因CASPL对生长和耐寒性有负面影响。科学通报2015;5(1):1 - 11。https://doi.org/10.1038/srep14299.
- 64.
张晓东,李志强,李志强,等。马铃薯表皮中StKCS6基因的沉默导致表皮胶质和蜡质化合物链长减少,表皮蒸腾增加。中国机械工程学报,2009a; 20(2): 697-707。https://doi.org/10.1093/jxb/ern314.
- 65.
王志强,王志强,王志强,等。植物组织中RNA分离方法的研究。中国生物化学杂志。1987;39(1):1 - 6。https://doi.org/10.1016/0003 - 2697 (87) 90086 - 8.
- 66.
Fernández-Piñán S, López J, Armendariz I, Boher P, Figueras M, Serra O.根农杆菌和根农杆菌介导马铃薯转化及其Suberin基因启动子活性的GUS染色研究J Vis Exp. 2019;(145)。https://doi.org/10.3791/59119.
- 67.
陈晓明,陈晓明,陈晓明,等。cyp86a33靶向基因在马铃薯块茎中沉默,改变了子叶皮组成,扭曲了子叶皮片层,损害了表皮的水屏障功能。植物科学进展。2009b; 32(2): 1050-60。https://doi.org/10.1104/pp.108.127183.
- 68.
Pfaffl兆瓦。一种新的实时RT-PCR相对定量数学模型。核酸研究,2001;29(9):e45-445。https://doi.org/10.1093/nar/29.9.e45.
- 69.
李志刚,李志刚,李志刚。马铃薯在生物胁迫和非生物胁迫下实时RT-PCR归一化基因的筛选。中国机械工程学报,2005;26(4):529 - 529。https://doi.org/10.1093/jxb/eri285.
- 70.
杨晓明,杨晓明,杨晓明,等。农杆菌介导植物转化的研究进展。植物科学进展,2002;7(5):193-5。https://doi.org/10.1016/s1360 - 1385 (02) 02251 - 3.
- 71.
Llave C, Kasschau KD, Carrington JC(2000)病毒编码的转录后基因沉默抑制子靶向沉默途径中的维持步骤。Proc natacard science 97:13401-13406。10.1073 / pnas上。230334397, 24.
- 72.
朗米德B,萨尔茨堡SL.快速间隙阅读对齐领结2。光子学报。2012;9(4):357-9。https://doi.org/10.1038/nmeth.1923.
- 73.
特拉普内尔,罗伯茨A,戈夫L, Pertea G,金D, Kelley DR,等。TopHat和袖扣RNA-seq实验的差异基因和转录物表达分析。网络学报。2012;7(3):562-78。https://doi.org/10.1038/nprot.2012.016.
- 74.
Roberts A, Pachter L.流式片段分配用于实时测序实验分析。自然科学进展。2012;10(1):71-3。https://doi.org/10.1038/nmeth.2251.
- 75.
哈德卡塞尔TJ,凯莉KA。baySeq:用于识别序列计数数据中的差分表达式的经验贝叶斯方法。生物信息学。2010;11(1):422。https://doi.org/10.1186/1471-2105-11-422.
致谢
作者感谢M. Molinas教授(UdG, Girona生物系)提供了扫描电镜图像,并在转录组数据分析过程中提供了富有成效的建议和反馈。我们也感谢T. Hardcastle和B. Santos在RNA-seq数据生物信息学分析方面的支持(剑桥大学植物科学系),感谢S. Gómez (UdG,赫罗纳生物系)在开展实验室工作和照顾植物方面的宝贵帮助,感谢N. Pibernat在StRIK亚细胞定位方面的帮助。我们也感谢C. Pla教授(生物系,UdG,赫罗纳)友好地借给热循环器。
资金
这项工作得到了Educación y Ciencia部长(AGL2006-07342:基因鉴定和转基因系的获得)Innovación y Ciencia部长[AGL2009-13745, FPI授权P.B.:马铃薯基因转录谱,转基因株系的选择]部长Economía y竞争[agl2012 - 36725;AGL2015-67495-C2-1-R:蛋白的表皮解剖、转录组和细胞定位分析],universament d 'Universitats, Investigació i Societat de la Informació de Catalunya[授予M.S.博士学位],赫罗纳大学[授予S.F.-P博士学位]和欧洲区域发展基金(ERDF)。
作者信息
从属关系
贡献
PB、MS、KK、OS、MF构思设计实验;MS克隆了完整的strike - rnai转基因植株;SFP对rfp - strike融合蛋白进行亚细胞定位,PB提取RNA并纯化mRNA;PB、SM、KK进行生物信息学分析;PB和XT进行qPCR;所有作者对数据进行了分析和讨论。PB和MF撰写了手稿,所有作者都投稿并批准了手稿。
相应的作者
道德声明
伦理批准并同意参与
该实验室拥有农业部(Alimentación y Medio Ambiente)批准的许可证,可开展限制使用转基因生物的第1类活动。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:图S1
马铃薯的氨基酸排列(美国tuberosumStRIK蛋白中同源蛋白最多美国tuberosumPhureja组(PGSC0003DMP400043638),美国lycopersicum而且美国pennellii(XP_004233384.1和XP_015065578.1),拟南芥(AAY24687.1)和玉米(AAY24682.1)。还包括Lorkovic和Barta(2002)鉴定为KH结构域蛋白的拟南芥剪接因子1 sf1样At5g51300,以及马铃薯PGSC0003DMP40003285和PGSC0003DMP400012836中同源性最高的两个蛋白(分别命名为S.tubPhurSF1_1和S.tubPhurSF1_2)。这两个预测的SF1_like-KH保守蛋白结构域和Burd和Dreyfuss描述的高度保守的KH结构域核心一致序列IIGxxGxxI [21]表示。还显示了确定的脯氨酸丰富区域。相同的氨基酸用黑色表示,相似的用灰色表示。RIK和SF1序列使用以下缩写:S.tub,美国tuberosum组Tuberosum;S.tubPhur,美国tuberosum组Phureja;S.lyc,美国lycopersicum;S.pen,美国pennellii;阿拉伯人,拟南芥;Z.may,z梅斯。
附加文件2:图S2
转录本积累剖面strike和S. phureja RIK在不同的组织和条件下。(a)相对转录丰度(RTA)斯特里克RTA水平以3个技术重复的平均值±SD表示。(b)的成绩单简介里克在美国phureja(DM和RH基因型).FPKM值从马铃薯基因组测序联盟报告的数据中获得[30.]和Massa等人(2011)。从较低和较高的转录本积累分别显示红绿色梯度。(c)积累斯特里克马铃薯块茎愈合盘的转录本超过144小时。RTA水平表示为两个生物重复的平均值±SD。有非常显著的线性增加斯特里克损伤后水平(回归分析测试转录物丰度与时间的线性关系:p< 0.001)。
附加文件3:图S3
基因组斯特里克序列。核苷酸序列用于斯特里克静音用红色字体表示。的12外显子斯特里克基因在灰色阴影中。启动启动和STOP密码子用绿色突出显示。
附加文件4:图S4
目标区域为246 bp斯特里克-图上灰色划线的RNAi片段里克基因(PGSC0003DMG400025145)基因组序列在Spub DB基因组浏览器(http://solanaceae.plantbiology.msu.edu/cgi-bin/gbrowse/potato/)源自[30.].的里克该基因编码在染色体2反义链(−)之间的25,304,888-25,313,841 bp的位置美国tuberosum它由12个外显子和11个内含子组成,可转录4种预测基因亚型。的斯特里克-RNAi片段靶向代表性转录本(PGSC0003DMT400064730)中的外显子8、9和10,以及另外两个基因异构体PGSC0003DMT400064729和PGSC0003DMT400064731,而第四个也是最短的基因异构体PGSC0003DMT400064735不被RNAi片段靶向。
附加文件5:图S5
斯特里克RT-qPCR检测马铃薯a)叶片和b)块茎周皮转录物积累斯特里克-连续两次种植的rnai和Wild型品系。每一列表示三个技术重复的平均值和标准偏差。在块茎周皮中选择用于进一步测试的线用红色箭头表示。
附加文件6:表S1
BLASTN结果与马铃薯转录本数据库斯特里克-RNAi构造作为查询。
附加文件7:表S2
基因的RNA-seq结果显示Wild型和斯特里克-RNAi马铃薯块茎周皮(FDR < 0.05)。马铃薯和拟南芥基因功能注释(e值≤10−5)、基因表达水平(有效计数)和log2FC值(斯特里克-RNAi/WT)。
附加文件8:表S3
与拟南芥共表达最多的300个基因列表里克基于ATTED-II数据库(https://atted.jp/).共表达度用互秩(Mutual Rank, MR)表示。
附加文件9:表S4
与共表达基因最多的300个基因本体里克拟南芥基因分析(http://structuralbiology.cau.edu.cn/PlantGSEA/index.php).
附加文件10:表S5
所用引物清单。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
鲍赫,P., Soler, M., Fernández-Piñán, S.;et al。沉默的斯特里克表明其在与RNA加工和应激有关的表皮中起作用。BMC植物生物学21,409(2021)。https://doi.org/10.1186/s12870-021-03141-z
收到了:
接受:
发表:
关键字
- rs2相互作用的kh蛋白
- 马铃薯块茎周皮
- 开花
- RNA调控
- kh结构域rna结合蛋白