摘要
背景
植物激素乙烯在植物发育过程中控制着许多过程,并作为响应生物和非生物胁迫的关键信号分子:它在洪水、伤害、干旱和病原体攻击以及脱落和果实成熟过程中迅速诱导。猕猴桃(猕猴桃(Spp .),果实成熟的特征是两个不同的阶段:系统-1乙烯生物合成的早期阶段,以缺乏自催化乙烯为特征,随后是自催化(系统-2)乙烯的晚期爆发,伴随着香气的产生和进一步的成熟。猕猴桃果实成熟的转录调控已经取得了进展,但系统-1乙烯生物合成的调控仍不清楚。这项工作的目的是更好地了解猕猴桃器官中乙烯生物合成两个系统的转录调控:果实和叶子。
结果
猕猴桃的分子生物学研究(答:对)显示机械损伤后叶片和果实中乙烯生物合成的调控不同。在水果中,乙烯生物合成伴随着1-氨基环丙烷-1-羧酸(ACC)合酶(ACS)、ACC氧化酶(ACO)和NAC类转录因子(tf)成员的转录增加。然而,在猕猴桃叶片中,伤口特异性的转录增加基本不存在,尽管与水果相比,猕猴桃叶片诱导乙烯产生的速度更快,这表明猕猴桃叶片中的转录后控制机制更为重要。一位ACS成员,AcACS1,似乎发挥了主要的双重作用;控制果实缠绕(系统1)和自催化成熟(系统2)乙烯生物合成。在猕猴桃中,果实中system-1和-2乙烯的转录调控似乎是由四个NAC (NAM, ATAF1/2, CUC2) tf (AcNAC1-4),导致AcACS1表达式直接绑定到AcACS1启动子显示使用凝胶位移(EMSA)和激活AcACS1启动子在足底基因激活试验与启动子缺失分析相结合。
结论
研究结果表明,猕猴桃中NAC转录因子AcNAC2-4通过调控猕猴桃损伤和成熟过程中乙烯系统-1和-2的生物合成AcACS1表达水平,但不是在叶片转录后/翻译调节机制可能占上风。
背景
植物激素乙烯控制植物发育中的许多过程,并作为响应生物和非生物胁迫的关键信号分子:它被洪水、伤害、干旱和病原体攻击等胁迫信号迅速诱导[1,2,3.],以及其他重要的生理过程,如脱落、生殖生物学和果实成熟[4,5,6,7,8].乙烯通过正负反馈循环调节自身的生物合成[9,10,11,12]从而提出了两套乙烯调控体系[13].System-1乙烯具有自抑制作用,与少量乙烯有关。当乙烯被伤害或病原体诱导时,它会迅速下调。系统2是自催化的,在某些物种的果实成熟和花瓣衰老过程中发生[14,15],并且通常伴随着呼吸的增加(“更年期上升”)。
乙烯是由氨基酸蛋氨酸合成的,它被转化为年代-腺苷甲硫氨酸(SAM)合成酶。SAM经ACC合成酶(ACS)转化为1-氨基环丙烷羧酸(ACC)和5 ' -甲基硫代腺苷(MTA) [16].最后一步是ACC氧化酶(ACO)将ACC转化为乙烯[17].向植物中添加基质ACC会产生乙烯[18,19,20.],表明乙烯生物合成的关键调控步骤由ACS控制[12,17,21].ACS在植物中受到转录和转录后水平的调控。相比之下,ACO一般在系统-1中组成型表达,但在系统-2中强烈诱导,因此可能只在成熟后期起限制作用[22,23,24,25,26].
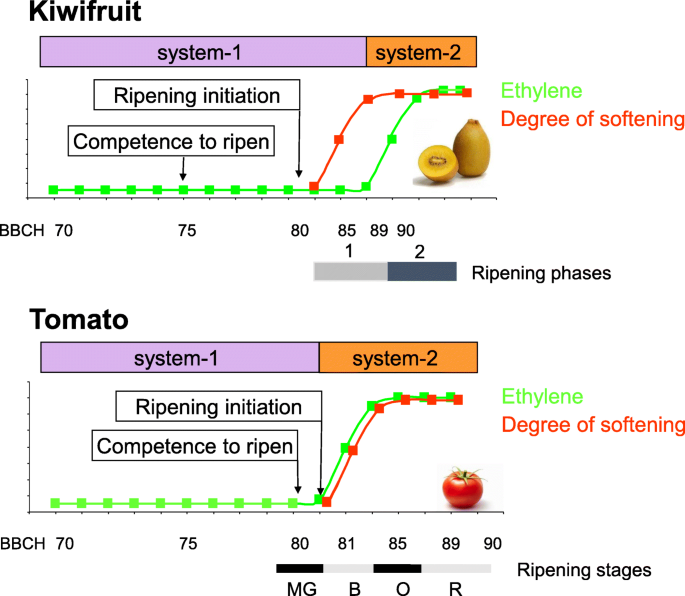
乙烯调控研究最深入的领域之一是番茄(茄属植物lycopersicum)果实的发育和成熟(图;1).番茄果实经过明确的生长阶段,从成熟的绿色、浅红色、橙色到红色,逐渐成熟[28].成熟的绿色到破碎阶段与乙烯从系统-1到系统-2的转换有关,在此期间果实迅速软化,经历颜色变化和香气挥发性增加。奇异果(猕猴桃)的果实发育也有很好的特征,通过德国生物实验室、德国生物实验室和工业化学实验室(BBCH, [29])果实生长发育的规模[27,30.].果实成熟发生在BBCH 80。在与淀粉分解相关的系统-1成熟初期(阶段1)之后,随后是软化和颜色变化,随后是系统-2(阶段2)成熟时期(BBCH 90),与香气挥发物的产生和进一步软化有关。在BBCH 80时,外源乙烯或丙烯使其逐渐成熟。然而,内源乙烯的产生在第一阶段成熟时受到抑制。的AcACS1基因与system-1和system -2的成熟有关,在第1期成熟过程中,外源丙烯处理只能短暂地诱导其表达。一旦第二阶段成熟开始,AcACS1不再压抑[30.].
植物叶片和果实的损伤与一些信号有关,这些信号随着时间和空间的推移平行地、顺序地发生。在茄科中,受伤时,小肽系统在[31]作为早期的局部和全身信号,而活性氧(ROS) [32]和寡糖,如寡半乳糖醛酸酯,也被确定为几种植物的早期创伤信号,与某些可能检测细胞壁完整性的受体信号通路结合[33,34].其他快速信号包括电子信号[35],离子通量[36]和MAP激酶信号通路[37,38].除了植物激素茉莉酸(JA)和脱落酸(ABA)外,乙烯还作为局部和系统信号参与损伤过程[16,39,40]并参与各种伤口信号通路之间的交叉对话[41].在成熟的绿番茄果实中,乙烯和乙烯的诱导作用迅速SlACS1A而且630分钟内。在受伤的叶子上,SlACS1A而且6可在10分钟内检测到感应[42], 4 h后,两种基因的表达均恢复到基线水平。在猕猴桃中,很少有人知道伤口产生乙烯。对刷刷猕猴桃去除果实毛状体的效果以及机械冲击损伤对果实成熟行为的影响的研究表明,这两种处理都加速了果实在随后贮藏期间的成熟,并伴随着乙烯产量的增加、可溶性固形物浓度的增加和硬度的降低[43,44].在这两种情况下,由果皮产生的缠绕乙烯可能是加速成熟的原因。AcACO1RNAi沉默的猕猴桃系在叶片中没有产生缠绕乙烯,在果实中也没有检测到明显水平的乙烯[45),建议AcACO1是果实和叶子乙烯产生的主要基因。
多种转录因子家族参与果实和叶片的成熟调控和乙烯转录调控。在番茄中发现了由RIN、TAGL1和ACS2组成的以MADS为中心的更年期乙烯正反馈环(system-2),而在其他更年期果实中发现了NAC或混合MADS/NAC正反馈环;所有这些回路包括乙烯稳定的EIN3(乙烯不敏感3)TF [46]但MYB转录因子也参与调控乙烯生物合成[47,48].最近对CRISPR基因敲除系的研究重新定义了野生型RIN、NAC-NOR和SBP-CNR在番茄成熟过程中的作用[49,50,51]因为这些突变系表现出更微妙的表型。在猕猴桃(答:对/答:arguta),多个家族成员的NAC TF表达在果实成熟后期被高度诱导,与乙烯的自催化生成一致,并诱导成熟相关的萜烯合酶[52]也与微RNA 164 (miR164)控制下的乙烯生产有关[53]及/或低温诱导成熟[54].一个SEP4/ rin样的MADS盒基因也与成熟水果中乙烯生物合成的调节有关[30.].在答:deliciosa除了乙烯单独处理外,茉莉酸甲酯处理可以刺激果实产生乙烯,两种NAC转录因子与成熟果实中ACS诱导增加有关[55].
虽然NAC tf参与调节果实成熟/系统-2乙烯在某些物种中已得到很好的证实,但对果实和叶片中系统-1损伤相关乙烯的产生和控制知之甚少。本研究以猕猴桃(答:对)和四个NAC tf参与乙烯生物合成基因启动子相互作用的基因调控。我们的目的是研究乙烯生产是如何被调节的,并确定不同器官和乙烯系统之间潜在的控制机制守恒。
结果
机械损伤猕猴桃未成熟果实后乙烯的产生
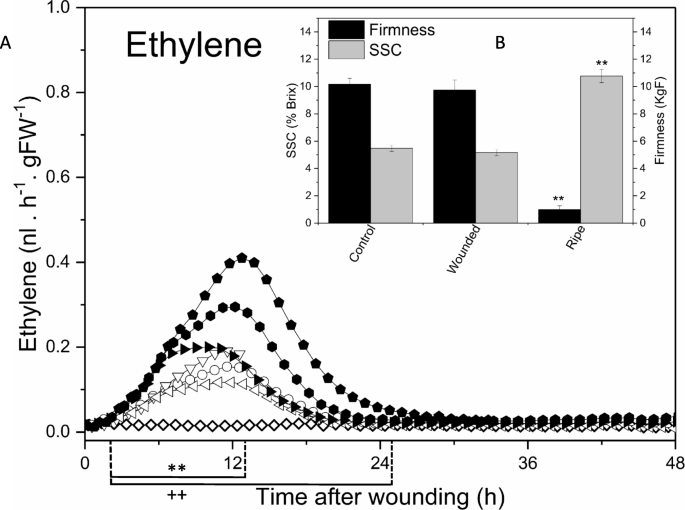
不成熟的答:对var。对' Hort16A '猕猴桃(BBCH 78]29],约占最终重量的80%,种子即将开始变黑)在开花后110天收获(DAFB) [27],并展示了系统-1乙烯反应[30.]进行外源性乙烯处理后,在两到四个切口上受伤,之后监测48小时内乙烯的产生情况,并与食用成熟水果进行比较。所有的受伤都导致了短暂的乙烯爆发,在受伤后12小时左右达到峰值(图2)。2A)有四个切口的水果比有两个切口的水果产生的乙烯大约是预期的两倍,因为伤口表面增加了。在受伤24小时后,乙烯水平迅速下降到接近基线水平,这是系统1乙烯产生的特征。在切开的水果中,可溶性糖和硬度在120小时内没有显著变化(图2)。2B) 24小时后未产生可检测到的乙烯。相比之下,吃成熟的水果更软,SSC含量高,产生的(自催化)乙烯含量要比受伤的水果高100倍。
乙烯的产生在受伤不成熟答:对Hort16A猕猴桃。(一个将果实切开2个切口(开放符号)或切开4个切口(封闭符号),以2l h的速度转移到1.5 L密封罐中−1空气流。乙烯产量在所示时间过程中连续测量。在整个实验过程中,未受伤的果实(开放的菱形果实)不产生乙烯。每个时间点从两个切口的水果中收获3个生物重复(每个重复包含3个果实)。(B可溶性固形物浓度(SSC, % Brix)和硬度(kgF)的变化。对照:无伤果;伤后120h测量切2个切口的果实;熟的:吃成熟的水果。数据为均值±标准差,n = 9个生物重复。**/++:分别在2 / 4个切割中与对照组相比有统计学差异(p< 0.01,方差分析(一个) /学生t检验(B)
番茄和猕猴桃ACS基因的比较
15个猕猴桃和14个番茄的ACS基因先前已描述[7,56],以确定那些参与乙烯生物合成的分子(图。3.).猕猴桃的四个acs样基因(AcACS3-5 7)和两个番茄基因(SlACS11 12)与转氨酶聚集在一起[58],因此不太可能参与乙烯的生物合成。基于c端序列,4个猕猴桃基因与I型ACS蛋白聚在一起(AcACS2, 8,10,11),其中3个为II型(AcACS1, 6, 9)和4个III型ACS蛋白(两对谬误序列:AcACS12/12R而且13/13R)(有关c端对齐,请参见补充图S1).在番茄中,8个acs蛋白与I型聚集在一起(图。3.,SlACS1A,1 b,2,4,6,13 - 15).四(SlACS3,5,7,8),包括第II类及两个(SlACS9而且10)III型,显示特征性c端(图;3.,补充图S1).SlACS15(类型I)可能是截断蛋白(长度333 AA),而SlACS4而且14(101 AA,截断)缺失特征I型c端残基(补充图S1).
拟南芥、番茄和猕猴桃中氨基环丙烷-1-羧酸合成酶(ACS)蛋白的一致系统谱。使用geneous MUSCLE比对工具对拟南芥(At)、番茄(Sl)和猕猴桃(Ac/蓝点)中预测的ACS蛋白进行比对,并使用1000个重复(Jukes-Cantor距离矩阵)生成一个一致的UPGMA bootstrap系统图。只显示支持阈值超过50%的分支。AT =转氨酶。I型、II型和III型ACS蛋白是根据保守的c端序列进行分配的补充图S1对齐)。I型(红色)=仅RLSF/SLSF;type II(绿色)= WVF, RLSF和RDE富结构域(TOE/ ETO1结构域的目标);type III(蓝色)= I/II型结构域的缺失(基于Yoshida et al. 2006) [57].(III) = SlACS4和13都聚集在I型,但在c端缺乏典型的I型残基补充图S1对齐)。S1, S2 =参与系统-1,- 2乙烯生产。T =参与了系统-1和-2之间的转换
未成熟果实机械损伤后乙烯生物合成基因的表达
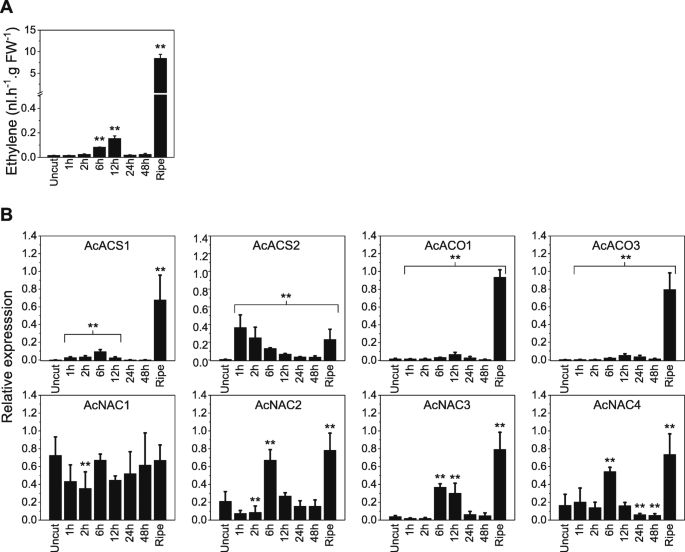
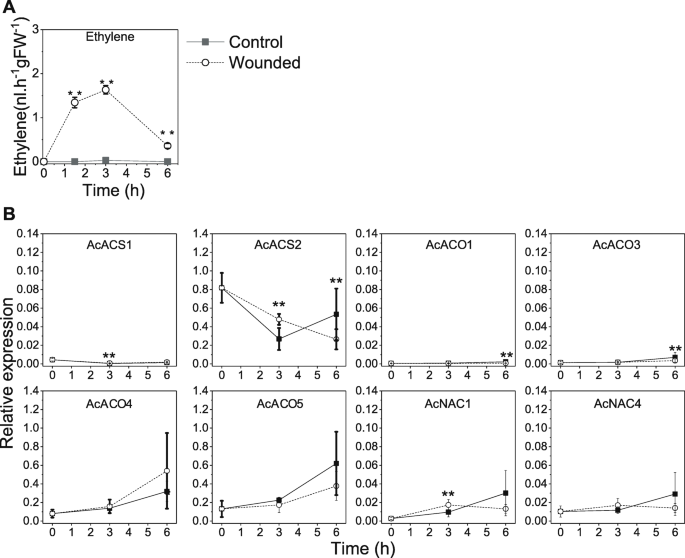
采用定量逆转录聚合酶链式反应(qRT-PCR)技术,测定猕猴桃伤后0、1、2、6、12、24、48 h提取的RNA在48 h内ACS基因的表达情况(不包括4个AT成员)。AcACS1显示在损伤期间(system-1)表达诱导最高,表达先于伤口乙烯释放,远低于成熟水果(图1)。4).AcACS2在损伤阶段表现出快速诱导,但总体峰值转录水平估计为>比AcACS1(补充表S1-比率)在缠绕乙烯生产阶段。其他8个ACS基因在实验过程中表现出较低的整体转录水平(补充表S1).
(一个)机械伤后未成熟乙烯的产生答:对“Hort16A”水果。时间过程如图所示。2A与成熟的水果作比较。(B)乙烯生物合成(ACS、ACO)基因和NAC tf基因在损伤果实中的表达分析。数据为平均比率校准±SD, n = 3个生物重复,并表示为与PP2A参考基因。* *:p根据混合模型统计(R包nlme和emmeans,如材料和方法中所述),与未损伤水果相比,差异显著< 0.01
猕猴桃基因组中9个ACO基因的表达[56]也在机械损伤成熟水果后进行监测。的表达AcACO1而且AcACO3在整个时间过程中密切反映乙烯水平,在受伤后12小时达到峰值(系统1),总体上在成熟果实中表达最高(系统2)。与对照组相比,其他7个ACO基因在时间过程中表现出较低的表达水平或无表达AcACO1而且AcACO3(补充表S1).
猕猴桃NAC转录因子参与system-1和-2乙烯生物合成
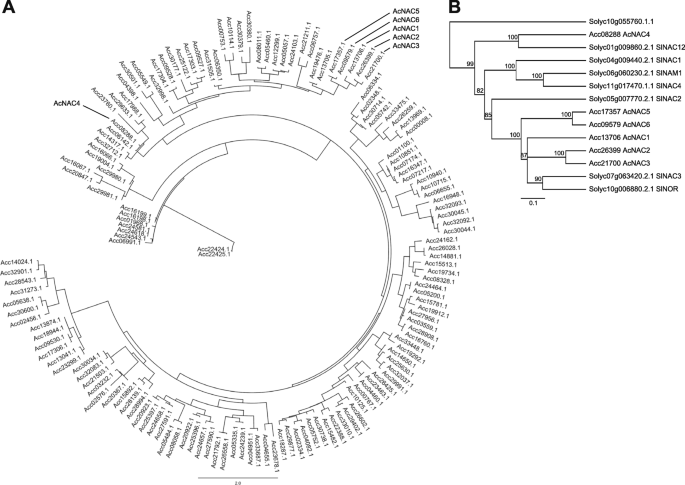
对猕猴桃基因组的分析在猕猴桃基因组中确定了147个假定的NAC家族成员。5;补充表S2).与猕猴桃的成熟有关AcNAC1-3先前描述的基因[52紧紧地聚集在一起SlNOR(LeNOR)而且SlNAC3(无花果。5),并显示了整个蛋白质长度的保守性,包括c端“WYS”尾巴,该尾巴也存在于拟南芥NARS1和NARS2 (NAM)蛋白质中[60参与胚胎发生。另外两个猕猴桃基因与SlNOR(无花果。5) (Acc17357和Acc09579,以下简称AcNAC5而且6但没有保守的c端(而分别是WNL/WNS)。AcNAC4集群与SlNAC12(Solyc01g009860.1/SGN-U563196)在另一组长度更短(< 300个氨基酸)且没有保守的c端的蛋白质中,而SlNAC2[61]位于两组之间(图;5).
猕猴桃NAC转录因子的系统发育分析。(一个)中确定的147个假定的NAC tf答:对“Red5”基因组(参见补充表S2)最初使用geneous MUSCLE对齐工具对齐,然后手动策划。提取DNA结合位点,用Muscle进行重组。Phyml [59]构造树,采用JTT (Jones, Taylor & Thornton)代入法,计算参数默认,以Acc22424.1和Acc22425.1作为外组进行根。(B猕猴桃(Ac)和番茄(Solyc) NAC tf(完全orf)的UPGMA共识树。该树使用1000个重复生成(Jukes-Cantor距离矩阵)。只显示支持阈值超过50%的分支。使用Solyc10g55760作为外组
AcNAC2-4表达量在伤后6 h达到峰值,随后迅速下降。的表达式AcNAC2-4紧密地反映了感应AcACS1伤口处理后(图;4B)。AcNAC1在未受伤/受伤水果中基本呈高水平的构成性表达,仅在2小时时间点表达量下降。AcNAC5而且AcNAC6在损伤过程中也有一定的诱导作用,在损伤后6小时达到峰值,在成熟果实中再次出现诱导作用(补充表S1-比率),但转录水平较低。果实表达高峰AcNAC2-6乙烯含量均在成熟果实中最高。4A / B)。
猕猴桃叶片损伤后乙烯生成及基因表达分析
AcACO1RNAi沉默的猕猴桃系在叶片中不产生损伤(系统-1)乙烯,在成熟果实中也没有检测到系统-2乙烯[45].这些结果表明水果和叶子产生乙烯之间存在联系,两者都依赖于AcACO1表达式。为了研究猕猴桃叶片中system-1乙烯的产生规律,利用96孔“针孔工具”对膨胀的叶片进行机械穿透。与水果相比,乙烯释放在受伤后3小时达到峰值,6小时后恢复到接近基线(图2)。6A). qRT-PCR分析表明,叶片损伤后ACS、ACO或NAC基因表达均无明显上调(图;6B和补充表S1),表明猕猴桃叶片中乙烯的诱导不涉及乙烯生物合成基因或上游NAC tf的转录增加,而更有可能是由上游的其他步骤或转录后或翻译水平控制。与水果相比,AcACO1而且3.表达水平较低AcACO4而且5在叶片(补充表S1,比)。
NAC转录因子答:对激活ACS启动子
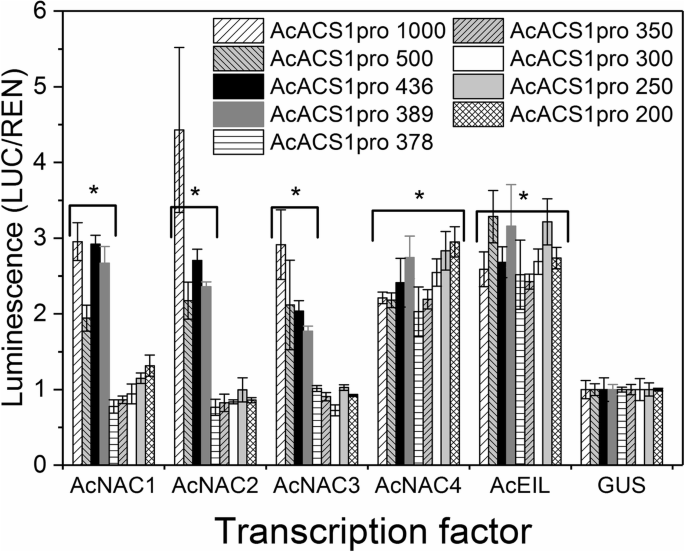
两者之间有很强的相关性AcNAC2-4而且AcACS1基因在猕猴桃中的表达提示NAC tf可能直接激活AcACS1促进子在受伤的果实(系统1)和成熟的猕猴桃(系统2)。的1kb片段AcACS1上游区域由答:对使用萤火虫荧光素酶报告基因系统分析' Hort16A '基因组DNA和启动子缺失系列[62].显著激活AcACS1AcNAC1、2、3和4个tf分别检测启动子,以及4个AcEIL1-4 (AcEIN3-like) tf使用1000、500、436和389 bp的启动子片段观察启动子(图2)。7)的上游。与GUS对照结构相比,AcNAC1-3与378、350、300、250或200 bp的较短启动子片段结合时未观察到激活。相反,激活AcACS1AcNAC4和AcEIL1-4启动子池与所有这些小片段进行了观察。这些数据表明,AcNAC1-3的结合位点存在于上游384 bp左右,AcNAC4和AcEIL的结合位点可能存在于近端。
NAC (NAM, ATAF1/2, CUC2)和EIL(乙烯-不敏感3样)tf使用基因缺失激活启动子中国羊草Hort16A”AcACS1启动子。不同大小的AcACS1在起始ATG帧中,克隆pGreenII-0800LUC LUC报告基因上游的调节区(< 1000 bp) (AcACS1pro +长度,单位bp),并检测其瞬时激活n benthamiana.转录因子LUC/REN发光比值AcNAC1-AcNAC4还有一池AcEIL1-4(等量的AcEIL1-4)与设置为1的GUS控制结构进行比较。经方差分析(ANOVA)后,采用Tukey诚实显著性差异检验(HSD)与GUS进行统计学比较。数据为均值±标准差,n = 3个生物重复(植物),*不同于p< 0.05
NAC转录因子直接与猕猴桃AcACS1启动子结合
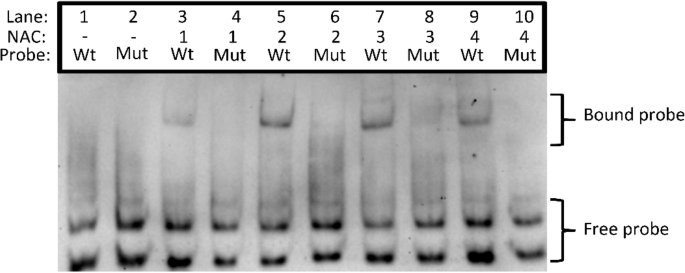
的猕猴桃AcACS1活化研究表明,在ATG上游389 ~ 378 bp之间可能存在一个NAC DNA结合位点。为了进一步研究这个潜在的结合位点,使用野生型(Wt)和突变(Mut)启动子片段(假定的回文NAC结合位点TATACGTATA是随机突变的)围绕该位点进行EMSA(电泳迁移率漂移测定)/凝胶漂移(图2)。8,补充图S2).双链野生型和突变生物素标记探针在缺乏NAC蛋白的凝胶基质中快速迁移(图2)。8Wt探针在与纯化的NAC1、NAC2、NAC3和NAC4蛋白(结合探针,3、5、7、9通道)孵育时显著延迟,而与Mut探针(4、6、8、10通道)孵育时则没有延迟。这些数据表明,AcNAC1-4转录因子根据启动子缺失结果特异性结合到该区域的野生型版本(27 bp),并需要TATACGTATA回文序列进行结合。启动子激活和EMSA结果共同支持NAC直接激活AcACS1在ATG上游389 - 378 bp之间的结合位点上发现了启动子,而启动子激活数据表明,AcNAC4和AcEIL在近端区域存在更多的结合位点。
电泳迁移率位移分析(EMSA)AcACS1启动子片段(27 bp)与重组NAC1-4蛋白。NAC1-4的DNA结合域(Nieuwenhuizen et al. 2015描述[52]中表达过度大肠杆菌作为麦芽糖结合蛋白(MBP)标记的融合蛋白,并通过直链树脂亲和纯化和EMSA纯化,根据Nieuwenhuizen et al. (2015) [52].Wt =野生型双链DNA探针,推定NAC回文结合位点(下划线):CATTATACGTATAGTCAACCACATAAC。Mut =突变双链DNA探针,NAC结合位点随机突变(斜体/下划线):CATCGATCCATCTGTCAACCACATAAC。NAC = mmp - nac1,−NAC2,−NAC3或-NAC4
讨论
系统-1和-2调节
比较猕猴桃的两个不同器官,提供了乙烯系统-1和系统-2生物合成转录调控的对比。在猕猴桃未成熟果实损伤(system-1)和乙烯自催化成熟(system-2)过程中,ACS活性似乎主要由单个基因的转录诱导控制,AcACS1在自催化乙烯生产过程中,成熟水果中也高度诱导产生乙烯(图2)。4).在猕猴桃叶片损伤中,乙烯也会产生,但速度要快得多,在3小时达到峰值,令人惊讶的是,任何ACS基因的表达都没有相关的增加。6而且补充表S1).AcACS1而且AcACS2是在未受伤/受伤叶片中唯一表达的两个基因,这表明这两个基因参与了叶片乙烯的产生,但在受伤时都没有显示出转录的增加(图。6,补充表S1).受伤猕猴桃叶片中乙烯生物合成的快速增加似乎主要是在转录后水平上受到调控。ACO或NAC基因的表达在叶片损伤过程中变化不大(图2)。6而且补充表S1).在番茄中,SlACS2在受伤后的转录后调控已被证明[63].在果实成熟后期(系统-2乙烯生物合成),转录上调AcACS1在猕猴桃,和SlACS2而且4是重要的调节步骤,但蛋白质的磷酸化可能是实现自催化阶段所需的高水平ACS酶活性的重要附加机制,也可能涉及伤口反应。
基于c端CDPK磷酸化位点的存在或不存在以及ETO1相互作用特征,至少有三种不同类型的ACS蛋白已经被鉴定出来[57(图。3.;S1).而SlACS1A,2而且6还有AcACS2均属于I型(CDPK磷酸化),表达为主AcACS1猕猴桃中的II型基因与eto1依赖活性抑制和26S蛋白酶体降解的翻译后控制相关。而SlACS4也与I型聚类,它缺少关键的c端特征残基(补充图S1- RLSF/SLSF motif),因此可能像III型ACS。研究AtACS7调控(III型)发现了一种环型E3连接酶XBAT32,它通过靶向26S蛋白酶体途径在调节III型和II型ACS蛋白稳定性中发挥作用[64].
系统-1和-2乙烯产生的调节可能与其他激素有关。分析AcNAC1-4而且AcACS1 2启动子的答:对确定了上游几个推定的MYC结合位点(补充图S3),可能在JA信号传导中发挥作用[65].在答:deliciosa甲基ja处理增强乙烯诱导的成熟,与诱导的增加相关AdNAC2,3.和下游AdACS1,−2[66在植物中,JA在几分钟内快速致伤已被广泛报道。一个推测的NAC结合位点在硅晶片/体外检测中被鉴定为在dna上游约2.2 kb处AdACS1启动子,但未被启动子缺失分析证实在足底[66].有进一步的报道称JA中间体顺式opda可能也有其自身独特的信号活性[67,68].在番茄,SlAREB1转录激活SlNOR在番茄果实成熟过程中参与脱落酸调节的乙烯生物合成,并可能在损伤和NAC表达之间提供另一种早期激素联系[69].
ACS的转录控制
在猕猴桃中,几种NAC tf在果实成熟过程中强烈上调,并诱导萜烯合成[52].我们已经证明过了AcNAC2-4在果实损伤过程中诱导的水平较低,而AcNAC2-4诱导与AcACS1在果实损伤(低峰值表达)和成熟(最高表达)时均有较高的表达量,而未诱导NAC TFs和AcACS1在叶片损伤过程中观察到。6而且补充表S2).这并不是调节猕猴桃成熟的唯一机制。在答:deliciosa,AdNAC6而且7已经被证明可以调节AdACS1而且AdACO1启动子。当这些NAC基因3 '端存在的miRNA结合位点被烧蚀时,它们能够诱导启动子活性,这表明miRNA水平可能通过影响NAC mRNA功能来影响成熟[70].
在番茄中,在果实成熟和system-2乙烯生成过程中,ACS和ACO转录受到转录因子的复杂控制,如SlHB1,它可以结合到番茄的同型盒顺式元素上SlACO1果实发育启动子及调控基因表达[71].转录因子成熟抑制因子(RIN的表达SlACS2在果实成熟过程中与CArG基序结合[72的启动子区域相互作用SlACS4[73].马特尔等人(2011)[74的相关性显著SlRIN表达,SlRIN丰度,和SlACS2表达式。然而,最近的研究表明,SlRIN可能与其他sep样基因冗余作用,激活ACS基因,其作用已被重新评估[49,75].SlERF2 / TERF2是另一类tf的代表(ERF/AP2域),具体与NtACS3烟草促进剂在体内及体外的研究[76].
在番茄中,几种NAC转录因子也与乙烯生物合成的调控有关。番茄NAC TF突变体也不是由突变引起的SlNOR基因(74,77,78],但野生型NOR的影响可能不那么明显[50].一个密切相关基因的敲除SlNAC3(NOR-like1)亦会延迟果实成熟及影响种子发育[79,80].第三个NAC TF过表达SlNAC1通过与乙烯生物合成基因启动子中的调控区域相互作用抑制果实成熟(SlACS2而且SlACO1),由酵母单杂交显示[81].番茄NAC基因SlNAC4也与调控成熟有关。在SlNAC4RNAi果实,表达SlACS2而且4还有SlACO1而且3.在成熟过程中被抑制,尽管没有证据表明直接启动子相互作用[82].
在猕猴桃和番茄中,与呼吸更年期相关的乙烯产生似乎受到不同机制的控制。1).在猕猴桃中,只有一个ACS基因(AcACS1)似乎与水果系统1和系统2的乙烯产生最相关。这表明AcACS1在果实中,不同的复合物控制着系统-1和系统-2的反应,但其他ACS基因可能参与了其他类型的乙烯生物合成,例如在不同的胁迫和花瓣场景中。例如,在拟南芥中,所有12个ACS基因在整个生长发育过程中以及在各种胁迫条件下都表现出不同的表达模式,而在番茄中,9个ACS基因中只有4个在水果中表达[83,84].在猕猴桃中,缓慢的成熟进程导致了乙烯的发生。1)可能指出在生产自催化乙烯之前需要克服系统-1反应。在番茄中,两组ACS基因(SlACS4而且2)与更年期有关。SlACS2在染色质水平通过可达性、DNA甲基化和组蛋白修饰进行调控[46,85),而SlACS1A而且6都与系统-1相连。
结论
机械损伤后,一系列复杂的快速局部和远端信号事件,以及激素和细胞反应被诱导。通过比较猕猴桃果实和叶片的损伤反应,本工作揭示了NAC在果实中损伤诱导的系统-1和自催化成熟的系统-2乙烯生物合成中的关键转录调控机制。在猕猴桃中,NAC和TF (AcNAC2-4),AcACS1果实中的转录水平,而在叶片中,转录后/ -翻译机制更可能参与以更快速的方式诱导损伤乙烯。
方法
植物材料和缠绕乙烯测量
不成熟的答:对var。对“Hort16A”果实采自新西兰植物和食品研究有限公司(PFR)的果园,在约110 DAFB/BBCH 78或最终果实重量的80%,然后在室温下保存。答:对“Hort16A”叶片材料(约10厘米长的幼叶)于11月在新西兰奥克兰阿尔伯特山研究中心的PFR温室中在常温和光照下种植的盆栽植物中获得。吃熟的答:对“Hort16A”水果也从新西兰里瓦卡的PFR获得。BBCH量表[29],开花时间为BBCH 60,果实发育时间为BBCH 70,果实成熟和成熟时间为BBCH 80。
答:对“Hort16A”果实用美工刀从果实的远端到近端(花梗)切出两个或四个相反的5毫米深的纵向切口。伤后48小时(伤后0、1、2、6、12、24、48小时)对果实取样,提取乙烯和RNA。分别对四切组和两切组进行方差分析(ANOVA),以确定时间点和时间零点之间乙烯产量的显著差异。乙烯测量在建模之前进行对数转换,以调整不同时间点之间的不平等方差。R 3.5.1版本[86],使用R包nlme(3.1-137版本)和emmeans(1.3.4版本)构建对比[87,88].
在所示时间采集切口周围1厘米宽的楔形物,包括皮肤,并在液氮中快速冷冻以提取RNA。对于叶片损伤,分离的叶片(不包括叶柄)在分离后立即用96孔销钉工具(含有直径2.5 mm、长度3 cm的扁钢销钉)穿孔,并在6小时内采样。乙烯测量使用ETD-300乙烯探测器与阀门控制箱(Sensor Sense,荷兰)。测量在0.75 L或1.5 L密封罐中进行,连续流速为2 L h−1过滤(干燥和CO2空气擦洗)。水果硬度(kgF)使用Effegi手持穿透仪(Facchini, Alfonsine, Italy)和7.9 mm探针测量,而SSC (% brix)使用电子Atago PAL-1折光仪(Tokyo, Japan)测量。在伤后120 h测定可溶性固形物浓度(SSC)和硬度变化。
蛋白质鉴定、比对及系统发育分析
猕猴桃ACS、ACO和NAC tf经BLASTP搜索(截断e−1)的答:对“Red5”基因组[56].氨基酸校准使用genous Muscle校准工具,使用默认参数和25次最大迭代(www.geneious.com),然后手动策划。系统发育关系评估使用遗传树生成器(www.geneious.com)与Jukes-Cantor遗传距离模型[89], UPGMA树构建方法[90]和1000个bootstrap重新采样,使用至少50%的支持阈值。
定量反转录PCR (qRT-PCR)分析
总RNA采用“松树”法组合提取[91]和Spectrum Plant Total RNA试剂盒(Sigma-Aldrich, USA)。简言之,将100 mg冷冻和研磨的组织与650 μl“Pine Tree”提取缓冲液混合,在65℃下摇匀孵育5 min。然后用等体积的氯仿:异戊醇24:1提取液体一次。将水相转移到Spectrum RNA试剂盒的过滤柱中,然后根据制造商的说明进行RNA纯化。DNaseI处理总RNA后,用基因特异性引物合成第一链cDNA并进行表达分析(补充表S3)在LightCycler 480平台(Roche, USA)上使用SYBR Green Master Mix(如前所述)进行[52]使用转录子第一链cDNA合成试剂盒(Roche, USA)。在对四个内参基因(EF1α、UBC9、PP2A和Actin)进行评价后,对样品进行PP2A归一化[92,93,94,95使用GeNorm [96]及BestKeeper [97]基于水果和叶子的组合数据集。(补充表S4).表达式计算包含引物效率(E),这是基于模板的连续稀释(见补充表S3参考引物)。使用LightCycler®480软件1.5计算的目标/参考比分析数据,(补充表S1),使用以下公式:Ratio = E (裁判)Cq样本/ e (目标)Cq样本,校准比率(CAL) =比率÷ (E (裁判)Cq校准器/ e (目标)Cq校准器).在本研究中,给定目标的校准器定义为在果叶联合数据集中具有最高目标基因表达(最低目标Cq)的生物复制。为了进行统计分析,基因表达数据进行对数转换,以调整处理组之间的不平等方差,然后将数据拟合到混合模型中。治疗拟合为固定效应,复制拟合为随机效应。在每个时间点,对比非损伤和损伤样本,以确定显著差异。所有分析均采用R 3.5.1版本[86].分别使用R包nlme(3.1-137版本)和emmeans(1.3.4版本)进行混合模型和对比[87,88].
荧光素酶瞬时表达启动子分析
1kb启动子和更小的片段AcACS1包括5 ' -未翻译区(5 ' -UTR)中国羊草Hort16A '进入NcoI/ATG起始点pGII0800-LUC [62]使用中列出的引物补充表S3.NAC和EIL完整的TF开放阅读框(orf)是从成熟果实的cDNA中克隆出来的中国羊草Hort16A '使用引物列出补充表S3进入CaMV 35s启动子驱动的pHEX2载体[62].启动子激活是通过比较萤火虫(Photinus pyralis)萤光素酶:renilla (Renilla reniformis) 3-4 d后荧光素酶发光比(LUC/REN)测定n benthamiana渗透(62].启动子与TF的比例为1:4,如所述[52].
电泳迁移率漂移测定
DNA结合域(来自每个NAC TF的182个n端氨基酸)在载体pMAL-c2x (New England Biolabs, USA)的麦芽糖结合蛋白纯化标签(MBP)后面的框架中被钝化克隆XmnI网站和BamHI限制性位点(引物参见补充表S3).蛋白表达于DH5α大肠杆菌根据制造商说明书(New England Biolabs, USA)使用直链淀粉树脂纯化细胞,并在柱状缓冲液中洗脱[20mm Tris-HCl pH 7.4, 0.2 M NaCl, 1mm EDTA和10mm麦芽糖]。将~ 2.5 μg重组NAC蛋白与0.9 pmol双链3 ' -生物素化DNA探针(EMSA探针;补充表S3),在20 μL的室温下反应15 min,制备结合缓冲液[0.2 mM二硫苏糖醇,0.02 mM EDTA, 5 mM HEPES-KOH, pH 7.6, 30 mM氯化钠,0.8 μg鲑鱼精子DNA(剪切后),0.2 μg poly (dI-dC)]。在含5% (v/v)甘油的0.5% (w/v)三硼酸EDTA缓冲液中,pH 8.3, 200 v, 4℃,25 min,电泳分离4% (w/v)聚丙烯酰胺凝胶。凝胶被电印迹到带正电荷的Hybond N+膜上(GE Healthcare;25 V/15分钟),并使用120 mJ cm的UVC500 (Hoefer)交联−2.印迹在1倍酪蛋白阻断溶液(Sigma Aldrich, USA, #B6429)中被阻断30分钟,并与1:2000链蛋白- hrp (Bio-Rad, USA)在阻断缓冲液中孵育1小时,并根据制造商的说明清洗(Sigma Aldrich, USA)。使用ChemiDoc MP成像仪(Bio-Rad)在ECL Select衬底(GE Healthcare)上进行成像。
数据和材料的可用性
在本研究过程中产生或分析的所有数据都包含在本文及其补充信息文件中。
缩写
- 阿坝:
-
脱落酸
- ACC:
-
1-Aminocyclopropane-1-carboxylic酸
- ACS:
-
ACC合酶
- 华:
-
ACC氧化酶
- :
-
转氨酶
- BBCH:
-
德国生物研究所,德国农业和化学工业研究所
- DAFB:
-
盛开后的日子
- EIN3:
-
Ethylene-insensitive3
- EMSA:
-
电泳迁移率漂移测定
- 是:
-
茉莉酸
- MTA:
-
5 ' -Methylthioadenosine
- 南京:
-
Nam ataf1/2 cuc2
- 也没有:
-
Non-ripening
- 存在:
-
定量逆转录聚合酶链反应
- RIN:
-
成熟抑制剂
- ROS:
-
活性氧
- 山姆:
-
S-adenosylmethionine
- TF:
-
转录因子
参考文献
- 1.
Morgan PW, Drew MC.乙烯和植物对胁迫的反应。植物科学。1997;100(3):620-30。https://doi.org/10.1111/j.1399-3054.1997.tb03068.x.
- 2.
Pierik R, Sasidharan R, Voesenek LACJ。乙烯控制生长:调节表型以适应环境。植物生长学报。2007;26(2):188-200。https://doi.org/10.1007/s00344-006-0124-4.
- 3.
茉莉酸盐和乙烯在非生物胁迫耐受中的不同作用。植物科学进展,2015;20(4):219-29。https://doi.org/10.1016/j.tplants.2015.02.001.
- 4.
杰克逊MB,奥斯本DJ。乙烯,叶片脱落的天然调节剂。大自然。1970;225(5237):1019 - 22所示。https://doi.org/10.1038/2251019a0.
- 5.
梅尔S,哲学哈达斯S,里奥夫J,塔克ML,帕特森SE,罗伯茨JA。花和器官脱落调控中乙烯依赖和乙烯独立途径的重新评价。中国生物医学工程学报,2019;29(5):457 - 457。https://doi.org/10.1093/jxb/erz038.
- 6.
De la Torre F, Del Carmen R-GM, Matilla AJ。乙烯如何在高等植物的生殖器官中起作用:来自第三个千年的信号更新。植物信号行为学。2006;1(5):231-42。https://doi.org/10.4161/psb.1.5.3389.
- 7.
刘春梅,王晓明,王晓明,杨晓明。乙烯对果实成熟的调控作用。中国生物医学工程学报,2015;29(4):339 - 339。https://doi.org/10.1104/pp.15.01361.
- 8.
Ferradás Y, Rey M, González MV。猕猴桃柱头臂乙烯合成和信号基因的表达分析及其在程序性细胞死亡过程中的参与。中国生物医学工程学报。2019;https://doi.org/10.1016/j.jplph.2019.153021.
- 9.
杨顺生,李国强。柑橘皮盘中乙烯产生的自抑制-1-氨基环丙烷-1-羧酸合成的抑制。植物学报。1982;69(3):687-90。https://doi.org/10.1104/pp.69.3.687.
- 10.
杨顺生,李国强。甘露醇对柑橘叶盘乙烯生成的刺激作用。植物学报。1982;70(1):142-6。https://doi.org/10.1104/pp.70.1.142.
- 11.
乙烯生物合成。植物学报,1993;44(1):283-307。https://doi.org/10.1146/annurev.pp.44.060193.001435.
- 12.
中冢A,村立S,大陆H,盐美S,中野R,久保Y,等。1-氨基环丙烷-1-羧酸合酶、1-氨基环丙烷-1-羧酸氧化酶和乙烯受体基因在番茄果实发育成熟过程中的差异表达及内部反馈调控植物科学进展。1998;18(4):1295-305。https://doi.org/10.1104/pp.118.4.1295.
- 13.
McMurchie EJ, McGlasson WB, Eaks IL.丙烯处理水果提供了乙烯生物成因的信息。大自然。1972;237(5352):235 - 6。https://doi.org/10.1038/237235a0.
- 14.
伍德森WR,劳顿KA乙烯诱导的康乃馨花瓣基因表达:与乙烯自催化生产和衰老的关系。植物科学进展。1988;32(2):498-503。https://doi.org/10.1104/pp.87.2.498.
- 15.
Woodson WR, Hanchey SH, Chisholm DN。乙烯在芙蓉离体花瓣衰老中的作用。植物学报。1985;79(3):679-83。https://doi.org/10.1104/pp.79.3.679.
- 16.
Boller T, Herner RC, Kende H.乙烯前体,1-氨基环丙烷-1-羧酸的测定和酶促生成。足底。1979;145(3):293 - 303。https://doi.org/10.1007/BF00454455.
- 17.
杨顺峰,Hoffman NE。乙烯在高等植物中的生物合成及其调控。植物学报,1984;35(1):155-89。https://doi.org/10.1146/annurev.pp.35.060184.001103.
- 18.
于亚波,杜国强,杨顺峰。绿豆下胚轴生长素诱导乙烯生成的调控:1-氨基环丙烷-1-羧酸的作用。植物学报。1979;63(3):589-90。https://doi.org/10.1104/pp.63.3.589.
- 19.
杨顺峰,杨晓峰。水分亏缺诱导胁迫乙烯的生物合成。植物学报。1981;68(3):596 - 6。https://doi.org/10.1104/pp.68.3.594.
- 20.
霍格赛特,拉巴RM,廷吉DT。大豆幼苗胁迫乙烯的生物合成:与内源乙烯生物合成的相似性。植物科学。1981;53(3):307-14。https://doi.org/10.1111/j.1399-3054.1981.tb04505.x.
- 21.
杨顺丰,杨晓东,杨晓东。分析LE-ACS31-氨基环丙烷-1-羧酸合成酶基因在番茄根系淹水过程中表达。中国生物医学工程学报,2001;29(3):516 - 516。https://doi.org/10.1074/jbc.270.23.14056.
- 22.
Van de Poel B, Bulens I. Hertog MLATM, Nicolai BM, Geeraerd AH, Oppermann Y, Sauter M, de Proft MP: ac -氧化酶是番茄采后贮藏乙烯生物合成的限速步骤。植物学报。2012;945:429-34。
- 23.
杨树ACC氧化酶的不对称表达控制了木材重力诱导过程中乙烯的产生。植物学报,2003;34(3):339-49。https://doi.org/10.1046/j.1365-313X.2003.01727.x.
- 24.
秦玉梅,胡春春,庞毅,Kastaniotis AJ, Hiltunen JK,朱yx。饱和超长链脂肪酸通过激活乙烯生物合成促进棉纤维和拟南芥细胞伸长。植物学报。2007;19(11):3692-704。https://doi.org/10.1105/tpc.107.054437.
- 25.
魏瑞岑,胡尔津克,马丽妮,吴森涅克。1-氨基环丙烷-1-羧酸氧化酶活性限制乙烯的生物合成Rumex palustris在下沉。植物科学进展。1999;21(1):379 - 379。https://doi.org/10.1104/pp.121.1.189.
- 26.
Van de Poel B, Bulens I, Markoula A, Hertog MLATM, Dreesen R, Wirtz M,等。番茄果实的目标系统生物学分析揭示了在更年期后成熟过程中,阳周期的协调和乙烯生物合成的独特调控。中国生物医学工程学报,2012;29(3):344 - 344。https://doi.org/10.1104/pp.112.206086.
- 27.
Richardson AC, Boldingh HL, McAtee PA, Gunaseelan K, Luo ZW, Atkinson RG,等。二倍体猕猴桃的果实发育猕猴桃对“Hort16A”。植物学报。2011;11(1):182。https://doi.org/10.1186/1471-2229-11-182.
- 28.
Feller C, Bleiholder H, Buhr L, Hack H, Heß M, Klose R, Meier U, staau ß R, van den Boom T, Weber E. Phänologische entwicklungsstadien von gemüsepflanzen: 2。Fruchtgemüse和hülsenfrüchte。《德国农业科学》1995;47(9)。
- 29.
张志刚,张志刚,张志刚,等。用扩展的BBCH量表描述单子叶和双子叶杂草的生长阶段。杂草学报,1997;37(6):433-41。https://doi.org/10.1046/j.1365-3180.1997.d01-70.x.
- 30.
陈晓东,陈晓东,陈晓东,陈晓东,等。猕猴桃非乙烯与乙烯混合成熟的响应(猕猴桃对)与MADS-box转录因子的差异调控有关。中国生物医学工程学报。2015;15(1):304。https://doi.org/10.1186/s12870-015-0697-9.
- 31.
Jacinto T, mcgull B, Franceschi V, DelanoFreier J, Ryan CA.番茄原系统素启动子在转基因番茄植株中诱导-葡萄糖醛酸酶基因的特异性表达。足底。1997;203(4):406 - 12所示。https://doi.org/10.1007/s004250050207.
- 32.
米特勒R, Vanderauwera S, Suzuki N, Miller G, Tognetti VB, Vandepoele K,等。ROS信号:新浪潮?植物科学进展,2011;16(6):300-9。https://doi.org/10.1016/j.tplants.2011.03.007.
- 33.
hemy K, Sado PE, Van Tuinen A, Rochange S, Desnos T, Balzergue S,等。受体样激酶介导拟南芥细胞对纤维素合成抑制的反应。动物学报,2007;17(11):922-31。https://doi.org/10.1016/j.cub.2007.05.018.
- 34.
Gramegna G, Modesti V, Savatin DV, Sicilia F, Cervone F, De Lorenzo G. GRP-3和KAPP编码WAK1交互子,对低聚半乳糖醛酸酯诱导的防御反应和局部损伤反应产生负向影响。中国科学(d辑),2016;26(6):344 - 344。https://doi.org/10.1093/jxb/erv563.
- 35.
Wildon DC, Thain JF, Minchin PEH, Gubb IR, Reilly AJ, Skipper YD,等。损伤植物的电信号和系统蛋白酶抑制剂诱导。大自然。1992;360(6399):62 - 5。https://doi.org/10.1038/360062a0.
- 36.
杨晓明,王晓明,王晓明,等。玉米初生根损伤对膜电压、内源电流和离子通量的影响。植物科学进展。1997;14(3):989-98。https://doi.org/10.1104/pp.114.3.989.
- 37.
萨瓦廷DV,格拉梅尼亚G,莫德斯蒂V,瑟沃内F.植物组织损伤:危险通道的防御。4 .前沿植物科学2014;https://doi.org/10.3389/fpls.2014.00470.
- 38.
中田伟,张志刚,张志刚。植物胁迫信号通路中MAP激酶的研究进展。植物科学进展,2005;10(7):339-46。https://doi.org/10.1016/j.tplants.2005.05.009.
- 39.
乙烯和伤口信号调节局部和全身转录win2转基因马铃薯植株中的基因。植物物理学报。1991;96(3):943-51。https://doi.org/10.1104/pp.96.3.943.
- 40.
Hildmann T, Ebneth M, Penacortes H, Sanchezserrano JJ, Willmitzer L, Prat S.脱落酸和茉莉酸在机械损伤基因激活中的一般作用。植物学报。1992;4(9):1157-70。https://doi.org/10.1105/tpc.4.9.1157.
- 41.
罗霍,李昂,桑切斯-塞拉诺。拟南芥伤口信号通路之间的交叉信号决定了局部与全身的基因表达。植物学报,1999;20(2):135-42。https://doi.org/10.1046/j.1365-313x.1999.00570.x.
- 42.
杨晓明,李志刚,杨晓明。番茄1-氨基环丙烷-1-羧酸合酶同基因的快速表达。植物生理学报。1999;40(7):709-15。https://doi.org/10.1093/oxfordjournals.pcp.a029597.
- 43.
马桑提尼R,兰萨罗塔L,博通迪R,门卡雷利F.猕猴桃成熟后的模拟刷。Hortscience。1995;30(3):566 - 9。https://doi.org/10.21273/HORTSCI.30.3.566.
- 44.
门卡雷利F,马桑提尼R,博通迪R。冲击面和温度对猕猴桃成熟响应的影响。采后生物技术,1996;8(3):165-77。https://doi.org/10.1016/0925 - 5214 (95) 00070 - 4.
- 45.
Atkinson RG, Gunaseelan K, Wang MY, Luo L, Wang T, Norling CL,等。猕猴桃中更年期乙烯作用的剖析(猕猴桃对)使用1-氨基环丙烷-1-羧酸氧化酶敲除线催熟。中国机械工程学报,2011;26(11):381 - 381。https://doi.org/10.1093/jxb/err063.
- 46.
卢鹏鹏,余松,朱宁,陈勇,周碧,潘勇,等。基因组编码分析揭示了肉质果实成熟趋同进化的基础。植物学报,2018;4(10):784-91。https://doi.org/10.1038/s41477-018-0249-z.
- 47.
Espley RV, Leif D, Plunkett B, McGhie T, Henry-Kirk R, Hall M,等。红到棕色:苹果中花青素反应升高,乙烯推动成熟和果肉褐变。10.前沿植物科学,2019;
- 48.
曹海辉,陈杰,岳明,徐超,简伟,刘永德,等。番茄转录抑制因子MYB70直接调控乙烯依赖性果实成熟。植物学报,2010;26(6):568 - 568。https://doi.org/10.1111/tpj.15021.
- 49.
伊藤Y,西泽横井A,远藤M,三上M,岛Y,中村N,等。重新评估rin突变和作用RIN在番茄成熟的诱导中。植物学报。2017;3(11):866-74。https://doi.org/10.1038/s41477-017-0041-5.
- 50.
高原,魏伟,范志强,赵小东,张亚平,景勇,等。重新评估也不NAC-NOR转录因子在番茄果实成熟中的作用(vol 71, pg 3560, 2020)。中国机械工程学报,2010;26(12):379 - 379。https://doi.org/10.1093/jxb/eraa247.
- 51.
高原,朱楠,朱旭,吴敏,蒋长忠,Grierson D,等。由fruitENCODE和新的CRISPR/Cas9揭示的成熟调控网络的多样性和冗余中国北车而且也不突变体。《科学通报》2019;6(1):39。https://doi.org/10.1038/s41438-019-0122-x.
- 52.
聂文慧珍,陈晓霞,王美玲,马蒂奇,裴瑞林,等。猕猴桃单萜合成的自然变异:NAC和乙烯不敏感3样转录因子对萜类合成酶的转录调控。中国生物医学工程学报。2015;37(4):344 - 344。https://doi.org/10.1104/pp.114.254367.
- 53.
王文俊,王杰,吴云云,李德伟,Allan AC,尹晓荣。对编码RNA和非编码RNA的全基因组分析揭示了一个保守的miR164-NAC调节水果成熟的途径。植物学报,2020;25(4):1618-34。https://doi.org/10.1111/nph.16233.
- 54.
Mitalo OW, Tokiwa S,近藤Y, Otsuki T, Galis I, Suezawa K,等。低温贮藏刺激猕猴桃果实软化和糖积累,而不会产生乙烯和香气挥发性物质。10.前沿植物科学,2019;https://doi.org/10.3389/fpls.2019.00888.
- 55.
吴云云,刘小峰,付宝林,张启勇,童勇,王杰,等。茉莉酸甲酯通过诱导促进猕猴桃乙烯的合成南汽激活基因ACS1.农学通报,2020;68(10):3267-76。https://doi.org/10.1021/acs.jafc.9b07379.
- 56.
Pilkington SM, Crowhurst R, Hilario E, Nardozza S, Fraser L, Peng YY, Gunaseelan K, Simpson R, Tahir J, Deroles SC,等。手动注释的猕猴桃对var。对(猕猴桃)基因组突出了与植物草稿基因组和基因预测相关的挑战。BMC基因组学。2018;19(1):257。https://doi.org/10.1186/s12864-018-4656-3.
- 57.
Yoshida H, Wang KL, Chang CM, Mori K, Uchida E, Ecker JR. ACC合酶TOE序列是与ETO1家族蛋白相互作用和靶蛋白失稳所必需的。植物分子生物学。2006;62(3):427-37。
- 58.
Yamagami T, Tsuchisaka A, Yamada K, Haddon WF, Harden LA, Theologis A.拟南芥基因家族编码的1-氨基-环丙烷-1-羧酸合酶同工酶的生化多样性。中国生物医学工程学报,2003;29(4):339 - 339。https://doi.org/10.1074/jbc.M308297200.
- 59.
Guindon S, Dufayard JF, Hordijk W, Lefort V, Gascuel O. PhyML:最大似然快速准确的系统发育重建。中华流行病学杂志,2009;9(3):384-5。
- 60.
国田T,光田N, Ohme-Takagi M,武田S, Aida M, Tasaka M,等。拟南芥外被中的NAC家族蛋白NARS1/NAC2和NARS2/NAM调控胚胎发生。植物学报。2008;20(10):2631-42。https://doi.org/10.1105/tpc.108.060160.
- 61.
王志强,王志强,王志强,等。致病性的两pv。番茄对番茄幼苗:冠状碱毒力功能的表型和基因表达分析。植物微生物学报,2008;21(4):383-95。https://doi.org/10.1094/MPMI-21-4-0383.
- 62.
Hellens RP, Allan AC, Friel EN, Bolitho K, Grafton K, Templeton MD,等。功能基因组学的瞬时表达载体,启动子活性定量和植物RNA沉默。植物科学进展。2005;1(1):13。https://doi.org/10.1186/1746-4811-1-13.
- 63.
Kamiyoshihara Y, Iwata M, Fukaya T, Tatsuki M, Mori H.番茄创伤诱导的1-氨基环丙烷-1-羧酸合成酶LeACS2的代谢受磷酸化/去磷酸化调控。植物学报,2010;36(1):344 - 344。https://doi.org/10.1111/j.1365-313X.2010.04316.x.
- 64.
Lyzenga WJ, Booth JK, Stone SL.拟南芥环型E3连接酶XBAT32介导乙烯生物合成酶1-氨基环丙烷-1-羧酸合成酶7的蛋白酶体降解。植物学报,2012;26(1):344 - 344。https://doi.org/10.1111/j.1365-313X.2012.04965.x.
- 65.
Boter M, Ruiz-Rivero O, Abdeen A, Prat S.保守MYC转录因子在番茄和拟南芥茉莉酸盐信号通路中发挥关键作用。基因开发,2004;18(13):1577-91。https://doi.org/10.1101/gad.297704.
- 66.
吴等号左边。刘晓峰,付保林,张启宇,童燕,王娟,王文强,Grierson D,殷晓茹:茉莉酸甲酯通过诱导NAC基因活化促进猕猴桃乙烯合成ACS1.农学通报,2020;68(10):3267-76。https://doi.org/10.1021/acs.jafc.9b07379.
- 67.
Weiler EW, Albrecht T, Groth B, Xia ZQ, Luxem M, Liss H,等。参与茉莉酸盐和它们的十八醇前体在卷须卷绕反应的证据Bryonia dioica.植物化学,1993;32(3):591 - 600。https://doi.org/10.1016/s0031 - 9422 (00) 95142 - 2.
- 68.
王志刚,王志刚。五环氧脂素的生物活性和生物合成:亚油酸途径。植物化学。1998;47(4):527 - 37。https://doi.org/10.1016/s0031 - 9422 (97) 00572 - 4.
- 69.
牟文文,李德东,罗志生,李林,毛立龙,应天军。SlAREB1的转录激活也不在番茄果实成熟过程中参与脱落酸调控的乙烯生物合成。植物科学通报2018;https://doi.org/10.1016/j.plantsci.2018.07.015.
- 70.
王W-q。王娟,吴艳艳,李德文,Allan AC,殷晓茹:通过对编码RNA和非编码RNA的全基因组分析,揭示了miR164-NAC在果实成熟中的保守调控通路。中国植物学报,2019;26(4):1619-34。
- 71.
林忠,洪艳,尹明,张凯,李春。番茄HD-zip同源盒蛋白的研究进展,LeHB-1在花器官发生和成熟过程中起重要作用。植物学报,2008;36(2):344 - 344。https://doi.org/10.1111/j.1365-313X.2008.03505.x.
- 72.
伊藤Y,北川M,岩桥N,矢部K,金原J,安田J,等。dna结合特异性,转录激活潜能,和rin番茄果实成熟调节剂的突变效应RIN.植物学报,2008;36(2):344 - 344。https://doi.org/10.1111/j.1365-313X.2008.03491.x.
- 73.
藤泽,中野,伊藤。利用染色质免疫沉淀法鉴定番茄果实成熟调控因子RIN的潜在靶基因。植物学报。2011;11(1):26。https://doi.org/10.1186/1471-2229-11-26.
- 74.
马蒂尔,傅雷巴洛夫,李国强,李国强。番茄MADS-box转录因子成熟抑制因子以无色非成熟依赖的方式与多个成熟过程中的启动子相互作用。中国生物医学工程学报,2011;29(3):344 - 344。https://doi.org/10.1104/pp.111.181107.
- 75.
李淑娟,陈克胜,李秀娟。乙烯和MADS转录因子在肉质果实成熟调控网络中的作用。植物学报,2019;221(4):1724-41。https://doi.org/10.1111/nph.15545.
- 76.
张震,张宏,权锐,王晓春,黄蓉。乙烯反应因子LeERF2在乙烯合成基因表达中的转录调控对番茄和烟草乙烯产量的影响。植物科学进展。2009;30(1):366 - 366。https://doi.org/10.1104/pp.109.135830.
- 77.
袁晓霞,王荣荣,赵小东,罗亚波,付德强。利用iTRAQ蛋白谱分析阐明了番茄非成熟突变在果实品质调控中的作用。PLoS One. 2016;11(10):e0164335。https://doi.org/10.1371/journal.pone.0164335.
- 78.
Kumar R, Tamboli V, Sharma R, Sreelakshmi Y.番茄Penjar种质NAC-NOR突变减弱多种代谢过程并延长水果保质期。食品化学,2018;259:234-44。https://doi.org/10.1016/j.foodchem.2018.03.135.
- 79.
高原,魏伟,赵小东,谭小玲,范志强,张亚平,景勇,孟LH,朱伯泽,朱海林等。NAC转录因子NOR-like1是一种新的番茄果实成熟正调控因子。Hortic Res-England2018, 5(75(2018))。
- 80.
韩qq,宋永泽,张建勇,刘丽芬。研究的作用SlNAC3番茄种子发育调控基因(茄属植物lycopersicum).中国生物医学工程学报。2014;39(4):423-9。https://doi.org/10.1080/14620316.2014.11513101.
- 81.
马宁,冯浩,孟X,李东,杨东,吴超,等。番茄过表达SlNAC1转录因子改变果实色素沉着和软化。中国生物医学工程学报。2014;14(1):351。https://doi.org/10.1186/s12870-014-0351-y.
- 82.
朱明民,陈桂平,周松,涂勇,王勇,董婷婷,等。一种新的番茄NAC (NAM/ATAF1/2/CUC2)转录因子SlNAC4在果实成熟和类胡萝卜素积累中起正向调节作用。中国生物医学工程学报。2014;36(1):339 - 339。https://doi.org/10.1093/pcp/pct162.
- 83.
Barry CS, Llop-Tous MI, Grierson D. 1-氨基环丙烷-1-羧酸合酶基因在番茄乙烯合成由系统1向系统2转化过程中的表达调控。植物科学进展。2000;23(3):979-86。https://doi.org/10.1104/pp.123.3.979.
- 84.
林泽峰,钟世林,Grierson D.乙烯研究进展。应用物理学报,2009;36(12):366 - 366。https://doi.org/10.1093/jxb/erp204.
- 85.
郎志斌,王永华,唐凯,唐德昌,Datsenka T,程建峰,等。DNA去甲基化在番茄果实成熟诱导基因激活和成熟抑制基因抑制中的关键作用。美国国家科学院。2017; 114 (22): E4511-9。https://doi.org/10.1073/pnas.1705233114.
- 86.
R_core_Team。R:统计计算的语言和环境。维也纳统计计算基金会;2018.https://www.R-project.org.
- 87.
Pinheiro J, Bates D, DebRoy S, Sarkar D, R_core_Team。线性和非线性混合效应模型。2018.https://CRAN.R-project.org/package=nlme版本3.1-137。
- 88.
Russell L. emmeans:估计边际均值,又名最小二乘均值。2019.https://CRAN.R-project.org/package=emmeans,版本1.3.4。
- 89.
朱克思,王志刚。蛋白质分子的进化。在:哺乳动物蛋白质代谢。Munro HN编辑。纽约:学术出版社;1969: 21 - 132。
- 90.
索卡尔,米切纳。评价系统关系的统计方法。堪萨斯大学科学通报,1958;38:1409-38。
- 91.
张志强,张志强,张志强,等。一种提取松材中核糖核酸的方法。植物摩尔生物学报告,1993;11(2):113-6。https://doi.org/10.1007/BF02670468.
- 92.
Walton EF, Wu RM, Richardson AC, Davy M, Hellens RP, Thodey K,等。猕猴桃中打破休眠的化学物质氢氰胺可诱导快速转录激活(猕猴桃deliciosa味蕾。应用物理学报,2009;26(3):339 - 344。https://doi.org/10.1093/jxb/erp231.
- 93.
聂文慧珍,王美美,马蒂奇,格林萨,陈晓霞,姚玉凯,等。猕猴桃花释放出的倍半萜主要由两种萜类合酶(猕猴桃deliciosa).应用物理学报,2009;30(11):323 - 19。https://doi.org/10.1093/jxb/erp162.
- 94.
王春霞,王春霞,王春霞,等。猕猴桃的功能及表达分析SOC1类基因表明,它们可能在开花的过渡过程中没有作用,但可能会影响休眠的持续时间。中国机械工程学报,2015;26(3):344 - 344。https://doi.org/10.1093/jxb/erv234.
- 95.
Fullerton CG, Prakash R, Ninan AS, Atkinson RG, Schaffer RJ, Hallett IC,等。两种软化率不同的猕猴桃基因型的果实在细胞壁的木葡聚糖和果胶结构域上存在差异。11.前沿植物科学2020;https://doi.org/10.3389/fpls.2020.00964.
- 96.
Vandesompele J, De Preter K, Pattyn F, Poppe B, Van Roy N, De Paepe A, Speleman F.多内控基因几何平均实时定量RT-PCR数据的精确归一化。基因组生物学200;3(7)。
- 97.
王志强,王志强,王志强。稳定管家基因,差异调控靶基因和样本完整性的确定:BestKeeper -使用成对相关的基于excel的工具。生物技术通报2004;26(6):509-15。https://doi.org/10.1023/B:BILE.0000019559.84305.47.
确认
我们感谢Monica Dragulescu和她的团队的植物护理,Peter McAtee在乙烯探测器上的帮助,Richard Espley和Erika Varkonyi-Gasic对手稿的严格审查,以及湖北省农业科学院科学家基金会(L2018023)对张雷的支持。我们也感谢Johanna John和Minna Pesonen在图形方面的帮助。
资金
这项工作由新西兰商业、创新和就业部(C11X1602)资助,内部PFR资金部分来自猕猴桃特许权使用费投资计划。
作者信息
从属关系
贡献
N.J.N.;a.c.a构想了最初的研究计划;w.a.l., r.j.s., A.C.A, r.g.a监督实验;n.j.n., X.C, M.P, L.Z.进行了实验工作;L.G.进行统计分析;n.j.n., a.c.a., r.g.a.设计了实验并分析了数据,并在R.J.S.的进一步贡献下撰写了这篇文章;N.J.N.同意作为作者负责联系并确保沟通;所有作者都同意作者名单和这些作者的贡献。作者阅读并批准最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。本手稿没有报道或涉及任何动物或人体数据或组织的使用。作者确认,对植物的实验研究,包括植物材料的收集,符合机构、国家或国际准则。
发表同意书
不适用。本手稿不包含任何形式的任何个人数据(包括任何个人细节、图像或视频)。”
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
聂文慧珍,陈晓明,陈晓明,陈晓明。et al。NAC转录因子对猕猴桃创伤乙烯生物合成的调控。BMC植物生物学21,411(2021)。https://doi.org/10.1186/s12870-021-03154-8
收到了:
接受:
发表:
关键字
- 猕猴桃
- 受伤
- 乙烯
- 生物合成
- 监管
- 南汽
- 转录因子