- 研究文章
- 开放获取
- 发表:
通过对代谢组和转录组图谱的综合分析,我们可以进一步了解'Candidatus Liberibacterasiaticus的感染
BMC植物生物学体积21文章编号:397(2021)
摘要
背景
“沙塘居”柑桔易受黄龙病(HLB)的影响,侵染黄龙病的果实体积小,果实成熟期无异味,果实保持绿色。为了解HLB病原菌与果皮颜色的关系及HLB对果皮颜色的影响机制,以“沙唐菊”为研究对象,对四种不同颜色的果实进行HLB病原菌和类胡萝卜素的定量分析,以及代谢组和转录组的综合分析。四种不同颜色的果实分别为全青果(WGF)、顶黄基绿果(TYBGF)、全浅黄果(WLYF)。感染HLB的全果(WDYF)。
结果
HLB菌群大小顺序为WGF > TYBGF > WLYF > WDYF。两组样本之间存在显著差异。叶绿素和类胡萝卜素积累方面,WGF中叶绿素-a含量最高,WDYF中最低。WGF中叶绿素b含量显著高于其他3种果皮。各组间类胡萝卜素总含量有显著差异。WGF和TYBGF果皮中植物烯、γ-胡萝卜素、β-隐黄质和罗布麻素含量较低,其他类胡萝卜素含量显著高于WDYF果皮。WLYF只缺少天启性。我们全面比较了异常果皮(WGF、TYBGF和WLYF)和正常果皮(WDYF,对照)的转录组和代谢物谱。三次比较共鉴定出差异表达基因(DEGs) 2,880、2,782和1,053个,分别包含121、117和43个转录因子。qRT-PCR证实了转录组中所选基因的表达水平。 Additionally, a total of 77 flavonoids and other phenylpropanoid-derived metabolites were identified in the three comparisons. Most (76.65 %) showed markedly lower abundances in the three comparisons. The phenylpropanoid biosynthesis pathway was the major enrichment pathway in the integrative analysis of metabolome and transcriptome profiles.
结论
综合以上分析结果,本研究表明,不同颜色的果皮与类胡萝卜素和苯丙素衍生物产物水平降低以及类黄酮、苯丙素衍生物生物合成途径蛋白和光合天线蛋白水平下调有关。
背景
普通话“Shatangju”(试简历。“沙塘居”是中国广东省优良的本地柑橘品种之一。其果实因其口感、气味、果皮柔软细腻等优点而广受欢迎。1,2,3.].然而,普通话“沙塘居”(试简历。‘沙塘居’)易受黄龙病(HLB)的影响Candidatus Liberibacter对“沙塘居”种植造成了很大影响。果实感染hlb的典型症状是果实小、不对称、异味,成熟期花柱端保持绿色,如甜橙和“沙塘居”。4,5].然而,一株感染hlb的“沙塘居”的果实在质量和外观上与未感染hlb的果实相似[6].在以往的研究报告中,HLB感染对柑橘果实产量和品质包括内外品质的影响均有报道[7].但HLB感染的影响机制尚不清楚。
类胡萝卜素和类黄酮是影响柑橘果实着色的主要代谢产物。柑橘类黄酮包括几个亚类黄酮,包括黄酮(柚皮苷和橙皮苷)和o -多甲氧基黄酮(PMFs,黄酮素和橘子素),特别是在甜橙(素类L. Osbeck)及普通话(试布兰科)[8].柑橘类黄酮生物合成途径的每一步都由多基因家族控制,形成一个高度复杂的网络。苯丙素途径是柑橘类黄酮合成整个过程的上游阶段。p -香豆酰辅酶A作为前体,经苯丙氨酸解氨酶(PAL)、肉桂酸4-羟化酶(C4H)和4-香豆酸:辅酶A连接酶(4CL)三步合成。在类黄酮生物合成的后续反应中,所有中间体和酶都发挥着至关重要的调控作用[9,10].这些基因促进了关键类黄酮代谢物的产生,如柚皮素、橙皮素、枇杷叶醇和樱苷。组成酶主要包括查尔酮合成酶(CHS)、查尔酮异构酶(CHI)、黄酮3-羟化酶(F3H)、黄酮3 ' -羟化酶(F3'H)、异黄酮合成酶(IFS)、黄酮醇合成酶(FLS)、二氢黄酮醇-4-还原酶(DFR)、浅色花青素还原酶(LAR)、花青素还原酶(ANR)、花青素合成酶(ANS)和UDP-糖基转移酶(UGT) [11,12,13].尽管柑橘同源性(CHS,气,F3H,FLS的而且UGT)的克隆和鉴定,HLB对柑桔果皮中这些基因的影响尚不清楚。
类胡萝卜素生物合成途径是柑桔重要的代谢途径之一。其类胡萝卜素的组成和含量不仅直接决定水果的颜色外观,而且影响营养。柑橘类胡萝卜素主要有α-胡萝卜素、β-胡萝卜素、紫黄质、蒽黄质、叶黄素、玉米黄质、α-隐黄质、β-隐黄质、植物烯、番茄红素等[14].根据类胡萝卜素累积差异,柑橘品种可大致分为四类:富含β-隐黄质(如试Blanco), II类富含紫黄质(如素类Osbeck), III类富含植物烯(柑橘天堂金花蛇Macf)和类胡萝卜素含量低的第IV类(柠檬l .蛇)[15,16].类胡萝卜素不仅受遗传因素的影响,还受温度、光照、疾病等多种环境因素的影响。柑橘果实中β-隐黄质积累的原因是上游基因高表达,下游羟化酶基因低表达[17].类胡萝卜素切割加氧酶(CCD)基因的表达与紫黄质积累显著相关[18].当(E/Z)-phytoene、phytofluene和番茄红素相关合酶基因表达量高而番茄红素环化酶基因表达量低时,番茄红素及其前体积累量会大幅增加[19].虽然类胡萝卜素的相关基因已经基本完善,但黄龙冰对类胡萝卜素的作用机制仍需进一步分析。
柑橘转录组分析已成功用于鉴定光合作用、碳水化合物代谢的合成和信号转导相关基因[20.,茉莉酸生物合成[21及类黄酮生物合成[22].利用转录组分析分析叶片的基因表达[22),根23]及纸浆样本[24]与HLB相关。然而,目前尚缺乏与HLB相关的不同颜色果皮的转录组分析。代谢组学的应用被广泛应用于各种水果或蔬菜的研究中,极大地促进了各种植物中活性代谢物和相关代谢途径的鉴定[25,26].代谢组学和转录组学的结合将有助于揭示关键代谢途径的生物合成机制。因此,应用这两种组学技术分析柑橘类胡萝卜素和类黄酮的生物合成途径是可行的。
果色作为柑桔果实重要的外观性状和品质性状,已被广泛研究[12,27].本研究结合代谢组学和转录组学数据,进一步阐明了HLB对WGF、TYBGF和WLYF果实颜色的影响机制。代谢组结果显示,WGF、TYBGF和WLYF果实中部分类黄酮含量显著降低,甚至无法检测到,而WDYF果实中部分类黄酮含量较高。对4种柑橘‘沙塘居’果皮中14种类胡萝卜素进行了鉴定和定量。通过基因和代谢物的组合,绘制相关网络,突出类黄酮和类胡萝卜素代谢物相关的调控基因。这些发现为“沙塘桔”果皮在HLB影响下的生物合成和代谢产物调控提供了新的分子机制,并强调了整合方法对理解这一过程的有效性。
方法
植物材料
试简历。本研究中的“沙塘居”种植在中国广东省广州市广东省农业科学院果树研究所的柑橘研究园(东经113°21′59”,北经23°9′15”)。用PCR方法从22株沙塘桔中筛选出10株感染hlb的沙塘桔。所有的树都感染了Candidatus Liberibacter2019年1月,从10株感染hlb的树木上采集了亚洲木本植物和新鲜水果,并将它们混合在一起。果实按颜色分为全绿果(WGF)、顶黄基绿果(TYBGF)、全浅黄果(WLYF)和全暗黄果(WDYF) 4种类型。颜色由色度计(美能达CR-300,柯尼卡美能达投资有限公司,上海,中国)检测。每个样本设3个生物重复,每个重复从10株感染hlb病毒的沙塘居柑橘树上随机采集果实60个。这些水果被运回实验室,果皮被用手术刀仔细切除,收集起来,冷冻在液氮中,粗略研磨,并保存在-80°C,以供进一步研究。
量化的Candidatus liberibacterasiaticus的存在
用CTAB法提取每个样品100mg果皮总DNA [28].采用16S rDNA特异性引物HLBasf (5 ' - tcgagcgtatgcaatacg -3 ')/HLBasr (5 ' - gcgttatc CCGTAGAAAAAGGTAG-3 ')和探针HLBp (5 ' (FAM)- agacgggtgagta ACGCG-(BHQ-1)-3 ')进行qRT-PCR [29].载体pMD-18T是通过加入的16s rDNA构建的Candidatus Liberibacter亚洲,约1200 bp。16s rDNA引物为P1(5- ' GCGCGTATGCAATACGAGCGGC-3 ')/P2(5 ' - gcctcgcgacttcgcaacccat -3 ')。用重组质粒pmd - 18t - 16s rDNA构建质粒拷贝数与CT值的标准曲线及方程[30.].由式可知,HLB菌群Candidatus Liberibacter计算果皮中亚细亚的含量。质粒拷贝数计算公式为‘(数量ng× 6.022 × 1023)/(长度:bp×1 × 109Ng /g ×650 g/mol of bp) [30.,其中length = 3829 bp '。扩增系统由探针qRT-PCR预糅合系统11.2µL (Takara, Ishiyama, Japan), 10µmol/L正反引物各0.4µL, cDNA模板2µL,无菌蒸馏水共20µL组成,在美国Applied Biosystems公司的StepOnePlus Real-Time PCR系统中,95℃扩增20 s, 95℃扩增1 s, 60℃扩增20 s,共40个循环。所有反应在三个重复中进行,每个测试包含一个阴性对照和一个阳性对照。
叶绿素和类胡萝卜素的提取与检测
叶绿素的提取和检测方法为丙酮分光光度计法。类胡萝卜素的提取方法如下:植物原料(100mg鲜重)在液氮中冷冻,研磨成粉末,用正己烷:丙酮:乙醇(2:1:1,V/V/V, Merck, Darmstadt, Germany)提取。将提取液涡旋(30 s),室温超声辅助提取20 min,离心(12000 rpm, 5 min)。收集上清液,重复上述步骤。上清液收集两次,然后在氮气气流下蒸发干燥,然后在75%甲醇中重新生成(V/V, Merck, Darmstadt, Germany)。离心,收集上清液进行LC-MS分析。采用18种类胡萝卜素进行定量分析。所有类胡萝卜素标准均购自Olchemim Ltd.(捷克共和国奥洛穆茨)和Sigma(美国密苏里州圣路易斯)。醋酸从国药化学试剂(上海)有限公司获得。标准品原液在ACN中配制,浓度为10 mg/mL。 All stock solutions were stored at -20 °C. The stock solutions were diluted with ACN to working solutions before analysis.
UHPLC条件和APCI-Q TRAP-MS/MS检测类胡萝卜素
UHPLC法测定类胡萝卜素的方法如下:采用LC- esi -MS/MS (UHPLC, Exion LC™AD;MS,应用生物系统公司6500,Triple Quadrupole)。分析条件:高效液相色谱柱,YMC C30 (3 μm, 2 mm×100 mm);溶剂体系,乙腈(ACN):甲醇(3:1,V/V)(含0.01% 2;6-二叔丁基-4-甲基苯酚,BHT):甲基叔丁基醚(含0.01% BHT);梯度程序,85:5 (V/V)在0分钟,75:25 (V/V)在2分钟,40:60 (V/V)在2.5分钟,5:95 (V/V)在3分钟,5:95 (V/V)在4分钟,85:15 (V/V)在4.1分钟,和85:15 (V/V)在6分钟;流速0.8 mL/min;温度、28°C;进样量5µL。流出物交替连接到esi -三重四极线性离子阱(Q trap)-MS。
API 6500 Q TRAP LC/MS/MS系统配备了APCI涡轮离子喷雾接口,在正离子模式下工作,由Analyst 1.6.3软件(AB Sciex, USA)控制。APCI源操作参数为:离子源、涡轮喷雾;源温度350°C;幕气(CUR), 25.0 psi;和碰撞气体(CAD),介质。对单个MRM跃迁的聚类势和碰撞能进行了进一步的优化。根据在每个时间段内洗脱的类胡萝卜素,监测一组特定的MRM过渡。
代谢物的提取和定性定量分析
“沙塘居”柑橘果皮代谢物的提取和分离以前有报道[27].简单地说,每个样品约100 mg细粉,提取70%甲醇在4℃过夜。将样品离心过滤,得到果皮提取物,进行LC-MS分析。代谢产物的定性和定量分析采用ESI-Q TRAP-MS/MS,由代谢组学专业公司(中国武汉美特尔生物技术有限公司)提供。根据| Log筛选显著变化的代谢物(SCMs)2(Fold Change) |≥1,且p值< 0.05。具体步骤参考Wang等[27].
RNA提取和illumina测序
RNA的分离纯化、cDNA文库的构建和测序工作由专业的转录组测序公司(中国北京诺创基因生物信息技术有限公司)完成。过滤后的读取被映射到素类基因组(https://www.citrusgenomedb.org/organism/Citrus/sinensis)使用HISAT2软件[31].每Kilo Base每Million map Reads (FPKM)被用作基因和转录水平量化的指标[32].差异表达基因(DEGs)由对数绝对值确定2FoldChange(日志2FC) > 1,假发现率(FDR)≤0.05。所有DEGs均采用基因本体论(GO)分析[33]和利用KOBAS软件富集京都基因和基因组百科全书(KEGG) [34].利用ITAK软件预测转录因子[35].
实时荧光定量PCR (qRT-PCR)验证
采用多糖多酚植物总RNA快速提取试剂盒(BioTeke,北京,中国)提取总RNA。使用PrimeScript II First Strand cDNA Synthesis Kit (Takara, Ishiyama, Japan)进行逆转录。选择12个基因用特异性引物进行qRT-PCR(补充表S1).利用StepOnePlus Real-Time PCR系统(Applied Biosystems, USA)和TB Green SYBR试剂盒(Takara, Ishiyama, Japan)进行qRT-PCR。扩增系统由TB Green SYBR Premix system II 10.4µL、10µmol/L正反引物各0.4µL、cDNA模板2µL和无菌蒸馏水组成,总体积为20µL。扩增程序为95℃30 s, 95℃5 s, 60℃30 s,共40个循环。2−∆∆ct方法采用内参基因进行相对定量分析,β肌动蛋白.每个样品进行3次技术重复,以确保重现性和可靠性。
代谢组和转录组数据的综合分析
选择代谢组中的类胡萝卜素和SCMs以及转录组中的DEGs进行综合分析。根据投影中变量重要性(VIP)大于1对SCMs进行过滤,p-value小于0.05,和Log的绝对值2相关分析时,FC大于1。Pearson相关系数和p采用Spearman法计算类胡萝卜素、SCMs和DEGs数据集成的-值。
统计分析
采用SPSS 22.0进行统计分析。数据以平均值±标准差(SD)表示。用最小显著性差异(p值< 0.05)。
结果
果实外观表型分析
本研究中使用的果实都是在果实成熟时采收的。“沙塘居”柑桔果实在最后成熟期发育较快。这种水果很快就会变大并上色,两个月后就会达到最后的颜色和大小。然而,如果树木被hlb相关病原体感染,Candidatus Liberibacter亚细亚的果实发育会受到影响。因此,我们将侵染hlb的果树成熟期果实按颜色和大小分为全绿果实(WGF)、顶黄和基绿果实(TYBGF)、全浅黄果实(WLYF)和全暗黄果实(WDYF, CK) 4种类型(图2)。1补充表S2a). WGF和TYBGF果实的外观都不能完全变成深黄色。WGF果实为全绿(H0= 104.49, CI(色指数,a/b比)= -0.29),最小为32.68 × 30.71 mm。TYBGF果实较大(35.62 × 33.77 mm),花梗部分颜色偏淡黄色(H0= 100.3, CI=-0.18)。WGF和TYBGF果实的垂直和水平直径均显著低于WDYF, WGF最低(补充表S2a). WLYF果实不能完全发育成暗黄色果皮,全部呈淡黄色(H0= 72.72, CI = 0.31), WDYF果实为最深黄色果实(H0= 55.12, CI = 0.70),但WLYF和WDYF果实的纵向和横向直径差异不显著(补充表S2一个)。
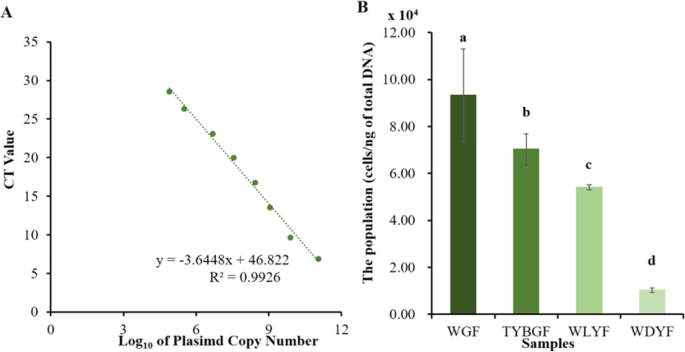
果皮中HLB菌群的定量分析
构建16s rDNA重组质粒,建立质粒拷贝数与qRT-PCR CT值之间的标准曲线,方程,y=-3.6448x + 46.822 (R²=0.9926)。2A).根据四种果皮HLB病原菌qRT-PCR的方程和平均Ct值,计算每纳克总DNA中HLB病原菌的数量。结果表明,种群数量Candidatus Liberibacter在WGF、TYBGF、WLYF和WDYF果皮中的亚的松含量为9.33 × 104, 7.03 × 104, 5.41 × 104,和1.03 × 104细胞/ng的总DNA(图。2B).通过显著差异分析,种群中WGF、TYBGF和WLYF果皮均显著高于WDYF果皮Candidatus Liberibacterasiaticus。WGF是HLB病原菌数量最多的群体,表型受影响也最严重。
所有样品中类胡萝卜素的定量分析
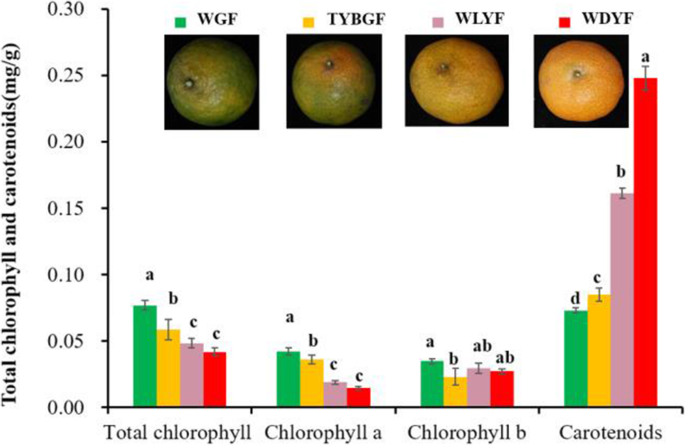
WGF、TYBGF、WLYF和WDYF的叶绿素总含量呈逐渐下降趋势,为7.69 × 10−2, 5.85 × 10−2, 4.83 × 10−2和4.17 × 10−2分别为毫克/克(无花果。3.).WGF中叶绿素a含量最高,TYBGF次之,两者差异不显著,WDYF中叶绿素a含量最低。WGF中叶绿素b含量最高,为3.48 × 10−2Mg /g,与其他3种果皮具有显著差异。其他3种果皮间差异不显著。4种果皮类胡萝卜素总含量差异显著。WGF、TYBGF、WLYF和WDYF分别为7.31 × 10−2, 8.47 × 10−2, 1.61 × 10−1和2.48 × 10−1毫克/ g(无花果。3.).
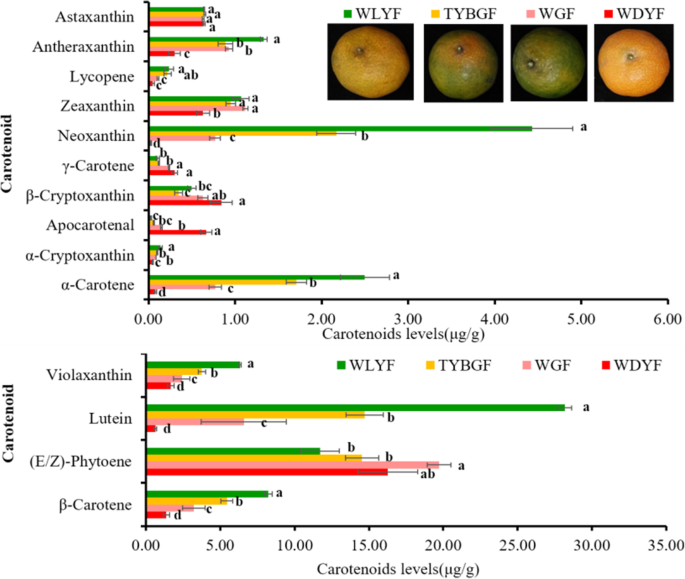
在WGF、TYBGF、WLYF和WDYF果皮中检测到18种类胡萝卜素含量,其中14种类胡萝卜素在WGF、TYBGF、WLYF和WDYF果皮中被鉴定出来(补充表)S2bcd和无花果。4).所鉴定的类胡萝卜素不包括植物荧光素、辣椒素、ε-胡萝卜素和卡红素。结果表明,所有样品的类胡萝卜素主要为叶黄素、叶黄素、β-胡萝卜素、新黄质和紫黄质。除γ-胡萝卜素、叶绿烯、β-隐黄质、罗布麻素和虾青素外,WGF和TYBGF果实中其他9种类胡萝卜素的含量均显著高于WDYF样品(图;4).WLYF中α-胡萝卜素、β-胡萝卜素、叶黄素、新黄质、玉米黄质和蒽黄质含量显著高于WDYF。WLYF与WDYF中α-隐黄质、β-隐黄质、γ-胡萝卜素、phytoene、番茄红素和紫黄质含量差异不显著。WLYF样本中只有apocotenal显著低于WDYF样本。此外,虾青素在所有比较中没有显示出任何显著差异(图。4).
三次比较中苯丙素类衍生物的差异积累
采用LC-ESI-MS/MS分析比较3个处理组与对照组(CK)的主要代谢和次生代谢的差异。本研究中发生显著变化的代谢物(SCMs)以黄酮类化合物和其他苯丙类衍生物居多,占35.81%。根据京都基因和基因组百科全书(KEGG)分析,在所有比较中,苯丙素生物合成途径是富集最显著的代谢途径[27].WGF与WDYF、TYBGF与WDYF、WLYF与WDYF中不同累积的黄酮类化合物和苯丙素类化合物分别为60、53和29。它们列于补充表中S3其中,WGF、TYBGF和WLYF较WDYF果皮分别显著降低39(65%)、43(81.13%)和24(82.76%)。
三次比较中基因的差异表达
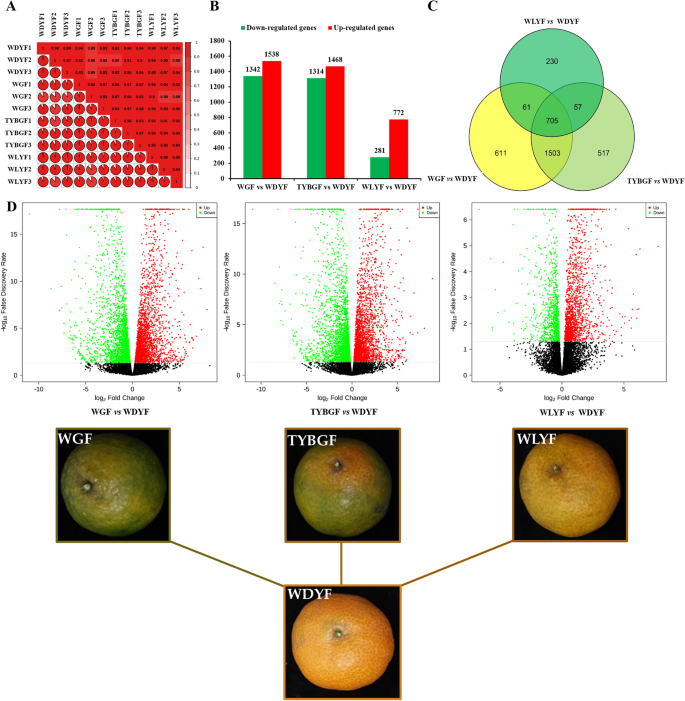
为鉴定WGF、TYBGF、WLYF果皮与WDYF果皮(CK)的差异表达基因,对上述四种材料进行转录组比较。经过严格的质量检测和数据清理,RNA-Seq分别从WGF、TYBGF、WLYF和WDYF cDNA文库中获得51.74 ~ 57.10(93.41 ~ 93.84%)、47.87 ~ 58.56(93.62 ~ 93.83%)、49.65 ~ 55.02(93.22 ~ 93.88)和47.91 ~ 63.47(93.05 ~ 93.61%)万条clean reads(补充表S4).共映射44.00-53.48、40.73-50.03、42.32-46.86和4068 - 5421万个reads到素类基因组数据库(https://www.citrusgenomedb.org/organism/Citrus/sinensis. ),with match ratios in the ranges of 80.16–80.69 %, 80.30-80.84 %, 80.00-80.66 % and 79.88–80.66 % in the WGF, TYBGF, WLYF and WDYF groups, respectively (Supplemental TableS4).WGF、TYBGF、WLYF和WDYF组中分别检测到19117、19073、19306和19263个基因。高相关系数(R2> 0.99)的基因表达表明数据的有效性(图。5一个)。
过滤条件为|日志2FoldChange|≥1,假发现率(FDR) < 0.05, WGF与WDYF、TYBGF与WDYF、WLYF与WDYF的3次比较中分别检测到2880、2782和1053个差异表达基因(DEGs),其中WGF与WDYF、TYBGF与WDYF、WLYF与WDYF的3次比较中分别有1538、1468和772个基因上调,1342、1314和281个基因下调(补充表)S5,无花果。5维恩图分析显示,三种比较共有705个deg(图2)。5C).所有比较中大多数DEGs上调。样本的表型差异越大,说明样本的差异表达基因越多。
通过基因本体(GO)分析,探讨hlb影响基因在生物过程(BP)、细胞成分(CC)和分子功能(MF)术语中的作用。WGF比较的2880个DEGs和TYBGF比较的2782个DEGs的GO分析显示,在一定程度上富集了细胞过程、代谢过程和对刺激的响应等5个主要生物学过程;GO分析WLYF中有1053个DEGs主要富集于代谢过程和细胞过程。在分子功能方面,三次比较中大多数DEGs都富集了催化活性和结合能力。在细胞成分方面,三种比较的DEGs均主要富集在细胞部分、膜和细胞器5类(supplementary Fig.;S1).在支持信息中总结了三种比较中CC、MF、BP富集程度最高的20个GO项(supplementary Fig.;S2).简单地说,三个比较中有几个与光合作用过程相关的GO术语(如:GO:0019684光合作用、光反应、GO:0009521光系统、GO:0009522光系统I、GO:0015979光合作用)。因此,这些GO术语在“沙塘居”柑橘hlb引起的颜色异常中起着重要作用。
KEGG分析(p-value < 0.05)表明所有比较中这些DEGs主要富集在11个代谢过程中。WGF与WDYF相比,富集最多的3个代谢途径包括光合-天线蛋白、甾体激素生物合成和苯丙素生物合成;TYBGF与WDYF相比,WLYF与WDYF相比,富集最多的3个代谢途径包括光合-天线蛋白、苯丙素生物合成和光合作用(补充表)S6和补充图。S3ACE)。因此,两种代谢途径,光合-天线蛋白和苯丙素生物合成,在所有比较中都得到富集。在WGF与WDYF、TYBGF与WDYF、WLYF与WDYF检测到的DEGs中,有41、40和23个糖基转移酶基因,44、41和5个甲基转移酶基因,25、23和10个酰基转移酶基因催化不同类型黄酮类化合物的合成。我们还检测到12、12和4个GST(谷胱甘肽- s转移酶)基因,17、18和5个ABC转运基因,37、38和13个MATE(多药和有毒化合物挤压)基因,以及1、1和0个SNARE(可溶性NSF附着蛋白受体)基因,它们可能在转运黄酮类化合物中发挥重要作用(补充图。S3快速公车提供)。
转录组和代谢组的综合分析
我们结合转录组和代谢组数据分析了‘沙塘居’果皮中涉及相同生物合成途径的代谢产物与基因之间的关联。结果表明,p参与苯丙素生物合成的代谢产物和基因的-值均小于0.01 (supplementary Fig.;S4)。为了了解WGF、TYBGF和WLYF果皮中类黄酮和其他苯丙素生物合成减少的调控机制,60、53和29个SCMs(31、27和11个类黄酮和29、26和18个其他苯丙素衍生代谢物,补充表S3)和92、92和44个DEGs(28、29和13个DEGs涉及类黄酮生物合成,48、47和23个DEGs涉及其他苯丙素衍生代谢物,补充表S7)进行Pearson相关系数分析。结果显示强正相关或显著负相关(R> 0.8或<-0.8和p-value < 0.05)S8).基于这些结果,SCMs和DEGs之间的相互作用网络(R> 0.9)在WGF、TYBGF和WLYF比较中进行分组(补充图。S5).同时,提出了九象限模型来描述三次比较中scm与DEGs之间的关系。根据九象限分析,黄酮类和其他苯丙素来源的SCMs和DEGs (R> 0.8或<-0.8)的相关代谢途径主要集中在1、3、7和9象限(补充表S8补充图。S6).3和7象限表明SCMs和DEGs的差异模式是一致的,1和9象限表明不一致。
类黄酮在植物的整个生命周期中扮演着许多不同的角色。本研究对WGF、TYBGF、WLYF和WDYF果皮中大量的黄酮类化合物进行了鉴定和定量(补充表S3).在3次比较中,15个DEGs被标注在柑橘类黄酮合成途径中(补充表S7).黄酮类化合物方面,WGF、TYBGF和WLYF果皮中绝大多数SCMs含量较WDYF果皮显著降低,包括乙酰-eriodictyol- o -hexoside(-5.52)、tricin-4 ' - o -β-越桔酰基甘油(-15.08)、tricin-O- sinapic酸(-3.59)、杨梅素(-13.67)和染料木素(4 ',5,7-三羟基异黄酮,-14.22);乙酰-eriodictyol- o - hexexoside (-4.28), c -己基-芹菜素o -咖啡酰基hexexoin (-2.22), tricin 4’- o - β-愈创木苷甘油(-4.90),tricin O-sinapic acid(-2.60),杨梅素(-13.67);乙酰-eriodictyol o - hexexoside(-2.57)、tricin 4′-O-β-愈伤木酰基甘油(-2.93)和杨梅素(-13.67)在WLYF与WDYF的比较(补充表S3).
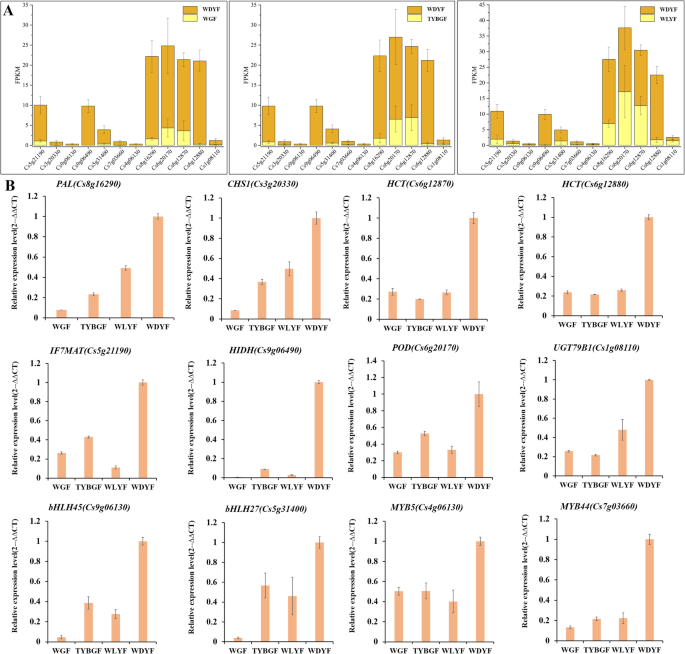
六个DEGs(同系物CHS,HCT(羟基桂皮酰转移酶),HIDH(2-hydroxyisoflavanone脱水酶),IF7MAT(异黄酮7- o -葡萄糖苷-6 " - o -丙二酰转移酶)和UGT79B1筛选基因以验证转录组结果。qRT-PCR结果显示,其表达水平为CHS(Cs3g20330),两个同源的HCT(Cs6g12870而且Cs6g12880),是IF7MAT (Cs5g21190的同源物HIDH(Cs9g06490)和的同源物UGT79B1(Cs1g08110)在WGF、TYBGF和WLYF果皮中的含量低于WDYF果皮(图2)。6).这些结果与RNA-Seq数据一致。柑橘类黄酮合成途径的大部分同源基因在WGF、TYBGF和WLYF果皮中的表达量低于WDYF果皮,说明这些酶基因在柑橘类黄酮合成中起着重要作用。
代谢组分析显示,在苯丙素代谢分支中,香豆素衍生物、香豆醛、针叶醇、甲氧基肉桂醛和肉桂醛等大部分苯丙素衍生代谢物在WGF、TYBGF和WLYF中的丰度显著低于WDYF果皮(补充表)S3).例如,WGF与WDYF的6,7-二甲氧基-4-甲基香豆素(-13.77)、对香豆醛(-5.66)和针叶醇(-4.48);6,7-二甲氧基-4-甲基香豆素(-13.77)、针叶林(-3.33)和4-羟基-3-甲氧基肉桂醛(-3.30)在TYBGF与WDYF的比较;异欧前胡素(-3.34)、4-羟基-3-甲氧基肉桂醛(-3.26)和对香豆醛(-3.17)在WLYF和WDYF中的差异。柑橘苯丙素生物合成途径中有26个DEGs被标注(补充表S7).其中一些,比如朋友,计算机辅助设计(肉桂醇脱氢酶),摘要:(coumarate-3-hydroxylase)和CCoAOMT(caffeoyl-CoA-3-O-methyltransferase)同源物,在WGF、TYBGF和WLYF样品中呈低表达水平。而CCR(cinnamoyl-CoA还原酶),COMT的(catechol-o-methyl转移酶),F6H1(feruloyl-CoA-6-hydroxylase)和UGT72E在WGF、TYBGF和WLYF样品中,同源基因(针叶醇糖基转移酶)表达水平较高。这些结果表明苯丙烷存在复杂的生物合成网络。两个度,Cs8g16290和Cs6g20170,筛选以验证转录组结果。qRT-PCR结果显示,其表达水平为朋友(Cs8g16290)和过氧化物酶基因(圆荚体,Cs6g20170)在WGF、TYBGF和WLYF果皮中的含量低于WDYF果皮(图2)。6).这些结果与RNA-Seq数据一致。
转录因子与代谢物的差异积累相关
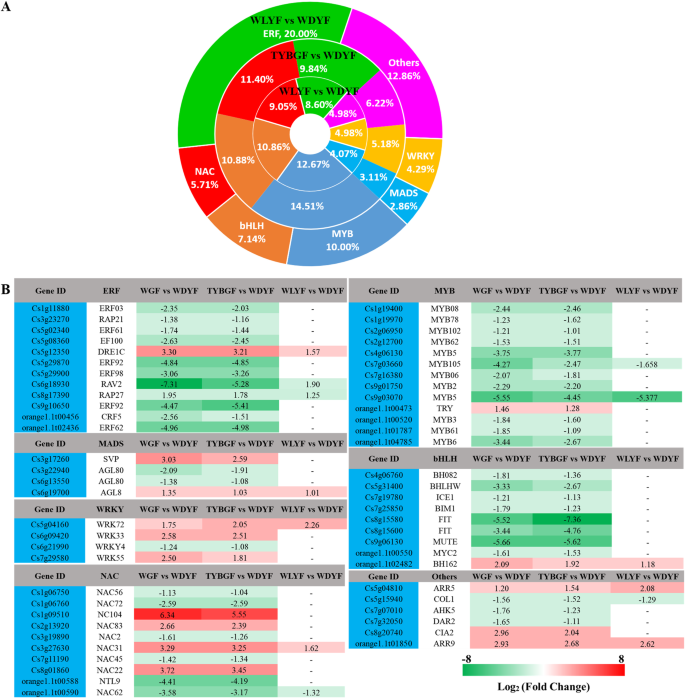
转录因子(Transcription factors, tf),如MYB家族和basic helix-loop-helix (bHLHs)家族中的转录因子,在调控黄酮类化合物生物合成相关基因的表达中起着关键作用拟南芥[36,37,38,39,40].在WGF、TYBGF和WLYF的比较中,分别鉴定出了121、117和43个差异表达转录因子(DETFs),它们属于6个转录因子家族。7补充表S9).WGF和WDYF中差异表达最多的转录因子家族分别是MYBs(12.67%)、MYBs(14.51%)和ERFs(20.00%)。结果表明,除DRE1C(Cs5g12350)在ERF家族中,试一试(orange1.1t00473)是MYB家族的成员BH162(orange1.1t02482),在三次比较中均表达上调,其中大部分ERFs、myb和bHLHs tf在三次比较中表达下调,尤其明显RAV2(Cs6g18930)在小块土地,MYB105(Cs7g03660)的myb和bHLHW(Cs5g31400),沉默的(Cs9g06130)。7.高级副总裁(Cs3g17260),AGL8(Cs6g19700),WRK33(Cs6g09420),WRK55(Cs7g29580),NC104(Cs1g09510),NAC83(Cs2g13920),NAC31(Cs3g27630),NAC22(Cs8g01860),ARR5(Cs5g04810),美国中央情报局(Cs8g20740),ARR9(orange1.1t01850)表达上调,可能在果实颜色形成中起负调控作用。而MADS、WRKY和NAC家族中的其他一些detf表达下调,可能具有正向调控功能。为了解WGF、TYBGF和WLYF果皮中类黄酮和苯丙素生物合成降低的调控机制,在WGF、TYBGF和WLYF果皮中对60、51和22个代谢物和57、54和17个detf进行了相关性检验。结果显示有很强的正相关和负相关(r> 0.8或<-0.8和p-value < 0.05),主要集中在1、3、7、9象限(补充表S10补充图。S6).
讨论
类胡萝卜素是一大类天然脂溶性色素,对包括柑橘类植物在内的植物具有重要作用。14].已从天然来源鉴定出超过1000种类胡萝卜素[15].类胡萝卜素在柑橘果实中大量积累。其含量和组成是衡量营养和商品品质的重要指标[41].已有研究表明,β-类胡萝卜素、叶黄素和α-胡萝卜素含量迅速下降至较低水平,部分品种在成熟过程中出现β-隐黄质、玉米黄质和紫黄质大量积累[41].在本研究中,我们对4种柑橘‘沙塘桔’果皮中14种类胡萝卜素的含量进行了鉴定和测定(补充表S2,无花果。4).WLYF组的植物烯积累量最高,WGF组的植物烯积累量最低(图3)。4).WGF、TYBGF和WLYF中α-胡萝卜素和叶黄素含量显著高于WDYF。WDYF组的γ-胡萝卜素和β-隐黄质、虾青素和罗布麻素显著高于其他3组。这与之前的研究一致。这表明WGF、TYBGF和WLYF尚未达到完全成熟阶段。有几种转录因子参与了果实成熟过程中类胡萝卜素积累的调控,包括MADS-box转录因子RIN,TAGL1,TDR4[42,43,44,45], AP2/ERF家族tfSlAP2a而且SlERF6[46,47和MYB家族tfRCP1 (48].通过转录组分析和转录因子与类胡萝卜素的相关性分析,发现AP2/ERF家族TFs等多基因RAP27(Cs8g17390)和NAC家族tfNAC22(Cs8g01860),NAC62(orange1.1t00590),NAC45(Cs7g11190),以及bHLH家族的tfBHLHW(Cs5g31400),BH162(Cs2g05960)和MYB家族tfMYB36(Cs4g13170)(补充表S11).这些数据表明,这些TFs可能有助于类胡萝卜素的合成,并受HLB入侵的影响。这方面有待进一步研究,以确定其作用机制。
类胡萝卜素和类黄酮都是构成柑橘类水果色素的重要因素。类黄酮相关基因的转录水平受转录因子(tf)调控,如MYB-bHLH-WD40 (MBW)复合体[39,48,49], WRKY [50]及MADS [51].MYB转录因子是MBW复合物的决定性调控因子。正向或负向调控类黄酮途径中的结构基因,维持植物器官中类黄酮的平衡。的MdMYB1在苹果52),PpMYB10在桃53),VvMYBA1,VvMYBA2,VvMYBA-pa2在葡萄54,55]属于MYB因子的正向调控,提高类黄酮相关基因的转录水平。FaMYB9 / FaMYB11[56),FaMYB1在草莓57),PpMYB18在桃58),Vvmybc2-l3而且Vvmybc2-l2在葡萄59),MdMYB16而且MdMYB15L在苹果60,61]为MYB因子负调控。它们抑制花青素的合成。本研究分析了异常色素果皮和WDYF (CK)果皮的转录组特征。发现一些TF家族,包括MADS, WRKY, MYB和bHLHs,表现出显著差异表达水平。因此,在WGF、TYBGF和WLYF比较中,66.67%的myb, 80.77和66.67%的myb明显下调。所有差异表达的转录因子都可能是调控柑橘类黄酮合成的候选基因。
转录组学和代谢物分析结果显示,WGF、TYBGF和WLYF中大部分黄酮类化合物和其他苯丙素衍生代谢物以及一些类胡萝卜素(植物烯、γ-胡萝卜素、β-隐黄质、虾青素和罗布烯)的丰度显著低于WDYF (CK)果实。根据黄酮类化合物和其他苯丙素衍生代谢产物的化学结构,绘制了黄酮类化合物和其他苯丙素生物合成途径的路线图。与WDYF相比,WGF中黄酮类化合物的三种前体(丁丁苷、绒螯二醇和根皮素)的含量均有所降低,尤其是绒螯二醇。值得注意的是,总黄酮和其他苯丙素衍生品中的5种代谢物(6,7-二甲氧基-4-甲基香豆素、乙酰-eriodictyol o-hexoside、杨梅素、tricin 4 ' -o-β-愈创木酰基甘油和对香豆醛)在所有比较中丰度下降最明显,尤其是杨梅素和tricin 4 ' -o-β-愈创木酰基甘油。6,7-二甲氧基-4-甲基香豆素和杨梅素具有显著的抗菌活性[62].因此,这一结果可能导致WGF、TYBGF和WLYF果皮的致病菌数量较高。
结论
本研究中,我们探索了致病菌的居群顺序为WGF > TYBGF > WLYF > WDYF。叶绿素和类胡萝卜素丰度方面,WGF的叶绿素总量最高,类胡萝卜素总量最低。WGF和TYBGF果皮中植物烯、γ-胡萝卜素、β-隐黄质、虾青素和罗布麻素含量较低,其他类胡萝卜素含量显著高于WDYF果皮。WLYF只缺少天启性。转录组和代谢组数据综合分析表明,HLB感染对沙塘桔果皮的影响机制可能涉及苯丙素来源的代谢途径和广泛的光合相关蛋白下调基因。本研究不仅为研究沙塘桔果皮HLB感染的分子和生化机制提供了新的思路,而且对揭示响应HLB的未知基因具有重要意义。
数据和材料的可用性
所有相关的支持数据集都包含在文章及其补充文件中。
缩写
- WGF:
-
全绿色水果
- TYBGF:
-
上黄色和底绿色的水果
- WLYF:
-
全淡黄色水果
- WDYF:
-
全深黄色果实
- 度:
-
差异表达基因
- 滴:
-
Huanglongbing
- 及:
-
O-Poly-Methoxylated黄酮
- 朋友:
-
苯丙氨酸Ammonia-Lyase
- C4H:
-
肉桂酸4-Hydroxylase
- 4 cl:
-
4-香豆酸辅酶A连接酶
- CHS:
-
查耳酮合酶
- 气:
-
查耳酮异构酶
- F3H:
-
黄烷酮3-Hydroxylase
- F3'H:
-
类黄酮3 ' -羟化酶
- 假设:
-
异黄酮合成酶
- 读者:
-
黄酮醇合成酶
- DFR:
-
Dihydroflavonol-4-Reductase
- 政治:
-
Leucoanthocyanidin还原酶
- ANR:
-
花青素还原酶
- 答:
-
花青素合成酶
- 置信区间:
-
色指数
- scm:
-
显著改变代谢产物
- FPKM:
-
每千基读取每百万地图读取
- 罗斯福:
-
错误发现率
- 英国石油公司:
-
生物过程
- 答:
-
电池组件
- MF:
-
分子功能
- 走:
-
基因本体论
- KEGG:
-
京都基因和基因组百科全书
- 销售税:
-
谷胱甘肽S-transferase
- 配偶:
-
多药和有毒化合物挤出
- 陷阱:
-
可溶性NSF附着蛋白受体
- HCT:
-
羟基肉桂酰转移酶
- HIDH:
-
2-Hydroxyisoflavanone脱水酶
- IF7MAT:
-
异黄酮7-O-Glucoside-6”-O-Malonyltransferase
- UGT:,
-
UDP-Glycosyltransferases
- 计算机辅助设计:
-
肉桂醇脱氢酶
- 摘要::
-
Coumarate-3-Hydroxylase
- CCoAOMT:
-
Caffeoyl-Coa-3-O-Methyltransferase
- CCR:
-
肉桂酰辅酶a还原酶
- COMT的:
-
Catechol-O-Methyl转移酶
- F6H1:
-
Feruloyl-Coa-6-Hydroxylase
- 圆荚体:
-
过氧化物酶
- bHLH:
-
基本Helix-Loop-Helix
- 可以:
-
乙腈
- UHPLC:
-
超高效液相色谱
- 二叔丁基对甲酚:
-
2, 6-Di-Tert-Butyl-4-Methylphenol
- 坏蛋:
-
窗帘气体
- 计算机辅助设计:
-
碰撞气体
- DP:
-
Declustering潜在
- CE:
-
碰撞能量
- 贵宾:
-
投影中的变量重要性
参考文献
- 1.
黎波里(音),瓜迪雅(音),陈建明(音),陈建明(音),陈建明(音)。柑橘类黄酮:分子结构、生物活性和营养特性的研究进展。食品化学。2007;104:466 - 79。
- 2.
张建勇,张强,张红霞,马强,陆建强,乔亚杰。‘沙塘桔’果皮中多甲氧基类黄酮(PMFs)的表征(试采用在线高效液相色谱联用光电二极管阵列检测和电喷雾串联质谱法。农业食品化学学报。2012;60:9023-34。
- 3.
余旭,张勇,王东,姜玲,徐旭柑橘reticulatae皮膜基于脱氧核糖核酸条形码和高效液相色谱-二极管阵列检测电喷雾电离/质谱/质谱结合化学计量分析。Pharmacogn杂志。2018;14(53):64 - 9。
- 4.
柑橘黄斑或斑驳病。Phytophylactica。1970;2:177 - 94。
- 5.
Bove JM。黄龙病:柑桔的一种破坏性新发百年病害。植物学报。2006;24(4):329 - 331。
- 6.
黄龙病对柑桔生理和果汁品质的影响:化学和物理分析。农业食品化学学报,2010;58(2):47-62。
- 7.
巴萨内齐RB,蒙特西诺LH,斯图奇ES。黄龙冰对巴西甜橙品种果实品质的影响。中国植物学报。2009;24(4):393 - 393。
- 8.
Green CO, Wheatley AO, Osagie AU, Dilworth LL, Morrison EYSA, Asemota HN。牙买加和墨西哥柑橘皮中促进健康的多甲氧基黄酮的特征。Acta Hortic。2009;841:71。
- 9.
刘霞,罗勇,吴慧,奚伟,于娟,张琴,周卓。柑橘o-甲基转移酶基因家族的系统分析及参与o-甲基化类黄酮形成的潜在成员鉴定。基因。2016;575(2):458 - 72。
- 10.
黄酮类化合物是柑橘中主要的多酚类物质。食品化学。2014;33(1):85-104。
- 11.
Mcintosh CA, Owens DK。类黄酮糖基转移酶的研究进展:将近期发现与长期柑橘研究相结合。Phytochem启2016;15(6):1075 - 91。
- 12.
Fabroni S, Ballistreri G, Amenta M, Rapisarda P. P.不同柑橘品种花青素含量的UHPLC-PDA-ESI/ msn辅助定性定量研究。食品科学与技术;2016;96(14):4797-808。
- 13.
黄丽娟,李志强,李志强,等。黄酮类化合物生物合成的分子遗传学研究进展。食品学报。2011;40:150-63。
- 14.
马国刚,张玲,王永源,张丽娟,张丽娟,张丽娟,张丽娟。柑橘类胡萝卜素羟化酶的表达与功能分析:研究柑橘类果实中叶黄素合成的机理。中国生物医学工程学报,2016;16(1):148。
- 15.
黄晓燕,王晓燕,王晓燕,等。柑橘类胡萝卜素积累相关基因的表达及类胡萝卜素谱多样性研究。育种科学。2016;66(1):139 - 47岁。
- 16.
Alquézar B, Rodrigo MJ, Zacarías L.类胡萝卜素在柑橘果实中的合成及其调控作用。林业科学与技术。2008;2(1):23-37。
- 17.
黄志明,张志明,张志明,等。柑橘类胡萝卜素生物合成特性的研究。中国地质大学学报(自然科学版)。2014;
- 18.
Kato M, Matsumoto H, Ikoma Y, Okuda H,矢野AM类胡萝卜素切割双加氧酶在柑橘成熟过程中类胡萝卜素谱调控中的作用。中国生物医学工程学报。2006;57(10):2153-64。
- 19.
刘强,徐军,刘永忠,赵晓林,邓XX,郭林,顾建强。一种新的芽突变,赋予甜橙果实中番茄红素积累异常模式(素类l .等)。中国生物医学工程学报2007;58(15-16):4161-71。
- 20.
王春梅,王春梅,王春梅,等。柑橘茎和根对番茄红素的响应Candidatus liberibacterasiaticus感染。《公共科学图书馆•综合》。2013;8 (9):e73742。
- 21.
徐敏,李艳,郑智,戴智,陶勇,邓欣。严重感染‘柑橘’的转录分析Candidatus liberibacterasiaticus”。《公共科学图书馆•综合》。2015;10 (7):e0133652。
- 22.
王艳,周玲,于欣,Stover E,骆峰,段颖。柑橘黄龙冰(HLB)抗性和感病植株转录组分析揭示基础抗性在HLB抗性中的作用。植物学报。2016;
- 23.
钟艳,程晨,蒋宁,蒋斌,张勇,吴斌,钟刚。柑橘根系对干旱胁迫的响应转录组和ITRAQ蛋白质组比较分析Candidatus liberibacterasiaticus感染。《公共科学图书馆•综合》。2015;10 (6):e0126973。
- 24.
王军,刘军,陈凯,李宏,何晶,管波,何磊。两种植物的转录组和蛋白质组分析比较素类品种在果实发育和成熟期间。BMC染色体组。2017;18(1):984。
- 25.
masenti R、LoBianco R、Sandhu AK、Gu L、Sims C.黄龙冰对瓦伦西亚橙子的品质成分和类黄酮含量进行了改良。食品科学与技术;2015;96(1):73-8。
- 26.
黄酮类化合物在植物中的抗氧化作用:定位和功能意义。植物科学。2012;196:67 - 76。
- 27.
王飞飞,黄艳杰,吴伟,朱成成,张荣,陈建忠,曾继伟。不同颜色柑橘果皮的代谢组学分析(试简历。利用UHPLC-QQQ-MS分析成熟期的“沙塘居”。摩尔。2020;25(2):396。
- 28.
Murray MG, Thompson WF。快速分离高分子量植物DNA。中国生物医学工程学报1980;8(19):4321-5。
- 29.
李伟,哈东JS, Levy L.实时荧光定量PCR检测鉴定Candidatus liberibacter与柑桔黄龙冰有关的种。微生物学报,2006;66(1):104-15。
- 30.
Lakshmi BR, Mukherjee F, Surendra KSNL, Bahekar VS, Srinivasan V.用于特异性检测的诊断性实时PCR的优化和验证鸟型分支杆菌亚种副结核.中国生物医学杂志。2015;4(1):12-24。
- 31.
HISAT:一种低内存要求的快速拼接对准器。Nat方法。2015;12(4):357 - 60。
- 32.
王磊,王松,李伟。RSeQC: RNA-seq实验的质量控制。生物信息学,2015,28(16):2184 - 5。
- 33.
作者:Ashburner M, Ball CA, Blake JA, Botstein D, Michael Cherry J.基因本体:生物学统一的工具。基因本体联盟。Nat麝猫。2000;得分上以25 - 9胜过25(1):。
- 34.
金久M,荒木M,后藤S,服部M,平川M,伊藤M,山西Y. KEGG,将基因组与生命和环境联系起来。中国生物医学工程学报。2007;36(6):429 - 429。
- 35.
郑勇,焦超,孙洪辉,Rosli HG, Pombo MA,张鹏飞,Banf M,戴晓波,Martin GB, Giovannoni JJ,赵px, Rhee SY, Fei ZJ。iTAK:植物转录因子、转录调控因子和蛋白激酶的全基因组预测和分类程序。摩尔。2016;9(12):1667 - 70。
- 36.
Stracke R, Ishihara H, Huep G, Barsch A, Mehrtens F, Niehaus K, Weisshaar B.密切相关的R2R3-MYB转录因子差异调控控制黄酮醇在不同部位的积累拟南芥幼苗。植物j . 2010;(4): 660 - 77。
- 37.
刘军,马平。MYB转录因子对植物苯丙素代谢的调控作用。摩尔。2015;8(5):689 - 708。
- 38.
拟南芥转录因子MYB12是一种黄酮醇特异的苯丙素生物合成调节剂。植物杂志。2005;138(2):1083 - 96。
- 39.
黄酮类化合物生物合成的转录调控:MYB-bHLH- WD40 (MBW)复合物的微调。植物信号处理。2014;9(1):e27522。
- 40.
周慧,林王凯,王峰,任峰,赵军,韩宇,激活因子型R2R3-MYB基因诱导抑制因子型R2R3-MYB基因平衡花青素和原花青素积累。新植醇。2019;221(4):1919 - 34。
- 41.
马刚,张玲,张玲,张丽娟,张丽娟,张丽娟。β-隐黄质和玉米黄质的类胡萝卜素切割双加氧酶4酶促合成β-柠檬黄苷。植物杂志。2013;163(2):682 - 95。
- 42.
Vrebalov J、Pan IL、Arroyo AJM、McQuinn R、Chung M、Poole M、Rose J、Seymour G、Grandillo S、Giovannoni J.番茄抗碎性基因调控肉质果实的膨大和成熟TAGL1.植物细胞。2009;21:3041 - 62。
- 43.
李志强,李志强,李志强,李志强,等。番茄成熟抑制因子(rin)位点的mof -box基因。科学。2002;296:343-6。
- 44.
Itkin M, Seybold H, Breitel D, Rogachev I, Meir S, Aharoni a .番茄agamouslike 1是果实成熟调控网络的一个组成部分。植物j . 2009; 60:1081 - 95。
- 45.
Bemer M, Karlova R, Ballester AR, Tikunov YM, Bovy AG, Wolters-Arts M, Barros Rossetto P, Angenent GC, Maagd RA。番茄果实完全同源TDR4/FUL1而且MBP7/FUL2调节乙烯对果实成熟的影响。植物细胞。2012;24:4437-51。
- 46.
Chung MY, Vrebalov J, Alba R, Lee J, McQuinn R, Chung JD, Klein P, Giovannoni J.番茄(茄属植物lycopersicum) APETALA2 /小块土地的基因,SlAP2a,是果实成熟的负调控因子。植物j . 2010; 64:936-47。
- 47.
李建明,jung JG, McQuinn R, Chung MY, Fei ZJ, Tieman D, Klee H, Giovannoni J.联合转录组、遗传多样性和代谢物分析揭示了番茄果实乙烯响应因子SlERF6在成熟和类胡萝卜素积累中起重要作用。植物j . 2012; 70:191 - 204。
- 48.
Sagawa JM, Stanley LE, Lafountain AM。一种R2R3-MYB转录因子调节类胡萝卜素色素沉着Mimulus lewisii花。新植醇。2015;209(3):1049 - 57。
- 49.
Ma D, Reichelt M, Yoshida K, Gershenzon, conabel CP. 2。R2R3-MYB蛋白是杨树类黄酮和苯丙素代谢的广泛阻遏物。工厂j . 2018, 96(5): 949 - 65。
- 50.
C . Lofke C . Jansen L . Goeminne G . Beeckman tWRKY23协助生长素分布模式拟南芥通过局部控制黄酮醇生物合成促进根系发育。美国国家科学院。2012年,109(5):1554 - 9。
- 51.
Jaakola L, Poole M, Jones MO, Kamarainen-Karppinen T, Koskimaki JJ, Hohtola A, Seymour GB。一种参与越桔果实花青素积累调控的鳞翅草MADS盒基因。植物杂志。2010;153(4):1619 - 29。
- 52.
胡德东,孙超,马启杰,尤春霞,郝玉杰。MDMYB1通过直接促进花青素和苹果酸转运到苹果液泡中来调节它们的积累。植物杂志。2016;170(3):1315 - 30。
- 53.
周慧,廖林,徐淑玲,任峰,赵斌杰,奥古图昌,王磊,蒋强,韩永平。R3重复序列上的两个氨基酸变化导致了两个聚集的功能分化MYB10基因在桃子。植物化学学报,2018;28(3):393 - 393。
- 54.
范欣,赵睿,王倩,刘超,方军。巨峰葡萄花青素及其衍生物的花色苷组成和myaba相关基因型。如果短科学。2018;53(12):1766 - 71。
- 55.
小梗N、小梗L、小梗A、小梗S、小梗C、小梗V、小梗C的异位表达VvMybPA2促进葡萄原花青素的生物合成,并提示该途径的额外靶点。植物杂志。2008;149(2):1028 - 41。
- 56.
Schaart JG, Dubos C, Romero De La Fuente I, Houwelingen AMML, Vos De RCH, Jonker HH, Xu WJ, Routaboul JM, Lepiniec L, Bovy AG。调控草莓原花青素合成的MYB-bHLH-WD40调控复合物的鉴定与表征(草莓属×ananassa)水果。新植醇。2013;197(2):454 - 67。
- 57.
Aharoni A, De Vos CH, Wein M, Sun Z, Greco R, Kroon A, Mol JN, O 'Connell AP.草莓FaMYB1转录因子抑制转基因烟草花青素和黄酮醇积累。植物j . 2001; 28(3): 319 - 32。
- 58.
周慧,王坤林,王福瑞,任峰,赵斌杰,奥古图C,何惠普,蒋倩,Allan AC,韩永平。激活型R2R3MYB基因诱导抑制型R2R3MYB基因来平衡花青素和原花青素积累。新植醇。2018;221(4):1919 - 34。
- 59.
Cavallini E、Matus JT、Finezzo L、Zenoni S、Loyola R、Guzzo F、Schlechter R、Ageorges A、arc - johnso P.在葡萄植株中,苯丙素途径在不同分支受一组R2R3-MYB C2阻遏子控制。植物杂志。2015;167(4):1448 - 70。
- 60.
徐慧,杨刚,张军,王勇,张涛,王宁,姜松,张智,陈旭。抑制因子的过表达MdMYB15L对红肉愈伤组织花青素和耐寒性的负调控。北京化工大学学报(自然科学版)2018;
- 61.
徐惠芬,王宁,刘建新,曲正洲,王永春,蒋绍生,卢乃林,王大东,张志勇,陈小霞。苹果花青素代谢的分子机制MdMYB16而且MdbHLH33基因。植物化学学报,2017,34(3):349 - 356。
- 62.
杨海燕,杨海燕,杨海燕,杨海燕素类而且柑橘aurantifolia抗骨质疏松及其植物化学成分。作物保护。2011;22(5):753 - 60。
确认
感谢AJE (https://www.aje.com/),以在准备这份手稿期间提供语言上的帮助。
资金
本研究由国家重点研发计划项目(No:2020YFD1001101)资助;农业部、农业部中国农业研究体系广东省农业科学院农业优势产业学科团队建设项目(No: 202113TD);农业科学高水平研究院科技创新战略建设专项资金(No: R2020PY-JG001);广东省科技计划项目(No: 2020A1515010167, 2018B020202009)。资助方未参与研究的设计、数据的收集、分析和解释以及手稿的撰写。
作者信息
从属关系
贡献
JC和JZ构思实验并修改手稿;FW设计并实施实验,分析数据,撰写并修改稿件;YH、WW提供素材,参与样片预处理和部分稿件撰写;YW参与了数据分析和部分稿件撰写;CZ和RZ参与数据分析并提供资金。作者阅读并批准了手稿的最终版本。
相应的作者
道德声明
伦理认可和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者声明他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格《自然》对出版的地图和机构附属关系中的管辖权要求保持中立。
补充信息
附加文件1:补充图S1。
三次比较中DEGs的GO分析。补充图S2。统计分析三次比较中DEGs的GO富集情况。补充图S3。三组比较中DEGs的KEGG分析。补充图S4。三组比较中SCMs和DEGs的KEGG分析。补充图S6。三次比较中所有SCMs和DEGs的九象限分析。
附加文件2:补充图S5。
调控基因与类黄酮和类胡萝卜素相关代谢物的连接网络。
附加文件3:补充表S1。
qRT-PCR特异性引物序列。
附加文件4:补充表S2。
A:柑橘果实的表型和颜色分析(试简历。《沙塘居》)。b:不同颜色柑橘果皮类胡萝卜素的UHPLC-MS/MS数据(试简历。《沙塘居》)。c:不同颜色柑橘类水果的类胡萝卜素含量(试简历。《沙塘居》)。医生:18种类胡萝卜素的方程式。
附加文件5:补充表S3。
与WDYF相比,WGF、TYBGF和WLYF中黄酮类化合物和苯丙素含量有显著变化。
附加文件6:补充表S4。
测序和基因组比较综述。
附加文件7:补充表S5。
与WDYF相比,WGF、TYBGF和WLYF的基因发生了显著变化。
附加文件8:补充表S6。
三次比较中DEGs的KEGG值。
附加文件9:补充表S7。
与WDYF相比,WGF、TYBGF和WLYF中涉及类黄酮和苯丙素代谢的基因。
附加文件10:补充表S8。
与WDYF相比,WGF、TYBGF和WLYF中类黄酮代谢途径相关基因及代谢产物的Pearson相关系数。
附加文件11:补充表S9。
WGF、TYBGF和WLYF与WDYF的转录因子表达差异。
附加文件12:补充表S10。
WGF、TYBGF和WLYF中TFs与类黄酮代谢途径中代谢产物的Pearson相关系数与WDYF比较。
附加文件13:补充表S11。
WGF、TYBGF和WLYF与WDYF的基因和类胡萝卜素Pearson相关系数比较。
权利和权限
开放获取本文根据知识共享署名4.0国际许可协议授权,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和源代码,提供知识共享许可协议的链接,并说明是否进行了修改。本文中的图像或其他第三方材料均包含在本文的知识共享许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的知识共享许可中,并且您的预期使用不被法定法规允许或超过允许的使用,您将需要直接从版权所有者获得许可。如欲查阅本牌照副本,请浏览http://creativecommons.org/licenses/by/4.0/.知识共享公共领域转让豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在对数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
王芳,吴艳,吴伟。et al。通过对代谢组和转录组图谱的综合分析,我们可以进一步了解'Candidatus Liberibacterasiaticus的感染。BMC植物杂志21日,397(2021)。https://doi.org/10.1186/s12870-021-03167-3
收到了:
接受:
发表:
关键字
- “Shatangju”
- 色素
- 类胡萝卜素
- 类黄酮
- 代谢物
- 转录组
- Candidatus Liberibacterasiaticus