摘要
背景
为了了解葡萄糖苷(glucosinolates, GSs)在特定器官中积累的机制,本研究采用生理变化分析和转录组测序相结合的方法。以芥蓝为材料,根据种子胚的发育情况,将种子和角果壁分为不同阶段,进行GS分析和转录组测序。
结果
芥蓝种子中GS的主要成分为葡糖苷和葡糖苷,其含量随种子发育而变化。在胚由鱼雷期向早期子叶胚期过渡的过程中,种子中GS的积累伴随着相应的角果壁GS的显著下降。因此,我们对这两个阶段的种子和相应的硅质壁进行了转录组测序分析。共鉴定出135个与GS代谢相关的基因,其中24个基因为转录因子,81个基因与生物合成途径相关,25个基因编码分解代谢酶,5个基因与转运蛋白匹配。在种子和角果壁中均检测到GS生物合成基因的表达。高表达FMOGS-OX而且AOP2在这两个阶段的种子中都发现了与侧面修饰产生葡萄糖红素有关的突变。有趣的是,GS生物合成基因在硅果壁上的表达量高于种子,但硅果壁上的GS含量低于种子。结合转运蛋白基因的高表达gtr硅石壁上的GS含量高于种子,表明硅石壁上GS向种子的转运是种子GS积累的重要来源。此外,与GS降解相关的基因在子叶胚早期在种子中大量表达,表明其在平衡种子GS含量方面具有潜在作用。
结论
种子发育过程中GS积累的关键阶段为鱼雷胚期和早期子叶胚期。此外,我们证实了GS从角锥壁向种子的运输,并提出在种子形成过程中可能存在GS生物合成的侧链修饰。
背景
芥蓝(b . oleracea),是十字花科植物的一种,因其富含促进健康的硫代葡萄糖苷(GS),并含有丰富的胡萝卜素和维生素C [1].芥蓝是一种原产于中国南方的蔬菜作物,是中国著名的特色蔬菜,鲜脆嫩滑,风味独特[2,3.,4].硫代葡萄糖苷是由葡萄糖和氨基酸合成的一类甾体糖苷。这些化合物作为次生代谢产物广泛存在于十字花科植物中拟南芥以及大量具有经济价值的蔬菜[5,6,7].根据化合物的氨基酸来源,GS可分为脂肪族GS、吲哚族GS和芳香族GS [8,9].
在植物中,GS定位于特定细胞的液泡内[10].草食动物受损后,GS与黑芥子酶(EC3.2.1)混合,形成分解产物[11].吲哚族GS水解生成不稳定的异硫氰酸酯(ITCs)和腈,而脂肪族和芳香族GS主要生成有害的ITCs [12].不同的GS群使植物对不同的攻击者具有不同的抗性。例如,吲哚GSs作用于韧皮部喂养者和病原体[13],而脂肪族、吲哚族和苄基GS则可能影响昆虫的咀嚼性能[14].
不同羽衣甘蓝品种的GS含量和GS谱极具差异性[15].GSs组成性地存在于芸苔科植物的所有组织中,但在不同器官中的分布存在差异,其中生殖器官(如种子、豆荚和发育中的花序)的GS含量最高,其次是幼叶和根[16].GS的积累是一个复杂的过程,可能受到多种机制的调控[17,18].调节GS积累的介质主要与该过程的三个方面有关,即:i) GS生物合成,ii) GS降解,iii) GS运输。在模型植物中拟南芥,大部分GS生物合成和降解基因已被鉴定[19,20.,21].GS的合成拟南芥包括三个独立的过程:特定氨基酸的延伸、核心结构的形成和侧链的二次修饰[17,22].经过与拟南芥基因,GS生物合成同源基因在我们前期研究中在芥蓝芽中被鉴定[3.].GS在植物体内的降解也可能对GS的积累产生重要影响,并由分解代谢酶介导[6].黑芥子酶,又称β-巯基糖苷酶,是十字花科植物中常见的水解酶,可有效降解GSs [11,23,24].6个黑芥子酶基因(巯基葡萄糖水解酶1-6;TGG1-TGG6)已在拟南芥[25,26,27].此外,渗透2(PEN2),PYK10能水解吲哚基GS拟南芥[28,29].最近,超过一半的β-巯基糖苷酶在拟南芥显示出黑芥子酶活性(BGLU18-BGLU39) [29,30.].此外,转运过程对保护植物高价值组织的防御化合物的重新分配是重要的。如在拟南芥, GSs在成熟时转运到种子硝酸盐转运蛋白1/肽转运蛋白(NRT1 / PTR)家庭搬运工[31,32,33].的NRT1 / PTR家庭包括NPF2.10 / GTR1,NPF2.11 / GTR2,NPF2.9 / GTR3.在这些转运蛋白中,GTR1和GTR2被广泛认为具有GS转运活性,而GTR3则专门转运吲哚型GS -甲基硫代葡萄糖苷[32,34,35].
蔬菜作物含有更多的与GS生物合成相关的同源基因拟南芥[36].然而,在芥蓝中,在特定代谢过程中起关键作用的同源物仍然未知,因此无法利用基因编辑来改善蔬菜品质。转录组测序(RNA测序)是一种高效和广泛应用的技术,用于获取深层转录组信息和全面了解生物转录本,特别是特定组织中代谢途径中涉及的转录本。同时,RNA测序分析被用于量化转录本水平,也能够识别新的转录本,以改善基因组的注释[37].在之前的研究中,我们发现了芥蓝芽GS代谢相关基因[3.].然而,为了提高芥蓝芽中GS的含量,我们观察到芽中GS的含量是种子释放、生物合成、降解和运输的结果,其中种子释放是影响芽中GS积累的主导因素[3.].因此,提高种子GS对调控芥蓝芽GS含量至关重要。
GS在不同部位的分布遵循最优防御理论,该理论允许植物优先将防御化合物分配给有价值的植物部位,这些部位对潜在的攻击者也有吸引力[38].驯化后,选择具有高价值食用部分的品种,使种子中GS的组成复杂化。拟南芥GS生物合成基因表达的硅晶分析表明,GS从硅晶壁向种子分配的重要作用[17,24].然而,芥蓝与拟南芥相比含有不同的GS谱,关于种子发育过程中GS积累来源的知识仍然有限。在本研究中,我们观察到芥蓝胚发育过程中,角果壁GS含量下降,种子GS积累增加。因此,我们提出GS在种子中的积累可能与GS从硅石壁的运输有关。通过对种子发育过程中GS积累及相应的硅果壁的生理分析,我们确定了GS转变的关键阶段,即鱼雷期和子叶期-胚期,并对这两个阶段进行RNA测序后的转录组分析。最后,我们认为在芥蓝种子形成过程中GS可能发生侧链修饰。
结果
芥蓝种子形成过程中胚发育及GS在种子及相应的角果壁中的积累
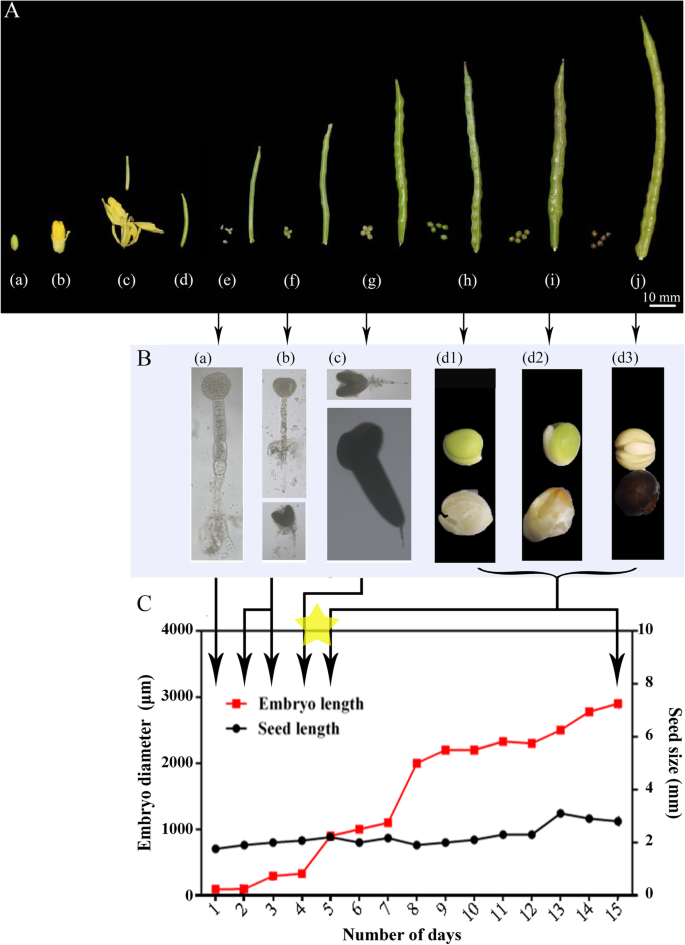
在花蕾出现后,跟踪了花和果实发育的整个过程(图1)。1A).花蕾出芽后10天,花朵完全开放,角果长10mm(第0天),开花后9天角果迅速长至35mm (DAF),球形期含胚。在15 DAF时形成心形胚,长40-55毫米。在长度为55-65毫米的31 DAF硅果中观察到一个鱼雷状胚胎。10天后,角果变绿,此时胚已进入子叶期。子叶-胚期持续13 d,直至角果变成褐色(图2)。1A和B)。从球状期到子叶期测量胚直径和种子大小(图。1C).当种皮从白色变为绿色时,胚从鱼雷期过渡到早期子叶期,胚直径急剧增大,但种子大小没有明显变化(图2)。1A和c)。
芥蓝种子形成过程中种子、相应的角果发育及胚的形态发生。一个芥蓝种子发育及相应的角果.(a)小花蕾(7 DBF), (b)大花蕾(1 DBF), (c) 10 mm角石带籽(上)和花(下)(第0天),(d) 20 mm角石带籽(3 DAF), (e) 35 mm角石带籽(9 DAF), (f) 40-50 mm角石带籽(15 DAF), (g) 55-65 mm角石带籽(31 DAF), (h)绿色角石带籽(41 DAF), (i)半棕色角石带籽(48 DAF), (j)全棕色角石带籽(53 DAF)。DAF代表花前的一天,DAF代表花后的一天。B无花果种子形成过程中胚的形态发生。1a . (a)球状胚,(b)心形胚,(c)鱼雷形胚,(d1)早期子叶胚和种皮,(d2)中期子叶胚和种皮,(d3)晚期子叶胚和种皮。C种子形成过程中胚直径和种子大小的变化。使用3个生物重复进行测量
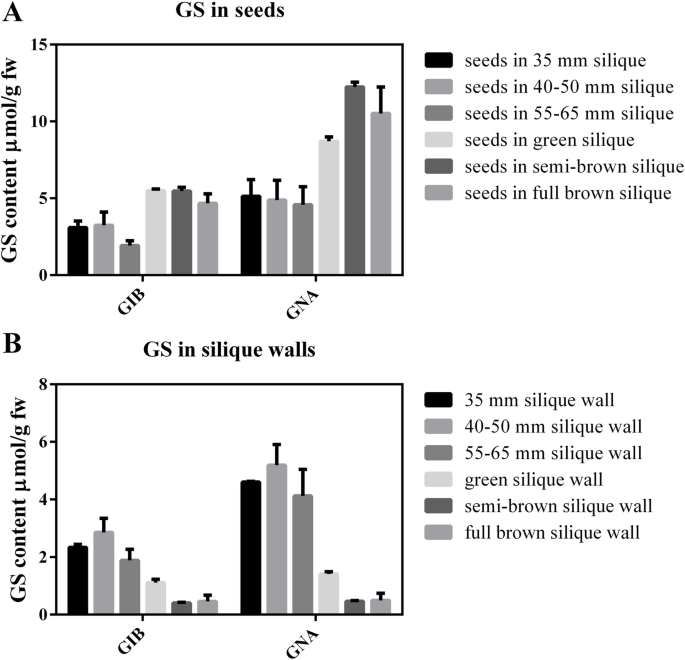
在不同发育阶段测定了种子和相应的硅石壁的GS含量(图2)。2).鉴定出8种GSs,包括4种脂肪族GSs (glucoiberin、progoitrin、gluconapin和glucoerucin)和4种吲哚族GSs (glucobrassicin、4-hydroxybrassicin、4-methoxyglucobrassicin和neoglucobrassicin)(补充表)1).两种脂肪族GSs,即3碳glucoiberin (GIB)和4碳gluconapin (GNA)在种子和角果壁中占主导地位(补充表1).GIB和GNA在种子中的积累具有相似的规律;在鱼雷胚期前含量相对较低,在胚进入子叶期后含量增加,此后一直保持较高含量,直至胚成熟(图2)。2A).相应的硅石壁面GS含量变化呈现相反的趋势,在硅石长10 ~ 65 mm时,GS含量较高,种皮变绿后,GS含量较低(图2)。2B).值得注意的是,GS含量在胚芽-胚期到子叶-胚早期显著变化,且GS在种子和相应的硅果壁中的积累趋势相反,说明GS可能在胚成熟过程中从硅果壁向种子转移。
鱼雷期和子叶胚期种子和角果壁的转录组分析
为了阐明GS在种子形成过程中积累的潜在机制,对鱼雷胚和早期子叶胚阶段的种子和角果壁进行了转录组测序。十二个转录组数据库s,包括鱼雷胚期(SC和PC)的种子和角锥壁,以及子叶胚早期(SD和PD)的种子和角锥壁,每组重复3次。
共获得5815万份原始reads,每个样本平均数据为6.47 Gb。过滤后,4312万个干净的读取被映射到b . oleracea基因组。映射百分比为80.66 ~ 84.51%。clean reads的平均Q30约为93%,保证了高质量的序列数据和后续分析(Table1).我们鉴定出49281个基因,其中43580个是已知基因,5701个是新基因。在检测到的47212个新转录物中,22070个是长链非编码RNA, 19321个是已知蛋白质编码基因的新备选剪接异构体,5821个是新的蛋白质编码基因的转录物。
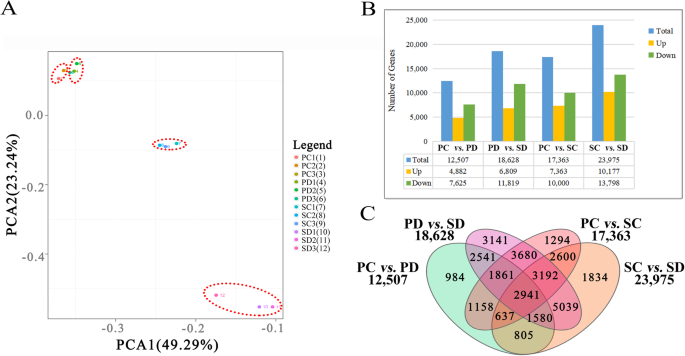
接下来,我们分析了测序样本与基因表达分布的相关性(图;3.).主成分分析(PCA)评价了12个cDNA数据库的相似性。四组(SC、PC、SD和PD)的三次复制聚集在一起,各组内基因表达强相关(图2)。3.A).四组差异表达基因(DEGs)数量统计于图中。3.B.在鱼雷胚期,SC与PC之间共检测到17363个deg,其中7363个基因上调,1万个基因下调。在子叶-胚胎阶段,SD和PD之间共鉴定出23975个差异基因,其中上调基因10177个,下调基因13798个(图2)。3.B).在胚发育从鱼雷期向子叶胚期过渡期间,角果壁和种子中分别有12507个和18628个基因差异表达,其中4882/6809个基因上调,7625/ 11819个基因下调(图。3.B).四组共鉴定出2941个共同的deg(图41。3.C)。
种子形成过程中差异表达基因分析
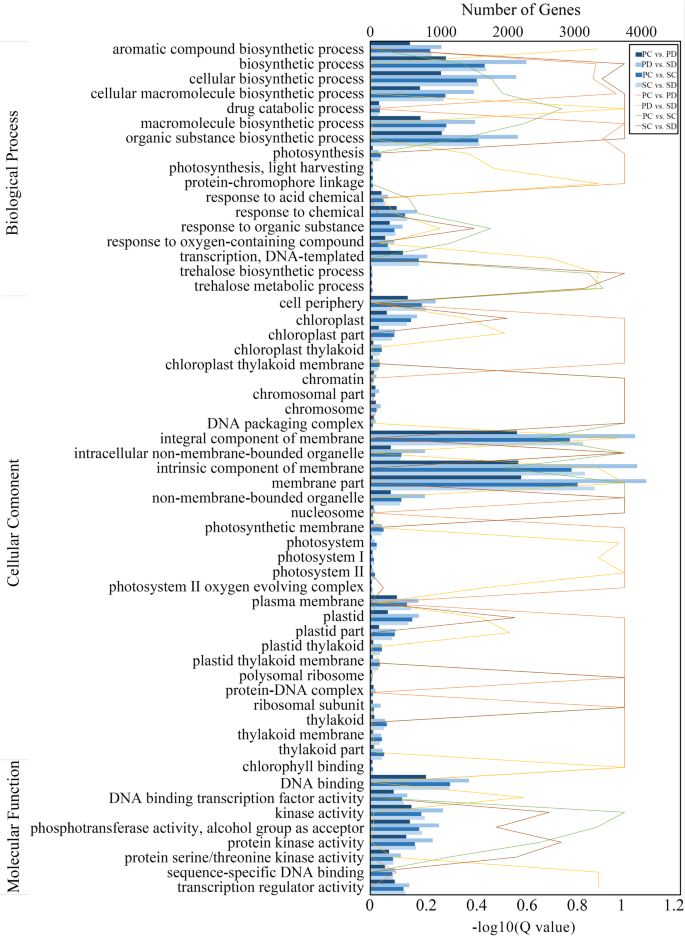
为了识别DEGs的功能,我们根据基因本体(GO)数据库中的注释进行功能分类(图2)。4,补充图。1).总共有24,854个基因被分配到生物过程(BP)、细胞成分(CC)和分子功能(MF)类别,分别富集了15、23和11个术语(补充图)。1).在SC vs SD, SC vs PC, PC vs PD, SD vs PD的比较中,deg表现出类似的GO分类。生物合成过程、细胞生物合成过程和有机物生物合成过程是BP富集程度最高的3个亚类。最高富集的CC亚类为膜整体组分、膜固有组分和膜部分。显示最高富集的MF项是DNA结合、激酶活性和磷酸转移酶活性。在BP、CC和MF类别中,大量的基因被归类为转录调控相关过程(图2)。4).
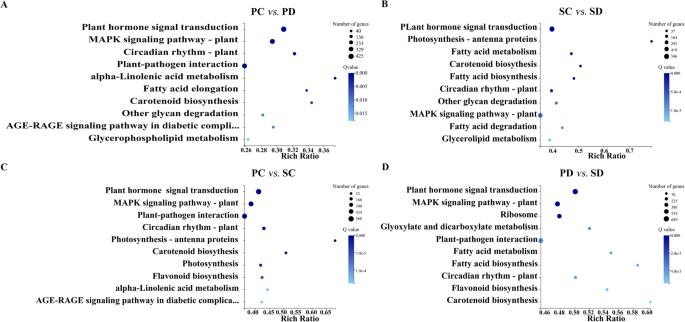
为了探索DEG参与的生物学途径,使用京都基因和基因组百科全书(KEGG)数据库对DEG进行分类[39,40].总共有9637个deg被分配到5个分支,19个分支(补充图。2).经过富集分析,筛选出基因数量最多、Q值较低的10个排名靠前的通路,如图所示。5.在PC与PD、PC与SC、SC与SD、PD与SD的比较中,DEGs富集数量最多的通路是植物激素信号转导通路,其次是MAPK信号通路。
种子形成过程中GS生物合成和降解相关基因的表达模式
GS的生物合成包括三个独立的阶段:脂肪族GS前体的延伸,核心结构的形成和侧链的修饰(图2)。6A、补充表2).
在芥蓝种子和相应的角果壁转录组中鉴定出17个与脂肪族GS前体伸长相关的基因。这些基因由两个支链转氨酶4 (BCAT4)、两个胆汁酸转运蛋白5 (BAT5)基因,四甲基硫代烷基苹果酸合成酶1 (MAM1)基因,一个苹果酸甲硫代肯基合成酶3 (MAM3)、一个苹果酸异丙酯异构酶(IPMI)、五种苹果酸异丙酯脱氢酶(IPMDH)基因和二支链氨基转移酶3 (BCAT3)基因。在鱼雷和子叶胚胎阶段,表达BCAT4-1,BAT5-1,MAM1-3,MAM1-4在种子中低于相应的硅石壁。在种子和硅果壁的比较中,在鱼雷胚阶段,两者的转录水平较高BCAT4基因,两BAT5年代的基因,MAM1-3,IPMI,IPMDH1-1,BCAT3-2在种子中检测到,而MAM1-1而且BCAT3-1在子叶-胚期的角果壁中检测到。6一个)。
在核心结构的形成方面,从数据库中绘制了包含39个成员的12个基因。这些基因由细胞色素组成P450同源染色体CYP79A2,CYP79B2,CYP79B3,CYP79F1,CYP83A1,CYP83B1,碳硫裂解酶(SUR1)、γ-谷氨酰多肽合成酶(GGP1)、葡萄糖转移酶(UGT74B1),并对GS转移酶基因进行脱硫SOT16,SOT17,SOT18.在脂肪族GS核心结构的合成中,一CYP79F1,两个CYP83A1,四个SUR1,一个GGP1,一个UGT74B1,四个SOT17,八SOT18基因被鉴定。在种子里,表达CYP79F1,CYP83A1-1,CYP83A1-2,UGT74B1,SOT17-2,SOT17-4,SOT18-1,SOT18-4,SOT18-5与相应的硅石墙相比,降低了。在具有多个成员的基因中,例如SOT17而且SOT18,部分委员(SOT18-6而且SOT18-7)在种子中的表达量高于硅果壁,而其他成员(SOT17-3而且SOT18-8)在SC与PC和SD与PD的比较中显示相反的趋势。在SD与SC的比较中,的表达式CYP83A1-1,SOT18-4,SOT18-6,SOT18-8的表达,而CYP83A1-2而且SOT18-5与SC相比,SD组较低(图;6A).对于与吲哚和芳香族GS核心结构合成相关的基因,9个CYP79A2,三个CYP79B2,一个CYP79B3,一个CYP83B1,四SOT16基因被鉴定。这些基因的表达在图中突出显示。6A分别用蓝色和绿色表示。
在二次修饰的最后一步,鉴定出6个与脂肪族GS生物合成相关的基因,包括3个单加氧酶(FMOGS)包括一个FMOGS-OX1,两个FMOGS-OX5基因,以及三种依赖于2-羟戊二酸的双加氧酶(AOP2)基因。类似于前面提到的多基因家族的表达模式,FMOGS基因成员也表现出不同的表达模式。表达水平FMOGS-OX1的表达降低,而FMOGS-OX5-1PC与SC、PD与SD的比较均增加。的表达式FMOGS-OX5-2PC、PD和SC较高,而SD较低(图2)。6A).还检测到参与吲哚基GS修饰的基因,包括14个CYP84F和五个IGMT基因。这些基因编码的蛋白质被预测定位在线粒体中,其表达水平在不同的样本中有所不同(图2)。6一个)。
在GS降解方面,6种典型的黑芥子酶(TGG1)在序列数据库中进行识别(图;6B、补充表2).的表达式TGG1发育中的种子和角果壁基因相对一致。在鱼雷胚胎阶段,转录水平为TGG1-2,TGG1-3,TGG1-6与PC相比,SC的基因含量较低TGG1-1,TGG1-4,TGG1-5SC与PC间无明显差异。在早期子叶-胚胎阶段,有丰富的转录本TGG1在种子中检测了所有基因的表达TGG与相应的硅果壁相比,种子的基因水平显著上调,并且在鱼雷胚期转录水平显著高于种子。因此,有人提出,在胚胎从鱼雷期到早期子叶期的过渡过程中,黑芥子酶由典型的TGG1基因在种子中大量积累。对于吲哚基GS的特异性降解,表达PEN2在种子中相对于硅果壁较低,并在胚发育过程中保持稳定(图。6B).其他具有黑芥子酶活性的β-巯基糖苷酶也被鉴定出来,这些基因的差异表达也被总结在图中。6B。
五个GTR包括两个基因GTR1基因,一个GTR2,二GTR3基因,在转录组中被注释(图;6C、补充表3.).较高的表达GTR2在PC (vs SC)和PD (vs SD)中检测到脂肪族GS,表明脂肪族GS可能从角锥壁向种子转移。与鱼雷-胚期种子相比,早期子叶-胚期GS向种子的运输可能增强,原因是GTR2与SC相比,SD的转录水平显著提高GTR1-2PD(相对于SD)增加,但PC(相对于SC)没有增加。这种差异可能与增强有关GTR1-2在角果壁早期子叶-胚阶段以较高丰度为主GTR1-2PD比PC检测到更多的转录本。的基因GTR1-1四组间转录本丰度无明显差异。这两个GTR3成员们表现出相反的表情模式。在SC vs PC和SD vs PD的比较中,表达GTR3-1的表达降低,而GTR3-2分别增加。
GS生物合成调控转录因子的鉴定
的阳性转录调控因子MYB在转录组中被注释(图;6D、补充表4).在拟南芥,MYB28,MYB29,MYB76转录因子是否调节脂肪族GS生物合成,以及MYB34,MYB122,MYB51参与调控吲哚基GS的合成[41].在本研究中,关于脂肪族GS的调节,4MYB28年代,两个MYB29S和1MYB76基因鉴定。在鱼雷期和子叶胚期,表达MYB28-1,MYB28-3,MYB28-4被下调了,为什么MYB28-2与相应的硅土壁相比,在种子中表达上调。的表达MYB76四组都有差异。在鱼雷胚胎阶段的SC vs PC,更少MYB76在种子中检测到转录本。在早期子叶-胚胎阶段MTB76与鱼雷胚期相比,种子中转录本含量显著增加,而硅果壁中转录本含量显著降低MYB76SD与PD的转录本比较。的表达式MYB29子叶-胚期的角锥壁较高,高于相应种子和鱼雷-胚期的角锥壁。在调控吲哚虫GS方面,最大的基因家族为MYB34,由11名成员组成。此外,三个MYB51和三个MYB122鉴定出的基因中,大多数在硅果壁中比在种子中表达更高(图2)。6D)。
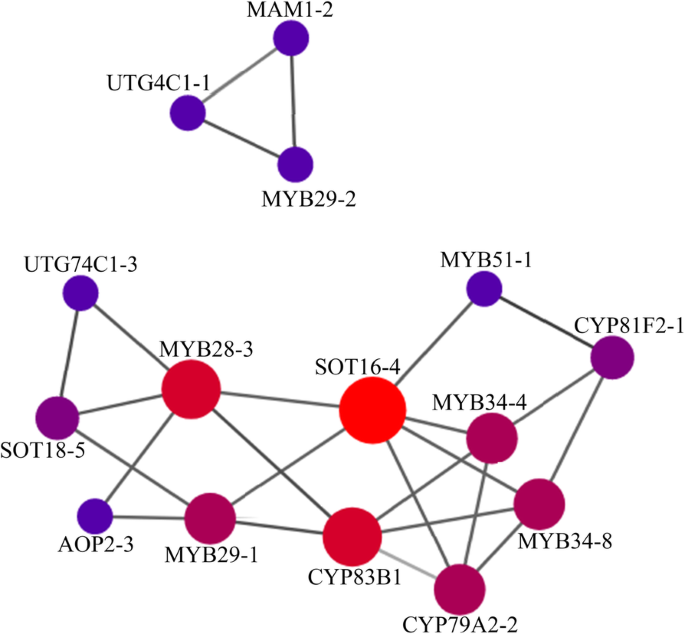
为了探索GS代谢的调控,我们通过蛋白-蛋白相互作用试验检测了GS代谢相关基因可能的相互作用。只有部分转录因子基因成员参与蛋白-蛋白相互作用(图。7,补充表4).在24个鉴定的myb中,MYB28-3、MYB29-1、MYB29-2、MYB34-4、MYB34-8和MYB51-1等6个myb被预测调控合成蛋白。在脂肪族GS的调控中,MYB28-3对AOP2-3和SOT18-5具有密切的亲和力。令人惊讶的是,脂肪族GS相关的MYB28-3与吲哚族GS合成蛋白SOT16-4和CYP83B1相互作用,这也可能受到MYB34的调控,表明吲哚族和脂肪族GS之间可能存在转录因子介导的相互作用。
讨论
为了了解芥蓝种子GS积累的机理,我们首先分析了种子和相应的角锥壁在胚发育过程中GS的积累规律。根据GS含量的差异选择了两个关键的连续阶段(鱼雷-胚胎期和早期子叶-胚胎期),并将GS代谢相关基因映射到基因组中。共鉴定出135个基因,其中24个基因为转录因子,81个基因与生物合成途径相关,25个基因编码分解代谢酶,5个基因与转运蛋白匹配。分析了这些基因在两个选择阶段的表达情况。GS在种子中积累的显著变化发生在从鱼雷胚期到早期子叶胚期的过渡阶段。基因分析证实,在从鱼雷到早期子叶胚阶段的过渡过程中,GSs从硅果壁向种子的运输。此外,侧链修饰相关基因的高表达FMOGS而且AOP2说明种子中可能存在硫代葡萄糖苷的改性。
芥蓝种子GS的积累
在拟南芥,硅质壁被认为是种子中GS的主要来源[42].在芥蓝中,角果壁上的GS对种子GS的积累也起重要作用。虽然在种子中积累的GS量比在硅石壁上多(图2)。2),多数GS生物合成基因在种子中的表达量低于相应的角锥壁(图2)。6A).这种基因表达与GS积累之间的差异可能是由于大量的GTR角锥壁的基因表达量与种子的基因表达量比较。已证实,GTRs负责将GS从硅石壁运输到种子[32].在本研究中,随着胚胎的发育,表达水平GTRs增强,表明从丝状体向种子转运GS的量增加。
GS的运移和合成是GS积累的重要来源。以往的研究研究了种子中GS含量的影响因素,特别是种子是否能够合成GS [31,43].支持种子中缺乏GS合成的发现有i)母系控制种子GS含量,因为F1后代在互交中总是表现出与母本相似的GS谱[44].ii)在硅微阵列中表达关键GS链延长基因MAM1和核心结构基因CYP79F1含量过低,不会影响GS在种子中的积累[31].最近,转运蛋白基因突变GTR在拟南芥中证实种子中没有GS生物合成gtr双突变体种子无GS积累[32].
在本研究中,几乎所有GS生物合成基因的同源基因都在芥蓝种子和角果壁中被鉴定出来。CYP79F1而且MAM1是这两种基因中的两种,而且在鱼雷胚和子叶胚阶段,它们在硅果壁中的转录水平都比在种子中高得多。此外,GS相关基因侧链修饰的高表达在鱼雷胚期的种子中尤为明显弗兰克-蒙塔吉尼而且AOP2基因。在硫代葡萄糖苷的生物合成中,本研究的芥蓝‘黄花’的特征是生成烯基化GS、GNA,这取决于侧链修饰相关基因的适当表达AOP2.以GNA为植物主要GS,属拟南芥Cvi生态型。然而,以Cvi作为GS积累材料的研究有限,主要使用的是Col-0,由于在中损失5bp,不能生成烯基GSAOP2基因(45,46,47].与拟南芥不同生态型的GS变化相似,芸苔属蔬菜也积累了不同种类的硫代葡萄糖苷,这取决于硫代葡萄糖苷的不同表达AOP2.的三个等位基因AOP2在b . oleracea,其中两个由于过早生成停止密码子而没有功能[48].羽衣甘蓝(b . oleraceavar。冬青),的表达BoAOP2可催化甲基亚砜丁基GS (glucoraphanin, GRA)生成烯基GSs [49].在西兰花中(B.甘蓝的外显子有2 bp缺失AOP2基因,导致AOP2功能障碍,西兰花主要积累GRA [50].花椰菜里(b.oleracea var. botrytis)和卷心菜(马齿苋),主要的天然合成物质为二丙烯甘氨酸(2-丙烯基GS)及/或PRO,视乎所使用的品种而定[51].在b·拉伯,三个AOP2同源物与AtAOP2.主要的硫代葡萄糖苷b·拉伯为GNA、芥菜氨基糖苷(4-戊烯基GS)和PRO [52].因此,我们提出了脂肪族GS通过表达的二次修饰AOP2可能与芥蓝种子形成过程中GNA的积累有关。同时,我们也不能排除在硅石壁上或其他来源的GNA数量足以使GNA的种子积累的可能性。AOP2在种子形成过程中GS积累中的作用还需要进一步的实验验证。
芥蓝GS积累的调控
相比之下拟南芥在芥蓝中鉴定出GS代谢相关基因的多个成员(1 ~ 9个)。基因冗余给基因编辑管理GS含量和谱带来困难,这需要精确的基因靶点[53,54].转录组分析揭示了一个家族中所有基因成员的表达,没有表达的基因可以被排除。例如,AOP2对其底物的烯基化至关重要,产物GNA是芥蓝中积累的主要GS。为了调控芥蓝种子中GNA的含量,AOP2具有高表达水平可能是靶标。然而,三个AOP2在芥蓝中检测到基因成员,这使得选择正确的AOP2靶标变得复杂。从目前的分析来看,应优先考虑AOP2-2其他成员在转录水平上没有明显变化。蛋白质-蛋白质相互作用分析也需要检查蛋白质之间可能的关系,这有助于降低由多个基因成员引起的复杂性。例如,脂肪族GS转录因子MYB28由四个成员组成,但只有MYB28-3被预测与SOT18-5和AOP2-3相互作用。
种子形成时伴随GS积累,含量丰富TGG在种子中检测到转录本(图;6B,有趣的是,增强TGG转录本水平在种子从鱼雷胚阶段过渡到早期子叶胚阶段期间出现。在这个过渡时期,表情最为典型TGG成员,TGG1SC降低(相对于PC), SD增加(相对于PD),这表明TGG1可能对GS的积累起重要作用。GS的周转为初级代谢提供了基础物质(如葡萄糖、硫酸盐、硫、氨和羧酸),特别是在萌发期间[10,55].最近,越来越多的非典型TGGs被观察到参与GS降解[30.].不同的生物过程需要不同的降解酶。Meier et al.(2019)通过分析发芽过程中GS含量的变化,揭示了功能性腈指示蛋白(NSP)是GS降解在发芽第4天至第10天期间所必需的规划的突变系[55].在芥蓝种子发育过程中,高水平的表达BGLU29在种子的早期子叶阶段也很明显。在种子发育过程中,黑芥子酶的积累不仅为种子的形成提供了物理保护屏障,而且可能在种子萌发过程中发挥潜在的硫提供者作用。但是,具体的功能TGG仍然难以捉摸。典型和非典型的直接参与TGG不同种子发育阶段对GS降解的影响还有待进一步研究。
结论
在羽衣甘蓝种子发育过程中,鱼雷-胚期和早期子叶-胚期是GS积累的关键时期。分析了这两个阶段GS代谢相关基因的表达,证实了GS在种子从鱼雷胚期和早期子叶胚期的转变过程中从角果壁向种子的转运。此外,AOP2在种子子叶-胚早期的高表达表明种子形成过程中可能发生侧链修饰。
方法
植物材料
芥蓝(oleracea甘蓝v黄花)种子购自高达种子店(中国福州),用于田间试验(福建农林大学)。将种子均匀地撒在直径为15厘米的含湿珍珠岩培养皿中,并置于28°C的腔室中(光照16小时/暗光周期8小时),直到子叶完全展开。然后将幼苗转移到含泥炭土:蛭石:珍珠岩的3:1:1培养基中,置于人工气候箱(MGC-450HP-2,上海艺恒科技有限公司)中,28℃,光照16 h /暗光周期8 h。栽培1个月后,将羽衣甘蓝幼苗种在田间,行距×行距为25 cm × 30 cm,在田间周围设置保护行。田间试验连续3年(201609-201704、201709-201804、201809 - 2011904)进行,每次重复至少24株。土壤经过深耕和耕作,以确保土壤条件和其他田间管理程序对本次试验评估的所有土地都是平等的。田间管理,如每日浇水和施肥,定期进行,直到植物进入繁殖阶段。
在花蕾出现后,标记树枝并记录种子的发育。当花完全展开时,在显微镜下观察种子胚的阶段(Olympus IX73,日本)。胚由球状期发育到子叶期。根据种子胚的发育情况,将种子分为不同的发育阶段。收获种子和相应的硅石壁并进行分类。然后将样品快速冷冻在液氮中,并储存在−80°C的冰箱中,用于以下测量。
种子形成过程中GS含量的测定
GS的测定分析参照Guo et al.(2016)的测试方法,并优化[3.].将200 mg样品加入2 mL煮沸的ddH中2在100°C下O 10 min,收集上清液,重复上述操作。将两次组合的上清液作为粗提液,在纯化柱中加入30mg活化的DEAE-Sephadex。用0.02 mol/L醋酸吡啶ddH清洗2O,然后将1 mL粗提物加入柱中。然后再次用醋酸吡啶和ddH清洗2加入0.1%的硫酸酯酶,浓度为100 μL,浸泡14 h后用水洗脱,得到脱硫GS。GS的分析采用超高相液相色谱(UPLC),使用Water的TUV检测器(Waters, Milford, USA)。采用UPLC BEH C18(粒径为1.7 μm, 2.1 mm × 50 mm, Waters, Milford, USA),以乙腈-水为流动相。分析条件为:流速0.4 mL/min,检测波长226 nm,进样量10 μL。
总RNA提取及文库构建
用Trizol试剂(Invitrogen, Carlsbad, CA, USA)从芥蓝中提取种子和角果壁的RNA,分两个阶段,分别重复3次。使用NanoDrop 1000分光光度计(Thermo Fisher Scientific, Wilmington, DE, USA)测量样品的纯度,使用Qubit®2.0荧光计(Life Technologies, CA, USA)测量RNA样品的浓度。使用RNA测序分析了12个独立的转录组数据库,每个转录组数据库的平均插入长度为200 bp,数据使用基因组样本试剂盒(Illumina, San Diego, CA)合成。使用Agilent 2100试剂盒(Agilent, Palo Alto, CA)在生物分析仪上测量数据库的浓度和大小。高通量测序使用Illumina HiSeq 2500仪器(MGI科技有限公司,中国),读取长度为PE125。
测序数据处理与分析
基于Synthesis测序技术,通过Illumina高通量测序平台(华大基因测序,中国深圳)对合格的数据库进行测序。对原始数据进行过滤,以去除低质量的reads、连接子污染和高水平的未知碱基N含量。本项目使用SOAPnuke进行统计[56]和trimmomatic用于过滤[57].然后使用Bowtie2将干净的reads与参考基因组进行比较(http://plants.ensembl.org/Brassica_oleracea/Info/Index) [58],然后用RSEM计算基因的转录表达量[59].所有序列均与NR、GO、KEGG数据库比对,鉴定其功能[39,60,61,62].
不同时期种子及相应硅果壁差异表达基因的鉴定
样本组间差异表达分析采用DEGseq方法[63],采用FPKM法分析差异基因表达水平,采用Benjamini-Hochberg法校正显著性P值。最后,校正P值,即Q值≤0.001,|log2(折量变化)|≥2作为差异表达基因显著性的筛选标准,Q值≤0.001,|log2(折量变化)|≥4作为差异表达基因极显著性差异的筛选标准。
统计分析
图中PCA3.使用R软件中的princomp函数分析A,使用R软件中的ggplot2包绘制A [64].图中的热图。6使用TBTools [65].钻石(https://github.com/bbuchfink/diamond)将基因与STRING数据库进行比较[66]用于分析图中蛋白质之间的相互作用。7.
数据和材料的可用性
本研究的资料由福建农林大学园艺学院提供。如欲索取资料,请向郭荣芳(guorofa@163.com).
缩写
- AOP:
-
Oxoglutarate-dependent加双氧酶
- BCAT:
-
支链转氨酶
- BGLU:
-
β-Thioglucosidases
- 英国石油公司:
-
生物过程
- 答:
-
蜂窝组件
- DAF):
-
开花后几天
- 度:
-
差异表达基因
- FMOGS:
-
单氧酶
- GGP:
-
γ谷酰基多肽
- 基博:
-
Glucoiberin
- 玲娜:
-
Gluconapin
- 走:
-
基因本体论
- 掌握:
-
Glucoraphanin
- g:
-
芥子油苷
- IPMI:
-
Isopropylmalate异构酶
- IPMDH:
-
Isopropylmalate脱氢酶
- 美国国际贸易委员会:
-
异硫氰酸酯
- KEGG:
-
京都基因和基因组百科全书
- 老妈:
-
甲基硫代烷基苹果酸合成酶
- MF:
-
分子功能
- NRT1 / PTR:
-
硝酸盐转运蛋白1/肽转运蛋白
- 规划:
-
Nitrile-specifier蛋白质
- PC:
-
鱼雷胚期的硅质壁
- 主成分分析:
-
主成分分析
- PEN2:
-
渗透2
- SC:
-
鱼雷胚阶段的种子
- SD:
-
早期子叶-胚阶段的种子
- 帕金森病:
-
早期子叶-胚阶段的角果壁
- TGG:
-
Thioglucoside glucohydrolase
- UPLC:
-
超高相液相色谱法
参考文献
- 1.
雷军,陈刚,陈超,曹斌。中国芥蓝种质多样性研究。园艺学报,2017;3(3):101-4。https://doi.org/10.1016/j.hpj.2017.07.006.
- 2.
郭睿,邓勇,黄志,陈霞,徐汉霞,赖哲。影响白花芸苔幼苗建立的mirna鉴定。前沿植物科学,2016;7:1760。
- 3.
郭锐,黄志,邓勇,陈霞,徐汉霞,赖哲。通过比较转录组分析,揭示了白花芸苔芽硫代葡萄糖苷的特殊代谢机制。前沿植物科学,2016;7:1497。
- 4.
陈,陈Z,李Z,赵Y,陈X, Wang-Pruski G, et al。白光和红蓝复合光下光周期对芥蓝芽的影响。前沿植物学报2021;11:589746。https://doi.org/10.3389/fpls.2020.589746.
- 5.
郭锐,沈伟,钱红,张敏,刘玲,王强。茉莉酸和葡萄糖协同调控拟南芥硫代葡萄糖苷积累。中国机械工程学报,2013;26(4):567 - 567。https://doi.org/10.1093/jxb/ert348.
- 6.
杨晓明,李志刚,李志刚,等。拟南芥硫代葡萄糖苷分解的机理、调控及生物学意义。拟南芥植物学报。2010;8:e0134。
- 7.
吴霞,黄红,蔡宏杰,吴勇,于磊,Pehrsson PR.芸苔属蔬菜中硫代葡萄糖苷的分布、含量及摄入的影响因素。中国食品科学,2017;12(1):485-511。https://doi.org/10.1146/annurev-food-070620-025744.
- 8.
Pfalz M, Mikkelsen MD, Bednarek P, Olsen CE, Halkier BA, Kroymann J.拟南芥吲哚硫代葡萄糖苷的代谢工程研究植物学报。2011;23(2):716-29。https://doi.org/10.1105/tpc.110.081711.
- 9.
田俊,奉世杰,Park JS, Park Y-K, Arasu MV, al - dhabi NA,等。豆瓣菜从头转录组分析及硫代葡萄糖苷分析。BMC基因组学杂志,2017;18(1):401。
- 10.
基森R,罗西特JT,博恩斯AM。“芥末油炸弹”:不容易组装?!黑芥子酶酶系组分的定位、表达和分布。植物化学,2009;8(1):69-86。https://doi.org/10.1007/s11101-008-9109-1.
- 11.
Bhat R, Vyas D.黑芥子酶:结构、催化、调节和环境相互作用的见解。生物技术,2019;39(4):508-23。https://doi.org/10.1080/07388551.2019.1576024.
- 12.
植物毒素及其在防御食草动物和病原体中的作用。植物学报。2002;5(4):300-7。https://doi.org/10.1016/s1369 - 5266 (02) 00264 - 9.
- 13.
胡晓东,王晓东,王晓东,王晓东,Doubský J,王晓东,等。活植物细胞中的硫代葡萄糖苷代谢途径介导广谱抗真菌防御。科学。2009;323(5910):101 - 6。https://doi.org/10.1126/science.1163732.
- 14.
杨晓明,李志刚,李志刚,等。基于硫代葡萄糖苷代谢工程基因的拟南芥对夜蛾抗性的研究。植物化学学报,2012;https://doi.org/10.1016/j.plaphy.2011.07.014.
- 15.
郭睿,王旭,韩旭,李伟,刘涛,陈波,等。比较转录组分析显示,高gs值和低gs值的白花芸苔芽具有不同的热胁迫反应。BMC基因组学。2019;20(1):269。https://doi.org/10.1186/s12864-019-5652-y.
- 16.
Brown PD, Tokuhisa JG, Reichelt M, Gershenzon J.拟南芥不同器官和发育阶段硫甙积累的变化。植物化学,2003;62(3):471 - 81。https://doi.org/10.1016/s0031 - 9422 (02) 00549 - 6.
- 17.
硫代葡萄糖苷代谢及其控制。植物科学进展,2006;11(2):89-100。https://doi.org/10.1016/j.tplants.2005.12.006.
- 18.
Mitreiter S, Gigolashvili T.硫代葡萄糖苷生物合成的调控。中国科学(d辑:自然科学),2011;
- 19.
Sønderby IE, Geu-Flores F, Halkier BA。葡萄糖苷的生物合成-基因发现及其他。植物科学进展,2010;15(5):283-90。https://doi.org/10.1016/j.tplants.2010.02.005.
- 20.
Textor S, De Kraker J- w, Hause B, Gershenzon J, Tokuhisa JG。MAM3催化拟南芥中所有脂肪族硫代葡萄糖苷链长度的形成。植物科学进展。2007;44(1):60-71。https://doi.org/10.1104/pp.106.091579.
- 21.
Burow M, Atwell S, Francisco M, Kerwin RE, Halkier BA, Kliebenstein DJ。硫代葡萄糖苷生物合成基因AOP2介导拟南芥茉莉酸信号的反馈调控。植物学报。2015;8(8):1201-12。https://doi.org/10.1016/j.molp.2015.03.001.
- 22.
胡斯比,柯普瑞沃娃,李B-R, Saha S, Mithen R, Wold A- b,等。拟南芥硫同化和硫代葡萄糖苷生物合成的日和光调节。中国机械工程学报,2013;32(4):439 - 448。https://doi.org/10.1093/jxb/ers378.
- 23.
王玲,刘东,Ahmed T,钟凤林,Conaway C,焦建伟。靶向细胞周期机制是萝卜硫素预防前列腺癌的分子机制。中华医学杂志,2004;24(1):187-92。
- 24.
威特斯托克U,哈尔基尔BA。拟南芥时代硫代葡萄糖苷的研究。植物科学进展,2002;7(6):263-70。https://doi.org/10.1016/s1360 - 1385 (02) 02273 - 2.
- 25.
Chadchawan S, Bishop J, Thangstad OP, Bones AM, Mitchell-Olds T, Bradley D.拟南芥黑芥子酶编码cDNA序列。植物学报。1993;103(2):671-2。https://doi.org/10.1104/pp.103.2.671.
- 26.
薛娟,李志刚,李志刚,李志刚。十字花科植物中芥子糖苷降解酶黑芥子酶的基因编码。植物分子生物学。1992;18(2):387-98。https://doi.org/10.1007/BF00034965.
- 27.
Vassão陈志勇,刘志强,刘志强,等。植物防御β-葡萄糖苷酶在鳞翅目食草动物的肠道中抵抗消化和维持活性。中国植物科学,2018;9:1389。
- 28.
Nitz I, Berkefeld H, Puzio PS, Grundler FM。Pyk10,来自拟南芥的幼苗和根特异性基因和启动子。中国植物科学,2001;26(2):339 - 344。https://doi.org/10.1016/s0168 - 9452 (01) 00412 - 5.
- 29.
中野RT, pimedveska - bednarek M,山田K, Edger PP,宫原M,近藤M,等。PYK10黑芥子酶揭示了拟南芥内质网体与硫代葡萄糖苷之间的功能协调。植物学报,2017;29(2):344 - 344。https://doi.org/10.1111/tpj.13377.
- 30.
中崎A,山田K,国田T,杉山R,平井MY,田村K,等。拟南芥莲座丛叶片内质网体参与了对食草性的防御。中国生物医学工程学报,2019;29(4):344 - 344。https://doi.org/10.1104/pp.18.00984.
- 31.
努尔-埃尔丁HH,哈尔基尔BA。拼凑脂肪族硫代葡萄糖苷的运输途径。植物化学,2009;8(1):53-67。https://doi.org/10.1007/s11101-008-9110-8.
- 32.
nouri - eldin HH, Andersen TG, Burow M, Madsen SR, Jørgensen ME, Olsen CE,等。NRT/PTR转运体对于硫代葡萄糖苷防御化合物向种子转运至关重要。大自然。2012;488(7412):531 - 4。https://doi.org/10.1038/nature11285.
- 33.
nouri - eldin HH, Madsen SR, Engelen S, Jørgensen ME, Olsen CE, Andersen JS,等。转运蛋白编码基因突变对芸苔属油籽中抗营养硫代葡萄糖苷含量的影响。中国生物工程学报,2017;35(4):377-82。https://doi.org/10.1038/nbt.3823.
- 34.
Jørgensen ME, Olsen CE, Geiger D, Mirza O, Halkier BA, nouri - eldin HH。功能性的EXXEK基序在NPF2的质子偶联和硫代葡萄糖苷转运中至关重要。11.中国生物医学工程学报。2015;36(12):344 - 344。https://doi.org/10.1093/pcp/pcv145.
- 35.
李辉,于敏,杜晓强,王志峰,吴文华,金特罗范杰,等。NRT1。5 / NPF7。3在拟南芥中作为一个质子耦合的H+/K+反转运体,将K+装载到木质部。植物细胞,2017;29(8):2016-26。https://doi.org/10.1105/tpc.16.00972.
- 36.
杨勇,胡勇,岳勇,蒲勇,殷霞,段勇,等。萝卜硫甙生物合成基因在不同发育阶段的表达谱及转化含黄素单加氧酶基因对毛状根硫甙含量的影响中国食品农业科学,2020;100(3):1064-71。https://doi.org/10.1002/jsfa.10111.
- 37.
斯特里克勒,邦马利,米勒,洛杉矶。设计一个非模式植物物种的转录组下一代测序项目1。中国机械工程学报,2012;39(2):357 - 357。https://doi.org/10.3732/ajb.1100292.
- 38.
梅尔道,埃尔布M,鲍德温IT。按需防御:最佳防御模式背后的机制。学报学报。2012;110(8):1503-14。https://doi.org/10.1093/aob/mcs212.
- 39.
金久M,荒木M,后藤S,服部M,平川M,伊藤M,等。将基因组与生命和环境联系起来。Nucleic Acids res 2007;36(suppl_1): D480-4。
- 40.
Kanehisa M, Furumichi M, Tanabe M, Sato Y, Morishima K. KEGG:基因组,通路,疾病和药物的新视角。核酸研究,2016;45(D1): D353-61。https://doi.org/10.1093/nar/gkw1092.
- 41.
吉格拉斯维利T,亚图塞维奇R,伯杰B, Müller C, Flügge UI。R2R3-MYB转录因子HAG1/MYB28是拟南芥中蛋氨酸衍生硫代葡萄糖苷生物合成的调节因子。植物学报,2007;26(2):344 - 344。https://doi.org/10.1111/j.1365-313X.2007.03133.x.
- 42.
Petersen B, Chen S, Hansen C, Olsen C, Halkier B.拟南芥发育过程中硫代葡萄糖苷的组成和含量。足底。2002;214(4):562 - 71。https://doi.org/10.1007/s004250100659.
- 43.
burrow M, Halkier BA。植物是如何在时间和空间上进行防御的呢?以拟南芥中的硫代葡萄糖苷为例研究。植物学报。2017;38:142-7。https://doi.org/10.1016/j.pbi.2017.04.009.
- 44.
甘蓝型油菜(Brassica napus)种子和幼苗中脂肪族硫代葡萄糖苷表达的母本效应。植物育种。1993;111(3):249-52。https://doi.org/10.1111/j.1439-0523.1993.tb00637.x.
- 45.
Kliebenstein DJ, Lambrix VM, Reichelt M, Gershenzon J, Mitchell-Olds T.拟南芥次生代谢多样化中的基因重复:2-氧谷氨酸依赖的双加氧酶控制硫代葡萄糖苷生物合成。植物学报。2001;13(3):681-93。https://doi.org/10.1105/tpc.13.3.681.
- 46.
杨晓东,李志强,李志强,李志强,等。拟南芥硫代葡萄糖苷的生物合成研究。植物科学进展。2004;35(2):344 - 344。https://doi.org/10.1104/pp.104.039347.
- 47.
Abrahams RS, Pires JC, Schranz ME。硫代葡萄糖苷MAM基因座的起源和多样性。植物科学进展2020;11:711。https://doi.org/10.3389/fpls.2020.00711.
- 48.
刘山,刘勇,杨旭,佟c, Edwards D, Parkin IAP,等。甘蓝基因组揭示了多倍体基因组的不对称进化。自然科学进展。2014;5(1):3930。https://doi.org/10.1038/ncomms4930.
- 49.
李永生,顾克明,贝克尔TM,朱维克JA。化学预防硫代葡萄糖苷在各种西兰花和羽衣甘蓝组织中的积累:基于微流体的副产物定值靶向转录组学。PLoS One. 2017;12(9):e0185112。https://doi.org/10.1371/journal.pone.0185112.
- 50.
李国强,李国强。植物侧链硫甙在拟南芥中修饰的研究。应用理论与实践。2003;36(6):366 - 366。https://doi.org/10.1007/s00122-002-1161-4.
- 51.
李智,郑松,刘勇,方智,杨林,庄敏,等。用uhplc -三tof - ms方法鉴定80种西兰花基因型和不同器官的硫代葡萄糖苷。食品化学。2021;334:127519。https://doi.org/10.1016/j.foodchem.2020.127519.
- 52.
金金俊,朱明生,金世杰,李东哲,李世善,林帅,等。油菜蔬菜作物中硫代葡萄糖苷的变异。学报。中国食品科学。2010;26(1):423-8。https://doi.org/10.1016/j.foodchem.2009.08.051.
- 53.
柯龙,李文杰,李文杰。通过多倍体复制的基因对转录组和器官特异性相互沉默的贡献不平等。自然科学进展,2003;21(3):344 - 344。https://doi.org/10.1073/pnas.0630618100.
- 54.
张勇,马扎恩,祁勇,张勇。CRISPR技术在植物科学中的应用前景。植物学报。2019;5(8):778-94。https://doi.org/10.1038/s41477-019-0461-5.
- 55.
Meier K, Ehbrecht MD, Wittstock U.休眠和发芽拟南芥种子硫甙含量受经典黑芥子酶和腈指示蛋白基因非功能等位基因的影响。中国植物科学,2019;10:1549。https://doi.org/10.3389/fpls.2019.01549.
- 56.
陈勇,陈勇,石超,黄忠,张勇,李松,等。SOAPnuke:一个支持MapReduce加速的软件,用于高通量测序数据的集成质量控制和预处理。Gigascience。2018;7 (1):gix120。
- 57.
Bolger AM, Lohse M, Usadel B. Trimmomatic:一种用于Illumina序列数据的灵活修剪器。生物信息学。2014;30(15):2114 - 20。https://doi.org/10.1093/bioinformatics/btu170.
- 58.
朗米德B,萨尔茨堡SL.快速间隙阅读对齐领结2。光子学报。2012;9(4):357-9。https://doi.org/10.1038/nmeth.1923.
- 59.
李B,杜威CN。RSEM:从RNA-Seq数据中精确的转录物定量,有或没有参考基因组。生物信息学杂志。2011;12(1):323。https://doi.org/10.1186/1471-2105-12-323.
- 60.
张军,张震,张志强,等。gapping BLAST和PSI-BLAST:新一代蛋白质数据库搜索程序。中国生物医学工程学报,1997;25(17):3389-402。https://doi.org/10.1093/nar/25.17.3389.
- 61.
Ashburner M, Ball CA, Blake JA, Botstein D, Butler H, Cherry JM,等。基因本体论:生物学统一的工具。中国科学,2000;25(1):25 - 9。https://doi.org/10.1038/75556.
- 62.
Kanehisa M, Goto S, Kawashima S, Okuno Y, Hattori M.基因组破译的KEGG资源。Nucleic Acids res 2004;32(suppl_1): D277-80。
- 63.
王磊,冯志,王旭,王霞,张旭。一种从RNA-seq数据中识别差异表达基因的R包。生物信息学,2010,26(1):136 - 8。https://doi.org/10.1093/bioinformatics/btp612.
- 64.
Wickham H: ggplot2:用于数据分析的优雅图形:施普林格;2016.
- 65.
陈超,陈宏,张勇,Thomas HR, Frank MH,何勇,等。tbtools -为大生物数据的交互式分析而开发的综合工具包。bioRxiv。2020:289660。
- 66.
Cv M, Huynen M, Jaeggi D, Schmidt S, Bork P, Snel B. STRING:预测蛋白质之间功能关联的数据库。核酸研究,2003;31(1):258-61。
确认
不适用。
资金
本工作得到国家自然科学基金(No. 31772310和31401859)的数据研究和收集支持,国家专项资助(No. 2017 T100464)和园艺博士后资助(No. 132300155)的数据分析支持,福建农林大学科技创新基金(CXZX2018076)的发表支持。
作者信息
从属关系
贡献
RG、ZL和XC设计了研究;RG, YZ, ZC, WT, BC进行研究并撰写论文;RG, YZ, JC, ZC分析数据。所有作者均已阅读并批准稿件出版。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
合著者赖忠雄教授,BMC植物生物学副主编。所有的作者都宣称他们没有竞争利益。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:补充图1。
差异表达基因(DEGs)的GO分类。X轴表示GO术语注释的基因数量,Y轴表示GO的分类。
附加文件2补充图2。
DEGs的KEGG分类。X轴为归属于KEGG途径类别的基因数量,Y轴为KEGG途径类别。
附加文件3:补充表1。
不同时期种子和相应的角角石壁中硫代葡萄糖苷谱及其含量。
附加文件4:补充表2。
芥蓝GS生物合成和降解相关基因。log2 (B/A)的值反映了B与A基因表达水平的比较,大于0表示处理组基因表达水平上调,小于0表示下调。A代表对照组,B代表治疗组。当log2(B/A) >为2时,表示调控显著。
附加文件5:补充表3。
芥蓝GS转运蛋白相关基因log2 (B/A)的值反映了B与A基因表达水平的比较,大于0表示处理组基因表达水平上调,小于0表示下调。A代表对照组,B代表治疗组。当log2(B/A) >为2时,表示调控显著。
附加文件6:补充表4。
MYB转录因子与芥蓝GS生物合成相关基因的研究log2 (B/A)的值反映了B与A基因表达水平的比较,大于0表示处理组基因表达水平上调,小于0表示下调。A代表对照组,B代表治疗组。当log2(B/A) >为2时,表示调控显著。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
赵,Y,, Z,陈,J。et al。芥蓝种子形成过程中硫代葡萄糖苷代谢基因的转录组比较分析。BMC植物生物学21,394(2021)。https://doi.org/10.1186/s12870-021-03168-2
收到了:
接受:
发表:
关键字
- 硫配糖体
- 种子
- 中国的羽衣甘蓝
- AOP2
- beta-glucosidases
- GTR