- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
套袋后无花果雌花组织风味成分和类黄酮生物合成的代谢组和转录组分析gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba21gydF4y2Ba,文章号:gydF4y2Ba396gydF4y2Ba(gydF4y2Ba2021gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
套袋可以改善水果的外观,提高食品的安全性和商品性,同时对水果的内在品质也有影响,这是普遍报道的负面变化。无花果基因组相对较小,果实季节较长,可以看作是一种新的模式水果。gydF4y2Ba
结果gydF4y2Ba
本研究对“紫宝”无花果套袋前后果实组织进行了基于HPLC - MS/MS和RNA-seq的广泛靶向代谢组学分析,揭示了无花果可食部分代谢产物的变化及底层基因表达网络的变化。利用无花果雌花组织进行代谢组分析,共鉴定出771种代谢物。其中88种代谢物(包括一种碳水化合物、八种有机酸、七种氨基酸和两种维生素)在套袋前后的果实组织中表现出显著差异。通过转录组分析套袋后黄酮类生物合成途径中16个结构基因、13个MYB转录因子以及内源激素(ABA、IAA和GA)代谢和信号转导相关基因的变化。KEGG富集分析也发现套袋前后雌花组织中黄酮类化合物生物合成途径存在显著差异。gydF4y2Ba
结论gydF4y2Ba
本研究为无花果雌花组织代谢产物的组成和丰度提供了全面的信息。结果表明,套袋前后果实风味成分的差异可以通过碳水化合物、有机酸、氨基酸和酚类化合物组成和丰度的变化来解释。本研究为套袋对果实内在品质和外观品质变化的影响提供了新的见解。gydF4y2Ba
背景gydF4y2Ba
无花果(Ficus carica L.)属于桑科榕属,是世界上最古老的栽培果树。它起源于西亚地区,数千年前通过丝绸之路传入中国。无花果果实含有多种健康有益的生物活性成分,除了提供糖和能量外,无花果果实还含有丰富的膳食纤维,被认为是矿物质的良好来源[gydF4y2Ba1gydF4y2Ba],固醇[gydF4y2Ba2gydF4y2Ba]、类胡萝卜素[gydF4y2Ba3.gydF4y2Ba],花青素[gydF4y2Ba4gydF4y2Ba],以及多酚[gydF4y2Ba5gydF4y2Ba].无花果果实的发育呈典型的双s型曲线,中间有两个快速生长期(I、III期)和一个缓慢生长期(II期)[gydF4y2Ba6gydF4y2Ba].无花果是一种雌花雌雄同体植物,果实颜色多样,可食用部分由花序的雌花发育而来,雌花被花托覆盖,在植物学上,它是一种假果实,称为“隐头果”。无花果果皮和雌花组织的显色表现出明显的时空和表达差异,雌花组织的显色开始得很早,而果皮中花青素的积累明显较晚。花青素在果皮中的积累速度比雌花组织快,浓度通常显著高于雌花组织。水果颜色是评价水果鲜食品质和商品价值的重要指标,因为鲜艳诱人的外观是影响种植者和消费者选择的最重要因素之一[gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba].gydF4y2Ba
花青素是一种水溶性类黄酮,是植物重要的次生代谢产物,具有抵抗紫外线伤害、病虫害、吸引昆虫授粉等生理功能[gydF4y2Ba9gydF4y2Ba].它们还具有很强的自由基清除作用,并具有许多生物活性,如心血管保护[gydF4y2Ba10gydF4y2Ba]和抗肿瘤特性[gydF4y2Ba11gydF4y2Ba].花青素是根据酚羟基和甲基的位置来分类的,自然界中至少有13种花青素,常见的有6种,分别是petunidin、peonidin、cyanidin、delphinidin、pelargonidin、malvidin。目前,这六类花青素及其衍生物约占自然界花青素总量的95%。花青素的生物合成途径已在园艺植物如苹果、葡萄和番茄中得到详细研究[gydF4y2Ba12gydF4y2Ba].这些研究确定了类黄酮生物合成途径中重要的上游结构基因,如查尔酮合成酶(CHS)和查尔酮异构酶(CHI),以及下游结构基因,如二氢黄酮醇还原酶(DFR)、花青素合成酶(ANS)和类黄酮3- o -糖基转移酶(UFGT)。花青素合成结构基因的表达受多种转录因子的调控。根据tf中包含的保守结构域,大致可分为MYB、bHLH、WD40、MADS-box、bZIP等家族[gydF4y2Ba13gydF4y2Ba],其中研究最多的是MYB家族。MYB是最具特征的tf家族之一,广泛分布于所有真核生物,包括动物、植物和真菌。MYB蛋白根据MYB重复序列的数量可分为4种类型:1 R-MYB、R2R3-MYB、R1R2R3-MYB和4 R-MYB [gydF4y2Ba14gydF4y2Ba].MYB TF家族中调控花青素生物合成的研究主要集中在R2R3-MYB TF上,R2R3-MYB TF调控果树花青素的研究起步较晚。2006年,Espley等人发现了光诱导花青素合成基因gydF4y2BaMdMYB1gydF4y2Ba在苹果中,其次是两种调节果肉中花青素生物合成的基因,gydF4y2BaMdMYB10gydF4y2Ba[gydF4y2Ba15gydF4y2Ba),gydF4y2BaMdMYB110agydF4y2Ba[gydF4y2Ba16gydF4y2Ba].随着关键tf的分离和功能验证,gydF4y2BaMdMYB1gydF4y2Ba而且gydF4y2BaMdMYB10gydF4y2Ba,苹果花青素的同源基因先后在草莓等植物中分离到。gydF4y2Ba17gydF4y2Ba],桃子[gydF4y2Ba18gydF4y2Ba],梨[gydF4y2Ba19gydF4y2Ba],甜樱桃[gydF4y2Ba20.gydF4y2Ba]、石榴[gydF4y2Ba21gydF4y2Ba].R2R3-MYB的调控可分为激活和抑制,例如,gydF4y2BaFaMYB1gydF4y2Ba在草莓中[gydF4y2Ba22gydF4y2Ba),gydF4y2BaAtMYBL2gydF4y2Ba在gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba23gydF4y2Ba),而gydF4y2BaVvMYBCgydF4y2Ba在葡萄中[gydF4y2Ba24gydF4y2Ba],抑制花青素的合成。gydF4y2Ba
套袋是果树栽培和管理中常用的方法,广泛应用于苹果、梨、葡萄等果树。水果套袋可以在一定程度上改善水果的外观和内在品质,减少农药残留,提高水果的食品安全性和商品化。当果皮与果肉着色的光敏感性存在差异时,套袋可以改变外界环境因素,特别是光信号对花青素合成的影响。套袋对果实的内在品质也有影响,这是普遍报道的负面变化。无花果基因组相对较小,果实季节较长,可以看作是一种新的模式水果。作为非光敏部位,无花果雌花组织花青素合成调控基因和风味成分的出现可能有另一种调控机制。gydF4y2Ba拟南芥gydF4y2Ba与基因突变gydF4y2Bacop1gydF4y2Ba能在黑暗条件下维持花青素合成,PAP1和PAP2激活结构基因PALs、CHS、CHI、F3H、f3’h、ANS和DFR,促进花青素生物合成[gydF4y2Ba25gydF4y2Ba].套袋对非光敏果实花青素积累影响不大,但对风味成分和口感的形成影响显著。装袋后的水果外观明显改善,但水果的口感和风味是影响顾客选择的另一个重要因素。水果的气味(由挥发性化合物如酚和醇引起)和味道(由糖、有机酸和氨基酸的比例和浓度决定)有助于水果风味的形成[gydF4y2Ba26gydF4y2Ba].以往的研究主要集中在套袋后果实的颜色、可溶性固形物、总糖和总酸成分的鉴定[gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba],但对套袋后果实内部转录和代谢物网络的变化研究较少。gydF4y2Ba
本研究以果皮和果肉均为彩色的无花果品种“紫宝”为研究材料。为了更好地了解套袋处理对果实颜色品质和风味成分的影响,利用转录组和广泛靶向代谢组联合对套袋果实进行分析。通过代谢组鉴定无花果果实套袋前后雌花组织中碳水化合物、有机酸、氨基酸等相关次生代谢产物的变化,通过转录组分析花青素合成途径中相关MYB tf、结构基因和内源激素(ABA、IAA、GA)代谢及信号转导相关基因的差异变化。本研究探讨套袋对无花果果实颜色品质和风味成分形成的分子机制的影响,为深入分析无花果果实着色的基因调控机制提供理论依据,为生产高品质无花果果实提供参考。gydF4y2Ba
结果gydF4y2Ba
广泛靶向代谢组和差异代谢产物KEGG分类分析gydF4y2Ba
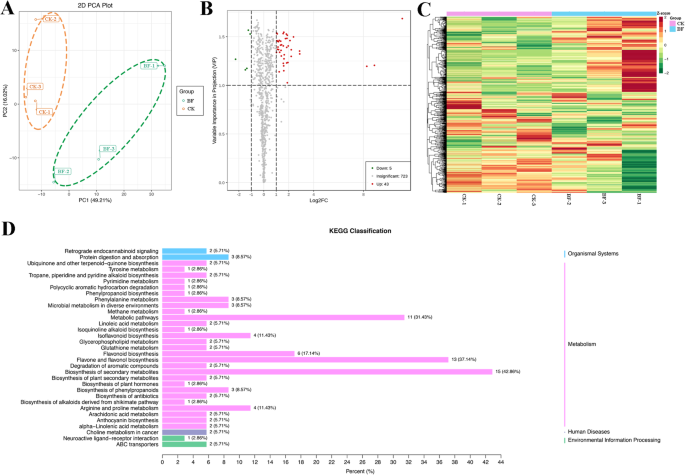
在脉冲光照射下,成熟无花果果皮的着色必须被照射以促进花青素的积累[gydF4y2Ba29gydF4y2Ba].随后的实验表明,在套袋条件下,果皮的颜色受到光信号的调节,花青素的积累几乎完全停止。而对于红色品种,光信号不影响无花果雌花组织的着色,套袋条件下雌花花青素的发育几乎不受影响,成熟期雌花花青素含量与对照组基本相同;成熟期雌花组织保持鲜红色(图2)。gydF4y2Ba1gydF4y2Ba).虽然雌花组织的颜色没有明显差异,但风味和口感仍略有不同。为了探究套袋对水果风味成分的影响,采用广泛靶向的代谢组对套袋前后样品的次生代谢产物进行分析。共检出16类771种化合物(表gydF4y2BaS2gydF4y2Ba).主成分分析(PCA)对771种代谢物进行分析,其中PC1为49.21%,PC2为16.02%。PCA分离两组雌花样品,显著性为0.01(图;gydF4y2Ba2gydF4y2BaA).当Log2FC≥2、≤0.5,VIP≥1时,鉴定出43个上调代谢产物和5个下调代谢产物(图2)。gydF4y2Ba2gydF4y2BaB).使用代谢物浓度数据对样本的分层热图进行聚类分析,观察到所有的生物重复都被分组在一起(图的顶部),这表明所得到的代谢组数据具有很高的可靠性(图。gydF4y2Ba2gydF4y2BaC).有趣的是,观察到未装袋的水果样品(CK)和装袋的水果样品(BF)之间有明显的区别,这表明两个样品的代谢物特征有明显的差异。代谢物(图左)也分为两大类,套袋前后红雌花组织样品的积累水平相反。共有771种代谢物被映射到KEGG数据库中,结果表明大多数代谢物与“代谢”有关。一些代谢产物被归类为“生物系统”或“人类疾病”,这表明无花果雌花组织中的某些代谢产物可能具有潜在的健康作用。KEGG富集分析显示,主要有35个组,其中套袋前后雌花组织代谢产物“植物次生代谢产物生物合成”、“黄酮及黄酮醇生物合成”和“代谢途径”3个组差异显著(gydF4y2BapgydF4y2Ba< 0.05)(图gydF4y2Ba2gydF4y2BaD)。gydF4y2Ba
苯丙素,黄酮,黄酮醇,黄酮和花青素gydF4y2Ba
黄酮代谢产物分析共检测到234种物质,其中32种达到显著差异水平。为了进一步挖掘差异代谢物,对数据进行PLS-DA分析(图。gydF4y2BaS1gydF4y2Ba).PLS-DA评分图组间分离明显,组内聚类明显,进一步说明两组间差异显著。双主成分模型的质量参数分别为:R2X = 0.643, R2Y R2X = 0.995, Q2R2X = 0.739,说明当前模型具有更好的数据解释和预测能力。使用VIP≥1.0、|日志gydF4y2Ba2gydF4y2Ba以FC |≥1为显著差异的阈值,从“CK与BF”样品中鉴定出32种类黄酮代谢产物具有显著差异,包括12种黄酮,9种苯丙类黄酮,5种黄酮醇,3种花青素和1种黄酮(表gydF4y2Ba1gydF4y2Ba).在套袋果实雌花组织中,花青素o -乙酰基己苷和花青素3- o -丙二酰己苷含量分别是CK的1.13倍和1.06倍,这也解释了套袋果实颜色较CK略深的原因。苯丙素生物合成途径位于花青素和类黄酮生物合成途径的上游。鉴定出9种苯丙类次生代谢产物,其中6种表达增加,3种表达减少。CK与BF相比,雌花组织中咖啡酸苯乙酯、当angelin和对香豆酸甲酯含量分别提高了8.26倍、2.87倍和2.20倍,3,4,5-三甲氧基肉桂酸、ioacteoside和3,4-二氢香豆素含量分别降低了2.26倍、1.48倍和1.09倍。在雌花组织中检测到12种黄酮类化合物,其中11种增加。差异最大的是三组:芹菜素、牛皮素和柑橘素。其中木犀草素上游底物芹菜素在高炉中显著提高11.11倍。gydF4y2Ba
碳水化合物,氨基酸,有机酸和维生素gydF4y2Ba
风味和营养成分主要由碳水化合物、有机酸和氨基酸组成。以VIP≥1,折叠变化≥1.6且≤0.6为显著差异阈值,从“CK vs BF”样品中共鉴定出19种累积显著差异的风味相关代谢产物,包括1种碳水化合物、7种氨基酸及其衍生物、8种有机酸及其衍生物、3种维生素及其衍生物(表1)gydF4y2Ba2gydF4y2Ba).套袋果实雌花组织中D(−)-Threose较CK增加3.70倍。此外,套袋处理后,无花果雌花组织中碳水化合物的总体积累减少(增加1个,减少6个),其中d -葡萄糖- 6-磷酸和d -果糖- 6-磷酸是影响雌花组织风味成分的重要碳水化合物(表2 - 1)gydF4y2BaS3gydF4y2Ba).套袋前后,从雌花组织中筛选出7种氨基酸及其衍生物物质,其中2种物质增加,5种物质减少。在显著降低的代谢物中,l-天冬氨酸、CYS-GLY、l-同型半胱氨酸、苯乙酰- l-谷氨酰胺、天冬氨酸均达到显著差异水平的5倍以上,说明袋装水果的糖和酸含量较对照少,风味降低。其中木犀草素上游底物芹菜素在高炉中显著提高11.11倍。苯丙素生物合成途径位于花青素和类黄酮生物合成途径的上游。在“CK vs. BF”中,筛选了8种显著不同的有机酸及其衍生物,其中7种增加了,1种减少了。其中,α-羟基异丁酸、(S)-(−)-2-羟基异己酸B含量分别增加4.61倍、3.05倍和2.28倍,磷酸烯醇丙酮酸三钠含量下降1.46倍。gydF4y2Ba
RNA-seq分析gydF4y2Ba
本研究对“紫宝”无花果雌花组织的对照组和处理组共2个样本进行测序,每个样本有3个生物学重复。对照组(CK)为三期末的雌花组织,处理组为套袋后的雌花组织,命名为套袋花(BF)。利用Illumina HiSeq 4000平台对两个样本的cDNA文库进行双端测序,共获得7394,743,914个和9,582,970,682个长度为200 bp的对端原始reads。删除低质量的reads,去除联合序列,CK和BF库分别获得6,747,389,564和9,137,841,606个干净数据。与参考数据库相比,映射率分别为91.37和91.32%gydF4y2BaS4gydF4y2Ba).以FDR < 0.05、| log2FC |≥2进行筛选校正。对比对照组和套袋组果皮与雌花之间的不同基因数量,在‘CK vs. BF’中发现了2389个差异表达基因,其中上调基因的数量略高于下调基因的数量,分别为1208个和1181个(图2)。gydF4y2BaS2gydF4y2BaA).基因本体论(GO,gydF4y2Bahttp://www.geneontology.org/gydF4y2Ba)的标注发现,1154个unigenes被标注为“Biological Process”,674个unigenes被标注为“Cellular Component”,572个unigenes被标注为“Molecular Function”(图2)。gydF4y2BaS2gydF4y2BaB).为了识别无花果雌花激活的生物学通路,选择了KEGG数据库注释序列的规范参考通路。在KEGG途径中,‘CK vs. BF’组的内质网蛋白加工、植物激素信号转导和植物-病原体相互作用途径经校正后显著改变gydF4y2BaPgydF4y2Ba-value≤0.05gydF4y2BaS5gydF4y2Ba,无花果。gydF4y2BaS2gydF4y2BaC)。gydF4y2Ba
类黄酮生物合成途径及转录调控gydF4y2Ba
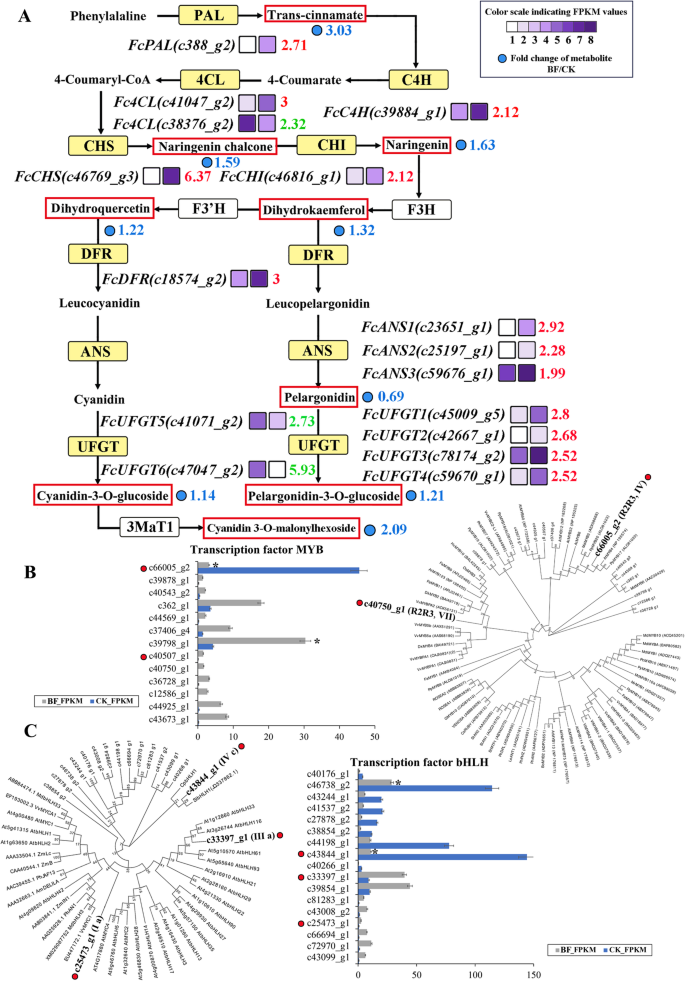
黄酮生物合成途径9个结构基因的表达(gydF4y2Ba朋友gydF4y2Ba,gydF4y2BaC4HgydF4y2Ba,gydF4y2Ba4 clgydF4y2Ba,gydF4y2BaCHSgydF4y2Ba,gydF4y2Ba气gydF4y2Ba,gydF4y2BaF3HgydF4y2Ba,gydF4y2BaF3'HgydF4y2Ba,gydF4y2BaDFRgydF4y2Ba,gydF4y2Ba答gydF4y2Ba,gydF4y2BaUFGTgydF4y2Ba)在花青素生物合成中起关键作用。为了更好地了解无花果果皮与雌花颜色的时空差异,选取了无花果“紫宝”雌花组织中差异表达的16个重要结构基因。其中,PAL,gydF4y2BaFcPALgydF4y2Ba(c388_g2),套袋后显著增加2.71倍,C4H,gydF4y2BaFcC4HgydF4y2Ba(c39884_g1),套袋后显著增加2.12倍;gydF4y2BaFcCHSgydF4y2Ba(c46769_g3)在套袋后雌花组织中显著上调6.37倍。gydF4y2BaFcCHIgydF4y2Ba(c46816_g1)在雌花组织中下调2.12倍。套袋后雌花组织中F3H和F3'H表达无明显变化。在“CK vs. BF”中,gydF4y2BaFcDFRgydF4y2Ba(c18574_g2)显著上调3倍。三个gydF4y2Ba答gydF4y2Ba在“CK vs. BF”中选择基因,gydF4y2BaFcANS1gydF4y2Ba,gydF4y2BaFcANS2gydF4y2Ba,gydF4y2BaFcANS3gydF4y2Ba均呈上调趋势,分别为2.92倍、2.28倍、1.99倍。有六个gydF4y2BaUFGTgydF4y2Ba基因,四个(gydF4y2BaFcUFGT1, FcUFGT2, FcUFGT3gydF4y2Ba,gydF4y2BaFcUFGT4gydF4y2Ba)在‘CK vs. BF’中分别显著上调2.8倍、2.68倍、2.52倍和2.52倍gydF4y2BaUFGTgydF4y2Ba的基因,gydF4y2BaFcUFGT5gydF4y2Ba(c41071_g2)和gydF4y2BaFcUFGT6gydF4y2Ba(c47047_g2),在' CK vs. BF '中分别显著下调2.73倍和5.93倍(图47047_g2)。gydF4y2Ba3.gydF4y2BaA).花青素3- o -葡萄糖苷转移酶催化花青素合成花青素-3- o -葡萄糖苷(下调5.93倍)。cyanidin- 3,5- o -二葡萄糖苷可由Cyanidin-3 - o -葡萄糖苷(下调2.09倍)或cyanidin-5- o -葡萄糖苷糖基化;udp -糖基转移酶75D1催化天竺葵素合成天竺葵素-3- o -葡萄糖苷(下调1.21倍)。此外,无花果雌花组织中苯丙素和黄酮、黄酮醇和异黄酮含量增加(表2)gydF4y2Ba1gydF4y2Ba,无花果。gydF4y2Ba3.gydF4y2Ba一个)。gydF4y2Ba
黄酮类化合物合成途径中结构基因和转录因子的转录谱FPKM和系统发育树。“紫宝”(CK)和套袋后的雌花组织(BF)。(A)结构基因显著差异表达的苯丙-类黄酮生物合成通路重建(黄色)。酶的名称,log2(表达比)和表达模式在每一步的旁边。每个单元转录本的表达模式显示在两个网格上,左边表示FPKM值“CK”,右边表示“BF”。FPKM值用8个不同灰度级的网格表示,RPKM值0 - 10,10 - 20,20 - 40,40 - 80,80 - 160,160-320,320-640和640-1280分别用灰度级1-8表示。(B) CK与BF中参与黄酮类化合物调控的候选MYB转录因子的表达模式,以及募集的r2r3 -MYB与其他植物花青素生物合成相关MYB的系统发育聚类。(C) CK与BF中参与黄酮类化合物调控的候选bHLH转录因子的表达模式,以及募集的bHLHs与其他植物花青素生物合成相关bHLHs的系统发育聚类。*gydF4y2BaPgydF4y2Ba< 0.05gydF4y2Ba
转录水平的基因表达在调控许多生物过程中起着重要作用,转录因子是调控次生代谢产物基因的关键。套袋后,“紫宝”无花果原有的红色果肉没有变化,表现出非轻依赖性。在CK vs BF中,13个MYB和17个bHLH家族成员表现出显著差异。MYB转录因子广泛存在于植物中,参与植物发育和代谢的几乎所有方面。在这些MYB家族中,有12个基因表达上调,其中c43673_g1、c12586_g1、c44925_g1、c36728_g1分别上调4.87倍、4.81倍、4.24倍、4.14倍,c66005_g2下调3.8倍(图。gydF4y2Ba3.gydF4y2BaCK中MYB c66005_g2的高表达与类黄酮MYB抑制因子PpMYB20密切相关(图2)。gydF4y2Ba3.gydF4y2BaB),而c40750_g1与调控葡萄花青素生物合成的花青素激活子基团聚在一起,与VvMYB5a、VvMYB5b和VvMYBPA2具有高度相似性[gydF4y2Ba30.gydF4y2Ba].gydF4y2Ba
基本螺旋-环-螺旋(bHLH)家族是植物中第二大转录因子家族,具有多种功能,包括调节花器官发育、光形态建成、表皮毛和气孔形成、植物激素反应和类黄酮代谢[gydF4y2Ba13gydF4y2Ba在“CK vs BF”中,bHLH家族中的8个基因c66694_g1(4.94)、c81283_g1(3.68)、c72970_g1(3.66)、c43099_g1(3.42)、c25473_g1(2.92)、c43008_g2(2.72)、c39854_g1(2.16)、c33397_g1(2.12)表达显著上调,9个基因表达显著下调,c43844_g1和c40266_g1分别下调3.71倍和4.39倍(图)。gydF4y2Ba3.gydF4y2BaC).通过构建系统进化树,发现CK中bHLH c43844_g1的高表达与木瓜中类胡萝卜素生物合成激活剂CpbHLH1密切相关(图。gydF4y2Ba3.gydF4y2BaC) (gydF4y2Ba31gydF4y2Ba].此外,c25473_g1与VvMYC1、MdbHLH3和MdbHLH33聚在一起。bHLH转录因子VvMYC1和VvMYBA1共表达可在葡萄悬浮细胞中积累花青素[gydF4y2Ba32gydF4y2Ba].MdbHLH3和MdbHLH33与MYB tf的相互作用参与了苹果果实花青素合成的调控[gydF4y2Ba33gydF4y2Ba].bHLH家族成员与果树中的花青素生物合成有关,并已被证明与MYB tf相互作用以调节果实颜色。gydF4y2Ba
套袋后植物内源激素代谢和信号转导基因的变化gydF4y2Ba
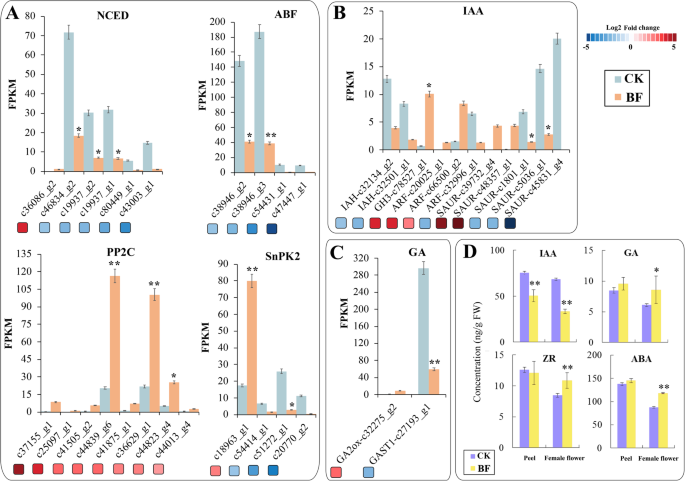
内源激素GA和ABA由光合作用的直接产物葡萄糖分子通过植物异戊二烯生物合成转化而来,异戊二烯调节花青素的生物合成[gydF4y2Ba34gydF4y2Ba].在ABA生物合成中,除c36086_g2显著上调外,其余4个9-顺式环氧胡萝卜素双加氧酶(NCED)基因均显著下调。8个基因被注释为蛋白磷酸酶2c (PP2C),显著上调。2个基因(c2285_g1和c25449_g1)在雌花中被标记为aba激活蛋白激酶2(SNRK2), 4个ABRE结合因子(ABF)基因在套袋后显著下调。其中一个ABA 8’-羟化酶(ABA 8’-h)基因(c23609_g1)在ABA分解代谢过程中显著下调3.17倍。gydF4y2Ba4gydF4y2BaA).在IAA生物合成基因中,有3个被标记为吲哚-3-乙酸诱导蛋白(ARG7)基因:1个基因c39732_g4显著上调,2个基因c1801_g1和c45831_g4显著下调,3个生长素反应因子(ARF)中c20025_g1和c20025_g2表达上调,c32996_g1表达下调。此外,还有1个Gretchen Hagen3 (GH3)基因c78527_g1、1个信号转导生长素-流载体(AUX1)基因和2个iaa -氨基酸水解酶(IAH)基因c32134_g2和c32501_g1上调(图。gydF4y2Ba4gydF4y2BaB).赤霉素(GA)在草莓和甜樱桃的成熟中起重要作用[gydF4y2Ba35gydF4y2Ba].赤霉素降解基因GA2氧化酶(GA2ox) c32275_g2在CK vs BF处理中显著上调2.88倍,赤霉素刺激转录基因(GASTI) c27193_1在装袋雌花组织中呈反向调控,下调2.32倍。gydF4y2Ba4gydF4y2BaC).采用酶联免疫分析法(ELISA)测定CK和BF果皮和雌花组织中4种植物激素的水平。雌花组织和果皮中活性IAA水平CK高于BF,且差异达到极显著水平(gydF4y2BaPgydF4y2Ba< 0.01)。本实验测得的GA含量为GA含量之和gydF4y2Ba1gydF4y2Ba和遗传算法gydF4y2Ba3.gydF4y2Ba.BF与CK相比,果皮中GA含量显著高于雌花组织,套袋后果皮和雌花组织中GA含量适度升高。果皮和雌花组织中ZR含量变化趋势相反,果皮套袋后ZR含量下降,雌花组织中ZR含量略有增加,且差异显著(gydF4y2BaPgydF4y2Ba< 0.01)(图;gydF4y2Ba4gydF4y2BaD)。gydF4y2Ba
qRT-PCR验证gydF4y2Ba
为了验证RNA-seq的关键结果,选取黄酮类生物合成途径和内源激素信号转导途径中的15个基因进行验证,通过qRT-PCR分析其在CK和BF中的表达水平(图。gydF4y2BaS3gydF4y2Ba).结果证实,基因表达水平与RNA-seq结果相似,与RNA-seq揭示的基因表达上调和下调趋势有很好的一致性。gydF4y2Ba
讨论gydF4y2Ba
套袋在改变果实发育微环境的同时,提高了果实对光的敏感性,影响了果实的内在品质和外观品质。水果的风味成分一般与糖、有机酸和酚类物质的含量有关。以前的研究主要关注袋装对果皮颜色的影响,而关于风味变化的研究只关注几种特定类型的代谢物,如糖(果糖、葡萄糖和蔗糖)、有机酸、氨基酸和醇[gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba].到目前为止,尚未对套袋对无花果果实次生代谢产物的整体变化进行研究。本研究采用LC-MS/ ms为基础的广泛靶向代谢组学方法研究了无花果果实套袋后的风味变化。共鉴定出771种代谢物,其中88种代谢物以差异表达方式在套袋后的雌花组织中积累。雌性无花果花的组织中含有大量的碳水化合物(表2)gydF4y2BaS2gydF4y2Ba),包括20种糖,其中12种糖在套袋后在雌花组织中的浓度显著降低,包括d -葡萄糖6-、d -果糖6-、核酮糖-5-磷酸、葡萄糖−1-磷酸和d -果糖6-磷酸二钠盐。这5种还原糖类型是形成无花果果实风味的主要糖类型,而鉴定出的115种有机酸中,有一半(52种)的浓度在套袋后雌花组织中显著降低,这可以部分解释果实风味的变化。氨基酸的组成和丰富度是营养品质的关键指标,也是决定风味的重要因素[gydF4y2Ba38gydF4y2Ba].之前的研究发现无花果果实中含有12种氨基酸[gydF4y2Ba39gydF4y2Ba].然而,广泛靶向代谢组分析鉴定出99种氨基酸,其中7种在CK和BF之间累积了差异(表1)gydF4y2Ba2gydF4y2Ba).这些氨基酸中的5种(l-天冬氨酸,CYS-GLY, l-同型半胱氨酸,苯乙酰- l-谷氨酰胺和天冬氨酸)在套袋后显著降低(表gydF4y2Ba2gydF4y2Ba).因此,结果表明,氨基酸组成和丰度的差异也会导致风味物质的变化。转录组分析显示7个与氨基酸合成和转运蛋白相关的差异表达基因,其中3个表达上调,4个表达下调。其中,氨基酸转运蛋白YPQ基因下调2.93倍(表gydF4y2BaS6gydF4y2Ba).gydF4y2Ba
植物激素在诱导花青素积累中起重要作用。植物激素通常与光信号通路相互作用来调节植物的生长。基于E3泛素连接酶的组成型光形态形成nic1 (COP1)是信号转导过程中光形态形成的决定性抑制剂,是位于光受体下游的“分子开关”。在黑暗条件下,COP1蛋白进入细胞核,可与phyA-105抑制因子(SPA1)形成复合体[gydF4y2Ba40gydF4y2Ba].然后,泛素降解光形态建成促进TF HY5,使其失活或离开其作用区域,从而调节花青素的合成[gydF4y2Ba41gydF4y2Ba].在光照条件下,COP1从细胞核转移到细胞质,HY5的积累启动光形态建成。在本研究中,光调节对ABA代谢和信号转导基因合成有显著差异表达。研究表明,ABA途径的成员可以与HY5和PIF3相关,这表明ABA可能是光依赖性花青素生物合成中最重要的植物激素[gydF4y2Ba35gydF4y2Ba].上述DEGs的GO富集分析表明,GA在功能上参与光介导的花青素生物合成(图。gydF4y2Ba4gydF4y2Ba).同时,HY5和PP2CA,以及PIF3和PYL10与其他参与花青素生物合成的tf和结构基因共表达。同样,可能相互作用途径HY5-SLY1-GASA3和PIF3-GID1A的成员与花青素生物合成基因共表达。目前已经发现ABA在无花果雌花组织的发育、成熟和采后阶段起重要作用。在颜色转换前,ABA在无花果雌花组织中迅速产生,在商业成熟前达到最高水平,而花青素含量变化晚于ABA。ABA合成抑制剂NDGA抑制花青素的积累,说明ABA是无花果正常发育过程中促进果实着色的重要因素之一[gydF4y2Ba35gydF4y2Ba) . .因此,本研究提出了一个涉及ABA-HY5-MYB在雌花组织花青素生物合成中的共表达网络。为了了解果实中众多激素代谢合成相关基因表达水平的变化是否会影响果实后期风味成分的变化,未来将对套袋后果实中的激素代谢产物进行研究。本研究将为探索植物激素和果味成分形成的分子代谢机制奠定基础。gydF4y2Ba
结论gydF4y2Ba
本研究通过HPLC-MS/ ms - s代谢组和转录组分析,系统比较了无花果果实套袋前后风味成分的差异和类黄酮生物合成的变化。本工作提供了无花果雌花组织代谢产物组成及丰度的全面信息,并初步探索了不同无花果组织时空着色模式的差异。为探明黄酮类生物合成途径中涉及的结构基因和MYB tf的各种调控模式,以及雌花组织中碳水化合物、有机酸、氨基酸、酚类和醇类成分的差异和浓度变化,确定套袋后果实风味品质变化的根本原因。gydF4y2Ba
方法gydF4y2Ba
植物材料及处理gydF4y2Ba
在北京市海淀区中国农业大学上庄实验站(40°23′N, 116°49′W)种植无花果普通品种“紫宝”(正式鉴定已获中国国家林业局批准,新品种权号[20150145])。无花果原料的原始来源采用山东威海长寿康食品有限公司。试验研究无花果符合中国和山东省地方法规。栽培5年,种植在行距和株距2 m × 3 m的温室内。采用内黑外浅棕色双层不透明纸袋(150 mm × 150 mm,中国农业科学院郑州果树研究所正果纸袋)遮荫。在第三期后期采集无花果,命名为CK(雌花自然生长)和BF(袋装雌花)。每个样品3个生物重复,每个重复从5棵树上随机收集30个果实。我们把无花果带回实验室,用剃须刀片小心翼翼地切除雌花(大约10克重)。雌花立即在液氮中冷冻,并在−80°C保存以供进一步使用。gydF4y2Ba
样品制备和代谢物提取gydF4y2Ba
无花果雌花样品进一步研磨,并在液氮中用研钵和研杵充分混合。使用混合磨机(MM 400, Retsch)与氧化锆珠在30 Hz下粉碎冻干组织1.5分钟。称取粉状样品(100 mg),用1.0 mL 70%甲醇水在4℃下提取过夜。离心10000倍gydF4y2BaggydF4y2Ba吸收萃取液(CNWBOND Carbon-GCB SPE Cartridge, 250 mg, 3 mL;ANPEL,上海,中国gydF4y2Bawww.anpel.com.cn/cnwgydF4y2Ba),过滤后(SCAA-104,孔径0.22 μm;LC-MS分析前的ANPEL)。gydF4y2Ba
采用LC-ESI-MS/MS系统(HPLC, shimo -pack UFLC SHIMADZU CBM30A系统,gydF4y2Bawww.shimadzu.com.cngydF4y2Ba;MS,应用生物系统6500 Q TRAP,gydF4y2Bawww.appliedbiosystems.com.cngydF4y2Ba).分析条件:高效液相色谱柱:Waters ACQUITY UPLC HSS T3 C18 (1.8 μm, 2.1 mm × 100 mm);溶剂体系为水(0.04%乙酸)和乙腈(0.04%乙酸);梯度程序,95:5 V/V在0分钟,5:95 V/V在11.0分钟,5:95 V/V在12.0分钟,95:5 V/V在12.1分钟,95:5 V/V在15.0分钟;流速,0.40 ml/min;温度,40°C;注量2 μL。流出物交替连接到esi -三重四极线性离子阱(Q trap)-MS [gydF4y2Ba42gydF4y2Ba].gydF4y2Ba
代谢物鉴定和定量gydF4y2Ba
采用qq -线性离子阱质谱仪(Q trap)、API 6500 Q trap LC/MS/MS系统进行LIT和三重四极杆(QQQ)扫描,该系统配备ESI Turbo离子喷雾接口,工作在正离子模式下,由Analyst 1.6.3软件(AB Sciex)控制。ESI源运行参数如下:离子源、涡轮喷雾;源温度500℃;离子喷涂电压(IS) 5500 V;离子源气体I (GSI)、气体II (GSII)和幕气(CUR)分别设置为55、60和25.0 psi;碰撞气体(CAD)较高。用10 μmol/L和100 μmol/L聚丙烯乙二醇溶液分别在QQQ和LIT模式下进行仪器调试和质量校准。QQQ扫描作为MRM实验,碰撞气体(氮气)设置为5 psi。对各MRM跃迁的聚类势(DP)和碰撞能(CE)进行了进一步优化。根据在此期间洗脱的代谢物,对每个时期的特定MRM转变进行监测。 Metabolite data analysis was conducted with Analyst 1.6.1 software (AB SCIEX, Ontario, Canada). Metabolite quantification was carried out using MRM. Partial least squares discriminant analysis (PLS-DA) was carried out with the metabolites identified. Metabolites with significant differences in content were set with thresholds of variable importance in projection (VIP) ≥ 1 and fold change ≥2 or ≤ 0.5 [43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba].gydF4y2Ba
RNA-seq和注释gydF4y2Ba
构建了6个文库,分别代表2个雌花样本和3个重复,用于转录组测序。采用CTAB法从无花果材料中提取总RNA [gydF4y2Ba45gydF4y2Ba].RNA浓度和纯度分别由NanoDrop 2000 (NanoDrop Technologies, Wilmington, DE, USA)和Agilent Bioanalyzer 2100系统(Agilent Technologies, Palo Alto, CA, USA)测量。1%琼脂糖凝胶电泳检测RNA完整性后,调整RNA浓度至相同水平。用低聚磁珠(dT)从总RNA中分离mRNA;cDNA使用cDNA Synthesis Kit (TaKaRa, Japan)合成,并将测序适配器连接到两端[gydF4y2Ba46gydF4y2Ba].文库制剂在Illumina HiSeq 4000平台上测序,通过RSEM软件从我们的实验室转录组数据库中获得的单基因序列进行集成注释[gydF4y2Ba29gydF4y2Ba].gydF4y2Ba
转录组数据分析gydF4y2Ba
原始读数用FastQC处理(gydF4y2Bahttp://www.bioinformatics.babraham.ac.uk/projects/fastqcgydF4y2Ba)来过滤掉适配器和低质量的序列。对于基因表达分析,计数通过HTSeq (v0.5.4p3)映射到每个基因的阅读量,然后归一化为每千碱基的转录本每百万次映射阅读量(FPKM)。EdgeR软件(gydF4y2Bahttp://www.bioconductor.org/packages/2.12/bioc/html/edgeR.htmlgydF4y2Ba)用于分析差异表达基因(DEGs)。筛选显著的DEGsgydF4y2BapgydF4y2Ba-value (p-FDR)≤0.05和|log2FC|≥1为标准。使用GOatools进行富集分析(gydF4y2Bahttps://github.com/tanghaibao/GOatoolsgydF4y2Ba)和费雪的精确测试。为了控制计算出的假阳性率gydF4y2BapgydF4y2Ba-值使用四种多重测试方法进行校正,在的差异基因上进行了GO功能化的显著差异gydF4y2BapgydF4y2Ba≤0.05。使用KOBAS软件进行KEGG通路富集分析(gydF4y2Bahttp://kobas.cbi.pku.edu.cn/home.dogydF4y2Ba)gydF4y2BaPgydF4y2Ba-value≤0.05 [gydF4y2Ba45gydF4y2Ba].gydF4y2Ba
激素测定及RT-qPCR验证gydF4y2Ba
采用酶联免疫分析法(ELISA)测定无花果雌花组织中生长素(IAA)、赤霉素(GA)、玉米素(ZR)和脱落酸(ABA)的含量[gydF4y2Ba47gydF4y2Ba].检测所用酶免疫检测试剂盒购自云南农业大学,按所述步骤进行激素检测,每个样品重复3次。最后计算平均值,并采用SPSS 17.0软件进行显著性分析。gydF4y2Ba
根据CK和BF无花果雌花的转录组数据,验证了15个DEGs的表达水平。PCR用ABI 7500快速实时检测系统(Applied Biosystems)进行,使用Ultra SYBR Mix试剂盒(TaKaRa,日本)。扩增体系由10 μL Ultra SYBR Premix system II、0.5 μL 10 μmol/L上游引物、0.5 μL 10 μmol/L下游引物、2 μL模板和总容积为20 μL的双蒸馏水组成。扩增程序为95°C 10 min,然后依次为95°C 5 s和58°C 30 s,循环40次。数据的相对定量分析由2gydF4y2Ba−ΔΔCTgydF4y2Ba方法以β-肌动蛋白为内参基因。用于RT-qPCR的引物列在附加文件中gydF4y2Ba1gydF4y2Ba:表S1。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
本研究中生成和分析的数据集可根据合理要求从通讯作者处获得。在研究过程中产生或分析的所有数据都包含在这篇发表的文章及其补充信息文件中。RNA-seq原始数据可在以下网站免费获取:gydF4y2Bawww.ncbi.nlm.nih.gov bioproject /gydF4y2BaPRJNA494945。gydF4y2Ba
缩写gydF4y2Ba
- 4 cl:gydF4y2Ba
-
4-香豆酸酯:辅酶A连接酶gydF4y2Ba
- 答:gydF4y2Ba
-
花青素合成酶gydF4y2Ba
- bHLH:gydF4y2Ba
-
基本helix-loop-helixgydF4y2Ba
- 气:gydF4y2Ba
-
查耳酮异构酶gydF4y2Ba
- CHS:gydF4y2Ba
-
查耳酮合酶gydF4y2Ba
- 齿轮:gydF4y2Ba
-
同源蛋白群数据库gydF4y2Ba
- 度:gydF4y2Ba
-
差异表达基因gydF4y2Ba
- DFR:gydF4y2Ba
-
Dihydroflavonol 4-reductasegydF4y2Ba
- FPKM:gydF4y2Ba
-
每千碱基的外显子模型的片段数gydF4y2Ba
- F3H:gydF4y2Ba
-
黄烷酮3-hydroxylasegydF4y2Ba
- F3'H:gydF4y2Ba
-
黄烷酮3 ' -羟化酶gydF4y2Ba
- 走:gydF4y2Ba
-
基因本体论gydF4y2Ba
- KEGG:gydF4y2Ba
-
京都基因与基因组百科全书gydF4y2Ba
- 政治:gydF4y2Ba
-
Leucoanthocyanidin还原酶gydF4y2Ba
- MYB:gydF4y2Ba
-
V-myb禽成髓细胞病病毒癌基因同源物gydF4y2Ba
- 朋友:gydF4y2Ba
-
苯丙氨酸ammonia-lyasegydF4y2Ba
- UFGT:gydF4y2Ba
-
udp -葡萄糖:类黄酮3- o -葡萄糖基转移酶gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
美国农业部。食物的营养价值。,U.S. Department of Agriculture, Agricultural Research Service, Nutrient Data Labora-tory, Beltsville, Maryland. Available athttp://www.nal.usda.gov/fnic/foodcomp/Data/HG72/hg72_2002.pdfgydF4y2Ba(2008年12月3日查阅);2002.gydF4y2Ba
- 2.gydF4y2Ba
Jeong WS, Lachance PA。无花果中的植物甾醇和脂肪酸(gydF4y2Ba无花果gydF4y2Ba(变种mission)水果和树的组成部分。中国食品科学,2001;66(2):278-81。gydF4y2Ba
- 3.gydF4y2Ba
苏琪,罗利,李志强,李志强,等。地中海饮食中主要类胡萝卜素的鉴定与定量:绿叶蔬菜、无花果和橄榄油。中华临床医学杂志,2002;29(4):344 - 344。gydF4y2Ba
- 4.gydF4y2Ba
Solomon A, Golubowicz S, Yablowicz Z, Grossman S, Bergman M, Gottlieb HE,等。无花果新鲜果实的抗氧化活性及花青素含量(gydF4y2Ba无花果gydF4y2Bal .)。农业食品化学学报。2006;54(20):7717-23。gydF4y2Ba
- 5.gydF4y2Ba
Caro AD, Piga A.两个意大利新鲜无花果品种果皮和果肉的多酚成分(gydF4y2Ba无花果gydF4y2Bal .)。中国食品科学。2008;26(4):715-9。gydF4y2Ba
- 6.gydF4y2Ba
弗莱什曼马,罗多夫V, Stover E.无花果:植物学,园艺和育种。Hort Rev. 2008; 4:13 13 - 96。gydF4y2Ba
- 7.gydF4y2Ba
周娟,曹璐,陈松,Perl A,马慧。消费者辅助选择:中国鲜食葡萄新品种的偏好。Aust J Grape Wine res 2015;21(3): 351-60。gydF4y2Ba
- 8.gydF4y2Ba
王震,周娟,徐旭,Perl A,陈松,马慧。我国葡萄栽培者对鲜食葡萄品种的属性偏好研究。科学通报。2017;216:66-75。gydF4y2Ba
- 9.gydF4y2Ba
黄酮醇和花青素在低温和UV-B驯化中的作用gydF4y2Ba拟南芥gydF4y2Ba(l)。BMC胃肠病杂志,2014;11(1):1 - 10。gydF4y2Ba
- 10.gydF4y2Ba
Wallace TC, Slavin M, Frankenfeld CL。花青素与心血管疾病标志物的系统综述。营养。2016;8(1):32。gydF4y2Ba
- 11.gydF4y2Ba
花青素对肿瘤发生、免疫系统和中枢神经系统的影响。在:花青素和人类健康:生物分子和治疗方面:施普林格国际出版社;2016.gydF4y2Ba
- 12.gydF4y2Ba
顾德东,王志强,胡德东,郝玉杰。花青素是如何涂漆我们的园艺产品的?科学通报。2019;249:257-62。gydF4y2Ba
- 13.gydF4y2Ba
李志刚,李志刚,李志刚,李志刚,等。基本Helix-loop-Helix转录因子MYC1参与了葡萄类黄酮生物合成途径的调控。植物学报。2010;3(3):509-23。gydF4y2Ba
- 14.gydF4y2Ba
刘娟,李志刚,马培平。MYB转录因子在植物苯丙类代谢中的调控作用。植物学报。2015;8(5):689-708。gydF4y2Ba
- 15.gydF4y2Ba
Espley RV, Brendolise C, Chagne D, Kuttyamma S, Green S, Volz RK,等。一个启动子片段的多次重复导致红苹果中的转录因子自动调节。植物学报。2009;21(1):168-83。gydF4y2Ba
- 16.gydF4y2Ba
夏尼D,林旺K, Espley RV, Volz RK, How NM, Rouse S,等。一种古老的苹果MYB转录因子复制导致了新的红色果肉表型。中国生物医学工程学报,2013;29(1):344 - 344。gydF4y2Ba
- 17.gydF4y2Ba
张志刚,张志刚,张志刚,等。草莓FaMYB1转录因子抑制转基因烟草花青素和黄酮醇的积累。植物学报,2001;28(3):319-32。gydF4y2Ba
- 18.gydF4y2Ba
周华,柯林旺,王华,顾晨,Dare AP, Espley RV,等。血红桃的分子遗传学揭示了NAC转录因子对花青素生物合成的激活作用。中国植物学报,2015;29(1):344 - 344。gydF4y2Ba
- 19.gydF4y2Ba
刘波,王磊,王松,李伟,刘东,郭旭,等。对袋装处理的‘平果’梨的转录组分析表明,果皮中参与花青素生物合成的MYB4-like1、MYB4-like2、MYB1R1和WDR在光照下表达上调。科学通报。2019;244:428-34。gydF4y2Ba
- 20.gydF4y2Ba
金伟,王辉,李敏,王杰,杨勇,张旭,等。R2R3 MYB转录因子PavMYB10.1参与花青素的生物合成,并决定甜樱桃的果皮颜色(gydF4y2Ba李属鸟结核gydF4y2Bal .)。植物学报,2016;14(11):2120-33。gydF4y2Ba
- 21.gydF4y2Ba
Rouholamin S, Zahedi B, Nazarianfirouzabadi F, Saei A.石榴花青素合成关键调控基因的表达分析。科学通报。2015;186:84-8。gydF4y2Ba
- 22.gydF4y2Ba
Paolocci F, Robbins MP, Passeri V, Hauck B, Morris P, Rubini A,等。草莓转录因子FaMYB1抑制莲叶原花青素的生物合成。中国机械工程学报,2011;26(3):339 - 344。gydF4y2Ba
- 23.gydF4y2Ba
Matsui K, Umemura Y, Ohmetakagi M. AtMYBL2是一种具有单一MYB结构域的蛋白,在拟南芥花青素生物合成中起负调控作用。植物学报,2008;36(6):344 - 344。gydF4y2Ba
- 24.gydF4y2Ba
Cavallini E, Matus JT, Finezzo L, Zenoni S, Loyola R, Guzzo F,等。在葡萄中,苯丙烷通路在不同的分支受到一组R2R3-MYB C2抑制子的控制。中国生物医学工程学报,2015;37(4):344 - 344。gydF4y2Ba
- 25.gydF4y2Ba
Mitsunami T, Nishihara M, Galis I, Alamgir KM, Hojo Y, Fujita K,等。PAP1转录因子的过表达揭示了在斜纹夜蛾侵袭的烟草植株中黄酮类化合物和苯丙类化合物代谢的复杂调控。PLoS One. 2014;9(9):e108849。gydF4y2Ba
- 26.gydF4y2Ba
邹松,吴娟,沙希德MQ,何勇,杨霞。枇杷关键味觉成分的代谢组学鉴别。食品化学2020;323:126822。gydF4y2Ba
- 27.gydF4y2Ba
Scarim AL, Arnush M, Hill JR, Marshall CA, Baldwin A. Mc Da Niel ML,等。gydF4y2BaMangifera籼gydF4y2Ba简历。'keitt')影响果实质量和矿物成分。采收后生物技术,1997;12(1):83-91。gydF4y2Ba
- 28.gydF4y2Ba
杨晓明,杨晓明,杨晓明,杨晓明。采前套袋对芒果果实品质的影响。环境科学,2016;9(11):1366-9。gydF4y2Ba
- 29.gydF4y2Ba
Rodov V, Vinokur Y, Horev B.采后短暂的脉冲光照射刺激无花果果实着色和花青素积累(gydF4y2Ba无花果gydF4y2Bal .)。中国生物医学工程学报,2012;68(8):43-6。gydF4y2Ba
- 30.gydF4y2Ba
周华,彭强,赵娟,Owiti A,任峰,廖林,等。多个R2R3-MYB转录因子参与调控桃花花青素积累前沿植物科学,2016;7:1557。gydF4y2Ba
- 31.gydF4y2Ba
周东,沈勇,周萍,法蒂玛·M,明瑞。木瓜CpbHLH1/2对番木瓜果实成熟过程中类胡萝卜素合成相关基因的调控。园艺通报2019;6(1):1 - 13。gydF4y2Ba
- 32.gydF4y2Ba
管林,李建华,范鹏鹏,李世生,方剑杰,戴志伟,等。遮光条件下teinturier葡萄品种组织中花青素生物合成的调控。中国生物医学工程学报。2014;29(3):366 - 366。gydF4y2Ba
- 33.gydF4y2Ba
谢小斌,李松,张富峰,赵军,郝玉军。bHLH转录因子MdbHLH3在低温下促进苹果花青素积累和果实着色。植物细胞环境学报。2012;35(11):1884-97。gydF4y2Ba
- 34.gydF4y2Ba
Rudell DR, Mattheis JP。乙烯和茉莉酸甲酯在富士苹果皮人工光诱导色素增强过程中存在协同作用。生物技术学报,2008;47(1):136-40。gydF4y2Ba
- 35.gydF4y2Ba
沈旭,赵凯,刘林,张凯,袁宏,廖旭,等。PacMYBA在aba调控红樱桃花青素生物合成中的作用。邓宏(gydF4y2Ba李属鸟结核gydF4y2Bal .)。植物生理学报。2014;36(5):862-80。gydF4y2Ba
- 36.gydF4y2Ba
陈晓辉,刘晓华,陈立林。两种枇杷果实发育过程中果肉有机酸浓度和酸代谢酶活性的发育变化(gydF4y2Ba枇杷gydF4y2Ba)果实酸度不同的栽培品种。食品化学。2009;14:657 - 64。gydF4y2Ba
- 37.gydF4y2Ba
Lombardo VA, Osorio S, Borsani J, Lauxmann MA, Bustamante CA, Budde CO,等。在桃果发育和成熟期间的代谢图谱揭示了支撑每个发育阶段的代谢网络。植物科学进展。2011;37(4):366 - 366。gydF4y2Ba
- 38.gydF4y2Ba
崔帅,安俊杰,金海杰,林nk,高祖奎,李文哲,等。枣中游离氨基酸、蛋白质和类黄酮含量的变化(gydF4y2BaZiziphus枣gydF4y2Ba)果实八个生长阶段的抗氧化和癌细胞抑制作用的提取物。农学通报。2012;60:10245-55。gydF4y2Ba
- 39.gydF4y2Ba
Slatnar A, Klancar U, Stampar F, Veberic R.无花果干燥的影响(gydF4y2Ba无花果gydF4y2BaL.)中糖、有机酸和酚类化合物的含量。农业食品化学学报,2011;59(21):11696-702。gydF4y2Ba
- 40.gydF4y2Ba
赛若勇,朱东,李娟,卢比奥V,周震,沈勇,等。拟南芥COP1/SPA1复合体和FHY1/FHY3与光敏色素a不同磷酸化形式的平衡光信号有关。生物化学学报。2008;31(4):607-13。gydF4y2Ba
- 41.gydF4y2Ba
李勇,毛凯,赵超,赵旭,张宏,舒华,等。MdCOP1泛素E3连接酶与MdMYB1相互作用,调控光诱导的苹果花青素生物合成和红色果实着色。中国生物医学工程学报,2012;26(2):344 - 344。gydF4y2Ba
- 42.gydF4y2Ba
张强,王磊,刘震,赵震,赵娟,王震,等。转录组和代谢组分析揭示了红枣果皮着色的机制。食品化学2020;312:125903。gydF4y2Ba
- 43.gydF4y2Ba
王震,崔勇,Vainstein A,陈松,马华。gydF4y2Ba无花果gydF4y2Bal)果实颜色:类黄酮生物合成途径的代谢组学和转录组学分析。植物科学进展(英文版);gydF4y2Ba
- 44.gydF4y2Ba
刘勇,吕杰,刘震,王杰,杨波,陈伟,等。结合代谢组和转录组分析辣椒果实颜色形成机制(gydF4y2Ba甜椒gydF4y2Bal .)。食品化学2020;306:125629。gydF4y2Ba
- 45.gydF4y2Ba
王智,宋敏,李艳,陈松,马慧。无花果(Ficus carica L.)伞果皮和雌花组织的差异颜色发育及其对光剥夺的响应:转录组解析。BMC植物生物学,2019;19(1):217。gydF4y2Ba
- 46.gydF4y2Ba
柴林,王志强,柴鹏,陈松,马华。San pedro型无花果转录组分析(gydF4y2Ba无花果gydF4y2Bal)孤雌breba与非孤雌main作物在激素相关基因表达上存在差异。树Genet基因组,2017;13(4):1-14。gydF4y2Ba
- 47.gydF4y2Ba
吴玲,兰杰,向旭,向宏,刘勇。猕猴桃转录组测序和内源植物激素分析揭示CPPU控制果实发育的新认识。科学通报。2020;15(10):e0240355。gydF4y2Ba
确认gydF4y2Ba
感谢武汉美特瑞生物科技有限公司(中国武汉)员工在代谢产物数据分析过程中的支持。gydF4y2Ba
资金gydF4y2Ba
本工作得到中国自然科学基金项目[31372007]的支持,资助人为转录组和代谢组学检测提供费用。云南省YEFICRC重点项目[2019ZG00907]、云南省应用基础研究基金[202101 AU070094],资助单位提供后续试验验证所需试剂费用、论文发表费用等。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
HM和SC设计了实验。ZW和MS进行了实验并对结果进行了分析。ZW, MS, SC, HM共同撰写稿件。所有作者均已阅读并批准稿件出版。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
这些实验没有涉及濒危或受保护物种。这些活动不需要特定的许可证,因为本研究中使用的无花果来自北京的一个果园,该果园是中国农业大学的示范基地。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们之间没有利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条所提供的资料,除非在资料的信用额度中另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
王,Z,宋,M,王,Z。gydF4y2Baet al。gydF4y2Ba套袋后无花果雌花组织风味成分和类黄酮生物合成的代谢组和转录组分析gydF4y2BaBMC植物生物学gydF4y2Ba21日,gydF4y2Ba396(2021)。https://doi.org/10.1186/s12870-021-03169-1gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-021-03169-1gydF4y2Ba
关键字gydF4y2Ba
- 图(榕)gydF4y2Ba
- RNA-seqgydF4y2Ba
- 代谢物gydF4y2Ba
- 装袋gydF4y2Ba
- 雌花组织gydF4y2Ba
- 类黄酮gydF4y2Ba
- 风味物质gydF4y2Ba