- 研究gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
从头转录组分析为植物叶片外植体不定根的形成提供了新的思路gydF4y2BaArnebia euchromagydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba21gydF4y2Ba,文章号:gydF4y2Ba414gydF4y2Ba(gydF4y2Ba2021gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
不定根的形成被认为是难以生根的植物繁殖过程中一个重要的发育步骤,特别是在园艺作物中。近年来,通过植物组织培养方法诱导的不定根也被用于生产类黄酮、花青素和蒽醌等植物化学物质。人们已经很清楚哪些园艺物种容易形成不定根,但在分子水平上影响这一过程或在离体条件下调节诱导过程的因素却很少为人所知。本研究旨在鉴定参与不定根体外诱导和形成的转录本gydF4y2BaArnebia euchromagydF4y2Ba不同时间点的叶片(完整叶片(对照),3 h, 12 h, 24 h, 3 d, 7 d, 10 d和15 d)。gydF4y2Ba答:euchromagydF4y2Ba是一种濒临灭绝的喜马拉雅草本植物,其根部含有红色萘醌色素。这些植物成分被广泛用作亚洲传统药物的草药成分,以及食品和化妆品中的天然着色剂。gydF4y2Ba
结果gydF4y2Ba
共生成13793 - 29376万份原始阅读,并组装成54587份转录本,平均长度分别为1512.27 bps和2193 bps。此外,还鉴定出50107个差异表达基因,并发现它们参与植物激素信号转导、细胞壁修饰和创面诱导的丝裂原活化蛋白激酶信号转导。数据显示生长素反应的优势(生长素反应因子8,gydF4y2BaIAA13gydF4y2Ba, GRETCHEN HAGEN3.1)和蔗糖易位(β -31果糖呋喃糖苷酶和单糖感应蛋白1)基因诱导期。在起始阶段,侧器官边界DOMAIN16、EXPANSIN-B15、ENDOGLUCANASE25和富含亮氨酸的重复延伸样蛋白的表达增加。在表达阶段,除了侧器官边界DOMAIN16外,还鉴定出相同的转录本。总的来说,转录组分析显示了相似的基因模式,然而,它们的表达水平在离体不定根形成的后续阶段有所不同gydF4y2Ba答:euchroma。gydF4y2Ba
结论gydF4y2Ba
本文的研究结果将有助于进一步了解植物不定根离体发育的关键调控因子gydF4y2BaArnebiagydF4y2Ba物种,这可能在未来部署在植物化学生产的商业规模。gydF4y2Ba
背景gydF4y2Ba
不定根的形成是一个胚胎后的发育过程,被认为是木本和园艺植物无性繁殖中最重要的步骤。不定根不仅成功地用于繁殖,而且还用于改良基因型的生产[gydF4y2Ba1gydF4y2Ba].不定根常由叶、茎或下胚轴诱导而来[gydF4y2Ba2gydF4y2Ba].不定根形成的过程可分为三个相互依赖的阶段:1)诱导(植物细胞获得产生奠基人细胞的能力),2)起始(奠基人细胞分裂形成根原基)和3)表达或出芽阶段(新形成的不定根穿过表皮出现)[gydF4y2Ba3.gydF4y2Ba].一般来说,切割/损伤/脱离组织在损伤部位产生各种信号,然后输入到转化细胞(叶肉细胞、叶缘细胞和一些血管细胞)[gydF4y2Ba4gydF4y2Ba].随后,这些信号引起生理反应,如质膜电位波动,细胞内钙gydF4y2Ba2 +gydF4y2Ba浓度,HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba产生和合成激素,如茉莉酸(JA)和乙烯(ET) [gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba].此后,这些反应导致启动的能力细胞(原形成层细胞、血管薄壁细胞、中柱鞘细胞和血管细胞)向奠基细胞的命运转变,最终产生根原基和不定根[gydF4y2Ba4gydF4y2Ba].gydF4y2Ba
在这方面,植物激素在不定根发育的不同阶段也起着重要作用。首先,生长素是与不定根形成的所有阶段相关的关键激素,在体外和体内条件下都被广泛使用[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba7gydF4y2Ba].在这一过程中,生长素通过基瓣转运载体在受损植物组织的启动细胞中积累[gydF4y2Ba8gydF4y2Ba].生长素极性转运的缺陷抑制了根创建者细胞的启动和分裂,从而减少了不定根的形成[gydF4y2Ba9gydF4y2Ba].通常,生长素通过激活wuschel相关的homeobox11/12 (gydF4y2BaWOX11/12gydF4y2Ba),但它们的作用尚未完全了解[gydF4y2Ba10gydF4y2Ba].据报道,生长素是生长素反应因子6 (gydF4y2BaARF6gydF4y2Ba)及8 (gydF4y2BaARF8gydF4y2Ba)不定根形成期间gydF4y2Ba拟南芥gydF4y2Ba下胚轴(gydF4y2Ba11gydF4y2Ba].此外,GRETCHEN HAGEN3 (gydF4y2BaGH3sgydF4y2Ba),gydF4y2Ba丝兰gydF4y2Ba,生长素外排PIN形成(gydF4y2Ba针gydF4y2Ba), ATP结合盒b型(gydF4y2BaABCBgydF4y2Ba)和流入载体gydF4y2BaAUXIN1 / LIKE-AUX1gydF4y2Ba基因家族也在不定根的形成中发挥作用[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba].除生长素外,细胞分裂素(CTK)、油菜素类固醇(BRs)、脱落酸(ABA)、ET和赤霉素酸(GA)也被报道可介导不定根的形成[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba].研究发现,CTK在苹果砧木不定根形成过程中维持根分生组织,而在杨树中,CTK则是不定根形成的负调节因子[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba21gydF4y2Ba].植物细胞壁完整性也影响不定根的表达过程。细胞壁的松动是一个重要的生理过程,尤其是在不定根形成的诱导和起始阶段gydF4y2Ba.gydF4y2Ba各种与细胞壁修饰相关的基因,包括木葡聚糖内转葡萄糖酶/水解酶、过氧化物酶、甘露醇脱氢酶和延伸样蛋白,在不定根形成过程中表达[gydF4y2Ba22gydF4y2Ba].在体内条件下,可以为重要商业植物不定根的发育提供全面的分子信息。这些研究的目的大多集中在提高传播效率上。gydF4y2Ba
此外,最近体外诱导不定根培养被用于工业规模的植物化学物质生产[gydF4y2Ba23gydF4y2Ba].未转化和快速生长的不定根是传统全植栽培的成功替代品[gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba].因此,有必要了解从叶片或茎等离体组织中诱导不定根的潜在机制,以建立这些离体培养。在本研究中,gydF4y2Ba答:euchromagydF4y2Ba利用叶片诱导不定根进行转录组分析。gydF4y2Ba答:euchromagydF4y2Ba(Boraginaceae)是喜马拉雅地区(海拔4000-4200 m a.m.s.l)的濒危药材。紫草根的树皮含有红色萘醌色素,被称为紫草素衍生物,在亚洲传统医学中用于治疗伤口、麻疹、烧伤和冻伤[gydF4y2Ba26gydF4y2Ba].这些色素亦用作食品、化妆品、头发配方及纺织工业的着色剂[gydF4y2Ba27gydF4y2Ba].最近对这些颜料的需求导致了过度开发gydF4y2Ba答:euchromagydF4y2Ba植物从它们的自然栖息地。因此,体外诱导不定根将是生产这些色素的可行替代方法。gydF4y2Ba
结果gydF4y2Ba
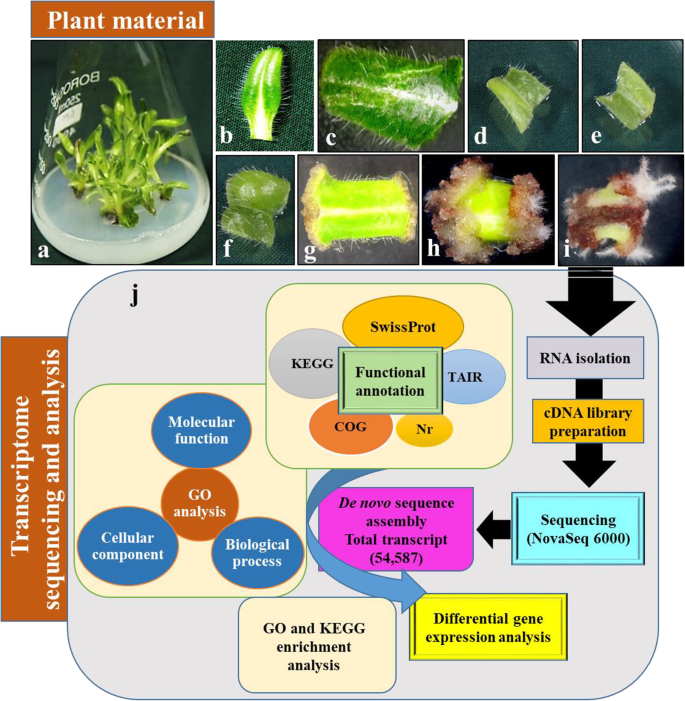
植物不定根发育过程中的形态观察gydF4y2BaArnebiagydF4y2Ba叶子gydF4y2Ba
不定根的形成是一个胚胎后发育过程,包括诱导、起始和表达等不同阶段,每个阶段都有自己的形态和必要性。从离体建立的芽培养叶片gydF4y2Ba答:euchromagydF4y2Ba用于诱导不定根(图;gydF4y2Ba1gydF4y2Baa).简单地说,从芽培养物中分离出的叶片切成小段(4-5 mm),接种于2.5 mg/L吲哚丁酸(IBA)添加Schenk & Hildebrandt (SH)培养基上。此后3天左右才出现形态变化。外植体肿胀是组织反应的第一个迹象。外植体诱导愈伤组织需7 ~ 10天左右。细胞学研究显示一个圆顶状凸起,这可能是新启动的根原基(图。gydF4y2Ba1gydF4y2Bag).接种10-15天后,不定根表达明显(图;gydF4y2Ba1gydF4y2Ba根据这些形态学观察,选取8个时间点(3 h、12 h、24 h、3 d、7 d、10 d和15 d,以完好叶片为对照)进行分析,并将不定根形成分为诱导(3 h ~ 3 d)、起始(3 ~ 7 d)和表达(7 ~ 15 d) 3个阶段(图。gydF4y2Ba1gydF4y2BaB-i)以揭示参与不定根形成各阶段的基因。gydF4y2Ba
植物不定根形成的转录组研究的离体取样和序列gydF4y2Ba答:euchromagydF4y2Ba:gydF4y2Ba一个gydF4y2Ba)培养,gydF4y2BabgydF4y2Ba)在生根培养基中接种后叶片和外植体完好gydF4y2BacgydF4y2Ba) 3 h,gydF4y2BadgydF4y2Ba) 12小时,gydF4y2BaegydF4y2Ba) 24小时,gydF4y2BafgydF4y2Ba) 3 d,gydF4y2BaggydF4y2Ba7 . dgydF4y2BahgydF4y2Ba10 . dgydF4y2Ba我gydF4y2Ba) 15 d及gydF4y2BajgydF4y2Ba)转录组分析gydF4y2Ba
转录组测序和组装gydF4y2Ba
mRNA文库是从冷冻(- 80°C)的不同时间间隔的不定根形成的组织中制备的gydF4y2Ba答:euchromagydF4y2Ba目的:探讨不定根诱导的分子机制。不同图书馆之间共产生了13793万至29376万次原始阅读(表gydF4y2Ba1gydF4y2Ba).使用Trinity软件过滤原始读取和使用的适配器序列。对低质量reads和适配器序列进行修剪后,分别从各库获得137.86 ~ 29366万条高质量clean reads,有效率大于99%。各样本的转录本丰度通过每公斤转录本碱基reads,每百万mapped reads (RPKM)进行分析。完整叶片的RPKM平均值为18.08,而不定根诱导培养基的RPKM平均值为10.14 ~ 19.72。RPKM最低的是在不定根发育完全的15 d后的组织中gydF4y2Ba1gydF4y2Ba).此外,转录体丰度在3 - 24 h呈上升趋势,3 d时下降,7 d时上升,之后下降。gydF4y2Ba
使用不同水平的每百万计数(CPM)[≥10,20]和每百万转录本(TPM)[≥0.5,1.0和2.0]参数对原始装配进行过滤。对所有经过过滤的装配结果的邻近性评估显示,使用TPM > =0.5时,N50的数量最高(2193 bps),因此,最终考虑的转录本总数为54,587 (39.4% GC),平均长度为1512.27 bps(表gydF4y2Ba2gydF4y2Ba;补充表gydF4y2BaS1gydF4y2Ba).gydF4y2Ba
与不定根发育相关的unigenes的功能注释和分类gydF4y2Ba答:euchromagydF4y2Ba采用GO和KEGG富集分析gydF4y2Ba
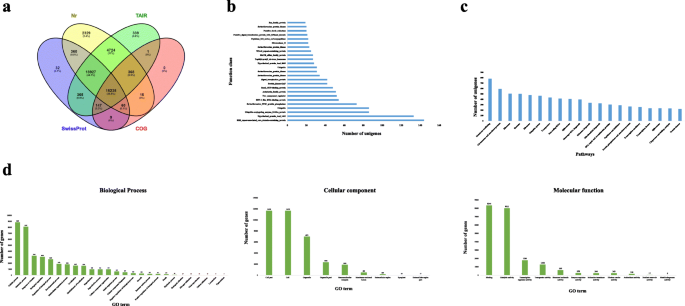
采用多种补充方法鉴定了参与不定根的unigenes的功能gydF4y2Ba答:euchromagydF4y2Ba.采用BLASTx算法在Nr、SwissProt、COG、TAIR和KEGG五个公共数据库中对54,587份转录本进行序列比对,E-value <1e-05(补充表S . 5)gydF4y2Ba2gydF4y2Ba).大部分unigenes被标注在Nr (42018;76.97%),其次是TAIR (40106;73.47%), SwissProt (35,126;64.35%), kegg (23,983;43.93%)和COG (15,826;28.99%)(表gydF4y2Ba3.gydF4y2Ba;无花果。gydF4y2Ba2gydF4y2Baa).由此可见,Nr数据库适合于的功能性转录本注释gydF4y2Ba答:euchromagydF4y2Ba.gydF4y2Ba
假设每个编码蛋白都是从一个祖先蛋白独立进化而来,利用COG数据库对unigenes(54,587)进行功能分类。根据各类蛋白的数量,筛选出25个顶级蛋白群,其中RHS重复相关核心结构域含蛋白最多(144个),其次是假设蛋白AASI 1443(133个)、泛素偶联酶e2样蛋白(86个)、泛素(86个)和丝氨酸/苏氨酸PP2C蛋白磷酸酶(73个)(图)。gydF4y2Ba2gydF4y2Bab).根据BLASTx注释确定物种分布。整体unigenes序列具有最大的相似性gydF4y2Ba胡麻属indicumgydF4y2Ba(2510)gydF4y2Ba紫树属中国gydF4y2Ba(2474),gydF4y2BaHandroanthus impetiginosusgydF4y2Ba(1308),gydF4y2BaErythranthe guttatagydF4y2Ba(558)和gydF4y2Ba葡萄gydF4y2Ba(419)(补充图。gydF4y2BaS1gydF4y2Ba).与不定根形成有关的UnigenesgydF4y2Ba答:euchromagydF4y2Ba与其他开花植物同源性高。gydF4y2Ba
不定根形成的组合体单基的作用gydF4y2Ba答:euchromagydF4y2Ba采用GO分析法进行分析(图;gydF4y2Ba2gydF4y2Bad).在共组装的54,587个unigenes中,42.70%的unigenes被标记为46个功能基团,分为细胞成分、分子功能和生物过程三类。主要的生物过程是“细胞过程”(8839;37.92%),“代谢过程”(8107;34.77%),“对刺激的反应”(3243;13.91%)和“生物调控”(3070;13.16%),而对于“分子功能”,主要过程是“结合”(8344;35.79%),“催化活性”(8011;34.36%),“转录调节活性”(1785;7.65%)和“转运体活动”(1268;5.43%)。 For ‘cellular components’ we found ‘cell’ (11,675; 50.08%), ‘organelle’ (6971; 29.90%) and ‘organelle part’ (2336; 10.02%).
通过功能富集的方法,研究了植物叶片外植体不定根发育过程中被激活的代谢过程gydF4y2Ba答:euchroma。gydF4y2Ba器官发育(GO)gydF4y2Ba:gydF4y2Ba0048513)、解剖结构发育(GO: 0048856)、发育过程(GO: 0032502)以及对刺激的反应(GO: 004222)、应激(GO: 0006950)、非生物刺激(GO: 0009628)和有机物(GO: 0010033)是高度丰富的生物过程(补充图)。gydF4y2BaS2gydF4y2Baa)和结合(GO: 0005488)、跨膜转运蛋白活性(GO: 0022857)、催化活性(GO: 0003824)、氧化还原酶活性(GO: 0016491)和水解酶活性(GO: 0016787)是高度鉴定的分子功能(补充图)。gydF4y2BaS2gydF4y2Bab).在细胞成分类别中,叶外植体不定根形成过程中细胞质(GO: 0005737)、细胞器(GO: 0043226)、膜(GO: 0016020)、线粒体(GO: 0005739)和细胞核(GO: 0005634)富集gydF4y2Ba答:euchromagydF4y2Ba(补充图。gydF4y2BaS2gydF4y2Bac). KEGG自动标注服务器(KAAS) (gydF4y2Bahttps://www.genome.jp/kegg/kaas/gydF4y2Ba)也用于识别不定根形成过程中显著调节的通路。分析显示54,587个unigenes分布在428个生物通路中,其中前20个通路如图所示。gydF4y2Ba2gydF4y2Bac)。gydF4y2Ba
不定根发育过程中差异表达单基因(DEGs)的鉴定gydF4y2Ba
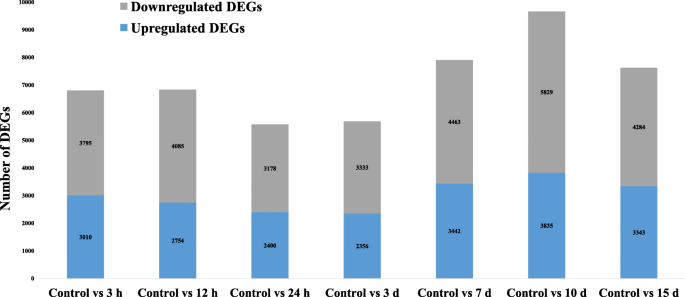
植物叶片离体不定根形成过程中的DEGsgydF4y2Ba答:euchromagydF4y2Ba分别在3 h、12 h、24 h、3 d、7 d、10 d、15 d的时间点采用IDEG6程序进行鉴定。gydF4y2Ba3.gydF4y2Ba)(补充表SgydF4y2Ba3.gydF4y2Baa & b)。将单个采样时间与完整叶片进行比较,作为对照。折叠变化(FC)表达水平≥1.0和gydF4y2BapgydF4y2Ba-value≤0.001为上调,FC≤1.0的基因为下调。在不定根形成的不同阶段共观察到50,107个deg,其中21,140个转录本上调,28,967个转录本下调。De novo DEG分析显示,不定根形成的7个时间点有6805、6839、5578、5689、7905、9664和7627个DEG。与其他不定根形成阶段相比,第10天上调的DEGs数量最多。总体而言,本研究中上调的基因数量低于下调的基因数量。叶片外植体接种后,在3 h至3 d期间,上调的DEGs数量减少,随后在不定根形成的第10天升高。第3天的表达水平似乎是不定根形成的一个中心点,从这个中心点开始,deg的数量发生了变化。接种15天后,不定根表达明显,上调的DEGs数量减少。在对本研究获得的DEGs进行下游分析后,发现大量转录本参与了植物激素介导的信号转导。其中包括生长素响应性[gydF4y2BaIAA10gydF4y2Ba(DN393_c0_g1_i1),gydF4y2BaIAA6gydF4y2Ba(DN6765_c0_g2_i1),gydF4y2BaIAA13gydF4y2Ba(DN11362_c0_g5_i1),gydF4y2BaIAA18gydF4y2Ba(DN19740_c0_g1_i4),gydF4y2BaARF8gydF4y2Ba(DN3_c1_g3_i3),gydF4y2BaARF18gydF4y2Ba(DN7598_c0_g1_i4),gydF4y2BaARF9gydF4y2Ba(DN3003_c0_g1_i4),gydF4y2BaGH3.1gydF4y2Ba(DN18251_c0_g1_i2)和gydF4y2BaGH3.6gydF4y2Ba(DN3834_c0_g1_i1)], CTK [gydF4y2BaCRE1gydF4y2Ba(DN3714_c0_g1_i15),gydF4y2Ba拟南芥gydF4y2Ba组氨酸磷酸转移酶(gydF4y2Ba层次分析法gydF4y2Ba) (DN12424_c0_g1_i2), b型拟南芥反应调节剂(gydF4y2BaB-ARRgydF4y2Ba) (DN1969_c0_g2_i3)和异戊烯基TRANSFERASES5 (gydF4y2BaIPT5)gydF4y2Ba(DN7996_c0_g1_i3)]和GA [gydF4y2BaGIBBERELLIN-INSENSITIVE DWARF2gydF4y2Ba(gydF4y2BaGID2gydF4y2Ba(DN12152_c0_g1_i1), DELLA蛋白,RalGDS-like2蛋白(gydF4y2BaRGL2gydF4y2Ba(DN8804_c0_g2_i3),光敏色素相互作用因子3 (gydF4y2BaPIF3gydF4y2Ba(DN4153_c0_g1_i6)]信号组件。此外,BRs[油菜素内酯insensitive1相关受体KINASE1 (gydF4y2BaBAK1gydF4y2Ba(DN3660_c0_g2_i1),油菜素类固醇INSENSITIVE1 (gydF4y2BaBRI1gydF4y2Ba) (DN425_c0_g2_i1;DN893_c1_g1_i2)gydF4y2BaTCH4gydF4y2Ba(DN19545_c0_g1_i1;DN1414_c0_g1_i1;DN10732_c0_g1_i3)]和苯丙氨酸代谢[gydF4y2Ba矫正性大动脉转位gydF4y2Ba(DN29918_c1_g1_i4),致病相关蛋白1 (gydF4y2BaPR1gydF4y2Ba(DN95671_c0_g1_i1)]在不定根形成过程中也有表达。除这些转录本外,与生长素与JA相互作用有关的DEGs [gydF4y2BaTIF9gydF4y2Ba(DN13128_c0_g1_i3)和gydF4y2BaMYC2gydF4y2Ba(DN2592_c0_g1_i6)]gydF4y2BaERF114gydF4y2Ba(DN3647_c0_g3_i1)也在此过程中表达。gydF4y2Ba
基于这些结果,gydF4y2BaIAA13gydF4y2Ba(DN11362_c0_g5_i1)在初始阶段(3 ~ 24 h)上调,而gydF4y2BaARF8gydF4y2Ba(DN3_c1_g3_i3)从12小时到15天gydF4y2BaGH3.1gydF4y2Ba(DN18251_c0_g1_i2)贯穿不定根的形成。此外,gydF4y2BaARF9gydF4y2Ba(DN3003_c0_g1_i4)在12 h至10 d持续下调。在CTK信号的情况下,差异表达gydF4y2BaCRE1gydF4y2Ba(DN3714_c0_g1_i15)和gydF4y2Ba层次分析法gydF4y2Ba(DN12424_c0_g1_i2)磷接力介质在不定根发育过程中也被发现下调(图。gydF4y2Ba4gydF4y2Ba).有趣的是,gydF4y2BaB-ARRgydF4y2Ba(DN1969_c0_g2_i3)在叶片外植体接种第10 d后表达量最大。与GA信号相关的基因,即gydF4y2Ba德拉gydF4y2Ba(DN8804_c0_g2_i3)和gydF4y2BaPIF3gydF4y2Ba(DN4153_c0_g1_i6)在不定根的形成过程中表达下调。然而,gydF4y2BaGID2gydF4y2Ba(DN12152_c0_g1_i1)在24 h(诱导期)至7 d(起始期)表达上调,然后呈突然下调的表达模式。BRs相关基因在DEGs中的表达谱也被检测。的基因gydF4y2BaTCH4gydF4y2Ba(DN10732_c0_g1_i3)除叶片外植体接种3 h外,在不定根形成的整个过程中均有上调。此外,苯丙氨酸信号通路基因即。gydF4y2BaPR1gydF4y2Ba编码病原体相关蛋白(DN95671_c0_g1_i1)在不定根形成的不同阶段均表达下调。gydF4y2Ba
不定根形成关键途径unigenes的相对表达量(fold change 1.0)(对照vs 3 h、12 h、24 h、3 d、7 d、10 d和15 d);+u:泛素化,+p:磷酸化[gydF4y2Ba32gydF4y2Ba]gydF4y2Ba
除了植物激素外,与伤口丝裂原活化蛋白激酶(MAPK)信号相关的基因也被发现受到差异调控。其中包括CALMODULIN-4 (gydF4y2BaCAM4gydF4y2Ba) (DN10034_c0_g2_i2),丝裂原活化蛋白激酶激酶e3 (gydF4y2BaMKK3gydF4y2Ba(DN3958_c0_g1_i4),丝裂原活化蛋白KINASE8 (gydF4y2BaMPK8gydF4y2Ba(DN1916_c0_g1_i4),呼吸爆裂氧化酶同源蛋白C (gydF4y2BaRBOHCgydF4y2Ba) (DN1706_c0_g1_i1)和诱导氧化应激1 (gydF4y2BaOXI1gydF4y2Ba) (DN5508_c0_g1_i11)。从这些中,gydF4y2BaCAM4gydF4y2Ba(DN10034_c0_g2_i2)在接种3d后表达量较高gydF4y2BaMPK8gydF4y2Ba(DN1916_c0_g1_i4)表达较早,即3小时后。此外,gydF4y2BaMKK3gydF4y2Ba(DN3958_c0_g1_i4)在表达期(7-15 d)上调gydF4y2BaOXI1gydF4y2Ba(DN5508_c0_g1_i11)在所有时间点均出现下调。在不定根形成过程中,除了上述突出的基因外,还表达了两个与库建立相关的基因。这些基因分别为除瘤转化酶/细胞壁转化酶或-果糖呋喃苷酶(DN6157_c0_g2_i2)和单糖转运蛋白或单糖敏感蛋白2 (DN25_c0_g1_i6),均在3 h(诱导早期)后表达,随后下调。侧器官边界gydF4y2BaLBD16gydF4y2Ba) (DN2020_c0_g1_i1)在叶片外植体接种7 d后表达量较高。gydF4y2Ba
在细胞壁修饰蛋白中,EXPANSIN-B15 (DN144245_c0_g1_i1)、果胶酯酶抑制剂7 (DN169482_c0_g1_i1)、ENDOGLUCANASE25 (DN27221_c0_g1_i1)、富含亮氨酸的重复伸展素样蛋白2 (DN18307_c0_g1_i1)和木葡聚糖内转葡萄糖酶/水解酶蛋白4 (DN28324_c0_g1_i5)在损伤组织中表达。其中,木葡聚糖内转葡萄糖苷酶/水解酶蛋白4 (DN28324_c0_g1_i5)在接种后3至24小时内表达上调,而果胶酯酶抑制剂7 (DN169482_c0_g1_i1)和富含leucine的重复延伸素样蛋白2 (DN18307_c0_g1_i1)在接种后24小时后表达上调。gydF4y2Ba
讨论gydF4y2Ba
Arnebia euchromagydF4y2Ba它是喜马拉雅地区的一种传统植物,以其药用价值和着色颜料而闻名。对野生植物的高需求,特别是在covid-19大流行之后,需要组织培养等体外技术作为提取植物化学物质的替代来源。因此,我们尝试从叶片外植体诱导不定根gydF4y2Ba答:euchromagydF4y2Ba.试图了解不定根的诱导过程,并从不同不定根形成阶段采集样本进行转录组学研究。在这项研究中,报道了在体外条件下不定根形成过程中观察到的转录组变化。gydF4y2Ba
植物不定根发育过程中unigenes的测定gydF4y2Ba答:euchromagydF4y2Ba
从母体植物上移除的叶片组织在损伤和随后的根形成过程中会发生改变,导致基因表达的改变。为了理解这种现象,Illumina RNA-seq技术被广泛用于转录组学研究,无论有无参考信息/数据。本研究采用NovaSeq 6000平台,研究植物不定根形成过程中的基因表达gydF4y2Ba答:euchromagydF4y2Ba.有必要破译与不定根相关的分子过程,并确定可用于体外条件下操纵其生长和植物化学产物的转录本。gydF4y2Ba
不定根形成过程中的植物激素gydF4y2Ba
植物激素在不同的发育阶段,即不定根形成的诱导、启动和表达,无论是单独的还是联合的,都起着重要的作用[gydF4y2Ba5gydF4y2Ba].其中一种主要激素是生长素,它从损伤组织中发起不定根。除了内源性生长素外,也有大量报道显示其外用于不定根形成[gydF4y2Ba7gydF4y2Ba,gydF4y2Ba28gydF4y2Ba].同样,如文献所述,在不外源施用生长素的情况下,离体叶片也能诱导出这样的根gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba17gydF4y2Ba].生长素的种类和暴露时间也会影响不定根的形成[gydF4y2Ba29gydF4y2Ba].生长素还通过与CTK、ET、JA、独脚金内酯和BRs等植物激素相互作用,在植物发育过程中发挥中介作用。例如,生长素和ET协同促进初生根和根毛的生长,但在侧根形成过程中,它们的作用是拮抗的[gydF4y2Ba30.gydF4y2Ba].此外,较高的生长素浓度促进不定根诱导,但在后期(起始和表达)发挥抑制作用[gydF4y2Ba31gydF4y2Ba].然而,到目前为止还没有关于药用植物不定根形成的研究gydF4y2Ba答:euchromagydF4y2Ba据报道。因此,我们努力了解植物的体外不定根的形成过程gydF4y2Ba答:euchroma。gydF4y2Ba
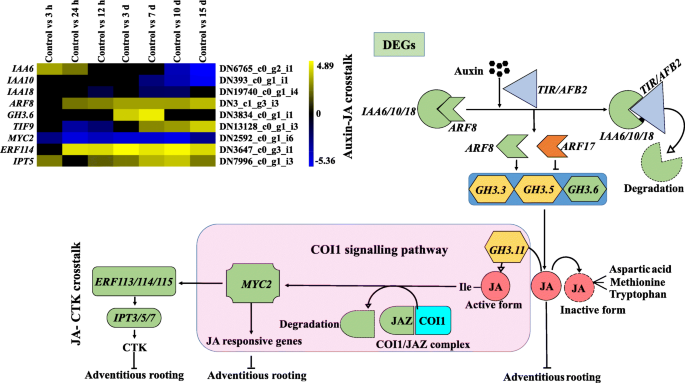
在本研究中,在deg中鉴定出植物激素相关基因。这些包括生长素、CTK、GA、BRs生物合成、JA和SA信号的转录控制(图5)。gydF4y2Ba4gydF4y2Ba) [gydF4y2Ba32gydF4y2Ba].四种生长素反应基因(gydF4y2BaIAA6gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba13gydF4y2Ba而且gydF4y2Ba18gydF4y2Ba)的差异表达,间接促进了生长素在离体不定根形成过程中的稳态。gydF4y2BaIAA6gydF4y2Ba(DN6765_c0_g2_i1)和gydF4y2BaIAA13gydF4y2Ba(DN11362_c0_g5_i1)在诱导早期表达量最高。Li et al.(2018)也报道了高表达水平gydF4y2BaIAA29gydF4y2Ba在苹果插枝不定根形成的早期,后期不定根逐渐减少[gydF4y2Ba7gydF4y2Ba].植物叶外植体再生根的研究进展gydF4y2Ba拟南芥gydF4y2Ba突变体揭示了特定的作用gydF4y2BaIAA14gydF4y2Ba,gydF4y2BaIAA18gydF4y2Ba而且gydF4y2BaIAA28gydF4y2Ba在维管增殖和根形成过程中[gydF4y2Ba33gydF4y2Ba].gydF4y2BaARF8gydF4y2Ba(DN3_c1_g3_i3)在诱导期(12 h至3 d)和表达期(10至15 d)表达增加,对不定根的形成具有积极作用gydF4y2Ba拟南芥gydF4y2Ba,在那里他们发现gydF4y2BaARF8gydF4y2Ba不定根形成的正向调节因子[gydF4y2Ba11gydF4y2Ba].gydF4y2BaGH3.1gydF4y2Ba(DN18251_c0_g1_i2)在诱导早期(12 h)表达量最高。在gydF4y2Ba答:芥gydF4y2Ba,gydF4y2BaGH3gydF4y2Ba(gydF4y2BaGH3.3gydF4y2Ba,gydF4y2BaGH3.5gydF4y2Ba而且gydF4y2BaGH3.6gydF4y2Ba)的表达在下胚轴不定根形成过程中也被生长素刺激[gydF4y2Ba12gydF4y2Ba].这些结果与我们在苹果砧木中的研究结果不一致,其中的表达gydF4y2BaGH3.1gydF4y2Ba在生根培养基中接种3 d后最高[gydF4y2Ba7gydF4y2Ba].gydF4y2Ba
除了生长素外,CTK在不定根形成中也有作用[gydF4y2Ba34gydF4y2Ba].CTK积极控制细胞分裂和芽发育。在gydF4y2Ba拟南芥gydF4y2Ba, CTK作为生长素的抑制剂,在根创建者细胞中中断PIN基因的表达,从而避免了根原基模式化所需的生长素梯度[gydF4y2Ba35gydF4y2Ba].除此之外,gydF4y2BaptRR13gydF4y2Ba,一个gydF4y2Ba杨树gydF4y2BaCTK的b型响应调节因子作用于下游并抑制不定根的形成[gydF4y2Ba18gydF4y2Ba].在目前的研究中,gydF4y2BaCRE1gydF4y2Ba(DN3714_c0_g1_i15)编码CTK信号通路的膜定位受体gydF4y2Ba层次分析法gydF4y2Ba(DN12424_c0_g1_i2)在不定根发育过程中被鉴定并下调。此外,gydF4y2BaB-ARRgydF4y2Ba(DN1969_c0_g2_i3),发现一个双组分响应调节蛋白在表达期上调,表明CTK可能参与了植物不定根发育的最后步骤gydF4y2Ba答:euchroma。gydF4y2Ba
GA控制植物生长的各个方面,如种子萌发、生殖生长、细胞伸长和开花,一般抑制不定根形成,但对根系伸长有积极作用[gydF4y2Ba36gydF4y2Ba].它通过DELLA蛋白中断生长素的极性转运,因此在不定根形成过程中,活性细胞无法形成向始祖细胞转变所需的生长素最大值[gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba].DELLA蛋白是GAI-RGA-AND-SCR (GRAS)家族的转录因子,是GA信号的负调控因子[gydF4y2Ba37gydF4y2Ba].随后的GA结合,GID1受体诱导DELLA降解gydF4y2Ba拟南芥gydF4y2Ba自洽场gydF4y2BaSLY1gydF4y2Ba或自洽场gydF4y2Ba新力gydF4y2Ba配合物(gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba,gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba].有报道揭示DELLA蛋白通过ga刺激缺失知名的PIN1和PIN2转运蛋白,阻断根尖生长素的转运[gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba],因此它的降解是正常GA信号通路和PIN蛋白积累所必需的。在目前的工作中,检测到四种与GA信号相关的deg。在这些deg中,gydF4y2BaGID2gydF4y2Ba(DN12152_c0_g1_i1)和gydF4y2BaPIN1gydF4y2Ba(DN17316_c0_g1_i1)表达上调,而gydF4y2Ba德拉gydF4y2Ba(DN8804_c0_g2_i3)和转录因子(gydF4y2Ba特遣部队gydF4y2Ba(DN4153_c0_g1_i6)在不定根发育的各个阶段均表达下调。综上所述,本研究中DELLA的持续下调可能导致了gydF4y2BaPIN1gydF4y2Ba(DN17316_c0_g1_i1)。因此,这表明生长素在不定根发育过程中与GA串扰。相反,GAs也被发现抑制不定根的形成gydF4y2Ba受欢迎的gydF4y2Ba而且gydF4y2Ba拟南芥gydF4y2Ba通过干扰生长素的运输[gydF4y2Ba45gydF4y2Ba].因此,ga -生长素相关基因可能在植物不定根的发育中起着至关重要的作用gydF4y2Ba答:euchroma。gydF4y2Ba
此外,生长素与br的相互作用对不定根的形成也是必不可少的。这些激素被发现可控制细胞扩张、增殖、血管分化和根的生长[gydF4y2Ba46gydF4y2Ba].在gydF4y2Ba拟南芥gydF4y2Ba时,侧根起始受到BRs的影响,并以生长素运输依赖的方式[gydF4y2Ba46gydF4y2Ba].在目前的调查中,gydF4y2BaBRI1gydF4y2Ba(DN425_c0_g2_i1)在诱导3 h后(早期诱导期)出现差异表达,并似乎与之相互作用gydF4y2BaBAK1gydF4y2Ba(DN3660_c0_g2_i1)受体(10 d)形成BRI1/BAK1复合物。已知该复合物可抑制糖原合酶激酶3 (gydF4y2BaGSK3gydF4y2Ba)/SHAGGY,进而激活BRs响应基因,即BRASSINAZOLE-RESISTANT1 (gydF4y2BaBZR1gydF4y2Ba).除此之外,gydF4y2BaTCH4gydF4y2Ba(DN10732_c0_g1_i3), BRs信号的下游调控因子在3小时后(早期诱导期)表达量最高,随后表达量下降[gydF4y2Ba47gydF4y2Ba].gydF4y2Ba
此外,生长素与JA、CTK在不定根形成过程中的相互作用在本研究中也很明显[gydF4y2Ba32gydF4y2Ba].在各种助教中,gydF4y2BaARF8gydF4y2Ba(DN3_c1_g3_i3)和gydF4y2BaGH3.6gydF4y2Ba(DN3834_c0_g1_i1)均有差异表达。gydF4y2BaARF8gydF4y2Ba(DN3_c1_g3_i3)的表达在三个不定根形成阶段均上调gydF4y2BaGH3.6gydF4y2Ba(DN3834_c0_g1_i1)仅在起始期表达较高。在gydF4y2Ba拟南芥gydF4y2Ba,蛋白酶体介导的分解gydF4y2BaIAA6gydF4y2Ba/gydF4y2Ba10gydF4y2Ba/gydF4y2Ba18gydF4y2Ba转运抑制因子1/生长素信号通路F-BOX2 (gydF4y2BaTIR1 / AFB2gydF4y2Ba)生长素受体促进植物的转录活性gydF4y2Ba东盟地区论坛gydF4y2Ba其作用于JA信号通路的上游[gydF4y2Ba48gydF4y2Ba].这些gydF4y2Ba东盟地区论坛gydF4y2Ba的表达是否上调gydF4y2BaGH3.3gydF4y2Ba,gydF4y2BaGH3.5gydF4y2Ba而且gydF4y2BaGH3.6gydF4y2Ba编码酰基酸酰胺合成酶的蛋白质[gydF4y2Ba12gydF4y2Ba].在gydF4y2Ba拟南芥gydF4y2Ba,这些酶被发现负责氨基酸共轭JA,一种已知的不定根形成的抑制剂[gydF4y2Ba12gydF4y2Ba].已知JA通过抑制b型CYCLIN依赖激酶的转录来抑制细胞分裂[gydF4y2Ba49gydF4y2Ba].如前所述,转录抑制gydF4y2BaIAA6gydF4y2Ba/gydF4y2Ba10gydF4y2Ba/gydF4y2Ba18gydF4y2Ba是负责上调表达的吗gydF4y2BaARF8gydF4y2Ba(DN3_c1_g3_i3),随后激活gydF4y2BaGH3.6gydF4y2Ba(DN3834_c0_g1_i1)。很可能,这种激活通过共轭作用导致了ja -色氨酸非活性复合物的形成(图。gydF4y2Ba5gydF4y2Ba).这可能会触发细胞分裂相关基因的表达,导致不定根的形成。关于JA信号通路,gydF4y2BaTIF9gydF4y2Baa JASMONATE ZIM DOMAIN (DN13128_c0_g1_i3)gydF4y2BaJAZgydF4y2Ba)辅受体和gydF4y2BaMYC2gydF4y2Ba(DN2592_c0_g1_i6)在不定根形成的不同阶段均有差异表达。gydF4y2BaTIF9gydF4y2Ba(转录抑制因子)在起始和表达阶段上调,而gydF4y2BaMYC2gydF4y2Ba(转录激活因子)在不定根形成过程中被发现下调gydF4y2Ba答:euchromagydF4y2Ba.这些转录因子,即。gydF4y2BaTIF9gydF4y2Ba而且gydF4y2BaMYC2gydF4y2Ba是JA依赖基因的已知调节因子[gydF4y2Ba50gydF4y2Ba].很明显,上调的gydF4y2BaTIF9gydF4y2Ba可能是降低表达的原因gydF4y2BaMYC2gydF4y2Ba从而抑制JA反应基因。根据目前的结果,上调的表达gydF4y2BaJAZ12gydF4y2Ba而且gydF4y2Ba26gydF4y2Ba在苹果扦插不定根发育起始期和表达期均有报道[gydF4y2Ba7gydF4y2Ba].同样的,gydF4y2BaMYC2gydF4y2Ba在不定根诱导过程中被发现下调gydF4y2Ba拟南芥gydF4y2Ba下胚轴(gydF4y2Ba12gydF4y2Ba].此外,gydF4y2BaMYC2gydF4y2Ba也调节机械损伤诱导的乙烯反应因子(gydF4y2Ba小块土地gydF4y2Ba) [gydF4y2Ba51gydF4y2Ba,gydF4y2Ba52gydF4y2Ba].已知这些因子在JA信号通路下游起作用,并激活蛋白的表达gydF4y2BaIPT 3/5/7gydF4y2Ba,在CTK生物合成中起重要作用[gydF4y2Ba53gydF4y2Ba].很大程度上,gydF4y2BaERF114gydF4y2Ba(DN3647_c0_g3_i1)和gydF4y2BaIPT5gydF4y2Ba(DN7996_c0_g1_i3)除3 h和12 h外,其余各相均上调(图;gydF4y2Ba5gydF4y2Ba) [gydF4y2Ba32gydF4y2Ba].由此可见,JA和CTK相关基因可能在不定根形成过程中与生长素信号通路相互作用gydF4y2Ba答:euchromagydF4y2Ba.gydF4y2Ba
植物生长素与茉莉酸(JA)和细胞分裂素(CTK)的相互作用gydF4y2Ba答:euchromagydF4y2Ba体外条件下的不定根[gydF4y2Ba32gydF4y2Ba]gydF4y2Ba
总的来说,不同的植物激素形成了一个复杂的网络,在不同水平上相互作用,影响不定根的形成。从以上结果和讨论可以推断,生长素、CTK、GAs、BRs和JA信号通路相关基因的差异表达在不定根的形成中起着重要作用gydF4y2Ba答:euchroma。gydF4y2Ba
损伤相关的MAPK信号通路gydF4y2Ba
机械损伤、食草动物或昆虫攻击引起的伤害会产生各种信号,引发一系列生理过程。然而,这些信号在植物再生以及受损组织的愈合或防御中的作用模式尚未被充分探索[gydF4y2Ba54gydF4y2Ba].损伤后,胞质CagydF4y2Ba2 +gydF4y2Ba快速增长,刺激gydF4y2Ba摄像头gydF4y2Ba,即CagydF4y2Ba2 +gydF4y2Ba已知的介导细胞间钙的结合蛋白gydF4y2Ba2 +gydF4y2Ba通路。这导致了Ca的形成gydF4y2Ba2 +gydF4y2Ba/CAM复合物,在活性氧(ROS)清除中发挥重要作用[gydF4y2Ba55gydF4y2Ba].gydF4y2Ba
同样,在本研究中发现了5个与伤口MAPK信号通路相关的deg(图。gydF4y2Ba6gydF4y2Ba) [gydF4y2Ba32gydF4y2Ba].这些包括gydF4y2BaCAM4gydF4y2Ba(DN10034_c0_g2_i2),gydF4y2BaMPK8gydF4y2Ba(DN1916_c0_g1_i4),gydF4y2BaMKK3gydF4y2Ba(DN3958_c0_g1_i4)和gydF4y2BaRBOHCgydF4y2Ba(DN1706_c0_g1_i1)。gydF4y2BaCAM4gydF4y2Ba3 d后(诱导期)表达量较高gydF4y2BaMPK8gydF4y2Ba,gydF4y2BaMKK3gydF4y2Ba而且gydF4y2BaRBOHCgydF4y2Ba在表达阶段得到表达。MPK8是一种蛋白激酶gydF4y2BaCAM4gydF4y2Ba或gydF4y2BaMKK3gydF4y2Ba独立调控的表达gydF4y2BaRBOHCgydF4y2Ba和损伤引发的ROS稳态[gydF4y2Ba55gydF4y2Ba].在本研究中,gydF4y2BaRBOHCgydF4y2Ba(DN1706_c0_g1_i1)在10 d(表达期)后表达,可见创面诱导信号在不定根形成中起着至关重要的作用gydF4y2Ba答:euchromagydF4y2Ba.gydF4y2Ba
MAPK信号转录物在伤口诱导不定根形成过程中被鉴定gydF4y2Ba答:euchromagydF4y2Ba[gydF4y2Ba32gydF4y2Ba]gydF4y2Ba
细胞壁修饰gydF4y2Ba
细胞壁直接影响植物组织的生长发育。它还在抵御病原体伤害或入侵的防御机制中发挥关键作用[gydF4y2Ba56gydF4y2Ba].一般情况下,损伤引起细胞壁的机械损伤,并产生多种信号,导致质膜电位、胞内Ca的改变gydF4y2Ba2 +gydF4y2BaH的浓度和产量gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba包括激素如JA和ET [gydF4y2Ba38gydF4y2Ba].同样,在不定根诱导过程中损伤组织会引起细胞壁动力学的变化并导致其软化,这可能是新形成的不定根出现所必需的。在本研究中,发现5个基因,即EXPANSIN B-15 (DN144245_c0_g1_i1)、果胶酯酶抑制剂7 (DN169482_c0_g1_i1)、ENDOGLUCANASE25 (DN27221_c0_g1_i1)、富亮氨酸重复延伸样蛋白2 (DN18307_c0_g1_i1)和木葡聚糖内转葡萄糖酶/水解酶蛋白4 (DN28324_c0_g1_i5)存在差异表达(图28324_c0_g1_i5)。gydF4y2Ba7gydF4y2Ba).EXPANSIN B-15 (DN144245_c0_g1_i1)在不定根形成的晚期和表达阶段均有差异表达。据报道,这种膨胀素在快速生长的组织中表达,并破坏纤维素微原纤维之间的氢键,导致细胞壁松动[gydF4y2Ba57gydF4y2Ba].据报道,这些基因在模式植物不定根发育中起作用gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba58gydF4y2Ba].gydF4y2Ba
参与不定根形成的其他调节因子gydF4y2Ba
LBD16/18gydF4y2Ba在伤口诱导、下胚轴诱导不定根形成中起重要作用gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba59gydF4y2Ba].在目前的研究中,gydF4y2BaLBD16gydF4y2Ba此外,β -果糖呋喃苷酶/细胞壁转化酶(DN6157_c0_g2_i2)和单糖转运蛋白/单糖感应蛋白1 (DN25_c0_g1_i6)在诱导早期表达差异,但在不定根形成的后续阶段表达下降。-果糖呋喃糖苷酶又称细胞壁转化酶(EC 3.2.1.26),负责将蔗糖水解为葡萄糖和果糖,是碳代谢、储存和运输所必需的[gydF4y2Ba60gydF4y2Ba].而单糖转运蛋白则参与了这些水解产物向损伤组织的转运。因此两者对于不定根的形成都是至关重要的gydF4y2Ba答:euchromagydF4y2Ba.同样,Ahkami等人(2014)报道了这两种蛋白在不定根诱导中的作用gydF4y2Ba佩妮gydF4y2Ba岩屑(gydF4y2Ba61gydF4y2Ba].gydF4y2Ba
结论gydF4y2Ba
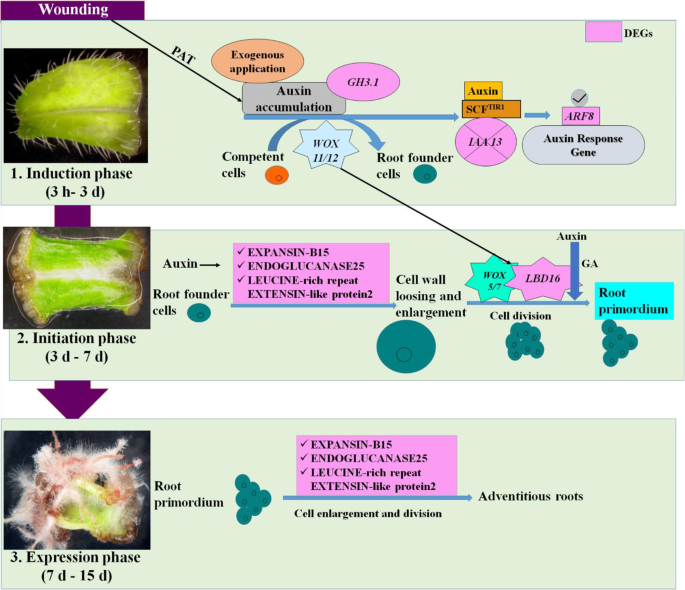
考虑到体外诱导不定根作为植物化学物质替代来源的潜力,有必要了解其诱导机制并确定对高效工艺开发至关重要的因素。因此,通过转录组学分析来了解叶诱导不定根的形成gydF4y2Ba答:euchromagydF4y2Ba.研究揭示了不定根形成的三个不同生理阶段,即诱导、起始和表达。目前的研究结果揭示了植物激素信号通路在不定根形成中的作用,然而,在将其应用于商业体外系统之前,单个基因的贡献还有待证实。基于我们的结果,一个不定根形成的假设模型如图所示。gydF4y2Ba8gydF4y2Ba.gydF4y2Ba
方法gydF4y2Ba
植物材料与不定根的体外诱导gydF4y2BaArnebia euchromagydF4y2Ba
Arnebia euchromagydF4y2Ba植物采自印度喜马偕尔邦斯皮提山谷的Kibber(32.33°N, 78.00°E),并在多房条件下养护(年温度范围:20-30°C;相对湿度60-70%)在CSIR-IHBT Palampur。目前研究中使用的植物材料的正式鉴定是由CSIR-IHBT Palampur的Shashi Bhushan博士完成的。植物样本保存在机构植物标本馆的样品凭证,编号为PLP18571。用蒸馏水冲洗健康植物的根茎嫩芽,去除灰尘颗粒,用吐温-20刷7-8分钟。然后,用0.05% (w/v)巴伐菌素和硫酸链霉素(0.05% w/v)对这些芽进行表面消毒8-10分钟,然后用氯化汞(0.02%,w/v)如前所述[gydF4y2Ba62gydF4y2Ba].表面消毒后,将芽垂直接种于增加激动素(1.0 mg/L)的Murashige和Skoog培养基中。培养基在121℃温度下灭菌15 min。在恒温(25±2℃)的无菌培养室内,在16/8小时的光周期下培养。接种1个月后,芽开放,增殖成芽。gydF4y2Ba答:euchromagydF4y2Ba将无菌芽叶片分离,切成4 ~ 5 mm的小段,接种在添加2.5 mg/L IBA、3%蔗糖和0.25% CleriGel (HiMedia)的SH培养基上诱导不定根。为了进行转录组分析,每个培养皿分别在3 h、12 h、24 h、3 d、7 d、10 d和15 d后采样4个外植体(2个重复)。然后在分离RNA之前,将样本立即在液氮中冷冻并保存在−80°C下。从嫩枝上取下的完整叶片立即冷冻,作为实验的对照。gydF4y2Ba
总RNA分离,mRNA文库制备和测序gydF4y2Ba
总RNA采用宿主研究所以前开发的iRIS方法分离[gydF4y2Ba63gydF4y2Ba].然后分别使用nanodrop 1000分光光度计(美国赛默飞世尔科学公司)和Bioanalyzer RNA纳米芯片(美国安捷伦2100技术公司)对总RNA进行质量和数量评估。取两个独立的生物重复进行进一步实验。每个重复的高质量总RNA (5.0 μg)使用TruSeq mRNA标准样品Prep Kit v2 (Illumina Inc., USA)按照制造商说明制备cDNA文库。然后通过荧光定量系统(Qubit, Life Technologies, USA)使用dsDNA HS检测试剂盒对纯化的cDNA文库进行定量。使用Bioanalyzer DNA 1000芯片确认文库插入大小约为260 bps。共制备了16个独立的配对端文库,随后变性并在400 pM加载,使用NovaSeq 6000平台进行高通量DNA测序。gydF4y2Ba
数据处理和从头组装gydF4y2Ba
用于cDNA文库制备的适配器序列和NovaSeq 6000平台测序生成的原始reads按照默认的trimmomatic参数进行质量评估,过滤掉适配器和低质量碱基。此外,丢弃< 200bps的短contigs也提高了读取质量。使用Trinity程序将8个样本k-mer长度为25bps的高质量清洁reads (gydF4y2Bahttps://github.com/trinityrnaseq/trinityrnaseq/wikigydF4y2Ba) [gydF4y2Ba64gydF4y2Ba].为了从剩余的转录本中预测开放阅读帧,Trans Decoder (gydF4y2Bahttp://transdecoder.github.iogydF4y2Ba)进行编码序列区域的识别。这些组装的序列被称为unigenes,并以高容差同一性(CD-HIT)程序(gydF4y2Bahttps://github.com/weizhongli/cdhitgydF4y2Ba(−c 0.95 -T 8 -M 2000-gap−2),通过丢弃重复序列来获得非冗余的unigenes,并进一步对其进行注释和功能分析。转录组分析数据被提交到NCBI SRA数据库(登录号PRJNA695864)供公众使用。gydF4y2Ba
假定文本的计算注释gydF4y2Ba
采用BLASTx算法对不同数据库的unigenes进行检测,E-value参数设为1e-05。数据库包括SwissProt (gydF4y2Bahttps://www.uniprot.orggydF4y2Ba), kegg (gydF4y2Bahttps://www.genome.jp/kegggydF4y2Ba), cog (gydF4y2Bahttps://www.ncbi.nlm.nih.gov/research/cog/gydF4y2Ba), Nr (gydF4y2Bahttps://ftp.ncbi.nlm.nih.gov/blast/dbgydF4y2Ba)及TAIR (gydF4y2Bahttps://www.arabidopsis.org/downloadgydF4y2Ba).使用agriGO对全部转录本进行GO,以确定其功能注释[gydF4y2Ba65gydF4y2Ba].此外,还利用KAAS分析了组装unigenes的通路富集分析(gydF4y2Bahttps://www.genome.jp/kegg/kaasgydF4y2Ba/) (gydF4y2Ba66gydF4y2Ba].本研究中用于转录组分析的数据库的总体信息如图所示。gydF4y2Ba1 jgydF4y2Ba.gydF4y2Ba
In-silicogydF4y2Ba差异表达转录本分析gydF4y2Ba
植物叶片外植体中各单基因的表达量gydF4y2Ba答:euchromagydF4y2Ba与对照组在不同时间间隔进行比较,并通过Trinity软件进行分析。在从头转录组分析中,丰度通过期望最大化(RSEM)包的RNA-Seq预测和归一化(gydF4y2Bahttp://deweylab.biostat.wisc.edu/rsem/gydF4y2Ba).利用edgeR包对转录本进行差异表达[gydF4y2Ba67gydF4y2Ba]与叶片外植体接种后3 h、12 h、24 h、3 d、7 d、10 d和15 d比较。识别deg的关键选择标准为:Log FC≥1.0和gydF4y2Bap -gydF4y2Ba当FC≤1.0时,取值≤0.001gydF4y2BapgydF4y2Ba-value≤0.001,为下调的deg。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
转录组分析数据提交到NCBI SRA数据库,由BioProject PRJNA695864 (gydF4y2Bahttps://dataview.ncbi.nlm.nih.gov/object/PRJNA695864?reviewer=2ev0m5a9ekgim1293n69cmq72dgydF4y2Ba).所使用的所有数据集都是开源的,并在手稿中适当引用了相同的链接。gydF4y2Ba
缩写gydF4y2Ba
- 答:euchromagydF4y2Ba:gydF4y2Ba
-
Arnebia euchromagydF4y2Ba
- h:gydF4y2Ba
-
小时gydF4y2Ba
- d:gydF4y2Ba
-
天gydF4y2Ba
- 个基点:gydF4y2Ba
-
碱基对gydF4y2Ba
- 是:gydF4y2Ba
-
茉莉酸gydF4y2Ba
- 等:gydF4y2Ba
-
乙烯gydF4y2Ba
- WOX11/12gydF4y2Ba:gydF4y2Ba
-
与wuscher相关的home box11/12gydF4y2Ba
- ARF6gydF4y2Ba:gydF4y2Ba
-
生长素反应因子6gydF4y2Ba
- ARF8gydF4y2Ba:gydF4y2Ba
-
生长素反应因子8gydF4y2Ba
- GH3gydF4y2Ba:gydF4y2Ba
-
格雷琴HAGEN3gydF4y2Ba
- 销gydF4y2Ba:gydF4y2Ba
-
销形成gydF4y2Ba
- ABCBgydF4y2Ba:gydF4y2Ba
-
ATP结合卡带B型gydF4y2Ba
- 与原:gydF4y2Ba
-
细胞分裂素gydF4y2Ba
- br:gydF4y2Ba
-
BrassinosteroidsgydF4y2Ba
- 阿坝:gydF4y2Ba
-
脱落酸gydF4y2Ba
- 遗传算法:gydF4y2Ba
-
赤霉酸gydF4y2Ba
- IBA:gydF4y2Ba
-
Indole-3-butyric酸gydF4y2Ba
- 承宪:gydF4y2Ba
-
Schenk & HildebrandtgydF4y2Ba
- CPM:gydF4y2Ba
-
每百万计数gydF4y2Ba
- TPM:gydF4y2Ba
-
每百万抄本数gydF4y2Ba
- RPKM:gydF4y2Ba
-
每公斤转录本的读数,每百万的映射读数gydF4y2Ba
- 走:gydF4y2Ba
-
基因本体论gydF4y2Ba
- KEGG:gydF4y2Ba
-
基因和基因组的京都百科全书gydF4y2Ba
- Nr:gydF4y2Ba
-
NCBI非冗余数据库gydF4y2Ba
- 齿轮:gydF4y2Ba
-
正交基团簇gydF4y2Ba
- TAIR:gydF4y2Ba
-
拟南芥信息资源库gydF4y2Ba
- 成熟:gydF4y2Ba
-
KEGG自动注释服务器gydF4y2Ba
- 度:gydF4y2Ba
-
差异表达的unigenesgydF4y2Ba
- 层次分析法gydF4y2Ba:gydF4y2Ba
-
拟南芥gydF4y2Ba组氨酸磷酸转移酶gydF4y2Ba
- B-ARRgydF4y2Ba:gydF4y2Ba
-
b型拟南芥反应调节剂gydF4y2Ba
- GID2gydF4y2Ba:gydF4y2Ba
-
GIBBERELLIN-INSENSITIVE DWARF2gydF4y2Ba
- RGLgydF4y2Ba:gydF4y2Ba
-
RalGDS-like2蛋白质gydF4y2Ba
- PIF3gydF4y2Ba:gydF4y2Ba
-
PHYTOCHROME-INTERACTING FACTOR3gydF4y2Ba
- BAK1gydF4y2Ba:gydF4y2Ba
-
油菜素类固醇不敏感1相关受体激酶1gydF4y2Ba
- BRI1gydF4y2Ba:gydF4y2Ba
-
BRASSINOSTEROID INSENSITIVE1gydF4y2Ba
- PR1gydF4y2Ba:gydF4y2Ba
-
PATHOGENESIS-RELATED PROTEIN1gydF4y2Ba
- MAPKgydF4y2Ba:gydF4y2Ba
-
丝裂原活化蛋白激酶gydF4y2Ba
- CAM4gydF4y2Ba:gydF4y2Ba
-
CALMODULIN4gydF4y2Ba
- MKK3gydF4y2Ba:gydF4y2Ba
-
丝裂原活化蛋白激酶3gydF4y2Ba
- MPK8gydF4y2Ba:gydF4y2Ba
-
丝裂原活化蛋白激酶gydF4y2Ba
- RBOHCgydF4y2Ba:gydF4y2Ba
-
呼吸爆裂氧化酶同源蛋白cgydF4y2Ba
- OXI1gydF4y2Ba:gydF4y2Ba
-
诱导氧化应激gydF4y2Ba
- LBD16gydF4y2Ba:gydF4y2Ba
-
侧边器官的边界发生了变化gydF4y2Ba
- 肝:gydF4y2Ba
-
GAI-RGA-AND-SCRgydF4y2Ba
- GSK3gydF4y2Ba:gydF4y2Ba
-
糖原合成酶激酶3gydF4y2Ba
- TIR1 / AFB2gydF4y2Ba:gydF4y2Ba
-
运输抑制反应1/生长素信号f-box2gydF4y2Ba
- BZR1gydF4y2Ba:gydF4y2Ba
-
BRASSINAZOLE-RESISTANT1gydF4y2Ba
- 小块土地gydF4y2Ba:gydF4y2Ba
-
乙烯响应因子115gydF4y2Ba
- IPTgydF4y2Ba:gydF4y2Ba
-
ISOPENTENYL转移酶gydF4y2Ba
- ROS:gydF4y2Ba
-
活性氧gydF4y2Ba
- mg / L:gydF4y2Ba
-
毫克/升gydF4y2Ba
- mm:gydF4y2Ba
-
毫米gydF4y2Ba
- CD-HIT:gydF4y2Ba
-
集群数据库具有较高的一致性和容忍度gydF4y2Ba
- RSEM:gydF4y2Ba
-
RNA-seq期望最大化gydF4y2Ba
- 舰队指挥官:gydF4y2Ba
-
叠化gydF4y2Ba
- RNA-seq:gydF4y2Ba
-
RNA-sequencinggydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
苏塞克斯IM。现代植物生物技术的科学根源。植物学报。2008;20(5):1189-98。gydF4y2Bahttps://doi.org/10.1105/tpc.108.058735gydF4y2Ba.gydF4y2Ba
- 2.gydF4y2Ba
下胚轴不定根器官发生与侧根发育不同。前沿植物科学,2014;5(495):1-13。gydF4y2Ba
- 3.gydF4y2Ba
Kevers C, Hausman JF, Faivre-Rampant O, Evers D, Gaspar T.激素控制不定根:进展与问题。中国科学(d辑). 1997;71(3-4):71 - l79。gydF4y2Ba
- 4.gydF4y2Ba
徐L。gydF4y2Ba新创gydF4y2Ba叶外植体的根再生:损伤、生长素和细胞命运转变。植物学报,2018;41:39-45。gydF4y2Bahttps://doi.org/10.1016/j.pbi.2017.08.004gydF4y2Ba.gydF4y2Ba
- 5.gydF4y2Ba
da Costa CT, de Almeida MR, Ruedell CM, Schwambach J, Maraschin FS, Fett-Neto AG。当压力和发育密切相关时:扦插不定根的主要激素控制。前沿植物学报2013;4:1-19。gydF4y2Ba
- 6.gydF4y2Ba
杜瑞杰,李志强,李志强,等。转录组分析显示乙烯是不定根形成的刺激因子,生长素是不定根形成的调节因子gydF4y2Ba佩妮gydF4y2Ba岩屑。前沿植物科学,2014;5(494):1-19。gydF4y2Ba
- 7.gydF4y2Ba
李凯,梁勇,邢林,毛健,刘震,董峰,等。转录组分析表明,多种激素、损伤和糖信号通路介导苹果砧木不定根的形成。国际分子化学杂志,2018;19(8):2201。gydF4y2Bahttps://doi.org/10.3390/ijms19082201gydF4y2Ba.gydF4y2Ba
- 8.gydF4y2Ba
余娟,刘伟,刘娟,秦鹏,徐磊。生长素对组织培养愈伤组织根器官发生的控制。中国植物科学,2017;36(4):344 - 344。gydF4y2Ba
- 9.gydF4y2Ba
Gonin M, Bergougnoux V, Nguyen TD, Gantet P, Champion A.什么是不定根?植物。2019;8(240):24。gydF4y2Ba
- 10.gydF4y2Ba
刘J,盛L,徐Y,李J,杨Z,黄H,等。WOX11和12参与了细胞命运转变的第一步gydF4y2Ba新创gydF4y2Ba根器官发生gydF4y2Ba拟南芥gydF4y2Ba.植物学报。2014;26(3):1081-93。gydF4y2Bahttps://doi.org/10.1105/tpc.114.122887gydF4y2Ba.gydF4y2Ba
- 11.gydF4y2Ba
古铁雷斯L, Bussell JD, Pacurar DI。李志刚,李志刚。植物不定根的表型可塑性研究gydF4y2Ba拟南芥gydF4y2Ba受生长素反应因子转录本和microRNA丰度的复杂调控控制。植物学报。2009;21(10):3119-32。gydF4y2Bahttps://doi.org/10.1105/tpc.108.064758gydF4y2Ba.gydF4y2Ba
- 12.gydF4y2Ba
Gutierrez L, Mongelard G, Flokov K, Pacurar DI, Novak O, Staswick P,等。生长素控制gydF4y2Ba拟南芥gydF4y2Ba调控茉莉酸稳态的不定根形成。植物学报。2012;24(6):2515-27。gydF4y2Bahttps://doi.org/10.1105/tpc.112.099119gydF4y2Ba.gydF4y2Ba
- 13.gydF4y2Ba
石口,田中K,酒井T,杉原S,河卫H,夏目石M,等。生长素的主要生物合成途径gydF4y2Ba拟南芥gydF4y2Ba.中国科学(d辑:自然科学),2011;29(4):344 - 344。gydF4y2Bahttps://doi.org/10.1073/pnas.1108434108gydF4y2Ba.gydF4y2Ba
- 14.gydF4y2Ba
李艳红,邹明明,冯博明,黄霞,张忠,孙gm .芒果生长素外排载体及不定根形成相关基因的克隆与鉴定(gydF4y2BaMangifera籼gydF4y2BaL.)子叶裂片。植物化学学报。2012;55:33-42。gydF4y2Ba
- 15.gydF4y2Ba
杨杨,李志强,李志强,等。gydF4y2Ba辅助/松懈gydF4y2Ba基因编码一个生长素流入转运体家族,在生长过程中发挥不同的功能gydF4y2Ba拟南芥gydF4y2Ba发展。植物学报。2012;24(7):2874-85。gydF4y2Bahttps://doi.org/10.1105/tpc.112.097766gydF4y2Ba.gydF4y2Ba
- 16.gydF4y2Ba
Busov V, Meilan R, Pearce DW, Rood SB, Ma C, Tschaplinski TJ,等。转基因改良gydF4y2Ba时至今日gydF4y2Ba或gydF4y2Bargl1gydF4y2Ba导致矮化和改变赤霉素,根生长,和代谢产物的概况gydF4y2Ba杨树gydF4y2Ba.足底。2006;224(2):288 - 99。gydF4y2Bahttps://doi.org/10.1007/s00425-005-0213-9gydF4y2Ba.gydF4y2Ba
- 17.gydF4y2Ba
陈长武,杨耀文,吕海生,蔡永刚,张春春。脱落酸在水稻调控中的新功能(gydF4y2Ba栽培稻gydF4y2BaL.)根系生长发育。植物物理学报。2006;47(1):1 - 13。gydF4y2Bahttps://doi.org/10.1093/pcp/pci216gydF4y2Ba.gydF4y2Ba
- 18.gydF4y2Ba
Ramirez-Carvajal GA, Morse AM, Dervinis C, Davis JM。细胞分裂素b型反应调节剂gydF4y2BaPtRR13gydF4y2Ba不定根发育的负调节因子在吗gydF4y2Ba杨树gydF4y2Ba.植物科学进展。2009;30(2):339 - 344。gydF4y2Bahttps://doi.org/10.1104/pp.109.137505gydF4y2Ba.gydF4y2Ba
- 19.gydF4y2Ba
Bergonci T, Ribeiro B, Ceciliato PH, Guerrero-Abad JC, Silva-Filho MC, Moura DS。gydF4y2Ba拟南芥gydF4y2BaRALF1反对油菜素类固醇对根细胞伸长和侧根形成的影响。中国机械工程学报,2014;26(3):344 - 344。gydF4y2Bahttps://doi.org/10.1093/jxb/eru099gydF4y2Ba.gydF4y2Ba
- 20.gydF4y2Ba
李国强,李国强,李国强,李国强。乙烯在调节番茄生长素依赖的侧根和不定根形成中的作用的遗传解剖。植物学报,2010;36(1):1 - 5。gydF4y2Bahttps://doi.org/10.1111/j.1365-313X.2009.04027.xgydF4y2Ba.gydF4y2Ba
- 21.gydF4y2Ba
斋藤T, Opio P,王S,大川K,近藤S,前岛T,等。Marubakaido苹果砧木不定根形成过程中生长素、细胞分裂素、脱落酸和植物肽反应基因的关系(gydF4y2Baprunifolia BorkhgydF4y2Ba.麻美(Var. ringo Asami)。植物学报。2019;41:1-10。gydF4y2Ba
- 22.gydF4y2Ba
李文文,冷云,史rf。一氧化氮诱导绿豆幼苗不定根早期基因谱的转录组特征。中国植物学报,2010;39(1):430-55。gydF4y2Bahttps://doi.org/10.1007/s00344-019-09993-ygydF4y2Ba.gydF4y2Ba
- 23.gydF4y2Ba
白琪,穆西,韩艳杰,钟俊杰。大规模培养人参不定根生产人参皂苷。生物化学工程师/生物技术。2009; 113:151 - 76。gydF4y2Ba
- 24.gydF4y2Ba
崔斯敏,何ss,罗YS,权乌,宣志华,白基。在生物反应器系统中试规模培养人参不定根。植物细胞组织与器官科学,2000;(3):187-93。gydF4y2Bahttps://doi.org/10.1023/A:1006412203197gydF4y2Ba.gydF4y2Ba
- 25.gydF4y2Ba
张志刚,张志刚。药用植物不定根培养产生次生代谢产物的研究进展。植物学报,2019;46(3):143-57。gydF4y2Bahttps://doi.org/10.5010/JPB.2019.46.3.143gydF4y2Ba.gydF4y2Ba
- 26.gydF4y2Ba
安杜贾尔I,雷西奥MC,吉纳RM,里奥斯JL。中药辨析:紫草素用于抗癌治疗的药理学基础。中国生物医学工程学报,2013;20(23):2892-8。gydF4y2Bahttps://doi.org/10.2174/09298673113209990008gydF4y2Ba.gydF4y2Ba
- 27.gydF4y2Ba
Malik S, Bhushan S, Sharma M, Ahuja PS.紫草素生产的生物技术方法:综述及最新进展。生物技术学报。2014;36(2):1-14。gydF4y2Ba
- 28.gydF4y2Ba
马巴克,韩艳杰,白琪。生长素和光质对巴戟天叶片外植体不定根诱导机制的影响。中国生物医学工程学报。2010;46(1):71-80。gydF4y2Bahttps://doi.org/10.1007/s11627-009-9261-3gydF4y2Ba.gydF4y2Ba
- 29.gydF4y2Ba
朴世华,王华,徐安,王安。植物不定根的形成gydF4y2Ba在体外gydF4y2Ba桃芽受生长素和乙烯的调控。科学通报,2017;26(6):344 - 344。gydF4y2Bahttps://doi.org/10.1016/j.scienta.2017.08.053gydF4y2Ba.gydF4y2Ba
- 30.gydF4y2Ba
秦华,黄蓉。乙烯控制生长素对植物根系发育的调控作用。中华分子化学杂志,2018;19(11):3656。gydF4y2Bahttps://doi.org/10.3390/ijms19113656gydF4y2Ba.gydF4y2Ba
- 31.gydF4y2Ba
德克勒克GJ,德克里肯W,德容JC。复习——不定根的形成:新概念,新可能性。中国生物医学工程学报,1999;35(3):189-99。gydF4y2Bahttps://doi.org/10.1007/s11627-999-0076-zgydF4y2Ba.gydF4y2Ba
- 32.gydF4y2Ba
卡内久M,后藤S. KEGG:基因和基因组百科全书。核酸Res. 2000; 28:27-30。gydF4y2Bahttps://doi.org/10.1093/nar/28.1.27gydF4y2Ba.gydF4y2Ba
- 33.gydF4y2Ba
Bustillo-Avendano E, Ibanez S, San O, Barros JAS, Gude I, Perianez-Rodriguez J.激素控制的调节,细胞重编程和模式gydF4y2Ba新创gydF4y2Ba根器官形成。中国生物医学工程学报,2018;36(2):379 - 379。gydF4y2Bahttps://doi.org/10.1104/pp.17.00980gydF4y2Ba.gydF4y2Ba
- 34.gydF4y2Ba
李志强,李志强,李志强,等。豌豆不定根形成过程中内源细胞分裂素含量的变化。植物科学进展。1988;32(3):366 - 366。gydF4y2Bahttps://doi.org/10.1016/s0176 - 1617 (88) 80102 - 0gydF4y2Ba.gydF4y2Ba
- 35gydF4y2Ba
拉普拉兹L, Benkova E, Casimiro I, Maes L, Vanneste S, Swarup R,等。细胞分裂素直接作用于侧根奠基者细胞,抑制根的起始。《植物科学》2007;19:3889-900。gydF4y2Ba
- 36.gydF4y2Ba
牛松,李忠,袁浩,方鹏,陈霞,李伟。赤霉素在烟草维管组织中的定位是调控烟草不定根发育的必要条件。中国机械工程学报,2013;26(4):344 - 344。gydF4y2Bahttps://doi.org/10.1093/jxb/ert186gydF4y2Ba.gydF4y2Ba
- 37.gydF4y2Ba
魏斯D,欧瑞N.赤霉素与其他激素之间的相互作用机制。植物科学进展。2007;32(3):344 - 344。gydF4y2Bahttps://doi.org/10.1104/pp.107.100370gydF4y2Ba.gydF4y2Ba
- 38.gydF4y2Ba
德维J,库马尔R,辛格K,格洛A,布山S,库马尔S。gydF4y2Ba在体外gydF4y2Ba不定根:在工业规模上生产植物成分的一种非破坏性技术。中国生物医学工程学报。2017;26(4):564-79。gydF4y2Bahttps://doi.org/10.1080/07388551.2020.1869690gydF4y2Ba.gydF4y2Ba
- 39.gydF4y2Ba
Mcginnis KM, Thomas SG, Soule JD, Strader LC, Zale JM, Sun TP,等。的gydF4y2Ba拟南芥gydF4y2BaSLEEPY1基因编码一个假定的scfe3泛素连接酶的F-box亚基。植物学报。2003;15(5):1120-30。gydF4y2Bahttps://doi.org/10.1105/tpc.010827gydF4y2Ba.gydF4y2Ba
- 40.gydF4y2Ba
邓丽娟,胡娟,孙春平,王志强,王志强。的gydF4y2Ba拟南芥gydF4y2BaF-box蛋白SLEEPY1针对赤霉素信号阻遏物进行赤霉素诱导的降解。《植物科学》2004;16(6):1392-405。gydF4y2Bahttps://doi.org/10.1105/tpc.020958gydF4y2Ba.gydF4y2Ba
- 41.gydF4y2Ba
Dohmann EM, Nill C, Schwechheimer C. DELLA蛋白抑制种子萌发和伸长生长gydF4y2Ba拟南芥COP9gydF4y2Basignalosome突变体。中国生物医学工程学报,2010;29(3):344 - 344。gydF4y2Bahttps://doi.org/10.1016/j.ejcb.2009.12.001gydF4y2Ba.gydF4y2Ba
- 42.gydF4y2Ba
Ariizumi T, Lawrence PK, Steber CM。两种F-box蛋白SLEEPY1和喷嚏zy的作用gydF4y2Ba拟南芥gydF4y2Ba赤霉素信号。中国生物医学工程学报。2011;36(2):344 - 344。gydF4y2Bahttps://doi.org/10.1104/pp.110.166272gydF4y2Ba.gydF4y2Ba
- 43.gydF4y2Ba
植物中的赤霉素信号——扩展版。前沿植物科学,2012;2(1):1-7。gydF4y2Ba
- 44.gydF4y2Ba
杨晓明,杨晓明,杨晓明,等。赤霉素DELLA信号以逆转录复合物为目标,重定向蛋白质运输到质膜。中国科学(d辑),2018;29(4):516 - 516。gydF4y2Bahttps://doi.org/10.1073/pnas.1721760115gydF4y2Ba.gydF4y2Ba
- 45.gydF4y2Ba
赤霉素对杂交白杨不定根的抑制作用gydF4y2Ba拟南芥gydF4y2Ba通过影响生长素的运输。植物学报,2014;26(3):342 - 344。gydF4y2Bahttps://doi.org/10.1111/tpj.12478gydF4y2Ba.gydF4y2Ba
- 46.gydF4y2Ba
鲍芳,沈娟,杨志军,杨志军,马迪·葛凯,油菜素内酯与生长素相互作用促进植物侧根发育gydF4y2Ba拟南芥gydF4y2Ba.植物科学进展。2004;34(4):344 - 344。gydF4y2Bahttps://doi.org/10.1104/pp.103.036897gydF4y2Ba.gydF4y2Ba
- 47.gydF4y2Ba
徐伟,Purugganan MM, Polisensky DH, Antosiewicz DM, Fry SC, Braam J.拟南芥TCH4编码木葡聚糖内转糖基酶植物学报。1995;7(10):1555-67。gydF4y2Bahttps://doi.org/10.1105/tpc.7.10.1555gydF4y2Ba.gydF4y2Ba
- 48.gydF4y2Ba
Lakehal A, Chaabouni S, Cavel E, Le Hir R, Ranjan A, Raneshan Z,等。控制不定根的分子结构gydF4y2BaTIR1 / AFB2gydF4y2Ba-gydF4y2Ba辅助/ IAAgydF4y2Ba依赖性生长素信号gydF4y2Ba拟南芥gydF4y2Ba.植物学报。2019;12(11):1499-514。gydF4y2Bahttps://doi.org/10.1016/j.molp.2019.09.001gydF4y2Ba.gydF4y2Ba
- 49.gydF4y2Ba
paulwels L, Morreel K, Witte ED, Lammertyn F, Montagu MV, Boerjan W,等。在体外培养的茉莉酸甲酯介导的代谢和细胞周期进程的转录重编程gydF4y2Ba拟南芥gydF4y2Ba细胞。中国科学:自然科学,2008;26(4):366 - 366。gydF4y2Bahttps://doi.org/10.1073/pnas.0711203105gydF4y2Ba.gydF4y2Ba
- 50.gydF4y2Ba
卡赞K,曼纳斯JM。MYC2:主人在行动。植物学报。2013;6(3):686-703。gydF4y2Bahttps://doi.org/10.1093/mp/sss128gydF4y2Ba.gydF4y2Ba
- 51.gydF4y2Ba
池内M,岩濑A, Rymen B, Lambolez A,小岛M, takbayashi Y,等。损伤通过激素和转录的动态变化触发愈伤组织的形成。中国生物医学工程学报,2017;29(3):344 - 344。gydF4y2Bahttps://doi.org/10.1104/pp.17.01035gydF4y2Ba.gydF4y2Ba
- 52.gydF4y2Ba
周伟,Lozano-Torres JL, Blilou I,张欣,翟Q, Smant G,等。茉莉酸信号网络激活根干细胞并促进再生。细胞。2019;177:1-15。gydF4y2Ba
- 53.gydF4y2Ba
Lakehal A, Dob A, Rahneshan Z, Novak O, escamamez S, Alallaq S,等。gydF4y2Ba乙烯响应系数115gydF4y2Ba整合茉莉酸和细胞分裂素信号机制抑制不定根gydF4y2Ba拟南芥gydF4y2Ba.科学通报,2020;28(5):1611-26。gydF4y2Bahttps://doi.org/10.1111/nph.16794gydF4y2Ba.gydF4y2Ba
- 54.gydF4y2Ba
陈玲,童娟,肖玲,阮勇,刘娟,曾敏,等。gydF4y2Ba丝兰gydF4y2Ba-介导的生长素生物发生是细胞命运转变所必需的gydF4y2Ba新创gydF4y2Ba根器官发生gydF4y2Ba拟南芥gydF4y2Ba.中国生物医学工程学报,2016;36(4):344 - 344。gydF4y2Bahttps://doi.org/10.1093/jxb/erw213gydF4y2Ba.gydF4y2Ba
- 55.gydF4y2Ba
高桥F,沟口T,吉田R, Ichimura K, Shinozaki K. calmodulin依赖的MAP激酶激活对ROS稳态的影响gydF4y2Ba拟南芥gydF4y2Ba.生物化学学报。2011;41(6):649-60。gydF4y2Bahttps://doi.org/10.1016/j.molcel.2011.02.029gydF4y2Ba.gydF4y2Ba
- 56.gydF4y2Ba
李志强,李志强,李志强,等。植物与病原菌相互作用的细胞壁动力学及其敏感性研究。前沿植物科学,2014;5(228):1-8。gydF4y2Ba
- 57.gydF4y2Ba
科斯格罗夫DJ,李振春。膨胀素在燕麦胚囊鞘发育和光控制中的作用。植物科学进展。1993;39(4):339 - 339。gydF4y2Bahttps://doi.org/10.1104/pp.103.4.1321gydF4y2Ba.gydF4y2Ba
- 58gydF4y2Ba
Lewis DR, Olex AL, Lundy SR, Turkett WH, Fetrow JS, Muday GK。生长素转录组的动力学分析揭示了调节侧根发育的细胞壁重塑蛋白gydF4y2Ba拟南芥gydF4y2Ba.植物学报。2013;25(9):3329-46。gydF4y2Bahttps://doi.org/10.1105/tpc.113.114868gydF4y2Ba.gydF4y2Ba
- 59.gydF4y2Ba
李华威,赵c,潘迪,朴勇,金美善,金杰。gydF4y2BaLBD16gydF4y2Ba而且gydF4y2BaLBD18gydF4y2Ba下游的作用gydF4y2BaARF7gydF4y2Ba而且gydF4y2BaARF19gydF4y2Ba是否参与不定根的形成gydF4y2Ba拟南芥gydF4y2Ba.BMC植物生物学,2019;19(1):46。gydF4y2Bahttps://doi.org/10.1186/s12870-019-1659-4gydF4y2Ba.gydF4y2Ba
- 60.gydF4y2Ba
Tauzin AS, Giardina T.蔗糖和转化酶,植物防御生物胁迫反应的一部分。植物科学进展(英文版);gydF4y2Ba
- 61.gydF4y2Ba
Ahkami A, Scholz U, Steuernagel B, Strickert M, Haensch KT, Druege UgydF4y2Ba佩妮gydF4y2Ba混合动力车。公共科学图书馆,2014;9(6):1-14。gydF4y2Ba
- 62.gydF4y2Ba
马立克,夏尔玛,夏尔玛,阿胡佳,胡尔玛,胡尔佳gydF4y2BaArnebia euchromagydF4y2Ba(Royle) Johnston使用噻地脲。细胞生物学杂志,2010;34(5):537-42。gydF4y2Bahttps://doi.org/10.1042/CBI20090372gydF4y2Ba.gydF4y2Ba
- 63.gydF4y2Ba
Ghawana S, Paul A, Kumar H, Kumar A, Singh H, Bhardwaj PK,等。富含次生代谢产物的植物组织RNA分离系统。BMC Res Notes, 2011;4(85): 1-5。gydF4y2Ba
- 64.gydF4y2Ba
葛瑞哲,哈斯,李志刚,李志刚,李志刚,李志刚。来自RNA-Seq数据的全长转录组组装,没有参考基因组。中国生物工程学报。2011;29(7):644-52。gydF4y2Bahttps://doi.org/10.1038/nbt.1883gydF4y2Ba.gydF4y2Ba
- 65.gydF4y2Ba
田涛,刘勇,闫红,尤强,易晓霞,苏哲。agriGO v2.0:面向农业社区的GO分析工具包。核酸研究,2017;45:122-9。gydF4y2Ba
- 66.gydF4y2Ba
Moriya Y, Itoh M, Okuda S, Yoshizawa AC, Kanehisa M. KAAS:自动基因组注释和路径重建服务器。核酸研究,2007;35:182-5。gydF4y2Ba
- 67.gydF4y2Ba
Robinson MD, Mccarthy D, Smyth GK。edgeR:用于数字基因表达数据差异表达分析的生物导体包。Biogeosciences。2010;26:139-40。gydF4y2Ba
- 68.gydF4y2Ba
2002年印度生物多样性法案及其在保护中的作用。热带生态学报。2009;50(1):23-30。gydF4y2Ba
致谢gydF4y2Ba
作者感谢CSIR对这项工作的资助,以及CSIR- ihbt Palampur主任在调查过程中的鼓励。JD感谢CSIR的博士奖学金。该手稿代表CSIR-IHBT通信号码4772。gydF4y2Ba
资金gydF4y2Ba
印度政府科技部科学与工业研究委员会(CSIR)为SB提供了开展工作的经常性和非经常性费用,而JD则获得了奖学金。资助者在本研究的设计、分析和解释中没有发挥任何作用。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
JD在湿式实验室实验、RNA提取、数据采集、分析和手稿撰写等方面都有贡献。EK和VA进行生物信息学分析并审阅手稿,MKS编制cDNA文库并协助测序。SB构思并设计了该研究,编辑并审阅了手稿。所有作者均已阅读并批准稿件。gydF4y2Ba
作者的信息gydF4y2Ba
不适用。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
在目前的研究中,gydF4y2Ba答:euchromagydF4y2Ba根据印度2002年生物多样性法案的规定,植物是从野生植物中采集的。该法案允许其真诚的公民将生物资源用于研究目的[gydF4y2Ba68gydF4y2Ba].作者证实,对植物的实验研究,包括植物材料的收集,符合机构、国家或国际准则和立法。gydF4y2Ba
发表同意书gydF4y2Ba
所有作者都同意将这篇手稿提交出版。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们之间没有利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1图S1。gydF4y2Ba
结果表明,紫菀属植物的种类分布。gydF4y2Ba
附加文件2图S2。gydF4y2Ba
关于不定根展开的函数注释gydF4y2Ba答:euchromagydF4y2Ba采用氧化石墨烯富集分析。gydF4y2Ba
附加文件3表S1gydF4y2Ba
.从头组装的总结gydF4y2BaArnebia euchromagydF4y2Ba叶片诱导的不定根在离体条件下。gydF4y2Ba
附加文件4表S2gydF4y2Ba
.的BLASTx结果摘要gydF4y2Ba答:euchromagydF4y2Ba5个数据库的转录组。gydF4y2Ba
附加文件5表S3a .gydF4y2Ba
.差异表达基因列表,折叠变化≥1.0。gydF4y2Ba表S3b。gydF4y2Ba差异表达基因列表,折叠变化≤1.0。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条所提供的资料,除非在资料的信用额度中另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
德维,J.,考尔,E.,斯瓦恩卡尔,M.K.gydF4y2Baet al。gydF4y2Ba从头转录组分析为植物叶片外植体不定根的形成提供了新的思路gydF4y2BaArnebia euchromagydF4y2Ba.gydF4y2BaBMC植物生物学gydF4y2Ba21日,gydF4y2Ba414(2021)。https://doi.org/10.1186/s12870-021-03172-6gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-021-03172-6gydF4y2Ba
关键字gydF4y2Ba
- Arnebia euchromagydF4y2Ba
- 不定根gydF4y2Ba
- 离体培养/繁殖gydF4y2Ba
- 转录组gydF4y2Ba
- 受伤gydF4y2Ba
- 生长素gydF4y2Ba