摘要
背景
冬季低温对紫花苜蓿的影响(紫花苜蓿l)的持久性和季节性产量,并可导致植物死亡。利用高通量表型和基因分型研究苜蓿抗冻性的遗传机制,对苜蓿抗冻性种质资源的筛选和抗冻性品种的培育具有重要意义。一个苜蓿的几个无性系1用冷室测试了映射种群(3010 x CW 1010)的FT。利用基因测序分型(GBS)技术鉴定的SNP标记对该群体进行基因分型,并将与FT相关的数量性状位点(QTL)绘制在亲本特异性连锁图上。最终目标是培育不休眠且耐寒的紫花苜蓿品种,使其能够在冬季温和的地区延长生长时间。
结果
本试验优化的苜蓿FT筛选方法包括无性系制备、驯化和冷冻试验三个主要步骤。每个基因型检测20个克隆,其中10个样本冷冻处理,10个样本作为对照。中度正相关(r ~ 0.36,P室内FT与田间抗寒性(WH)的差异均< 0.01),表明室内FT试验是苜蓿种质抗寒性的一种有效的间接筛选方法。共检测到与4个性状相关的QTL 20个;9个用于基于视觉评级的FT, 5个用于存活率(PS), 4个用于处理以控制再生比(RR), 2个用于处理以控制生物量比(BR)。部分QTL位置与之前报道的WH QTL重叠,提示FT与WH存在遗传关系。来自耐寒亲本(3010)的一些有利QTL来自一个耐寒基因的潜在基因区CBF.的BLAST对齐CBF的序列米.truncatula与紫花苜蓿的亲缘关系进行对比,结果表明该基因的同源物位于6号染色体上约75mb。
结论
该室内耐寒性选育方法可为苜蓿育种者通过间接选育加快育种周期提供参考。该QTL及其相关标记为研究界增加了基因组资源,可用于苜蓿耐寒性改良的标记辅助选择(MAS)。
背景
美国大部分地区在冬季会经历极低的低温,这对草本牧草物种的生存构成了严重威胁。紫花苜蓿的严冬伤害很常见,尤其是在北方气候地区[1,2].严冬影响紫花苜蓿(紫花苜蓿L.)生长导致生物量产量降低,林分持久性降低,最终死亡(http://www.canr.msu.edu/uploads/resources/pdfs/e2310.pdf).苜蓿抗寒性的改良传统上是通过在寒冷地区的田间苗圃中大量和反复选择优良基因型来实现的[3.].然而,由于冬季不可预测,以及高效选择需要多个地点和年份的数据,托儿所的抗寒性选择通常效率较低[3.].记录多个季节的多个数据既昂贵又费力[4].北美苜蓿改良会议(NAAIC)还建议至少收集两个地点的数据,并进行两年的冬季生存评估(https://www.naaic.org/stdtests/wintersurvivalnew.pdf).NAAIC还推荐了一些收集和解释紫花苜蓿冬季生存数据的指南,因为过早记录的冬季生存评级可能会低估休眠基因型的WH。此外,基于传统育种的紫花苜蓿抵御冬季损害的选择速度太慢,因为该性状是定量的,与环境有实质性的相互作用[5].因此,现场WH的评估是一个相对繁琐和漫长的过程。
紫花苜蓿是同源四倍体(2n = 4x = 32),是全球最广泛种植的牧草[6].耐寒性(FT)是预测紫花苜蓿抗寒性(WH)的重要因子[7].因此,在模拟环境中评估植物对冰冻温度的耐受性被认为是一种替代田间表型的方法。室内耐冻性测试通常采用恒温浴进行[8],作为漏电评估[9],利用叶绿素荧光分析[10],以及设定温度的冷冻室[3.].从室内冷冻试验中选择的苜蓿具有较好的苗圃性能[3.,11和其他物种。Adkins et al.(2002)评估了该属十个物种的抗寒性绣球花在实验室里,他们观察了H.macrophylla与其景观表现相对应的栽培品种[12].据报道,冰冻试验与植物抗寒性之间存在很强的正相关[Stenotaphrum secundatum(沃特。)Kuntze] [13].
低温诱导若干基因和相关信号转导途径合成必需的生物分子(蛋白质、可溶性糖、渗透保护剂),以适应低温[14].的CBF(c -重复序列结合因子)基因是一种转录因子,无论温度来源如何,在冷适应中都起关键作用[15,16].冷敏感植物通常缺乏相关基因,或者基因突变失活,从而导致冷驯化调节和信号分子的形成失调。其他因素如水分胁迫、农药施用、肥料处理、细菌定植及种植日期[8也会影响植物的抗寒能力。然而,低温是引起敏感植物细胞变化和冬季损伤的主要因素。因此,解剖与紫花苜蓿耐寒性相关的基因组特征至关重要。此外,一些紫花苜蓿种质资源,通常是耐寒型,在秋季白天缩短和气温下降时,会发生休眠,这种现象被称为秋季休眠(FD)。然而,最近的研究结果表明,冬季生存(WS),即植物承受冬季寒冷而不受伤害的倾向,和FD是两个不同的性状,可以通过遗传分离来同时改善这两个性状的种质资源[17].在非休眠紫花苜蓿种质中引入耐寒性基因,是培育高产冬活紫花苜蓿品种的理想选择。
QTL分析用于识别与感兴趣性状相关的有效位点和基因组区域,是过去几十年作物育种和基因组学研究中的常用方法[18].Poudel等人[19]对伪f的抗冻性进行了QTL分析2研究了柳枝稷种群的室内表型,并报道了6个显著QTL和潜在候选基因。最近,一组研究人员报道了结缕草低温驯化和耐寒相关性状(如绿色组织存活和再生)的多个QTL (结缕草spp。)20.].QTL分析还揭示了局部适应性抗冻性的遗传基础拟南芥意大利和瑞典的人口[21].它是紫花苜蓿最接近的二倍体亲戚,Medicago truncatula检测与冻害相关的QTL,以及叶片电解质渗漏、叶绿素含量指数和干重等相关性状[22].作者报道了不同连锁群(LG)的QTL米.truncatulaLG1、LG4和LG6,其中LG6中与耐寒性相关的QTL是最有效的QTL,可解释高达40%的变异。在紫花苜蓿中,有效抗冻QTL的信息有限,这些QTL可能也有助于种质的整体冬季生存改善。
抗寒性、适应性较强的非休眠紫花苜蓿在冬季和早春通过延长再生时间来填补牧草空白。季节性牧草缺口的存在,是因为当冷季牧草尚未生产时,暖季牧草的部分或完全生长停止[17].乔治亚州和美国东南部的冬天总体上是温和的,但根据纬度和海拔的不同,这些地方每个季节经常会有几天结冰。因此,不休眠且耐寒的紫花苜蓿是该地区的理想品种。在之前的一项研究中,我们报道了与紫花苜蓿WH和田间植物休眠相关的QTL [17].
在这项研究中,我们利用冷冻室的室内表型研究了抗冻性与遗传位点的关系。因此,本试验的目的是(i)优化紫花苜蓿步入式冷冻室抗冻试验方案;(ii)确定与紫花苜蓿抗冻性相关的QTL; (iii)选择耐寒苜蓿先进选育系,培育耐寒品种。
结果
耐冻性测试
对照组和处理组5262 (WS = 2)和G-2852 (WS = 4)标准对照苗差异显著(P< 0.05)(图1)当调节冻结环境使最低测试温度为-8℃时。优化的方案包括一系列的温度和暴露时间的组合。驯化后,处理组和对照组均在0℃下维持8小时。然后,对照组从冷冻室移出,并在14小时转移到正常生长条件下。光照下(23°C), 10小时。(15°C)。处理组中的植物以这样的方式处理,温度降低2°C/hr,直到达到-8°C。植物在-8℃下保持90分钟,然后以2℃/小时的速度逐渐升高,直到达到2℃。然后将处理过的植株转移到正常温室条件下进行表型分析。
表型变异和分布
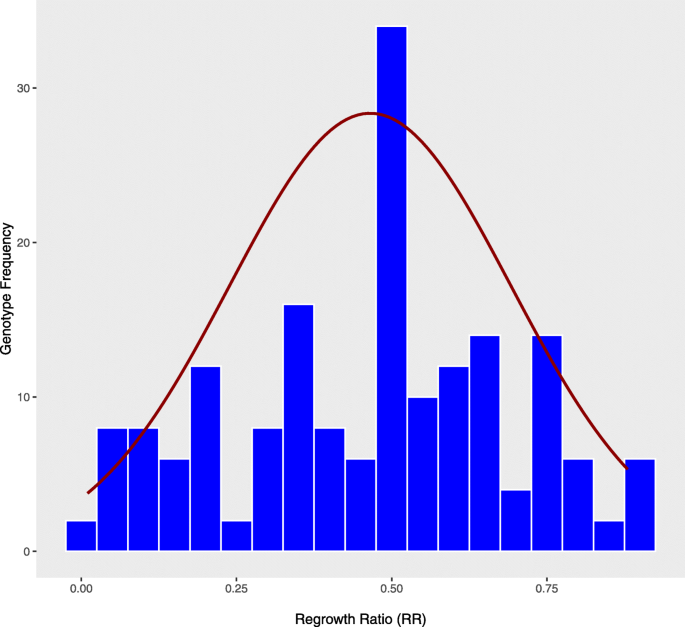
在F1耐寒性(FT)、成活率(PS)、再生长率(RR)和生物量比(BR)(图2)1而且2).所有性状在群体内均表现出接近正态的变异分布,其中具有平均性状值的样本数量最多。假设性状值是基因型和复制的函数,对再生高度和生物量等性状进行方差分析,结果表明只有基因型具有显著性(P< 0.05)效应。我们还注意到所有四种特征都存在越界隔离。经冷处理的基因型PS在7 ~ 100%之间。在处理组和对照组中,存活植株的平均RR范围从完全敏感(接近0)到几乎完全耐受(~ 1)基因型(图2)。2).同样,处理组和对照组存活植株的平均BR在0.01 ~ 0.99之间。平均视觉评分基于FT的F1植物的变异范围为1 ~ 4.9,表明F1耐冻温基因型。PS、RR和BR较高,FT较低的基因型被认为是耐寒基因型。PS表现出较强的负相关(r= -0.91,P平均FT < 0.01),说明克隆存活率越高,各基因型的耐寒性越好(表2)1).显著正相关(r= 0.55,PPS与RR以及PS与BR (r= 0.40,P< 0.01)表明存活率高的基因型再生率较高,生物量也较高。变量FT和RR之间也存在较强的负相关,表明冷敏感基因型的再生长率较低。同样,显著的负相关(r= -0.46,PBR与FT的相关值均< 0.01),相关值中等(表21).
我们发现显著的正相关(r= 0.36,P均值FT与2017年JPC田间位置的WH得分最小二乘(LS)均值(WH017JPC)之间< 0.01)。显著正相关(r= 0.23,P2017年Blairsville地区(BVL)的FT和WH数据(WH017BVL)之间也存在< 0.01的差异(表1)1).除FT外,室内测试的其他变量,如PS、RR和BR也显示出显著相关性(P< 0.05)与来自该领域的WH数据(表1).然而,我们没有发现显著的相关性(PBVL的现场数据与变量PS、RR和BR的差异均< 0.05)。然而,它们之间的关系方向与JPC现场数据所显示的相似。这些性状之间的关系表明了所使用的表型方法的价值。
QTL定位
由于我们生成了两组相对密集的(1.5 cM/SNPs)连锁图,具体到每个亲本,我们分别在它们上绘制QTL。在本研究中,我们共检测到4个性状的20个QTL(表2).在休眠亲本(d)(3010)的连锁图谱上检测到的QTL编码为“d”+性状名称(小写)和数字。例如,dft1、dft2、…、dft5表示在休眠亲本图上检测到的不同QTL。3.).映射在非休眠亲本(n)连锁图谱上的QTL使用相同的方法编码,只是将“d”替换为“n”,例如,非休眠亲本的耐寒QTL命名为nft1、nft2等(表2)2).
在3010个连锁图上检测到5个FT QTL, 2个在同源同源3p上,1个在4B上,1个在6B和6D上2).在来自母本的5个FT QTL中,QTL dft1 (R2= 0.19)解释了最高的表型变异。由于我们只使用单一剂量的等位基因位点进行连锁分组,仅代表同源四倍体物种中负责性状的部分位点,因此在这里我们只报道了等位基因效应的方向,而不是实际的加性效应。在来自3010亲本的5个FT相关QTL中,只有2个QTL (dft4和dft5)位于6号染色体同源体上2;无花果。3.)对抗冻性有积极作用,而其他三种则增强了抗冻敏感性。我们在3010个连锁图谱上检测到RR (drr1和drr2)的2个QTL, BR (dbr1和dbr2)的2个QTL, PS (dps1)的仅1个QTL2).在3010(耐寒)亲本的10个QTL中,有5个QTL表现出对耐寒相关性状有积极影响的有利位点(表1)2).
我们在CW 1010的连锁群上鉴定了4个FT、4个PS和2个RR的QTL(表2)2).对于FT,我们在CW 1010的5B上确定了4个QTL中的3个,其中一个QTL (nft3)解释了高达29%的表型变异。在5B的同一区域还发现了两个PS QTL (nps1和nps2)。在CW 1010基因5B上发现的5个具有阴性效应的QTL nft3、nps1(重叠)、nft4、nps2(重叠)和nft2,表明该染色体段对苜蓿的冻敏性至关重要。我们还在4D和8D染色体上观察到该父本再生比的两个QTL (nrr1和nrr2)(表2)2).在冷敏感亲本cw1010上鉴定的10个QTL中,只有一个QTL (nft1)对苜蓿抗冻性具有良好的(+)效应,解释率仅为11% (R2= 0.11)的表型变异。这个输出确认了我们使用的trait值的可靠性。
本实验鉴定的部分QTL与先前报道的whl相关QTL基因组区域重叠。4D染色体上的QTL nrr1与ws10在同一染色体区域被检测到[17].本文报道的QTL nrr2在CW 1010亲本8D染色体上也与ws5重叠[17].在2B染色体3010号的另一个QTL dbr1,在其近端发现了抗寒QTL wh15和休眠相关QTL dorm16 [17].在两种表型条件下,这些QTL的等位基因效应方向重叠和匹配。此外,在本研究中,我们在染色体2、3、4、5、6和7的各种同源物上检测到了主要的QTL。另一项实验也报道了与冬季损伤相关的主要QTL连锁群2,3,4,5,6和7 [23].这些证据支持了抗冻性和野外低温生存之间的遗传关系。提供了该QTL的侧翼标记和峰值标记序列(补充文件)S1)可作为标记辅助选择(MAS)的潜在标记。
CBF正交谱和相关的耐寒性QTL
序列比对CBF基因(补充文件)S2)米.truncatula对紫花苜蓿参考使用BLAST算法显示紫花苜蓿CBF在第6号染色体上存在75 Mb左右的同源体(表3.).由于紫花苜蓿仅有8条染色体[24],它缺乏6号染色体所有4个同源体的序列信息,我们无法知道6号染色体是否所有同源体都具有CBF基因。同时,我们观察到91%的最大身份时米.truncatula CBF同源体排列在紫花苜蓿参照上,表明基因在从紫花苜蓿进化的过程中发生了变化米.truncatula.一个最有趣的观察是CBFBLAST命中最好的区域在第6染色体的75.72 ~ 75.77 Mb附近,说明该区域存在多个基因CBF该地区的家庭。
当我们对与耐寒QTL相关的标记:dft4 (6B染色体)和dft5 (6D染色体)的标记序列(~ 60 bp)进行比对时,我们发现dft4相关标记标记序列BLAST命中最好的出现在第6染色体上的120 Mb左右,而dft5相关标记标记序列最好的出现在第6染色体上的10 Mb左右。的位置不重叠背后可能有多种原因CBFOrtholog和dft4标记,如我们可能漏掉检测CBF因为我们只使用SDA snp。由于在参考基因组中缺乏所有四个紫花苜蓿同源物的序列,我们目前没有办法确切地知道在哪里CBF取决于同源体以及基因有多少个不同的副本。此外,非常短的标记序列(~ 60 bp)对齐可能会受到质疑。然而,最近发表的紫花苜蓿参考基因组和可用的克隆基因米.truncatula这为我们确定紫花苜蓿耐寒基因同源体的潜在位置提供了机会。
室内筛选育种材料
经过连续循环的耐寒性试验、选择和多交,我们共培育出177个半兄弟姐妹家族。在乔治亚州Blairsville的佐治亚大学研究农场,这些品种在野外进行了抗寒性筛选,并进行了冬季生存和秋季休眠标准检查。在2019-2020年冬季,成熟植株表现出较好的冬季存活率(林分数为40 - 70%)。尽管如此,冬季生存检查显示16 - 80%的存活率。冬季生存检查:ZG9830和WL325HQ的存活率高达80%,而CUF 101的存活率仅为16%。此外,秋季休眠(FD)检查UC-1465在冬季霜冻后完全死亡,而另一个FD检查ABI 700(半休眠)只有10%的存活率。这些观察结果表明,一些冬季生存检查的较好生存可能是由于它们的休眠性质。由于在Blairsville, GA的冬天大多是严重的29.3°F(-1.5°C)的平均低温一月(https://www.weather-us.com/en/georgia-usa/blairsville-climate),具有较好的耐寒性、耐寒性和耐寒性的非休眠紫花苜蓿种质资源是耐寒紫花苜蓿品种开发的优良遗传资源。
讨论
紫花苜蓿耐冻性室内筛选
我们报道的室内耐冻性选择方法比野外选择方法更快、更便宜,因为驯化后只需在冰箱中放置几个小时。所有步骤都在受控环境中进行,因此冷冻试验可以克服与现场表型相关的困难,主要是环境变异性和不可预测的冬季。过去的研究已经证实,苜蓿在田间的抗寒性受基因型耐寒和抗冻能力的影响[7],表明优化的冻结试验是有价值的。这种室内FT选择也可以同时筛选大量的产品;通常,我们测试了一组生长在球果中的196 (98 × 2)个克隆,包括对照组和实验组。尽管如此,室内选择的紫花苜蓿在作为耐寒品种释放之前可能也需要很少的田间选择周期。之前的一项研究表明,室内选择的紫花苜蓿植株后代表现出高达5˚C的耐寒性和优越的冬季生存能力[3.].
在冬季偶尔有霜冻和温度波动的温和地区,这种情况可能会损害紫花苜蓿等多年生牧草,而非休眠类型的植物尤其容易受到伤害。当冬季温暖,温度接近13°C时,越冬的紫花苜蓿会打破休眠,开始长出细长的冠芽(http://www.canr.msu.edu/uploads/resources/pdfs/e2310.pdf),这种现象称为“水土不服”[25].这一过程消耗了苜蓿根的储备,最终使植物容易受到低温的影响(http://www.canr.msu.edu/uploads/resources/pdfs/e2310.pdf).因此,敏感的基因型在冬末和早春霜冻时无法重新适应。4).因此,冷冻试验的效率似乎可以通过对已测试的(未驯化的)无性系进行一次冷冻来提高。换句话说,一个包括一系列适应-不适应-再适应过程的模拟环境可能是未来苜蓿冷冻试验的理想环境。
克隆变异
在苜蓿室内低温试验中遇到的挑战之一是通过茎插枝产生相同的无性系。无性系变异并不罕见,同一基因型茎插枝无性系间的无性系变异在紫花苜蓿中很常见。也许不受控制的变异来源可归因于建立的活力和与环境的相互作用(浇水,生长室的位置等)(Yves Castonguay,人事交流,2016)。这种影响可以通过为每个基因型制造多个克隆繁殖体和使用均匀大小的活力克隆进行冷冻处理来最小化。当资源不受限制时,生产大量的岩屑和测试更均匀的无性系可以有效地避免无性系之间不受控制的变异来源。在本研究中,由于所测试的克隆是根据它们的一致性仔细选择的,因此没有显著的变化(P在再生和生物量等性状上,某基因型存活复制无性系的差异均< 0.05)。然而,我们发现同一基因型的克隆在冷冻后的存活率(PS)水平不同,这表明PS是一种数量性状,且因基因型而异。无性系中存在的表型变异,也称为体细胞无性系变异,可能是表观遗传变化等其他因素的结果[26].
FT与WH的关系
中度正相关(r= 0.23 ~ 0.36)1)表明,在冷冻室内筛选紫花苜蓿可以加速田间的紫花苜蓿选育。过去的一些研究也报告了类似的信息。Brouwer等人[7]发现正相关(r田间冻害与冬季冻害的差异= 0.34 ~ 0.58),表明耐寒性和耐寒性可能受某些共同遗传机制的控制。利用室内选择亲本培育的育种群体加快了育种过程[3.].例如,优良的耐寒品种如Apica (ATF0)和(ATF5)是通过多达5个周期的循环选择培育出来的[27].本研究和以往的研究结果表明,室内冷冻试验可以间接地选择紫花苜蓿的抗寒性。
抗寒性是一个广义的术语,指的是植物抵御严冬的能力,包括冰冻温度、疾病、高湿度、结冰和冻胀(https://extension.umaine.edu/publications/2272e/)[28].因此,仅根据FT进行选择只代表了变量谱的一部分,育种人员还需要对所选的耐寒植物进行田间试验。例如,据报道,在人工冷冻和自然硬化后,苜蓿冠中碳水化合物的积累水平不同[29].人工耐冻性与蔗糖、水苏糖和棉子糖的积累以及葡萄糖、果糖和淀粉水平的降低有关。相比之下,苜蓿自然硬化引发棉子糖和水苏糖的积累,与蔗糖的积累相关性较小[29].也许,这些生理和分子因素是我们在本研究中看到的室内FT和田间WH之间适度关系的背后原因。
FT QTL、候选基因及未来发展方向
在本实验中,我们发现了6个有利的QTL(表2),它们可能有潜力用于苜蓿耐寒性的MAS,因为它们单独解释了超过10%的表型方差(R2≥10)。其他几个对紫花苜蓿抗冻性有负面影响的QTL可能是研究紫花苜蓿抗冻性分子基础的一个有趣区域。植物的耐寒性是由一个复杂的基因网络调节的。30.].苜蓿作为一种同源四倍体,目前还缺乏完整同源水平的参考基因组,其基因组研究相对复杂。此外,该物种表现出四体遗传,具有复杂的分离模式,因此很难包含全基因组标记信息。使用伪测试交叉标记寻找某些QTL并不能解释所有控制感兴趣性状的位点。由于苜蓿是同种异体,因此在苜蓿中不可能开发出其他有效的QTL定位群体,如重组自交系(RIL)。此外,在这种同源多倍体物种中,还没有像在其他物种中那样产生双倍单倍体(DH)群体的既定方法[31],可用于绘制稳定QTL。因此,在这个基因组时代,任何与苜蓿感兴趣性状的QTL和候选基因对应的小信息都是有价值的。
调整米.truncatula CBF在第6染色体附近发现了一个耐寒QTL (dft4),表明该候选区域还有待进一步研究。过去的报告表明m . truncatula有一套CBF六号染色体长臂上的基因[32].表达分析CBF相关基因米.trunctatula在苜蓿中表明基因(MsCBFl-17而且MsCBFl必经18的潜在功能同源物CBF3[33].的CBF同源体和基因群不仅位于米.trucatula6号染色体,还有5号染色体[33,34],我们还检测到几个与冻结敏感性相关的QTL和一个有利的QTL (dbr2)(表2).正如我们观察到的几个与冷冻敏感性相关的QTL,基因组区域也可能存在低温调控(天哪)基因,影响的表达CBF对寒冷敏感的紫花苜蓿。
此外,FT和WH的多个QTL [17低到中等的R2表明基因组选择(GS)可能是改善这些性状的可行选择。GS正成为一种快速筛选优良基因型以提高不同作物抗寒性的有效方法[35,36].在牧草和豆科植物中实施GS,通过减少平均周期时间和提高选择精度来提高遗传收益,已被认为是目前和未来有益的选择方法[37].例如,Poudel等人。38他认为GS是为北纬地区开发耐寒生物能源作物柳枝稷品种的有效途径。介绍了GS在苜蓿中的潜在应用[39,40].
由于本研究中发现的QTL解释了至少10%的方差,因此将这些QTL作为固定效应协变量整合到GS模型中可能是提高苜蓿耐寒性的有效途径。但是,在将QTL作为协变量使用之前,必须对多个环境和不同种质进行验证。过去的一些报告表明,在GS模型中加入主要QTL或基因可以提高模型在不同作物物种中的预测精度[41,42,43,44].Bernardo, R.(2013)报道,如果主基因解释的百分比方差为> 10%,那么将其作为固定效应协变量可提高全基因组选择的预测精度。我们还认为,在未来的GS研究中,将苜蓿主耐寒QTL作为固定效应,可以有效提高模型的预测能力。由于GS基于全基因组标记,在模型中使用QTL极有可能减少所需标记的数量。此外,本文所述的室内表型方法可用于为苜蓿抗寒性选择设计的GS训练群体的表型分析。
结论
本文报道了一种室内快速筛选紫花苜蓿抗冻性(FT)的方法,为加快田间抗冻性(WH)的选育提供了依据。由于FT和WH之间存在一定的相关性,建议在大田前对苜蓿种质进行室内筛选,以获得更好的冬生选择。我们在被测群体中鉴定了20个ft相关性状的QTL。最有利的QTL位于第6染色体附近,关键的耐寒基因家族(CBF)已被报道为紫花苜蓿的近亲米.truncatula.在MAS中采用这些QTL之前,需要在不同遗传背景下对其进行验证,以确保这些位点在种群和环境中是稳定的和可重复的。然而,一些解释10%或更多表型方差的有利QTL可以在MAS中直接检测。我们认为,在苜蓿基因组选择中加入经验证的、具有主效应的QTL作为协变量,是提高耐寒性等数量性状的理想选择。
方法
植物材料
本试验的植物材料包括两个紫花苜蓿亲本品种F1后代和冬季生存检查。苜蓿品种CW 1010和3010的商业认证种子分别来自Alforex seeds (Woodland, CA, USA)和BrettYoung (Winnipeg, Manitoba, Canada)。cw1010的秋季休眠等级为10级(FD = 10), 3010的秋季休眠等级为2级(FD = 2)。这些种子是根据国家和国内的指导方针收集的。耐寒亲本3010的冬季存活率为2 (WS = 2),而cw1010的WS等级尚未确定(https://www.alfalfa.org/pdf/2021_Alfalfa_Variety_Leaflet.pdf).从田间观察来看,cw1010在冬季表现出广泛的危害,被认为是冬季易感苜蓿品种之一。更多关于这些品种的信息可以在NAFA品种评级中找到(https://www.alfalfa.org/pdf/2021_Alfalfa_Variety_Leaflet.pdf)和有关品种的资料,亦可在资料库(https://www.alfalfa.org/varietyratings.php).检查品种来自国家植物种质资源系统(NPGS)。对苜蓿拟试交F进行了筛选1[3010(♀)× CW 1010(♂)]群体的冷冻温度响应。母本' 3010 '是休眠型紫花苜蓿品种,具有较高的冬季生存能力,而cw1010则是非休眠型和冷敏感型。测绘种群发展及野外实验已在前面描述[17,45,46].简要地说,采用人工授粉的方法培育F1F1用3个SSR标记进行杂交鉴定。然后在两个地方,佐治亚大学的Blairsville和Watkinsville研究农场使用随机完全块设计(RCBD)中的三个克隆复制进行种群生长。本研究的重点是使用步入式冷冻室(ESPEC North America, Inc.)对映射种群的苜蓿无性系进行冷冻测试。184株F的茎切得到每个基因型20个无性系1后代和父母。无性系在正常生长条件和温室管理下生长。在冷驯化前,将20个无性系分为两组,一组为对照组,另一组为处理组。结合实验定位群体,我们还种植了NAAIC推荐的紫花苜蓿冬季存活(WS)检查品种,以优化冻结试验。检测品种包括ZG 9830 (WS = 1)、5262 (WS = 2)、WL325HQ (WS = 3)、G-2852 (WS = 4)、Archer (WS = 5)和Cuf 101 (WS = 6),其中WS ' 1 '和' 6 '分别表示极耐寒和非耐寒(https://www.naaic.org/stdtests/wintersurvivalnew.pdf).
室内表现型
对于检验品种,我们测试了种子植株,而对于群体,我们测试了营养无性系。检查种子被播种在14厘米高(Ray Leach, SC10)的容器中,容器内装满农田土壤,在球果顶部有5厘米深的Fafard胚芽混合物(Fafard, MA)。塞西尔砂壤土类型的农田土壤属于土壤等级细,高岭石,热典型坎哈积岩,如前所述[47].将种球果放置在RL98托盘中,在温室中生长6-8周。然后,将植株转移到温度为4℃的驯化室中3周。实验室调节到8/16小时(亮/暗),相对湿度70%。在驯化期间,植物每周浇水一次,并用霍格兰的营养液施肥一次。处理组和对照组的植物是随机的,这样两组植物都有统一的表型分布。我们移除了任何在表型上与它们的姐妹克隆不同的神秘克隆。对低温和暴露时间的各种组合进行了测试,以优化冷冻试验,直到存在显著差异(卡方检验)P= 0.95),如前所述,5262检验样本(WS = 2)和G-2852检验样本(WS = 4)之间的差异(https://www.naaic.org/stdtests/wintersurvivalnew.pdf).冷冻试验结束后,这些植物被转移到正常的温室条件下。控制组和处理组的植株顶部都被剪掉,在树冠上方留下两个节,以便重新生长。治疗两周后,记录数据为存活率、再生高度和基于耐冻性的视觉评分,评分范围为1 - 5,其中1代表最耐冻性,5代表最耐冻性。用于耐寒等级的标准在用于冬季生存等级的基础上有轻微的修改(https://www.naaic.org/stdtests/wintersurvivalnew.pdf).无损伤和均匀再生的基因型得分为1,而严重损伤和勉强存活的基因型得分为5。我们还记录了冷冻试验三周后被测样品的生物量。记录了4个性状:耐寒性(FT)、存活率(PS)、处理与对照的再生比(RR)和生物量比(BR)。
FT与WH的关系
利用SAS 9.4 (SAS Institute Inc.)中的PROC CORR程序计算室内筛选FT性状与田间WH分数之间的表型相关性。在2016/2017年冬季,格鲁吉亚经历了温和的天气,但3月第一周发生的早春霜冻对冬季的新生长造成了严重破坏。因此,我们将FT与WH 2016/2017赛季从地点和组合环境获得的现场数据进行了比较1).
GBS和标记鉴定
GBS文库制备、Illumina测序和数据处理步骤在前面已经有了清晰的描述[17].综上所述,对所述方法稍加修改后,从冻干组织中提取紫花苜蓿定位群体和亲本样本DNA [48].然后,使用ApeKI DNA消解方法,按照[中描述的方法,构建两个96丛的GBS文库。49].这些文库在Georgia Genomics and Bioinformatics Core (GGBC)使用Illumina NexSeq (150 Cycles) 75 PE高输出流单元进行测序。我们使用两种不同的管道处理测序数据:Universal Network-Enabled Analysis Kit (UNEAK) [50]和GBS-SNP-CROP [51]用于单核苷酸多态性(SNP)鉴定。对于前者,我们只使用正向(R1)读取,而对于后者,我们同时使用正向(R1)和反向(R2)读取。
遗传连锁和QTL定位
用GBS鉴定的单核苷酸多态性(SNP)标记被过滤掉缺失(删除< 30%缺失)的数据。然后,我们再次筛选单剂量等位基因(SDA)位点多态性(Aaaa x Aaaa),如所述[49].采用卡方检验(α = 0.05)检验SDA SNPs分离比1:1 (AB:AA)。由于该物种表现出四体遗传,利用所有标记和可用的计算资源是不可能的。因此,我们只使用在伪testcross子代中分离的标记,这种策略被称为伪testcross策略。然后,我们利用JoinMap 5.0上的回归映射,分别构建了8个染色体和父系4个同源体的32个连锁群,其中我们使用Kosambi映射函数和最小独立LOD值10进行标记分组[17,52].母系亲本特异性的32个连锁图谱保留了1837个SDA SNPs,而父系连锁图谱总共保留了1377个SNPs。各亲本类型连锁图谱的平均标记密度为1.5 cM/SNP。根据标记标记序列在其上的排列,为相应的连锁基团分配染色体米.truncatula参考V4.1 [17].我们使用Windows QTL Cartographer 2.5版在连锁图谱上绘制了与耐寒性相关的性状。QTL定位采用复合区间映射法(composite interval mapping, CIM) [53].特定于该性状的LOD评分计算使用全基因组阈值的1000个排列P≤0.05 [17].将4个性状的基因型平均值作为QTL定位的特征值。
候选QTL的基因组分析
紫花苜蓿基因组最近被发表了24],我们对寒冷相关基因C-repeat结合因子(CBF)米.truncatula关于紫花苜蓿参考文献(表3.),紫花苜蓿序列未克隆。排列让我们找到了CBF并将其与我们鉴定的耐寒QTL联系起来。我们还在QTL区域下对标记的标记序列进行了比对,这些标记序列很可能代表的基因座CBF基因家族,关于紫花苜蓿的参考。然而,标记序列只有大约64 bp的长度(Supplementary File .)S1).
培育育种材料
本研究选择的耐寒基因型可作为苜蓿抗寒品种开发的源种质。为了开始育种和选择过程,我们移植了耐寒F1以温室内的植物为研究对象,利用蜂媒授粉在亲本间进行多交。兄弟姐妹F2种子被大量收获并在温室中发芽。然后使用恒定的冷冻环境筛选幼苗的耐冻基因型。幸存下来的同父异母的兄弟姐妹随后被移植到更大的容器中并进行杂交。然后是F2分别为每个亲本收获衍生的半兄妹子代种子并发芽。然后于2019年春季在佐治亚州布莱尔斯维尔种植这些经过冷冻测试的亲本的幼苗,以评估它们的田间表现。通过对同父异母后代在2019/2020年冬季后的存活率进行评估,评价植株的抗寒能力。
数据和材料的可用性
测序基因分型的原始读数可以在NCBI SRA找到,注册号为SRP150116,并有链接https://www.ncbi.nlm.nih.gov/sra/SRP150116.GBS条形码密钥文件需要分解的SRA沉积fastq序列文件可以在Dryad数字存储库(https://doi.org/10.5061/dryad.1g1jwstwv).
缩写
- BR:
-
生物量比率
- CBF:
-
C-repeat-binding因素
- 装备:
-
染色体
- 英国《金融时报》:
-
冻结公差
- FD:
-
秋天休眠
- GBS:
-
Genotyping-by-sequencing
- MAS:
-
分子标记辅助选择
- PS:
-
百分比的生存
- QTL:
-
数量性状位点
- RR:
-
再生率
- SNP:
-
单核苷酸多态性
- WH:
-
抗寒性
- WS:
-
冬季生存
参考文献
- 1.
李志强,李志强,李志强,等。秋季休眠和雪深对紫花苜蓿抗冬性的影响,第93卷。2001.
- 2.
Bélanger G等,加拿大东部多年生饲料作物的冬季损害:原因、缓解和预测,第86卷。2006.
- 3.
Castonguay Y,等人。一种提高紫花苜蓿抗冻性的室内筛选方法。作物科学2009;49(3):809-18。
- 4.
林志刚,李志刚。8种木本类群的耐低温和驯化研究。HortScience。1989; 24(5): 818 - 20。
- 5.
Castonguay Y,等人。分子生理学和育种在抗寒性改善的十字路口。中国生物医学工程学报。2013;37(1):344 - 344。
- 6.
王晓明,王晓明,王晓明,等。黑麦对紫花苜蓿杂草抑制及产量的化感作用。中国植物科学,2018;9(4):685-700。
- 7.
Brouwer DJ, Duke SH, Osborn TC。同源四倍体紫花苜蓿冬季抗寒、秋季生长和冻害相关遗传因子图谱研究由美国农学院哈奇基金资助。生命科学。,Univ. of Wisconsin-Madison. Crop Sci. 2000;40(5):1387–96.
- 8.
Lindstrom OM。移栽期对利兰柏树移栽后抗寒性有影响。HortScience。1992; 27(3): 217 - 9。
- 9.
Peixoto MdM, Sage RF。改进了芒草和柳枝稷根状茎耐寒阈值的实验方案。Gcb生物能源,2016;8(2):257-68。
- 10.
Mishra A,等。叶绿素荧光发射对拟南芥耐寒性的报告。植物信号行为研究。2011;6(2):301-10。
- 11.
Castonguay Y,等人。低温诱导的苜蓿群体生化和分子变化选择性提高抗冻性作物科学,2011;51(5):2132-44。
- 12.
王志刚,王志刚,王志刚。绣球花属10种植物的抗寒能力。环境园艺学报。2002;20(3):171-4。
- 13.
金博尔JA,等。评估圣奥古斯汀草的耐寒性:温度响应和评价方法。Euphytica。2017;213(5):110。
- 14.
三浦雄,陈志强,陈志强,等。植物低温信号通路与低温反应。中华分子化学杂志,2013;14(3):5312-37。
- 15.
王晓明,王晓明,王晓明,等。植物低温驯化研究。2014。p。6。
- 16.
Miller AK, Galiba G, Dubcovsky J.在单球菌小麦抗冻基因座Fr-Am2上发现了一组11个CBF转录因子。中国生物医学工程学报。2006;26(2):344 - 344。
- 17.
Adhikari L,等。多倍体多年生苜蓿关键适应性性状的GBS-SNP图谱分析中国植物科学,2018;9:934。
- 18.
保罗·D等人。第38章-利用数量性状位点培养植物的抗逆性。在:Tripathi DK等,编辑。环境变化下的植物生命。学术出版社;2020.917 - 65页。
- 19.
Poudel HP,等。低地与高地柳枝稷群体抗冻性的数量性状位点。中国植物科学,2019;10:372。
- 20.
布朗JM,等。结缕草冷驯化和抗冻性相关QTL的鉴定。作物科学,2021;1-12。
- 21.
Oakley CG等。耐寒性的QTL定位:与适应性和适应性权衡的联系。分子生物学杂志,2014;23(17):4304-15。
- 22.
阿维亚·K,等。截叶苜蓿抗冻性及其相关性状的遗传变异及QTL定位。应用理论与实践。2013;26(3):344 - 344。
- 23.
李X,等。四倍体紫花苜蓿秋季休眠与冬季损伤的图谱研究。作物科学2015;55(5):1995-2011。
- 24.
沈c,等。同源四倍体紫花苜蓿染色体水平基因组序列和核心种质重测序为紫花苜蓿研究提供了基因组资源。植物学报。2020;13(9):1250-61。
- 25.
刘志刚,刘志刚,刘志刚。抗寒植物的适应性研究进展。中国植物科学(英文版);2006;26(1):1 - 6。
- 26.
Pikaard CS, Mittelsten O, Scheid。植物的表观遗传调控。冷泉港展望生物学。2014;6(12):a019315。
- 27.
Dubé M-P,等。苜蓿中两个新的K3冷诱导脱氢基因的鉴定。应用理论与实践。2013;26(3):823-35。
- 28.
4个抗枯萎苜蓿品种非选择无性系的冬季损伤与寿命艾力龙。1945;37(10):828-38。
- 29.
Castonguay Y,等人。不同抗寒苜蓿品种碳水化合物积累的差异。作物科学,1995;35(2):509-16。
- 30.
McKhann HI等人。拟南芥凡尔赛核心种质CBF基因序列的自然变异、基因表达及抗冻性中国生物医学工程学报。2008;8(1):105。
- 31.
Filiault DL,等。用于QTL定位的双单倍体系的生成。方法Mol生物学,2017;1610:39-57。
- 32.
Tayeh N,等。CBF/DREB1基因序列位于截叶苜蓿第6染色体上一个主要的耐寒QTL区。中国生物医学工程学报。2013;14(1):814。
- 33.
Kanchupati P,等。苜蓿cbf样基因家族:拟南芥CBF3的表达分析及潜在功能同源物的鉴定。作物科学,2017;57(4):2051-63。
- 34.
Shu Y,等。转录组测序分析表明,CBF基因在苜蓿抗冻胁迫中可能发挥重要作用。中国生物医学工程学报,2017;40(4):824-33。
- 35.
Michel S,等。通过基因组选择提高和保持面包小麦的抗寒性和抗冻性。中国植物科学,2019;10:1195。
- 36.
Beil CT,等。兼性和冬小麦基因型间冬季生存能力的基因组选择。动物育种。2019;39(2):29。
- 37.
Simeão Resende RM, Casler MD, de Resende MDV。牧草育种中的基因组选择:准确性和方法。作物科学,2014;54(1):143-56。
- 38.
Poudel HP,等。美国北部低地柳枝稷冬季生存的基因组预测。G3(贝塞斯达)。2019; 9(6): 1921 - 31所示。
- 39.
贾C,等。苜蓿25个农艺性状和品质性状的基因组预测。植物科学,2018;9:1220-0。
- 40.
Biazzi E,等。紫花苜蓿饲草品质性状的全基因组关联定位与基因组选择。公共科学学报,2017;12(1):e0169234。
- 41.
水稻B,李卡AE。在玉米和高粱中纳入峰值全基因组关联研究信号的RR-BLUP基因组选择模型的评估植物基因组学报,2019;12(1):180052。
- 42.
张晓东,张晓明,张晓明。中间小麦草产量组成性状的全基因组关联研究及其在基因组选择和育种中的意义。G3(贝塞斯达)。2019; 9(8): 2429 - 39。
- 43.
贝尔纳多R.全基因组选择,当主要基因是已知的。作物科学,2014;54(1):68-75。
- 44.
Zaïm M等,干旱条件下四种硬粒小麦群体的QTL分析和基因组预测。前沿遗传学2020;11(316)。
- 45.
Adhikari L, Makaju SO, Missaoui AM。四倍体苜蓿开花时间与生物量产量的QTL定位。BMC植物学报,2019;19(1):359。
- 46.
Adhikari L, Missaoui AM。四倍体紫花苜蓿抗叶锈病的数量性状位点定位。《物理与植物病理学》2019;106:238-45。
- 47.
Adhikari L, Missaoui AM。低pH土壤中苜蓿结瘤对补钼的响应及其与根、梢生长的相关性植物学报,2017;40(16):2290-302。
- 48.
道尔·j·d,道尔·j·l 1987。一种用于少量新鲜叶片组织的快速DNA分离程序。植物化学通报,1987;19:1。
- 49.
李X,等。同源四倍体苜蓿饱和遗传连锁图谱(苜蓿.)利用测序基因分型技术与截叶苜蓿基因组高度同向。G3(贝塞斯达,马里兰州)。2014; 4(10): 1971 - 9。
- 50.
Lu F,等。柳枝稷基因组多样性、倍性和进化:基于网络的SNP发现协议的新见解。公共科学学报,2013;9(1):e1003215。
- 51.
Melo AT, Bartaula R, Hale I. GBS-SNP-CROP:利用可变长度、配对端测序数据进行SNP发现和植物种质鉴定的参考可选管道。生物工程学报。2016;17(1):1 - 15。
- 52.
Van Ooijen JW。JoinMap®5,用于计算二倍体物种实验种群遗传连锁图的软件。瓦赫宁根:Kyazma B.V.;2018.
- 53.
王山,曾哲,巴斯滕C, Windows QTL制图器2.5版。统计遗传学。罗利:北卡罗来纳州立大学;2005.
确认
我们要感谢Jonathan Markham先生在种植和现场数据收集方面对这项研究的帮助。我们还要感谢Kathryn Prado女士和Muna Sharma女士在克隆繁殖体准备方面的帮助。
资金
这项工作得到了美国农业部国家食品和农业研究所Hatch/Evans-Allen/McIntire Stennis项目的支持[1008718]。基金用于实验设置和基因分型。佐治亚大学品种开发和研究项目为室内冷冻筛选和数据生成提供了部分资金。这笔资金用于技术人员支助实地检查。
作者信息
从属关系
贡献
LA进行表型数据收集、冷冻试验、测序数据分析、基因分型和稿件撰写;SOM参与表型分型、克隆制备和手稿修改;OML协助抗冻性试验方案设计及实验完成;AMM设计了实验,审查了数据分析,并撰写了手稿。所有作者都阅读并批准了文章的提交版本。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
补充文件1:补充文件S1。
在QTL区域内识别的侧翼标记序列和峰值标记。每个SNP的两个变异等位基因分别表示为“query”和“hit”。
补充文件2:补充文件S2。
Fasta序列米.truncatula耐寒相关基因脱水反应元件结合蛋白1C(也称为CBF5)的数据来自国家生物技术信息中心(NCBI)。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
Adhikari, L., Makaju, S.O, Lindstrom, O.M.et al。基于室内表型的苜蓿耐寒QTL定位。BMC植物生物学21日,403(2021)。https://doi.org/10.1186/s12870-021-03182-4
收到了:
接受:
发表:
关键字
- 紫花苜蓿
- GBS
- 单核苷酸多态性
- CBF
- 冻结公差
- 冬季生存
- 种质
- 耐寒性