摘要
背景
芸苔属植物carinataBraun作为一种可持续的生物燃料作物最近在全世界获得了越来越多的关注。b . carinata在许多地区作为夏季作物种植,在生长季节,高温是一个重要的压力。然而,很少有人进行研究来了解这种作物对高温的反应机制。了解改善这种作物高温适应性的性状对于开发耐热品种是至关重要的。本研究探讨了脂肪重塑b . carinata对高温应力的响应。一个商业品种Avanza 641,在阳光控制的环境条件下,在土壤-植物-大气-研究(SPAR)室中,在最佳温度(OT;23/15°C)的条件。播种后8天,植物暴露于三种温度处理中的一种[OT,高温处理-1 (HT-1;33/25°C)和高温处理-2 (HT-2;38/30°C)]。温度处理期持续至播后84 d末收。播种后74天采集叶片样品,用电喷雾电离三重四极杆质谱分析脂质。
结果
温度处理显著影响Avanza 641的生长发育。两种高温处理均引起叶片脂质组的改变。这些改变主要表现为膜脂不饱和水平的降低,这是脂质重塑的累积效应。不饱和指数的下降是由(a)含有高度不饱和亚麻酸(18:3)的脂类减少和(b)含有较少不饱和脂肪酸的脂类增加引起的,如油酸(18:1)和亚油酸(18:2)和/或饱和脂肪酸,如棕榈酸(16:0)。第三个可能有助于降低不饱和水平的机制,特别是对叶绿体膜脂而言,是向由真核途径产生的脂类的转移,以及由真核途径产生的由较少不饱和脂肪酸组成的甘油脂的通道进入叶绿体。
结论
脂质改变似乎是在高温条件下保持最佳膜流动性的适应机制。在本研究中发现的有助于热应激反应的脂类相关机制可用于开发耐热性和最终耐热性品种的生物标志物。
背景
芸苔属植物carinataA. Braun,通常被称为埃塞俄比亚芥末,阿比西尼亚芥末,或carinata,是一种在北美,南美,欧洲和澳大利亚的新兴油料作物。生物燃料作物的一个基本特征是它对土地使用变化的影响最小,即取代粮食和饲料作物的土地。龙葵是一种淡季作物、轮作作物和边缘土地作物,为可持续生物燃料作物提供了潜在的选择[1,2,3.,4,5,6,7].龙葵的高芥酸含量(40 - 45%)不仅提高了它作为生物燃料作物的适用性[2,8,9还提高了它在工业应用方面的价值,如塑料、润滑剂、油漆、皮革鞣制、肥皂和化妆品的制造[10,11].此外,有研究报道,海豆荚能耐受干旱和寒冷等非生物胁迫,并能抵抗多种病虫害[12,13,14,15].其减少夏季杂草种子库的能力使其适合于作物生产系统中的虫害综合治理[7,16].龙葵也有潜力作为饲料作物(由于其高蛋白和低纤维含量[17,18,19])和生物增肥剂(含高硫代葡萄糖苷的品种[20.])。在过去的几年里,公共和私营实体共同努力,在美国将海豆荚建立为一种可持续的生物燃料作物[1,16,21,22,23,24].
龙葵在许多地区作为夏季作物种植,预计在生长季节高温将是一个重要的压力。关于龙葵对高温的反应资料有限。最近一项研究利用12个基因型研究了高温胁迫对龙葵的影响[25].同一研究还发现,高温胁迫(27/19ºC)对龙葵萌发和早期生长的芽、根和生理性状有显著影响。然而,驱动高温敏感性的潜在机制尚不清楚[25].要开发耐高温品种,就必须了解使该物种适应高温的机制。
先前对其他物种的研究表明,脂质代谢的改变显著影响植物适应高温胁迫的能力[26,27,28,29,30.,31,32].脂类和蛋白质是生物膜的主要成分。膜脂成分的动态特性对于维持细胞乃至整个植物的内稳态以响应生长温度的波动至关重要[33].多种脂类被认为在应激信号或适应机制中起作用[29,34,35,36,37,38].最近在另一处发现了它芸苔属植物物种(芸苔属植物显著L.,油菜)的研究表明,夜间高温导致脂肪酸分解代谢相关基因的过度表达,从而导致夜间赤霉素信号上调[39].此外,最近在其他物种的研究表明,耐热和敏感基因型在脂质组的热诱导变化上存在差异。这些变化有可能作为选择耐热基因型的生物标志物[29,30.,32].
本研究采用自动直接输注电喷雾电离-三重四极杆质谱(ESI-MS/MS)技术研究了热诱导下黄芪叶片脂质组的变化b . carinata.目的是确定与高温胁迫反应相关的脂质相关机制。
结果
高温胁迫影响生长性状
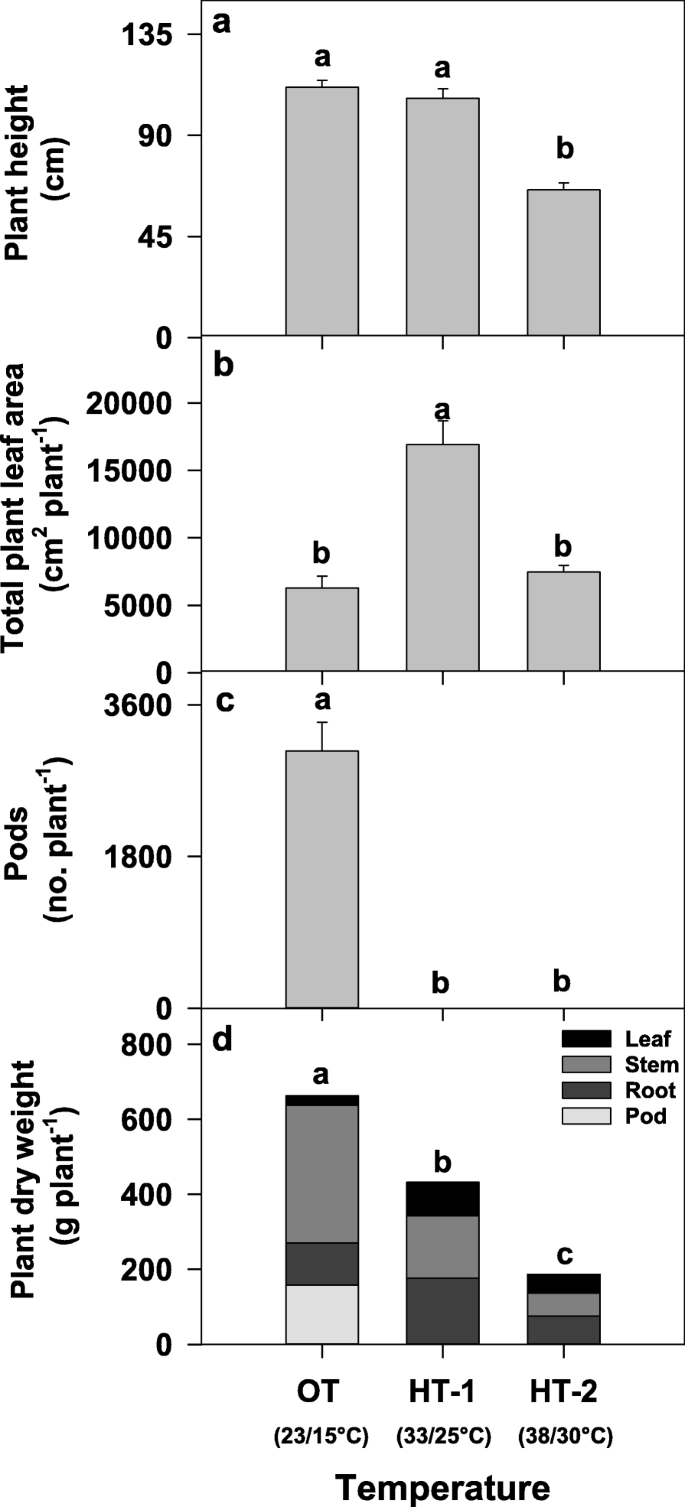
温度处理显著影响Avanza 641的生长发育。1).在最佳温度23/15℃下,第一次抽苔(花序出现)和开花所需天数分别为41.7±0.33和47.9±0.35。在高温(ht - 1,33 /25和ht - 2,38 /30°C)下生长的植株在84天的时间内没有栓花或开花,表现出完全的繁殖失败。植株产生3052±342个荚果−1而HT-1和HT-2没有。在HT-1条件下生长的植株叶面积比在OT条件下生长的植株叶面积大(+ 169%)。另一方面,OT处理的植株总干重显著增加,HT-1和HT-2处理的植株总干重显著降低(- 35%)。
采用电喷雾电离-三重四极杆质谱(ESI-MS/MS)对叶片脂质进行定性和定量分析。
ESI-MS/MS方法定量分析了Avanza 641树叶中的105种脂质分析物(补充表S1,附加文件)1).这些脂类包括可塑性脂类[DGDG,双半乳糖二酰基甘油;MGDG、monogalactosyldiacylglycerol;PG,磷脂酰甘油],塑外脂类[PC,磷脂酰胆碱;PE、磷脂酰乙醇胺;π,磷脂酰肌醇;PS、磷脂酰丝氨酸、LPC、溶血磷脂酰胆碱;和LPE,溶血磷脂酰乙醇胺]和磷脂酸(PA)。方差分析结果显示,在高温胁迫下,叶片脂质组的组成发生了显著变化(补充表S2,附加文件1).
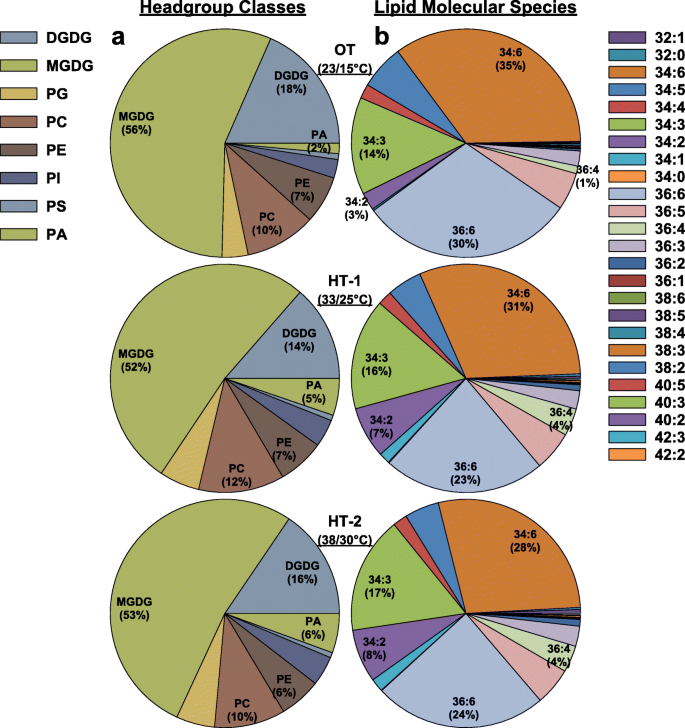
对照处理(OT;23/15°C)以MGDG(56%)、DGDG(18%)和PC(10%)为主,共占归一化质谱强度的约85%(图5)。2a). OT中相同的三个头组类也是HT-1和HT-2的主要类。在两种高温处理下,它们加起来占总脂类的78%左右(图5)。2一个)。
饼图描述不同脂质头组的组成(一个)和脂质分子种类(b)对Avanza 641叶片进行不同温度处理。OT,昼/夜最佳温度;高温处理-1;高温处理-2。DGDG digalactosyldiacylglycerol;MGDG、monogalactosyldiacylglycerol;PA,磷脂酸;电脑,磷脂酰胆碱;PE、磷脂酰乙醇胺;PG, phosphatidylglycerol; PI, phosphatidylinositol; PS, phosphatidylserine. Lipid molecular species are identified as total acyl carbons: total double bonds
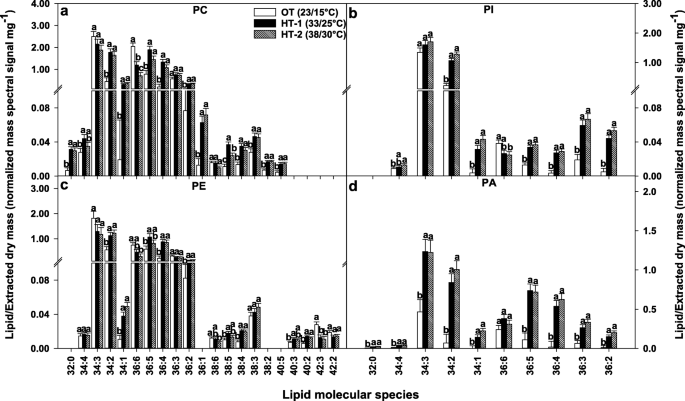
根据脂质分子物种组成分析,OT条件下叶片脂质组以34:6(35%)、36:6(30%)和34:3(14%)三个脂质分子物种为主,共占所有脂质物种的79%(图4)。2b).在HT-1条件下,同样的三种脂类占优势,共占脂类总种类的70%(图1)。2b).同样,在HT-2条件下,同样的三种脂类占主导地位,共占总脂类的69%(图2)。2b).与OT相比,HT-1处理下34:6和36:6的水平分别降低了11%和23%。同样,与OT相比,HT-2条件下两种脂类的水平降低了20%。相比之下,在HT-1和HT-2条件下,34:3分别增加了14%和21%。在两种高温处理下,34:1(556 - 680%)、34:2(133 - 167%)和36:4(300%)的产量显著增加(图。2b)。
在高温胁迫下,头组类的不饱和水平和脂类组成发生了变化
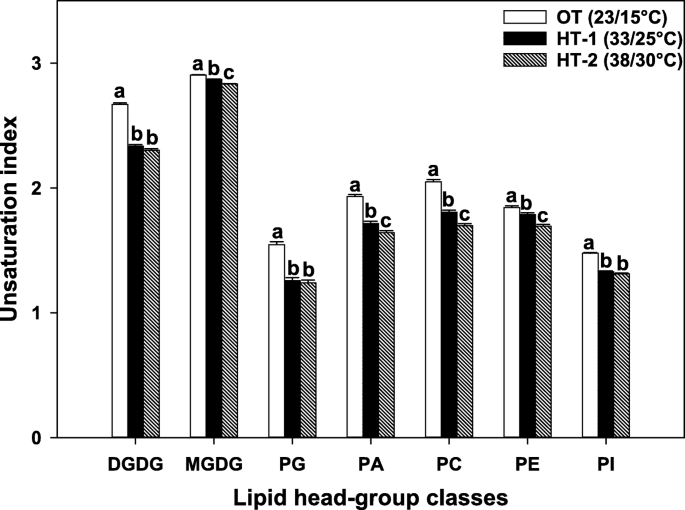
在进行主成分分析时,高温胁迫和OT之间叶片脂质组的差异清楚地反映在温度处理的分离中,主成分1和2分别捕获了脂质数据总变化的64.5和23.5%(补充图S1,附加文件)2).高温应力导致所有头组的不饱和水平显著降低。3.).此外,四个头群(MGDG、PA、PC和PE)的不饱和水平从HT-1显著降低到HT-2。
高温胁迫下脂质不饱和水平的变化。脂质分子物种的不饱和指数是指每个酰基链上的双键数的平均值,它是由该脂质分子物种的酰基链上的双键总数除以其酰基链数得到的。对于脂质头族类,不饱和指数的计算方法如前所述[29]:\(\frac{\sum \左(\mathrm{不饱和}\ \mathrm{in}\mathrm{dices}\ \mathrm{of}\ \mathrm{in}\mathrm{in}\mathrm{个体}\ \mathrm{物种}\ \ \mathrm{in}\ \mathrm{the}\ \mathrm{class}\ \mathrm{amount}\ \ \ \mathrm{of}\ \mathrm{all}\ \ \mathrm{脂类}\ \ \mathrm{分子}\ \mathrm{物种}\ \ \柱形表示最小二乘均值,误差柱形表示相应的标准误差。根据Fisher最小显著性差异检验,不同字母的最小二乘均值在α = 0.05处差异显著。OT,昼/夜最佳温度;高温处理-1;高温处理-2。DGDG digalactosyldiacylglycerol;MGDG、monogalactosyldiacylglycerol;PA,磷脂酸;电脑,磷脂酰胆碱;PE、磷脂酰乙醇胺; PG, phosphatidylglycerol; PI, phosphatidylinositol; PS, phosphatidylserine
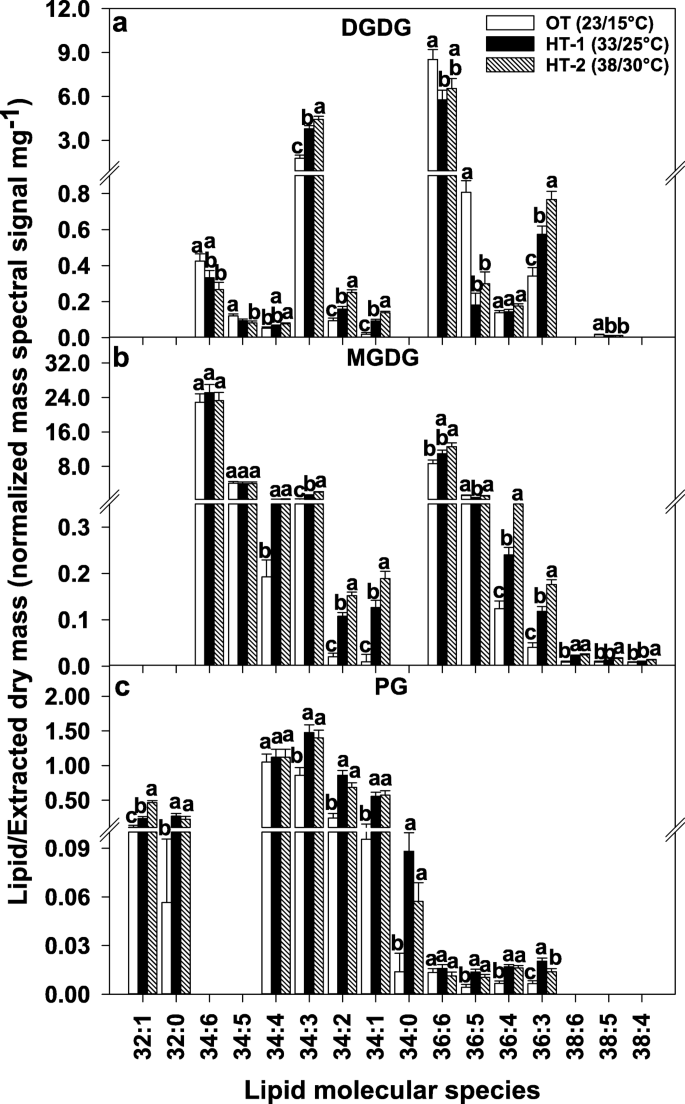
在高温应力作用下不饱和指数的降低方式上,各头组之间存在着相似和差异。高不饱和脂类,即含有两个三烯酰基链的脂类,如34:6(18:3/16:3)和36:6(18:3/18:3),在两种高温处理下均显著减少。其中包括塑性脂质种类DGDG(34:6)和DGDG(36:6)(图。4),以及塑外脂质种类PC(36:6)、PE(36:6)和PI(36:6)。5).相比之下,可塑性脂质种类MGDG(36:6)对HT的反应显著增加,但MGDG(34:6)和PG(36:6)没有显著变化(图6)。4)和PA(36:6)(图。5).此外,几种不饱和和饱和脂类对高温的反应显著增加。在质体中,脂质种类DGDG 34:2、34:1和36:3;MGDG 34:2, 34:1, 36:4,和36:3;PG 32:1、32:0、34:2、34:1、34:0、36:4、36:3增加(图4).塑外脂质种类PC 32:0, 34:2, 34:1, 36:4, 36:4, 36:2, 36:1;PE 34:2, 34:1, 36:4,和36:2;PI 34:2, 34:1, 36:4, 36:3, 36:2, PA 32:0, 34:2, 34:1, 36:4, 36:3, 36:2也增加了(图。5).当检测不同脂质头基类的脂肪酸组成时,观察到相同的趋势,饱和(16:0和18:0)和/或不饱和(18:1和18:2)的酰基链在高温下增加,而高度不饱和的18:3酰基链减少(表2)1).综上所述,脂质分子种类组成水平的脂质重塑对降低不饱和水平有很大的贡献。
高温胁迫下可塑性脂质分子种类水平的变化。所示的所有脂质分子种类均通过了检测限(LOD > 0.002 nmol)和变异系数(CoV < 0.3)截止点(详见“方法”)。柱形代表最小二乘均值,误差柱形代表相应的标准误差。根据Fisher最小显著性差异检验,不同字母的最小二乘均值在α = 0.05处差异显著。OT,昼/夜最佳温度;高温处理-1;HT-2、高温处理-2;DGDG digalactosyldiacyglycerol;MGDG、monogalactosyldiacylglycerol;PG, phosphatidylglycerol。脂类分子种类被鉴定为全酰基碳:全双键
高温胁迫下脂质外和磷脂酸(PA)分子种类水平的变化。所示的所有脂质分子种类均通过了检测限(LOD>0.002 nmol)和变异系数(CoV<0.3)截止点(详见“方法”)。柱形代表最小二乘均值,误差柱形代表相应的标准误差。根据Fisher最小显著性差异检验,不同字母的最小二乘均值在α = 0.05处差异显著。OT,昼/夜最佳温度;HT-1、高温处理-1;HT-2、高温处理-2;电脑,磷脂酰胆碱;π,磷脂酰肌醇;PE、磷脂酰乙醇胺。脂类分子种类被鉴定为全酰基碳:全双键
34:3品种在高温处理下叶绿体结构脂(DGDG、MGDG和PG)和胞外结构脂(PC和PE)的含量变化趋势相反。而在高温处理下,34:3种DGDG、MGDG和PG增加(图4)。4), PC和PE的比例为34:3。5).尽管在叶绿体和塑外膜中都存在PA(34:3),但在高温处理下PA(34:3)显著增加(图4)。5).总的来说,在高温处理下,C34 DGDG脂类增加,C36 DGDG脂类减少,C34和C36 PA脂类增加(补充图S2,附加文件)2).
讨论
温度处理显著影响Avanza 641的生长性状。观察到的生殖诱导失败和营养生长的延续B.carinata在HT-1和HT-2的观测结果与先前在高地的观测结果相似(陆地棉l . (40])和皮玛(海岛棉l . (41)棉花品种和显著l . (42,43].在HT-2条件下生长的植株比在OT和HT-1条件下生长的植株短。1a). HT-1处理的单株叶面积大于OT和HT-2处理(图2)。1b).中高温(HT-1)处理下叶面积增大是由于生殖诱导失败,促进了营养生长。在高温处理(HT-2)中观察到的较低叶面积是由于叶片较小(数据未显示)。单株总干物质产量(叶、茎、荚和根的重量)在HT-1和HT-2处理下显著降低(图2)。1D)很大程度上是由于缺乏高温胁迫下的豆荚。
半乳糖类MGDG和DGDG占总叶脂的大部分(66 - 74%;无花果。1a) Avanza 641在所有三种温度处理(OT, HT-1和HT-2)下。这是意料之中的,因为半乳糖是质体的主要膜脂,而在光合组织中质体极为丰富[44,45,46,47].
Avanza 641对高温的主要反应是膜脂不饱和水平的降低。3.),这是一种脂质重塑的累积效应。降低细胞膜中的脂质不饱和水平可使植物在生长温度升高时保持最佳的膜流动性[27,29,30.,32,33,48].尽管植物脂质组在高温胁迫下的一个常见反应是不饱和水平的降低,但耐热基因型的不饱和水平降低幅度大于热敏感基因型[27,29,30.,32,33,48].
Avanza 641用于降低脂质不饱和水平的两种机制是:减少高不饱和脂质种类(例如,34:6和36:6)和增加低不饱和和/或饱和脂质种类(例如,32:0、34:2、34:1、36:3和36:2)。2b,4而且5).这种结合在DGDG、PC、PE和PI头组类中最为明显。4而且5).34:6和36:6的脂质在高温下减少(表1),含有高不饱和亚麻酸(18:3),36:6中含有两种,34:6中含有一种。34:6,脂类中除了18:3还含有16:3的脂肪酸。脂肪酸去饱和酶(FAD) 3、FAD7和FAD8是催化18:2脂肪酸转化为18:3的酶(FAD3在ER中,FAD7/8在质体中)。质体中16:2到16:3的转化也由FAD7/8催化。通过降低18:3和/或16:3脂肪酸的含量来降低脂质不饱和水平FAD3,FAD7和/或FAD8基因可能是植物的热适应机制[30.,32,49,50].
在高温胁迫下增加的不饱和脂类中,许多含有亚油酸(18:2)。脂肪酸去饱和酶2催化内质网(ER)中18:1的脂肪酸转化为18:2。据报道,表达FAD2基因增加是多种植物对热胁迫的适应机制,包括花生(落花生hypogaeal .) [32),大豆(大豆l .)[稳定30.),拟南芥l . (28),而滨藜属lentiformisl . (28].在本研究中,在高温下,塑性外结构脂PC和PE中18:2/18:3酰基链的比例显著增加(图1)。6),因为增加了18:2个水平,而减少了18:3个水平1).因此,Avanza 641中含有18:3脂肪酸的脂类数量的减少和含有18:2脂肪酸的脂类数量的增加导致的塑外脂类不饱和水平的降低可能是由于表达量的减少FAD3基因表达增加FAD2基因。未来的研究可以通过测量的表达来证实这一假设FAD3而且FAD2基因。也有可能是在高温胁迫下,膜脂不饱和水平的降低与膜脂不饱和的速率一致新创脂肪酸合成[49].
MGDG(34:6)在高温胁迫下没有减少,而MGDG(36:6)显著增加(图4)。4).然而,由于一些不饱和度较低的MGDG物种的显著增加,MGDG的不饱和指数下降了。4),如HT-1和HT-2下单不饱和MGDG(34:1)分别增加了13.7倍和20.4倍(图5)。7).在脂肪酸组成水平上,在高温下,MGDG和DGDG的饱和脂肪酸棕榈酸(16:0)均显著增加(表1)的初始产物新创脂肪酸生物合成(46].法尔科内等人[49)中观察到的一个.芥叶片膜脂响应高温显著增加16:0,显著降低16:3,这有助于膜脂不饱和水平的降低。值得注意的是,这种对高温的反应增加了16:0,作者将其归因于新合成的脂肪酸,即使在脂质生物合成突变体中也是恒定的fad7 fad8而且fad6,那里很少或没有生产16:3 [49].考虑到DGDG的16:3水平下降(表1),这需要以MGDG为前驱体,并且在DGDG和MGDG中,16:0水平均显著增加(表1),新脂肪酸的生物合成增加,同时下调FAD7/8基因可能有助于降低这两种半乳糖的不饱和水平。这种16:0优于16:3的优先积累反映在高温下DGDG和MGDG的16:0/16:3比值的显著增加上(图。6).
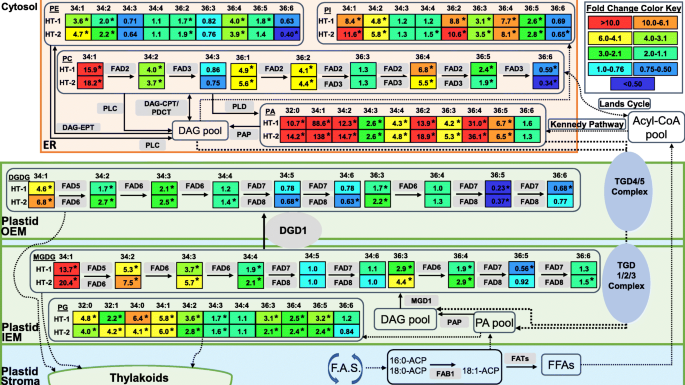
在已知脂质代谢途径的背景下,综合本研究结果的脂质代谢图谱[27,45,51,52,53,54,55].虚线箭头表示多步转化或脂质运输途径。脂类分子种类被鉴定为全酰基碳:全双键。计算各高温处理下的叠度变化值为:HT-1 = (HT-1下的脂质值/ OT下的脂质值),HT-2 = (HT-2下的脂质值/ OT下的脂质值)。在脂质的折叠变化值旁边的星号(*)表示在相应的处理下,该脂质在α = 0.05处有显著变化。ACP,酰基载体蛋白;辅酶A,辅酶A;DAG甘油二酯;DAG-CPT CDP-choline:甘油二酯cholinephosphotransferase;DAG-EPT CDP-ethanolamine:甘油二酯cholinephosphotranserase; ER, endoplasmic reticulum; FAB1, fatty acid biosynthesis 1; FAD, fatty acid desaturase; F.A.S., fatty acid synthesis; FAT, fatty acyl-ACP thioesterase; FFAs, free fatty acids; IEM, plastid inner envelope membrane; MGDG, monogalactosyldiacylglycerol; OEM, plastid outer envelope membrane; PA, phosphatidic acid; PAP, phosphatidic acid phosphatase; PC, phosphatidylcholine; PDCT, phosphatidylcholine:diacylglycerol cholinephosphotransferase; PE, phosphatidylethanolamine; PG, phosphatidylglycerol; PI, phosphatidylinositol; PLC, phospholipase C; TGD, trigalactosyldiacylglycerol (lipid transporter protein). OT, optimal day/night temperatures, 23/15°C; HT-1, high temperature treatment-1, 33/25°C; HT-2, high temperature treatment-2, 38/30°C
除了改变去饱和酶的活性外,植物在响应温度胁迫时调节膜不饱和水平的另一种方法是,通过导通具有特定酰基链组成的DAG/PA基团,调节叶绿体和细胞质质内质网之间的酰基脂质代谢通量[28,56,57].在植物中,甘油脂的组装发生在质体(原核途径)和ER(真核途径)[46].质体和内质网脂代谢酶的底物特异性只允许C16脂肪酸在sn-2位置的质体衍生的甘油脂和只有C18脂肪酸在sn-2 er衍生甘油脂的位置[46,51,58].自从ER-derivedsn-116:0不是质体去饱和酶的底物,这种酰基链在质体的脂质中不会发生进一步的去饱和。因此,与原核途径相比,真核途径可以产生不饱和水平较低的脂质,例如,真核生物C34:3 (16:0/18:3) vs.原核生物C34:6(18:3/16:3)。因此,为了降低高温条件下叶绿体脂肪酸去饱和的可能性,植物可能会抑制原核途径的输入(如减少C34:6的形成),并增强真核脂质(如C34:3)向叶绿体的通道[28].Li等人支持这一机制。[28]发现在高温条件下,具有er衍生DAG/PA基团的C34 MGDG和DGDG脂类增加,而头部组的34:6和36:6脂类减少答:芥而且答:lentiformis.油菜籽也有同样的趋势(显著;与Avanza 641属相同),除了MGDG(36:6)显示增加,如果真核和原核脂质组装的比例增加,这是可以预期的[57].在本研究中,Avanza 641似乎采用了类似的脂质通道机制来重塑其脂质组以应对高温胁迫,这种机制在DGDG中最为明显,34:6和36:6脂质显著减少,34:3脂质显著增加(图4)。4).此外,不饱和的DGDG物种可能含有C18在sn-2的位置也增加了(例如,34:2,34:1,和36:3)。4).
我们观察到PC(34:3)和PE(34:3)在高温下均有所下降,而PA(34:3)显著升高(图4)。5).这些观察结果与高温下C34 DGDG脂类增加,C36对应脂类减少,C34和C36 PA脂类增加有关(补充图S2,附加文件2)表明温度诱导的植物脂质通路调整。可能是真核途径进入DGDG的C34:3脂质最终来源于PC, PA作为运输方式将甘油脂质部分运送到叶绿体脂质中。李等人。[28]也观察到与我们观察到的相同的PA中C34的增加,并证实通过PA进入MGDG和DGDG的C34甘油脂部分的组成为16:0/C18 (sn1 /sn-2),显著降低了两个头群的不饱和水平。因此,进一步的研究可以确定是否相同的甘油脂组分通道进入Avanza 641的叶绿体,以降低叶绿体膜脂的不饱和水平。
可能导致叶脂质组改变的代谢途径b . carinata在植物脂质代谢的广泛背景下,对高温胁迫下的反应进行了总结,并在图中显示。7.简单地说,脂肪酸是在质体中合成的,在质体中它们可以被并入塑性脂类,也可以被输出到内质网并并入塑性外脂类。在内质网中,附着在PC上的脂肪酸可以通过Lands循环返回酰基辅酶a池;通过cdp -胆碱:二酰基甘油胆碱磷酸转移酶(dagg - cpt)或磷脂酰胆碱:二酰基甘油胆碱磷酸转移酶(PDCT)转移到DAG脂类,通过磷脂酶C (PLC)去除整个磷酸基头组,通过磷脂酶D (PLD)产生PA去除PC头组,然后通过磷脂酸磷酸酶(PAP)去除剩余的磷酸盐,或通过Kennedy途径将酰基辅酶a池中的修饰脂肪酸并入DAG;或通过前面提到的先转化为DAG脂类,然后通过cdp -乙醇胺:二酰基甘油胆碱磷酸酶(DAG- ept)转移乙醇胺头基,从而转移到PE脂类[59,60].由三半乳糖酰二酰基甘油(TGD)蛋白1到5组成的多蛋白转运复合物以单向方式将er组装的脂质运输到质体的外膜(OEM) (TGD4/5)和内膜(IEM) (TGD1/2/3) [61,62,63,64,65,66,67,68,69].er组装的PA通过TGD复合物转移到质体膜上,可被磷脂酸磷酸酶(PAP)去磷酸化生成DAG, DAG是半乳糖的前体[52,70].真核和原核DAG都是由位于质体IEM的单半乳糖酰二酰基甘油合成酶1 (MGD1)半乳糖化形成的。然后,双半乳糖酰二酰基甘油合成酶1 (DGD1)可将MGDG转化为DGDG [71].脂肪酸在质体和内质网中酯化为甘油脂,可以通过去饱和酶(FADs)进行去饱和。植物可以通过调节FADs活性来调节膜脂的不饱和水平。在高温胁迫下,植物可能通过降低催化形成高不饱和亚麻酸(18:3)的FAD3、FAD7和/或FAD8酶的活性和/或提高催化形成不饱和亚油酸(18:2)或饱和棕榈酸(16:0)的FAD2和/或脂肪酸生物合成酶的活性来做出反应。植物也可以抑制它们的原核途径,同时增强它们的真核途径。这促进了不饱和较低的er衍生甘油脂的通道,作为降低叶绿体膜脂不饱和水平的一种相对快速的手段。在Avanza 641中观察到这两种脂质重塑性状。7).
结论
高温处理(33/25和38/30°C)显著影响了Avanza 641的生长发育,并引起叶片脂质组的改变。脂质改变似乎是在高温条件下保持最佳膜流动性的适应机制。叶片脂质组的重塑主要表现为膜脂不饱和水平的降低。导致脂质不饱和水平降低的可能机制有:(1)含高不饱和18:3脂肪酸的脂质含量降低;(2)不饱和脂肪酸含量较低的脂类(如18:2、18:1)和饱和脂肪酸含量较低的脂类(如16:0)增加;(3)特定真核途径衍生的脂质向叶绿体的通道增加。
随着最近的可用性b . carinata具有不同耐热性水平的基因型,现在可以比较物种内脂质组和相关酶活性的适应变化的幅度,以确定脂质相关的耐热性生物标志物。进一步研究不同组织类型的脂质组或脂质组在不同时空环境下的变化,将为提高龙葵的耐热性提供必要的依据。最后,利用其他领域现有工作的比较研究芸苔属植物油菜或油菜籽等品种(甘蓝型L.)可以潜在地识别出适用于整个属的稳定生物标志物。
方法
植物材料和生长条件
本研究使用的植物材料是一种释放品种b . carinata种子来自佛罗里达大学(University of Florida)的Ramdeo Seepaul博士;原始种子来源为Agrisoma Biosiences Inc., Quebec, Canada;收集种子样本不需要许可)。它是目前在美国东南部的一个商业品种(不是转基因)。根据种子活力性状,该品种在早期营养生长阶段为热敏型,在种子萌发阶段为中度热敏型[25].
所有的植物实验都按照相关的指导方针和规定进行。植物是在阳光控制的环境条件下生长的,这种环境条件被称为密西西比州立大学的土壤-植物-大气-研究(SPAR)室。72].每个SPAR室有一个土壤箱(1米深× 2米长× 0.5米宽)存放植物的地下部分,一个有机玻璃室(2.5米高× 2米长× 1.5米宽)存放地上部分。有机玻璃允许97%的可见太阳辐射,并且在可见光光谱(400-700纳米)内不区分。在研究期间,SPAR室的白昼时间从12.56到14.17小时不等。
Avanza 641的种子于2018年6月7日在聚氯乙烯(PVC)花盆(直径15.24厘米,高30.48厘米,体积5.5 L)中播种,花盆中填充3:1 (v/v)土壤:沙子混合物。用纯砂(粒径小于0.3 mm)灌满罐子,每个罐子底部放500 g砂砾,插入填满沙子的土仓中,使罐子顶部与土仓顶部对齐。在每个花盆中播种5颗种子,但在出苗一周后进行间苗,以便每个花盆只保留一株植物。因此,在研究中使用的三个SPAR室中,每个花盆(复制)都保留了9个花盆(每个复制),每个复制包含一株植物。植物/花盆排列在3行,行距0.66 m, 9株植物米−2.
为了确保植物不经历任何水分胁迫,花盆用全强度Hoagland营养液灌溉[73]透过自动滴灌系统,每罐一个滴灌器,每滴灌器每分钟排出50毫升水−1.灌溉量为前一天测量的蒸散发量的120% [72,一天分成三次。所有SPAR室的幼苗最初生长在最佳温度(OT;日最高/夜最低23/15°C)至播种后8天。之后,三种温度处理[OT,高温处理-1 (HT-1;33/25°C)和高温处理-2 (HT-2;38/30°C)]被随机分配到三个SPAR腔室。根据Persaud [25和布特等人。[74].Persaud [25]发现22/14°C是龙葵早期生长发育的最佳温度,27/19°C开始出现明显的热损伤。布特等人[74报告了龙葵各种生长发育过程的基本温度;最佳温度一般在25℃左右,顶棚温度一般≥35℃。每隔10秒监测和调整每个SPAR单元的空气温度,并通过调节空气通过植物冠层,以足够的速度引起叶片颤振(4.7 km h),将温度维持在设定值±0.5°C内−1),然后被送回土壤上方的空气处理装置。冷却后的乙二醇通过几个平行的电磁阀供应到冷却系统,这些电磁阀根据冷却需求开启或关闭。为了微调空气温度,两个电阻加热器根据需要提供短脉冲热。的有限公司2浓度(有限公司2],全天每10秒监测和调整一次,并使用专用的LI-6250 CO保持在420±10ppm2分析仪(LI-COR, Inc., Lincoln, NE)。室内空气温度[CO2],每个SPAR装置的盆栽浇水以及环境和植物气体交换变量的持续监测均由专用计算机系统控制[72].白天的温度在日出时开始,在日落1小时后恢复到夜间温度。温度处理期持续至2018年8月29日最终收获(播种后84天)。
通过安装在航空管道回程路径上的传感器(HMV 70Y, Vaisala, Inc.,圣何塞,加利福尼亚州)监测每个腔室的相对湿度。根据这些测量结果,按Murray [75温度处理期间OT为0.65±0.01 kPa, HT-1为0.97±0.04 kPa, HT-2为1.12±0.05 kPa。
植物生长在环境光照条件下。在实验过程中,SPAR单元外部的每日太阳辐射(285-2800纳米)由一个比辐射计测量(模型4-8;Eppley实验室公司,Newport, RI),范围为4.40至34.25 MJ m−2d−1平均为22.54±14.40 MJ m−2d−1.可变密度的遮阳布,用来模拟冠层光谱特性,放置在植物冠层的边缘,定期调整以匹配冠层高度,并消除对边缘植物的需要。
生长性状的测定
株高测定为最终收获时(播种后84天)土壤表面与顶端分生组织之间的距离。每株的荚果数是在最后收获时计算所有植物的荚果数。在最终收获时,使用LI-3100叶面积计(LI-COR, Inc., Lincoln, NE)测量整个植物叶面积。只使用绿色和黄色的叶子来测量叶面积。干燥的叶子没有被用来测量叶面积,而是用来测量叶干重。在收获的时候,每个花盆里都有根系的土壤培养基被放在细筛网上,用温和的水流彻底清洗以收集根系。植物的组成部分,叶,茎,荚和根,在75°C的烤箱中干燥,直到达到恒定的重量。每一温度处理对9个植株(复制体)的所有生长性状进行测定。
叶片脂质提取
播后74天(即温度处理期第66天)10:00 - 11:00采集约0.5 g的叶盘。每次温度处理从5个植株(复制组)顶部的第3个完全成熟的叶片上收集叶瓣。按照前面所述进行叶盘收集和脂质提取[76].简单地说,每株植株很快就能获得10个叶盘。3个软木钻孔器,并立即转移到6毫升预热(75°C 15分钟)含有0.01%丁基羟基甲苯(BHT)的异丙醇在50毫升玻璃管中。加入叶盘后,试管再次在75°C保存15分钟,使脂质水解酶失活。将带叶盘的溶剂冷却至室温,在溶剂中加入3 ml氯仿和1.2 ml蒸馏水,样品管置于-20℃保存,待进一步处理。
进一步的脂质提取是通过在室温下在轨道摇床上摇1小时来进行的。每个试管中的溶剂用巴斯德移液器转移到新的试管中,留下叶瓣。对叶片,加入4毫升氯仿:甲醇(2:1)和0.01 % BHT,并在室温下放置在轨道摇床上过夜。第二天,用巴斯德移液管将每个试管中的溶剂转移到前一天转移的初始溶剂的试管中。三步:加入4 ml氯仿:甲醇(2:1)与0.01 % BHT,室温下摇晃一夜,转移溶剂,重复4次以上,直到叶盘呈现白色。用氮气蒸发器蒸发前几步积累的溶剂。然后,将每个试管中干燥的脂质提取物溶解在1ml氯仿中,转移到一个2ml的透明玻璃小瓶中,带特氟龙内衬螺旋盖,在-80°C保存,直到准备运往堪萨斯脂质组学研究中心。通过蒸发氯仿制备装运样品。之后,这些样品被用气泡膜包装以保护,并与干冰一起运输。叶片在105°C的烤箱中干燥一夜,冷却到室温,称到小数点后五位以表示干重的脂质含量。
用三重四极质谱仪进行脂质组学分析
用适当的内标在氯仿中制备脂质提取物。采用电喷雾电离-三重四极杆质谱法(Applied Biosystems API 4000)检测脂类[29,77].脂质分子种类用前体扫描或中性损失扫描进行识别,并用内部标准对每个头族类进行定量。通过将所有样本的等分组成一个质量控制(QC)池。从这个QC池中提取的相同样品在实验样品之间循环分析,这样就可以计算每种脂质分析物的变异系数(CoV)。脂质水平被量化为每毫克叶干重归一化强度,其中1的值是1纳摩尔的内标强度。半乳糖的修正系数为2.8,以修正不饱和脂类高于饱和内标的反应。若脂质分析物低于检出限(强度对应0.002 nmol)或CoV值大于0.3,则排除进一步分析。
未饱和指数计算
含双键脂肪酸链的脂类被认为是不饱和脂类,不饱和指数可以表示其不饱和程度。脂类分子种类的这个指数是每个酰基链上双键的平均数,计算方法如下:
对于脂质头族类,不饱和指数的计算方法如前所述[29]:
数据分析
实验设计为完全随机设计。SAS(版本9.4,SAS Institute)中的GLIMMIX程序用于分析方差和估计最小二乘均值和标准误差。复制被认为是一种随机效应。利用GLIMMIX程序中的LSMEANS选项在α = 0.05时根据Fisher 's least significant difference (LSD)检验分离最小二乘均值。主成分分析(PCA)在MetaboAnalyst 5.0 (MetaboAnalyst .ca)中进行[78,79].
数据和材料的可用性
本研究中产生或分析的所有脂质数据均包含在本文及其补充表S1附加文件中1.
改变历史
2021年10月06
缩写
- DAG-CPT:
-
CDP-choline:甘油二酯cholinephosphotransferase
- DAG-EPT:
-
CDP-ethanolamine:甘油二酯cholinephosphotranserase
- DGD1:
-
Digalactosyldiacylglycerol合酶1
- DGDG:
-
Digalactosyldiacylglycerol
- 呃:
-
内质网
- 质/女士:
-
电喷雾电离-三重四极杆质谱
- 时尚:
-
脂肪酸desaturase
- IEM:
-
膜内信封
- MGD1:
-
Monogalactosyldiacylglycerol合酶1
- MGDG:
-
Monogalactosyldiacylglycerol
- OEM:
-
外层信封膜
- PA:
-
磷脂酸
- 人民行动党:
-
磷脂酸磷酸酯酶
- PC:
-
磷脂酰胆碱
- PDCT:
-
磷脂酰胆碱:甘油二酯cholinephosphotransferase
- 体育:
-
磷脂酰乙醇胺
- 答:
-
Phosphatidylglycerol
- PI:
-
磷脂酰肌醇
- 公司:
-
磷脂酶C
- 骑士:
-
磷脂酶D
- 梁:
-
Soil-plant-atmosphere-research室
- TGD1-5:
-
Trigalactosyldiacylglycerol蛋白质1 - 5
参考文献
Christ B, Bartels W-L, Broughton D, Seepaul R, Geller D.在追求一种国产生物燃料:导航系统的伙伴关系,利益相关者的知识,和采用芸苔属植物carinata在美国东南部。能源科学与技术,2020;29(5):561 - 562。
Gesch RW, Isbell TA, Oblath EA, Allen BL, Archer DW, Brown J,等。比较的几个芸苔属植物生长在美国中北部,是潜在的航空燃料原料。工业作物研究,2015;75:2-7。
Gesch RW, Long DS, Palmquist D, Allen BL, Archer DW, Brown J,等。农艺的性能十字花科在美国西部的多个环境中种植油籽。Bioenerg杂志2019;12:509-23。
Hossain Z, Johnson EN, Wang L, Blackshaw RE, Gan y十字花科加拿大草原上的油菜籽。工业作物学报2019;136:77-86。
玛丽莉亚E-F,弗朗西斯T,福尔克KC,史密斯M,泰勒DC。帕利泽的承诺:芸苔属,一种新兴的加拿大西部作物,可提供新的生物工业油原料。生物催化农业生物技术。2014;3:65-74。
Shi R, Archer DW, Pokharel K, Pearlson MN, Lewis KC, Ukaew S,等。美国北部大平原油料原料替代休耕的可再生射流分析。ACS持续化学工程2019;7:18753-64。
Tiwari R, Reinhardt Piskáčková TA, Devkota P, Mulvaney MJ, Ferrell JA, Leon RG。日益增长的冬天芸苔属植物carinata作为综合杂草管理的多样化作物轮作的一部分。华东桐柏生物能源。2021;13:425-35。
王晓燕,王晓燕,王晓燕,等。生物柴油生产的中试研究芸苔属植物carinata为原料。今天催化。2005;106:193 - 196。
Cardone M, Mazzoncini M, Menini S, Rocco V, Senatore A, Seggiani M,等。芸苔属植物carinata在意大利作为一种生产生物柴油的替代油料作物:农艺评价,通过酯交换生产燃料和特性。生物质生物能源。2003;25:623-36。
阿特邦恒河冲积层土壤水分和氮对芥菜的影响。印度农学杂志,1979;24:180-6。
Jadhav A, Katavic V, Marillia E- f, Michael Giblin E, Barton DL, Kumar A,等。通过内源FAD2基因的共抑制和反义抑制提高芸苔属芥酸水平。金属底座Eng。2005;7:215-20。
黄文华,王文华,王文华,等。埃塞俄比亚芥菜种质材料的基因型多样性及其变异模式(芸苔属植物carinataa·布劳恩)。作物遗传学报2002;49:573-82。
黄牛、亚麻子和芸苔属害虫。亚的斯亚贝巴:在:第一届全国油籽讲习班上提交的论文;1992.
埃塞俄比亚芥菜(Brassica carinata a . Braun)与印度芥菜(Brassica juncea L. Czern and Coss)的遗传改良。哥本哈根:第十一届国际油菜籽会议论文集;2003.
Taylor DC, Falk KC, Palmer CD, Hammerlindl J, Babic V, Mietkiewska E等人emopen芸苔属——一种用于提供生物工业油原料的新型分子农业平台:基因修饰提高种子中极长链脂肪酸和油含量的案例研究。生物燃料Bioprod Biorefin. 2010; 4:538-61。
西保罗DDR,乔治S,赖特JG。用种子萌发法对普通油料种子的耐旱性进行分类。油菜学报,2019;10:97-105。
Márquez-Lema A, Fernández‐Martínez JM, Pérez‐Vich B, Velasco L.海渗分离降低硫代葡萄糖苷含量芸苔属植物carinata布劳恩。植物品种。2006;125:400-2。
Márquez-Lema A, Fernández-Martínez JM, Pérez-Vich B, Velasco L. A的发展与表征芸苔属植物carinata含有低硫代葡萄糖苷含量基因的自交系b . juncea.Euphytica。2008;164:365 - 75。
辛红,于平。与油菜粕相比,蓖麻粕(一种非常规饲料资源)瘤胃降解、肠道和全消化特性及代谢蛋白供应。动物饲料科学技术,2014;191:106-10。
Márquez-Lema A, Fernández‐Martínez JM, Pérez‐Vich B, Velasco L.埃塞俄比亚芥菜种子中高硫代葡萄糖苷含量的遗传。植物品种。2009;128:278 - 81。
西保罗R,乔治S,赖特DL。比较的反应芸苔属植物carinata而且显著营养生长发育和光合作用对氮的营养。工业作物研究,2016;94:872-83。
Seepaul R, Marois J, Small I, George S, Wright DL。优化包裹和化学干燥剂的时机,以加速冬季龙葵的成熟。农学j . 2018; 110:1379 - 89。
Seepaul R, Marois J, Small IM, George S, Wright DL。干物质积累和养分吸收对氮肥的响应。农学j . 2019; 111:2038-46。
Seepaul R, Small IM, Marois J, George S, Wright DL。抽苔后缺氮限制了油菜和甘蓝型油菜的生长、氮素利用、种子和产油能力。作物科学。2019;59(6):2720 - 32。
用发芽试验和营养生长参数对红芸苔基因型的耐热性进行分类[网上论文]。斯塔克维尔:密西西比州立大学;2020.可以从:https://ir.library.msstate.edu/handle/11668/16679.[引自2021年3月1日]。
Djanaguiraman M, Perumal R, Jagadish SVK, Ciampitti IA, Welti R, Prasad PVV。高粱花粉和雌蕊对高温胁迫的敏感性。植物细胞环境学报,2018;41:1065-82。
黄斌。热胁迫和热驯化匍匐枯草叶片和根系脂质组成及饱和水平的变化(Agrostis多茎目).环境实验机器人2004;51:57-67。
李强,郑强,沈伟,Cram D, Fowler DB, Wei Y,等。了解植物温度诱导的脂质途径调节的生化基础。植物细胞。2015;27:86 - 103。
纳拉亚南,田村,罗思,普拉萨德,威尔蒂。高温胁迫下小麦叶片脂质的变化:I.高昼夜温度导致主要脂质变化。植物细胞环境学报2016;39:787-803。
Narayanan S, zoonglwe ZS, Gandhi N, Welti R, Fallen B, Smith JR,等。脂质组学比较分析揭示了两种温度敏感性不同的基因型大豆的热胁迫响应。植物。2020;9:457。
小麦膜流动性和成分在高温胁迫下的变化。在:Wani SH, Mohan A, Singh GP,编辑。小麦改良的生理、分子和遗传前景。瑞士:施普林格自然;2021.115 - 23页。
宗丽丽,魏志强,李文杰,李文杰,等。高温胁迫诱导花生花药脂质组重构。Sci众议员2020;10:22163。
郑刚,田斌,张芳,陶峰,李伟。植物对高温和低温之间频繁变化的适应:膜脂的重塑和不饱和水平的维持。植物细胞环境学报2011;34:1431-42。
康丽,王云云,Uppalapati SR,王凯,唐勇,Vadapalli V,等。一种脂肪酸酰胺水解酶的过表达降低了先天性免疫拟南芥.植物j . 2008; 56:336-49。
Kilaru A, Herrfurth C, keereetapler J, Hornung E, Venables BJ, Feussner I,等。脂氧合酶介导的多不饱和氧化N-acylethanolamines在拟南芥.生物化学杂志2011;286:15205-14。
Markham JE, Lynch DV, Napier JA, Dunn TM, Cahoon EB。植物鞘脂:功能随形。植物生物学,2013;16:350-7。
脂质信号。植物生物学杂志2004;7:329-36。
王旭,Devaiah SP,张伟,Welti R.磷脂酸的信号功能。脂质研究进展2006;45:250-78。
周亮,闫涛,陈旭,李铮,吴丹,华硕,等。夜间高温对油菜种子发育过程中贮藏脂质和转录组变化的影响。J Exp Bot. 2018; 69:1721-33。
Reddy KR, Reddy VR, Hodges HF。温度对早季棉生长发育的影响。农学j . 1992; 84:229-37。
Reddy KR, Hodges HF, McKinion JM, Wall GW。温度对皮玛棉生长发育的影响。农学j . 1992; 84:237-43。
Polowick PL, Sawhney VK。高温诱导油菜雌雄不育(芸苔属植物显著l .)。安机器人。1998;62:83-6。
Young LW, Wilen RW, Bonham-Smith PC。高温应力芸苔属植物显著花期降低微子体和巨子体的育性,诱导果实败育,并干扰种子生产。实验学报2004;55:45 - 95。
陈建平,陈建平。甘油脂的合成:生物化学和调控。植物生物学杂志1991;42:467-506。
18 - 3和16 - 3植物叶绿体脂质代谢的异同。植物杂志。1983;72:273-9。
脂质生物合成。植物细胞。1995;7:957 - 70。
Williams JP, Khan MU。脂类的生物合成芸苔属植物显著叶:I. 14c -主要甘油脂的脂肪酸标记动力学。油脂生物化学学报。1982;713:177-84。
王晓燕,王晓燕,王晓燕,等。高温胁迫下小麦花粉脂质组的变化。植物细胞环境学报,2018;41:1749-61。
温升,王晓东,王晓东。温度对植物膜脂肪酸组成的调节作用拟南芥膜脂成分的改变。植物生物学2004;4:17。
村上杨,高山M,小林杨,小玉H,伊巴k。三烯脂肪酸与植物高温耐受性。科学。2000;287:476-9。
王晓燕,王晓燕,王晓燕,等。突变体脂质生物合成调控的改变拟南芥叶绿体缺乏甘油-3-磷酸酰基转移酶活性。中国科学院学报1988;85:4143-7。
王铮,徐超,本宁C. TGD4是一种磷脂酸结合蛋白,参与了内质网到叶绿体的脂质运输。植物j . 2012; 70:614-23。
植物细胞中脂质运输参与细胞器生物发生的机制。细胞发育生物学2009;25:71-91。
Li-Beisson Y, Shorrosh B, Beisson F, Andersson MX, Arondel V, Bates PD等。Acyl-Lipid新陈代谢。在:Chang C, Graham I, Last R, Leyser O, McClung R, Weinig C,等编辑。拟南芥的书。洛克维尔:美国植物生物学家协会;2013: e0161。https://doi.org/10.1199/tab.0161.
热胁迫下植物叶片膜甘油脂质组学研究。油脂研究进展2019;75:100990。
陈杰,Burke JJ,辛铮,徐成,Velten J拟南芥热敏的突变atts02揭示了半乳糖在耐热性中的重要作用。植物细胞环境学报2006;29:1437-48。
Johnson G, Williams JP。生长温度对半乳糖二酰甘油分子形态生物合成的影响芸苔属植物显著叶子。植物杂志。1989;91:924-9。
浏览J, Warwick N, Somerville CR, Slack CR.通过“16:3”植物中脂质合成的原核和真核途径的通量拟南芥.j . 1986; 235:25-31。
贝茨PD。了解植物油生物合成中脂质代谢网络对酰基通量的控制。生物化学与生物物理学报2016;
胡铮,任铮,吕聪。转基因中磷脂酰胆碱二酰基甘油胆碱磷酸转移酶是有效积累羟基脂肪酸所必需的拟南芥.植物杂志。2012;158:1944-54。
Awai K, Xu C, Tamot B, Benning C.一种参与脂质运输的叶绿体内膜磷脂酸结合蛋白。中国科学(d辑:自然科学版)2006;
范健,翟智,闫超,徐聪。拟南芥TRIGALACTOSYLDIACYLGLYCEROL5与TGD1、TGD2和TGD4相互作用,促进脂质从内质网向质体转移。植物细胞。2015;27:2941-55。
吕b,本宁C.一个25个氨基酸序列拟南芥TGD2蛋白足以与磷脂酸特异性结合。生物化学杂志2009;284:17420-7。
Lu B, Xu C, Awai K, Jones AD, Benning C拟南芥, TGD3,参与叶绿体脂质导入。生物化学杂志2007;282:35945-53。
罗斯顿,高洁,徐超,本宁。拟南芥叶绿体脂质转运蛋白TGD2破坏细胞膜,是一个大型复合体的一部分。植物j . 2011; 66:759 - 69。
Roston RL, Gao J, Murcha MW, Whelan J, Benning C. TGD1, -2和- 3蛋白与多种底物结合蛋白形成atp结合盒(ABC)转运体,参与脂质运输。生物化学杂志2012;287:21406-15。
徐超,范杰,Froehlich JE, Awai K, Benning C. TGD1叶绿体包膜蛋白突变对水稻磷化代谢的影响拟南芥.植物细胞。2005;17:3094 - 110。
徐超,范杰,Riekhof W, Froehlich JE, Benning C.一种参与内质网向类囊体脂质转移的蛋白拟南芥.EMBO j . 2003; 22:2370-9。
徐超,Moellering ER, Muthan B,樊杰,Benning C.脂质转运介导的拟南芥TGD蛋白从内质网到质体是单向的。植物细胞学报2010;51:1019-28。
Nakamura Y, Tsuchiya M, Ohta H.在原核起源的脂质磷酸磷酸酶的一个独特亚家族中鉴定的塑磷脂酸磷酸酶。生物化学杂志2007;282:29013-21。
植物甘油脂代谢的细胞组织与调控。植物与细胞物理学报2019;60:1176-1883。
雷迪·K,霍奇斯HF,里德J,麦金恩JM,贝克J,塔普利L,等。土壤-植物-大气-研究(SPAR)设施:植物研究和建模的工具。Biotronics。2001;30:27-50。
Hoagland DR, Arnon DI。无土种植植物的水栽培方法。加利福尼亚农业试验站。1950;347:4-32。
Boote KJ, Seepaul R, Mulvaney MJ, Hagan AK, Bashyal M, George S,等。采用CROPGRO模型来模拟生长和生产芸苔属植物carinata这是一种生物燃料作物。GCB-Bioenergy。2021; 00:1-15。
默里弗兰克-威廉姆斯。关于饱和蒸气压的计算。应用气象学报,1967;6:203-4。
Welti R,李伟,李梅,桑旸,Biesiada H,周海娥,等。植物胁迫响应中的膜脂:磷脂酶dα在拟南芥冷冻诱导的脂质变化中的作用。生物化学杂志2002;277:31994-32002。
肖松,高伟,陈庆芳,陈树伟,郑树新,马杰,等。过度的拟南芥酰基辅酶a结合蛋白ACBP3促进饥饿诱导的和年龄依赖性的叶片衰老。植物细胞。2010;22:1463 - 82。
Chong J, Soufan O, Li C, Caraus I, Li S, Bourque G,等。MetaboAnalyst 4.0:走向更加透明和整合的代谢组学分析。核酸学报2018;46:W486-94。
夏娇,心理学家N, Young N, Wishart DS。MetaboAnalyst:一个用于代谢组数据分析和解释的web服务器。核酸学报,2009;37:W652-60。
确认
我们感谢David Brand的技术支持和环境植物生理学实验室研究生们在数据收集过程中的帮助。我们感谢佛罗里达大学的Ramdeo Seepaul博士安排了实验中使用的龙葵种子。我们感谢Ruth Welti博士,堪萨斯州立大学对手稿的批判性审查。脂质分析在堪萨斯脂质组学研究中心(KLRC)进行。KLRC的仪器采集和方法开发得到了NSF赠款MCB 0455318和0920663和DBI 0521587的支持,NSF EPSCoR赠款ps -0236913以及堪萨斯州通过堪萨斯州技术企业公司和堪萨斯州立大学的配套支持。KLRC也得到了K-INBRE(国家研究资源中心INBRE项目的NIH拨款P20 RR16475)的支持。
资金
这项工作得到了美国国家粮食和农业研究所、NIFA 2019-34263-30552和MIS 043050的部分支持。资助者在研究的设计、收集、分析、数据解释和撰写手稿中没有任何作用。
作者信息
从属关系
贡献
ZZL:概念化,数据策划,形式分析,方法论,可视化,和写作-原始草案和编辑;SN:概念化、监督、验证、方法和写作——审查和编辑;KRR:概念化、监督、资助、评审和编辑;SS和LP:数据收集和审核;WG:资金和审查;和JL:审查和编辑。所有作者均已阅读并认可该手稿。
相应的作者
道德声明
伦理批准和同意参与
芸苔属植物carinata本研究以Avanza 641为材料。Avanza 641不是一个转基因品种。种子来自佛罗里达大学的Ramdeo Seepaul博士。最初的种子来源是Agrisoma Biosiences Inc.,魁北克,加拿大;收集种子样本不需要许可。所有的植物实验都按照相关的指导方针和规定进行。
同意出版
不适用。
相互竞争的利益
作者声明他们没有竞争利益。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
本文原在线版本进行了修改:作者在图6中发现了一个较小的排版错误。修改不影响论文的结果或结论。原文已被更正。
补充信息
附加文件1:表S1。
105种脂质分析物作为每毫克叶干重归一化强度的数据。表S2。温度处理对脂质头组不饱和指数、脂质分子种类和头组类子池水平影响的方差分析结果。
附加文件2:图S1。
主成分分析(PCA)评分显示不同温度处理的脂质分布。图S2。Avanza 641叶片中双半乳糖酰二酰基甘油(DGDG)和磷脂酸(PA)子池水平在高温胁迫下的变化
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
宗吕维,Z., Sah, S., Persaud, L。et al。叶脂质组的变化芸苔属植物carinata在高温下压力。BMC植物杂志21,404(2021)。https://doi.org/10.1186/s12870-021-03189-x
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-021-03189-x
关键字
- 芸苔属植物carinata
- 脂质
- 高温压力
- 叶lipidome
- 脂质重塑
- 未饱和指数
- 脂质通灵