摘要
背景
在植物中,碱性亮氨酸拉链转录因子(TFs)在开花、果实生长发育和胁迫响应等多个生物过程中发挥着重要作用。然而,中国白梨中bzip - tf的系统研究和表征尚不清楚。白梨是一种具有重要营养价值和药用价值的水果作物。
结果
本研究从梨中全面鉴定了62个bZIP基因,其中54个基因分布在17条染色体上。频繁的全基因组复制(WGD)和分散复制(DSD)是中国白梨bZIP基因家族形成的主要驱动力。根据系统发育树将bzip - tf分为13个亚家族。随后,净化选择在进化过程中起着重要的作用PbbZIPs.对bZIP基因进行Synteny分析,共鉴定出196对同源基因Pyrus bretschneideri,花楸,梅李,而且碧桃.此外,独联体的启动子区域发现了对各种压力和激素做出反应的元素PbbZIP这是由刺激引起的。基因结构(内含子/外显子)和不同的基序组成表明亚家族之间存在功能差异。表达模式PbbZIP实时qRT-PCR检测激素处理下梨果实中脱落酸、水杨酸和茉莉酸甲酯基因的表达差异。
结论
对中国白梨的基因结构、基序组成、亚细胞定位、同构性分析以及同义(Ks)和非同义(Ka)的计算进行了系统分析。在中国梨中鉴定了62个bzip - tf,并在ABA、SA和MeJa激素胁迫下综合分析了它们的表达谱,这些激素响应多种非生物胁迫和果实生长发育。PbbZIP基因通过全基因组复制和分散复制事件发生。这些结果为进一步阐明多发育阶段和非生物胁迫响应下的生物功能特征提供了基本框架。
背景
转录因子(Transcription factors, TFs)在各种环境胁迫下的调控和生物过程中起着至关重要的作用[1,2].碱性亮氨酸拉链转录因子(basic leucine zipper, bZIP)家族成员是真核生物中种类最多、数量最多的转录因子之一[3.].结构域长度为60-80个氨基酸,包含两个功能各异的区域;碱基区高度保守,由16个与特定DNA结合的氨基酸残基组成(N-× 7-R/K-× 9) [4].另一方面,亮氨酸拉链的保守性较低,由几个螺旋结构组成,这些螺旋结构负责二聚的稳定性和特异性(homo/heterodimerization) [5].
植物的非生物胁迫抗性是由激素ABA介导的,ABA调节许多应激反应基因,赋予植物非生物胁迫抗性[6].A组AtbZIP蛋白质包括aba响应元件结合蛋白(AREB)或ABRE结合因子(ABF),它们在功能上已被确定为aba依赖基因表达和非生物应激反应的主要调节因子[1,6].III类SnRK2s磷酸化激活Areb1 / abf2, areb2 / abf4, abf1,ABF3在拟南芥中,控制其下游基因的表达[7,8].AtbZIP17, AtbZIP60和AtbZIP28蛋白质在内质网应激反应中发挥重要作用[9].在拟南芥AtbZIP28, AtbZIP17盐胁迫激活基因,发挥盐胁迫传感器/传感器的作用[10].盐处理增加了转录AtbZIP1, MtbZIP2,MtbZIP26从答:芥而且Medicago truncatula,使其抗盐应力增强[11,12,13].的bZIP科成员已被全面鉴定和功能特征在各种植物,如答:芥(75个基因)[1),显著(247个基因)[14),茄属植物lycopersicum(69个基因)[15),b . distachyon(96个基因)[16),栽培稻(89个基因)[3.),玉米(125个基因)[17),大豆(131个基因)[18],圆锥藻,(34个基因)[19),葡萄(55个基因)[20.),马吕斯有明显(116个基因)[21),草莓属vesca(50个基因)[22),高粱二色的(92个基因)[23),碧桃(47个基因)[24),蓖麻.[25].
植物bZIP蛋白在植物生长和多种生物学功能中发挥重要作用,包括体细胞胚胎发生[26],种子萌发[20.,27],细胞伸长[28],血管发育[29],花的诱导和生长[30.],未折叠蛋白反应[31],以及光形态建成[32].植物bZIP转录因子也参与了各种与非生物/生物应激相关的活动,包括激素信号和糖反应[33,34,35,36],光响应[37,38],病原体感染[39,40],冷信号[41,42]、渗透应力[43]、热应激[44等等。ABA响应性结合因子(ABRE)和结合蛋白(AREB)通常与ABA和胁迫相关因子有关[45].在大米、OsbZIP71aba介导的盐和耐旱性[46].ZmbZIP17也受到ABA相互作用的高度诱导(独联体-element ABRE) [45].SlbZIP33(SlAREB1)参与了番茄的胁迫诱导反应,并在果实成熟过程中作为调控重要代谢途径相关基因表达和代谢编程的关键成分[47,48].
中国梨(Pyrus。bretschneideri)水果作物在世界各地都有种植,尤其是在中国,由于其具有很高的药用和营养价值,已成为最受欢迎或必不可少的作物[49,50].虽然bZIP成员已在各种模式植物中被鉴定出来,但该基因家族在植物中尚未得到全面的研究Pyrus。bretschneideri.然而,在中国梨中已经发现了bZIP家族的全面和系统的分析。最后,在这项研究中,62PbbZIP根据系统进化树将基因分为13个类群。进化关系/历史,染色体分布,保守结构域,基因重复,基因结构分析,保守基序,微共时关系,独联体研究了启动子区域的-元素、ka/ks值分析等重要信息PbbZIP基因。的表达式配置文件PbbZIP利用RNA-seq数据分析了不同果实发育阶段的基因。然后,通过qRT-PCR检测12个基因对ABA、水杨酸和MeJA的响应。这些结果为今后的研究提供了具体的知识和研究方向。
结果
中国白梨bZIP基因家族的鉴定
采用隐马尔可夫模型(HMM)和Blast方法对梨bZIP转录因子家族成员进行了鉴定。系统方法bZIP域(PF00170)分析也使用Pfam数据库进行。最初,梨bZIP家族成员被鉴定出来,并从梨基因组中下载了它们的序列。最后,对候选基因进行了简要分析,验证了bZIP结构域。随后选取该家族中编码完整bZIP DNA结合域的62个成员进行序列比对和进一步分析。根据染色体位置对这些基因进行命名,并对所有基因进行重命名PbbZIP1来PbbZIP62(表2).氨基酸长度从141 AA (PbbZIP41)至1726aa (PbbZIP16),其跨池等电点(IP)介于4.96 (PbbZIP28)至10.51 (PbbZIP50).这些基因的分子量在16313.4 ~ 194044.9 kDa之间。基因id、名字、分子量、等电点、基因大小、染色体分布等详细信息见表S2.
系统发育分析
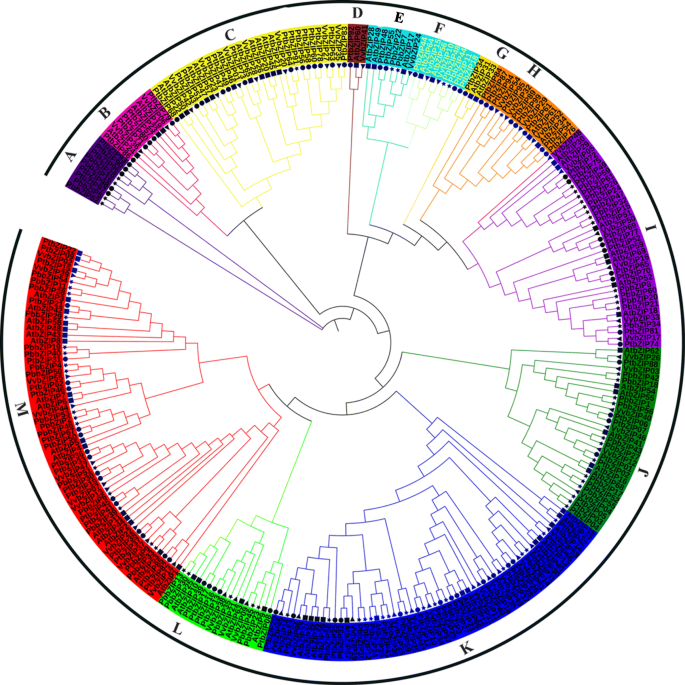
进一步了解梨(62个基因)、拟南芥(75个基因)、葡萄(55个基因)和杨树(86个基因)bZIP转录因子的进化关系及异同。采用邻居连接法(NJ-M)和最大似然法(ML-M)生成无根系统发育树。为了进一步的研究,我们利用邻居连接树对中国梨与拟南芥进行了系统发育特征(图2)。1和S2).最后通过itol软件可视化系统发育树,将其分为13个亚家族(A, B(F/Ara), C (D /Ara), d, e (b /Ara), F (H /Ara), g, h (e /Ara), I(I/Ara), J(G/Ara)、K (/Ara), L (C / /Ara), (S /Ara).这些类群根据拟南芥类群进行分类,在亚家族D和G中梨不存在,但在亚家族A中除拟南芥外只含有梨和杨树基因,这可能是由于功能分化或这些亚家族表明了特定的功能。此外,检查系统发育树,最大PbbZIPs亚科A中有13个成员,亚科E-F中有最少的成员(2)。1).亚家族C、D、G和H形成了不含梨基因的分支,表明这些分支可能是杨树和拟南芥特有的。基因丢失和获得机制发生在进化机制中,并引起功能分化。
基因本体论(GO)分析与亚细胞定位PbbZIP
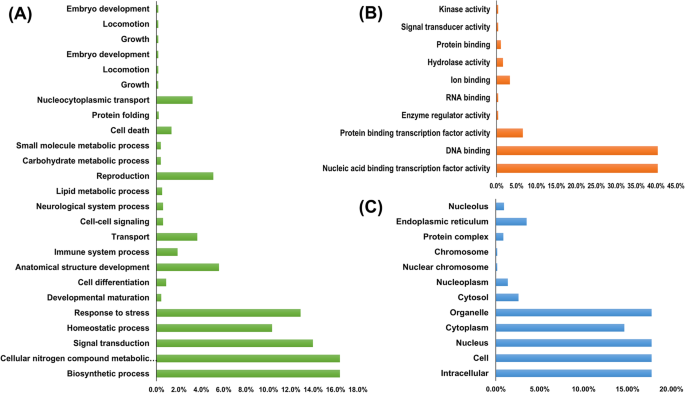
中各函数的预测进行GO注释分析PbbZIP成员。基因本体论,如细胞成分、生物过程和分子功能。此外,62年PbbZIP根据蛋白质在三个基本基团下的相似性,将蛋白质分为44个功能基团。在生物过程本体论中,我们评价参与生物合成过程(16.39%)和细胞氮化合物代谢过程(16.39%)的比例最高。在PbbZIP分别有13.98、12.87、10.33%的基因可能参与信号转导、应激反应和止血过程。另外,一些基因参与发育(0.43%),免疫系统(1.88%),细胞缺失(0.86%),解剖结构(5.50%)。2).在分子函数本体论中,PbbZIPs参与核酸结合转录功能活性的基因比例最高,参与DNA结合的基因比例为40.46%,其次是蛋白质结合转录因子5.59%、酶调节活性0.40%、RNA结合0.40%、离子结合3.36%、水解酶活性1.61%、蛋白结合1.80%、信号转导活性0.40%、激酶活性0.40%。
此外,细胞成分本体论提示也含有细胞成分,细胞内、细胞和细胞器中发现的成分相同,且比例较高(17.74%),而另一种是细胞质(14.65%)、细胞质(2.58%)、核染色体(0.16%)、核质(1.36%)、染色体(0.16%)、蛋白质复合物(0.86)、内质网(0.92%)(表S .)3.).用CELLOGO工具软件预测亚细胞定位。这些结果表明,大多数的PbbZIP基因(96.8%)定位于细胞核,其余基因涉及细胞质和叶绿体(表S .)3.).
保守基序的基因结构分析与鉴定
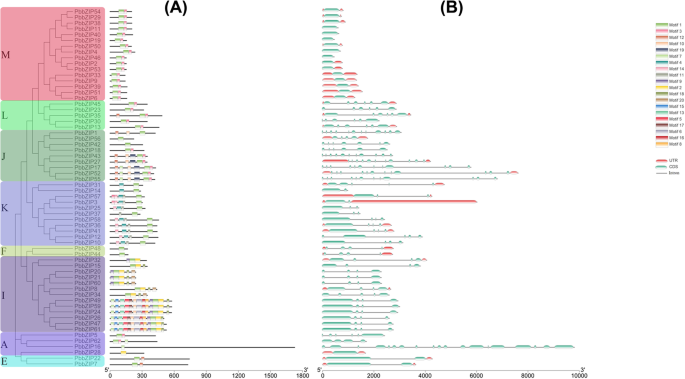
通过比较中国白梨各bZIP基因的通用特征格式(GFF3)文件,进行结构分析,了解结构多样性现象。使用基因结构显示服务器识别内含子/外显子的组成和位置,并比较不同或相同亚家族的基因结构。在PbbZIP基因含有最多的内含子/外显子(18/19)(图;3).这些结果揭示了5PbbZIP基因(PbbZIP11, 40,19,4和46)的基因结构中没有内含子,而保留了PbbZIP基因包含1 ~ 18个内含子。
此外,PbbZIPs亚家族A基因外显子/内含子数量最多;例如,PbbZIP1619-exons / 18-introns。另一方面,在同一亚家族中内含子/外显子的数量也不同,如PbbZIP31,4-exons / 4-introns。这些结果揭示了基因中内含子/外显子结构的分化PbbZIPs家庭可能与不同的功能有关。
的蛋白序列进行保守motif分析PbbZIP基因使用MEME服务器。分布和组成守恒PbbZIP亚科间基序比相似,支持系统发育树的结果。共预测了二十(20)个母题PbbZIP基因,和母题包含在PbbZIP亚科的成员各不相同。PbbZIP根据系统发育树和基序分化程度,将基因分为M、L、J、K、F、I、A、E亚家族。亚家族i编码了大量的保守基序。不同亚科和同一亚科的基序数量不同。基序数在亚科M(基序2的最大数目)、L(基序3的最大数目)、J(基序9的最大数目)、K(基序6的最大数目)、F(基序1的最大数目)、I(基序13的最大数目)、A(基序3的最大数目)和E(基序2的最大数目)之间存在差异(图2)。3 b).保守基序二的高度贡献大多是基因。众多主题的存在PbbZIPMembers表示相似的重复事件。在中国,梨(Pyrus bretschneideri),在65个bZIP成员中,有50个残基为保守结构域(motif 2)。同一bZIP蛋白之间,特别是亚科内,存在保守基序可能反映了功能的相似性。这些蛋白在同一亚家族中保守的不同基序反映了它们的不同功能(表S4).
基因复制事件、扩增和染色体分布的鉴定
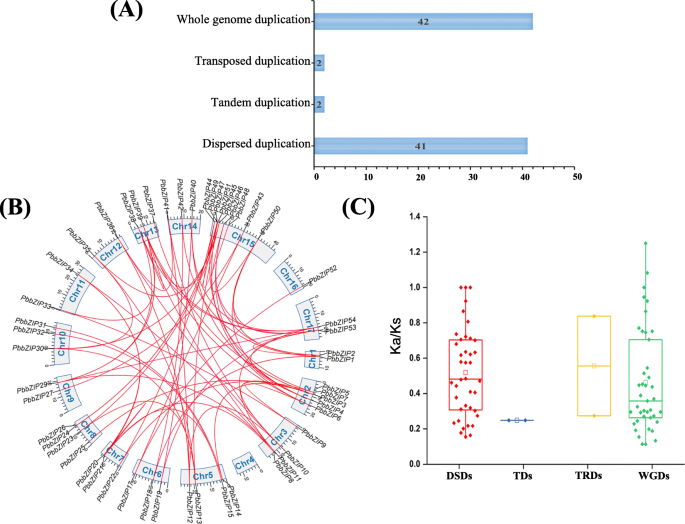
为了阐明中国梨bZIP TFs基因家族的起源,我们进行了四种类型的复制(wgd -全基因组复制、td -串联复制、trd -转置复制和DSD-分散复制)(图5)。4 b).在中国梨中,共有87对重复基因,其次是DSDs(41对)、WGDs(42对)、TDs(2对)和TRDs(2对),表明基因家族的扩展(图2)。4).基因家族的扩张主要通过全基因组复制和分散复制两种方式进行[51].在本研究中,通过串联复制和分散复制来阐明bZIP基因的扩增Pyrus bretschneideri.同时,这些结果也揭示了复杂的复制机制PbbZIP家庭。所有复制模式(DSDs、WGDs、td和TRDs)都参与了演化和扩展PbbZIP基因。在梨中,41%的基因表现为分散性复制(DSD), 2%的基因表现为串联复制(TD),表明分散性复制事件对梨的扩展和进化有重要作用PbbZIP与串联复制事件的比较(表S5).WGD(15号染色体上最多8个重复基因)、DSD(支架上最多6个重复基因)、TD(15号染色体上和支架上分别最多1个重复基因)、TRD(8号染色体上和支架上分别最多1个重复基因)的重复基因数量不同(表S .)5).要了解本地化PbbZIP不同染色体上的基因,除了位于支架上的基因外,所有的基因都按照梨基因组进行了定位。由于62PbbZIP基因方面,54个基因位于染色体上,8个基因位于支架上。此外,15号染色体上最多可追踪到9个基因。另一方面,16号染色体最少携带一个基因(图S1及表S2).
Ka/Ks分析的估计
为了确定基因复制事件的进化日期,我们计算了87个重复基因对的同义(Ks)和非同义(Ka)值。Ka/Ks值范围为1.24 ~ 0.21,如表S所示5.一般情况下,Ka/Ks值大于1为正向选择,Ka/Ks小于1为净化选择,Ka/Ks =1为中性选择[52,53].在我们的研究中,所有PbbZIP基因对Ka/Ks值小于1,说明这些基因主要经历了纯化选择。另一方面,四个基因的ka/ks值为1,说明正向选择(图。4摄氏度).我们还计算了DSD、TD、TRD和WGD中的ka/ks值。这些基因对PbbZIP40-PbbZIP19Had (ka/ks 1.0827),和PbbZIP10——PbbZIP12(ka/ks 1.2498)具有较高的ka/ks值,表明该基因家族进化历史复杂。
的同步性分析PbZIP基因
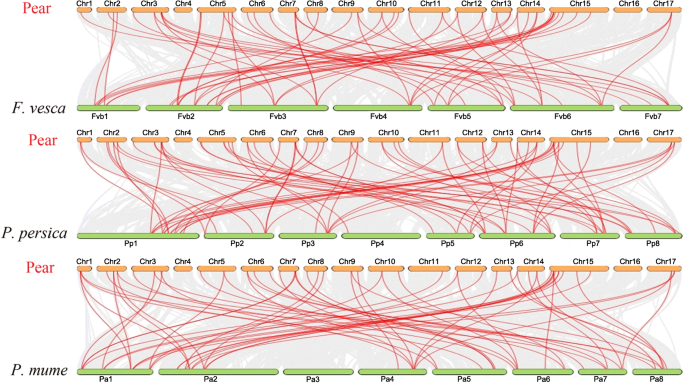
在其他物种的同源性之间建立共线性关系,以说明同源性的共线性关联PbZIP基因之间的草莓属vesca,李属却已,碧桃.共线性关系Pyrus bretschneideri,花楸,梅李,而且碧桃共显示了196个同源对。的正交对PbbZIP其他物种的基因,包括Pyrus bretschneideri-草莓属vesca(63对),梨树-梅梅(61双),以及红桃(72对6.最后,这些结果表明,与其他同源关系和系统发育关系密切的相似关系(图。5).
独联体元素分析
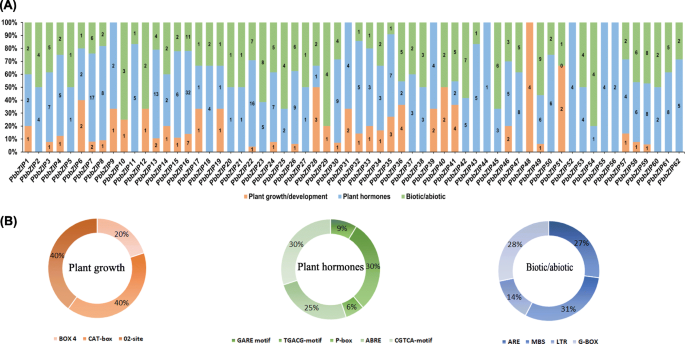
启动子活动在调控机制和不同类型的基因功能中起着至关重要的作用[54].的独联体通过分析启动子区域的-元素分析来估计代谢网络,包括应激反应、组织特异性表达、多刺激反应和其他环境条件[53,55].反式作用元素和独联体-调控元件对任何基因表达的增减起着潜在的作用机制。独联体的启动子区获得了-元素PbbZIP了解基因的潜在作用和机制。我们观察到最高的量独联体-元素在启动子区域通过plantCare数据库。此外,独联体-元素被分为三个基本类别:(1)胁迫响应(生物/非生物)(2)植物生长/发育(3)植物激素响应(图2)。6).主要是植物内生长/发育PbbZIPs基因中含有Box 4、MRE、G-Box(光照下植物生长响应)、CAT-box(分生组织相关)、02-site(玉米醇溶蛋白代谢相关)等调控元件。与压力相关独联体-元素包括MBS(光响应),LTR(低温相关)和ARE(负责厌氧诱导)。随后,在植物激素相关类中鉴定出大量独联体-元素包括P-box和GARE-motif(赤霉素反应元素)。在胁迫响应、植物生长/发育、植物激素响应三个类别中,G-box(28%)、CAT-box和02-site(40%)和TGACG-motif和CGTCA-motif(30%)占主导地位。这些结果表明,不同类型的cis-elements在相同的类型PbbZIP基因可能有不同的功能(表S7).此外,tca元件参与水杨酸(SA)反应,TGACG-motif和CGTCA元件参与茉莉酸甲酯(MeJA)反应顺式元素和ABRE对ABA(脱落酸)有反应独联体元素。这些激素(ABA、SA和MeJA)参与了果实的衰老和成熟[56,57].这些结果表明,bZIP家族可能与激素变化有关,参与了梨果实的衰老、成熟和成熟过程。
表达模式PbZIP不同果实发育阶段的基因
基于梨果实不同发育阶段的RNA-seq数据,我们研究了其表达谱PbZIP基因(表S)8).RNA-seq数据来自先前在7个果实发育阶段(stage1- 15dab, stage2- 30dab, stage3- 55dab, stage4- 85dab, stage5- 115dab, stage6-成熟阶段和stage7-果实衰老阶段)进行的研究。利用微阵列数据研究了基因的时空表达谱PbZIP不同果期的成员。使用每千碱基百万片段(FPKM)值分析基因表达模式。这些结果表明PbZIPs表达模式在不同发育阶段有增有减。PbZIP49, PbZIP59这些基因在第7阶段大量表达,这意味着这些基因可能在果实成熟和发育中起着关键作用。另一方面,2个基因(PbZIP39, PbZIP51)增加,三个基因(PbZIP33, PbZIP6和PbZIP9)在果实发育阶段减少,这表明它们可能在果实发育早期和后期发挥重要作用。梨果实发育1期和2期的表达模式高于其他发育阶段(图2)。7).
表达分析PbZIP激素治疗下的基因
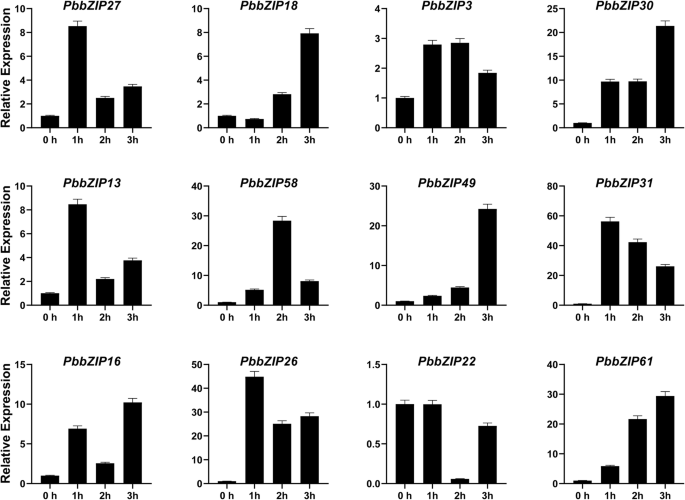
的表达模式PbZIP激素治疗压力下(ABA, SA和MeJA)。在不同时间(1 h、2 h、3 h)喷施梨果实后,随机选取12个基因。最后用qRT-PCR分析表达谱。应用外源性激素喷雾剂分别观察抑制和诱导两种表达。在ABA(脱落酸)激素处理下,大部分基因(PbZIP3、13、58、49、16、26)在3 h表达量最高,PbZIP27、18、30、22和61个基因在2 h达到峰值表达,只有1个基因(PbZIP31)在39 DAF时与对照(CK)相比表现出高表达。在ABA处理下,所有基因均表现出显著的表达。8A).在SA(水杨酸)处理中,我们发现PbZIP18在1 h时,30、13、16和22达到最高表达模式。而PbZIP27、3、49、26、61在3 h时均显著上调。另一方面,两个基因(PbZIP58和31)在2 h时显著表达(图;8B).在MeJA(茉莉酸甲酯)处理下,基因也出现了与脱落酸和水杨酸相同的趋势,除了PbZIP22.五个基因,即PbZIP18、30、49、16和61在3 h上调表达,而PbZIP22基因在1 h、2 h和3 h抑制表达。表达式PbZIP27、13、31和26在1 h和2个基因(PbZIP58, 3)比对照组高2 h。(无花果。8C)。
讨论
亮氨酸拉链(bZIP . zip)转录基因家族已在许多植物中被鉴定和全面研究,如拟南芥,栽培稻,玉米,甘氨酸max,小角孢粉,葡萄,蓖麻,家棠,草莓属vesca,高粱二色的,显著,茄属植物lycopersicum,b . distachyon,碧桃,并有证据表明这些基因参与了植物不同的生理发育过程。本研究对中国白梨的62个基因进行了鉴定和分析,并研究了激素胁迫下不同果实发育阶段的表达规律。同步性分析,进化史,独联体进行元素分析、染色体定位、基因结构和基因重复检测。虽然bZIP家族已在许多作物中被鉴定和鉴定,但在梨中的系统和比较研究仍然未知。bZIP基因分为13个亚家族(A, B(F/Ara), C (D /Ara), d, e (b /Ara), F (H /Ara), g, h (e /Ara), I(I/Ara), J(G/Ara)、K (/Ara), L (C / /Ara), (S /Ara)基于系统发育树和拟南芥类群。采用邻居连接法(NJ-M)构建了bZIP基因的系统发育树。树的进化分析表明,在梨的进化过程中,亚家族C、D、G和H基因可能在亚家族中丢失,而在亚家族中扩展(图2)。1).拟南芥、杨树和杨树中bZIP基因的数量碧桃在葡萄、苹果和草莓中含量较高,而在梨中含量较低。这些结果表明bZIP基因在梨中扩增。不同模式的基因复制事件(wgd -全基因组复制、td -串联复制、trd -转置复制、DSD-分散复制)是扩展和进化过程的主要动力来源[58,59,60]例如Hsf和F-box基因家族[61,62].全基因组复制(WGD)可以在短时间内产生大量的重复基因[63].在本研究中,我们鉴定了PbbZIP基因家族中的四种复制模式(DSDs、WGDs、TDs和TRDs), 42对全基因组复制,41对分散复制,2对串联复制和2个转座复制。此外,WGD和DSD基因的参与比例较高,表明这些模式(WGD和DSD)可能在进化和扩展中起着关键作用PbbZIPs.
进一步计算了副同源基因对的成对同义值(Ks)和非同义值(Ka),如图所示。4及表S5.两两的ka/ks值表明了三种类型的选择(阳性选择、净化选择和中性选择)。大多数副同源基因的Ka/ks值表明,在中国存在纯化选择PbbZIPs基因家族。串联复制事件仅包含两个基因对,说明串联复制在基因扩增中起不了重要作用PbZIP与分散复制相比(表S5).此外,我们还分析了它们之间的正交共线关系Pyrus bretschneideri,花楸,梅李,而且碧桃.Pyrus bretschneideri而且草莓属vesca有63对同源基因对,其次是Pyrus bretschneideri而且李属却已同源基因对61对,而Pyrus bretschneideri而且碧桃包含72个同源基因对。这些共线性分析结果表明,蔷薇科物种(梨、桃、苹果和草莓)具有较强的相似同向同源同源和进化关系。随后,基因结构(内含子/外显子)的组织可能意味着不同bzip的进化轨迹[64].内含子的数量决定了植物的适应潜力和发育过程[25) . .此外,来自同一群体的bZIP个体的外显子-内含子组成经常被识别,如图所示。3..在某些基因家族中,这种现象被认为是一种进化印记,导致功能不同的谬误同源的发展[65,66].那些内含子较短或没有内含子的基因在进化选择中发挥了激活作用[67].一些PbbZIP基因,特别是PbbZIP11, 40, 19, 4,和46,普遍缺乏内含子(图。3.),从而减少对多种非生物胁迫的转录后反应过程[68].在本研究中,内含子/外显子的最大数量(18/19)和最小内含子/外显子(1/1)(图。3.).检测到20个基序PbbZIPs通过MEME网络工具。母题的构成如表S所示4.这些保守的基序组成和不同的数目表明不同亚科之间的功能差异。高度保守的motif 2分布在大部分基因中。这些结果表明,保守基序可能在决定bZIP蛋白的特定功能方面发挥多种作用[25].
品种的顺式元素被分为三组;1)与胁迫有关(LTR、G-box、ARE), 2)与植物激素有关(GARE motif、TGACG motif、P-box、ABRE、cgtca motif), 3)与植物生长发育有关(Box 4、CAT-box、02-site)PbbZIPs.转录因子参与了应激反应,例如ABA [69],乙烯[35]、光信号[37,38]、激素信号[34,35,36]、干旱[46]、冷应力[41,42]以及机械和渗透胁迫[43].OsABF2对水稻非生物胁迫和ABA信号的正向调控[70].SlbZIP38番茄基因是对盐胁迫的反应[71].ZjbZIPs在非生物和生物胁迫下的发展中发挥作用[5].10拟南芥TGA家族基因在SA防御信号通路和坏死性病原体中发挥重要作用[5,72].外源施用赤霉素、乙烯、SA和ABA后,植物提高了生物和非生物反应[73].FD同源蛋白(跟随位点D;ATbZIP14)和FDP (FD para;ATbZIP27)转录因子答:芥在fd样枝中发现,它们可能在开花过程中起重要作用。最后,通过qRT-PCR分析,确定了PbbZIPs在外源激素胁迫(ABA, SA和MeJA)下的果实中。PbbZIPs除一个基因(PbZIP22)对不同时间梨果实的影响(图;8).根据RNA- seq数据,stage1和stage4基因高表达。bZIP基因存在于许多植物中,包括番茄[74],苹果[75]、西瓜[76],都参与了果实的发育和成熟过程。然而,bzip是否参与中国梨果实发育和收获后成熟尚不清楚。在目前的研究中,我们发现PbbZIP基因在不同发育阶段均有大量表达。这些结果表明PbbZIPs基因广泛参与中国白梨无花果果实发育和成熟过程。9而且10.
结论
综上所述,共有62个PbbZIPs根据系统进化、保守基序和内含子/外显子分析,在中国白梨中鉴定。PbbZIPs基因被分为13个亚科。全基因组复制(WGD)和分散复制(DSD)可能是影响该基因扩增的重要因素PbbZIPs.此外,染色体定位,亚细胞定位,共时性分析,特征,计算ka/ks值,启动子区域,基因结构分析。最后,qRT-PCR结果显示PbbZIPs在非生物和生物压力中有重要作用。我们的研究结果为我们提供了坚实的基础PbbZIPs在果实发育、成熟过程、分子机制和进化关系中的作用,特别是在多重胁迫条件下。
方法
植物材料及处理
开花39天后的果实样本来自一株42岁的梨树,该梨树生长在中国安徽砀山的一个研究园林园。将外源激素按照上述方法分别用200 μM水杨酸(SA)、500 μM脱落酸(ABA)和500 μM茉莉酸甲酯(MeJA)喷洒在果实的整个表面[50,77].所有水果样品在39 DAF下收获,并于0 h、1 h、2 h、3 h收集。立即将所有水果样品冷冻在液氮中,并转化为- 80°C保存,直到进一步实验。
识别,保守域,序列分析
中国白梨全基因组序列及GFF3(通用特征格式文件)和CDS(编码序列)从梨基因组计划在线服务器(http://peargenome.njau.edu.cn) [78].此外,拟南芥bZIP蛋白序列从TAIR web服务器(http://arabidopsis.org),对梨基因组进行轰击PbbZIP基因。其次,从Pfam数据库(http://pfam.xfam.org) [79],利用Blast从梨基因组中提取bZIP转录因子基因。HMMER v3.3.2软件包和NCBI web保守域(http://ncbi.nlm.nih.gov/structure/bwrpsb/pwrpssb.cgi)使用默认参数进行完整性域识别。最后,所有输出候选基因用SMART (http://smart.embl-heidelberg.de) [80InterPro (htt:// .www.ebi.ac.uk InterPro /搜索/序列) [81].
基因结构与保守基序
模因套装(多重EM for Motif Elicitation)在线工具(http://meme-suit.org)用以下默认参数对保守motif进行可视化和识别;鉴定出最小宽度6个残基,最大宽度50个残基,最大数目20个[82].随后,对内含子/外显子进行分析PbZIP通过通用特征格式(GFF3)文件找到基因,并使用(GSDS v2.0)基因结构显示服务器(http://gsds-gao-lab.org) [83].
染色体分布与基因特征
每个bZIP蛋白的起始点和结束点信息是从梨注释GFF3文件中调查的,使用MapChart v2.3 (http://www.wur.nl/en/shoe/Mapchart.htm) [84].然后,利用在线网络工具ExPasy (http://www.expasy.org) [85].
基因重复、共时性分析及ka/ks值计算
我们使用多重共线性扫描工具包(MCScanx) [86],检测基因复制的四种模式(WGD、TD、TRD和DSD)PbbZIP基因与同构之间的关系Pyrus bretschneideri,花楸,梅李,而且碧桃.最后,利用circos软件和Tbtool软件显示基因重复和共线性关系[87使用默认参数。测定ka/ks值,用于测量不同基因对在扩增和进化过程中的选择压力。ka/ks值由ka/ks计算器(http://github.com/qiaoxin/scripts_for_Gb/tree/master/ calculator_ka_ks_pipeline) (88].
独联体元素分析和基因本体
潜在的独联体分析了bZIP基因启动子区域的调控元件。使用了每个bZIP的启动子序列,该序列已从梨基因组计划下载(http://peargenome.njau.edu.cn).此外,植物护理[89web工具(http://bioinformatics.psb.ugent.be/webtool/plantcare)来识别假定的独联体-启动子区调控元件。在预测基因中,使用CELLOGO工具确定GO注释和亚细胞定位[90].
种系发生树
利用MEGA-X软件(http://www.megasoftware.net) [91].采用邻居连接法(NJ-M)构建系统发育树,自举重复1000次,选择配对删除法和泊松修正距离法,其他默认参数。另一方面,利用在线IQ-TREE程序,利用最大似然方法构建系统发育树。最后,利用itol软件可视化系统发育树(https://itol.embl.de/) [92].
芯片表达分析
研究的表达模式PbbZIP不同果实发育阶段(stage1- 15dab、stage2- 30dab、stage3- 55dab、stage4- 85dab、stage5- 115dab、stage6-成熟期和stage7-果实衰老期)的基因Pyrus bretschneideriSRA (sequence read archive,序列读取存档)数据从NCBI (http://www.ncbi.nlm.nih.gov),编号为SRX1595645、SRX1595648、SRX1595646、SRX1595647、SRX1595651、SRX1595650、SRX1595652。最后,给出了热图PbbZIP采用TBtool软件对家族进行可视化[87].
RNA分离及实时荧光定量PCR分析
采用RNA-prep植物纯试剂盒(天根-北京)从梨果实中分离总RNA。qRT-PCR特异性引物采用Beacon Designer 7软件设计,特异性引物序列如表S所示1.qRT-PCR混合物为20 μl,其中SYBER预混物Ex Taq II 10 μl,正向引物1 μl,反向引物1 μl, RNAase自由水6 μl, cDNA 2 μl。梨微管蛋白基因被用作内部对照(表S1) [78,80].的最终表达模式PbbZIP基因计算使用2−ΔΔCt方法(93].
数据和材料的可用性
中国白梨bZIP蛋白序列来源于梨基因组工程(http://peargenome.njau.edu.cn).拟南芥bZIP蛋白序列从拟南芥信息源(TAIR)数据库(http://www.arabidopsis.org).葡萄中所有bZIP转录因子基因(葡萄)和杨树序列是从葡萄基因组12X组合的最新数据库版本(V1) (http://genomes.cribi.unipd.it/)和phytozome。所有RNA-Seq数据存入NCBI SRA数据库,编号为SRX1595645、SRX1595648、SRX1595646、SRX1595647、SRX1595651、SRX1595650、SRX1595652。
缩写
- bZIP:
-
亮氨酸拉链
- 山:
-
水杨酸
- 阿坝:
-
脱落酸
- 惩罚:
-
甲基jasmonate
- 嗯:
-
隐马尔可夫模型
- DAF):
-
开花后几天
- 轻拍:
-
开花后翌日
- 走:
-
基因本体论
- NJ:
-
neighbor-joining
- 德牧:
-
基因结构显示服务器
- TF:
-
转录因子
- MEME:
-
多重Em Motif Elicitation
- 兆瓦:
-
分子量
- pI:
-
等电点
- MCSscanX:
-
多重共线性扫描工具包
- FPKM:
-
每千碱基100万个片段
- cd:
-
编码序列
- RNA:
-
核糖核酸
- 存在:
-
实时定量逆转录PCR
- gDNA:
-
基因组DNA
参考文献
- 1.
Jakoby M, Weisshaar B, Dröge-Laser W, Vicente-Carbajosa J, Tiedemann J, Kroj T,等。拟南芥bZIP转录因子研究。植物科学进展,2002;7(3):106-11。https://doi.org/10.1016/s1360 - 1385 (01) 02223 - 3.
- 2.
Rian DM. PlnTFDB:植物转录因子数据库的最新内容和新特点。2010; 2009年10月38日:822 - 7。
- 3.
Survey G, Jain M, Tyagi AK, Khurana JP水稻1基亮氨酸拉链转录因子家族的基因组调查及基因表达分析[w][OA]。2015; 146:333-50。
- 4.
盖伟,马晓霞,乔勇,石波,Haq S,李强。辣椒bZIP转录因子家族的特征分析(甜椒L .): CabZIP25正向调节耐盐性。2020;2月11日:1-18。
- 5.
张勇,高伟,李华,王勇,李东,薛超,等。枣bZIP基因家族的全基因组分析(Ziziphus jujuba.2020: 1 - 14。
- 6.
梅泽T,中岛K,宫川T,黑森T,田仓M,筱崎K,等。ABA反应中核心调控网络的分子基础:传感、信号和转运。植物生理学报。2010;21(11):1821-39。https://doi.org/10.1093/pcp/pcq156.
- 7.
吉田T,藤田Y,早山H, Kidokoro S,丸山K, Mizoi J,等。AREB1, AREB2和ABF3是主要转录因子,它们协同调节abre依赖的ABA信号,参与干旱胁迫耐受性,并需要ABA才能完全激活。植物学报,2010;36(4):344 - 344。https://doi.org/10.1111/j.1365-313X.2009.04092.x.
- 8.
吉田T,藤田Y,丸山K,茂上J, Todaka D, Shinozaki K,等。四种拟南芥AREB/ABF转录因子主要在渗透胁迫下脱落酸信号转导中SnRK2激酶下游基因表达中起作用。植物细胞环境学报。2015;38(1):35-49。https://doi.org/10.1111/pce.12351.
- 9.
植物内质网应激反应。植物科学进展。2013;26(1):349 - 349。https://doi.org/10.1146/annurev-arplant-050312-120053.
- 10.
刘建新,刘建新,刘建新。拟南芥AtbZIP17基因的表达及其对盐胁迫的保护作用。植物细胞环境学报。2008;31(12):1735-43。https://doi.org/10.1111/j.1365-3040.2008.01873.x.
- 11.
Hartmann L, Pedrotti L, Weiste C, Fekete A, Schierstaedt J, Göttler J,等。在拟南芥根中,两条bZIP信号通路之间的串扰协调了盐诱导的代谢重编程。植物学报。2015;27(8):2244-60。https://doi.org/10.1105/tpc.15.00163.
- 12.
王震,程凯,万林,闫林,姜华,刘松,等。6种豆科植物基因组基本亮氨酸拉链(bZIP)转录因子基因家族的全基因组分析。BMC Genomics. 2015;16(1):1 - 15。https://doi.org/10.1186/s12864-015-2258-x.
- 13.
孙旭,李勇,蔡宏,白旭,季伟,丁旭,等。拟南芥AtbZIP1转录因子是植物耐盐、渗透和干旱胁迫的正向调节因子。中国植物学报,2012;29(3):344 - 344。https://doi.org/10.1007/s10265-011-0448-4.
- 14.
周勇,徐东,贾林,黄霞,马刚,王松,等。甘蓝型油菜bZIP转录因子基因的全基因组鉴定与结构分析。基因(巴塞尔)。2017年,8。
- 15.
李东,付芳,张华,宋峰。番茄bZIP转录因子家族的全基因组系统特征。BMC Genomics. 2015;16(1):1 - 18。https://doi.org/10.1186/s12864-015-1990-6.
- 16.
刘霞,褚卓。短柄藻bZIP转录因子响应多种非生物胁迫的全基因组进化特征及表达谱分析。BMC Genomics. 2015; 16:1-15。
- 17.
魏佳,陈娟,王亚,陈亚,陈帅,林怡娜,等。玉米bzip编码基因的全基因组分析。2012463-76。
- 18.
廖勇,魏兆华,郝文文,简亚平,刘海宇,陈建忠。大豆GmbZIP44、GmbZIP62和GmbZIP78基因在转基因拟南芥中发挥ABA信号负调控作用并具有耐盐和耐寒性。2008;:225-40。
- 19.
徐勇,王勇,赵辉,吴明,张杰,陈伟,等。分枝杆菌分叶锥菌bZIP转录因子的全基因组鉴定及表达分析。2020.
- 20.
刘杰,陈楠,陈峰,蔡斌,Santo SD, Tornielli GB,等。葡萄bZIP转录因子基因家族的全基因组分析及表达谱(葡萄).2014.
- 21.
张震,崔宏,邢松,刘霞,陈霞,王霞。计算机科学与系统生物学家苹果bZIP家族的全基因组鉴定与分析及其在多种非生物胁迫下的表达,2017;10:32-42。
- 22.
王霞,陈霞,杨涛,程强,程哲。草莓干旱和热胁迫相关bZIP家族基因的全基因组鉴定(草莓属vesca).2017年,2017年。
- 23.
王娟,周娟,张波,王丽娟,姜松。高粱碱性亮氨酸拉链转录因子的全基因组扩增及表达差异分析——以高粱为例2011;
- 24.
王小玲,钟勇,程志明,熊建军。草莓、桃子和苹果bZIP基因家族的分化表明基因复制后存在多种进化模式。中国生物医学工程学报。2015;https://doi.org/10.1155/2015/536943.
- 25.
金志,徐伟,刘安。蓖麻bZIP基因家族的基因组调查与表达分析(萝藦L。)。2014: 299 - 312。
- 26.
关勇,任宏,谢宏,马志,陈峰。胡萝卜bzip型转录因子的鉴定与鉴定(胡萝卜胡萝卜L .)体细胞胚胎发生。: 207 - 2009; 17。
- 27.
井泽T,福斯特R,中岛M,岛本K,蔡N, The S,等。水稻bZIP转录激活子RITA-1在种子发育过程中高度表达发表于:美国植物生物学家学会(ASPB)
- 28.
傅泽明,李志强,李志强,李志强,等。bZIP转录激活因子对细胞生长的调控作用。中国生物医学工程学报(自然科学版),2000;
- 29.
尹勇,朱强,戴松,兰姆C,比奇RN。RF2a是韧皮部特异性水稻tungro bacilliform病毒启动子的bZIP转录激活子,在血管发育中起作用。1997; 16:5247-59。
- 30.
Ren ÆD, Cha D. AtbZIP34是拟南芥花粉壁形成和花粉发育过程中几种代谢途径的控制所必需的。2009: 581 - 601。
- 31.
刘娟,王晓明,张晓明,张晓明,张晓明。盐胁迫对拟南芥内质网胁迫信号通路的影响及其机制研究2007;
- 32.
光PU、黄X,欧阳X,杨P,刘OS,李G, et al。FHY3和HY5积极介导拟南芥COP1转录的诱导,以响应光形态发生UV-B LightP™。2015; 24:4590 - 606。
- 33.
陈志强,李志强。糖抑制脱落酸对胚根萌发的抑制作用,但对幼苗生长无抑制作用。植物科学进展。2000;22(4):1179-86。https://doi.org/10.1104/pp.122.4.1179.
- 34.
Nieva C, Busk PK, domabi E, Lumbreras V.两个新的bZIP玉米ABA响应基因rab28调控基因的分离和功能特征。2005: 899 - 914。
- 35.
李震,张磊,于勇,权荣,张震,张宏,等。乙烯反应因子AtERF11被bZIP转录因子HY5转录调节,是拟南芥乙烯生物合成的关键抑制因子。2011;5:88-99。
- 36.
陈志伟,陈志伟,陈志伟,陈志伟。拟南芥茉莉酸/乙烯诱导防御途径的研究进展。2012;12月2011:1-10。
- 37.
杨晓明,张晓明,张晓明,等。拟南芥bZIP转录因子HY5在UV-B胁迫下的表达及基因表达分析。2004;
- 38.
杨晓东,李志强,李志强,李志强。HY5在拟南芥轻度调控发育中的靶向失稳。2000;405:0-4。
- 39.
27.彭蒂尔。D .苗子林。植物TGA因子的反显性抑制及其在植物防御反应中的正向和负向作用2001;
- 40.
Thurow C, Schiermeyer A, Krawczyk S, Butterbrodt T, Nickolov K, Gatz C,等。烟草bZIP转录因子TGA2。2和相关因子TGA2。1在植物防御反应和植物发育中起着不同的作用。2005; 1:100-13。
- 41.
清水H,佐藤K, Berberich T,宫崎A,尾崎R,今井R,等。LIP19是一种基本区域亮氨酸拉链蛋白,是水稻低温信号通路中的一种fos样分子开关。2005;46:1623-34。
- 42.
刘超,吴勇,王晓霞。bZIP转录因子OsbZIP52 / RISBZ5:水稻寒冷干旱胁迫响应的潜在负调控因子。2012: 1157 - 69。
- 43.
王x, Chaban ÆC, Hanson ÆJ, Teige ÆM, Harter ÆK, Sjef JVÆ,等。拟南芥C / S1 bZIP转录因子网络内的表达模式:异二聚体伙伴的可用性控制胁迫反应和发育过程中的基因表达。2009; 1:107-19。
- 44.
刘刚,王杰,Cramer G,戴智,段伟,徐华,等。葡萄的转录组分析(葡萄)在热应激恢复期间和之后的叶子。2012.
- 45.
杨勇,吕伟,李敏,王波,孙东,邓霞,等。玉米膜结合转录因子Zmbzip17在内质网质量控制和ABA信号传递中的关键调控因子。2020;1:2020-33。
- 46.
刘春,毛波,欧S, cl通道R. bZIP转录因子OsbZIP71与水稻耐盐和耐旱性有关。2013.
- 47.
Orellana S, Yañez M, Espinoza A, Verdugo I, González E, Ruiz-Lara S,等。转录因子SlAREB1具有耐干旱、耐盐胁迫和调控番茄生物和非生物胁迫相关基因的功能。植物细胞环境学报。2010;33(12):2191-208。https://doi.org/10.1111/j.1365-3040.2010.02220.x.
- 48.
Bastías A, Yañez M, Osorio S, Arbona V, Gómez-Cadenas A, Fernie AR,等。转录因子AREB1调节番茄果实的主要代谢途径。中国科学(d辑),2014;26(3):344 - 344。https://doi.org/10.1093/jxb/eru114.
- 49.
李赵苏X, Y,王H, G,程X,金问,等。中国白梨(Pyrus bretschneideri Rehd.)早期果实发育的转录组分析及PbCCR1在木质素生物合成中的功能鉴定。BMC植物生物学,2019;19(1):417。https://doi.org/10.1186/s12870-019-2046-x.
- 50.
李阿米尔M,程X, G,苏X,阿卜杜拉M, Cai y基因结构、P-ATPase基因家族的进化和表达分析在中国梨(Pyrus bretschneideri)。计算生物化学2020;88:107346。doi:https://doi.org/10.1016/j.compbiolchem.2020.107346.
- 51.
乔霞,尹华,李玲,王蓉,吴娟,吴娟,张松。不同的基因复制模式在梨(Pyrus bretschneideri)中表现出不同的进化模式,对重要果实性状基因家族扩展的贡献也不同。植物科学,2018;9:161。https://doi.org/10.3389/fpls.2018.00161.
- 52.
程旭,曹颖,苏旭,马曼佐尔,高洁,蔡颖,李勇。陆地棉锌指同源结构域转录因子(ZHDs)研究(陆地棉):纤维发育中的全基因组鉴定和表达分析。前热内。2018;9:357。https://doi.org/10.3389/fgene.2018.00357.
- 53.
李程X,李米,阿卜杜拉•M G,张J, Manzoor妈,王H,金问,江T, Cai Y,李d在硅片的全基因组分析梨(Pyrus bretschneideri)诺克斯的家人和PbKNOX1的功能描述,一个拟南芥Brevipedicellus orthologue基因,参与细胞壁和木质素生物合成。前热内。2019;10:632。https://doi.org/10.3389/fgene.2019.00632.
- 54.
阿卜杜拉,曹勇,程旭,孟D,陈勇,沙库尔,等。中国梨(pyrus bretschneideri Rehd.)蔗糖合酶基因家族:结构、表达和进化。分子。2018;23:1-16。
- 55.
曹颖,程欣,陈晓明,苏欣。中国大豆SBP基因的全基因组分析、特征及进化草莓属vesca,白梨,碧桃而且李属却已.2018:1-12。
- 56.
Balbontín C, Gutiérrez C, Wolff M, Figueroa CR.脱落酸和茉莉酸甲酯对甜樱桃果实品质和抗裂性的影响。2018; 78年9月:438 - 46。
- 57.
程X,穆罕默德,李G,张J,程J,邱J,江T,金Q, Cai Y, Y林Family-1 UDP在梨糖基转移酶(Pyrus bretschneideri):分子识别、phylogenomic描述和表达分析在石细胞形成。Mol Biol Rep 2019;0:0。doi:https://doi.org/10.1007/s11033-019-04669-y, 46, 2, 2153, 2175。
- 58.
王志刚,王志刚,王志刚,等。蛋白质结构域家族与核功能的关系。2002;
- 59.
Moore RC, Purugganan MD.重复基因进化的早期阶段;2003.
- 60.
曹勇,韩勇,孟D, Abdullah M,于杰,李东,等。gdsl型酯酶/脂肪酶在蔷薇科基因组中的扩增和进化模式中国生物医学工程学报。2018;18(6):673-84。https://doi.org/10.1007/s10142-018-0620-1.
- 61.
张松,田志,李辉,郭勇,张勇,Roberts JA,等。F-box基因家族的全基因组分析与鉴定陆地棉l . 2019;: 1 - 16。
- 62.
乔霞,李敏,李玲,殷红,吴娟,张松。中国白梨与其他5种蔷薇科植物热休克转录因子家族的全基因组鉴定与比较分析。植物学报。2015;15:1-16。
- 63.
王勇,王旭,Paterson AH。基因组和基因复制与基因表达差异:从植物角度看。2012: 1 - 14。
- 64.
研究结果表明,植物bZIP转录因子的基因表达与基因表达的相关性研究进展。植物园和G。雷蒙dii(今天棉花的二倍体祖先)。Physiol Mol Biol Plants, 2020。doi:https://doi.org/10.1007/s12298-020-00771-9.
- 65.
李霞,高松,唐勇,李林,张峰,冯波,等。小麦及其近缘种bZIP转录因子的全基因组鉴定和进化分析及花药发育相关TabZIP基因的表达谱。BMC Genomics. 2015;16(1):1 - 21。https://doi.org/10.1186/s12864-015-2196-7.
- 66.
刘华,钟勇,郭超,王小玲,熊杰,程强,等。6种Fragaria植物bZIP转录因子基因家族的全基因组分析与进化。中国生物医学工程学报,2017;29(3):344 - 344。https://doi.org/10.1007/s00606-017-1433-8.
- 67.
朱敏,闫斌,胡勇,崔智,王霞。水稻FTIP基因家族全基因组鉴定及系统发育分析。基因组学。2020;112(5):3803 - 14所示。https://doi.org/10.1016/j.ygeno.2020.03.003.
- 68.
周艳,曾玲,陈瑞,王艳,宋娟。苜蓿A20/AN1锌指蛋白胁迫相关蛋白(SAP)基因家族的全基因组鉴定与鉴定。中国生物医学工程学报,2018;70(1):87-98。https://doi.org/10.2298/ABS170529028Z.
- 69.
崔浩,洪俊,河俊,姜俊,金世永。ABFs是ABA响应元件结合因子家族*,在植物中含有大量ABA /胁迫响应基因。2000; 275:1723-30。
- 70.
赵俊,韩敏,安春,全俊,安庚,等。abre结合bZIP转录因子OsABF2是水稻非生物胁迫和ABA信号的正向调节因子。植物营养学报,2010;29(4):344 - 344。https://doi.org/10.1016/j.jplph.2010.05.008.
- 71.
潘艳,胡霞,李超,徐霞,苏超,李娟,宋辉,张霞,潘艳。SlbZIP38是一个被脱落酸下调的番茄bZIP家族基因,是耐干旱和耐盐胁迫的负调控因子。基因。2017;8(12):402。https://doi.org/10.3390/genes8120402.
- 72.
彭勇,孙涛,张颖Physcomitrella金属盘.植物科学进展(英文版);https://doi.org/10.3389/fpls.2017.02145.
- 73.
王志强,王志强,王志强,等。中国农学通报,2016;4(3):162-76。https://doi.org/10.1016/j.cj.2016.01.010.
- 74.
Rohrmann J, Tohge T, Alba R, Osorio S, Caldana C, McQuinn R,等。结合转录因子分析、微阵列分析和代谢产物分析,揭示了在番茄果实发育过程中代谢转移的转录控制。植物学报,2011;36(6):379 - 379。https://doi.org/10.1111/j.1365-313X.2011.04750.x.
- 75.
Costa F, Alba R, Schouten H, Soglio V, Gianfranceschi L, Serra S,等。这个临时PDF对应的文章,因为它出现在接受。利用同源和异源基因表达谱工具描述苹果果实成熟和成熟过程中的转录动态,文章t. 2010;: 1-17。
- 76.
李伟东,李志强,李志强,等。西瓜果实发育成熟过程中表达的基因。植物细胞学报,2006;25(11):1233-45。https://doi.org/10.1007/s00299-006-0163-0.
- 77.
李G,刘X, Y,默罕默德,汉W,李D, et al。梨肉桂酸4-羟化酶两个基因的克隆及功能研究。植物物理生物化学。2020;156:135-45。doi:https://doi.org/10.1016/j.plaphy.2020.07.035.
- 78.
吴娟,王震,史志,张松,明荣,朱松,等。梨(Pyrus bretschneideri Rehd.)的基因组。基因组学报,2013;23(2):396-408。https://doi.org/10.1101/gr.144311.112.
- 79.
Finn RD. Pfam:部落,网络工具和服务。核酸决议2006;34(90001):D247-51。https://doi.org/10.1093/nar/gkj149.
- 80.
Letunic I, Doerks T, Bork P. SMART 7:蛋白质域注释资源的最新更新。核酸res 2012; 40:302-5。
- 81.
Zdobnov EM, Apweiler R. InterProScan - InterPro中签名识别方法的集成平台。生物信息学。2001;17(9):847 - 8。https://doi.org/10.1093/bioinformatics/17.9.847.
- 82.
Bailey TL, Boden M, Buske FA, Frith M, Grant CE, Clementi L,等。MEME S UITE: motif发现和搜索工具;2009.1 - 7页。
- 83.
胡斌,金军,郭安,张宏,罗娟。基因组分析GSDS0:升级的基因特征可视化服务器。2014年12月31日:1296 - 7。
- 84.
计算机笔记MapChart:用于链接映射和qtl的图形表示的软件。1994: 77 - 8。
- 85.
李文杰,李志强,李志强,等。ExPASy: SIB生物信息学资源门户。2012; 40:597 - 603。
- 86.
王勇,唐辉,Debarry JD,谭鑫,李娟,王旭,等。MCScanX:一个用于检测和进化分析基因同步性和共线性的工具包。核酸决议2012;40:1-14。
- 87.
陈超,陈宏,张勇,陈海峰。TBtools -用于生物大数据交互分析的集成工具包。植物学报。2020;13(8):1194-202。https://doi.org/10.1016/j.molp.2020.06.009.
- 88.
王东,张勇,张震,朱军,于军。KaKs_Calculator 2.0:一个包含gamma系列方法和滑动窗口策略的工具箱。基因组学。蛋白质组学生物信息学。2010;8:77-80。
- 89.
Lescot M. PlantCARE,植物顺式作用调控元件的数据库和启动子序列硅分析工具的门户。中国生物工程学报,2002;30(1):325-7。https://doi.org/10.1093/nar/30.1.325.
- 90.
余春春,陈玉春,陆超,黄建科。预测蛋白质亚细胞定位。蛋白质:结构,功能和生物信息学。2006;64(3):643-51。https://doi.org/10.1002/prot.21018。.
- 91.
Kumar S, Stecher G, Li M, Knyaz C, Tamura K.简要交流(修订)MEGA X:跨计算平台的分子进化遗传学分析。中国生物医学杂志,2018;35(6):1547。https://doi.org/10.1093/molbev/msy096.
- 92.
Letunic I, Bork P.交互式生命树(iTOL) v4:最新更新和新发展。核酸研究,2019;47(W1): W256-9。https://doi.org/10.1093/nar/gkz239.
- 93.
Livak KJ, Schmittgen TD。利用实时定量PCR和2-ΔΔCT方法分析相关基因表达数据。方法。2001;25(4):402 - 8。https://doi.org/10.1006/meth.2001.1262.
确认
我们感谢专业人士。蔡永平对全文的修改和指导付出了很大的努力。
相应的作者
蔡永平通信
资金
本工作由安徽农业大学生命科学学院完成,国家自然科学基金(No. 31640068)和安徽农业大学自然科学青年基金(No. 2019zd01)资助。这些资助机构在研究设计、数据收集、分析和解释或撰写手稿方面没有任何作用。
作者信息
从属关系
贡献
MAM构思并设计了实验;MMM、GL、MA、WH、HW、AS、MWR、SR贡献了试剂/材料/分析工具;YC为整个手稿提供了指导。MAM写了这篇文章。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:表S1。
引物的PbbZIP的基因用于qRT-PCR。
附加文件2:表S2。
分子特性PbbZIP梨基因组中的基因家族。
附加文件3:表S3。
预测的分子功能,细胞成分的生物过程,和亚细胞定位PbbZIP梨基因家族。
附加文件4:表S4。
bZIP基因Motif序列。
附加文件5:表S5。
基因复制事件的模式,以及非同义(ka)和同义(ks)值PbbZIP基因家族。
附加文件6:表S6。
中鉴定的bZIP同源基因对列表小李子而且碧桃。
附加文件7:表S7。
的调查独联体作用元件PbbZIP的基因。
附加文件8:表S8。
的RNA-seq数据PbbZIP的梨果实不同发育阶段的基因分析。
附加文件9:图S1。
染色体位置PbZIP基因在p . bretschneideri.
附加文件10:图S2。
中bZIP基因的系统发育树p . bretschneideri,F. vesca, P. perica,而且m .释放有采用极大似然法。不同颜色表示不同亚科(A-I)。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
曼佐尔,文学硕士,曼佐尔,m.m.,李,G。et al。梨bZIP转录因子的全基因组鉴定、鉴定及其在非生物胁迫下的表达谱(Pyrus bretschneider我)。BMC植物生物学21,413(2021)。https://doi.org/10.1186/s12870-021-03191-3
收到了:
接受:
发表:
关键字
- PbbZIP基因家族
- 系统发育分析
- 扩张
- 表达分析
- 应激反应