摘要
背景
顶花1(TFL1)属于磷脂酰乙醇胺结合蛋白(PEBP)家族,在一些植物中参与花序分生组织发育并抑制开花。在目前的研究中,有四个TFL1从芒果中克隆出基因(Mangifera籼L.)品种“SiJiMi”并命名MiTFL1-1,MiTFL1-2,MiTFL1-3而且MiTFL1-4.
结果
序列分析表明,编码的MiTFL1蛋白含有一个保守的PEBP结构域,属于TFL1族。表达分析表明MiTFL1基因不仅在营养器官中有表达,在生殖器官中也有表达,且表达水平与花的发育有关。过度表达的四种MiTFL1转基因基因延迟开花拟南芥.此外,MiTFL1-1而且MiTFL1-3改变一些转基因植物的花形态。酵母双杂交(Y2H)分析表明,几种应激相关蛋白与MiTFL1蛋白相互作用。
结论
这四个MiTFL1基因表现出相似的表达模式,在拟南芥导致开花延迟。此外,MiTFL1-1而且MiTFL1-3过度表达影响花器官发育。此外,MiTFL1蛋白可与bHLH和14相互作用-3 - 3蛋白。这些结果表明MiTFL1基因可能在芒果开花过程中起重要作用。
背景
花的转变是高等植物生命周期中的一个重要阶段。植物由营养期向生殖期转变的过程受到复杂的内部信号和外部环境因素的调控[1,2].不同的开花响应途径,如光周期、春化、赤霉素、自主、环境温度和年龄相关的途径,已经确定在模式植物拟南芥[3.].许多基因在这些过程中起着至关重要的作用,所涉及的相互作用决定了分生组织的命运[4].君士坦斯(有限公司)含有锌指结构和CCT结构域,激活转录开花位点t(英国《金融时报》)基因通过与英国《金融时报》启动子区,以及英国《金融时报》蛋白质从叶组织移动到茎尖,开始植物从营养生长到生殖生长的转变[5,6].的花位点c(方法)基因在植物的春化过程中起着核心作用,即诱导植物开花[7,8,并通过结合来抑制开花英国《金融时报》,开花位点d(FD),constans1过表达抑制因子(SOC1),并抑制这些基因的表达[9].花分生组织特异性基因多叶的(LFY),APETALA1(AP1)直接诱导茎尖分生组织分化,促进植物进入花期,然后这些基因被激活英国《金融时报》或SOC1[10].
顶花1(TFL1),该蛋白属于磷脂酰乙醇胺结合蛋白(PEBP)家族,首次在拟南芥[11].TFL1而且英国《金融时报》是具有高度同源序列但功能相反的基因。TFL1编码具有保守的His88和Asp144残基的蛋白质,以及典型的氨基酸三联体模块EYD, YFG和END [12].FT蛋白不具有这种结构,这是这两个基因功能相反的关键原因[13].TFL1基因作为开花抑制因子,决定了顶端分生组织转变为花序分生组织的时间和花序的分支模式[14].在拟南芥,AtTFL1基因不仅维持茎尖分生组织和花序分生组织的无限生长,而且参与花的形成[15].在大多数果树中,…的功能TFL1同源基因是延缓开花的,功能类似AtTFL1.例如,的函数PmTFL1(从李属却已),即延迟开花,详见transformed拟南芥[16].之间的拮抗作用英国《金融时报》而且TFL1表现出与竞争有一定的关系FD[17,18].的TFL1基因抑制的表达LFY而且AP1的下游英国《金融时报》基因,通过结合到FD并抑制开花[19].此外,LFY而且AP1调节的表达TFL1以相反的方式使基因:LFY作为一种活化剂,AP1是一个抑制基因,这两个基因形成了一个不明确的反馈回路。植物的开花取决于花期的比例TFL1来LFY基因的表达。高的比例使植物处于开花抑制期,而低的比例使植物处于花期早期[20.].
与一年生植物相比,木质果树的幼年期较长,严重影响了育种。多项研究表明,过表达或沉默开花相关基因可以缩短花期,促进开花。例如,BpMADS4来自白桦的基因在苹果中构成性过表达,转基因植株表现出明显缩短的幼花期和花期[21].PcTFL1-1而且PcTFL1-2利用RNAi技术对欧洲梨进行了沉默处理,植株表现出开花早、幼花期短的特征[22].
芒果(Mangifera籼L.)是一种世界著名的木质果树,广泛生长在热带和亚热带地区。影响芒果开花的环境因素包括低温、水分胁迫和碳水化合物。外源喷施硝酸钾、多效唑和乙烯利可促进开花,而喷施赤霉素则抑制开花[23].芒果基因组的发表为开花基因的挖掘提供了有价值的信息[24].近年来,在芒果中分离并鉴定了数个开花调控基因,其中包括促花基因MiSOC1[25),两个MiAP1基因(26),三MiFT基因(27],以及一种抑制开花的基因(MiCO) [28].的功能MiTFL1在该植物中尚未发现。在目前的研究中,有四个MiTFL1同源基因,即MiTFT1-1,MiTFT1-2,MiTFT1-3而且MiTFT1-4,是从m .籼l .简历。“SiJiMi”。四种表达模式MiTFL1对不同组织和不同花期的基因进行了分析。MiTFL1构建基因过表达载体,通过基因转化确定基因的功能拟南芥.通过酵母双杂交(Y2H)试验筛选与MiTFL1蛋白相互作用的蛋白。结果表明,这四个MiTFL1基因抑制芒果开花。
结果
分离和序列分析MiTFL1基因
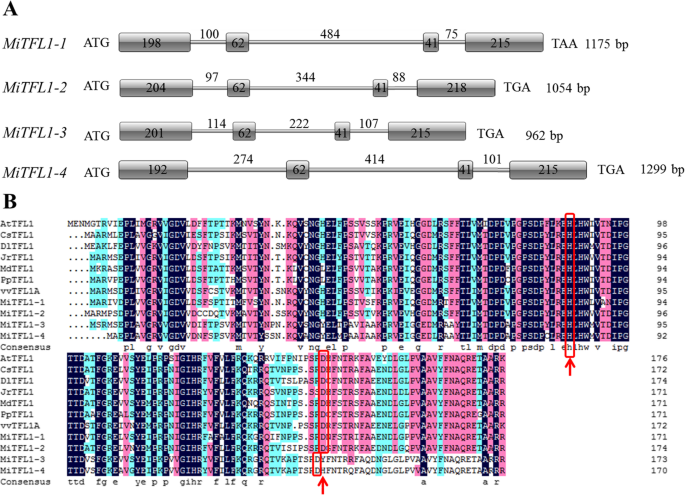
四个TFL1从‘SiJiMi’芒果的转录组和基因组数据(未发表数据)中鉴定出同源基因。我们通过RT-PCR进一步验证了这些序列,结果表明这些序列与从转录组数据中获得的序列一致。这四个基因被命名MiTFL1-1,MiTFL1-2,MiTFL1-3而且MiTFL1-4, DNA序列长度分别为1175 bp、1054 bp、962 bp和1299 bp。所有的四个MiTFL1基因包含4个外显子和3个内含子(图;1a).序列比对分析显示,四种基因的第一个外显子长度不同MiTFL1基因中,第二和第三外显子长度相同;在所有基因中,第4外显子长度为215 bpMiTFL1-2,长度为218 bp。这四个的完整编码序列MiTFL1基因编号为516 bp、525 bp、519 bp和510 bp,分别编码172 aa、175 aa、173 aa和170 aa。氨基酸序列比对分析表明,MiTFL1-3与MiTFL1-4的相似性比MiTFL1-1与MiTFL1-2的相似性(70%)高90%。MiTFL1-1、MiTFL1-2、MiTFL1-3和MiTFL1-4蛋白的氨基酸序列与AtTFL1 (NP_196004.1)的序列相似性分别为68.9、69.1、62.9和60.1%拟南芥,分别。此外,所有的MiTFL1蛋白都被鉴定为含有TFL1样蛋白关键的保守氨基酸残基的TFL1蛋白(图1)。1b),即85位的组氨酸(H85)和140位的天冬氨酸(D140)。
多序列比对及基因结构TFL1基因。一个基因结构MiTFL1基因。b不同果树TFL1蛋白的氨基酸序列比对拟南芥.以下物种被包括在分析中(GenBank的加入编号显示在括号中):拟南芥(AtTFL1 NP_196004.1),素类(CsTFL1 NP_001275848),花芽龙眼(DlTFL1 AHY24028.1),胡桃regia(JrTFL1 XP_018811176.1),马吕斯有明显(MdTFL1 NP_001280887.1),梨x bretschneideri(PpTFL1, NP_001289244.1),以及葡萄(VvTFL1A NP_001267929.1)。黑色表示序列完全相同。红色表示相似度≥75%。蓝色表示相似度≥50%。红色框表示tfl1样蛋白的关键残基His85和Asp140
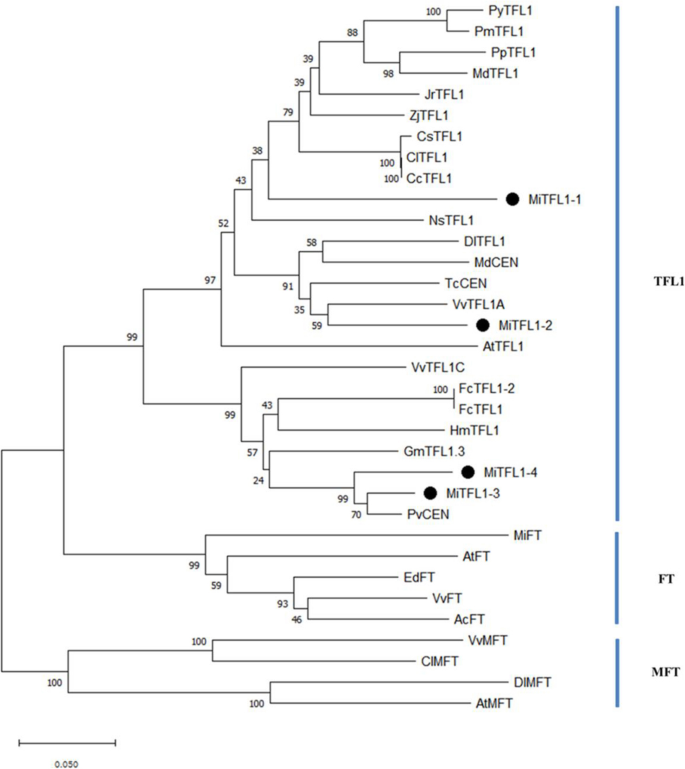
PEBP基因家族分为TFL1,英国《金融时报》而且分区,亚科。根据系统发育树分析(图;2), MiTFL1-1、MiTFL1-2、MiTFL1-3和MiTFL1-4蛋白与其他种的TFL1蛋白聚在一起。在所研究的蛋白中,MiTFL1-1蛋白与苹果、梨、杏、李、核桃、枣等芸香科果树和玫瑰植物的TFL1蛋白密切相关。MiTFL1-2蛋白与桂圆和葡萄的TFL1蛋白、苹果和可可的CEN蛋白密切相关。MiTFL1-3和MiTFL1-4蛋白聚在一起,与开心果的PvCEN蛋白密切相关。
PEBP蛋白的系统发育树分析。以下物种被包括在分析中(GenBank的加入编号显示在括号中):拟南芥(AtTFL1 NP_196004.1),素类(CsTFL1 NP_001275848),花芽龙眼(DlTFL1 AHY24028.1),胡桃regia(JrTFL1 XP_018811176.1),马吕斯有明显(MdTFL1 NP_001280887.1),梨x bretschneideri(PpTFL1 NP_001289244.1),马吕斯有明显(MdCEN NP_001280940.1),黄连木维拉(PvCEN蛋白1,XP_031269481.1)Theobroma可可(TcCEN XP_017973069.1),绣球花macrophylla(HmTFL1 MF374628.1),大豆(GmTFL1.3 FJ573238.1),无花果(FcTFL1-2 AB746842.1),柑橘克莱门蒂娜(CcTFL1 XP_006430226.1),柠檬(ClTFL1 AWW25018.1),无花果(FcTFL1 BAX00857.1),烟草的抗旱性(NsTFL1 XP_009766168.1),李属却已(PmTFL1 AEO72021.1),李属yedoensis(PyTFL1 AEO72023.1),葡萄(VvTFL1A NP_001267929.1),葡萄(VvTFL1C NP_001267933.1),Ziziphus枣(ZjTFL1 XP_015898753.1),猕猴桃对(AcFT AJA40932.1),拟南芥(AtFT BAA77838.1),Eriobotrya deflexa(EdFT AMB72867.1),Mangifera籼(MiFT AGA19021.1),葡萄(VvFT NP_001267907.1),拟南芥(AtMFT OAP13671.1),柠檬(ClMFT AWW25016.1),花芽龙眼(DlMFT, AUG98253.1),以及葡萄(VvMFT NP_001267935.1)
表达分析MiTFL1基因
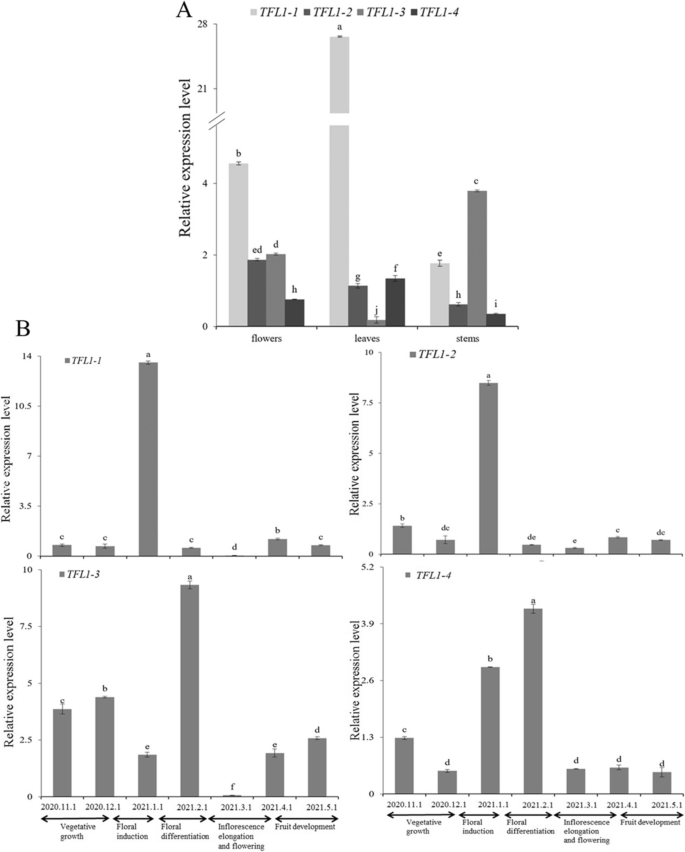
的表达模式MiTFL1用qRT-PCR方法对芒果不同组织(包括花、叶和茎)中的基因进行了检测。3.一个)。MiTFL1-1,MiTFL1-2,MiTFL1-3而且MiTFL1-4在花,叶和茎中表达。MiTFL1-1而且MiTFL1-4在叶片中表达量高于其他组织。MiTFL1-2在花中高度表达,而MiTFL1-3在茎中高度表达。
的表达模式MiTFL1芒果不同开花发育阶段的基因m .籼l.简历.从营养生长期到开花结果期(2020年11月- 2021年5月)采集“四稻”叶片,分析结果如图所示。3.B.的表达模式MiTFL1-1而且MiTFL1-2基因相似。这两个基因在花诱导期的表达量显著高于其他阶段。的表达级别MiTFL1-3基因在营养生长期高,花诱导期显著降低,花分化期显著升高。花期表达量最低,果实发育期叶片表达量较高。表达水平MiTFL1-4在花诱导期先下降后上升,在花分化期达到峰值,随后下降,最终在果实发育期趋于稳定。
MiTFL1蛋白的亚细胞定位
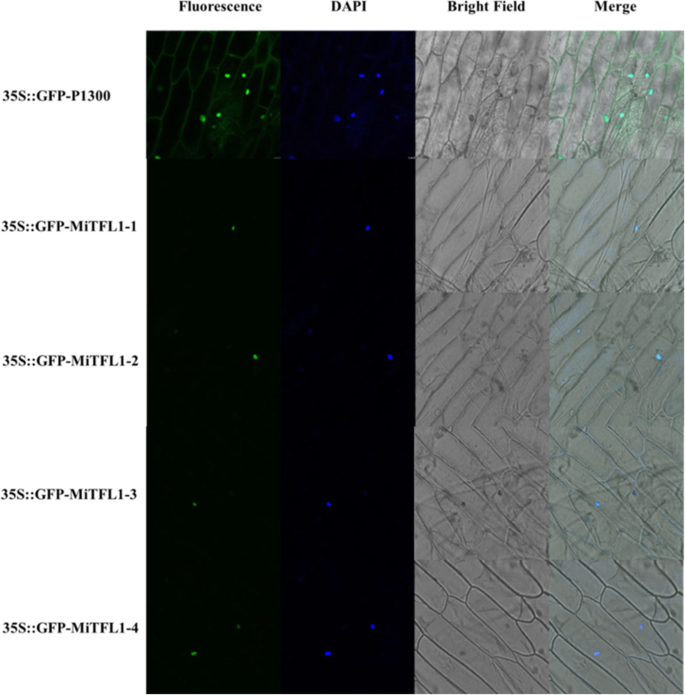
为了检测MiTFL1蛋白的亚细胞定位,将35S::GFP-MiTFL1-1、35S::GFP-MiTFL1-2、35S::GFP-MiTFL1-3、35S::GFP-MiTFL1- 4和35S::GFP- p1300分别转化为洋葱表皮细胞(图2)。4).在整个细胞内观察到空载体35S::GFP-P1300的荧光信号。35S::GFP-MiTFL1-1、35S::GFP-MiTFL1-2、35S::GFP-MiTFL1-3和35S::GFP-MiTFL1-4融合蛋白仅在细胞核中可见,并用DAPI染色。
的表型分析MiTFL1超表达在拟南芥
MiTFL1基因延缓植物开花拟南芥
的功能MiTFL1-1,MiTFL1-2,MiTFL1-3而且MiTFL1-4在芒果开花过程中,构建pBI121-MiTFL1单个过表达载体,分别转入WT中答:芥.对t3代纯合子植株进行表型观察,WT和pBI121空载体表达拟南芥作为对照。
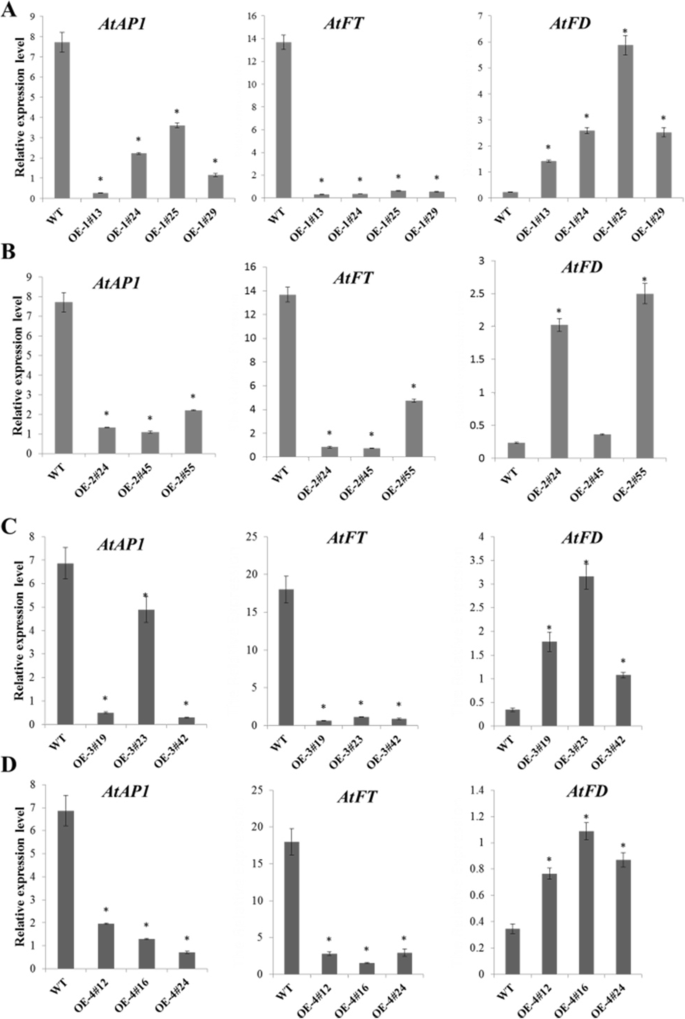
四个独立的线路MiTFL1-1(OE-1#13, OE-1#22, OE-1#25和OE-1#29)和三个独立的行MiTFL1-2选择过表达(OE-2#24, OE-2#45和OE-2#55)进行功能分析。半定量RT-PCR分析显示MiTFL1-1而且MiTFL1-2在转基因株系中大量表达,但在空表达载体的转基因或WT植株中不表达(图2)。5A1和B1)。所有的独立线MiTFL1-1而且MiTFL1-2表现为抽苔和开花延迟:这些过程在这些品系分别发生在28.7-32.5天和33.3-42.2天,在对照品系分别发生在24.9-25.3天和28.5-28.8天。5A B和桌子1).所有的变换线MiTFL1-1而且MiTFL1-2表现出与WT植株相似的正常抽苔现象。此外,与野生型植物的高度相比,野生型植物的高度较低MiTFL1-1而且MiTFL1-2除OE-1#13、OE-1#29和OE-2#45外,其余植株的莲座叶均未受显著影响(表2 - 4)1).
转基因表型拟南芥转基因株系及表达谱。一个过度表达mitfl1 -1转基因株系的表型表现为延迟开花(右),以及WT和pBI121转基因株系作为对照在LD条件下的表型(左)。A1RT-PCR分析MiTFL1-1在控制和MiTFL1-1过表达转基因系。B表型的MiTFL1-2在LD条件下,显示延迟开花的过表达转基因株系(右)和作为对照的WT和pBI121转基因株系(左)。B1RT-PCR分析MiTFL1-2对照和过表达mitfl1 -2转基因株系。原始数据见图。S1a - b
三个独立MiTFL1-3过度表达(OE-3#19, OE-3#23和OE-3#42)MiTFL1-4选择过表达系(OE-4#24、OE-4#45和OE-4#55)进行功能分析。半定量RT-PCR分析证实MiTFL1-3而且MiTFL1-4在转基因株系中大量表达,但在WT和pBI121转基因株系中不表达拟南芥植物(图。6A1和B1)。在长日(LD)条件下,过表达mitfl1 -3和过表达mitfl1 -4的转基因植株的抽苔时间明显延迟。6ab和表格2).抑制作用MiTFL1-4开花时间较其他三株弱MiTFL1基因。一些植物的高度MiTFL1-3而且MiTFL1-4转基因株系表现出显著差异,但部分植株高度与对照株系差异不显著。任何一种植物的莲座叶均未受显著影响(表2)2).
转基因表型拟南芥转基因株系及表达谱。一个在LD条件下,过表达mitfl1 -3转基因株系的表型表现为开花延迟(右)和WT和pBI121转基因株系的表型表现为对照(左)。A1RT-PCR分析MiTFL1-3对照和过表达mitfl1 -3转基因株系。B过度表达mitfl1 -4的转基因株系的表型(右),以及WT和pBI121转基因株系在LD条件下的表型(左)。B1RT-PCR分析MiTFL1-4对照和过表达mitfl1 -4转基因株系。原始数据见图。S1c - d
MiTFL1-1而且MiTFL1-3影响花的表型拟南芥
mitfl1 -1过表达(图;7b)和过表达mitfl1 -3的转基因株系(图;7c)表现出与WT系相似的异常表型(图;7a).在转基因植株中,部分心皮发育成新的花序(图;7B-a和C-a),一些花结构缺乏花瓣(图。7B-b和C-b),与WT植物的结果相反(图。7A-a -b)。与野生型植株相比,在转基因植株中发现了两种类型的角果变异(图2)。7A-b, A-c):在一些硅果中,果柄在形成过程中继续从花中延长(图。7B-c和C-c);其余的果柄呈弯曲生长,果柄较短(图2)。7B-c和C-c)高于WT植物。此外,由于花形态的变化,转基因植物的花序与野生型植物有显著不同(图2)。7A-d, B-e和C-e)。此外,转基因植株的侧枝上生长出轮生叶拟南芥但在对照植物中没有。7A-e, B-f和C-f)。
转基因内源基因的表达模式拟南芥表达MiTFL1基因
以确定是否MiTFL1转基因中的基因过表达拟南芥改变了一些与开花有关的基因的表达,比如AtFT,AtFD,AtAP1同源染色体在拟南芥, T3代全地上部分纯合转基因答:芥在种植后30天采集,进行qRT-PCR分析(图;8).AtACTIN2作为内参基因。也发现了类似的表达模式AtFT,AtFD,AtAP1记录在拟南芥在过度表达这四个之后MiTFL1基因(图。8模拟)。的表达水平AtFT而且AtAP1基因在所有的MiTFL1-过表达转基因株系.然而,表达的AtFDmitfl1 -2基因在许多转基因株系中均显著增加,但在过表达株系OE-2#45中无显著增加。
与MiTFL1蛋白相互作用的蛋白质
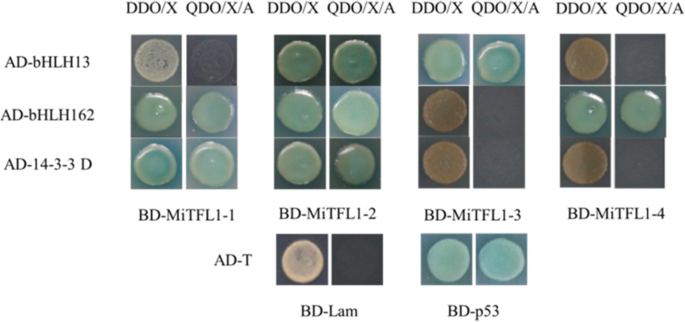
采用Y2H体系筛选与MiTFL1蛋白相互作用的蛋白,验证其相互作用。通过双酶切构建诱饵载体pGBKT7-MiTFL1,未检测到自活化和毒性(见图)。S2).将含饵质粒的酵母细胞与“四吉米”cDNA同质化文库结合,筛选阳性克隆。经过Y2H分析,我们获得了9个与MiTFL1-1蛋白相关的候选蛋白,7个与MiTFL1-2蛋白相关,6个与MiTFL1-3蛋白相关,7个与MiTFL1-4蛋白相关(表1-4)S1).从候选蛋白中筛选出3个胁迫或开花相关蛋白,在DDO/X和QDO/X/A培养基上进行进一步点对点验证。这三种蛋白分别为碱性螺旋-环-螺旋蛋白13 (bHLH13)、bHLH162和14-3-3D,如图所示。9.pGADT7重组载体中含有候选蛋白bHLH13的细胞在QDO/X/A固体培养基上呈蓝色,生长正常,表明该蛋白与MiTFL1-2和MiTFL1-3蛋白相互作用。bHLH162与MiTFL1-1、MiTFL1-2和MiTFL1-4互作,而14-3-3D仅与MiTFL1-1和MiTFL1-2互作。
讨论
英国《金融时报》而且TFL1编码一对属于PEBP家族的开花调节因子,并在从营养生长到生殖发育的转变过程中发挥关键作用[19].英国《金融时报》而且TFL1具有高同源性,表现为高核苷酸和氨基酸序列的一致性,但具有相反的功能。英国《金融时报》促进生殖发育和开花的过渡,而TFL1抑制开花[19,29].我们之前的研究确定了三种英国《金融时报》来自芒果的基因进一步证实了这一切英国《金融时报》基因显著促进转基因植物开花[27].在目前的研究中,有四个TFL1从“SiJiMi”芒果的转录组和基因组数据分析中获得基因(未发表数据),并对其命名MiTFL1-1,MiTFL1-2, MiTFL1-3而且MiTFL1-4.序列分析表明,4TFL1“SiJiMi”芒果的基因与“Alphonso”的核苷酸序列高度一致(图2)。S3).
副本多份TFL1在其他植物中也发现了同源基因,如大豆[30.]、毛竹[13]和枇杷[31],三个矮牵牛花[32],四个棉质[33]五分之一橡胶树取代巴西橡胶树[34].在之前的研究中,只有两个TFL1基因,即MiTFL1而且MiTFL1a,是在另一种芒果品种中发现的。”阿方索,对应于MiTFL1-2而且MiTFL1-1,在本研究中,[35].MiTFL1基因包含四个外显子和三个内含子。不同基因间第二、第三外显子核苷酸长度高度一致MiTFL1基因(图。1a).在这四种MiTFL1蛋白中也发现了TFL1蛋白的关键氨基酸His88和Asp144(图。1b).构建的系统发育树显示,这4个MiTFL1蛋白属于TFL1蛋白分支。在树状图中,MiTFL1-1和MiTFL1-2距离较近,而MiTFL1-3和MiTFL1-4距离也较近。2).
的TFL1大多数果树的基因表达模式与花的发育有关.柑橘类CsTFL1只在花器官中表达[36].P. mume PmTFL1在幼年期在叶、茎和根中表达,而PmTFL1只在成熟阶段的叶芽和嫩叶中发现[16].的PpTFL1桃的基因主要在成熟嫩叶中表达,而在成熟叶片和花器官中均无表达[37].EjTFL1-1主要在根和叶芽中表达,但在芽、花芽和花中表达量低。EjTFL1-2主要在叶芽、花和果实中表达,在其他组织中不表达[31].在本研究中,MiTFL1与上述报道的基因表达模式不同。组织表达分析表明MiTFL1-1,MiTFL1-2,MiTFL1-3而且MiTFL1-4在营养组织和生殖组织均有表达,但表达水平不同。我们的结果与其他芒果品种“Alphonso”和“Ratna”的结果相似[35].这些结果表明,在组织表达模式TFL1不同种间基因差异显著。
一些研究表明,蛋白的表达模式TFL1在花发育的不同阶段,基因是不同的。例如,在梨、苹果和榅桲中TFL1-1而且TFL1-2花分化前基因在花蕾中高表达,花分化后基因表达呈下降趋势[38].在h .取代巴西橡胶树,HbTFL1-1,HbTFL1-2而且HbTFL1-3在花序发育过程中,表达量逐渐增加HbCEN1而且HbCEN2在此期间持续减少[39].表达水平EjTFL1-1而且EjTFL1-2花芽分化前逐渐减少,开花期又开始增加[31].芒果的种类阿方索”,MiTFL1在开花诱导期表达增加,随后减少,而MiTFL1a在花期表达量仍然很低[35].在本研究中,表达的MiTFL1芒果中的基因与上述报道的相似。MiTFL1-1而且MiTFL1-2花诱导期在叶片中高表达,而MiTFL1-3而且MiTFL1-4在花分化期叶片中均有高表达。
TFL1同源基因在许多物种中具有相似的功能,这些功能包括延迟开花时间和通过抑制花序分生组织来维持花序分生组织AP1而且LFY表达式[15].苹果的过度表达MdTFL1在拟南芥延迟开花时间,抑制其表达MdTFL1基因通过RNAi技术获得早花性状[34,40].日本杏PmTFL1[16]和橡胶TFL1基因在转基因中表现出相同的功能拟南芥[39].在目前的研究中,有四个芒果MiTFL1转基因基因具有相同的延迟开花时间的功能拟南芥.此外,MiTFL1-1而且MiTFL1-3转基因株系表现出花瓣缺失、心皮发育为新花序、荚果弯曲生长和种子败育等花器官表型异常。这些结果表明MiTFL1-1而且MiTFL1-3参与花器官发育。在菊花中也发现了类似的表型CmTFL1c -而且李属PsTFL1-overexpressing转基因拟南芥行(41,42].
外生的介绍TFL1基因显著下调了内源基因的表达水平AtFT而且AtAP1在转基因拟南芥,导致花期延迟。例如,过度表达HkTFL1基因萱草属植物延迟开花,和表达水平AtFT而且AtAP1在转基因拟南芥均较WT拟南芥[43].的菊花CmTFL1c基因通过抑制来负向调控开花AtFT,AtLFY而且AtAP1表达式[42].黄瓜CsTFL1b也会延迟开花拟南芥的表达水平的降低和增加AtFT而且AtFD,分别[4].在目前的研究中,我们发现了四个MiTFL1基因表达下调AtFT而且AtAP1表达上调AtFD转基因表达拟南芥.
在水稻中,tfl1样蛋白rice CENTRORADIALIS (RCN)可以直接与14-3-3蛋白相互作用[44].在本研究中,我们还利用Y2H实验筛选了一些与MiTFL1相互作用的蛋白(表2 - 1)S1).例如,14-3-3D蛋白被发现与MiTFL1-1和MiTFL1-2相互作用,这一结果与水稻中发现的结果相似。另外两种bHLH蛋白也被发现与不同的MiTFL1蛋白相互作用,并在几个过程中发挥作用,包括生长、发育和对各种应激的反应[45].此外,还筛选出了其他可能与MiTFL1蛋白相互作用的蛋白,它们也参与了胁迫反应、植物生长发育。然而,这些相互作用的蛋白质必须进一步测试。
结论
在目前的研究中,有四个MiTFL1在芒果中鉴定了基因。这些蛋白同时含有关键氨基酸His88和Asp144。表达分析表明MiTFL1基因表现出相似的表达模式MiTFL1基因在营养组织和生殖组织中均有表达,在开花诱导期和花分化期成熟叶片中表达量较高。过度表达的四种MiTFL1基因在拟南芥导致开花延迟,而MiTFL1-1而且MiTFL1-3过度表达影响花器官发育。Y2H分析表明,MiTFL1蛋白与bHLH和14-3-3蛋白相互作用。这些结果提供了初步证据MiTFL1基因负向调控芒果花诱导,但其相互作用机制有待进一步验证。
方法
植物材料和生长条件
的m .籼l.简历.本研究中使用的“四稻”植物种植在广西南宁(22°502 N, 108°17 e)广西大学的一个果园。为了进行组织表达分析,2021年3月10日采集了17年树龄的叶子、茎和花。为了进行季节表达分析,从2020年11月1日(营养期)到2021年5月1日(果实发育期),每月收集一次靠近顶芽的叶片。所有样品立即在液氮中冷冻,并保存在−80°C。的拟南芥本实验室保持Col-0生态型。
隔离MiTFL1芒果基因
根据制造商的说明,使用RNAprep Pure Plant Kit (TianGen, Beijing, China)从芒果叶片中提取总RNA。根据制造商的说明,从1 μg总RNA中使用M-MLV逆转录酶(TaKaRa, Dalian, China)合成第一链cDNA。采用CTAB法从芒果叶片中提取基因组DNA。四个TFL1从芒果叶片中获得基因并命名MiTFL1-1,MiTFL1-2,MiTFL1-3而且MiTFL1-4.特异性引物(QTFL1-1u/d, QTFL1-2u/d, QTFL1-3u/d, QTFL1-4u/d;表格S2)被设计用来放大MiTFL1来自基因组DNA和cDNA的基因。聚合酶链反应(PCR)混合液中含有2.5 μl 10× PCR缓冲液(含MgCl2 +)、0.5 μl 10 mM dNTPs(生工生物技术,上海,中国)、上下行引物各1 μl (10 μM)、0.15 μl TransTaq-T DNA聚合酶(天根)、1 μl基因组DNA (100 ng/μl)或cDNA (100 ng/μl)作为模板、无菌水(25 μl)。PCR扩增条件为95℃初始变性4 min;38个循环,95°C为40秒,56°C为50秒,72°C为N min (N= 1 min/kb);最后在72°C延长10分钟。将扩增片段克隆到pMD18-T载体(Takara)中进行测序。
序列分析
使用BioXM 2.6软件进行序列分析和氨基酸预测。IBS 1.0版本用于生成外显子-内含子结构。保守域分析使用NCBI BLAST搜索引擎(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi).FT1/TFL1家族氨基酸序列通过GenBank BLAST搜索下载(http://www.ncbi.nlm.nih.gov/BLAST/).使用DNAMAN软件分析TFL1蛋白的多个序列比对。采用邻居连接法在MEGA-Χ中构建系统发育树,自举重复1000次。
表达分析MiTFL1基因
的表达式MiTFL1基因采用实时荧光定量PCR检测。根据制造商的说明,使用RNAprep Pure Plant Kit (TianGen)从所有样品中提取总RNA。合成第一链cDNA作为模板。基因特异性引物(qTFL1-1u/d, qTFL1-2u/d, qTFL1-3u/d和qTFL1-4u/d;无花果。S4),以区分MiTFL1基因。的MiActin1以芒果的基因为内参基因[46].PCR混合物中含有SYBR Premix Ex Taq II (Takara) 10 μl、cDNA 1 μl (100 ng/μl)、上下行引物0.5 μl (10 μl)、ROX参比染料II 0.8 μl和无菌水,总体积为20 μl。PCR扩增条件为95℃30 s;95°C持续5秒,60°C持续34秒,95°C持续15秒,循环40次;60°C 1分钟;95°C 15 s。相对转录本丰度用2——ΔΔCt方法(47].每个样品的分析包括3个生物学重复。
MiTFL1蛋白的亚细胞定位
的完整编码序列MiTFL1将无终止密码子的基因构建到P1300-GFP载体中Xba我和BamHI限制酶的裂解位点。将所构造的向量变换为根癌土壤杆菌EHA105。将GFP融合载体和空载体转化洋葱表皮细胞农EHA105。用4′,6-二氨基苯基吲哚(DAPI)观察细胞核。使用高分辨率激光共聚焦显微镜(TCS-SP8MP;德国徕卡)。
质粒构建与遗传转化
的MiTFL1以CaMV 35S为启动子,将基因克隆到pBI121二元表达载体上,构建OE过表达载体Xba我和XmaI限制酶的裂解位点。将过表达质粒转入农应变EHA105。将过表达向量和空向量转化为WT答:芥采用花浸法[48].转基因种子在含50 mg/l卡那霉素的1/2 MS培养基上筛选,经基因组PCR鉴定。采用特异性引物MiTFL1-1u/d、MiTFL1-2u/d、MiTFL1-3u/d和MiTFL1-4u/d检测其是否转化MiTFL1基因是成功的。采用纯合子T3转基因植株进行后续实验。
表型分析
野生型和空向量转换拟南芥植物作为对照。测定了抽苔时间、开花时间、抽苔至开花时间、莲座叶数等表型指标。的表达水平MiTFL1基因和一些开花相关基因在转基因和对照植物,30日龄转基因和野生型幼苗拟南芥收集植株进行总RNA提取。提取总RNA,按上述方法合成第一链cDNA。采用半定量RT-PCR法测定各基因的表达水平MiTFL1转基因和对照系中的基因。PCR扩增条件为95℃初始变性2 min;95°C持续30秒,56°C持续30秒,72°C持续30秒,循环30次;最后在72°C下延长5分钟。PCR产物在1.8%琼脂糖凝胶上电泳分离。一些内源开花相关基因在转基因和对照中的表达水平拟南芥采用上述反应体系和条件进行qRT-PCR检测。拟南芥AtACTIN2作为qRT-PCR分析的内参基因。本研究所用引物均列于表中S1.
与MiTFL1蛋白相互作用的蛋白质
cDNA文库m .籼l.简历.利用酵母双杂交文库构建试剂盒(Clontech, Dalian, China)构建四稻叶和开花器官。Y2H测定根据酵母转化系统2协议(Clontech)进行。的完整编码序列MiTFL1基因被插入pGBKT7载体之间濒死经历我和EcoRI限制酶的裂解位点。将pGBKT7-bait质粒转化为Y2H金酵母细胞,稀释10_1和10_2并涂有SDO/−Trp、SDO/−Trp/X-alpha-Gal和SDO/−Trp/X-alpha-Gal /AbA介质。用该方法验证了其转录活性和毒性。
在QDO/−Trp/−Leu/−His/−Ade培养基上筛选DNA文库,鉴定相互作用蛋白。提取相互作用蛋白的质粒,用于进一步验证实际相互作用。将含有pGBKT7-bait质粒的Y2H Gold酵母细胞与含有候选猎物的Y187酵母细胞混合,在含2 × YPDA的液体培养基中30°C、200 rpm培养20-24 h。然后将混合物涂敷在DDO/−Trp/−Leu/X和QDO/X/A培养基上,培养3-5天。媒体上的蓝色殖民地表明了一种积极的相互作用。AbA浓度为500 μg/ml, X-α-gal浓度为200 ng/ml。阳性对照为Y2H Gold (pGBKT7-53)和Y187 (pGADT7-T),阴性对照为Y2H Gold (pGBKT7-LAM)和Y187 (pGADT7-T)。
统计分析
采用SPSS 19.0统计软件(SPSS Inc., Chicago, IL, usa)进行统计分析。
数据和材料的可用性
在本研究过程中产生或分析的所有数据都包含在这篇发表的文章及其补充信息文件中。本研究生成的数据集可在GenBank (http://www.ncbi.nlm.nih.gov/Genbank),而登记编号如下:AtTFL1 (NP_196004.1), CsTFL1 (NP_001275848), DlTFL1 (AHY24028.1), JrTFL1 (XP_018811176.1), MdTFL1 (NP_001280887.1), PpTFL1 (NP_001289244.1), VvTFL1A (NP_001267929.1), MdCEN (np_017973069.1), PvCEN蛋白1 (xp_012669481.1), TcCEN (XP_017973069.1), HmTFL1 (MF374628.1), GmTFL1.3 (FJ573238.1), FcTFL1-2 (AB746842.1), CcTFL1 (XP_006430226.1), ClTFL1 (AWW25018.1), FcTFL1 (BAX00857.1), NsTFL1 (XP_009766168.1), PmTFL1 (AEO72021.1), PyTFL1 (aeo72093.1), VvTFL1C (NP_001267933.1),ZjTFL1 (XP_015898753.1), AcFT (AJA40932.1), AtFT (BAA77838.1), EdFT (AMB72867.1), MiFT (AGA19021.1), VvFT (NP_001267907.1), AtMFT (OAP13671.1), ClMFT (AWW25016.1), DlMFT (AUG98253.1), VvMFT (NP_001267935.1)。
缩写
- CTAB:
-
Hexadecyltrimethylammonium溴化
- 存在:
-
定量逆转录聚合酶链反应
- DAPI:
-
6-diamidino-2-phenylindole
- X-Alpha-Gal:
-
5-bromo-4-chloro-3-indoxyl -α-D-galactopyranoside
- 阿坝:
-
Aureobasidin一
参考文献
- 1.
拉尔森,兰德伯格K,米克斯瓦格纳博士终端FLOWER2(TFL2)基因控制拟南芥的生殖转变和分生组织的特征。遗传学。1998;149(2):597 - 605。https://doi.org/10.1093/genetics/149.2.597.
- 2.
Prudencio AS, Hoeberichts FA, Dicenta F, Martínez-Gómez P, Sánchez-Pérez R.杏花花蕾早、晚开花时间候选基因的鉴定。树木物理,2020年。https://doi.org/10.1093/treephys/tpaa151.
- 3.
他怎么一点。开花的染色质调控。植物科学进展,2012;17(9):556-62。https://doi.org/10.1016/j.tplants.2012.05.001.
- 4.
赵伟,顾睿,车刚,程哲,张旭。CsTFL1b可调节黄瓜的开花时间和花序结构(Cucumis巨大成功l .)。生物化学学报,2018;49(2):357 - 357。
- 5.
卢奇奥尼L,克兹穆斯基M,桑切兹拉马斯M,卡拉耶科夫E, Cerdán PD,卡萨尔JJ。君士坦斯延迟拟南芥在短日照下开花。植物学报,2018;36(5):344 - 344。https://doi.org/10.1111/tpj.14171.
- 6.
王晓燕,王晓燕,王晓燕,王晓燕,等。薰衣草花抑制因子基因的克隆及功能鉴定。足底。2020;251(2):41。https://doi.org/10.1007/s00425-019-03333-w.
- 7.
Sheldon CC, Rouse DT, Finnegan EJ, Peacock WJ, Dennis ES。春化的分子基础:春化的中心作用开花位点c(方法).中国科学(d辑),2000;29(3):344 - 344。https://doi.org/10.1073/pnas.97.7.3753.
- 8.
元善,郑子,金杰。菊花MADS-box基因家族的全基因组分析。中国生物工程学报,2015;https://doi.org/10.1016/j.compbiolchem.2020.107424.
- 9.
Ream TS, Woods DP, Amasino RM。不同植物群春化的分子基础。中国科学院学报(自然科学版)2011;
- 10.
夏尔马B,巴茨TA,卡翁达尔R,克莱默EM,拉尔森RB。Aquilegia coerulea春化诱导向开花过渡的发育和分子变化(James)。基因。2019;10(10):734。https://doi.org/10.3390/genes10100734.
- 11.
Shannon S, Meeks-Wagner DR.拟南芥的突变TFL1基因影响花序分生组织发育。植物细胞学报。1991;3(9):877-92。https://doi.org/10.2307/3869152.
- 12.
Carmona MJ, Calonje M, Martínez-Zapater JM。的英国《金融时报》/TFL1基因家族在葡萄藤。植物化学学报,2007;26(5):537 - 548。https://doi.org/10.1007/s11103-006-9113-z.
- 13.
杨志林,陈琳,Kohnen MV,熊斌,甄霞,廖军,等。毛竹PEBP家族基因的鉴定与鉴定(撂荒).科学通报2019;9:14998。
- 14.
刘旭,张娟,谢德元,Franks RG,向青军。功能表征顶花1加拿大山茱萸基因转化同源物。植物细胞学报,2019;38(3):333-43。https://doi.org/10.1007/s00299-019-02369-2.
- 15.
刘志刚,刘志刚,刘志刚。拟南芥花序结构的研究进展。科学。1997;275(5296):80 - 3。https://doi.org/10.1126/science.275.5296.80.
- 16.
叶秀美,李志刚,李志刚,李志刚TFL1日本杏(Prunus mume Sieb)的同源物。调查)。科学通报。2010;25(4):489 - 497。https://doi.org/10.1016/j.scienta.2010.05.016.
- 17.
Moraes TS, Dornelas MC, Martinelli AP. FT/TFL1:校准植物结构。中国植物科学,2019;10:97。https://doi.org/10.3389/fpls.2019.00097.
- 18.
Périlleux C, Bouché F, Randoux M, Orman-Ligeza B.把分生组织变成堡垒。植物科学进展,2019;24(5):431-42。https://doi.org/10.1016/j.tplants.2019.02.004.
- 19.
Wickland DP, Hanzawa Y. The开花位点t/顶花1基因家族:功能进化与分子机制。植物学报。2015;8(7):983-97。https://doi.org/10.1016/j.molp.2015.01.007.
- 20.
康迪L,布拉德利D。顶花1是一种控制拟南芥结构的移动信号。植物学报。2007;19(3):767-78。https://doi.org/10.1105/tpc.106.049767.
- 21.
Flachowsky H, Peil A, Sopanen T, Elo A, Hanke vBpMADS4白桦(Betula pendula Roth.)诱导苹果(Malus aldomestica Borkh.)提早开花。中国植物学报。2007;26(2):344 - 344。https://doi.org/10.1111/j.1439-0523.2007.01344.x.
- 22.
傅瑞曼,薛泽曼,郭博维奇,杨晓明,等。转基因早花梨的研制(Pyrus普通的l)基因型的RNAi沉默PcTFL1-1而且PcTFL1-2.足底。2012;235(6):1239 - 51。https://doi.org/10.1007/s00425-011-1571-0.
- 23.
罗超,于海霞,范勇,张新军,何晓辉。芒果开花机理研究进展。植物学报,2019;1244(2):17-22。https://doi.org/10.17660/ActaHortic.2019.1244.2.
- 24.
王鹏,罗玉峰,黄建峰,高硕,朱桂平,党志刚,等。热带水果芒果的基因组进化与驯化。中国生物医学工程学报。2020;26(1):60。https://doi.org/10.1186/s13059-020-01959-8.
- 25.
魏建勇,刘德宝,刘元元,唐杰,陈友友。的分子克隆、表征和表达MiSOC1:开花基因的同源物constans1过表达抑制因子来自芒果(Mangifera籼L).前沿植物科学2016;7:1758。https://doi.org/10.3389/fpls.2016.01758.
- 26.
于海霞,罗超,范勇,张新军,黄峰,李明,等。分离和表征两种APETALA1-Like芒果的基因(Mangifera籼l .)。Sci Hortic(阿姆斯特丹,荷兰)。2020; 259:108814。
- 27.
范志智,何晓红,范勇,于海霞,王永华,谢晓军,等。隔离和功能表征三个方面MiFTs芒果基因。植物生理学杂志,2020;155:169-76。https://doi.org/10.1016/j.plaphy.2020.07.009.
- 28.
刘勇,罗超,张新军,卢XX,于海霞,谢新军,等。芒果的过度表达MiCO基因延迟了拟南芥的羽化时间。《植物细胞与组织器官》,2020;43(1):329 - 329。https://doi.org/10.1007/s11240-020-01894-3.
- 29.
半泽Y,钱T,布拉德利D.一个单一的氨基酸转化抑制开花激活剂。中国科学院学报(自然科学版),2005;21(2):344 - 344。https://doi.org/10.1073/pnas.0500932102.
- 30.
刘B,渡边S,内山T,孔F,金泽A,夏Z,等。大豆茎生长习性基因dt₁的正交正交向量拟南芥终花.植物科学进展。2010;29(1):379 - 379。https://doi.org/10.1104/pp.109.150607.
- 31.
蒋友友,朱玉明,张林,苏文文,彭俊荣,杨晓华,等。EjTFL1基因促进枇杷生长,抑制花芽分化。植物科学进展2020;11:576。https://doi.org/10.3389/fpls.2020.00576.
- 32.
吴玲,李峰,邓强,张松,刘刚开花位点t/顶花1矮牵牛花的基因家族。中国生物医学工程学报,2019;38(9):982-95。https://doi.org/10.1089/dna.2019.4720.
- 33.
张旭,王超,庞超,魏华,王辉,宋敏,等。陆地棉PEBP家族基因的鉴定与功能分析(陆地棉l .)。PLoS ONE。2016; 11 (8): e0161080。
- 34.
Kotoda N, Iwanami H,高桥S, Abe K.的反义表达式MdTFL1,一个TFL1-like基因缩短了苹果的幼年期。地球科学进展,2006;26(1):344 - 344。https://doi.org/10.21273/JASHS.131.1.74.
- 35.
Vyavahare SN, Krishna B, Joshi SS, Chaudhari RS, Sane PV。芒果的特性开花位点T(英国《金融时报》),顶生花1(TFL1)基因。自然科学进展,2017;29(3):344 - 344。https://doi.org/10.17660/ActaHortic.2017.1183.16.
- 36.
Pillitteri LJ, Lovatt CJ, Walling LL。a的隔离和特征终端花柑桔的同源性及其与幼龄的相关性。植物科学进展。2004;35(3):344 - 344。https://doi.org/10.1104/pp.103.036178.
- 37.
陈勇,蒋鹏,Thammannagowda S,梁辉,王尔德HD。桃子的特性TFL1比较一下英国《金融时报》/TFL1酒糟科的基因家族。中国科学:地球科学,2013;29(1):344 - 344。https://doi.org/10.21273/JASHS.138.1.12.
- 38.
田秀美,田涛,杨永森多叶的而且顶花1蔷薇科蔷薇亚科六种果树的同源。植物生殖学报。2005;17(6):277-87。https://doi.org/10.1007/s00497-004-0239-3.
- 39.
毕志,Tahir AT,黄红,华艳顶生花1/中心状类似橡胶树的基因。中国生物医学工程学报。2019;26(2):612-27。
- 40.
琴田N,和田M。MdTFL1,一个TFL1式在转基因拟南芥中,该基因可延缓植物由营养期向生殖期的过渡。植物科学进展,2005;26(1):1 - 5。https://doi.org/10.1016/j.plantsci.2004.07.024.
- 41.
王毅,皮尤特总理。a的隔离和特征顶花1Prunus serotina Ehrh的同源物。树物理学报,2013;33(8):855-65。https://doi.org/10.1093/treephys/tpt051.
- 42.
高原,高原,吴震,卜旭,范敏,张强终末花1同源染色体CmTFL1c来自菊花的基因。中国生物医学工程学报,2019;39(6):587-601。https://doi.org/10.1007/s11103-019-00838-6.
- 43.
刘勇,高原,袁林,张强顶花1萱草属植物。科学通报。2019;253:154-62。https://doi.org/10.1016/j.scienta.2019.03.036.
- 44.
美穗K, Rie KI, Chiaki OT, Chojiro K, Misa NF, Izuru O,等。水稻tfl1样蛋白通过与14-3-3和FD竞争形成复合体而拮抗水稻ft样蛋白在花序发育中的作用。植物生理学报,2018;39(3):458-68。https://doi.org/10.1093/pcp/pcy021.
- 45.
牛X,关玉霞,陈斯克,李海峰。短柄藻基本螺旋-环-螺旋(bHLH)转录因子的全基因组分析。BMC基因组学。2017;18(1):619。https://doi.org/10.1186/s12864-017-4044-4.
- 46.
罗超,何晓辉,陈辉,胡勇,欧诗杰。4个肌动蛋白基因的克隆及表达分析(MiACT)芒果。中国生物医学工程学报。2013;37(2):339 - 344。https://doi.org/10.1007/s10535-012-0278-9.
- 47.
Livak KJ, Schmittgen TD。利用实时定量PCR技术对相关基因表达数据进行分析——ΔΔCT方法。方法。2001;25(4):402 - 8。
- 48.
刘志刚,刘志刚。拟南芥农杆菌介导转化的一种简化方法。植物学报,1998;16(6):735-43。https://doi.org/10.1046/j.1365-313x.1998.00343.x.
致谢
不适用。
资金
国家自然科学基金(31860541和31660561)、广西科技重大专项(GuiKeAA17204026和GuiKe AA17204097)、亚热带农业生物资源保护与利用国家重点实验室(SKLCUSA-c201901)和广西芒果产业创新团队(nycytxgxcxtd- 07-02)资助。资助者在研究的设计中没有任何作用;数据的收集、分析和解释;并为手稿的撰写提供了资金支持。
作者信息
从属关系
贡献
CL和XHH为这项研究设计并获得了资金。YHW进行实验。HXY, XM, YF, ZYF, XJX和YL参与了实验和数据分析。YHW和CL撰写了手稿。所有作者都已阅读并批准了手稿。
相应的作者
道德声明
伦理批准并同意参与
本项目的所有资料均由广西大学(中国南宁)提供。本研究中对植物进行的实验研究符合机构、国家和国际准则。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1
:补充表1。四种TFL1相互作用蛋白通过酵母二杂交。
附加文件2
:补充表2.本研究中使用的引物。
附加文件4
:图2.pGBKT7-MiTFL1s载体的自活化和毒性,浓度为10−1.采用双酶切法构建MiTFL1-1、MiTFL1-2、MiTFL1-3和MiTFL1-4酵母饵表达载体,转入Y2H金酵母,在SDO/−Trp、SDO/X和SDO/X/A培养基中培养。阳性对照为Y2H Gold (pGBKT7-53),阴性对照为Y2H Gold (pGBKT7-lam)。结果表明,4个pGBKT7-MiTFL1s均无自活化和毒性。
附加文件5
:图3.四种植物的cDNA序列比较MiTFL1阿方索和四稻两个品种的基因。(A)两个栽培品种之间的比较相似性MiTFL1-1基因为99.4%。(B)两个栽培品种之间的比较相似性MiTFL1-2基因为100.0%。(C)两个栽培品种之间的比较相似性MiTFL1-3基因为98.5%。(D)两个栽培品种之间的比较相似性MiTFL1-4基因为98.3%。
附加文件6
:图4.底漆设计现场MiTFL1s基因用于qRT-PCR。四个基因的cDNA序列比较,其中黄色阴影部分代表开始密码子,红色阴影部分代表结束密码子。红色序列表示上游引物序列,蓝色序列表示下游引物序列。黑色部分表示相似性为100%。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
王,YH。, He, XH。,于,HX。et al。芒果中4个MiTFL1基因的过表达延迟了转基因拟南芥的开花时间。BMC植物生物学21日,407(2021)。https://doi.org/10.1186/s12870-021-03199-9
收到了:
接受:
发表:
关键字
- Mangifera籼l
- MiTFL1基因
- 表达式
- 函数
- 蛋白质相互作用