摘要
背景
建立期间的早期种子萌发和功能根系发展是在边际营养土壤条件下促进营养能力的关键属性。藜藜麦野生(藜科)是一种乡村作物,能够生长在边缘地区。高原和沿海低地是南美藜麦种植的两个具有代表性的地区,土壤肥力和土壤气候条件截然不同。
在本研究中,我们假设来自高原和低地的奎奴亚藜的生态型在高原和低地各自的气候带中发展了不同的适应反应,以便在低氮可用性条件下生存。为了了解不同地方品种间氮素竞争力的内在差异,研究了不同地方品种的种子代谢产物和萌发能力。此外,为了阐明建立过程中限制氮素条件下的氮素吸收和同化机制,两种地方品种的种子都在充足的硝酸盐(HN)和低硝酸盐(LN)条件下生长。研究了不同处理下植物根系的光合性能、蛋白质储存、根系形态参数、氮同化酶活性和表达以及硝酸盐转运体的表达。
结果
Socaire landrace种子中游离氮相关代谢产物含量较高,种子发芽率较Faro landrace快。两种生态型幼苗在HN供应下表现出相似的生理性能,但在LN供应下差异较大。在LN, Socaire植物的根生物量增加(包括更高的侧根数量和总长度),这是一种硝酸盐转运体(aNPF6.3- 状同源物)属于低亲和力运输系统(LAT),以及硝酸盐转运蛋白的上调(anrt2.1.与Faro相比,属于高亲和硝酸盐转运系统(HATS)。与低地藜麦植物相比,这些反应可能与高原植物叶片中存储的更高数量的蛋白质有关,并与提高光化学性能有关。
结论
Faro植物上的SOCAIRE的这些差异特征可能涉及适应在Altiplano的残酷不利气候条件下增强硝酸盐摄取。
背景
氮是预测植物生理性能和产量最重要的营养物质[1].氮(N)是许多大分子的组成部分,包括核酸和蛋白质。植物氮化合物还包括鸟氨酸循环和莽草酸途径的成分[2].
种子中储存的氮具有重要的生态作用,因为它涉及到种子的捕食、保护和萌发[3.,4].此外,有人建议储存在种子中的代谢物代表了定义的代谢状态,并且它们可能在基因表达上发挥调节作用,限定休眠或/和成熟程度的水平[5,6].此外,种子中的代谢产物在营养状况不佳的情况下在物种的早期表现中发挥着重要作用[7,8].
发芽后,幼苗从土壤中吸收和同化氮的能力取决于多种因素,包括有效态氮、其他养分的存在、土壤特性、pH值、温度、非生物因素、生物相互作用、竞争、根系结构等。在大多数植物中,只有一小部分的土壤氮被植物根系吸收和吸收。植物可以在根系中捕获各种无机形态的氮,但硝酸盐(NO3.−)是好氧土壤中植物吸收和同化的主要氮源[9].硝酸还原酶(NR)催化硝酸同化中的第一个反应,将硝酸还原为亚硝酸盐。亚硝酸盐还原成铵是由亚硝酸盐还原酶(NiR)催化的。然后,在GS- gogat循环中,谷氨酰胺合成酶(GS)将铵结合到谷氨酰胺中,将植物中的无机氮转化为有机氮[10.].
植物积极占用3.−通过质子/硝酸盐耦合机制,根系特定转运体的活性[11.].不3.−摄取转运体分为两类:低亲和转运系统(LATS)和高亲和转运系统(HATS) [12.].在拟南芥中观察到,LATS主要参与高硝酸盐浓度下的运输,而HATS在低硝酸盐条件下(< 1 mM)具有活性[13.,14.].
藜藜麦(藜科)种子蛋白质含量高,氨基酸组成完整。此外,由于藜麦具有广泛的适应性和在不利环境下生长的能力,联合国粮食及农业组织已宣布藜麦在粮食可持续性方面具有全球重要性[15.].
奎奴亚藜驯化了大约在3000的公元前300.,可能是秘鲁和玻利维亚的Altiplano的高强韧[16.].奎奴亚藜被印加帝国沿着整个安第斯山脉,从哥伦比亚到智利南部[17.].今天,世界各地的农民种植了6000多个藜麦地方品种。
高原和低地是具有代表性的地理区域,在那里藜麦植物被提交到智利不同的环境条件。高原位于智利北部的阿塔卡马沙漠中。生长在高原上的藜麦植物暴露在被称为“冷沙漠”的极端紧张气候条件下。这些条件包括高通量太阳辐射、非常强烈的温度日变化、有限的年降雨量(150-300毫米/年)和盐渍土壤[18.].另一方面,奎奴亚藜低地生态型(来自智利中部和南部)必须应对酸性和贫瘠的土壤、生长期间升高的温度和每年500到1500毫米的降雨量[19.].这两个地方及其土壤气候条件都代表了广泛的压力条件(减少营养吸收和同化的可能性),藜麦必须在智利应付。
我们假设,来自Altiplano和低地的藜麦在不同气候区氮有效度低的条件下发展了不同的适应反应。在这方面,我们想阐明不同地方的藜麦种子是否储存了不同水平的N代谢物,从而决定了不同的萌发速度和对营养物质的竞争。因此,我们确定了种子的n相关代谢物组成和它们的发芽能力。此外,在充足的硝酸盐(HN)和低硝酸盐(LN)条件下,两种地方品种幼苗生长20天,并测定了一些参数,以阐明各地方品种在限制氮条件下的氮素吸收和同化机制。这些参数包括形态测量、光合性能、蛋白质储存、氮同化酶(NR、GS)活性和基因表达。对奎奴亚藜LATS和HATS同源基因进行系统发育分析,并对所选LATS基因(ANPF6.3-like homologue)和一个被选择的HATS基因(anrt2.1.-like homologue)也被执行。我们发现了地方品种间氮素吸收表现差异的证据。
结果
种子萌发、含氮量及代谢谱分析
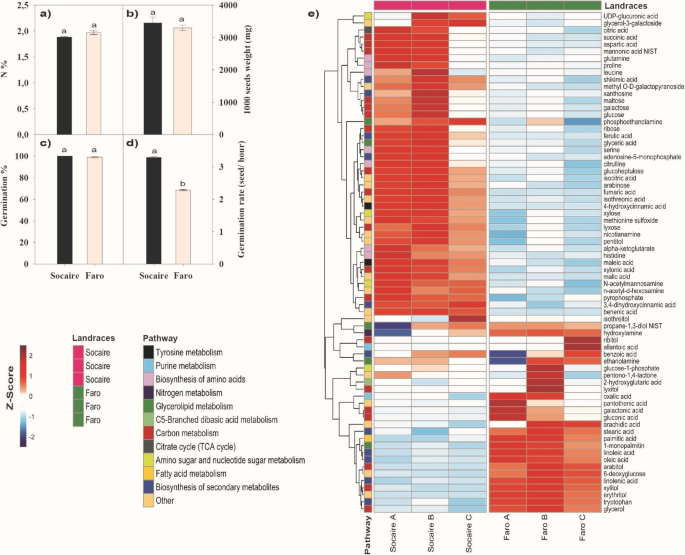
Socaire和Faro的种子重量和N含量相似。1A和B)。尽管在48小时内,但在吸收48小时后,也达到了100%的萌芽(图。1c). Socaire种子的发芽率显著高于Faro(3.5对2.3种子/h;无花果。1d). Socaire种子在16 h时萌发时间较Faro种子早,而Faro种子在24 h时萌发时间较长(增文。无花果。S1).
藜麦两个地方品种(Socaire和Faro)的种子相关参数。(一个)种子n内容,(b) 1000粒种子重量(c)萌发的百分比和d)测定各地方品种种子的发芽率。条形图表示平均值±SE (n= 5)。不同的字母代表了体重存在和治疗之间的显着差异P <采用双向方差分析0.05。e)利用KEGG途径信息绘制选定代谢产物的热图。只显示了重复之间方差低的代谢物。代谢物归一化的丰度用z分数进行标度,并用颜色标度表示。landrace后的字母(A,B,C)显示来自三种不同植物的不同样本(50毫克)(n= 3)。所有代谢物丰富的原始完整数据集都显示在提供中。表格S1
比较Socaire和Faro地方品种的种子代谢产物。利用非靶向的全球代谢组学平台,结合气相色谱-质谱(GC - MS)和超高效液相色谱-串联质谱(UPLC/ MS/ MS)分析两个地方种的种子,共确定了161个命名的代谢物。结果表明,不同地方品种间的代谢物含量存在显著差异,反映了种子来源和/或遗传背景的差异。1e)。
确认的161种代谢产物包括大部分初级代谢途径和一些次级代谢途径。将代谢物分为糖、糖醇、脂肪酸、三羧酸循环、游离氨基酸、嘌呤和嘧啶代谢、鸟氨酸循环和草酸途径八大代谢途径(图)。1,2和3.e)。
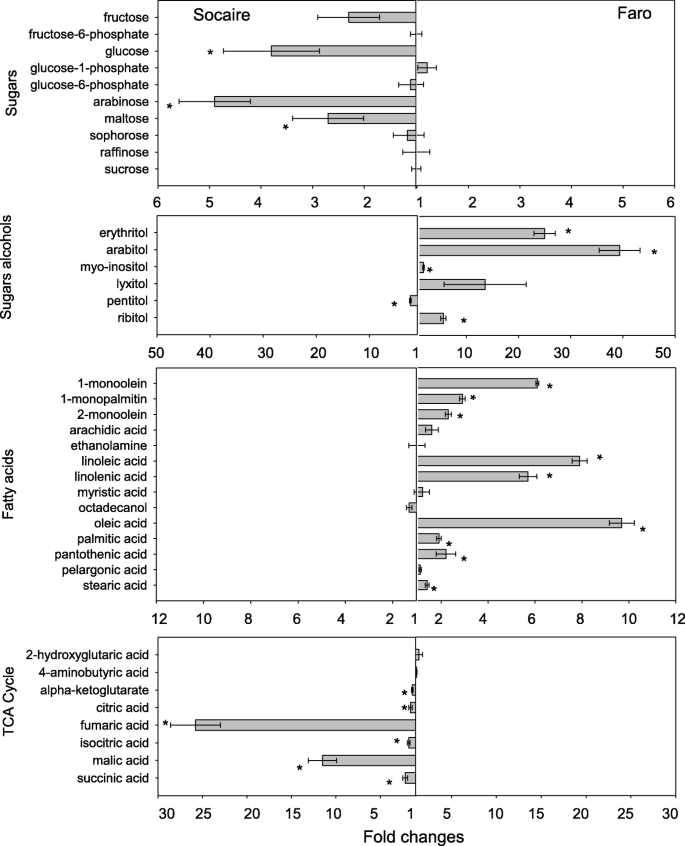
当比较两个地方品种时,发现了相似水平的最显著的水溶性碳水化合物和糖酵解中间体,包括蔗糖,棉子糖,葡萄糖-6-磷酸,葡萄糖-1-磷酸果糖-6-磷酸,3-磷酸甘油醛,磷酸烯醇式丙酮酸和丙酮酸。2和3.).然而,与Faro种子相比,Socaire种子含有更多的葡萄糖、果糖和其他更复杂的糖(如赖氨酸、阿拉伯糖、半乳糖和麦芽糖)。
Faro种子含有较高的糖酸,糖醇和奈斯糖,包括萘酸(糖酸),mio-initolol,核糖醇,甲醇醇,阿拉伯醇和赤藓糖醇。此外,FARO种子呈现出更高水平的脂肪酸(包括硬脂酸,肉肝酸,泛酸,棕榈酸,油酸,十八烷醇,肉豆蔻酸,亚麻酸,亚油酸,花生酸,1-单烯醇,2-单烯醇和与Socaire种子相比(图。2).对于参与三羧酸循环的代谢物,Socaire种子检测到的所有有机酸(柠檬酸、反丁烯二酸、异柠檬酸、马来酸、苹果酸和α -酮戊二酸)的含量更高(图。2).
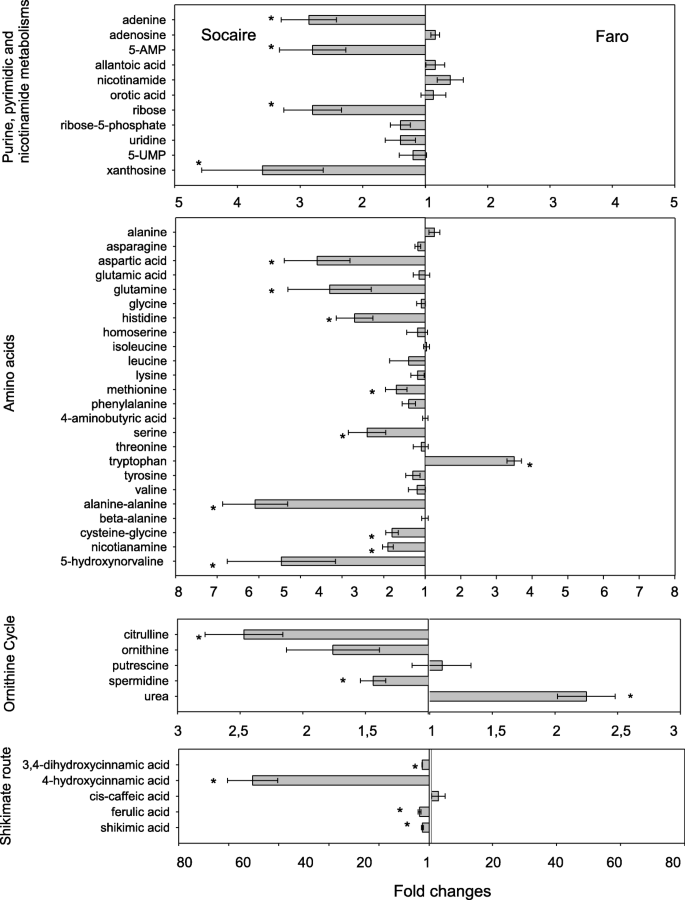
与Faro种子相比,Socaire种子也有更高水平的游离n相关代谢物(与大分子无关)。3.).Socaire种子中与嘌呤-和嘧啶途径相关的代谢产物含量较高(包括:黄嘌呤、腺嘌呤、腺苷-5-磷酸和核糖- 5p;无花果。3.).另外,在Socaire种子中发现了大量的氨基酸(天冬氨酸、谷氨酰胺、组氨酸、脯氨酸和丝氨酸),包括非蛋白质氨基酸(羟降缬氨酸和烟胺)和二肽(半胱氨酸-甘氨酸和丙氨酸-丙氨酸)。唯一的例外是色氨酸,它在Faro种子中的含量高于soaire种子。
关于鸟氨酸途径,SOCAIRE种子呈现了较高量的鸟氨酸,亚柠檬酸和多胺硫胺胺(图。3.).在莽草酸途径上,Socaire种子中莽草酸、对cumaric酸(4-羟基肉桂酸)、咖啡酸(3,4-二羟基肉桂酸)和阿魏酸含量高于Faro种子。
硝态氮供应对sockaire和Faro幼苗生长及生理参数的影响
除了对两个地方品种的种子进行研究外,我们还对不同NO下的植株表现进行了评价3.−供应条件。确定足够的和限制的NO3.−在不同氮浓度下,我们研究了两种植物生态型的生长。据观察,没有3.−供给量对植物生长有显著影响。无花果。S2一种)。射击鲜体重和叶面积增加,没有增加3.−供应,达到最大值时,增长存在20 嗯不3.−并在100毫米时下降(增刊。无花果。S2). 叶面积和地上部重量显著降低,在0~5之间 嗯不3.−.植物灌溉0.5毫米不3.−与20 mM NO相比,2个地方品种的地上部重和叶面积减少了80%3.−.20mm和0.5 mM否3.−后续试验分别选择高氮(HN)和低氮(LN)供给处理。
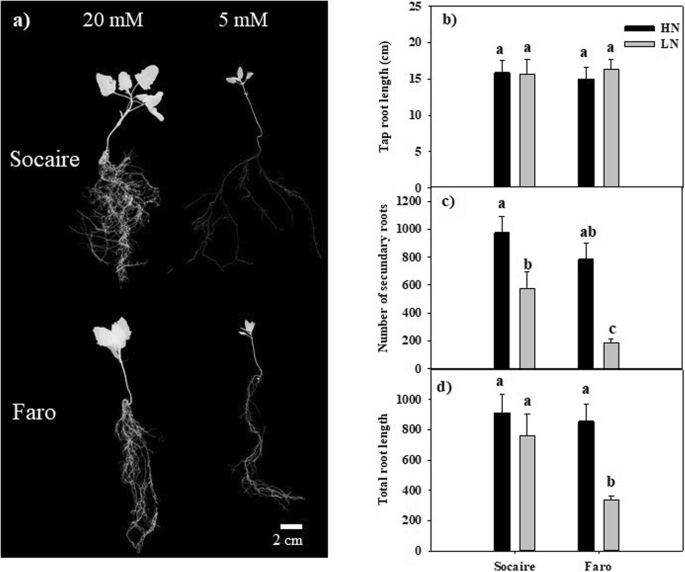
两种地方品种的幼苗在HN或LN条件下生长24天。虽然在HN和LN供应的情况下,两种奎奴亚藜地方品种的根长没有显著差异(图。4),SOCAIRE植物中的二次根和总根长度的数量显着高于LN电源的FARO植物(图。4c和d)。在LN供应条件下,Socaire植物的根冠比显著高于Faro植物(表1)1).
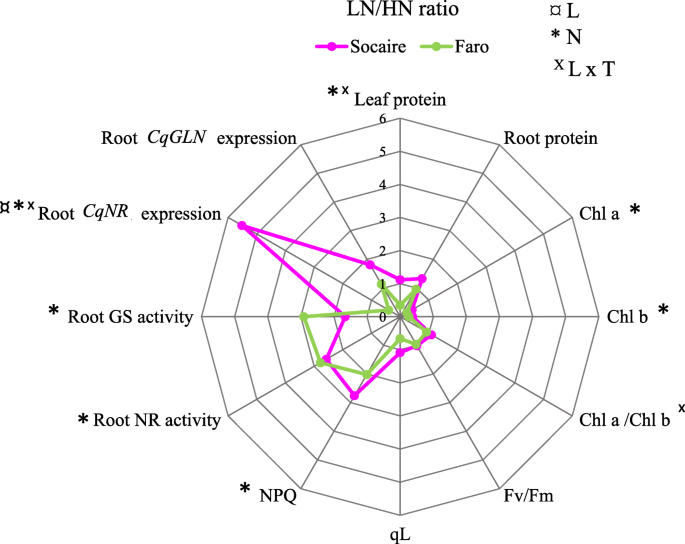
比较叶片和根蛋白浓度、叶绿素含量和荧光、硝酸还原酶(NR)和谷氨酰胺合成酶(GS)酶活性及其表达水平(CqNR公司和CqGLN)在HN和LN供应的藜麦地方品种中均有测定。在雷达图中,这些参数的变化计算为两个地方低氮供应(LN)条件下的每个值与HN条件下的值(LN vs HN)的比值。5).
Socaire和Faro对LN反应的生理参数变化。雷达图显示了叶片和根的蛋白质、叶绿素(Chl一个和b和chl.一个/b叶绿素荧光参数Fv/Fm (PSII最大效率)、NPQ(非光化学猝灭)和qL(还原态QA的比例)、蛋白质、NR和GS酶活性及各自的基因表达(CqNR公司和CqGLN)在两个地方品种的藜麦。以LN水平(0.5 mM NO3.−)至HN水平(20mm NO . 25)3.−).值为平均值(n= 5)。SOCAIRE比变化在粉红色和FARO中表示为绿色。符号¤*,X采用Fisher LSD检验,表明地方品种间、施氮量间存在显著差异,两因素间存在互作效应;P <0.05)。用于统计分析的数据见附注。表格S2
在LN供应下,Faro植物叶片蛋白质浓度显著下降,而Socaire植物则没有(图5)。5).施氮对两种藜麦地方品种的根系蛋白质浓度均无显著影响(图2。5).
两种奎奴亚藜地方品种的叶绿素含量在LN供应下均下降了约70%。5);因此,背影一个/ chl.b在施氮处理下,比值保持不变。不同地方品种间的反应无差异。
叶绿素荧光参数一个被定量化以了解N供应对光合仪器的影响。FV / FM是植物中应力的指标,它代表了光系统II的最大量子效率。在比较体型时,发现了FV / FM值的显着差异,硝酸盐供应对该参数没有显着影响(图。5).
光化学猝灭(qL)反映了光化学过程中能量消耗的比例,而非光化学猝灭(NPQ)是光保护机制的指标,其增强与吸收过量光能的热耗散有关。我们发现,在LN条件下,两个地方品种都能以热量的形式耗散多余的能量,但在Faro植物中qL值下降了30%,而在Socaire植物中没有明显的下降(图1)。5).
施氮对Socaire和Faro根中NR和GS活性均有显著影响。LN条件下两种酶的活性均显著高于HN条件下(图1)。5).这种反应伴随着上调(约6倍)CqNR公司在Socaire植物中,但在Faro植物中没有,它们的转录本减少到一半。以同样的方式,只有soaire在CqGLN1型在Faro植物中未观察到。
藜麦硝酸盐转运体同源物的系统发育分析及基因表达
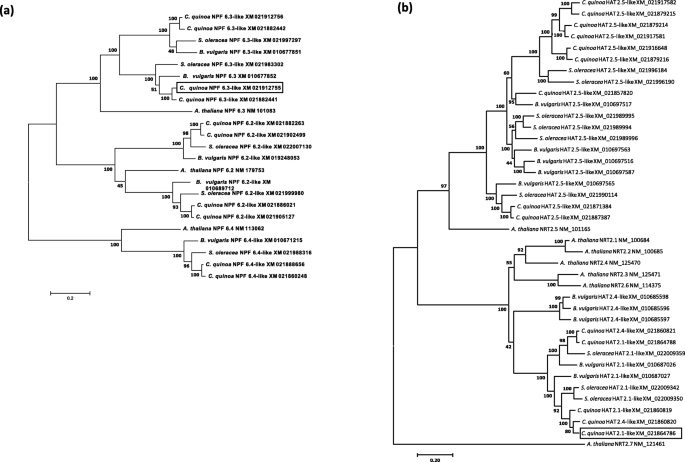
一些低亲和硝酸盐转运体的系统发育分析(nrt1 / ptr家族, 或者净现值)和所有高亲和硝酸盐转运体(nrt2.)的同源物c .藜麦进行了(图。6).在这些分析中,硝酸盐转运蛋白同源物拟南芥和其他两种藜科植物(甜菜属和菠菜oleracea)也包括在内。
低亲和力硝酸盐转运蛋白的分子系统发育分析c .藜麦.硝酸转运体同源物核苷酸编码序列的系统发育最优树c .藜麦,其他两种脑内核糖科家族(美国oleracea和b .寻常的),A.拟南芥.在Tamura-Nei模型的基础上,采用极大似然法进行进化历史推断。在低亲和转运蛋白(LAT)同源物(一个),显示了具有最高日志似然的树( - 21,210.48)。在高亲和力转运蛋白(帽)的系统发育分析中(b),显示了具有最高日志似然的树( - 29,578.42)。在分支机构旁边显示相关的分类卡的树木的百分比。通过将邻接和BIONJ算法应用于使用最大复合似然(MCL)方法的成对距离的矩阵自动获得启发式搜索的初始树,然后选择具有卓越的日志似然值的拓扑。离散伽马分布用于模拟位点之间的进化率差异。树被绘制到刻度,分支长度在每个站点的替换的数量中测量。分析涉及23(一个)及40 (b)核苷酸序列。淘汰了少于95%的站点覆盖率的所有位置。指示每个序列的登录号。本研究中的基因表达以基因表达为特征的基因同源物包含在盒子中。进化分析在Mega7进行
关于LATS基因,几个同系物藜麦,甘蓝和寻常芽孢杆菌集群与A. thaliana NPF 6.3基因(图。6其他)。c .藜麦(但不美国oleracea也不b .寻常的)同系物聚集NPF 6.2和NPF 6.4基因A.拟南芥,形成各自的支链(图。5一种)。在这些集群中的每一个中,c .藜麦具有比其他物种更多的同源物。
关于高亲和转运体(HATS),几个同源的c .藜麦,美国oleracea和b .寻常的聚集在一起A. Thaliana NRT 2.5基因(图。6b). Chenopodioideae亚科的三个种的几个其他同系物与一个包含A. Thaliana NRT 2.1,NRT 2.2,NRT 2.3,NRT 2.4和NRT 2.6.基因。没有同系物A. Thaliana NRT 2.7发现基因(图。6b)。
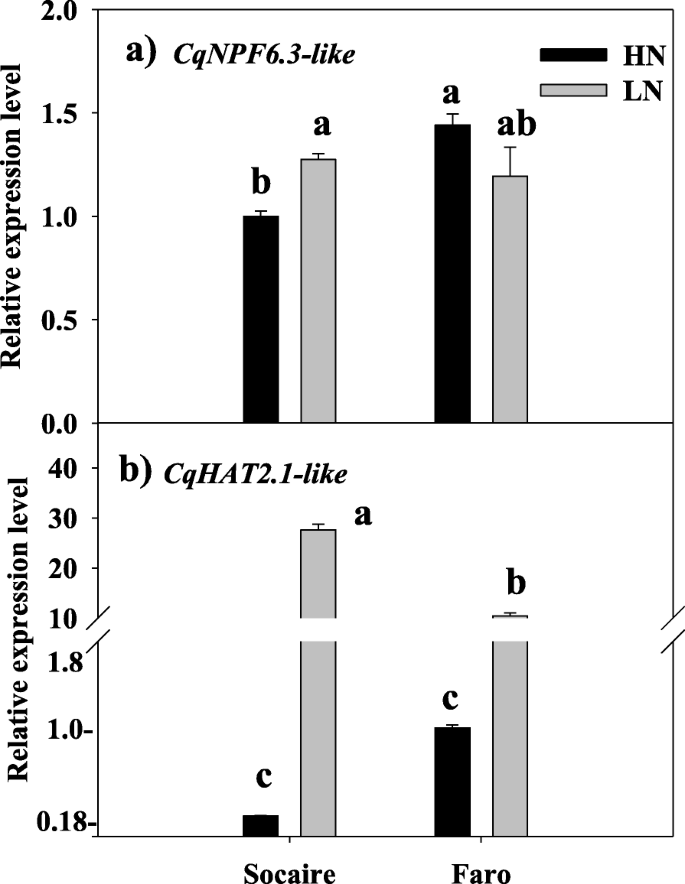
为了进行基因表达研究c .藜麦拉特和帽子同源物,转录水平NPF 6.3就像(Acc)。不。XM_02191275)和帽子2.1-like(ACC。No. XM_021864786)使用基因特异性引物进行实时PCR分析基因同源物。
在Socaire和Faro植物根中检测了这两个硝酸盐转运蛋白基因的转录水平。研究发现,硝酸盐供给对这些低亲和和高亲和硝酸盐转运体在藜麦中的表达有显著影响。显著上调NPF 6.3就像在SOCAIRE中观察到同源物,但在LN电源的情况下,不在FALO植物中观察(图。7a) 是的。此外,在mRNA水平的显著增加帽子2.1-like与在HN电源下观察到的转录物水平相比,在LN供应的Socaire和Faro植物中观察到同源物(图。7b)。
讨论
地方品种种子组成
对比度环境和遗传背景对不同藜麦地区种子化合物的影响主要来自人类营养观点[20.].尽管如此,我们的代谢种子特性试图揭示两个地方品种从种子阶段的生理性能的对比。
通常,在生态学研究中观察到,种子总氮浓度是释放休眠的一个重要因素[5,6,8].我们的结果表明,适应不同气候条件(高原和低地)和当地管理程序的植物产生的种子具有相似的重量和氮含量(图。1),但表现出不同的发芽率(图。1D和图。S1).这些结果表明,N含量本身并不能反映N代谢物在萌发过程中的复杂性、分布、利用率和命运的巨大差异[8].这表明,较高的游离代谢物含量有利于吸水率,并在萌发早期作为能量的快速燃料[5,6].这与我们的结果是一致的,在Socaire地方品种中,自由代谢物储存较高的地方品种也表现出较快的萌发(Figs。1,2和3.).我们的代谢组学分析强调了来自高原地区和低地地区的地方品种之间巨大的代谢物差异。根据地方品种在种子中的含量高低,将地方品种分为两个相对的组(图1)。1e).与Chen等人的研究结果一致。20.],根据其生物活性植物化学物质,他将藜麦品种分为两组。
有趣的是,Socaire种子有更高水平的碳水化合物和更高的热量糖,如葡萄糖和果糖,可以支持萌发的能量成本作为碳骨架在三羧酸循环(苹果酸,异柠檬酸,琥珀酸,富马酸)[21.].另一方面,Faro种子储存的酒精糖含量较高,被认为是低热量(0.4千卡/克)的"甜味剂",如阿拉伯糖醇和赤糖醇。此外,Faro种子中油酸、亚麻酸和亚油酸(脂肪酸代谢物)的含量高于Socaire种子。对油籽植物的几项研究表明,游离脂肪酸和甘油通过向糖的转化,支持三羧酸循环,改善种子萌发和幼苗建立过程,从而提高种子的氧化稳定性[22.].
另一个值得注意的事实是,soaire种子中n相关代谢物的含量高于Faro种子。在吸胀激活种子代谢的过程中,嘌呤回收途径(而不是“从头”合成)被认为是嘌呤核苷酸合成的一条途径,因为它们具有良好的能量反应和较低的ATP成本[23.].与嘌呤途径相关的代谢物包括AMP、UMP、黄嘌呤和天冬氨酸(以及其他),在Socaire种子中比在Faro种子中含量更高。3.).这表明,Socaire中嘌呤相关代谢产物、核糖5-P和TCA中间体含量较高,可能是种子萌发后与能量生产和核酸生物合成相关的主要途径相关的不同酶反应的原因[23.,24.].
芳香族氨基酸色氨酸、苯丙氨酸和酪氨酸是一系列次级代谢产物的前体,对植物生长以及人体营养和健康都很重要。Socaire种子中出现较高水平的草酸、咖啡酸(3,4-二羟基肉桂酸)、对cumaric酸(4-羟基肉桂酸)和阿魏酸,表明该地方种的次级代谢水平高于Faro种子。据报道,这些代谢物的变化苋菜种子可能是由于种源不同的气候条件,也可能是由于它们的遗传背景[25.].有趣的是,色氨酸是唯一一种在Faro种子中含量高于Socaire种子的氨基酸,与我们的数据一致,这种氨基酸是小麦发芽的缓凝剂[26.].
其他重要的氨基酸是谷氨酰胺和脯氨酸(图。3.).两个氨基酸都参与鸟氨酸循环和多胺途径。此外,Socaire的瓜氨酸和亚硫酸盐水平比在法摩种子中高2倍。所有这些高氮含量化合物与藜扣的干旱和盐度耐受性有关[27.,28.].
当然,干燥种子中的这些差异水平的代谢物不一定意味着对萌发的直接影响,但许多作品表明种子中一些代谢物的水平和比例影响了后期发芽所需的过程[29.].
在低NO条件下,幼苗生长性能存在差异3.−供应
为了继续研究生长发育过程,我们有兴趣了解这些藜麦植物在充足(HN)和低NO条件下的早期表现3.−(LN)供应条件。有趣的是,当两个地形在HN条件下种植时,它们在所研究的参数中呈现了类似的反应。然而,在LN供应下,揭示了他们生理性能的差异。
两种地方品种在两种供氮条件下萌发后24天的总生物量相似(表21)但是射击:LN供应的地位之间的根源比例显着差异,表明SOCAIRE在这些条件下的root植物中的资源比例较高。众所周知,根本和特异性根尖是植物根吸收水和营养素的重要网站[1].侧根在营养丰富的地区优先增殖,在氮素供应不足时受到抑制[30.].我们的结果显示,与其他物种类似,LN供应与HN条件相比,能导致侧根数量减少c .藜麦.然而,在LN供应下,Socaire幼苗比Faro幼苗表现出更高的侧根数量和总根长。4).考虑到Socaire的叶片蛋白质浓度高于Faro幼苗(图。5),我们认为保持较高的侧根数量可能是Socaire生态型高氮积累的关键因素。
众所周知,绝大多数N主要储存在叶片中的叶片和其他蛋白质中的叶片中的叶片和其他植物的光学络合物[1].在LN条件下,两种地方品种的叶绿素含量均呈下降趋势。5)可以是光合仪器调整的结果,以减少由植物捕获的能量以避免光电模压。毒叶绿素也支持藜麦的光合仪器调整能力一个分析表明,在HN和LN条件下,Fv/Fm水平相似,表明这些植物没有遭受PSII的损害。此外,由于LN的光化学(qL)和非光化学猝灭(NPQ)在HN条件下的变化,我们认为这两个地方在利用光的过程中经历了动态的调节,改变了光化学过程中消耗的能量和/或以热的形式耗散到环境中的能量。这些地上测量参数在地方品种之间的主要差异是在LN条件下Socaire植物保持qL值的能力。考虑到光合作用是解释奎奴亚藜qL值的主要过程[28.],这可能是地方品种在LN条件下叶片蛋白质含量不同的基础。
众所周知,LN供应(和其他应激条件)会诱导次生代谢物的产生,触发蛋白质降解并增加光呼吸[31.].所有这些过程都会引起细胞内NH的升高4+浓度,它是有毒的,在GS酶催化的反应中必须并入氨基酸。因此,根系GS活性的增加可能与整个植株的细胞稳态维持有关。soaire中GS活性的变化与上调CqGLN1型; 然而,在Faro植物中没有观察到这种关系。这表明转录和翻译后修饰可能参与了GS在不同植物中亲和力和活性的提高[31.,32.].
硝酸盐还原酶(NR)是催化抑制反应的酶在减少NO3.−.众所周知,NR活性取决于没有3.−供应;因此,在LN条件下该酶的活性增加是一个意外的观察(图。5).对这一结果的一个合理解释是,根系中NR的调节方式与地上部不同,因此根系中NR可以在较小的NO下被激活3.−浓度(33.].这可能是Socaire植物的解释,但不在Faro植物中,NR转录水平下降了一半(桌子)S2).需要进一步的研究,以了解本物种中根N生理学重点酶的生化和分子调控。
没有的系统发育和基因表达研究3.−转运蛋白在藜麦
四个转运蛋白基因家族参与植物硝酸盐吸收。它们包括NPF(硝酸盐转运蛋白1/肽转运蛋白家族)转运蛋白(低亲和力硝酸盐转运蛋白系统或LATS)和NRT2(硝酸盐转运蛋白2)家族(高亲和力硝酸盐转运蛋白系统或HATS)[12.].通过系统发育分析,我们发现了藜麦和藜亚科(chenopodioide亚科)的其他两种植物的不同LATS和HATS基因同源物。菠菜oleracea和甜菜属;无花果。6).
NPF家族包含了大量的基因(在基因组中多达53个成员)A.拟南芥). 拟南芥NPF6.3 (NTR1.1 / CHL1)是第一种硝酸盐转运蛋白。该基因在若干根组织中表达,其中该转运物从土壤中进行硝酸盐摄取[13.].NPF6.3 (NTR1.1 / CHL1)最初被鉴定为低亲和硝酸盐转运体,后来发现该转运体可以感知外界硝酸盐浓度并改变其转运活性。因此,该蛋白被认为是具有n -感应功能的受体[14.].NPF6.3能在LN条件下切换到高亲和活性,并增加NPF6.3mRNA转录本存在低水平的NO3.−被观测到 [11.,13.].事实上,淘汰NPF6.3突变体在高亲和NO3.−摄取[34.].我们确定了四种同源物NPF6.3在藜麦(图。6一种)。这些同源物的存在可能是由基因重复事件产生的,并表明该基因毒素中该基因的成员对根部N的微调调节。我们研究了其中一个的表达NPF6.3同源物(NPF6.3-like, Acc。不。XM_021912755)在Socaire和Faro Landraces的根部,提交给HN或LN电源(图。7一种)。在HN条件下,基因表达NPF6.3-like在Faro植物中明显高于Socaire植物,表明该基因在低亲和NO3.−NO的活性和/或效率较高3.−在法郎植物的摄取。然而,该基因在LN供应的Socaire植物中显着上调,表明高亲和力没有3.−该基因在该地方种的转运功能(图。7一种)。在拟南芥中,LN条件下的Thr残基的磷酸化促进NPF6.3高亲和力没有3.−运输 [13.].有趣的是,所有的四个NPF6.3在奎奴亚藜中鉴定的同源序列保留了相应的苏氨酸残基。有趣的是,我们注意到NPF6.3菠菜中的同源物(图。6a)主要在根中表达,它们在HN条件下上调,并且在比较低N和高N植物品种时,两种同源物呈现不同的表达模式[35.]. 因此,必须进行功能特性研究,以阐明这些转运蛋白同系物在细胞中的功能作用c .藜麦在Chenopodioideae亚家族的其他植物中。
关于帽子,七nrt2.基因被鉴定和鉴定拟南芥,人们都知道nrt2.家族在限制氮条件下从土壤中获取硝酸盐的作用和重要作用[14.].观察到构成基因nrt2.5.的A.拟南芥在硝酸盐流入中起作用[36.].值得注意的是,藜科植物有几个(多达9,在案例c .藜麦)与拟南芥的硝酸盐转运蛋白一起聚集的同源物(图。6B),表明这些基因在根硝酸盐吸收中的重要作用c .藜麦和藜亚科的其他植物。这些同源物可能是基因复制事件的结果。
通过另一种方式,答:芥NRT2.1是最习惯的运输车nrt2.在大多数条件下,它是根系吸收硝酸盐的主要组分。该基因显示出非常严格的组织特异性转录谱,仅限于根组织的外层,并且该基因的敲除突变导致高达75%的根硝酸盐内流损失[36.,37.].chenopodioideae亚家族的植物没有近似正直nrt2.1.,但它们有几个同源物,聚集在一起的一个分支,包含在根表达的几个诱导HATSA.拟南芥(即,nrt2.1.,nrt2.2.和nrt2.4)及其他两个同源物(nrt2.3.和nrt2.6)其在植物中的作用鲜为人知[12.].我们已经研究了这些HATS同系物(高亲和力转运蛋白2.1样, Acc。不。(XM_021864786), sosocaire和Faro植物的根提交给HN或LN供应(图。7b).该基因在两个藜麦地方品种的LN供应中都显著诱导。这一结果符合其同系物的表达模式A.拟南芥由于N饥饿而表现出短暂的上调[12.].在奎奴亚藜的情况下,Socaire的上调比Faro工厂显着高,这表明在Socaire植物中的LN供应中的硝酸盐摄取的推定更高的活动和/或效率。有趣的是,据报道,表达了一个美国oleracea NRT2.1例如同系物(Acc)。不。XM_022009342)在低硝态氮含量品种的根部比在高硝态氮品种的根部高3.−内容多样,暗示着在3.−吸收;但是,在LN供应条件下没有观察到基因上调[35.],表明该同源物在藜亚科不同植物中的作用和调控可能是不同的。据报道答:芥NRT2.1可参与侧根发育[36.];一定,我们观察到,Socaire植物在LN电源下显示比Faro工厂更高的横向根,更高的总根长度(图。4c, d)。
没有液泡膜特异性的同源物nrt2.7基因A.拟南芥属藜科。该基因对水稻种子硝酸盐积累具有重要作用A.拟南芥[12.,38].未来的研究必须阐明这些chenopodioideae亚家族的这些植物是否具有硝酸盐转运蛋白同源物,种子中具有特异性功能。
必须进行额外的研究,以阐明毒素和帽子同源物的表达模式,底物特异性和功能作用。这些研究将允许表征这些基因对硝酸盐积累的贡献,并确定哪些同源物更为重要,以便应对不育的土壤。
结论
综上所述,Socaire和Faro地方品种有不同的应对低营养获取的策略。Socaire的种子能够比Faro的发芽更快,这可能与种子中不同的代谢物组成有关。不3.−治疗影响了相关基因的表达,调节了根系形态和鸟瞰在生态型中的差异。考虑到不同地方的土壤质量和N来源的变化[39,对NO的特定适应3.−不同生态类型之间的吸收可能会影响我们的结果。因此,我们的工作开启了未来的新问题:不同的氮来源如何影响藜麦这种长期广泛扩张的物种对它们的吸收和同化?
我们的发现很重要,因为对不同敏感性的不同藜麦生物型生殖器探索是重要的3.−限制。这些有价值性状的鉴定可为耐氮种质的筛选和在贫瘠土壤中的推广提供参考。
方法
种子集合
两个一起的藜藜麦在这项工作中使用了:来自Altiplano(圣佩德罗·奥卡卡,阿塔卡马沙漠,智利)和智利中部的法院的Socaire。私人领域收集了SOCAIRE种子(23°34°67°54'W,3500 m..s.L.)。Socaire社区和Ceaza根据与项目FIA Pyt-2014-0280有关的协议,根据研究Socaire藜麦种质。
法罗种子是在Vicuña市(Inia Intihuasi Banco Base station (La Pepa, 30°2'S 70°42'W, 616 m.a.s.l.)采集的,并获得了研究所(http://163.247.128.32/gringlobal/search.aspx.).Pedro Leon (Banco Base Inia Intihuasi)对这些植物标本进行了正式鉴定。值得注意的是c .藜麦没有濒危物种,并且根据智利落下的实践(Servicio Agricola Y Ganadero)的实践,实验研究。
两个地方品种的种子在夏季(2月)在每个地点收集。全氮和速效氮分别为0.09%和46.00% 土壤中mg/kg,0.12%和42% 维库尼亚土壤中的mg/kg。Garcia等人和Montes等人对两地农业生态条件的进一步描述[40,41].收集的种子在室温干燥条件下保存5个月,直至实验进行。
种子特性和代谢物分析
从三种随机选择的植物中分别采集种子用于不同的实验(表征、代谢组学和萌发)。在重量测量方面,Socaire和Faro藜麦谷粒在80°C的烤箱中过夜干燥,并测量每个地方品种的1000粒种子重量。采用凯氏定氮法(Kjeldahl等人的方法)定量100毫克的磨粒N含量[42].
为了进行代谢组学分析,将种子冷冻,磨成粉末,冻干,为每个样品生成50 mg的样品。根据Botanga等人所述的方法,在西海岸代谢组学中心(UC Davis, Davis, CA, USA)进行了代谢谱分析[43].根据Fiehn等人的均质化,提取和衍生化。[44].色谱分析按照Botanga等的方案进行[43].利用Fiehnlib库鉴定代谢物[45].使用在开源Binbase Metabolome数据库中实现的算法进一步处理数据[46].
使用MetaboAnalyst 3.0 webserver对原始数据进行标准化、过滤和分析[47].使用Pheatmap R包进行热线图(为了可视化代谢物配置文件)。数据由Z-SScore缩放,以捕获具有类似行为的代谢物。使用默认Pheatmap Ward方法进行代谢物的聚类。代谢物途径信息是从Kegg API获得的(https://www.kegg.jp/kegg/rest/keggapi.html),使用Shell脚本。
发芽
每次试验选用两个地方品种3个不同个体的50粒种子。种子从c .藜麦地方品种用滤纸放置在培养皿上;根据需要添加无菌蒸馏水,以确保足够的水分用于发芽。种子培养48小时 24小时 °C在黑暗中。每4天记录一次发芽苗数 h代表48 H这个实验是一式三份进行的。当胚根从种子中长出来时,就认为萌发是完全的。在48小时内记录了每个长白猪种子的发芽率(发芽种子数/h) 小时[48].发芽率,定义为[发芽种子的数量/总种子的数量]×100 [49]在种子吸胀后每4小时至48小时记录一次。
确定足够和低硝酸盐供应
为了确定足够的和限制的NO3.−为Socaire和Faro植物地方品种提供浓度的种子,萌发后胚根长度相似的种子被移植到700 mL的花盆中,花盆中装有沙子:珍珠岩(1:1)。幼苗在生长室内条件下(21°C, 16 h光/8 h暗光周期,57%的相对湿度)生长20天。用含有Murashige和Skoog所述宏量和微量营养素的MS 407营养培养基浇灌植物[50,除了硝酸盐、钾和磷酸盐。为了弥补这些营养物质的不足,营养液中添加了85 mg/L KH2宝4, 950 mg/L KCl和不同浓度的NO3.−作为kno.3..6个氮处理(0.0、0.5、2.0、5.0、20和100 mM NO3.−),以确定这两种基因型藜麦的充足和有限的硝酸盐供应条件。各施氮处理10盆,每盆3株。
在试验期间用田间容量的不同溶液灌溉幼苗。为了补偿试验期间的水分损失,还对植物进行了灌溉。在实验结束时,采集整株植物的样本,并测量生长参数,以评估充足和低氮供应浓度。
在充足和低硝态氮供应下的幼苗表现
为研究两个奎奴亚藜地方品种在适氮和限制氮条件下的建树性能,在2个NO3.−浓度,先前通过上述实验(第2.4节)确定:20 mM和0.5 mM NO3.−,对应充分(HN)和低(LN) NO3.−供应。使用上述相同的植物生长条件(第2.4节),每次LANDRACE每株每一个供应条件使用30罐700毫升(每壶植物)。实验在完全随机设计中运行24天,其中包括增加的植物以防止接壤效果。在实验结束时,收集了至少四片真实叶子的植物。
对于涉及N吸收和同化的机制,在两种治疗的植物中定量叶绿素,生物质,叶绿素和蛋白质含量,NR和GS酶活性和基因表达,以及硝酸盐转运蛋白表达,以及硝酸盐转运蛋白表达.
植物形态学分析
叶面积(n=每个地方品种提交各处理5株),利用ImageJ软件进行图像分析。叶、芽及根的干重(n=每个地方品种各5株),在60°C下干燥48 h直至等重。次根数及总根长(n = 5 plants of each landrace submitted to each treatment) were determined by image analysis using the WinRhizo software [51].
蛋白质含量量化
叶和根(n=每个地方品种各5株)在液氮中研磨,在400 μL萃取缓冲液(50 mM Tris-HCl pH 7.8, 1 mM EDTA, 1 mM DTT, 10 mM MgSO)中均质4,5mM谷氨酸钠,10%乙二醇)。离心(10,000g 10分钟)后,上清液用于测量Bradford测定的总蛋白质含量[52].以牛血清白蛋白为标准。
叶绿素量化和叶绿素荧光测量
叶绿素一个和b通过按照LichtentHaler和Buschmann描述的方法,分光光度仔细测定内容物53].
使用便携式荧光仪(FMS 2, Hansatech Instruments Ltd.,英国诺福克)进行叶绿素(Chl)荧光测量(每个地方品种提交给每个处理的5株)。在测量之前,将叶片暗适应20分钟。测量是在室温下进行的。光化光为300 μmol光子m- 2 s- 1,如Bascuñán-godoy等人所述。[54].荧光参数按Maxwell、Johnson和Kramer等[55,56].
根中硝酸盐还原酶和谷氨酰胺合成酶的活性
硝酸还原酶(NR;EC 1.6.6.1)和谷氨酰胺合成酶(GS;EC 6.3.1.2)酶催化NO还原的限制步骤3.−对NH4+(初级同化)和NH的加入4+分别变成氨基酸。测定根中NR活性(n=每种地方品种提交5株处理),根据Kaiser和Lewis [57].如上所述提取总蛋白质,通过加入150μl反应缓冲液(50mm KH)开始反应2宝4-KOH缓冲液,pH 7.5;10毫米KNO3.和0.1 mM NADH)到100 μL可溶性蛋白提取物。30°C孵育15分钟。在340 nm波长下用分光光度法测定NADH氧化。测定根中GS活性(n=每个地方品种5株,每次处理),采用O 'Neal和Joy描述的方法形成γ-谷氨酰羟肟酸[58]. 为了进行酶促反应,400 μL蛋白提取物与150 μL反应缓冲液(100 mM Tris-HCl,pH值 7.8; 50 mM谷氨酸钠,5 盐酸羟胺,50 mM MgSO公司420 mM ATP),在30°C下孵育20分钟。用检测液(0.37 M FeCl)停止反应3.,0.67M HCl和20%三氯乙酸)。使用γ-谷氨酸羟肟酸盐作为标准,在540nm下测量谷氨酸谷氨酸分光光度法。
硝酸盐转运体的系统发育分析
硝酸盐转运蛋白(LAT和帽子)同源物序列c .藜麦和其他两种藜亚科(甜菜属和菠菜oleracea)从植物孢子(https://phytozome.jgi.doe.gov/pz/portal.html)和NCBI(https://www.ncbi.nlm.nih.gov.)数据库,使用BLAST算法和拟南芥同系物作为查询。基于Tamura-Nei模型的最大似然法推断了这些基因的进化史[59].采用自助法(N = 1000个伪重复)评估节点的鲁棒性。系统发育分析采用MEGA7 [60].在通过系统发育分析的第一次表征之后,选择毒素和毒性毒素的同源物用于基因表达研究。
RNA提取、cDNA第一链合成及实时荧光定量PCR
采用RNeasy Plant Mini试剂盒(Qiagen)从藜麦根中分离总RNA。获得的RNA用RNase-free DNase I (Qiagen)处理,并用NanoDrop 1000分光光度计(Thermo Scientific, USA)定量。在变性甲醛/琼脂糖凝胶电泳中,通过目测28S和18S rRNA条带的完整性来验证RNA的完整性。RNA储存在−80°C以供进一步使用。
RNA(1 μg)反转录成单链cDNA模板™ RT试剂盒(Takara)和oligo-p(dT)15.底漆。在每个实验的所有比较样本中,以等比例(即等量的RNA)进行反转录。cDNA合成反应混合物在蒸馏水中稀释10倍后用于实时PCR。
使用底漆3输入软件v设计实时PCR反应的基因特异性引物。0.4.0(http://bioinfo.ut.ee/primer3-0.4.0/primer3/input.htm),熔化温度为58-60℃并产生50-200bp的PCR产物。伸长因子(EF1-alpha)被用作内源性(管家)基因,以规范实验结果[26.].引物序列及相应基因的登录号如下:EF1-alpha(向前,5 ' - GTACGCATGGGTGCTTGACAAACTC-3”;相反,5“-TCAGCCTGGGAGGTACCAGTAAT-3”;加入基因库。XM_021860126);硝酸还原酶(NADH)的地方(正向,5 ' - aggactggaccattgaggtg -3 ',反向,5 ' - GCTGCAGAACCCCAATTAAA-3 ';Acc。不。XM_021892662.1);谷氨酰胺合成酶细胞溶质同工酶1-1 - 类似(前进5'aaaggatatttcgaggagagag-3′,反面5′-cttgagagagacagctagatt-3′);账号:XM\ U 021911887.1;nrt1 / ptr家族(即,净现值)6.3技术(一个LAT的同源物)(前进,5'-gagacatggctagctgagga-3';反向,5'-ccttttaggcatgacattagct-3'; acc。xm_021912755);高亲和性硝酸盐转运体(即,帽子)2.1技术(前进,5'-ATGTTGCTGAGTACGACGAC-3';反向,5'- GGGACGTTGTGTAGGGGTAG-3'; ACC。XM_021864786)。
每个PCR反应含有10μL的2×SYBR绿色PCR主混合物(Agilent Technologies),50ng cDNA和每种引物的0.45μm(终浓度),最终体积为20μl。实时PCR反应在Agilent MX3000P QPCR系统(Agilent Technologies)中进行。初始变性时间在95℃下为3分钟,其次是35个PCR循环,由95℃组成30s和60℃,20s。在PCR循环之后,通过分析相应的熔化曲线检查PCR产物的纯度。比较2(-ΔΔct)方法用于定量转录本的相对丰度[61].实验设3个生物重复,每个生物重复3个技术重复。
统计分析
使用Statistica V6.0软件包(Statsoft Inc.,Tulsa,OK,USA)分析数据,www.statsoft.com).单向ANOVA用于识别萌发期间LATERACES之间的差异。
为了分析代谢物简档并比较两个地标,首先通过散点图3D r封装使用主成分分析(PCA)开发了探索性数据分析(LOV。图。S3).PCA分析显示,第一个主成分(PC1)解释了94%的方差,而PC2和PC3分别占4和1%,将数据分为Socaire和Faro地方种的两个主要聚类。因此,PCA成分的变异主要是由于地方品种间的差异,而PC2和PC3的较小变异则是由于重复间的差异。
从检测到的371种代谢物中,仅对161种具有KEGG化合物同一性的代谢物进行了分析(补充。表S1).为了比较各地方种的代谢产物与途径信息的差异,我们选择了100个重复间方差最小的代谢物,并去除那些没有分配KEGG途径信息的代谢物(Suppl。表格S1).因此,85个残余代谢物通过热图进行分析,包括利用KEGG途径信息进行代谢物聚类分析。
为了确定充足和低硝酸盐供应,我们使用了双向方差分析(显著性水平P< 0.05)。通过双向Anova分析了来自硝酸盐供应对不同藜麦地体(SOCAIRE和FARO)的影响的数据。Fisher试验用于识别具有显着差异的手段(意义程度P< 0.05)。
可用性数据和材料
本研究中产生的所有数据均包含在本文及其补充信息文件中。
缩写
- 排名:
-
氯乙烯
- FV / FM:
-
psii的最大效率
- GOGAT:
-
谷氨酰胺氧化戊二酸氨基转移酶
- GS:
-
谷氨酰胺合成酶
- 帽子:
-
高亲和力运输系统
- HN:
-
足够的硝酸盐
- KNO3:
-
硝
- 背阔肌:
-
低亲和力运输系统
- 自然对数:
-
低硝酸盐
- 制程:
-
可能性最大的复合
- n:
-
氮
- 不3.−:
-
硝酸
- 近红外光谱:
-
亚硝酸盐还原酶
- NPQ:
-
Non-photochemical淬火
- 编号:
-
硝酸还原酶
- psii:
-
光系统II
- QL:
-
光化学猝灭
参考
- 1。
Marschner P. Marschner的高等植物矿质营养。3版。伦敦:学术出版社;2012.
- 2。
Ezeagu IE, Petzke JK, Metges CC, Akinsoyinu AO, olohobo AD。热带植物种子蛋白质含量及氮蛋白转化因子研究。食品化学。2002;78:105-9。
- 3.
Lieffering M,Andrews M,McKenzie Ba。温带谷物中种子储备的硝酸盐刺激:水吸收的重要性。Ann Bot。1996; 78:695-701。
- 4.
Grubb PJ, Metcalfe DJ, Grubb EAA, Jones GD。澳大利亚热带雨林的氮丰富度和种子保护:植物防御理论的检验。Oikos。1998;82:467 - 82。
- 5.
等。相关网络分析揭示了种子萌发过程中代谢和转录状态的序列重组以及幼苗发育过程中的基因-代谢关系拟南芥.BMC系统生物学。2010;4:62。
- 6.
Ribeiro Pr,Jan-Willems La,Mudde E,Gonzaga-Fernandez L,Delmondez-de Castro R,Ligterink W等人。油籽作物的代谢物分析里纳斯市政府在种子早期的吸胀过程中,对温度的响应表现出特定的代谢特征。作物研究进展。2015;67:305-9。
- 7.
关键词:种子氮,水稻,发芽,出苗率,建立abstract:土壤科学与植物营养学报,1998;44:359-66。
- 8.
关键词:热带落叶林,种子储备,早期幼苗生长,种子迁移植物生态。2013;214:1361 - 75。
- 9.
无机氮的获取和信号转导:生理学和分子生物学研究。摘自:Eshel A, Beeckman T, editors。植物的根:隐藏的一半。Boca Raton: CRC出版社;2013.25页。1-25-18。
- 10。
Wallsgrove RM, Turner JC, Hall NP, Kendall AC, Bright SW。大麦缺乏叶绿体谷氨酰胺合成酶的突变体-生化和遗传分析。植物杂志。1987;83:155-8。
- 11.
王yy,hsu pk,tsay yf。硝酸盐的摄取,分配和信号。趋势植物SCI。2012; 17:458-67。
- 12.
Krapp A, David LC, Chardin C, Girin T, Marmagne A, Leprince AS等。硝酸盐的运输和信号拟南芥.实验机器人,2014;65:789-98。
- 13。
植物根系硝酸盐吸收和感知的转运蛋白拟南芥.前植物SCI。2016; 7:1391。
- 14
[15]范晓霞,张建平,陈建平。植物硝酸盐转运体的研究进展[j] .植物营养与肥料学报,2017,33(3):457 - 464。实验机器人。2017;68:2463-75。
- 15
世界粮食不安全状况。2011年,联合国粮食及农业组织。http://www.fao.org/docrop/014/i2330e/i2330e.pdf..2019年12月20日通过。
- 16
梨DM。植物驯化与雅迹中的农业转变。在:Silverman H,Isbell W,编辑。南美考古学手册。纽约:斯普林克;2008. p。105-20。
- 17
从损失的作物到利润丰厚的商品:藜麦复兴的保护意义。嗡嗡声器官。2015;74:86 - 99。
- 18
reguera m,conesa cm,gil-gómeza,haros cm,Pérez-casasmá,briones-labarca v,bolañosl,bonillai,álvarezr,pinto k,mujicaá,bascuñán-godoy l.不同农业生态病症的影响论奎奴亚藜种子的营养成分。peerj。2018; 6:E4442。
- 19.
Bascuñán-Godoy L, Sanhueza C, Pinto K等。对比基因型的氮生理藜藜麦Willd。(苋科)。Sci众议员2018;8:17524。
- 20。
代谢指纹图谱揭示了藜麦油作为一种生物活性植物化学物质的来源。食品化学。2019;286:592-9。
- 21。
Fait A, Angelovici R, Less H, Ohad I, Urbanczyk-Wochniak E, Fernie AR等。拟南芥种子的发育和萌发与时间上不同的代谢开关有关。植物杂志。2006;142:839-54。
- 22。
引用本文:马勇,张娟,李霞,张松,兰慧。环境胁迫对水稻种子萌发和幼苗生长的影响猪毛菜ferganica(藜科)。生态学报,2016;36:56 - 63。
- 23.
种子休眠和质量相关种子萌发早期ATP综合和利用。physiol植物。1986; 66:177-82。
- 24.
Witte CP,Herde M。植物的核苷酸代谢。植物生理学。2020;182(1):63–78.
- 25.
Steffensen SK, Rinnan A, Mortensen AG, Laursen B, De Troiani RM, Noellemeyer EJ等。田间栽培种子多酚含量的变化苋菜基因型。食品化学。2011; 129:131-8。
- 26.
Morris CF,Mueller DD,Faubion JM,Paulsen GM.L-色氨酸作为白小麦胚萌发内源抑制剂的鉴定。植物生理学。1988;88:435–40.
- 27.
Ruiz KB, Rapparini F, Bertazza G, Silva H, Torrigiani P, Biondi S.比较Salares和沿海低地藜麦地方品种的盐诱导应答(藜藜麦Willd)。环境实验机器人。2017;139:127-42。
- 28。
Bascuñán-godoy L,Sanhueza C,HernándezCE,Cifuentes L,Pinto K,Álvarezr等。氮气供应在藜麦干旱诱导的衰老期间影响光合作用和光保护物质。前植物SCI。2018; 9:994。
- 29。
roental L, Perelman A, Nevo N, Toubiana D, Samani T, Batushansky A等。环境和遗传对番茄种子代谢平衡的影响及其与萌发活力的关系。BMC基因组学。2016;17:1047。
- 30.
孙春,于建强,胡德广。硝酸盐:侧根发育的重要信号。植物生态学报,2017;
- 31.
在低地沙漠条件下生长的藜麦种质的形态分析。作物学报,2010;7:24 - 827。
- 32.
水稻铵离子同化与氮素再利用的研究(栽培稻l .)。实验机器人2007;58:2319-27。
- 33。
橡树A,Aslam M,Boesel I.铵和氨基酸作为玉米根中硝酸盐还原酶的调节剂。植物理性。1977年; 59:391-4。
- 34。
植物NRT1.1双亲和硝酸盐转运体的分子机制。杂志。2015;6:386。
- 35。
王X,Cai X,Xu C,王S,戴S,王Q.硝酸盐输送中硝酸盐累积和基因的表达模式在菠菜中的同化。分子。2018; 23:2231。
- 36。
O'Brien JA, Vega A, Bouguyon E, Krouk G, Gojon A, Coruzzi G,等。植物中硝酸盐的运输、感知和响应。摩尔。2016;9:837-56。
- 37。
李某,王y,okamoto m,crawford nm,siddiqi我的,玻璃A.解剖AtNRT2.1:AtNRT2.2诱导型高亲和力硝酸盐转运蛋白簇。植物理性。2007; 143:425-33。
- 38
肖邦等[1]研究了一种新型的生物信息学方法。的拟南芥ATNRT2.7硝酸盐转运体控制着种子中硝酸盐的含量。植物细胞。2007;19:1590 - 602。
- 39
关键词:大气氮沉降,中央谷地,洛斯安第斯山脉Rev chilist Nat 2002; 75:233-43。
- 40.
García玻利维亚高原地区雨养农业的农业气候限制。干旱环境学报。2007;71:109-21。
- 41.
Montes C, Rutllant JA, Aguirre A, Bascuñán-Godoy L, Juliá C. Terral de Vicuña,半干旱的智利北部的一种类似于风的风:气象方面和对满足落叶果树寒冷需求的影响。应用气象气候学报,2016;55:1 83 - 96。
- 42。
一种测定有机物中氮的新方法。肛门化学1883;22:366 - 82。
- 43。
Botanga CJ,Bethke G,Chen Z,Gallie Dr,Fiehn O,Glazebrook J.拟南芥的代谢物分析接种alceraria brassicicola揭示抗坏血鬼降低疾病严重程度。Mol植物微生物相互作用。2012; 25:1628-38。
- 44。
(1)范恩(Fiehn O, Wohlgemuth G, Scholz M, Kind T, Lee DY, Lu Y,等。植物代谢组学的质量控制:报告符合msi的研究。植物j . 2008; 53:691 - 704。
- 45。
liu j, liu j, liu j, liu j, et al. .基于四极杆和飞行时间气相色谱/质谱的代谢组学质谱和保留指数库。肛门化学2009;81:10038-48。
- 46。
Fiehn O,Wolgemuth G,Scholz M.通过整合生物和质谱元数据来设置和注释代谢组实验。Proc Lect Notes Bioinf。2005; 3615:224-39。
- 47.
夏J,西内尼科夫四世,韩B,维斯哈特DS。代谢分析3.0——使代谢组学更有意义。核酸研究,2015年;43:第251–7页。
- 48.
Ranal Ma,Santana DG。如何以及为何测量萌发过程?Braz J Bot。2006; 29:1-11。
- 49.
Abiri R, Shaharuddin NA, Maziah M, ZNB Yusof1, Atabaki N, Sahebi M,等。籼稻萌发对氢化启动、激素启动和聚乙二醇启动的定量评价。儿童J Agr res 2016; 76:392-400。
- 50。
一种用于烟草组织培养的快速生长和生物测定的修正培养基。杂志。1962;15:473 - 97。
- 51。
Arsenault JL, Poulcur S, Messier C, Guay R. WinRHlZO™,具有独特的重叠校正方法的根测量系统。HortScience。1995; 30:906d - 906。
- 52。
利用蛋白质-染料结合的原理,快速和灵敏的定量蛋白质的微克量的方法。学生物化学肛门。1976;72:248-54。
- 53.
关键词:叶绿素,叶绿素,类胡萝卜素,紫外-可见光谱《食品与化学》2001;1:F4-3。
- 54.
Bascuñán-Godoy L, Alcaíno C, Carvajal D.干旱条件下两种优势沼泽森林的光保护反应。Gayana机器人。2013;70:279 - 86。
- 55.
麦克斯韦尔,约翰逊。叶绿素荧光——实用指南。实验机器人,2000;
- 56.
Kramer DM, Johnson G, Kiirats O, Edwards GE。测定QA氧化还原态和激发能通量的新的荧光参数。Photosynth杂志2004;79:209。
- 57。
Kaiser JJ, Lewis OAM。硝酸盐饲料叶片和根中硝酸盐还原酶和谷氨酰胺合成酶的活性Helianthus Annuus.植物土壤。1984;77:127-30。
- 58。
豌豆叶谷氨酰胺合成酶。一、纯化、稳定和pH优化。生物化学,生物物理学,1973;159:113-22。
- 59。
利用邻域连接法推断大系统发育的前景。美国国家科学研究院2004;101:11030-5。
- 60.
Kumar S、Stecher G、Tamura K。分子进化遗传学分析7.0版,用于更大的数据集。分子生物学。2016;33:1870–4.
- 61.
Livak KJ, Schmittgen TD。采用实时荧光定量PCR对相关基因表达数据进行分析−ΔΔCT方法。方法。2001;25:402-8。
确认
我们感谢因蒂瓦西和索卡雷尼亚半比索银行为这项工作慷慨捐助种子。
资金
这项工作由Vicerrectoría de Investigación y Desarrollo de la Universidad de Concepción VRID-Iniciacion 218.111.065-1支持。OIN, PCI-CONICYT REDI170289, CONICYT智利(R16A10003)和FIA PYT-2014-0280。资助者在研究设计、数据收集和分析、决定出版或手稿准备方面没有任何作用。
作者信息
隶属关系
贡献
采用KP、TC、EOG、CI、VB、RA、CS、PC、LBG等5种检测方法进行设计,并共同撰写文章。KP、CC和AV进行了分析、测量和数据分析。LBG领导了这个项目。所有作者阅读并批准最终稿件。
相应的作者
伦理宣言
伦理批准并同意参与
不适用。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有利益冲突。
额外的信息
出版商的注意
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充信息
附加文件1:图S1。
Socaire和Faro Loreraces的种子萌发率。在24小时内每4小时进行测量(每平50个种子,n = 3). 星号表示地方品种之间的显著差异。
附加文件2:图S2。
缺氮对玉米生长参数的影响c .藜麦植物。植物受到不同的3.−供应从0到100毫米每20天。(a)处理20天后的幼苗图像(b)叶面积和(c)茎鲜重。数值为平均值±SE (n= 7)。在考虑地方品种和营养处理(20 mM和0.5 mM NO)的情况下,采用双因素方差分析(two-way ANOVA)结果显示,不同字母之间存在统计学差异3.−)作为因子(Fisher LSD检验;P< 0.05)。
附加文件3:图S3:
Socaire和Faro地方品种种子代谢物的主成分分析。
附加文件4:表S1。
原始代谢组学数据用于热图和代谢物聚类分析。
附加文件5:表S2。
的生理数据。sosocaire和Faro藜麦的生化和分子参数测定提交HN (20 mM NO3.−)和ln(0.5毫米的否3.−)供应,并在流程图中描绘(图。5). 值是平均值 ± 东南(n= 5)。以地方品种和氮素处理为影响因素,采用双因素方差分析(Fisher LSD检验;P< 0.05)。重要的P- 值是红色的。
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
Pinto Irish,K.,Coba de la Peña,T.,Ostria Gallardo,E。et al。藜麦高原和沿海生态型幼苗的种子特性和早期氮代谢性能。BMC植物生物学20,343(2020)。https://doi.org/10.1186/s12870-020-02542-w
收到了:
接受:
发表:
关键字
- 氮代谢
- N运输
- 谷氨酰胺合成酶
- 光化学过程
- 叶绿素荧光
- 硝酸还原酶
- 硝酸盐转运蛋白
- 硝酸盐感应
- 蛋白质
- 作物产量