- 研究文章
- 开放获取
- 发布:
Broachypodium distachyon.:研究镰刀虫头的新探病系统枯萎等镰刀菌素小麦的疾病
BMC植物生物学体积11, 文章编号:One hundred.(2011)
摘要
背景
镰刀菌素小麦枯萎病(Fusarium head blight, FHB)和其他重要病害是由小麦品种引起的。致病因子产生象脱氧雪腐镰刀菌醇(DON)这样的天花粉霉菌毒素。双子叶模式种拟南芥蒂利亚纳已经被用来学习了吗镰刀菌素-host交互,但对于模型到作物的转换不是理想的。Broachypodium distachyon.(Bd)已被认为是一种新的单子叶模式种,用于禾本科植物功能基因组学研究。本研究旨在评估最常见的fhb病因之间的相互作用镰刀菌素物种和BD为了开发和利用BD作为FHB等的遗传模型镰刀菌素疾病的小麦。
结果
的能力镰刀菌素graminearum和镰刀菌素culmorum结果表明,两种植物都能感染所有被检测的Bd组织,包括完整的叶组织。DON在受感染的穗组织中积累的水平与受感染的小麦穗相似。组织学研究揭示了感染、定植和宿主反应的细节,并表明毛细胞是感染的重要部位。易感性镰刀菌素唐在两个BD杂肉型中评估,并揭示了生态型之间的抵抗的变化。
结论
Bd表现出与小麦高度相似的易感性特征,包括对小穗疾病传播的易感性。Bd是第一个通过fhb诱导成功感染完整叶面组织的植物物种镰刀菌素物种。DON在Bd中似乎是一种毒力因子,就像它在小麦中一样。本研究认为Bd模型可作为开展穗枯病等病害研究的一个有价值的模型镰刀菌素疾病的小麦。
背景
几个镰刀菌素物种是全球麦小麦的重要病原体(小麦).这些真菌感染花组织以及幼苗,茎基和根部引起镰刀菌枯萎(FHB),幼苗枯萎,冠腐肉和根腐腐烂[1那2 gydF4y2Ba].其中,赤霉病是全球最重要的小麦病害之一,是最具破坏性的小麦病害之一,对经济和健康都有影响[3.那4.].主要镰刀菌素与FHB有关联的物种有镰刀菌素graminearum(FG)(Teleomorph:赤霉菌属菌) 和镰刀菌素culmorum(Fc),亦是最具经济意义的[5.那3.].
由于Fg和Fc会在受感染的谷物中产生一些对人类和动物消费者有毒的次级代谢物,因此FHB是首要关注的问题。最普遍的镰刀菌素小麦中的霉菌毒素是脱辛维酚(Don)和Nivalenol(NIV)等胞滴管[6.].使用无法产生DON的Fg突变体进行的实验表明,这种霉菌毒素在小麦中作为一种毒力因子,增强了病害在小麦头部的传播,但相比之下,在大麦中没有可识别的作用[7.].Trichothecene毒性的研究表明,DON通过与60S核糖体亚基结合而抑制蛋白质合成,激活细胞信号通路,导致编程细胞死亡的形式[8.那9.].DON对小麦的植物毒性作用表现为褪绿、坏死和萎蔫,通常导致接种点以上的整个头部漂白[10].
使用抗性小麦品种被认为是预防FHB流行和小麦毛癣菌污染的最有效策略[11].小麦的FHB抗性已被广泛分为两种不同类型:抗初始渗透(I型)的抗性和对头部内的病原体的抗性(II型)[12].然而,也有人提出了其他类型的抗性;对籽粒侵染的抗性(III型)、对FHB和毛癣菌的抗性(IV型)[13],通过两种方式对毛绿素积累产生抗性(V型):对毛绿素进行化学修饰(V-1型)和抑制毛绿素合成(V-2型)[14].目前已可靠地鉴定出100多个小麦抗FHB的数量性状位点[11],但迄今为止,只有四个位点显示出孟德尔遗传[15-18].Fhb1这是目前已知的唯一一个分子机制的位点。含有该QTL的小麦品系能够将DON转化为毒性较小的DON-3- o -glycoside (V-1型)Fhb1是编码Don-甘油三糖基转移酶或这种酶的表达或活性的调节剂[10].
由于其大量的allohexaploid基因组(总共约17,000 Mbp的三个祖先基因组),小麦不容易进行复杂性状的遗传研究,这极大地阻碍了FHB抗性QTL的完全遗传表征。由于与小麦相关的固有困难,已经提出了许多替代宿主作为研究FHB中的宿主病原体相互作用的模型。虽然它的基因组尚未完全测序,但大麦(Hordeum Vulgare.)呈现具有二倍体基因组的优点,而也是一种自然感染的单圈植物镰刀菌素然而,大麦具有固有的fhb - II型抗性[3.]这可能是研究小麦中FHB抗性的机制的障碍。米 (奥雅萨苜蓿)是第一个进行基因组测序的单子叶植物,是一种天然宿主镰刀菌素然而,水稻的某些特性及其相互作用镰刀菌素真菌减少了模拟小麦FHB的潜力:米是一种热带植物,适应于早期发展的水生环境,主要感染镰刀菌素引起小麦赤霉病的品种除外[19].
一些研究人员使用了目前研究得最好的植物模型,拟南芥蒂利亚纳,因为它非常适合实验室研究,并且有广泛的遗传和基因组资源可用[20.].花和叶生物测定已经报道了Fg和Fc与拟南芥相互作用的研究[21那22].这些试验已经证明NPR1和EDS11有助于拟南芥对Fc的抗性[23而GLK转录激活因子的过表达会产生对Fg的抗性[24].然而,到目前为止,有关宿主抗性遗传机制的研究成果镰刀菌素从拟南芥到谷类作物的感染是罕见的。Chen就是一个例子et al。[25他证明了Fg利用乙烯(ET)信号通路在拟南芥上定植,并表明ET信号也有助于小麦对FHB的易感。尽管拟南芥作为FHB的模型有许多优势,但它不是FHB的天然宿主镰刀菌素,它向那些在小麦上发生了不同的花卉症状[21].因此,鉴定一个模式,遗传上易于控制,单子叶系统,更接近小麦是非常可取的。
Broachypodium distachyon.(Bd)是草科温带单子叶植物,已被提出为草功能基因组学的新模式种[26].近交系Bd21最近被测序到8倍覆盖范围[27].Bd的几个方面使它成为一个非常有吸引力的模型温带小粒谷物,包括小麦。Bd是草类中最小的基因组之一[28]包含超过272MBp的5染色体,其中预测了约25,000个蛋白质编码序列[27].Bd在包含大多数温带谷物(包括小麦)的'core pooid'属的进化枝之前分化,使其有可能用于功能基因组学[26].BD和其他谷物之间存在广泛的染色体同步,具有最强的同情关系与小麦相比,大约77%的BD基因具有强烈的Triticeae EST比赛[28].此外,利用Bd标记可以直接获得小麦基因组中的遗传/物理位置,这在复杂的精细定位中得到了证明PH1.小麦的轨迹区[29].BD的另一个优势在于它是一种自我肥沃的近亲繁殖的年度,速度迅速为8-10周[26取决于环境的生长条件。此外,这个品种是小的大小(大约30厘米在成熟)和不苛求的生长要求。此外,目前正在开发资源,以便在Bd进行功能性遗传学研究。目前已有多个突变体集合,包括EMS和T-DNA插入突变体[http://brachypodium.pw.usda.gov,Brachytag.org,30],以及使用BD21和BD3-1作为父母线的分离人口[http://www.modelcrop.org].
目前的研究旨在检验双相障碍作为研究与之交互作用的模型的潜力镰刀菌素物种和一个基础,从中进行模型到作物转化的研究。
结果
花卉感染
FHB是小麦最大意义的疾病,如果BD作为模型有用,则表达与小麦相似的症状。BD的尖峰喷雾接种以评估BD至FG和FC的易感性,并将症状与小麦上的FHB(图1a,b).最适侵染是在接种后立即将植株置于黑暗8 h(在黑暗期开始时接种植株)。与小麦赤霉病的情况相似,Bd穗似乎最易受感染镰刀菌素SPP在中期半期的时间[4.那31].在花中期或花期之前接种Bd尖刺可明显抑制症状的发展。
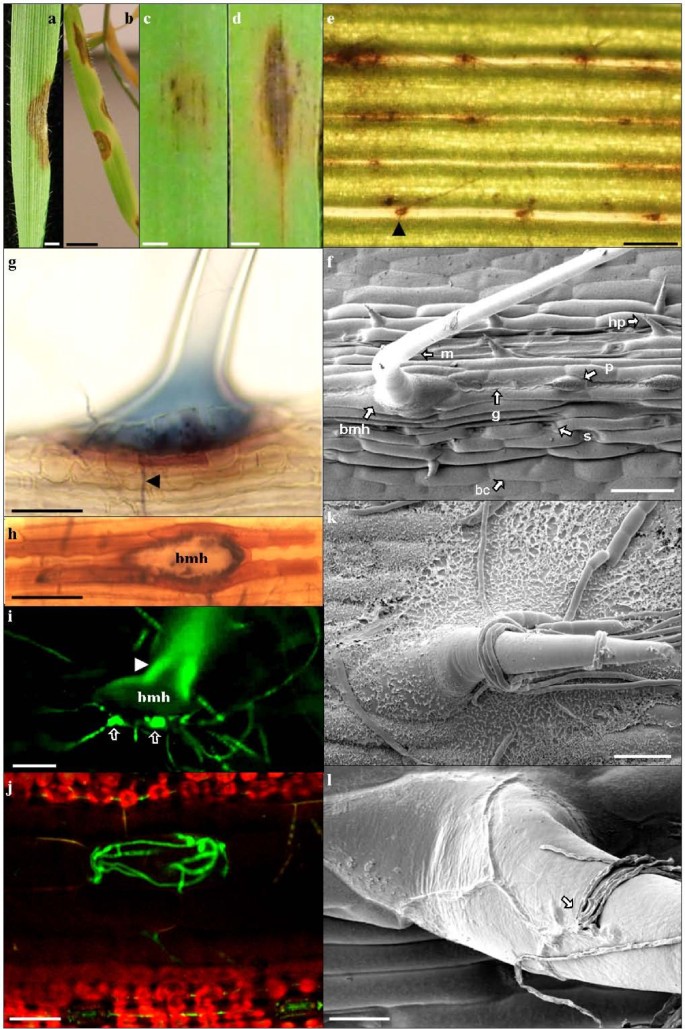
枯萎病的症状和渗透点在Bd穗.a)点接种小麦穗上典型的早期FHB症状。b)点接种小麦穗的典型FHB晚期症状表现为白化。c - e) FgUK1喷雾接种症状:分别为3、7、14 dpi。f和g) FgUK1点接种,相同穗2和4 dpi。h)保持高湿喷雾接种后FgUK1症状。比例尺a-h = 1厘米。分离后Bd21小花的光镜图像,3dpi与Fg染色,透明,苯胺蓝染色。i)外稃的外表面显示在宏观毛上菌丝接触(箭头)。J & k)是图i)在不同焦平面拍摄的特写。 j) shows hyphal strands enveloping the macro-hair and k) shows a globose fungal structure formed at the base of the macro-hair (bmh). l) Internal surface of the palea showing hyphal colonization, necrosis and accumulation of phenolic compounds in corrugated circular cells (arrow). m & n) Macro-hair base of lemma at early stage of fungal colonization showing aggregated hyphal structure, n) Macro-hair base of lemma at late stage of fungal colonization showing extensive hyphal strands enveloping the base of the macro-hair, intense phenolic compound accumulation and collapse of the macro-hair. o-p) External surface of the palea showing the base of a macro-hair and neighbouring corrugated circular cell (arrow head) accumulating phenolic compounds (o) in response to hyphal contact (p), Upper arrow points at globose structure located above the corrugated circular cell and lower arrow pointing at hyphal strands in contact with the base of the macro-hair. Scale bars i-p = 20 μm.
在宿主表面上可检测到12至36 HPI和浅棕色之间的菌丝体生长,水浸泡病变在近侧出现在引理的外表面,在24至48hpi之间(结果未显示)。从48小时到96小时,小花草失去了绿色的外观,并以高度让人的方式漂白,以便与FHB的小麦头展出的漂白症状(比较数字1a,b与图1C,D).喷雾接种后,整个小穗变白,在96 - 144 hpi之间,坏死症状沿轴向下扩散到上下相邻的小穗(图)1 d).疾病继续发展,在接种后7至14天(dpi),整个穗变白,坏死向下扩散到茎柄(图1 e).如果在接种后没有保持湿度,感染会减少甚至不成功,导致在接种后24 - 48小时(hpi)后症状发展完全停止(结果未显示)。相比之下,保持高于48 hpi的高湿度会导致气生菌丝广泛生长,常常覆盖整个穗(图1 h).虽然在喷接种Fg或Fc(数据未显示)后,Bd21和Bd3-1上的花状症状相似,但通常在Bd3-1上比在Bd21上发展得更快,特别是在喷接种Fg分离株后。
点接种是为了确定Bd是否像小麦一样,表现出在小穗内扩散的敏感性(II型敏感性)Sensu.Schroeder和Christensen [12])。点接种后,花组织的漂白倾向于从接种点向小穗上端扩散,接种点以下的病害进展不明显(图)1 f(2dpi), 1g (4dpi))。小麦籽粒被DON污染是影响食品安全的最重要因素。用Fg喷雾接种Bd21尖刺后,研究了Fg在Bd组织内产生DON的能力。当条件非常有利于感染和真菌生长时,在感染尖刺中检测到大量DON,浓度高达1815 mg/kg的新鲜组织(图)1 h).
在光镜下对分离的Bd21小花接种Fg进行3dpi研究,观察其侵染早期的病原菌渗透和早期宿主反应。分别解剖近轴(外稃)和远轴(外稃)叶组织。在外稃的外表面观察到广泛的菌丝生长和分枝,并在体积巨大的毛上固定和分枝(图)1我,箭头)。仔细观察表明菌丝在宏观的底部盘绕(图1 j,箭头)和形成球状结构(图1 k,箭头)其存在与宿主组织的琥珀色变色剂相关。在相互作用的早期阶段,菌丝在宏毛(BMH)碱周围形成聚集结构,宿主组织很少或没有变色(图1米).然而,在相互作用的晚期阶段,BMH周围的广泛悬垂生长与宿主组织的强烈变色和塌陷相关(图1 n).类似的观察结果也出现在外表面,其中球状菌丝结构与BMH相关,附近的细胞呈波纹状圆形(图)1 o, p)及强烈的琥珀褐色褪色。内表面没有宏观毛。然而,在这些波纹状圆形细胞中观察到琥珀棕色的变色和细胞死亡,我们认为这是发育受阻的毛发原基(图)1 l).
叶面感染
首次对Bd21全株进行喷施接种,以鉴定其亲和组织镰刀菌素感染。棕色,水浸湿的坏死病变在叶子上产生48到72hpi(图2),随后是周围的褪绿区(图2 b).此外,还进行了离体叶片试验,研究了接种Fg或Fc的完整叶组织和损伤叶组织的症状发展。创面接种后,在24 ~ 48 hpi的创面部位出现了深褐色的水浸坏死病变,主要沿着维管束向叶尖和叶基部延伸1).在接种完整的Bd叶组织后,接种滴下的叶片上出现非常小的坏死点(图)2 c, e),随后出现更广泛的坏死。随后在这些病变周围出现褪绿区(图)二维).症状的发展方式与伤口接种叶片上的症状相似,但进展一般延迟约48小时。
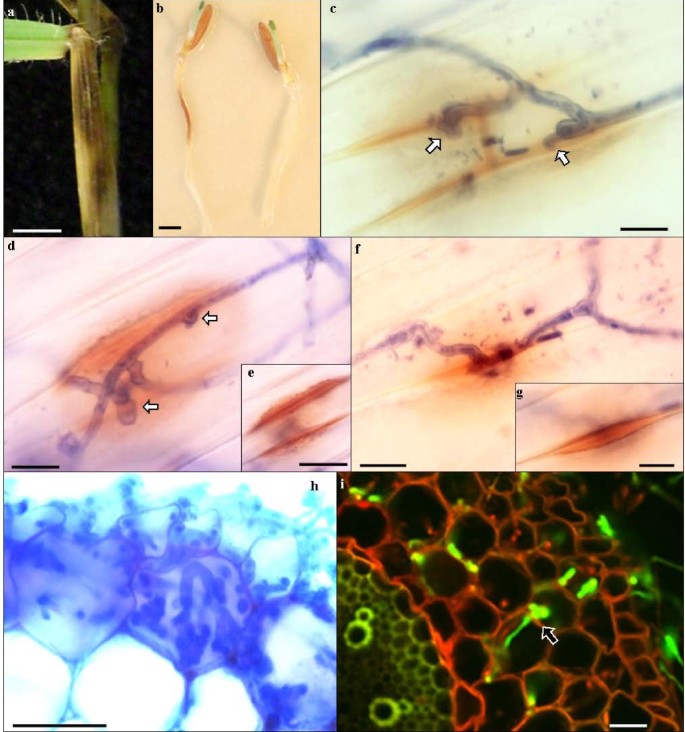
BD21叶面组织对镰刀菌症状和渗透部位.a & b) Bd21全株喷施后叶片fguk1症状。刻度条:k = 0.5 cm, m = 1 cm:早期症状和晚期症状。c和d)完整的Bd21离体叶片上的Fg症状:c和e) 96hpi,和d) 144hpi。比例尺:c和d = 0.25 cm, e = 250 μm。f) Bd21完整叶片表面的SEM图像显示Bd表皮细胞类型(bc: bulliform cell, mh: macro-hair, bmh: macro-hair base, g:梁状,p:刺细胞,hp:钩状刺,s:气孔)。比例尺= 50 μm。g和h)经Fg UK1, 120 hpi感染后叶绿素清除的Bd21叶片经台虫蓝染色的光镜图像。比例尺g & h = 50 μm。i) Bd21叶片宏毛基96hpi与GFP1-Fc的荧光显微镜图像。 Arrow head shows macro hair endogenous fluorescence. Arrows show GFP1-Fc fluorescent hyphae forming globose structures at the bmh. Scale bar = 50 μm. j) Confocal laser scanning microscope (CLSM) image of GFP1-Fc infection on intact Bd21 detached leaf, 72 hpi, showing chlorophyll-less cells above the vascular bundles and GFP1-Fc hyphae in the cell directly beneath the bmh (bmh not in focal plane). Scale bar = 20 μm. k & l) SEM images of intact Bd21 leaf infection with FgS1, 48hpi. k) Fg hyphae enveloping a prickle cell. Scale bar = 20 μm. l) Fg hyphae aggregating near the bmh, penetrating (arrow) and growing underneath the cuticule. Scale bar = 10 μm.
在研究感染过程时,重要的是考虑组织的结构。BD的叶面表皮的特征在于在连续平行肋和沟槽中组织的明显细胞类型(图2 f).肋骨是覆盖维管束的体积大的结构。它们由沿纵向轴排列的不同细胞类型组成,这些细胞以连续的波状边缘梁状细胞为中心,其间穿插着刺细胞和大量的宏毛(图)2 f).在这个轴的每一边都有两到四排拉长的细胞,在气孔(朝向主梁细胞线)和刺细胞(朝向沟槽)之间。沟是由泡状细胞形成的。
在接种到完整的叶片表面上,FG Catidia通常在犁沟中聚集。在12至36月的HPI和36 HPI和菌丝在接种位点的叶子表面的各个方向上生长。观察菌丝生长朝向和过度的气孔孔(结果未显示),但未获得直接渗透的证据。
菌丝经常缠绕在刺细胞周围(图)2 k)和宏观。经常观察到与宏观毛碱的关系(图2 g)并且这种与最早的可见宿主响应相关联:宏毛底部的琥珀棕色变色在细胞中特别突出,立即沿着宏头发(图2 g h).在许多情况下,悬垂的生长是大量关于宏毛和在毛发底部产生的球状真菌结构(图2我)和菌丝用CLSM观察,菌丝位于巨毛基部正下方的细胞内2 j).扫描电镜显示,生长在宏毛上的菌丝可以穿透角质层,并在角质层以下继续生长,直至宏毛的基部(图)2 l),这时感染开始进行,可能是通过毛发基部形成的球状结构(图)2我).
对其他BD组织进行感染
另外还使用了一些试验来研究Fg和Fc感染其他组织的能力,并评估Bd作为其他谷物疾病的模型的潜力镰刀菌素物种。棕色,水浸性坏死病变在48到72 HPI之间形成,几乎所有上面的地面植物零件,包括茎,茎节点,叶子护套和叶子。感染的茎和茎节点只显示暗坏死的病变,即使在相互作用的后期(在5到7 dpi之间),而叶护鞘上的坏死区域被氯化环绕(图3).
Bd胚芽鞘和根部镰刀菌侵染分析.a)叶鞘FgUK1症状。比例尺= 1厘米。b) Bd21根上FgUK1症状(左)和模拟接种防治(右),48 hpi。比例尺= 0.5厘米。c-g) Bd21 coleoptiles上Fg UK1感染的光显微镜图像,6dpi,台虫蓝染色。c) Fg菌丝试图通过感染钉(箭头)在相邻细胞之间的连接处渗透,显示酚类化合物的相关沉积。d)通过相邻细胞连接处的感染钉(箭头)的穿透尝试失败,在较低焦平面(e),在试图的感染点下显示强烈的酚类化合物沉积。f)通过感染钉(箭头)在相邻细胞之间的连接处成功穿透,在较低的焦平面(g)显示分离。比例尺:c = 10 μm, d = 10 μm; e = 20 μm, f & g = 10 μm. h) Light microscope image of Fg UK1 at disease front of Bd21 root infection, 48 hpi stained with trypan blue. Scale bar = 20 μm. i) CLSM image of GFP-expressing Fc at infection site of Bd21 root, 48 hpi. Arrow shows hyphal translocation between two adjacent cortical cells. Scale bar = 10 μm.
BD21的根源迅速发展症状,琥珀棕色褪色在与接种物的接触部位,24 HPI(图3 b).蔑视根部继续,从48 HPI开始,病变变得深褐色。根症状沿着感染部位的根部沿着根部传播,直至整根均为96至120 HPI。
Bd初生根最外层的细胞层为根皮层,根皮层下为单细胞层,由多细胞层组成。中柱位于皮层的内部,由单细胞层内皮层与中柱分离,中柱中有中央的后生木质部导管和木质部导管。在24 hpi检测下,感染部位的根呈琥珀棕色变色,此时真菌仅在根皮层和最外层的皮层细胞层可见细胞间和细胞内的存在(图)3 h).通过48 HPI,通过间细胞内生长和细胞内生长(图3我)、皮层细胞层,这与皮质细胞呈琥珀棕色有关。
共聚焦显微镜证实,真菌通过48 HPI侵犯了大多数内部皮质细胞层(图3我),但菌丝在96 hpi后仍被排除在中柱外(结果未显示)。喷施生孢子后,根茎未出现症状。然而,菌丝体在外部生长以到达胚芽鞘,在邻近细胞之间的连接处经常观察到试图渗透,并似乎通过感染钉继续进行(图)3 c, d).尝试的渗透与在接触/企图渗透率的接触宿主细胞中的琥珀棕色沉积物的局部生产有关(图3d,E.).在大多数情况下,在某些情况下有效地防止了真菌进入,而在某些情况下,细胞似乎被撬开,允许它们之间的菌丝生长(图3F,G.).
Bd21和Bd3-1对Fg和DON的不同反应
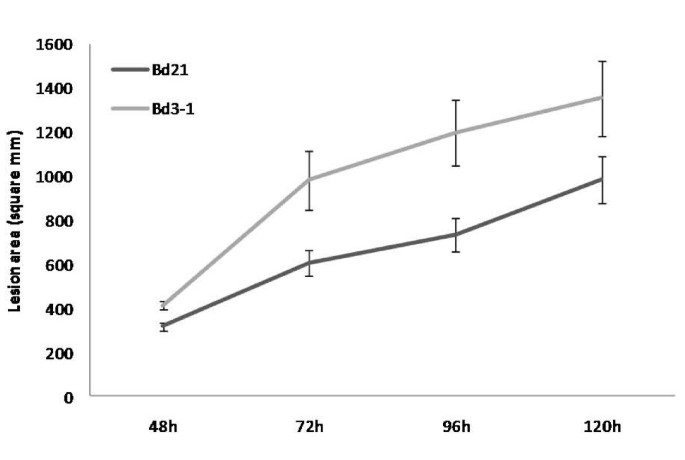
作为确定抗性自然变异潜力的第一步,研究了两个Bd生态型(modelcrop.org)的亲本镰刀菌素比较了Bd21和Bd3-1品系叶片对接种Fg伤的反应。Bd3-1的症状发展明显快于Bd21 (P = 0.016)(图4.).最引人注目的是,Bd3-1上的病变被大面积的褪绿包围,而Bd21上的病变仍保持绿色(补充文件)1).与Bd21叶片相比,Bd3-1叶片的分生孢子产量显著(P = 0.001)增加7dpi2 gydF4y2Ba).
还比较了Bd21和Bd3-1,以评估在Fg单小花点接种后它们在II型抗性上是否不同。由AUDPC确定的疾病进展在Bd3-1(31.92)中显著(P < 0.05)高于Bd21 (20.16)3.),但在13 dpi时,实验终止时的分生孢子产量没有显著差异(数据未显示)。
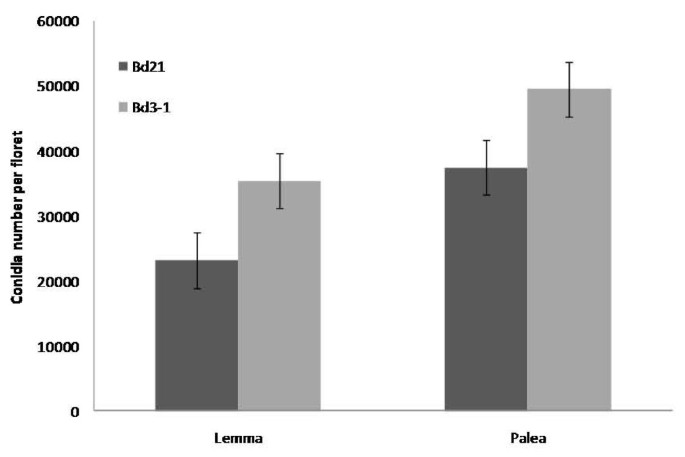
在互补实验中,拆卸了BD21和BD3-1的单一小花,将在培养皿中的湿滤纸上置于植物悬浮液,并在PALEA或LEMMA表面接种,以研究这些组织的感染并识别易感性的潜在差异在BD线和组织之间。当分类地接种到PALEA上的CONICIA,在PAPEA上,在PAPEA上,CONCIDIAP的CONSIDIAL生产显着大(P <0.001),在BD21和BD3-1生态型中。此外,PALEA和LEMMA的分析产量高于BD3-1(分别为49,556和35,400个Conidia / Floret)比BD21(分别为37,533和23,200分枝蔓/小花香)(图5.).
STINE BD21和BD3-1也被评估了易感性。用一系列唐浓度(15,75和150μm)缠绕脱离叶片。在最高的唐浓度下,BD 21和BD3-1的伤口位点周围出现了琥珀棕色的变色,从72 HPI围绕。病变沿着血管束传播,在96 HPI左右变成坏死。较低的唐浓度没有导致坏死病变的传播(数据未显示)。BD21和BD3-1上的坏死区域的大小没有统计学上不同。然而,在所有唐浓度下,在BD3-1上发育的氯也是在BD21上观察到的(图6.).
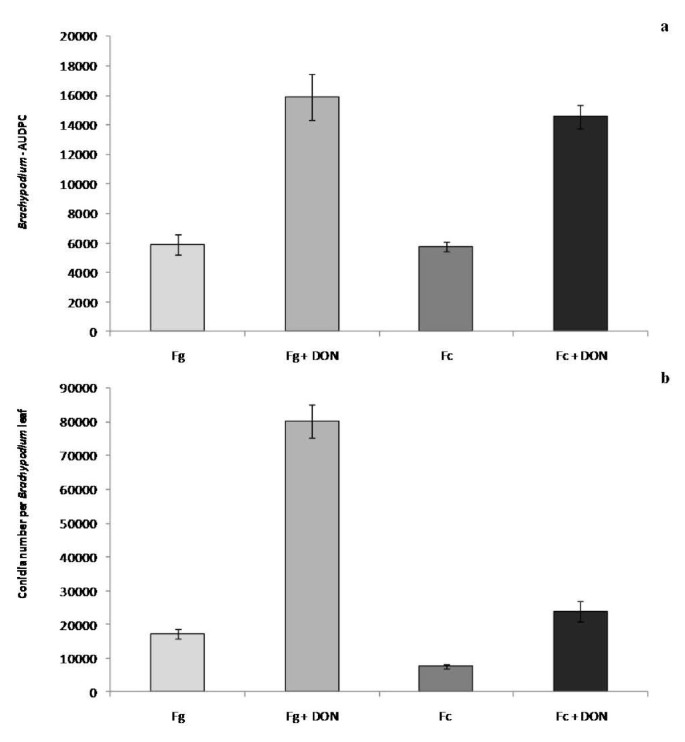
DON已被证实是一种对小麦赤霉病和冠腐病的毒力因子。DON对镰刀菌侵染的影响Brachypodium在伤口接种的分离的叶片上检查,以确定它是否增强了FG和FC的毒力。唐(75μm)的分析inoculum的修订显着增加(P <0.001)FG和FC的平均病变区(图7A)和共分享生产(图7B.)与单独使用分枝蔓的感染相比。这些结果与唐修正对小麦叶片的病变发展的影响引起了惊人的相似之处(附加档案4.).
如上所示,Bd3-1比Bd21花组织的症状发展更大,我们进行了额外的实验,以确定这是否也反映在DON积累的差异上。对Bd21和Bd3-1的穗部喷接种Fg的分生孢子,测定DON含量为21 dpi。Bd21和Bd3-1(新鲜组织分别为620 mg/kg和625 mg/kg)的DON含量无显著差异(P = 0.971)。
讨论
本研究旨在确定Bd作为Fg和Fc的宿主的潜力,并确定这种相互作用是否可以作为两者之间的模型镰刀菌素物种和小麦。结果清楚地证明了Bd与二者相互作用的相容性镰刀菌素与FHB最大的物种,主要镰刀菌素小麦相关疾病。此外,疾病症状的发展与报道的小麦相似。
关于FHB,在短时间性期间,BD尖峰喷雾接种与FG分类显示的小棕色斑,首先出现在引理的中间或基础上,高度让人在小麦中的初始症状[4.].病变蔓延到邻近的小花,通常引起小穗上部的漂白,类似于在小麦中观察到的[32那10],侵染向下延伸到邻近的小穗,甚至殖民花序梗,就像小麦侵染时看到的那样。总的来说,镰刀菌素感染Bd尖峰导致的症状发展与被Fg和Fc感染的小麦穗所描述的症状惊人地相似[4.].
花卉组织的显微镜分析强调了在感染的早期阶段的特异性表皮细胞类型发挥的潜在作用。镰刀菌素反复观察到菌丝缠绕在大量的宏观毛发上,呈现出典型的琥珀棕色变色。在这些毛发的基部反复观察到球状真菌结构,这表明这些细胞类型是最容易穿透的目标。人们广泛认识到两种抗食源性细菌的成分;对初次感染的抵抗力(第一类)及对头部内扩散的抵抗力(第二类)[12].大麦的PALEA和LEMMA组织已被证明表达不同水平的I型阻力,前者比后者更容易受到[33].在本研究中观察到,在本研究中观察到BD的PALEA和LEMMA组织的类似差异型,以及两种测试近交系的I型易感性的差异。II型电阻通过点接种小麦头部的点接种[4.].在接种BD Florets的PD Floculation中,FG和Fc都成功地殖民化了BD小穗组织,并通过痛苦蔓延到邻近的小穗和沿着花梗,与易感小麦品种头部的殖民化模式密切相关[4.].小麦穗部接种点上方的小穗漂白是赤霉病的另一典型症状[10].漂白与受感染小麦穗内真菌产生DON有关,也可在小麦穗内注射DON后引起[10].我们对BD感染尖峰的观察因此类似于小麦FHB的情况比大麦更紧密,这具有固有的II型电阻限制镰刀菌素最初感染区域的症状[3.].
DON已被证明在小麦中作为一种毒力因子发挥作用,在FHB发育期间抑制轴内细胞壁强化的发育[34],并在冠腐病发展期间协助茎殖化[35].相比之下,DON似乎在大麦穗的疾病发展中没有可识别的作用[34那7.或拟南芥的花组织[36].添加DON可显著增强Bd伤离体叶片上的病症状和Fg和Fc产生的分生孢子,同样也可影响接种Fg和Fc后小麦离体叶片的症状和分生孢子的产生(附加文件)4.).这强烈表明,在小麦中,在BD中的作用,在那里理解为毒力因素[34那35].
用Fg接种Bd21和Bd3-1花后检测到高浓度的DON,表明这些组织支持DON的产生镰刀菌素物种。Bd喷剂接种穗中DON的水平与之前在控制条件下接种小麦后报告的水平相似[37那38].在Bd的花组织中观察到的高水平DON与拟南芥的情况明显不同,在拟南芥中报道的水平通常非常低[23那21].已证明,在小麦侵染过程中,并不是均匀地诱导了天花粉的产生,相反,天花粉的产生是组织特异性的,在正在发育的籽粒和轴节中进行了诱导[39].在Bd和小麦中可能存在诱导trichocene产生的必要成分,而在拟南芥中却没有,这使得Bd对小麦具有吸引力。由于高侵染压力导致种子极度萎缩,目前的实验无法提供有关籽粒抗性的信息,因为整个花组织取样。然而,在未来的实验中,降低侵染压力和解剖花的部分可以为抗核侵染提供线索。
喷施整株Bd后,几乎所有植株地上部分(茎、叶鞘和叶)都出现了症状。出乎意料的是,喷淋接种植株的完整叶片也出现坏死和褪绿症状,就像接种的未受伤的脱落叶片一样。的存在镰刀菌素在BD组织中通过CLSM观察GFP表达的真菌来证实。这是我们的知识,第一份迄今为止通过A的完整叶面组织的成功感染镰刀菌素物种。离体叶片试验以前曾用于鉴定与赤霉病相关的抗性成分,但这些试验虽然使用了未伤接种,但都是使用Microdochium majus,是一种不会产生毒素的食物血红蛋白品种[40].我们已经确定,Fg和Fc可以感染Bd的花和叶组织,允许真菌毒素产生种用于这些组织的比较分析。因此,完整的Bd叶片的敏感性为建立叶部和花部抗病成分之间的关系提供了第一次机会镰刀菌素并鉴定与赤霉病抗性相关的叶组分。Bd对叶面渗透的独特敏感性镰刀菌素spp还提供了对Bd突变体进行高通量遗传筛选的潜力,以鉴定对渗透敏感性改变的品系。在观察了所有测试的Bd组织的疾病症状后,进行了组织学检查,以确定Fg和Fc如何进入该宿主。Fg和Fc对小麦头部组织的直接气孔穿透已有报道[41-43].尽管在多个实例中观察到Fg和Fc萌发菌丝与气孔直接接触的情况,但我们没有获得通过气孔进入Bd的证据。总的来说,我们的研究结果表明,虽然通过气孔可能发生穿透,但不太可能是主要的进入方式。在许多情况下,菌丝与气孔接触导致保卫细胞变成深褐色,表明可能有酚类化合物沉积。有趣的是,酚类化合物此前已被证明在小麦抗FHB疾病中发挥作用[44],同样的情况也可能发生在Bd的保卫细胞中。光镜图像显示,在叶片上出现的第一个可见症状是典型的琥珀棕色变色(与接触到的保卫细胞的颜色不同),与真菌存在和试图渗透宿主相关的宏毛基部和直接邻近的细胞。虽然这种琥珀色的颜色也表明酚类化合物,从coleoptile侵染的研究结果表明,它在真菌试图渗透的部位的积累并不能有效地防止侵染。在Fg侵染小麦期间也观察到类似的配位现象,抗性品种比感病品种更明显[45].在Bd的感染过程中,荚膜蛋白似乎产生了感染钉,并通过细胞之间的生长进入细胞。这与在小麦上观察到的感染相似[43].完整BD叶片表面的SEM分析表明毛细胞的渗透可以是病原体的优选进入途径。我们观察了角质层,生长和分支在宏观毛的底部的渗透。宏毛位于血管束上方,瞄准它们的初始渗透底座,使病原体几乎直接进入血管束,从而能够快速扩散到相邻的组织[46].这是一个有趣的发现,与之前对分离小麦颖片的研究有关,在分离小麦颖片中,Fg被观察到通过短毛细胞(称为刺毛)渗透和入侵宿主组织[47])。普雷奇及同事还注意到FG菌丝和刺毛(也称为乳头细胞)在小麦上进行关联[42,尽管他们没有对相互作用进行详细调查。比较感染的花和叶组织的显微镜图像显示惊人的相似。镰刀菌素观察到菌丝特异性靶向两种组织中的毛发,其中形成关于BMH的球状悬垂结构。作为宿主对渗透尝试的宿主反应,在花卉和叶面组织中发生酚类化合物的积累。这些相似之处支持调查机制的想法镰刀菌素对叶面组织的感染可能与花组织的抗性机制直接相关到FHB。
通过接触菌丝塞接种根组织也能成功感染。但分生孢子产生的感染压力并不能诱导感染,是否可以直接从分生孢子进行感染,还是需要菌丝进行感染尚待确定。感染早期通过观察皮层内和细胞间真菌菌丝的颜色变化来证实。即使在感染后期,真菌菌丝也被排除在中柱之外,类似于最近在小麦中报道的情况[41].结合对茎基部症状发展的观察,这些结果表明Bd也可用于模拟冠腐病和根腐病。
其他研究人员已经观察到Bd种质资源对生物和非生物胁迫的不同反应,这表明Bd种质资源中自然发生的等位变异可能为了解农艺重要性状响应的机制提供了线索[48那49].在分离的Bd小花上接种Fg分生孢子,发现Bd21和Bd3-1系间真菌发育存在数量差异。有趣的是,在离体叶片试验中,这两个品系的敏感性也存在差异,其中最显著的差异是在Bd3-1中发生了广泛的褪绿。有趣的是,在受损的Bd21和Bd3-1叶片上施用DON也导致了对褪绿病发展的不同反应,这表明这两个品系对Fg的不同反应至少部分是由于对DON敏感性的不同。由Bd21和Bd3-1杂交得来的种群的可用性(http://www.modelcrop.org),将有助于绘制这些品系对DON和叶面感染的不同易感性的遗传图谱。此外,研究广泛的二倍体、四倍体和六倍体Bd材料将有望揭示不同水平和机制的抗性镰刀菌素.
此前有报道将Bd作为水稻抗性研究的模型Magnaporthe Grisea.[48].目前的研究首次详细报道了Bd作为一种坏死营养真菌引起的小麦疾病的潜在模型。
结论
我们在此证明了两者之间的相容反应镰刀菌素物种和BD并建立了一种新的致病系统,用于研究遗传单象间模型物种中FHB抗性的机制。BD尖峰上的疾病症状和在花组织中的DON的积累与小麦头上的那些非常相似。Futhermore,我们确定了对抵抗力的自然发生的变化镰刀菌素在BD Radiots和Report中的物种第一次成功镰刀菌素完整叶面组织的感染。花卉和叶面组织的感染高度相似,强烈暗示从一个组织到另一个组织的结果直接相关性。BD和小麦之间的Synteny非常高,使得可以直接翻译关于特定基因在BD中抗性的特定基因在小麦的同行中的作用。这与功能基因组序列的可用性和功能基因组学的可用性一起携带,使BD能够成为调查抗性的重要模型物种镰刀菌素物种并提供与小麦和其他谷物作物直接相关的信息。
方法
维护和准备镰刀菌素培养液
从约翰英尼斯中心的培养收集的产don的Fg (UK1和S1)分离物被整个使用。共聚焦显微镜下观察Fc(由爱尔兰都柏林大学F. Doohan博士提供)中产生don的组成性GFP表达分离物(FcGFP1)。在绿豆(MB)液体培养基中产生分生孢子,并在25°C下摇匀7天,如前所述制备[50].取分生孢子,用消过毒的平纹布过滤培养液,3000 g离心5 min,洗涤一次,用1 × 10浓度的无菌蒸馏水(SDW)重新悬浮6.分生孢子毫升-1保存至-20°C。
Brachypodium线和生长条件
Broachypodium distachyon.自交系Bd21和Bd3-1 [51始终使用。将BD种子发芽并在湿滤纸上在湿滤纸上在5℃下孵育5天。然后将种子在15℃下在黑暗中孵育24小时,然后在20℃下暴露于16 h / 8h光暗循环24小时。然后将种子种植在8×8×10cm的罐中,填充50%泥炭和沙子,与50%John Innes 2 Loam堆肥混合,并放置在22°时的相对湿度(RH)的上升湿度(RH)。C。从16 h / 8h高暗循环中生长的植物获得叶面组织,而植物在20 h / 4h光暗循环中生长以获得花组织。
Brachypodium喷、点、胚芽和根接种、潜伏期和症状评估
整株喷施FgUK1孢子悬浮液(1 × 10)5.分生孢子毫升-1),用0.05%吐温20修订,使用手持式先生直到耗尽。将喷涂的植物置于塑料盖下并定期雾化,SDW将相对RH增加至约90%,直至接种后3天(DPI),当移除并雾化停止时。使用三星NV7数码相机拍摄疾病症状。通过在两个相邻的小花之间插入一件(2×8mm)的滤纸(2×8mm)来进行花点接种。分析悬浮液(5μl1×106.分生孢子毫升-1)FG UK1小心地应用于滤纸。接种后,将植物处理为上述喷雾接种。通过视觉评估量化花卉症状发展,并且在2,4和8 dpi中计数感染的小花的数量。
以Bd幼苗为试验材料,在20℃、16 h/8 h光照-暗循环条件下培养5 d,对萌发的Bd幼苗进行根和胚芽鞘侵染研究。用菌丝塞(直径5毫米)接种用于根感染的幼苗,菌丝塞距离马铃薯葡萄糖琼脂(PDA)在20℃下生长14天的菌落的生长边缘,并用PDA塞作为对照。用1 × 10的分生孢子悬浮液接种胚芽鞘6.分生孢子毫升-1),并以无菌水作对照。
喷施Fg S1或Fc GFP1孢子悬浮液(1 × 10)后21 d采收Bd21和Bd3-1花5.分生孢子毫升-1N .液体2 gydF4y2Ba磨成细粉。DON检测和定量采用ELISA竞争免疫分析法(AgraQuant)®如罗默实验室新加坡私人有限公司(Romer Labs Singapore Pte Ltd))。
离体叶片的接种、培养和症状评价
从21日龄植株上取下叶片,切至5厘米长,在中脉相对两侧的两个位置,用巴斯德玻璃吸管在近轴面上轻轻挤压。叶片切片放置在10 × 10平方厘米的塑料盒中,其中含有0.8%的水琼脂,并按照之前报道的小麦和大麦处理[25].每个盒子包含来自不同植物的八个叶子部分。液滴(10μl)的共分悬浮液(1×106.分生孢子毫升-1)用0.05%Tween 20进行修复,沉积在每个伤口部位上。在其他实验中,用DON(75μm)修正结合悬浮液。使用0.05%Tween 20(10μl)的SDW类似地进行嘲弄接种。
在单独的实验中,用FG类似地接种未解压缩的叶子或通过加入唐(15,75和150μm,用0.01%吐温20)进行。板盖的内表面用SDW雾化以将100%RH保持在22℃下在16h / 8h光暗循环下在22℃下孵育平板。每24小时记录疾病症状,使用Image-J软件测量病变尺寸[52].
光学显微镜
将BD叶片和花朵在70%乙醇下在70℃下清除1小时以除去叶绿素。在叶蛋白蓝或苯胺蓝(0.1%)中染色样品1分钟(1:1:1,乳酸:甘油:H.2 gydF4y2BaO),用15 M水合氯醛溶液冲洗。样品被安装在40%甘油中,用尼康Eclipse 800显微镜观察,用Pixera Pro ES 600数码相机拍照。解剖接种后的外稃和外稃组织,清除叶绿素,苯胺蓝染色,光镜下观察。
共聚焦显微镜
使用切片系统(vibriaTome 1000加)解离24,48,72和96 h后的横截面(接种和非接种)的根(接种和非接种),并在SDW中的玻璃载玻片之间置于接种(HPI)。在用488nm氩离子激光激发的共聚焦显微镜(Leica DMR SP1)下分析根部,并在505-555nm处检测。在580-680nm处检测到细胞壁和叶绿体的自体荧光。
扫描电子显微镜
完整的BD叶片部分通过使用O.C.T安装在铝片上。化合物(BDH),进入液氮溶解,然后转移到连接到Zeiss Supra 55 VP Feg扫描电子显微镜上的Alto 2500冷冻转移系统(GataN)的低温静量。然后将样品用铂(10mA,-110℃)溅射涂覆,并在显微镜主室的低温阶段在-130℃下在3kV上成像。替代固定方法用于从BD叶的表面去除蜡晶,并允许观察子内心结构。在FAA(3.7%甲醛,5%乙酸,50%乙醇)中,在20℃下固定叶片部分约4小时,随后通过乙醇系列脱水。临界点干燥后,使用3 kV的加速电压涂有金色并在飞利浦XL30 Feg显微镜中检查。
统计分析
使用GENSTAT版本9.1 (Lawes Agricultural Trust, Rothamsted Experimental Station, UK)软件包,通过广义线性模型(GLM)分析疾病严重程度、分生孢子产量、DON积累和病变面积数据。单独的治疗与未配对的对照组进行比较t- 在glms内。
参考文献
- 1.
谷物镰刀菌病:物种复杂和相关霉菌毒素谱,在欧洲。acta botanica sinica(云南植物学报),1998,30(4):531 - 534。
- 2.
Desmond Oj,礼仪JM,Sephenens AE,Maclane Dj,Schenk PM,Gardiner DM,Munn Al,Kazan K:The镰刀菌素真菌毒素脱氧雪腐镰刀菌醇引起小麦过氧化氢的产生、程序性细胞死亡和防御反应。植物营养与肥料学报。2008,29(6):741 - 746。10.1111 / j.1364-3703.2008.00475.x。
- 3.
杜绝na,eudes f:谷物中的trichothecenes。国际分子科学杂志。2009,10:147-173。10.3390 / IJMS10010147。
- 4.
Parry DW,Jenkinson P,McLeod L:镰刀菌素小谷物谷物中的耳朵枯萎(scab) - 评论。植物病理学。1995年,44:207-238。10.1111 / J.1365-3059.1995.TB02773.x。
- 5.
Tóthb,mesterházya,horvátha,bartókt,varga m,varga j:中欧孤立的遗传变异镰刀菌素graminearum物种复杂。acta botanica sinica(云南植物学报),2005,31(6):643 - 648。10.1007 / s10658 - 005 - 0296 - y。
- 6.
谷物和动物饲料的全球污染综述镰刀菌素霉菌毒素。动物饲料科学与技术。1999年,78:21-37。10.1016 / S0377-8401(98)00278-8。
- 7.
Maier FJ,Miedaner T,Hadeler B,Felk A,Salomon S,Lemmens M,Kassner H,Schäfer:通过基因破坏Trichodiene合酶(Tri5)基因在三个田间分离的基因中断的大麦和玉米中的Trichothecenes参与不同的趋化型和毒力。分子植物病理学。2006,7:449-461。10.1111 / J.1364-3703.2006.00351.x。
- 8。
关键词:脱氧雪腐镰刀菌烯醇,免疫调节,细胞和分子机制毒理学通报。2004,31(4):531 - 534。10.1016 / j.toxlet.2004.04.023。
- 9。
Rocha O,Ansari K,Doohan FM:Trichothecene mycoToxins对真核细胞的影响:综述。食品添加剂和污染物。2005,22:369-378。10.1080 / 02652030500058403
- 10.
Lemmens M, Scholz U, Berthiller F, Dall’asta C, Koutnik A, schuhacher R, Adam G, Buerstmayr H, Mesterházy A, Krska R, Ruckenbauer P:解毒真菌毒素脱氧雪腐镰刀菌醇的能力定位于小麦抗枯萎病的一个主要数量性状位点。植物与微生物的相互作用。10.1094 / mpmi - 18 - 1318。
- 11.
陈志强,陈志强,陈志强:小麦赤霉病抗性QTL定位及分子标记辅助选择研究进展。植物育种。2009、128:1-26。10.1111 / j.1439-0523.2008.01550.x。
- 12.
SCHROEDER HW,Christensen JJ:影响小麦抵抗造成的因素赤霉菌属菌.植物病理学杂志。1963,53:831-838。
- 13.
Mesterházy A:小麦对赤霉病的抗性类型及组成。植物育种。1995,19(4):534 - 534。10.1111 / j.1439-0523.1995.tb00816.x。
- 14.
小麦抗逆性的自然机制镰刀菌素Trichothecenes。欧洲杂志植物病理学。2008,121:411-423。10.1007 / s10658-007-9266-x。
- 15.
Cuthbert Pa,Somers DJ,Thomas J,Cloutier S,Brulé-Babel A:精细映射Fhb1,控制镰刀镰刀镰刀镰刀枯萎病的主要基因。理论和应用的遗传学。2006,112:1465-1472。10.1007 / s00122-006-0249-7。
- 16.
Cuthbert PA, Somers DJ, Brulé-Babel A:地图Fhb2在6BS染色体上:一个基因控制镰刀菌素面包小麦的头部枯萎场抵抗力(小麦l .)。基因工程学报。2007,29(4):429-437。10.1007 / s00122 - 006 - 0439 - 3。
- 17.
QI LL,Pumphrey Mo,Friebe B,Gill BS:与基因外星血栓分子的分子细胞遗传学表征Fhb3对于抗镰刀菌头的抗性,小麦枯萎病。理论和应用的遗传学。2008,117:1155-1166。10.1007 / s00122-008-0853-9。
- 18.
薛S,李克,贾H,徐F,林F,唐米,王Y,y,xu,张l,kong z,ma z:精细映射Fhb4,一个主要的QTL调理抵抗力镰刀菌素面包小麦感染(小麦l .)。基因工程学报,2010,31(4):489 - 494。10.1007 / s00122 - 010 - 1298 - 5。
- 19。
Amatulli Mt,Spadaro D,Gullino Ml,Garibaldi A:分子鉴定镰刀菌素意大利稻瘟病相关菌群及其致病性评价。植物病理学杂志。2010,59:839-844。10.1111 / j.1365-3059.2010.02319.x。
- 20。
Huala E,Dickerman Aw,Garcia-Hernandez M,Weems D,Reiser L,Lafond F,Hanley D,Kiphart D,Zhuang M,Huang W,Mueller La,Bhattacharya D,Bhaya D,Sobla BW,Bevis W,Meinke DW,城镇CD,Somerville C,Rhee Sy:拟南芥信息资源(TAIR):用于模型工厂的全面数据库和基于Web的信息检索,分析和可视化系统。核酸研究。2001,29:102-105。10.1093 / nar / 29.1.102。
- 21.
城市M,Daniels S,Mott E,Hammond-Kosack K:拟南芥对谷物穗枯病真菌病原体敏感吗镰刀菌素graminearum和镰刀菌素culmorum.植物杂志。2002,32:961-973。10.1046 / J.1365-313x.2002.01480.x。
- 22.
Chen X, Steed A, Harden C, Nicholson P:表征拟南芥蒂利亚纳-镰刀菌素graminearum生态型相互作用与抗性变化的识别。分子植物病理学。2006,7:391-403。10.1111 / J.1364-3703.2006.00349.x。
- 23.
王志强,王志强,王志强:NPR1和EDS11对寄主抗性的影响镰刀菌素culmorum在拟南芥的芽和花中植物营养与肥料学报。2008,29(6):641 - 646。10.1111 / j.1364-3703.2008.00488.x。
- 24.
Savitch LV, Subramaniam R, Allard GC, Singh J: GLK1 '调控'编码疾病防御相关蛋白并赋予抗性镰刀菌素graminearum在拟南芥.生物化学与生物物理研究通讯。2007年,359:234 - 238。10.1016 / j.bbrc.2007.05.084。
- 25.
Chen X, Steed A, Travella S, Keller B, Nicholson P:镰刀菌素graminearum利用乙烯信号传导来定植二坐子和单子叶植物。新的植物学家。2009,182:975-983。10.1111 / J.1469-8137.2009.02821.x。
- 26.
Draper J, Mur LAJ, Jenkins G, Ghosh-Biswas GC, Bablak P, Hasterok R, Routledge APM:Broachypodium distachyon..草类功能基因组学新模式系统。植物生理学报。2001,27(4):449 - 454。10.1104 / pp.010196。
- 27.
国际短柄草倡议:模型草的基因组测序和分析Broachypodium distachyon..自然。2010年,463:763-768。10.1038 / Nature08747。
- 28.
霍n, Vogel JP, Lazo GR, You FM, Ma Y, McMahon S, Dvorak J, Anderson OD, Luo MC, GuYQ:结构表征Brachypodium基因组及其与稻米和小麦的同族关系。植物分子生物学。2009,70:47-61。10.1007 / s11103-009-9456-3。
- 29.
格里菲斯S,Sharp R,Foote Tn,Bertin I,Wanous M,读者S,Colas I,Moore G:分子表征PH1.作为多倍体小麦的主要染色体配对位点。自然科学。2006,439:749-752。10.1038 / nature04434。
- 30.
Vain P, Worland B, Thole V, McKenzie N, Alves SC, Opanowicz M, Fish LJ, Bevan MW, Snape JW:农杆菌属-介导的温带草的转变Broachypodium distachyon.(基因型BD21)用于T-DNA插入诱变。植物生物技术杂志。2008,6:941-941。
- 31。
Xu XM, Nicholson P, Thomsett MA, Simpson D, Cooke BM, Doohan FM, Brennan J, Monaghan S, Moretti A, Mule G, Hornok L, Beki J, Tatnell J, Ritieni A, Edwards SG:小麦赤霉病病原菌复合体与环境条件的关系。植物病理学杂志,2008,33(4):429 - 434。10.1094 /发朵- 98 - 1 - 0069。
- 32。
Weise MV:小麦病害纲目。美国植物病理学会出版社,美国圣保罗,明尼苏达州,1987,112-
- 33.
Lewandowski Sm,Bushnell WR,Evans CK:在田间菌群中分布菌丝菌落和病变接种镰刀菌素graminearum.植物病理学杂志,2006,26(6):567-581。10.1094 /发朵- 96 - 0567。
- 34.
Jansen C, von Wettstein D, Schafer W, Kogel KH, Felck A, Maier FJ:干扰野生型和trichodiene合成酶基因的大麦和小麦穗侵染模式镰刀菌素graminearum.美国国家科学院院刊。2005年,102:16892 - 16897。10.1073 / pnas.0508467102。
- 35.
关键词:小麦,冠腐病,真菌毒素,脱氧雪腐镰刀菌醇镰刀菌素graminearum和Fusarium pseudogroinearum..生理和分子植物病理学。2006,69:73-85。10.1016 / J.PMPP.2007.01.003。
- 36.
Cuzick A,Urban M,Hammond-Kosack K:镰刀菌素graminearum基因缺失突变体map1和tri5揭示致病性要求的相似之处和差异引起拟南芥和小麦花组织的疾病。新的植物学家。2008,177:990-1000。10.1111 / J.1469-8137.2007.02333.x。
- 37.
真菌毒素脱氧雪腐镰刀菌醇(deoxynivalenol)在小麦穗部的分布镰刀菌素graminearum.加拿大植物病理学杂志。2000,22:280-285。10.1080 / 07060660009500476
- 38.
GOSMAN N,Chandler E,Thomsett M,Draeger R,Nicholson P:分析耐镰刀菌长的关系与冬小奥诺伊酚苯甲苯酚的耐氧化苯酚耐受耐受性®.acta botanica sinica(云南植物学报),2005,34(5):457 - 461。10.1007 / s10658 - 004 - 2733 - 8。
- 39.
Ilgen P,Hadeler B,Maier FJ,SchäferW:开发内核和Rachis节点诱导TrichotheNe途径镰刀菌素graminearum在麦穗感染期间。植物营养与肥料学报,2009,28(4):489 - 498。
- 40。
布朗Ra,Mascher F,Golebiowska G,Hofgaard是:在分离的叶片测定中检测到小麦部分疾病抗性的组分接种Microdochium majus用一、二、三棵幼苗扩叶。植物营养与肥料学报,2006,29(4):429 - 434。10.1111 / j.1439-0434.2006.01084.x。
- 41。
王志强,王志强,王志强,等。小麦根腐病和冠腐病的侵染过程及对根腐病和冠腐病的响应镰刀菌素culmorum.植物病理学。
- 42。
关键词:小麦穗状芽孢杆菌,真菌,防御反应基因,生长发育镰刀菌素graminearum.植物与微生物的相互作用。2000,13:159-169。10.1094 / MPMI.2000.13.2.159。
- 43。
Kang K,Buchenhauer H:细胞学和超微结构的小麦尖峰感染镰刀菌素culmorum.Mycological研究。2000,104:1083-1093。10.1017 / S0953756200002495
- 44。
Boutigny AL, Barreau C, atanasova - penicon V, verda - bonnin MN, Pinson-Gadais L, richardforget F:阿魏酸,一种有效的B型毛绿烯生物合成抑制剂Tri.基因表达在镰刀菌素液体培养。生物工程学报,2009,32(4):453 - 457。
- 45.
康志,黄磊,韩强,张华:小麦抗性株系穗部反应的细胞学和免疫细胞化学研究。Sumai 3和易感cv。小燕22日以感染为由镰刀菌素graminearum.acta botanica sinica(云南植物学报),2008,30(6):653 - 656。10.1007 / s10658 - 007 - 9230 - 9。
- 46.
康K,碧塞尔H:受感染麦尖峰镰刀菌毒素的免疫细胞化学定位镰刀菌素culmorum.植物营养与肥料学报,2003,22(4):429 - 434。10.1006 / pmpp.1999.0233。
- 47.
Rittenour WR, Harris SD: An在体外感染相关形态发生分析方法镰刀菌素graminearum.分子植物病理学。2010,11:361-369。10.1111 / J.1364-3703.201010.00609.x。
- 48.
Routledge APM, Shelley G, Smith JV, Talbot NJ, Draper J, Mur LAJ:Magnaporthe Grisea.与模型草的相互作用Broachypodium distachyon.与大米(Oryza Sativa)相似的比较。分子植物病理学。2004,5:253-265。10.1111 / J.1364-3703.2004.00224.x。
- 49.
罗宁,刘军,于旭,蒋勇:干旱响应的自然变化Broachypodium distachyon..Physiologia plantarum。2010,141:19-29。
- 50.
马建平,王志强,王志强,等。拟南芥NPR1基因的克隆及表达对小麦枯萎病抗性的影响。植物与微生物的相互作用。2006,19:123-129。10.1094 / mpmi - 19 - 0123。
- 51。
Vogel JP, Gu YQ, Twigg P, Lazo GR, Laudencia-Chingcuanco D, Hayden DM, Donze TJ, Vivian LA, Stamova B, colman - derr D:模式草EST测序和系统发育分析Broachypodium distachyon..遗传工程学报,2006,27(1):1 - 8。10.1007 / s00122 - 006 - 0285 - 3。
- 52。
Abramoff MD,Magelhaes PJ,RAM SJ:带imagej的图像处理。生物学学国际。2004,11:36-42。
确认和资金
我们感谢Philippe Vain博士和Vera Thole博士提供了短柄花种子。我们还感谢Thomas Girin博士和Kim Findlay夫人在扫描电子显微镜方面的专业知识,以及英国生物技术和生物科学研究理事会(BBSRC)对这项研究的资助。
作者信息
隶属关系
通讯作者
附加信息
作者的贡献
AP进行了所有的Bd喷雾和点接种、病害评估和离体叶片分析以及正常光照和扫描电镜分析。GB进行了Bd根接种和根组织CLSM分析,并参与了Bd离体叶片分析。AS和PN参与了研究的设计和监督,并参与了手稿的起草。所有作者都已阅读并批准了最终稿。
电子补充材料
12870 _2011_882_moesm1_esm.tiff
附加文件1:Bd21和Bd3-1叶子上Fg感染后症状的比较。伤口接种Fg UK1 120 h后Bd21和Bd3-1的叶片症状。(TIFF 740 KB)
12870_2011_882_moesm2_esm.tiff.
附加文件2:BD21和BD3-1脱离叶片上FG合成生产的比较。将FG UK1接种到BD21和BD3-1脱离的叶片后,共分享产量,7 DPI。(TIFF 188 KB)
12870 _2011_882_moesm3_esm.tiff
附加文件3:Bd21和Bd3-1小穗接种Fg点后坏死症状发展的比较。接种Fg UK1的Bd21和Bd3-1小穗点的病害进展曲线下面积(AUDPC)。(TIFF 192 KB)
12870 _2011_882_moesm4_esm.tiff
附加档案4:唐治疗对脱离小麦叶片感染FG或Fc的影响。a)疾病进展曲线(audpc)在伤口接种小麦(cv. paragon)后的病变(cv. paragon)与fg UK1和Fc GFP1有或没有修正的唐(75μm)。b)在小麦叶片(CV.CV.)在伤口接种后的共分享产量(6DPI),其用FG UK1和FC GFP1与唐(75μm)进行或不修改。(TIFF 246 KB)
作者为图像提交的原始文件
权利和权限
本文由BioMed Central Ltd授权发表。这是一篇基于知识共享署名许可协议(http://creativeCommons.org/licenses/by/2.0.),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
佩拉尔迪,贝卡里,斯蒂德。et al。Broachypodium distachyon.:研究镰刀虫头的新探病系统枯萎等镰刀菌素疾病的小麦。BMC植物杂志11,100(2011)。https://doi.org/10.1186/1471-2229-11-100
已收到:
公认:
发表:
关键字
- 镰刀菌素
- Broachypodium distachyon.
- 小麦
- deoxynivalenol
- model-to-crop翻译
- 抗病性
- host-pathogen交互