摘要
背景
以细菌天冬氨酸激酶,酸酸酯异α和泰拉(哌膦酸脱氢酶)命名的动作结构域是一种调节结构域,其用作反馈调节氨基酸代谢酶中的氨基酸结合位点。我们之前鉴定了一种新型的含有型ACT域的蛋白质系列,交流T域repeat (ACR)蛋白家族拟南芥.ACR家族的成员,ACR1到ACR8,包含四个延伸到整个多肽的ACT结构域副本。在这里,我们描述了4个新的含有ACT结构域的蛋白,即ACR9到ACR12,在拟南芥.ACR9和ACR10蛋白包含三个ACT结构域副本,而ACR11和ACR12蛋白有一个假定的过境肽,后面跟着两个ACT结构域副本。这些植物ACR蛋白的功能目前尚不清楚。
结果
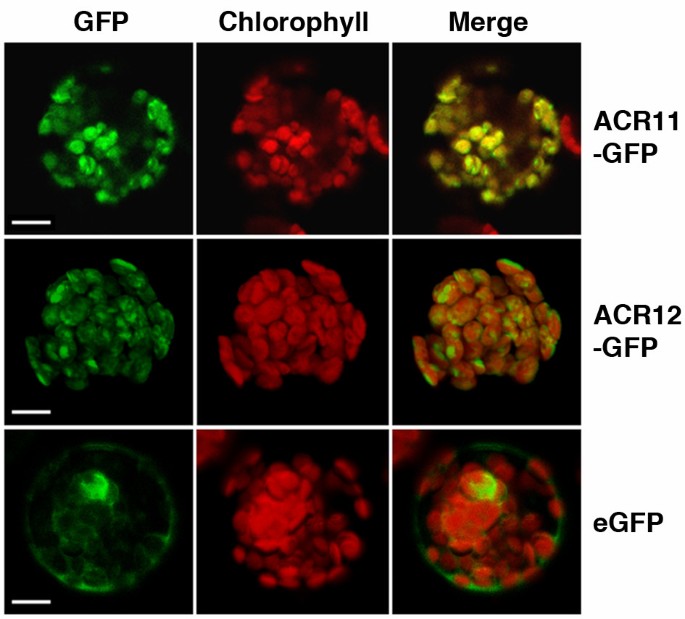
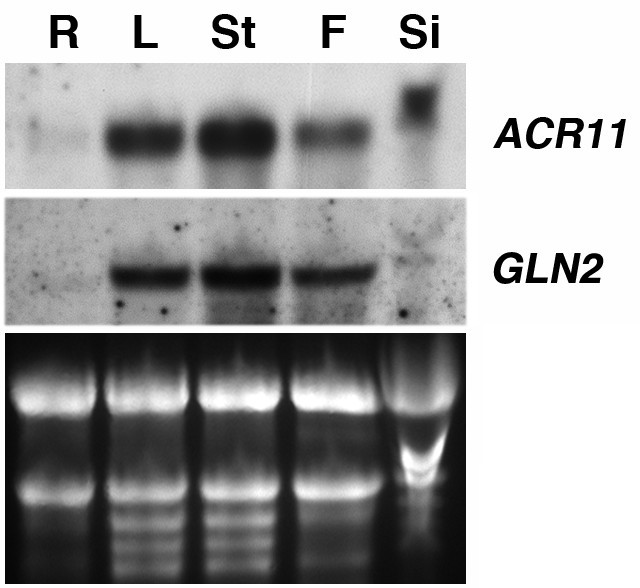
预测ACR11和ACR12蛋白以叶绿体为靶点。利用原生质体瞬时表达实验证明拟南芥ACR11-和acr12 -绿色荧光融合蛋白定位于叶绿体。分析一个ACR11启动子-β-葡萄糖醛酸酶(GUS)的融合拟南芥揭示了GUS活性主要在成熟的叶片和萼片中检测到。有趣的是,共表达分析显示GLN2编码氯塑料谷氨酰胺合成酶的组成基因网络中的最高互等级ACR11.我们用RNA凝胶印迹分析证实ACR11和的相似吗GLN2从6周大开始就在不同的器官里拟南芥.此外,表达ACR11和GLN2在2周龄时,蔗糖和光/暗处理是否高度协同调控拟南芥幼苗。
结论
本研究报道了4个新的ACT结构域重复蛋白,ACR9到ACR12,在拟南芥.ACR11和ACR12蛋白定位于叶绿体,并在叶绿体中表达ACR11和GLN2是高度协调。这些结果表明ACR11和GLN2基因可能属于相同的功能模块。的拟南芥ACR11蛋白可能是叶绿体中与谷氨酰胺代谢或信号转导有关的调节蛋白。
背景
氮是植物生长和发育中最重要的营养素之一。植物可以利用不同形式的氮,包括硝酸盐,铵和氨基酸。大多数植物使用无机氮酸硝酸盐作为初级氮源。通过硝酸还原酶和亚硝酸盐还原酶将从土壤中取出的硝酸盐降低至铵。通过谷氨酰胺合成酶(GS)/谷氨酰胺 - 氧基氟化氨基转移酶(Gogat)循环可以将来自含氮化合物从其他含氮化合物重新氧化的氨基铵分化为谷氨酰胺和谷氨酸。谷氨酰胺和谷氨酸是用于合成其他氨基酸和植物中的含氮化合物的主要氨基供体[1].除了它们在蛋白质合成和代谢中的作用外,谷氨酰胺和谷氨酸还可以用作植物中的信号分子[2- - - - - -6].
谷氨酰胺和谷氨酸的合成也依赖于α-酮戊二酸的可得性。在细菌中,氨同化的碳骨架,α-酮戊二酸,表示氮缺乏,而谷氨酰胺,完全胺化的产物,通常表示氮充足[7].在大肠杆菌,谷氨酰胺合成酶基因的表达及其酶活性受谷氨酰胺和α-酮戊二酸的可用性调控[7- - - - - -10].在低谷氨酰胺/α-酮戊二酸的响应大肠杆菌PII蛋白(编码glnB)通过Glnd,尿素三烷烃/尿嘧啶除去酶尿苷化[11,12].尿苷化的PII与腺苷转移酶相互作用到死烯酸,并激活GS酶(编码glnA)[11,13].此外,NtrB/NtrC双组分系统将激活的表达glnA在限氮条件下[9,14- - - - - -19].相比之下,在谷氨酰胺/α-酮戊二酸高的反应中,尿苷化的PII被GlnD去尿苷化。未修饰的PII蛋白与腺苷转移酶相互作用,从而导致GS酶腺苷化和失活[11,12].未修饰的PII蛋白也与NtrB/NtrC双组分系统相互作用,使蛋白的表达失活glnA[9,14- - - - - -19].因此,细菌PII蛋白是α-酮戊二酸和腺苷酸能量电荷的传感器,而GlnD是谷氨酰胺的传感器[20.,21].
关于植物中氨基酸的感知和信号传递,我们知之甚少。已识别pii样蛋白拟南芥和大米(22,23].然而,细菌Glnd同源物尚未在植物中鉴定。的大肠杆菌传感器蛋白GlnD由一个核苷酸转移酶结构域、一个核苷酸水解酶结构域和两个c端ACT结构域组成。研究表明,GlnD的c -末端ACT域可能通过与谷氨酰胺的结合来调节其活性[21].
ACT域以细菌天冬氨酸激酶、chorismate mutase和TyrA (prephenate dehydrogenase)命名,是一个调节域,在反馈调节的氨基酸代谢酶中作为氨基酸结合位点[24- - - - - -28].例如,大肠杆菌3-磷酸糖脱氢酶(PGDH),丝氨酸中的关键酶,是通过丝氨酸调节的反馈。C-Terminal Act域大肠杆菌PGDH是其变构效应器丝氨酸的结合位点[24,29,30.].其他氨基酸代谢酶如乙酰羟基酸合酶[31,苏氨酸脱氨酶[32,33和苯丙氨酸羟化酶[34]还包含监管法案域名。此外,ACT结构域也发现了几种转录因子[35- - - - - -39].
在此之前,我们发现了一种新的ACT结构域蛋白家族拟南芥,其成员包含四个交流T域repeats(“ACR”蛋白质家庭)[40].除了ACT结构域之外,ACR蛋白的氨基酸序列与数据库中的任何已知的酶或基序没有同源性(http://www.ebi.ac.uk/tools/Interproscan/).尽管已经在水稻中发现了与ACR家族同源的蛋白质[41- - - - - -43[这些ACR蛋白的功能在很大程度上是未知的。
在这份报告中,我们确定了另外四个含有ACT结构域的蛋白拟南芥.这些蛋白质由三个或两个ACT结构域的副本组成。这些蛋白质的氨基酸序列没有任何可识别的基序,除了ACT结构域。这些新的含有ACT结构域的蛋白被归类为ACR家族的新成员。我们发现,新鉴定的ACR11和ACR12蛋白定位于叶绿体。有趣的是ACR11被共同调节GLN2编码叶绿体谷氨酰胺合成酶(GS)的基因。可能的函数拟南芥本文讨论了ACR11。
结果
四部小说的鉴定ACR基因在拟南芥
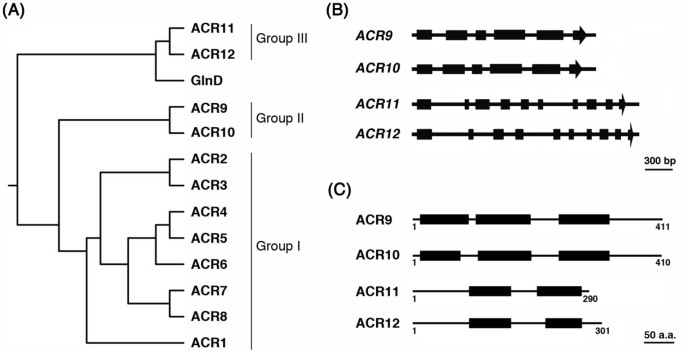
我们之前使用ACT结构域(Pfam01842)和细菌GlnD序列进行鉴定拟南芥ACR1到ACR8蛋白,包含四个ACT结构域的副本[40].除了这些ACR蛋白外,我们还鉴定了一种编码的含四种新型ACT结构域的蛋白质At1g16880,At2g36840,At2g39570和AT5G04740,其中包含两个或三个ACT域的副本。因为这些蛋白质也含有交流T域r我们建议将这些蛋白分类为ACR家族的新成员。我们将编码的蛋白质命名为At2g39570,At2g36840,At1g16880和AT5G04740基因ACR9、ACR10、ACR11和ACR12。根据氨基酸序列比对和系统发育分析,ACR1 ~ ACR12蛋白被分为三组(图1)1).最初鉴定的ACR1至ACR8蛋白属于A组。新识别的ACR9至ACR12分别属于II组(ACR9和ACR10)和第III组(ACR11和ACR12)(图1).
ACR9.和ACR10在外显子和内含子的大小和排列方面几乎相同的基因结构(图1 b).相比之下,ACR11和ACR12具有相同数量的外显子和内含子,但有些内含子的大小不同(图1 b).我们使用计算机程序InterProScan (http://www.ebi.ac.uk/tools/Interproscan/)分析ACR9至ACR12的域组成。ACR9和ACR10蛋白质含有三个动作域的副本,而ACR11和ACR12蛋白质含有两个ACT域的副本(图1 c).与ACR1到ACR8蛋白类似,ACR9到ACR12蛋白没有InterProScan发现的其他已知结构域或基元。
序列的分析拟南芥ACR11和ACR12
根据GenBank中的序列,设计了特异性引物,采用RT-PCR方法扩增了该菌株的全长cdnaACR11和ACR12.ACR11和ACR12蛋白分别有290和301个氨基酸残基。ACR11和ACR12的氨基酸序列比对显示,这两个蛋白的n端区域不是高度保守的。除了n端区域,ACR11(74 - 290残基)和ACR12(85 - 301残基)的氨基酸序列具有63%的同源性和82%的相似性(图)2).包括PSORT(包括PSORT)的几个计算机程序(http://www.psort.org/)及TargetP (http://www.cbs.dtu.dk/services/TargetP/)预测ACR11和ACR12蛋白质局部局限于叶绿体。大多数核编码的叶绿体蛋白质含有N-末端过渡肽序列,其有助于将这些蛋白质从细胞质转移到叶片上的蛋白质。在将前体蛋白质进口到叶绿体中后,将裂解过境肽。在ACR11和ACR12中,较少保守的N-末端序列可以用作过渡肽以将这些蛋白质靶向叶绿体。实际上,计算机程序氯(http://www.cbs.dtu.dk/services/ChloroP/)预测了两种蛋白中都存在转运肽,并且可能的转运肽裂解位点分别位于ACR11的52Arg-53Leu和ACR12的32Pro-33Ala之间(图2).
蛋白质BLAST分析表明,除了在光合生物体中的同源物(未显示的数据)之外,ACR11和ACR12还与细菌PII-尿嘧啶三转移酶(GLND)的动作结构域最相似。我们将动作域与拟南芥ACR11和ACR12的两个ACT域大肠杆菌GlnD和Pfam01842的ACT一致序列。预测ACT共识序列的结构形成一个βαββ ββ折叠,这与ACT域的原型结构一致大肠杆菌PGDH [24].此外,对ACT结构域的初步鉴定和比对发现,在第一个β链和第一个α螺旋之间的转弯处有一个几乎不变的甘氨酸残基,与Ser In的结合位点一致大肠杆菌PGDH [25].对ACR11、ACR12和GlnD的ACT结构域比对表明,这些序列在β1-α1环区高度保守(图)2 b).此外,不变的Gly残留物也存在于动作域中拟南芥ACR11和ACR12(图2 b).
ACR11-和ACR12-GFP定位于叶绿体
采用绿色荧光融合蛋白(GFP)和原生质体瞬时表达法检测ACR11和ACR12的亚细胞定位。全长ACR11和ACR12的前94个氨基酸融合到GFP的n端。将由花椰菜花叶病毒(CaMV) 35S启动子驱动的ACR11-和ACR12-GFP融合结构转化为ACR11-和ACR12-GFP拟南芥原生质体。共聚焦显微镜观察转化后16h的荧光信号。ACR11-和ACR12-GFP融合蛋白的绿色荧光信号与叶绿体中叶绿素的自荧光信号共定位(图)3.).相比之下,单独使用空GFP载体转化的原生质体在胞质和细胞核中都有绿色荧光信号(图)3.).这些结果表明拟南芥ACR11和ACR12蛋白定位于叶绿体。
共表达基因网络Arabidopsis ACR11和ACR12
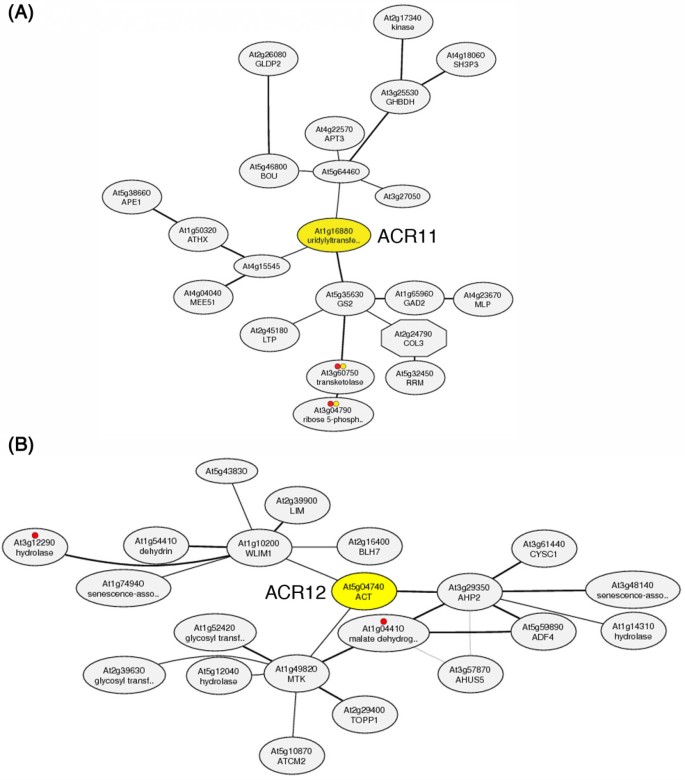
的功能拟南芥ACR11和ACR12是完全未知的。已经有人提出,参与相关生物学途径的基因通常是合作表达的[44].我们试图通过寻找与ACR11和ACR12共同表达的基因来识别它们的功能ACR11和ACR12,分别。我们获得了ACR11和ACR12来自ATTED-II数据库的共表达基因网络(http://atted.jp/)[45].具有最高相互等级(MR)的三个基因ACR11是At5g35630(GLN2,编码叶绿体谷氨酰胺合成酶;= 1.0)先生,At1g15545(编码未知蛋白质; MR = 8.5),和At5g64460(编码未知蛋白质;MR = 9.2)(图4).发现这一点很有趣ACR11和GLN2与所有其他基因相比,拟南芥基因组。相比之下,前三个基因与ACR12是At3g29350(编码AHP2,含组氨酸的磷传递素2;= 2.2)先生,At1g10200(编码WLIM1,一个成员拟南芥LIM蛋白;MR = 6.2),以及At1g49820(编码MTK1,5-甲基硫化物激酶1; MR = 7.5)(图4 b).的表达ACR12不协调监管与ACR11和GLN2在ATTED-II数据库中。
周围的共表达基因网络Arabidopsis ACR11和ACR12.(一)共表达互秩(MR)最高的3个基因ACR11是At5g35630(编码谷氨酰胺合成酶2;= 1.0)先生,At4g15545(编码未知蛋白质; MR = 8.5)和At5g64460(编码未知蛋白质;先生= 9.2)。ACR11 (At1g16880)在数据库中被注释为尿苷转移酶相关蛋白。(B)共表达互秩(MR)最高的3个基因ACR12是At3g29350(编码AHP2,含组氨酸的磷传递素2;= 2.2)先生,At1g10200(编码WLIM1,一个成员拟南芥LIM蛋白;MR = 6.2),以及At1g49820(编码MTK1, 5-甲基硫糖激酶1;先生= 7.5)。共表达基因网络ACR11和ACR12可以在待命的II网站上获得(http://atted.jp/data/locus/At1g16880.shtml和http://atted.jp/data/locus/at5g04740.shtml.).
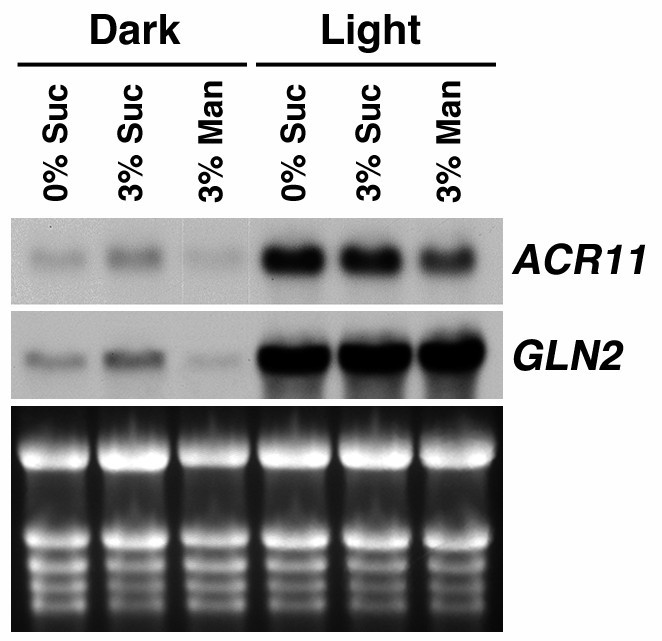
的表达ACR11和GLN2是由光和蔗糖上调的吗
我们用RNA凝胶印迹法分析ACR11和GLN2在不同的器官中拟南芥植物。稳态水平的ACR11和GLN2与叶子,茎和花朵相比,MRNA在根中较低(图5).众所周知,表达拟南芥GLN2是由光和蔗糖调节的[46].我们用RNA凝胶印迹分析来检测光和蔗糖对表达的影响ACR11和GLN2(图6).两周大拟南芥将在16 h光照/8 h暗循环条件下生长的幼苗转移到含0%蔗糖、3%蔗糖或3%甘露醇的培养基中,并在适应暗环境或连续光照条件下生长48 h。从这些样本中提取的总RNA用于RNA凝胶印迹分析。在适应黑暗的幼苗,稳定的水平ACR11和GLN2经3%蔗糖处理后,mrna含量略有增加。这种蔗糖效应与渗透变化无关,因为添加3%甘露醇不会增加积累ACR11和GLN2转录物。相比之下,稳态水平ACR11和GLN2无论培养基中添加多少蔗糖或甘露醇,光处理都能显著增加mrna的数量。的表达模式ACR11和GLN2几乎是相同的。这些结果证实了ACR11和GLN2基因在各种条件下协同表达。
ACR11promoter-GUS活动
进一步检查细胞类型和组织特异性表达ACR11基因的启动子,我们融合了ACR11对于β-葡糖醛酸酶报告基因(ACR11P-GUS)并产生稳定拟南芥转基因线。在3、5和7日龄幼苗的子叶中检测到ACR11p-GUS活性(图)7得了).有趣的是,在新生叶和成熟叶的基部未检测到ACR11p-GUS活性,这部分主要由分裂和生长的幼细胞组成(图)7汉英).在发育或成熟的花中,ACR11p-GUS活性在萼片中被检测到从顶端(高)到基部(低)的梯度(图)7 f和7 g).在成熟花中,花柱中也检测到ACR11p-GUS活性7 g).在成熟的角果中,在花梗顶端检测到ACR11p-GUS活性(图7小时).
讨论
有三组不同的ACR蛋白拟南芥
我们之前报道了8个ACT结构域重复蛋白的鉴定和特性拟南芥并分别将这些蛋白质ACR1命名为ACR8 [40].这些ACR蛋白各自含有ACT域的四个副本。在这里,我们描述了四种含有含有域的蛋白质蛋白质拟南芥.这些新的含有ACT结构域的蛋白的氨基酸序列除了在ACT结构域区域外,与最初鉴定的ACR蛋白并不相似。但是,它们也包含ACT域的多个副本。因此,我们采用了“交流T域rEpeats(ACR)“并分别命名这些蛋白质ACR9至ACR12。
氨基酸序列比对和系统发育分析将这些ACR蛋白划分为三个不同的类群。最初鉴定的ACR1到ACR8蛋白含有4个ACT结构域,属于i组。ACR9和ACR10蛋白含有3个ACT结构域,属于II组ACR蛋白。ACR9和ACR10的氨基酸序列在整个多肽中非常相似。此外,基因结构ACR9.和ACR10几乎是相同的(图1 b),这表明这两个基因最近是复制的拟南芥基因组在进化过程中。相比之下,III组ACR蛋白,包括ACR11和ACR12,包含两个ACT结构域副本。的基因结构ACR11和ACR12是相似的。然而,编码的氨基酸序列在n末端区域不保守。其余的氨基酸序列,例如氨基酸序列。ACR11的残基74至290和ACR12的残基85至301的残留物高度保守。预计ACR11和ACR12的非保守N-末端氨基酸序列预计是过渡肽,其将这些蛋白质靶向叶绿体。因此,III族ACR蛋白可以局限于叶绿体。
第III族ACR蛋白质局限于叶绿体
大多数氨基酸是在叶绿体中合成的。预计叶绿体中还可能存在一些参与氨基酸代谢或信号转导的调控蛋白。的拟南芥在这方面,III组ACR蛋白是很好的候选蛋白,因为它们被预测靶向叶绿体。我们在拟南芥验证ACR11-和ACR12-GFP融合蛋白定位于叶绿体(图)3.).去除转运肽后,成熟的ACR11和ACR12蛋白仅由两个ACT结构域组成。可以想象,ACR11和ACR12蛋白的ACT结构域可能作为氨基酸结合域。ACR11和ACR12蛋白与特定氨基酸结合后,可调节叶绿体中氨基酸生物合成酶的活性。另外,ACR11和ACR12蛋白的两个ACT结构域可能作为叶绿体中特定的氨基酸传感器,这与细菌GlnD蛋白的功能相似。它将是有趣的进一步描述的功能拟南芥ACR11和ACR12蛋白及其在其他植物中的同源物。
ACR11和GLN2处于相同的共用基因网络
涉及相关生物途径的基因通常是协调调控的[44].从待命的II数据库获得的共抑制分析(http://atted.jp)可以帮助我们识别…的功能拟南芥ACR11 ACR12。在ATTED-II数据库中ACR11和ACR12基因有不同的共同表达基因网络(图)4).这两个同源基因编码的蛋白质可能还具有不同的功能拟南芥叶绿体。有趣的是Arabidopsis ACR11和GLN2都在同一个共同表达基因网络中。而且,这两个基因共表达的相互等级在各自的基因网络中最高(图)4).众所周知,表达拟南芥GLN2是由光和糖调节的[46].我们用RNA凝胶印迹分析来检测光和蔗糖对表达的影响ACR11.有趣的是,结果与数据库中的共表达分析一致。两者的稳态水平ACR11和GLN2通过蔗糖和光照处理,信使rna增加(图)6).高度合作的表达ACR11和GLN2在我们的实验和数据库中观察到,这两个基因可能属于相同的功能模块。的GLN2编码叶绿体GS2,这是叶绿体中谷氨酰胺合成的主要酶。然而,叶绿体定位的ACR11蛋白的功能完全未知。的ACR11和GLN2基因具有最高的共表达关系拟南芥ACR11蛋白可能具有与GS2相关的功能。
之间的关系拟南芥ACR11和GS2的调控与PII-GlnD系统相似glnA细菌基因表达与GS酶活性的关系[7- - - - - -10,18].除了植物中的ACR同源物之外,ACR11的氨基酸序列与细菌传感器蛋白GLND(例如尿嘧啶烯烃酶)的动作结构域最相似。因此,ACR11(AT1G16880)在Genbank(NM_101549)中以尿嘧啶类相关蛋白作为尿嘧啶相关蛋白。细菌Glnd蛋白可以感测谷氨酰胺的可用性,可能通过C末端区域中的两个动作域来调节GS酶活性及其基因表达[21].有可能拟南芥ACR11蛋白还可以使用其动作结构域来感测谷胺中谷氨酰胺的可用性,然后调节GS2活性或谷氨酰胺代谢。
ACR11和ACR12,推定的氨基酸传感器蛋白在叶绿体中
叶绿体是植物细胞内一次生氮同化活动的场所。氨同化为谷氨酰胺是植物将无机氮转化为有机氮的主要途径。因此,预计植物可能有一种机制来感知叶绿体内谷氨酰胺的可用性。在大肠杆菌,谷氨酰胺可能作为信号分子影响氮同化基因的表达和氮代谢酶的活性[7].位于GlnD蛋白c端区域的两个ACT域被认为是细菌中的谷氨酰胺传感器[21].关于植物中氨基酸的感知和信号传递,我们知之甚少。有趣的是,ACR11和ACR12蛋白由两个ACT结构域组成,并且定位于叶绿体。可以想象,ACR11和ACR12蛋白可能具有氨基酸传感器的功能拟南芥.这些叶绿体ACR蛋白的功能有待进一步研究。
结论
虽然动作域具有高序列分歧,但这些域中存在共同的监管主题。的拟南芥ACR蛋白含有ACT结构域的多个副本,其功能在很大程度上尚不清楚。在本研究中,我们鉴定了两组新的ACR蛋白拟南芥.第二组ACR蛋白,ACR9和ACR10,有三个ACT结构域副本。而III组ACR蛋白ACR11和ACR12包含两个ACT结构域,并且定位于叶绿体。的活动ACR11启动子gus主要存在于成熟叶片中。此外,表达ACR11和GLN2是高度协调。ACR11可能作为一种调节蛋白参与谷氨酰胺代谢或感知谷氨酰胺拟南芥.
方法
植物材料及生长条件
拟南芥生态型Columbia-0在温室土壤中生长,光照16小时/暗8小时,温度为23°C。从同一批6周龄土壤生长的植物中提取根、叶、茎、花和果实总RNA。将植物转移至0%、3%蔗糖或3%甘露醇的试验中,种子播种在1.5 cm × 8 cm、250 μm目大小的尼龙网上(Tetko, Elmsford, NY, USA,目录编号:0。3-250/50),放置在Murashige和Skoog (MS)板[MS盐(Sigma-Aldrich Co., St. Louis, MO), pH调整到5.7与1N KOH, 0.8% (w/v)植物琼脂]含有3%蔗糖。4°C冷处理48 h后,垂直放置于23°C的室内,光照16 h /暗8 h循环2周。将植株和尼龙网吊起来,转移到含0%、3%蔗糖或3%甘露醇的新鲜MS培养基中,适应黑暗或在连续光照下生长48 h。
克隆的拟南芥ACR9.,ACR10,ACR11和ACR12CDNA.
2周总RNA拟南芥采用逆转录- pcr (SuperScript II RT Kit, Invitrogen公司,卡尔斯巴德,CA)扩增ACR9.(At2g39570),ACR10(At2g36840),ACR11(At1g16880),ACR12(AT5G04740)的互补。采用以下引物扩增全长cdna:ACR9., 5'-TGTTGTTGATTCATTGGCTC-3'和5'-AGTAGTAGATGAATATATTG-3';ACR10, 5'-ATAGGAGGAACAACACAAAC-3'和5'-TTACTATGAAACCCACACAG-3';ACR11,5'-aaaaggatccatggctatgcctctgcttc-3'和5'-ggggagggcctgaactgactcgtcagttg-3';ACR12,5'-agggaccggtatggcgttctcgagtctcat-3'和5'-gggggaccggtgtagctgtcaatgtcagttt-3'。将PCR产物克隆到PGEM-T易于载体(Promega Co.,Madison,Wi)中,并提供测序。的拟南芥ACR9来ACR12在Genbank(JF797174至JF797177中,验证cDNA序列并沉积。
序列分析
氨基酸序列拟南芥ACR1 (NM_125986), ACR2 (NM_122441), ACR3 (NM_179566), ACR4 (NM_202378), ACR5 (NM_126420), ACR6 (NM_111065), ACR7 (NM_118407), ACR8 (NM_101114), ACR9 (JF797174), ACR10 (JF797175), ACR11 (JF797176), ACR12 (JF797177),氨基酸残基708-890大肠杆菌GlnD (M96431)由ClustalW2以默认设置对齐(http://www.ebi.ac.uk/Tools/msa/clustalw2/).采用邻居连接算法得到系统进化树。序列比对采用BOXSHADE 3.21 (http://www.ch.embnet.org/software/BOX_form.html).InterProScan (http://www.ebi.ac.uk/Tools/pfa/iprscan/)分析ACR9 ~ ACR12的结构域组成。PSORT (http://www.psort.org/)及TargetP (http://www.cbs.dtu.dk/services/TargetP/)用于预测ACR9到ACR12的亚细胞定位。ChloroP (http://www.cbs.dtu.dk/services/ChloroP/)用于预测ACR11和ACR12的转运肽裂解位点。的ACR11和ACR12共表达基因网络取自ATTED-II数据库(http://atted.jp/).
ACR11-和ACR12-GFP融合结构
GFP表达载体PHBT,用于瞬态表达测定[47,用于构建ACR11-和ACR12-GFP融合体。一个Bam你好/stu.来自pGEM-T-的碎片ACR11包含完整长度的克隆ACR11将cDNA亚克隆到pHBT载体中,构建ACR11-GFP融合构建物。利用引物5'-GGAAGGATCCATGGCGTTCTCGAGTTCCATC-3'和5'-GGAAAGGCCTCATTGGAACAACGTCGTCATC-3', PCR扩增ACR12前94个氨基酸的n端cDNA序列。PCR产物经酶切Bam嗨stu.并在pHBT载体中克隆到GFP的n端。由此产生的结构,ACR12-GFP,包含ACR12的过境肽融合到一个GFP。得到的ACR11-和ACR12-GFP结构体,并将GFP空载体转化为拟南芥原生质体利用聚乙二醇(PEG)介导的瞬时基因表达[47[转化后16小时,在共聚焦激光扫描显微镜(510 meta Zeiss)下观察。
RNA凝胶印迹分析
拟南芥采用苯酚萃取法分离总RNA [48].总RNA (10 μg)经电泳在标准甲醛凝胶中分离,并在尼龙膜上印迹。检测ACR11和GLN2通过PCR使用以下引物产生MRNA,Digoxigenin(DIG)标记的单链DNA探针:ACR11(At1g16880),5'-atggctatgcctctgcttc-3',5'-gaactgactcgtcagttg-3';GLN2(At5g35630),5'-ggtgaagttatgcctgga-3',5'-gagagaccacatagacac-3'。根据Boehringer-Mannheim Genius System用户指南,进行挖掘探针标记,预杂交,杂交,洗涤条件和检测:挖掘应用手册,用于过滤杂交。
ACR11promoter-GUS融合
ACR11(At1g16880)及其上游基因At1g16870在相反的方向。这两个基因的起始密码子(ATG)之间有638个核苷酸。推定的发起者ACR11(-1 ~ -625)的起始密码子拟南芥引物5'-CACCTCTAGACACTCAAAAATCGGAATTAA-3'和5'-AACAAAGCTTATCTCTTGAGTCTGACTCAA-3'。将PCR产物克隆到pCR2.1-TOPO载体(TOPO TA Cloning Kit, Invitrogen公司)中,序列确定。一个欣dIII /XbaI片段包含0.625 kbACR11启动子区亚克隆到pBI101二元载体中ACR11启动子- gus融合构建物转化为根癌土壤杆菌应变GV3101。
采用花浸法拟南芥变换(49].几个独立的ACR11promoter-GUS拟南芥转基因株系培养至T3纯合子,并进行GUS活性染色[50].
参考文献
- 1.
Forde BG,Lea PJ:植物中的谷氨酸:代谢,调节和信号。J Exp Bot。2007,58:2339-2358。10.1093 / JXB / ERM121。
- 2.
林慧敏,赵建平,谢明华,李文华,黄志强,黄志强:植物谷氨酸受体基因的研究进展。自然科学。1998,396:125-126。10.1038/24066。
- 3.
植物中氮、碳养分和代谢产物的信号转导。植物生理学报。2001,25(4):461 - 464。10.1104 / pp.125.1.61。
- 4.
l -谷氨酸(L-glutamate, L-glutamate, L-glutamate, L-glutamate, L-glutamate, L-glutamate, L-glutamate, L-glutamate, L-glutamate拟南芥.植物营养与肥料学报。2006,27(4):457 - 461。10.1093 /卡式肺囊虫肺炎/ pcj075。
- 5.
水稻对氨离子的吸收和氮素的利用(栽培稻l .)。中国生物医学工程学报。2007,31(4):429 - 434。10.1093 / jxb / erm016。
- 6.
Forde BG,Walch-Liu P:硝酸盐和谷氨酸作为植物根部行为反应的环境提示。植物细胞环境。2009,32:682-693。10.1111 / J.1365-3040.2008.01927.x。
- 7.
细菌和古菌的氮素调控。微生物学进展。2007,61:349-377。10.1146 / annurev.micro.61.080706.093409。
- 8.
Bueno R Pahel G, Magasanik B:作用glnB和glnD基因产品在调节中glnALG操纵子大肠杆菌.J细菌。1985,164:816-822。
- 9.
增强子结合蛋白的可逆磷酸化调控细菌氮利用基因的转录。生物化学进展。1988,13:475-479。10.1016 / 0968 - 0004(88) 90234 - 4。
- 10。
MR: PII信号转导蛋白。微生物学报,2000,8:172-179。10.1016 / s0966 - 842 x(00) 01709 - 1。
- 11.
Brown MS, Segal A, Stadtman ER:谷氨酰胺合成酶腺苷化和deadenylated的调节是由PII调节蛋白的代谢转化介导的。美国国家科学院学报。1971年,68:2949 - 2953。10.1073 / pnas.68.12.2949。
- 12.
串级控制大肠杆菌谷氨酰胺合成酶。PII尿苷转移酶和尿苷去除酶的纯化及性质研究。中国生物化学杂志。
- 13.
孙HS,李志刚:级联控制大肠杆菌谷氨酰胺合成酶。PII蛋白的纯化、性质及其结构基因的核苷酸序列。中国生物医学工程学报。
- 14.
McFarland N, McCarter L, Artz S, Kustu S:氮调控位点”glnR"由顺反子组成的肠道细菌ntrB和ntrC:蛋白质产物的鉴定。美国国家科学院学报。1981年,78:2135 - 2139。10.1073 / pnas.78.4.2135。
- 15.
Ninfa AJ, Magasanik B:共价改性glnG产品,NRI,由glnL产物NRII调控glnALG操纵子的大肠杆菌.美国国家科学院学报。1986年,83:5909 - 5913。10.1073 / pnas.83.16.5909。
- 16.
Reitzer LJ, Magasanik B:转录glnA在大肠杆菌是由与远离启动子的位点结合的活化剂刺激的。Cell. 1986, 45: 785-792。10.1016 / 0092 - 8674(86) 90553 - 2。
- 17.
关键词:氮调节蛋白NTRB,蛋白激酶,磷酸蛋白磷酸酶,NTRC美国国家科学院学报。1988年,85:4976 - 4980。10.1073 / pnas.85.14.4976。
- 18.
Magasanik B:肠道细菌对氮利用的调节。细胞生物学杂志。1993,51:34-40。10.1002 / jcb.240510108。
- 19.
Atkinson MR, Kamberov ES, Weiss RL, Ninfa AJ:可逆尿苷化大肠杆菌PII信号转导蛋白调节其刺激转录因子氮调节因子I (NRI或NtrC)去磷酸化的能力。中国生物医学工程杂志,1994,21(4):514 - 514。
- 20.
Jiang P, nifa AJ:大肠杆菌在体外,控制氮同化的PII信号转导蛋白作为腺苷酸能量电荷的传感器。生物化学。2007,46:12979-12996。10.1021 / bi701062t。
- 21。
Zhang Y Y, Pohlmann EL, Serate J, Conrad MC, Roberts GP:双功能氮传感器蛋白GlnD四个结构域的突变和功能特性。中国生物医学工程学报,2010,31(4):513 - 514。10.1128 / JB.01674-09。
- 22。
谢敏华,林敏华,范德卢,王志强:一种pii样蛋白拟南芥:氮感测的假定作用。美国国家科学院学报。1998年,95:13965 - 13970。10.1073 / pnas.95.23.13965。
- 23。
水稻n -乙酰谷氨酸激酶(N-acetylglutamate kinase)与PII-like蛋白的相互作用。植物营养与肥料学报。2004,29(4):457 - 461。10.1093 /卡式肺囊虫肺炎/ pch199。
- 24.
vmax型协同酶磷酸甘油酸脱氢酶的变构配体位点。张志强。10.1038 / nsb0195 - 69。
- 25.
Aravind L, Koonin EV:通过迭代数据库搜索收集蛋白质的非琐碎结构、功能和进化信息。中国生物医学工程学报,2003,23(4):427 - 434。10.1006 / jmbi.1999.2653。
- 26.
Chipman DM, Shaanan B: ACT域名家族。中国生物医学工程学报。2001,11:694-700。10.1016 / s0959 - 440 x (01) 00272 - x。
- 27.
Libles JS,Thorolfsson M,Martinez A:含有参与氨基酸代谢的ACT结构域的变构机制。氨基酸。2005,28:1-12。10.1007 / s00726-004-0152-y。
- 28.
Grant GA: ACT结构域:小分子结合结构域及其作为普通调控元件的作用。中国生物医学工程学报。10.1074 / jbc.R600024200。
- 29.
许晓莉:调控域-底物结合域界面的特异性相互作用对抑制和效应结合协同性的影响大肠杆菌D-3-phosphoglycerate脱氢酶。中国生物医学工程杂志。2001,27(6):457 - 461。10.1074 / jbc.M007512200。
- 30.
徐晓丽,胡志强:d -3磷酸甘油酸脱氢酶活性位点邻近亚基的贡献。中国生物医学工程杂志。1999,27(4):457 - 461。10.1074 / jbc.274.9.5357。
- 31.
Mendel S, Elkayam T, Sella C, Vinogradov V, Vyazmensky M, Chipman DM, Barak Z:乙酰羟基酸合成酶:一个由突变证据支持的调控亚基结构。中国生物医学工程学报,2003,21(4):427 - 434。10.1006 / jmbi.2000.4413。
- 32.
E: c端调控域的氨基酸取代破坏与生物合成苏氨酸脱氨酶结合的变构效应大肠杆菌.中国生物医学工程学报。1998,27(4):531 - 534。10.1074 / jbc.273.36.23219。
- 33。
陈志强,陈志强,陈志强,等:吡哆醛磷酸依赖的变构苏氨酸脱氨酶的结构和调控。结构。1998,6:465-475。10.1016 / s0969 - 2126(98) 00048 - 3。
- 34。
siltberger - liberles J, Martinez A:寻找苯丙氨酸羟化酶调控区域的远端同源物。氨基酸。2009,36:235-249。10.1007 / s00726 - 008 - 0057 - 2。
- 35。
Wilson TJ, Argaet VP, Howlett GJ, Davidson BE:两个芳香氨基酸结合位点的证据,一个atp依赖,另一个atp不依赖,在大肠杆菌调节蛋白Tyrr。mol microbiol。1995,17:483-492。10.1111 / J.1365-2958.1995.MMI_17030483.x。
- 36.
Ettema TJ, Brinkman AB, Tani TH, Rafferty JB, Van Der Oost J:一种新配体结合结构域参与调节原核生物的氨基酸代谢。中国生物医学工程杂志。2002,27(4):461 - 468。10.1074 / jbc.M206063200。
- 37.
Schreiter ER, Sintchak MD, Guo Y, Chivers PT, Sauer RT, Drennan CL:镍响应转录因子NikR的晶体结构。王志强。2003,10:794-799。10.1038 / nsb985。
- 38.
引用本文:张荣格,李志刚,Joachimiak A, Derewenda ZS:该化合物的结构和配体结合特性枯草芽孢杆菌YkoF基因产物,新型硫胺类/ HMP结合蛋白的成员。J Mol Biol。2004,343:395-406。10.1016 / J.JMB.2004.08.037。
- 39.
Feller A, Hernandez JM, Grotewold E:一个act样结构域参与了几种植物基本螺旋-环-螺旋转录因子的二聚化。中国生物医学工程学报。10.1074 / jbc.M603262200。
- 40.
中华结核分枝杆菌一种新基因家族的分子特征拟南芥.植物生理学报。2002,30(4):593 - 598。10.1104 / pp.007484。
- 41.
Hayakawa T,Kudo T,ITO T,Takahashi N,Yamaya T:Act域重复蛋白7,ACR7,在水稻核中与伴侣HSP18.0-CII相互作用。植物细胞生理。2006,47:891-904。10.1093 / PCP / PC9062。
- 42.
Liu Q: ACR基因家族的计算鉴定和系统分析栽培稻.植物营养与肥料学报。2006,29(3):441 - 446。10.1016 / j.jplph.2005.05.011。
- 43.
Kudo T, Kawai A, Yamaya T, Hayakawa T:水稻核定位蛋白ACT域重复蛋白9的细胞分布(栽培稻).植物营养学报。2008,33(4):489 - 494。10.1111 / j.1399-3054.2008.01051.x。
- 44.
eeisen MB, Spellman PT, Brown PO, Botstein D:全基因组表达模式的聚类分析和显示。美国国家科学院学报。1998年,95:14863 - 14868。10.1073 / pnas.95.25.14863。
- 45。
Obayashi T,Nishida K,Kasahara K,Kinoshita K:申请 - II更新:条件特异性基因共存,以将共表达分析和应用扩展到广泛的开花植物。植物细胞生理。2011,52:213-219。10.1093 / PCP / PCQ203。
- 46。
Oliveira IC,Coruzzi Gm:碳和氨基酸相互调节谷氨酰胺合成酶的表达拟南芥.植物生理学报。1999,21(4):451 - 457。10.1104 / pp.121.1.301。
- 47。
Chiu W, Niwa Y, Zeng W, Hirano T, Kobayashi H, Sheen J:转基因绿色荧光蛋白在植物中的重要报道。生物谷学报。1996,6:325-330。10.1016 / s0960 - 9822(02) 00483 - 9。
- 48.
离子强度、pH和螯合二价金属对烟草叶片中多核糖体分离的影响。植物生理学。1977,57:5-10。10.1104 / pp.57.1.5。
- 49.
花浸:一种农杆菌介导的植物转化的简化方法拟南芥.植物学报1998,16:735-743。10.1046 / j.1365 - 313 x.1998.00343.x。
- 50.
GUS融合:β -葡萄糖苷酶在高等植物中作为敏感和通用的基因融合标记。Embo J. 1987, 6: 3901-3907。
确认
我们感谢美珍芳辅助在共聚焦显微镜下提供帮助。来自国家科学理事会(NSC 99-2311-B-001-007-MY3)和台湾的学术界(98-CDA-L04),对MHH的补助金提供支持。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
Tys进行了原生质体瞬态测定。TYC进行了RNA印迹分析。Tys,TYC和CPH参与分子克隆和启动子 - GUS分析。MHH构思了这项研究,进行了生物信息分析和序列对齐,并写了稿件。所有作者阅读并认可的终稿。
宋子英、钟翠云对这部作品贡献相当。
作者为图像提交的原始文件
权利和权限
开放获取本文由BioMed Central Ltd授权发表。这是一篇开放获取的文章,是根据知识共享署名许可协议(https://creativecommons.org/licenses/by/2.0)提供任何介质中的不受限制使用,分发和再现,所以提供了正确的工作。
关于这篇文章
引用这篇文章
宋雅婷,钟雅婷,徐淑珍,CP。等等。的ACR11编码一种新型类型的氯塑料ACT结构域重复蛋白,其与之相同的表达GLN2在拟南芥.BMC植物杂志11,118(2011)。https://doi.org/10.1186/1471-2229-11-118
收到了:
接受:
发表:
关键词
- 转运肽
- 绿色荧光融合蛋白
- Chorismate变位酶
- Prephenate脱氢酶
- 氨基酸的传感器