摘要
背景
谷氨酰胺合成酶(GS;EC: 6.3.1.2, l -谷氨酸:氨连接酶adp形成)是高等植物铵态氮同化和代谢的关键酶。目前的工作是发展一个更全面的理解的分子和生化特征GS.并对杨树的发育调控进行了研究GS.在杨树多年生生长的各个组织和不同时期的表达。
结果
的GS.基因家族由8个不同的基因组成,这些基因表现出与其功能基因相一致的所有结构和调控元件。我们的研究结果表明,该家族的成员由4组重复基因组成,其中3组编码胞质GS亚型(GS1), 1组编码染色质GS亚型(GS2)。我们的分析表明杨树trichocarpa第一个被观察到的植物物种是完整的吗GS.家庭复制。详细的表达分析揭示了具体的空间和季节模式GS.杨树的表达式。这些数据为深入了解杨树中GS亚型的代谢功能提供了依据,并为今后的功能研究奠定了基础。
结论
我们的数据表明GS.为了增加某一特定细胞类型中的酶的数量,复制体可能被保留下来。这种可能性可能有助于与谷氨酰胺衍生代谢产物变化相关的氮代谢功能的稳态。复制的存在GS.通过在特定细胞类型中将GS多肽组装成homo oligomeric和/或heterosoligomeric全酶,杨树中的基因也有助于特定GS亚型酶的酶学特性的多样化。
背景
谷氨酰胺合成酶(GS;EC 6.3.1.2, l -谷氨酸:氨连接酶adp形成)催化atp依赖的氨(nhh)加成4+)谷氨酸的γ-羧基产生谷氨酰胺并用作植物中氮流动的中心。谷氨酸合成酶(FD-Gogat,EC 1.4.7.1; NADH-GOGAT,EC 1.4.1.1)然后催化谷氨酰胺和2-氧代摩托酸盐的转化物,产生两个谷氨酸分子,其中一个聚合物通过GS参与进一步的铵同化。其他捐赠所有含氮生物分子的减少的氮[1].GS在生产谷氨酰胺过程中同化的铵可以来自不同的来源,包括直接从土壤中吸收、硝酸盐和亚硝酸盐的还原、光呼吸、苯丙氨酸解氨酶催化的苯丙氨酸脱氨、以及营养贮藏蛋白动员和衰老过程中铵的分解代谢释放。
多个核编码的GS多肽在高等植物的光合和非光合组织中表达,这些多肽组装成位于细胞质或叶绿体中的低聚同工酶[2,3.].最近据报道,植物GS全酶具有由两个面对面的亚基的两个面对面的亚基组成的透明结构,其中每个环内的每个两个相邻亚基之间形成有源部位[4,5].核苷酸和氨基酸序列的系统发育研究表明,植物中叶片和细胞源GS的基因形成两个姐妹群,其中具有共同的祖先,在缓解植物和裸子植物之间的分裂前通过复制分流[6].
在被子植物中有两种主要的GS亚型:胞质GS (GS1)和叶绿体GS (GS2)。这表明谷氨酰胺的产生有几种不同的途径,空间上和时间上都有。在叶片发育过程中,谷氨酰胺主要在叶绿体中通过GS2同工酶的活性产生。在幼叶中被同化为谷氨酰胺的铵是通过硝酸盐还原和光呼吸产生的[7,8].另外,胞质GS1主要产生谷氨酰胺用于细胞间氮运输。胞质酶吸收从土壤中吸收的铵,并在苯丙素生物合成和氮再活化过程中释放[9- - - - - -11].因此,GS1基因在根和血管组织中差异表达。基因组的分子分析GS.从一些被子植物的序列已经表明,胞质GS1基因属于一个小的多基因家族,而叶绿体GS2是由一个单一基因编码的[9,10].
GS在木本植物的生长发育中起着基础性的作用[11,12].在杨树中,通过对转基因杨树异位表达松胞质GS的研究,清楚地证明了GS的关键作用。转基因杨树营养生长增强[13,14],在生理生态和酶促及非酶促抗氧化剂水平上增强对干旱胁迫的抵抗力[15],提高氮的利用效率[16].由此可见,杨树的GS活性是其生长发育的限制因素。目前的工作是发展一个更全面的理解的分子和生化特征GS.杨树的基因家族,以建立对杨树特定成员的作用的认识GS.基因家庭在开发期间,并表征发展规定GS.在杨树多年生生长的各个组织和不同时期的表达。
结果
杨树的鉴定与结构分析GS.基因
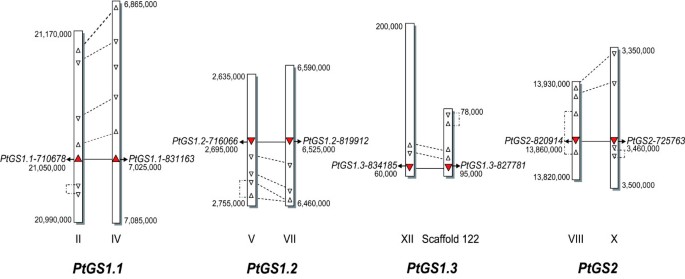
搜索杨树trichocarpa日本基因研究所的全基因组序列[17]允许我们识别包含的地区GS.序列。保留了8个包含完整ORF的序列以及一个功能基因的结构和调控元件,以供进一步研究。杨树基因组数据库也包含9GS.伪原以及额外的GS.基因表现出高度的同一性GS.在原始细菌基因。全长cdna (flcdna)GS.分析基因,比较其orf编码的多肽的特性(表1)1).通过这些生物信息学分析,鉴定出6个编码胞质GS同工酶(GS1)的基因和2个编码塑质GS同工酶(GS2)的基因。此外,我们的分析表明GS.杨树的基因家族在4组重复基因中组织,PtGS1.1,PtGS1.2,PtGS1.3和PtGS2.根据JGI数据库的原始识别号,杨树GS1基因命名ptgs1.1 - 710678和ptgs1.1 - 831163,ptgs1.2 - 716066和ptgs1.2 - 819912,PTGS1.3-827781和ptgs1.3 - 834185.遵循相同的标准,杨树GS2基因命名ptgs2 - 725763和ptgs2 - 820914.不同的遗传距离GS.考虑到基因家族的个体成员的完整基因组序列来计算基因,确认存在的基因家族GS.基因重复。
四个重复GS.基因被定位在连锁组(LG)或支架中杨树trichocarpa基因组(图1).基因组区域GS.通过确定基因的上游和下游的开放阅读框(open reading frames, ORFs),对定位的基因进行详细检查GS.基因对之间这些相邻区域的基因和交叉对准。几种重复的基因相结合地定位了PtGS1.1,PtGS1.2和PtGS2重复。但是,不可能本地化PtGS1.3副本,因为该区域DowstreamPTGS1.3-827781在基因所在的支架中不存在(图1).在附近也观察到非重复基因GS.基因,以及位于同一染色体上的内部复制。
结构分析GS.杨树中的基因家族是通过对外出口/内含子组织进行的。如图所示2外显子的大小通常在这四个重复中保持得很好,PtGS1.1,PtGS1.2,PtGS1.3和PtGS2.然而,基因组结构在内含子区域有很大的不同,内含子在大小和序列上有显著差异。与这些观察到的基因重复之间的差异相反,每个重复的两个成员之间的外显子/内含子边界几乎相同(图)2).的PtGS2和PtGS1.2副本包含13个外显子和12个内含子PtGS1.3有12个外显子和11个内含子PTGS.1.1副本包含11个外显子和10个内含子。有趣的是,外显子6PtGS1.1duplicate表示PtGS1.2中外显子6和7的融合,PtGS1.3和PtGS2重复。另一方面,最后一个外显子PtGS1.1和PtGS1.3重复代表第12和13外显子的融合PtGS1.2复制。有趣的是要注意在2 kB中断外显子5和6中的内含子的存在PtGS1.2复制。
的比较分析GS.植物基因组序列中的基因家族
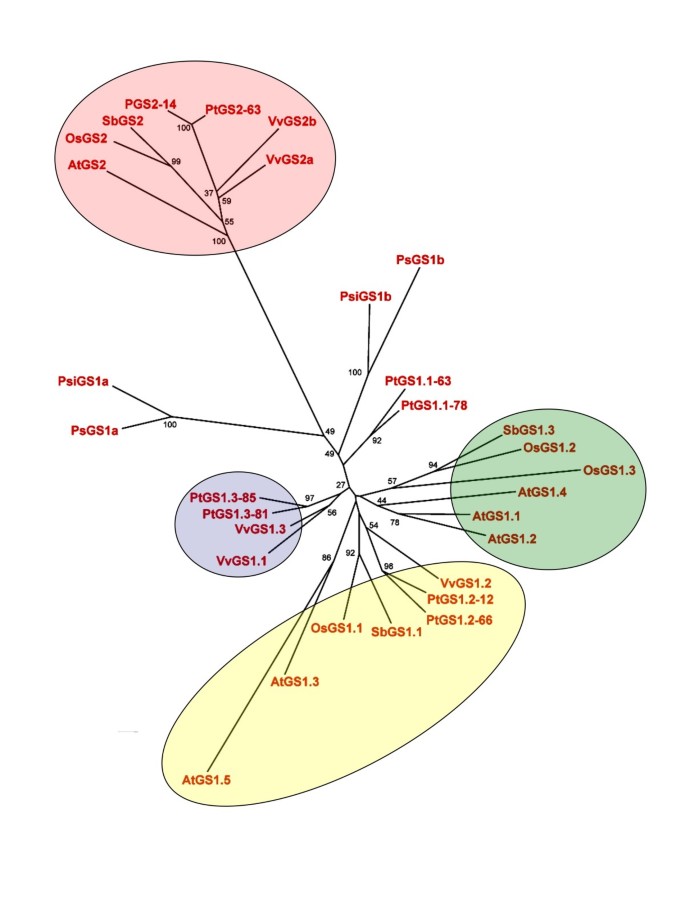
研究杨树的进化关系GS.我们根据推导的氨基酸序列进行了分支分析,包括完整的GS.来自拟南芥,稻米,葡萄,高粱和杨树的测序基因组的基因系列。松树和云杉GS.基因也包含在这个比较分析中(图3.).在分子水平上的系统发育重建显示,被子植物中胞质(GS1)和叶绿体(GS2)序列分离为两个分化良好的簇。数字3.还显示poplar重复GS2和GS1基因分布在这两个簇中。GS1拟南芥、水稻、葡萄和高粱的基因分布在3个亚科中PtGS1.2和PtGS1.3复制品明显与这些亚属中的两个相关。相比之下,PtGS1.1duplicate在保守的GS1亚科之外,与被子植物中GS1主要亚科以外的裸子植物的GS1亚型更接近。然而,这些数据的解释应该谨慎,因为支系的支持值是中等的。
杨树的调控区域GS.基因
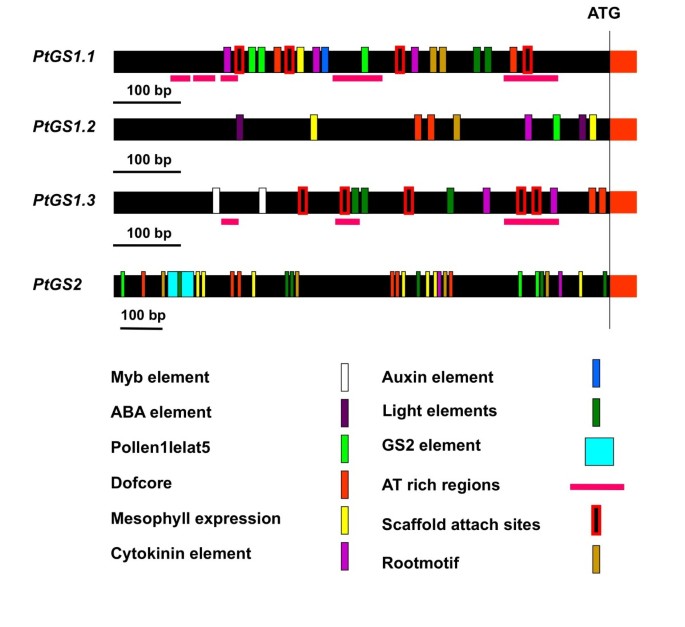
为了深入了解GS.在杨树基因中,研究了调控元件在5′-上游区域的存在。根据先前在结构和系统发育分析中获得的结果,我们决定只考虑存在于aGS.复制(图4).在PtGS1.1,PtGS1.2和PtGS1.3在基因中,这些常见的调控元件集中在启动子的近端区域(翻译起始点上游约600 bp)。相反,共同的调控元件的存在跨越了启动子的一个主要区域PtGS2重复(大约1300 bp上游的翻译启动)。涉及与MYB分析因子相互作用的推定监管元素是专门确定的PtGS1.3复制。除GATA box外,所有基因重复中均检测到GATA box等光响应元件PtGS1.2.在所有基因中鉴定了组织特异性基因表达(叶蛋白,根)的调节元件,除了PtGS1.3而ABA响应元件则存在于启动子中PtGS1.2重复。所有人都确定了特异于细胞蛋白响应的盒子GS.基因,但营养因子响应元素被专门发现PtGS1.1.杨树GS2启动子包含一个约200 bp的序列,与豌豆和普通豆的GS2中功能特征的光调节元件具有90%的同源性[18].最后,在所有的GS启动子中都检测到at丰富区,尽管它们在GS启动子中含量较少PtGS2复制。
器官特异性的重复表达GS.杨树的基因
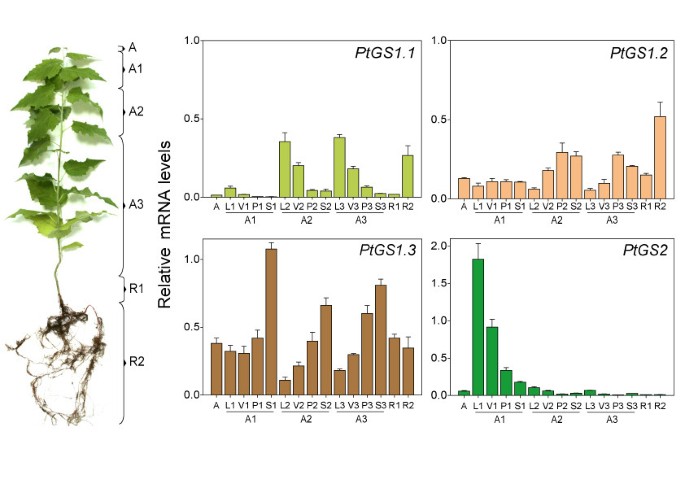
了解的监管GS.并进一步了解基因家族成员的生物学作用,GS.表达被精确地量化在空间和时间上。从不同的器官中提取总RNA和相对丰度GS.real-time PCR (qPCR)定量检测转录本。在所有情况下,转录水平与内参基因的表达水平进行比较(如材料和方法中所述)。将两个月龄的杂交杨树分为地上区和根系区(图2)5).气生区包括分生组织顶端(A)、幼叶和茎节间(A1)、中间叶和茎节间(A2)、成熟叶和茎节间(A3)。在叶片(L)、叶脉(V)和茎(S)的叶片上进一步细分A1、A2和A3区域。根系区域包括靠近根冠(R1)的主根和次根块(R2)。如图所示5,基因表达谱PtGS1.1,PtGS1.2,PtGS1.3和PtGS2在检验的样本中差异显著。PtGS1.1转录本在含中间和成熟叶片的空中区域(A2和A3)和R2中特别丰富。有趣的是,最大的PtGS1.1在叶片薄层(L2,L3)中观察到表达,在叶静脉中降低(V2,V3)。在叶柄(P2,P3)和茎中观察到少量基因表达(S2,S3)。为了PtGS1.2重复在二次根质量(R2)中观察到最高转录性丰度,而在叶柄(P2,P3)和茎(A1和A2)的叶柄(P2,P3)和茎(S2,S3)中观察到该值的大约一半。较低的水平PtGS1.2在其余样本中检测到转录本。数字5也显示了the的表达PtGS1.3杨树之间的重复是主要的GS1基因,高水平PtGS1.3转录产物分布在根尖、气切和根切。此外,水平的PtGS1.3转录量以杨树最高GS.基因家族在顶点。重要的是要注意在空中部分,表达PtGS1.3与叶柄(P1, P2和P3)和茎(S1, S2和S3)等维管组织中富集的样本明显相关,而在所有检测的叶片中,基因表达水平都较低。最后,分析了PtGS2重复表明,该家族成员的转录本在幼叶中最丰富(A1),从树的顶部到树的底部逐渐减少,在根中检测到的值最低。
的表达式模式之间是否有对应关系GS.转录物和GS多肽的分布,我们检查了不同器官中Gs多肽的分布。通过使用针对松GS升高的抗体,通过蛋白质印迹分析鉴定来自叶片,茎和GS多肽的叶片,茎和根部的茎,茎和GS多肽[19].先前已经报道,这些抗体能够识别特异性杨树Gs多肽[13].数字6在叶片中鉴定出两个GS多肽,GS2 (45 kDa)和GS1 (40 kDa)。GS1多肽在茎和根中占优势。
为了调查对应的通知GS.通过二维凝胶电泳(2D-PAGE)对不同器官、相同蛋白样品(叶、茎、根)的总蛋白进行了分离,并通过western blotting对GS多肽进行了鉴定(图)6 b).这种实验方法使我们能够在相同大小的GS多肽家族中识别出不同电荷的GS多肽。因此,在叶片中,GS2多肽被分解为几个最丰富的点,显示出计算的等电点(pI)为5.26。GS1多肽被解析为pI为5.52的主要点。茎中有2个主要位点对应pI 5.20和5.81的GS1多肽。最后,根中主要GS1点的pI为5.14。这些实验pI值均在杨树GS多肽的pI预测值范围内(表1)1).
GS基因表达的季节变化
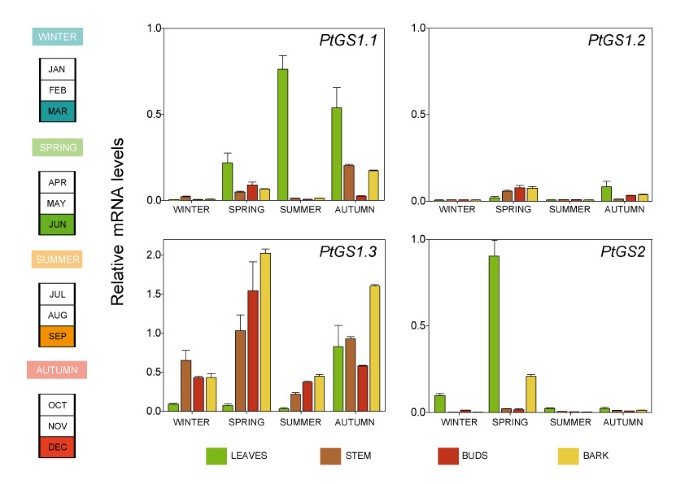
我们还对季节变化的表达感兴趣GS.杨树的基因家庭。转录水平的PtGS1.1,PtGS1.2,PtGS1.3和PtGS2从10年生杨树的叶、茎、芽和树皮中提取的RNA杨树tremulaxp·阿尔巴,克隆INRA 7171 1-B-4)。数字7显示,GS.复制物在年生长期间表现出基因表达的对比模式。表达PtGS1.1重复量冬季极低,春季增加,夏末和秋末达到最大值。有趣的是,转录产物的峰值出现在叶片中。转录本丰度PtGS1.2在一年的不同季节,所有样本的复发率都很低。PtGS1.3在茎芽和树皮中均有高表达,在春季和秋季的转录量最高。有趣的是PtGS1.3除秋季水平显著升高外,叶片中的转录本含量较低。最后,高水平的PtGS2转录本只在春季膨大叶片中检测到。
讨论
的GS.杨树基因家族由8个不同的基因组成,这些基因显示出所有的结构和调控元件,可能被认为是功能基因(见表1)1).基因组的详细分析GS.序列表明GS.杨树的基因家族被分为4组重复基因,PtGS1.1,PtGS1.2,PtGS1.3和PtGS2.这些GS.基因分布在不同染色体的单独基因座上,以及我们的知识,杨树trichocarpa第一种植物是哪一种完整的GS.据观察了家庭复制。但是,单一的重复GS.基因以前在植物中被报道过。因此,两个副本GS1基因已经在Pisum一[20.,最近又出现了两个截然不同的例子GS2基因已经在Medicago truncatula[21].基因组区域的同源-微同位分析GS.基因定位强烈表明,重复基因的起源是发生在大约65 Myr的全基因组重复事件,大约92%的杨树基因组仍可检测到[17].复制之后,基因的新副本可能会发生修饰,从而实现功能多样化,这是植物进化新颖性的重要来源[22].然而,也有可能一个复制的基因副本在伪基因化过程中迅速丢失。有趣的是,杨树每对复制基因的外显子-内含子结构高度保守,启动子中存在类似的调控元件。这些发现提供了支持表达的证据GS.在同样的细胞类型中,它们受到相似的发育和环境提示。此外,它们的编码区域也非常保守,表明它们编码的是本质上相同或非常相似的GS酶。这些结果表明,这些重复基因在杨树氮素代谢过程中发挥了相同的作用。
的分子和功能分析GS.其他植物的基因家族揭示了GS同工酶的专一性,根据组织和植物种类的不同,在氮代谢中发挥特定的和非重叠的作用[9,10].杨树系统发育分析GS.基因显示编码叶绿体和胞质异构体的基因形成两个姐妹组,如前面所述GS.基因家族(10].有人建议这两组基因(GS1和GS2)由于复制而从共同的祖先分离出来的[23并且这种分离发生在裸子植物/被子植物分化之前[5],但可能是在维管植物出现之后[24].有人提出,GS2中n端过境肽的获得将通过增强质体中的光呼吸铵同化作用为植物提供适应优势[12].被子植物的GS1分支的成员按先前由其他学者所报告的亚科分类[6,10,21].PtGS1.2和PtGS1.3在这些亚家族中发现了重复基因,表明它们可以发挥与这些亚型相似的功能。相比之下,PtGS1.1发现了分离的副本PtGS1.2和PtGS1.3基因。
杨树的内外内外组织GS.基因支持上述假设(图3.).所有基因的外显子的位置和长度都非常相似,这表明祖先的结构GS.在进化期间,基因已经保持在进化期间,例如在第一个外显子中存在塑性靶向序列的存在GS2以及其他外显子的微小变化GS1基因。
详细分析GS.在杨树不同组织和器官中的转录丰富度使我们能够识别该基因家族个体成员的特定表达模式(图)5和7).PtGS2如先前报道的GS2同种型负责摄影铵的同化,转录物在叶片中最丰富的叶片最丰富9,10].事实上,杨树的启动子GS2重复包含CIS.其他中描述的监管要素GS2被子植物的基因[18].GS2的另一个作用是在叶片中同化硝酸盐衍生的铵。众所周知,植物在硝酸盐还原和同化过程中的定位是不同的。因此,一些物种在根中定位硝酸盐的还原和同化,而其他物种则优先在叶中同化硝酸盐。在杨树中,大多数硝酸盐同化发生在叶片中[25].因此,需要高水平的GS2亚型来同化叶绿体内硝酸盐还原产生的铵。
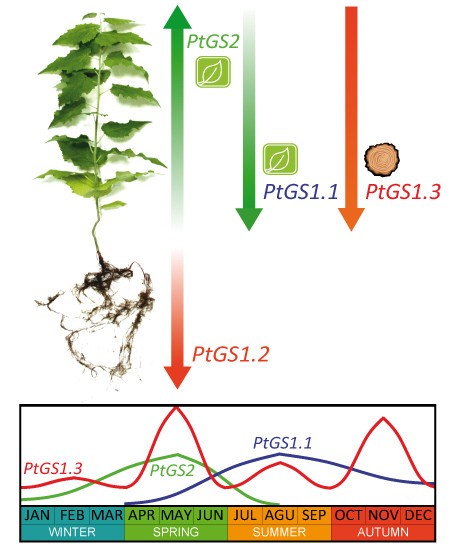
只是三个中的一个PtGS1重复在杨树,PtGS1.1,也优先在叶片中表达,有趣的是,其表达模式在空间上与观察到的表达模式互补PtGS2.因此,PtGS1.1转录本在位于树基部的老叶中特别丰富。这些结果表明了一个相关的作用PtGS1.1与叶片光合代谢相关的谷氨酰胺生物合成。此外,灯光管制箱的存在[26,27的启动子区域PtGS1.1副本(图4)与我们的数据一致,并且可以解释绿叶中的上述表达式模式。
杨树GS1.2在幼树的根中优先表达,这表明该基因复制在土壤氮素的初级同化中发挥作用,正如之前对植物中其他胞质GS酶的描述[28- - - - - -30.].有趣的是,相对丰富的PtGS1.2转录物在感染的杨树叶中增加(12倍)两,而其他成员的表达GS.基因家族没有受到影响(数据未显示)。GS1基因对病原体攻击的诱导已经在前面描述过[31,32].此外,在受感染的番茄叶和衰老的烟草叶中已经证实,参与氮再动员的胞质异构体是aGS1基因优先在根中表达[33,34].这些数据,以及我们在这里所描述的工作表明PtGS1.2可能与叶片衰老过程中氮的再动员有关。
在幼树中,双生子的最大表达水平PtGS1.3在茎和叶柄中检测到基因。此外,这一成员的杨树GS.家族表现出最高水平的基因表达,表明它在氮代谢中起重要作用。监管区域PtGS1.3含有AC元件的副本,参与与调控木质素生物合成基因转录的R2R3 Myb因子成员的相互作用[35,36].类似的顺式调控元件和反式作用因子已被发现在松树中协调木质素生物合成和氮循环[37),这表明PtGS1.3涉及杨树中与瘫痪相关的氮回收。转录组分析还提出了DOF家族成员在基因调节中的作用,导致木质素沉积增加[38].最近有报道称Dof家族成员(Dof5)对针叶树胞质GS基因的差异调控[39]和推测的调控因子已在杨树中被鉴定GS.基因(图4).此外,我们还发现同源Dof因子也参与了杨树GS亚型的调控(García-Gutiérrez, Avila C, Cánovas FM,未发表的数据)。利用2D-PAGE分析不同杨树器官的GS多肽(图6)很大程度上证实了为复制体确定的表达模式GS.基因。GS多肽在四个主要斑点中分解,杨树器官的差异积聚。因此,在叶子中,GS2和GS1多肽在计算出的PI值的范围内显示PI值PtGS2和PtGS1.1基因表达产物1).在茎中,主要的GS1多肽被预测为茎的表达产物PtGS1.3重复,而在根中的主要GS1多肽预计是表达产物PtGS1.2.图中分离的GS1亚型的pI值非常相似,支持了这一结论6以及由所编码的多肽推导出的相应值PtGS1.3和PtGS1.2副本(表1).
成年树在一年的生长过程中转录本的分析(图7)表明,杨树GS家族成员的表达是季节性调节的。表达PtGS2当光合作用和光抑制处于最大水平时,春天的叶子中的重复率高了[40].此外,谷氨酰胺在春季新梢发育过程中启动营养蛋白积累是必需的[41].培养叶在主动增长期间代表氮气的强槽[42].高水平的PtGS1.1在成树的叶片中也发现了基因的表达,在夏季和秋季时表达PtGS2非常低。这些数据表明,GS1.1同种型可以在夏季和秋季的杨树叶片中的氮气再分布中发挥重要作用。在成年树的叶子,茎,芽和树皮中,极低的水平PtGS1.2在冬季和夏季检测到转录本,但在春季和秋季观察到轻微的增加。杨树的氮素调动是按季节进行调节的,在秋季,氮素从老化组织循环和输送到贮藏组织,以及在春季调动储存的氮素以支持其旺盛的生长[42].在成年树中,PtGS1.3基因表达受季节调节,春季和秋季的转录量特别高。除秋季衰老的叶片外,茎、芽和树皮等异养组织的转录本丰度较高。
胞质GS在杨树生长和生物质生产中的作用已经报道了[13,14].此外,增强GS.在杨树中表达可提高氮同化效率[16].在多年生植物中,GS1在铵态同化和氮素恢复中的作用尤其重要,因为多年生植物能够应对周期性的生长和休眠。例如,树木将大量的碳转化为生成木质素所需的苯丙素的生物合成,而木质素是木材的重要组成部分。虽然木质素不含氮,但在木材形成过程中,当苯丙氨酸被脱胺并进入木质素生物合成和当甘氨酸在C1代谢中脱羧时,氮以铵的形式大量释放。这两种代谢途径在木质化细胞中是活跃的[43].释放的铵离子必须重新整合到代谢中,以维持高木质素化速率而不影响氮经济[12,44].事实上,杨树的GS1转录本和多肽是在木质部细胞发育过程中积累的,在木质部细胞中,参与苯丙素途径和C1代谢的酶活性较高,因此释放了铵[45,46].根据这些发现,我们决定在硅上检测杂交杨树(杨树tremulaxPopulus Temuloides.)使用可用的微阵列数据杨树DB (47].主成分分析(附加文件1)表现出高度的共表达PtGS1.3以及木质素生物合成和C1代谢相关基因。相反,其他成员GS.在杨木形成期间也表达了家族(PtGS1.1和PtGS2)并没有显示出这种相关性。综上所述,这些数据表明PtGS1.3在杨树的木质组织中。
结论
在本研究中的研究和表达分析GS.介绍了杨树的基因家族。的GS.基因家族由8个不同的基因组成,这些基因表现出与其功能基因相一致的所有结构和调控元件。我们的研究结果表明,该家族成员由4组重复基因组成,其中3组编码胞质GS亚型(GS1), 1组编码叶绿体定位GS亚型(GS2)。详细的表达分析揭示了具体的空间和季节模式GS.杨树的基因调节(图8).这些数据为深入了解杨树中GS亚型的代谢功能提供了依据,并为今后的功能研究奠定了基础。
我们的分析表明杨树trichocarpa第一个被观察到的植物物种是完整的吗GS.家庭复制。考虑到本文中的所有数据,似乎GS.杨树全基因组复制后基因高度保守。相比之下,杨树中其他基因家族的重复成员则迅速分化[48,49].一些作者认为,参与转录调控和发育基因的基因优先被保留[50].也有人提出,影响重复基因保留概率的因素之一是其连通性[22].我们的数据表明GS.为了增加某一特定细胞类型中的酶的数量,复制体可能被保留下来。这种可能性可能有助于与谷氨酰胺衍生代谢产物变化相关的氮代谢功能的稳态。据报道,最近重复的基因在代谢产物的功能补偿中发挥着重要作用拟南芥[51].复制的存在GS.通过在特定细胞类型中将GS多肽组装成homo oligomeric和/或heterosoligomeric全酶,杨树中的基因也有助于特定GS亚型酶的酶学特性的多样化。需要进一步的研究来证实这些假设。
方法
植物材料
以杂交杨树(杨树tremulaxPopulus Alba.,克隆INRA 717 1-B4, Institut National de la Recherche Agronomique, INRA为了分析植物不同器官的表达,我们将植物在半强度Murashige和Skoog培养基(MS)上进行离体微繁殖,如前所述[13].除非另有说明,否则Plantlets在先前描述的条件下维持[13,14].生根的幼苗被转移到植物生长室的塑料罐中,其中含有盆栽混合物(HM3-Agromálaga, Málaga,西班牙)和蛭石,比例为1:1。离体驯化后,在22℃恒温、16 h日照、125 μmol m光照条件下培养8周2年代-1湿度约为80%。定期提供含有10mM硝酸钾的营养溶液。在成长期结束时,p . tremulaxp·阿尔巴收获植物,并从15种不同的部分从枝条到根尖取出的样品。
植物的空中区域分为四个部分:顶端芽(a),第1,第2,第3,第4和第5个顶端叶(A1);中间区域具有第六,第7,第8,第9和第10叶(A2),以及包括第11,12,第13号,第14和第15叶(A3)的更多基础区域。每个部分进一步分为:L,叶片;v,校长米子;p,叶柄;年代,茎。根部在R1,主根和R2,二次根中段。
在西班牙Barrio de San Julián, 29004, Málaga实验中心的Grice-Hutchinson杂交杨树中监测了基因表达的季节分析。所用的样本是杂交树木的叶子、茎、芽和树皮。样本采集于2008年3月中旬、6月、9月和12月。
GS基因重复序列的鉴定及染色体定位
的GS.使用Join Genome研究所的真核生物Orthologous Groups (http://genome.jgi-psf.org/Poptr1_1/Poptr1_1.home.html).在我们的研究中,该基因组门户所使用的蛋白质标识被保守(见表)1).从杨树数据库中捕获的GS序列通过blastp在GenBank (http://blast.ncbi.nlm.nih.gov/Blast.cgi).GS系列的偏振和内部区域中的p距离用系统发育项目兆4兆4 [52,将每个基因的内含子连续排列。基因组区域之间的同一性程度GS.采用不同连锁群间微同一性搜索策略,对重复基因进行定位。上游和下游基因组序列与CLUSTALW比对[53]侧翼的ORF序列GS.基因手动定位。然后将结果与[17].
序列和系统发育分析
对齐的杨树trichocarpaGS蛋白序列用CLUSTALW进行分析[53].从完全测序的基因组的物种中收集在系统发育树的构建中使用的蛋白质序列。另外,其他有趣的树栖物种的序列,包括松果体或云杉,都被包括在内。蛋白质序列及其对应的标识符在以下数据库中找到:
杨树trichocarpa和高粱二色的:http://genome.jgi-psf.org/
抗旱性和云杉sitchensis:http://www.ncbi.nlm.nih.gov/Genbank/index.html.
拟南芥:http://www.arabidopsis.org/
奥雅萨苜蓿:http://rice.plantbiology.msu.edu/
使用系统发育平台构建系统发育树http://www.phylogeny.fr/[54并包括以下步骤。序列使用T-Coffee (v6.85)进行对齐,使用10个最佳局部对齐(Lalign_pair)和精确的全局对齐(slow_pair)。对齐后,用gblock (v0.91b)去除模糊区域。间隙清洗后的块最小长度设置为10;在最后的校准中不允许有间隙位置。所有相邻非保守位置大于8的片段被拒绝。侧翼位置的最小序列数设定为85%。采用在BioNJ程序中实现的邻居连接方法,以Dayhoof PAM矩阵作为替代模型,包含1000个bootstrap,重建系统发生树。使用ProtDist计算距离。选择DAY替代模型进行分析[55].
启动子分析
调控元件在杨树5′-上游区域的存在GS.从翻译起始的ATG密码子开始分析。每对重复基因的序列通过MultAlin比对[56],以定位共同区域,并对那些具有较高同源性的区域进行分析,以确定植物数据库PLACE [57]及PlantCARE [58].比较了GS1基因的600对碱基对和GS2基因的1300对碱基对的序列长度。没有考虑更远的区域,因为这些区域的p-distance值表明重复序列之间的相似性大大降低。
RNA提取和cDNA合成
从光合组织(0.25 g)或非光合组织(0.5 g)中提取的样本分别以1:2和1:1的比例用研钵和杵在液氮下研磨。按照Canales等人的描述进行RNA提取[59稍作修改。用NanoDrop对RNA进行了定量®ND-1000分光光度计美国威尔明顿)。琼脂糖凝胶电泳验证了样品中RNA的完整性。
采用Takara BIO公司(Otsu, Shiga Japan)的PrimeScriptTM RT试剂(Perfect Real Time),按照制造商推荐的说明书进行cDNA合成。反应混合物中含有0.5 μg总RNA,最终体积为10 μL, 37℃孵育15 min。
实时定量PCR (qPCR)
的3'非翻译区域PtGS1.1,PtGS1.2,PtGS1.3和PtGS2对重复基因进行比对,以确定每对重复基因具有高同源性的序列。设计寡核苷酸引物以特异性扩增每对复制基因编码的转录本。下面是正向和反向引物的序列。
PtGS2- f: GGAGCATCACTTGGATCTAGATGG
PtGS2-R:caaaacccaagagtaaaaaggtcc.
PtGS1.1- f: ATGGTTGTCTGTCAATTTGTTTGCC
PtGS1.1- r: CCAGCAAGAGTTTTATTTAGATTAG
PtGS1.2- f: GGAATTGAGTATTGGAAGATGATGG
PtGS1.2-R:tatgttcataaatgatcaacagcc.
PtGS1.3- f: TGGAAACCATAAGAGATCACCACC
PtGS1.3- r: GAAGAGGCAATTCTTGTACCAAG
PCR产物在每次实验结束时通过熔点分析进行验证。每个PCR产物的身份GS.副本在方案制定过程中通过凝胶电泳进行测试,并通过DNA测序进行确认(附加文件)2).
采用热循环仪(Real System Stratagene MX Swindles PCR 3000PTM, Agilent Technologies, Santa Clara, CA)对基因表达进行相对定量。qPCR系统为QUANTIMIX EASY SYG (Biotools B&M Labs S.A. Madrid, Spain),遵循制造商推荐的方案。PCR反应以不含DNA的样品为对照,重复三次。qPCR样品体积为2 μL,包含10 ng的RT反应cDNA。扩增程序分为3步:i) 1个循环(95°C, 2 min);ii) 40个循环,cDNA变性(95℃,15 s),杂交(55℃,15 s)和延伸(72℃,30 s);iii)绝对温度从55°C到95°C, 1个循环(95°C, 1 min)和1个循环(30 s),生成解离曲线,以确认每个单独反应的特异性扩增。
以肌动蛋白2和泛素为内参基因计算相对表达量[60].候选基因和内参基因的初始转录本数(N0),采用LinRegPCR软件11.0版计算[61].归一化N0通过计算n的平均值之间的比率来发现0N0参考基因(归一化因子)。
蛋白提取和western blot分析
使用以下方案进行杨树蛋白提取。将一克植物组织在砂浆中均质化,杵和1g砂和1ml萃取缓冲液[0.175 m Tris pH 8.8,5%sds(w / v),15%甘油(v / v),0.3m巯基乙醇].然后将提取物以10,000×g,4℃离心30分钟。将上清液与4体积的丙酮在-20℃下混合1小时,然后以10,000×G 4℃离心30分钟。将所得颗粒用80%(v / v)丙酮洗涤,并以10,000×g 4℃以10倍离心15分钟。将沉淀干燥并在12.5%(w / v)聚丙烯酰胺凝胶上的SDS-电泳中的加载缓冲液中加入并溶解。将多肽电转移到硝化纤维素膜上(Whatman GmbH,Dassel,德国)和GS多肽的存在,如Cánovas等人所述的那样免疫。[62]使用针对重组松GS的抗血清[19].通过过氧化物酶测定进行后续检测免疫复合物。
二维凝胶电泳
如前所述进行了二维凝胶电泳[63].用等电聚焦(IEF)加载缓冲液溶解杨树蛋白。每个凝胶的蛋白质含量为30 μg。IEF平板凝胶为80 × 70 × 1 mm,由5% (w/v)聚丙烯酰胺、8.3 M尿素、2.5% (v/v)载两性电解质(Pharmalyte pH 4-6)组成。IEF在200 V下进行2.5 h。在含有上述SDS的12.5% (w/ V)聚丙烯酰胺凝胶的80 × 70 × 1.5 mm板凝胶中也进行了二维电泳。分解后的蛋白被转移到硝化纤维素膜上,免疫检测基本按照一维蛋白质印迹法进行。
蛋白定量
蛋白质水平是由布拉德福德的手术决定的[64].在SDS溶解的样品中,蛋白质含量根据ekramodoullah的描述进行了估计[65].
参考
- 1.
植物氮素代谢的研究进展。植物氨基酸,生物化学和生物技术。Marcel Dekker,纽约。编辑:BK Singh, 1999, 1-47。
- 2.
谷氨酰胺合成酶的分子生物学研究。《植物分子生物学与细胞生物学》,1989,6:115-128。
- 3.
Lam HM,Coschigano Kt,Oliveira Ic,Melo-Oliveira R,Coruzzi Gm:氮素同化分子在高等植物中氨基酸的分子遗传。植物生理学和植物分子生物学年度综述。1996,47:569-593。10.1146 / annurev.arplant.47.1.569。
- 4.
Unno H, Uchida T, Sugawara H, Kurisu G, Sugiyama T, Yamaya T, Sakakibara H, Hase T, Kusunoki M:植物谷氨酰胺合成酶的原子结构:植物生产力的关键酶。中国生物化学学报。2006,31(6):691 - 698。10.1074 / jbc.M601497200。
- 5.
谷氨酰胺合成酶的结晶和初步晶体学特性Medicago truncatula.Acta physica sinica(物理学报),2009,34(6):759 - 763。10.1107 / S1744309109047381。
- 6.
Sáez AC, Munoz-Chapuli R, Plomion C, friigerio J, Cánovas FM:在松树基因组中,两个编码不同胞质谷氨酰胺合成酶的基因紧密相连。欧洲生物化学学会通讯。2000,477:237-243。10.1016 / s0014 - 5793(00) 01796 - 8。
- 7.
李志刚,李志刚,李志刚:光呼吸作用的调节与控制。acta botanica sinica(云南植物学报). 1995,46(6):1397-1414。
- 8.
Masclaux-Daubresse C,Daniel-Vedele F,Dechorgnat J,Chardon F,Gaufichon L,Suzuki A:植物中的氮素吸收,同化和重新化:可持续和生产性农业的挑战。植物学的年。2010,105:1141-1157。10.1093 / AOB / MCQ028。
- 9.
谷氨酰胺合成酶在高等植物中调控基因和蛋白从器官到细胞的表达。植物营养与肥料学报。1999,19(4):489 - 494。
- 10.
胞质谷氨酰胺合成酶在氮同化和循环中的重要性。植物学报,2009,36(4):457 - 461。10.1111 / j.1469-8137.2009.02823.x。
- 11.
Suárez MF, Ávila C, Gallardo F, Cantón FR, García-Gutiérrez A, Claros MG, Cánovas FM:木本植物铵同化的分子和酶解分析。acta botanica sinica(云南植物学报),2002,33(4):531 - 534。10.1093 / jexbot / 53.370.891。
- 12.
Cánovas FM, Avila C, Cantón FR, Cañas RA, de la Torre F:针叶树的铵同化和氨基酸代谢。acta botanica sinica(云南植物学报),2007,28(6):643 - 648。10.1093 / jxb / erm051。
- 13.
Gallardo F,Fu J,CantónFR,García-GutiérrezA,CánovasFM,Kirby Eg:Conifer谷氨酰胺合成酶基因在转基因杨树中的表达。Planta。1999年,210:19-26。10.1007 / S004250050649。
- 14.
Jing ZP, Gallardo F, Pascual MB, Sampalo R, Romero J, Torres de Navarra A, Cánovas FM:转基因杂交杨树谷氨酰胺合成酶的田间试验。植物生态学报,2004,29(4):457 - 461。10.1111 / j.1469-8137.2004.01173.x。
- 15.
El-Khatib R, Hamerlynck EP, Gallardo F, Kirby EG:转基因杨树以松胞质谷氨酰胺合成酶基因异位表达为特征,对水分胁迫的耐受性增强。植物生理学报。2004,24(4):729-736。
- 16.
杨树松胞质谷氨酰胺合成酶异位表达的研究。植物生态学报,2005,27(6):751 - 756。10.1111 / j.1469-8137.2005.01461.x。
- 17.
Tuskan Ga,Difazio S,Jansson S,Bohlmann J,Grigoriev I,Hellsten U,Hellsten U,Putnam N,Ralph S,Rombauts S,Salamov A,Schein J,Sterck L,Aerts A,Bhalerao Rr,Bhalaerao RP,Blaudez D,Boerjan W,Brun A,Brunner A,Busov V,Campbell M,Carlson J,Chalot M,Chapman J,Chen Gl,Cooper D,Coutinho PM,Couturier J,Covert S,Cronk等:黑色杨杨的基因组,杨树trichocarpa(托尔。&灰色)。科学。2006,313:1596-1604。10.1126 / Science.1128691。
- 18.
TJADEN G,Edwards JW,Coruzzi GM:独联体元素和trans影响叶绿体谷氨酰胺合成酶的非光合光度型基因调控的因素。植物生理学。1995,108:1109-11。10.1104 / pp.108.3.1109。
- 19.
Cantón FR, García-Gutiérrez A, Crespillo R, Cánovas FM:高级表达抗旱性谷氨酰胺合成酶的大肠杆菌.重组蛋白多克隆抗体的制备及在松树幼苗中的表达研究。欧洲生物化学学会通讯,1996,100:205-210。
- 20。
Walker EL, Weeden NF, Taylor CB, Green P, Coruzzi GM: Pisum sativum胞浆谷氨酰胺合成酶基因重复拷贝的分子进化。植物营养与肥料学报,2011,29(6):591 - 598。
- 21。
塞拉,维埃拉,库利莫尔,卡瓦略Medicago truncatula包含第二种基因,该基因编码谷氨酰胺合成酶的质体,该质体仅在发育中的种子中表达。植物营养与肥料学报。2010,27(6):733 - 736。
- 22。
植物的基因复制与进化的新颖性。植物学报,2009,33(4):557-564。10.1111 / j.1469-8137.2009.02923.x。
- 23。
熊田Y,本森DR,Hillemann d,托管TJ,罗什福尔DA,汤普森CJ,Wohlleben W,立野Y:谷氨酰胺合成酶基因的演变,最老的现有的和功能的基因中的一个。美国国家科学院学报。1993,90:3009-3013。10.1073 / pnas.90.7.3009。
- 24.
Ghoshroys,Binder M,Tartar A,Robertson DL:谷氨酰胺合成酶II的分子演变:植物演化早期非核生物基因转移事件的系统发育证据。BMC进化生物学。2010,10:198-10.1186 / 1471-2148-10-198。
- 25.
Black Bl,Fuchigami LH,Coleman Gd:杨树,茎秆和根部的硝酸盐同化分区。树生理学。2002,22:717-724。
- 26.
基多尼,布罗西奥,邦德-纳特,贝德布鲁克,邓斯缪尔:小说CIS.- 喇叭花的元素出租车基因启动子。acta photonica sinica, 2011, 37(4): 437 - 444。10.1007 / BF00339739。
- 27.
植物基因的分子光开关。acta botanica sinica(云南植物学报),2010,29(2):489 - 494。
- 28.
Sukanya r,Li Mg,Snustad DP:玉米含有玉米谷氨酰胺合成酶基因的根特异性和拍摄特异性响应硝酸盐和铵。植物分子生物学。1994年,26:1935-1946。10.1007 / bf00019504。
- 29.
石山K,井上E,渡边高桥A,小原男,Yamaya T,高桥H:动力学性质和在谷氨酰胺合成酶的胞质同工酶铵依赖性调节拟南芥.中国生物化学学报。2004,29(6):691 - 698。10.1074 / jbc.M313710200。
- 30.
Ishiyama K,Inoue E,Tabuchi M,Yamaya T,Takahashi H:细胞溶胶谷氨酰胺合成酶的生化背景和分区功能,稻根中活性铵同化。植物和细胞生理学。2004,45:1640-1647。10.1093 / PCP / PCH190。
- 31.
Pérez-García A, Pereira S, Pisarra J, García-Gutiérrez A, Cazorla F, Salema R, de Vicente A, Cánovas FM:一种新型谷氨酰胺合成酶在番茄叶肉细胞中对细菌侵染或phosphinothricin处理的响应。植物学报。1998,206:426-434。10.1007 / s004250050418。
- 32.
关键词:植物,氮素,氮素动员,氮素动员炭疽菌lindemuthianum在菜豆叶片取决于真菌致病性。实验植物学杂志。2007,58:3351-3360。10.1093 / JXB / ERM182。
- 33.
Brugièren,Dubois F,Masclaux C,Sangwan Rs,Hirel B:谷氨酰胺烟草中谷氨酰胺合成酶的免疫定位(烟草表明氨同化作用逐渐向叶肉细胞质转移。植物学报。2000,21(4):519-527。10.1007 / s004250000309。
- 34.
Olea F,Perez-GarcíaA,Cantónfr,Rivera Me,Cañasr,阿维拉C,Cazorla FM,Cánovasfm,de Vicente A:由细菌病原体感染的番茄叶中芦笋合成酶的上调和定位两.植物营养与肥料学报。2004,29(4):489 - 494。10.1093 /卡式肺囊虫肺炎/ pch092。
- 35.
Patzlaff A, McInnis S, Courtenay A, Surman C, Newman LJ, Smith C, Bevan MW, Mansfield S, Whetten RW, Sederoff RR, Campbell MM:松树MYB调控木质素的特征。acta botanica sinica(云南植物学报),2003,36(6):743- 743。10.1046 / j.1365 - 313 x.2003.01916.x。
- 36.
Goicoechea M, Lacombe E, Legay S, Mihaljevic S, Rech P, Jauneau A, Lapierre C, Pollet B, Verhaegen D, Chaubet-Gigot N, Grima-Pettenati J: EgMYB2,一种新的转录激活因子桉树木质,调节二次细胞壁形成和木质素生物合成。植物杂志。2005年,43:553-567。10.1111 / J.1365-313x.2005.02480.x。
- 37.
Gómez-Maldonado J,Avila C,De La Torre F,CañasR,CánovasFM,Campbell MM:谷氨酰胺合成酶启动子和MYB蛋白之间的功能相互作用。植物杂志。2004,39:513-526。10.1111 / J.1365-313x.2004.02153.x。
- 38.
Rogers LA, Dubos C, Surman C, Willment J, Cullis IF, Mansfield SD, Campbell MM:三种异位木质素突变体中木质素沉积的比较。植物生态学报,2005,27(6):759 - 763。10.1111 / j.1469-8137.2005.01496.x。
- 39.
Rueda-López M, Crespillo R, Cánovas FM, Avila C:单个Dof转录因子对两个谷氨酰胺合成酶基因的差异调控。acta botanica sinica(云南植物学报),2008,33(6):743 - 748。10.1111 / j.1365 - 313 x.2008.03573.x。
- 40。
王志强,王志强,王志强,等。植物氮素的动态变化及其对植物生长的影响。植物生态学报。植物生理学报。2010,30(4):593 - 598。10.1093 / treephys / tpq042。
- 41。
田文敏,彭世强,郝伯忠,吴建林,胡志辉,崔克明:杨树(杨树黄花在春季新梢发育过程中启动营养贮藏蛋白的积累。acta botanica sinica(云南植物学报),2005,28(6):717-725。10.1111 / j.1744-7909.2005.00093.x。
- 42。
杨志强,王志强:杨树氮素储存与季节循环的分子生理学和生态生理学研究。植物学报,2005,33(4):457 - 461。10.1111 / j.1469-8137.2005.01451.x。
- 43。
CantónFr,苏拉斯MF,Cánovasfm:树木中氮气动员和再循环的分子方面。光合作用研究。2005,83:265-278。10.1007 / s11120-004-9366-9。
- 44。
van Heerden PS,塔GH,Lewis Ng:氮地区的氮素代谢松果体taeda细胞培养。生物化学学报。1996,31(4):591 - 598。10.1074 / jbc.271.21.12350。
- 45。
关键词:谷氨酰胺合成酶,氮代谢,空间和时间表达,松枝发育acta botanica sinica(云南植物学报),2001,25(4):457 - 461。10.1046 / j.1365 - 313 x.2001.00938.x。
- 46。
谷氨酰胺合成酶和苯丙氨酸解氨酶在水稻幼叶中的重叠表达。植物营养与肥料学报。2001,13(4):489 - 498。10.1034 / j.1399-3054.2001.1130314.x。
- 47。
Hertzberg M, Aspeborg H, Schrader J, Andersson A, Erlandsson R, Blomqvist K, Bhalerao R, Uhlen M, Teeri TT, Lundeberg J, Sundberg B, Nilsson P, Sandberg G:木材形成的转录路线图。美国国家科学院学报。2001年,98:14732 - 14737。10.1073 / pnas.261293398。
- 48.
Kalluri UC, DiFazio SP, Brunner AM, Tuskan GA: Aux/IAA和ARF基因家族的全基因组分析杨树trichocarpa.植物营养与肥料学报。2007,29(6):759 - 762。
- 49.
Lan T,Yang ZL,Yang X,Liu Yj,Wang XR,曾QY:广泛的功能多样化杨树谷胱甘肽s -转移酶表基因家族。植物营养与肥料学报。2009,21(3):489 - 494。10.1105 / tpc.109.070219。
- 50.
De Bodt S,Maere S,Van de Peer Y:基因组重复和Anviosperms的起源。生态与发展的趋势。2005,20:591-597。10.1016 / J.Tree.2005.07.008。
- 51.
Hanada K, Sawada Y, Kuromori T, Klausnitzer R, Saito K, Toyoda T, Shinozaki K, Li WH, Hirai MY:复制基因介导的初级和次级代谢产物的功能补偿拟南芥.分子生物学进化。2011,28:377-382。10.1093 / molbev / msq204。
- 52.
Tamura K, Dudley J, Nei M, Kumar S: MEGA4:分子进化遗传学分析(MEGA)软件版本4.0。分子生物学与进化。2007,24:1596-1599。10.1093 / molbev / msm092。
- 53.
Larkin MA, Blackshields G, Brown NP, Chenna R, mcgetigan PA, McWilliam H, Valentin F, Wallace IM, Wilm A, Lopez R, Thompson JD, Gibson TJ, Higgins DG: Clustal W and Clustal X version 2.0。生物信息学。2007,23:2947-2948。10.1093 /生物信息学/ btm404。
- 54.
DEREEPER A,GUIGNON V,BLANC G,AUDIC S,BUADET S,CHEVENET F,Dufayard JF,Guindon S,Lefort V,Lescot M,Claverie JM,Gascuel O:Phylogyy.fr:非专业的强大的系统发育分析。核酸研究。2008,36:W465-469。10.1093 / nar / gkn180。
- 55.
T-Coffee:一种快速、准确的序列比对新方法。分子生物学杂志。2000,8:205-217。doi: 10.1006 / jmbi.2000.4042。302.
- 56.
Corpet F:分层聚类的多序列比对。中国生物医学工程学报。1988,16:10881-10890。10.1093 / nar / 16.22.10881。
- 57.
Higo K, Ugawa Y, Iwamoto M, Korenaga T:植物CIS.-作用调控DNA元件(PLACE)数据库。核酸研究,1999,27:297-300。10.1093 / nar / 27.1.297。
- 58.
Lescot M, Dehais P, Thijs G, Marchal K, Moreau Y, Van De Peer Y, Rouze P, Rombauts S: PlantCARE,植物数据库CIS.-作用调控元件和启动子序列硅分析工具的门户。核酸研究。2002,30:325-327。10.1093 / nar / 30.1.325。
- 59.
刘志刚,刘志刚,刘志刚,等:海松根系铵态氮调控基因的鉴定。氨基酸。2010,39:991-1001。10.1007 / s00726 - 010 - 0483 - 9。
- 60.
陈志刚,李志刚,李志刚:植物基因表达定量研究的内控机制。植物营养与肥料学报。2004,22(4):514 - 514。
- 61。
AFM:扩增效率:定量PCR数据分析中的连接基线和偏倚。核酸研究。2009,37:45-10.1093/nar/gkp045。
- 62。
Cánovas FM, Cantón FR, Gallardo F, García-Gutiérrez A, de Vicente A:海松发育早期谷氨酰胺合成酶的积累(松果体松树)幼苗。Planta。1991,185:372-378。
- 63。
ÁvilaC,García-gutiérreza,克斯诺瓦·r,cánovasfm:膦素治疗对苏格兰松树幼苗谷氨酰胺合成酶同种型的影响。植物生理学和生物化学。1998年,36:857-863。10.1016 / s0981-9428(99)80003-5。
- 64。
布拉德福德M:利用蛋白质染料结合原理定量微克数量蛋白质的快速敏感方法。分析生物化学。1976,72:248-254。10.1016 / 0003-2697(76)90527-3。
- 65。
A:用十二烷基硫酸钠和巯基乙醇萃取针叶树叶蛋白的测定方法。植物化学的分析。1995年,6:20 - 24。10.1002 / pca.2800060103。
确认
这项工作得到了西班牙科学与创新部的资助(BIO2009-07490)和军政府de Andalucía(组BIO114)的研究资助。我们感谢Juan Antonio Pérez-Claros在统计分析方面提供的帮助建议,以及雷麦黛丝·克雷斯皮略提供的出色技术支持。我们非常感谢Kirby和Cánovas实验室成员在这项工作的各个方面给予的友好帮助。我们还要感谢安东尼奥·德·维森特,感谢他慷慨赠送的丁香假单胞菌病原菌番茄。Angel García-Gutiérrez被授予Dirección General de Innovación Educativa y Formación del教授Consejería de Educación y Ciencia(军政府de Andalucía,西班牙)在Málaga大学进行为期一年的研究。爱德华·g·柯比感谢西班牙Educación y Ciencia部长在Cánovas实验室提供的休假奖学金。
作者信息
隶属关系
相应的作者
附加信息
作者的贡献
VCR进行了实验。AGG提供了生物信息学分析并做了插图。JC参与了qPCR工作。CA对蛋白质工作有贡献。AGG、CA和FMC构思了本研究。手稿由EGK和FMC撰写。所有作者阅读并批准了最终的手稿。
电子辅料
主成分分析(PCA)
额外的文件1:GS.与木质素生物合成和C1代谢有关的基因.的表达式概况GS.在杂交杨树的木材形成期间在硅中检查基因(杨树tremulaxPopulus Temuloides.)使用可用的微阵列数据杨树DB (48].从形成层分生细胞发育的5个位置采集组织样品:形成层、早期膨大、晚期膨大、次生壁形成和晚期细胞成熟。GS.基因:ptgs1.1 - 710678,PTGS1.3-827781和ptgs2 - 725763;木质素的基因:ptpal - 696959,PTCCOAMT-691730.,ptaldomt - 345776;C1新陈代谢基因:ptgdc - h - 570626,ptmthfr - 654300,ptahcy - 540785,ptmtr - 738504和ptmat - 689393.分析变量(木质化过程中的基因表达水平)在两个第一主成分上的曲线图:分别为90.8%和3.3%的方差。多数基因共表达值与第一主成分呈正相关。第二个主成分的主要特征是相互排斥的表达ptgs1.1 - 710678和ptgs2 - 725763分别。(JPEG 290 KB)
预测和测序杨树的CDNA
额外的文件2:GS.基因.预测和测序杨树的CDNAGS.列出的基因。(XLS 18 KB)
作者为图像提交的原始文件
下面是作者提交的原始图片文件的链接。
权利和权限
开放获取本文由BioMed Central Ltd授权发表。这是一篇开放获取的文章,是根据知识共享署名许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
Castro-Rodríguez, V., García-Gutiérrez, A., Canales, J。et al。谷氨酰胺合成酶基因家族杨树.BMC植物杂志11,119(2011)。https://doi.org/10.1186/1471-2229-11-119
收到了:
接受:
发表:
关键字
- 重复的基因
- 杂交杨树
- 木质素生物合成
- 叶子板
- 铵同化