抽象的
背景
叶绿体是发生光合作用的绿色质体。叶绿体的生物发生需要核基因和叶绿体基因的协同表达,并受发育和环境信号的调控。尽管对叶绿体生物发生和发育的遗传基础和调控机制进行了广泛的研究,但目前尚不清楚。
结果
Green Cauliflower突变体导致植物豆荚菌的异位发育,转动其他白色凝乳绿色。为了研究叶绿体发育的转录控制,我们使用RNA-SEQ方法比较绿色和白色凝乳之间的基因表达。深度测序产生超过1500万读,每个cDNA库的长度为86个碱基对。共发现总共7,155个基因在绿色和白色凝乳之间表现出至少3倍的变化。这些包括光调基因,编码叶绿素成分的基因,以及参与叶绿素生物合成的基因。而且,我们发现花椰菜细长HYPOCOTYL5(Bohy5.)在绿色凝乳中表达较高,而不是白色凝乳,与白色凝乳组织相比,形成2616次靶向基因,其中包括1600个上调基因和1016个下调基因,与绿色不同地表达。所有这些1600个上调的基因都是光的HY5靶向基因。
结论
RNA-SEQ在绿色凝乳中基因表达的基因组分析导致了与叶绿体发育相关的大量基因,并提出了调节基因在介导异位叶绿体发育中的光信号通路高阶段中的作用在绿色凝乳花椰菜突变体中。
背景
原质体的叶绿体生物发生需要核和叶绿体基因的协调表达[1],并主要受到诸如光的发展和环境暗示的调节。叶绿体中大约3000个蛋白质由核编码[2].它们参与叶绿体生物发生所需的大量功能过程。这些过程包括通过Toc/Tic复合物输入核编码蛋白、蛋白质与伴侣蛋白组装和拆卸、类囊体形成、色素合成、质体分裂和逆行信号传导[3.那4.].此外,已经显示出叶绿体外叶绿体的大量蛋白质,例如感受,光信号传感器和转录因子,涉及叶绿体发展[3.那4.].一方面,大多数属于这两种类别的基因对于叶绿体开发至关重要,因为它们的表达抑制导致叶绿体受损。另一方面,一些光信号通路基因,例如组成型光学骨膜1(COP1),COP10那COP11那退硫化1(Det1.),光敏色素相互作用转录因子3(PIF3.),用作测量基因表达的抑制剂和这些基因的功能突变导致异位叶绿体发育[5.-7.].相比之下,细长的胚乳5(HY5)作用于多个光感受器家族的下游[8.-10.]在遗传学上被描述为广谱光形态建成的正调控因子,并影响叶绿体发育[4.那11.].HY5-ΔN77的过表达已经被证明会导致下胚轴叶绿体的早熟发育[12.].确定这些基因在叶绿体发育过程中是如何协调表达的,需要对从非有色质体向叶绿体过渡期间的基因表达进行全基因组检查。
模型和其他植物物种中的突变是功能基因组学研究的重要资源。一些塑性发育突变体的分析识别塑性发育的重要调节基因。例如,ARC6.,发现的第一个基因对拟南芥突变体鉴定出在高等植物中具有全球对塑性分化的影响ARC6.[13.].这橙色(或者)编码锌指DnaJ富含半胱氨酸结构域的蛋白质的基因从橙凝花椰菜突变体中分离出来,并已被证明负责白质转化为染色体[14.].绿色凝乳花椰菜突变体是一种自发突变,凝乳中叶绿体发育异常。与叶绿体发育受损的其他突变体相比,绿色凝乳突变体是在诸如红细胞形成叶片中的非光合白组织转变为绿色的非光合白组织。绿色凝乳花椰菜中的突变可能涉及足以用于叶绿体发育的基因,尽管白色凝乳花椰菜有可能抑制叶绿体发育的遗传机制,但是绿色凝乳突变将抑制的叶绿体发育。
在本研究中,我们使用RNA-SEQ方法在基因组规模上以绿色和白色凝乳中的基因表达分解了基因表达。我们组装了118,000个unigenes,平均长度为406bp的绿色和白色凝乳的cDNA文库,并检测到7155差异表达基因,表达至少3倍的变化。其中是与叶绿体发育相关的大量基因。我们也观察到这一点Bohy5.在绿色凝乳中表达量高于在白色凝乳中表达量,2616个hy5靶向基因存在差异。在这些hy5靶向基因中,1600个上调基因均为拟南芥中光照下的hy5靶向基因,提示其在拟南芥中具有一定的作用Bohy5.绿豆腐花椰菜突变体的异位叶绿体发育。
结果
带有绿色凝乳的花椰菜变种
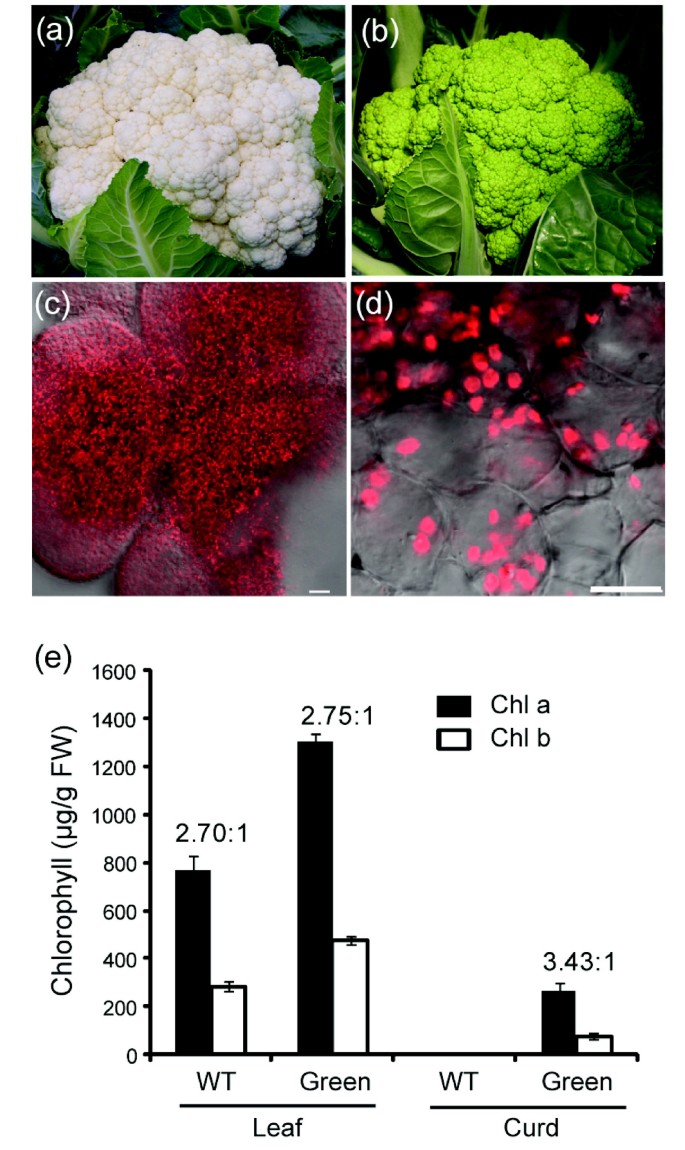
花椰菜凝乳由花序分生成的组成,通常含有颅骨和白皮形成,因此是白色的[15.].在市售的绿色花椰菜突变体中,叶绿体在凝乳中开发,转动其他白色的组织绿色(图1A和1B.).虽然突变植物在温室的正常生长条件下产生了绿色凝乳,但凝乳组织中的绿色色调强度受光强度的影响。在现场生长条件下,暴露于直射阳光的凝乳组织显示暗绿色,种植的暗影呈现较少的绿色色调。在共聚焦显微镜下的绿色凝乳细胞中清楚地观察到叶绿素中叶绿素的自发荧光(图1C和1D).
为了研究绿凝乳突变体的叶绿体发育,我们首先测定了嫩叶和凝乳组织中的叶绿素含量。绿色菜花植株叶片组织中总叶绿素含量高于白色对照。绿凝菜花叶片叶绿素含量为1780.4 μg/g鲜重,白凝菜花叶片叶绿素含量为1056.6 μg/g鲜重。虽然两种突变体的总叶绿素含量不同,但白色突变体和绿色突变体叶片的叶绿素a/b比值相似,分别为2.70:1和2.75:1。在344.4 μg/g FW时,绿花椰菜凝乳的叶绿素含量较叶片组织低。叶绿素a/b比值为3.43:1,表明绿凝乳中叶绿素a的积累远大于叶绿素b的积累(图)1E).如预期的那样,在白色凝乳组织中没有检测到叶绿素积累。绿豆腐花椰菜突变体为研究植物叶绿体生物发生的遗传基础提供了一个极好的模型系统。
绿色凝乳花椰菜基因表达的比较分析
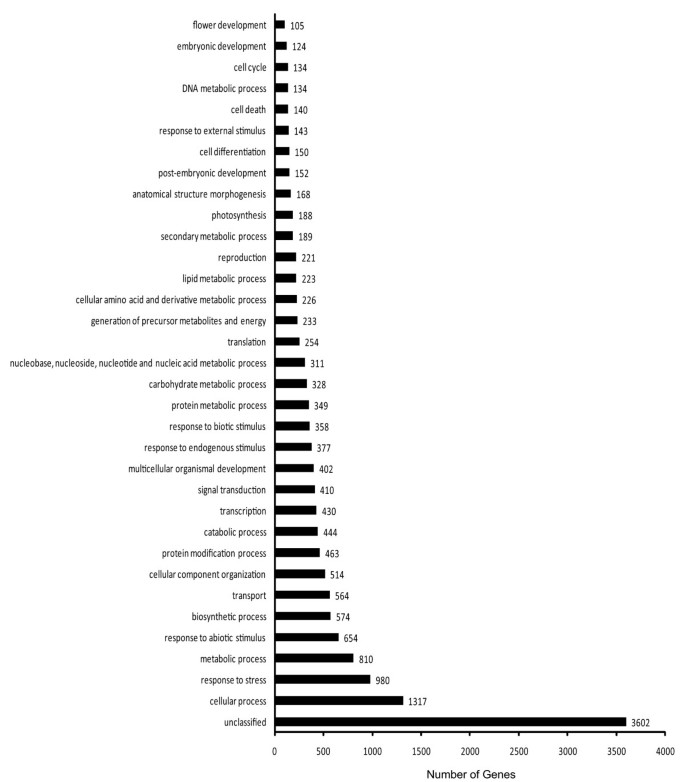
为了研究叶绿体发育的转录控制,RNA-SEQ用于监测绿色凝乳突变体和白色花椰菜之间基因表达的差异。每个图书馆都使用了一个Illumina Gaii Run的单线,并产生了来自每条车道的超过1500万86英镑的读数。由于目前没有可用于花椰菜的全基因组序列(芸苔属植物oleracea)基因组学资源芸苔由于RNA-SEQ读取的短长度,物种不适用,我们为我们的RNA-SEQ数据开发了一种新的分析策略,如方法部分所述。获得了总长度为406bp的118,000岁(包括替代剪接同种型)。统计学分析确定了绿色凝乳突变体和白色凝乳控制之间差异表达的7155个unigenes。其中,4436个基因(3.76%)表示至少3倍(附加档案1)和2719个基因(2.3%)在绿凝乳中表达比在白凝乳中至少低3倍(附加文件2).功能分类显示,这些基因在很大程度上涉及细胞过程(1317),对应激(980),代谢过程(810),对非生物刺激(654)的响应和生物合成过程(574)的响应。然而,一大群基因(3602)仍未分类(图2).
定量RT-PCR验证基因表达
为了验证RNA-seq方法获得的表达谱,我们利用qRT-PCR分析了14个筛选的基因的表达。这些基因编码光信号转导(FAR1、CRY2、PHOT2、LSH7、HY5、CIP1)、光系统II组分(LHCB5)、叶绿体组分(GUN5、LHCB1.5、Toc159、HSC70-1、ACP)、atp依赖肽酶(FtsH8)和叶绿素合成酶(G4)。其中上调基因11个(FAR1、CRY2、PHOT2、HY5、G4、Toc159、LHCB5、GUN5、LHCB1.5、FtsH8、ACP),下调基因3个(HSC70-1、CIP1、LSH7)。qRT-PCR观察到的这些基因表达模式的趋势与RNA-seq方法检测到的趋势一致(表1)1).然而,正如其他研究报道的那样,在折叠水平上存在差异[16.].
代谢途径的变化
为了识别绿凝乳突变体中受影响的代谢途径,我们基于所组装的花椰菜unigenes注释创建了一个花椰菜代谢途径数据库。利用Plant MetGenMAP分析系统对影响显著的途径进行了鉴定http://bioinfo.bti.cornell.edu/cgi-bin/MetGenMAP/home.cgi[17.].绿色凝乳突变体共有198种特异性代谢途径(P <0.01)(额外文件3.).正如预期的那样,许多参与叶绿体生物发生和功能的代谢途径被显著改变。这些包括与叶绿素生物合成相关的,如叶绿素a生物合成I、叶绿素a生物合成I、叶绿素a生物合成II、叶绿素a降解和叶绿素循环,以及类胡萝卜素生物合成(附加文件)3.).此外,与光合作用相关的途径,如氧气光合作用、卡尔文循环、光呼吸,以及发生在叶绿体中的其他代谢过程,如氨基酸生物合成和淀粉生物合成,也发生了显著变化(附加文件)3.).
参与叶绿体形成的基因
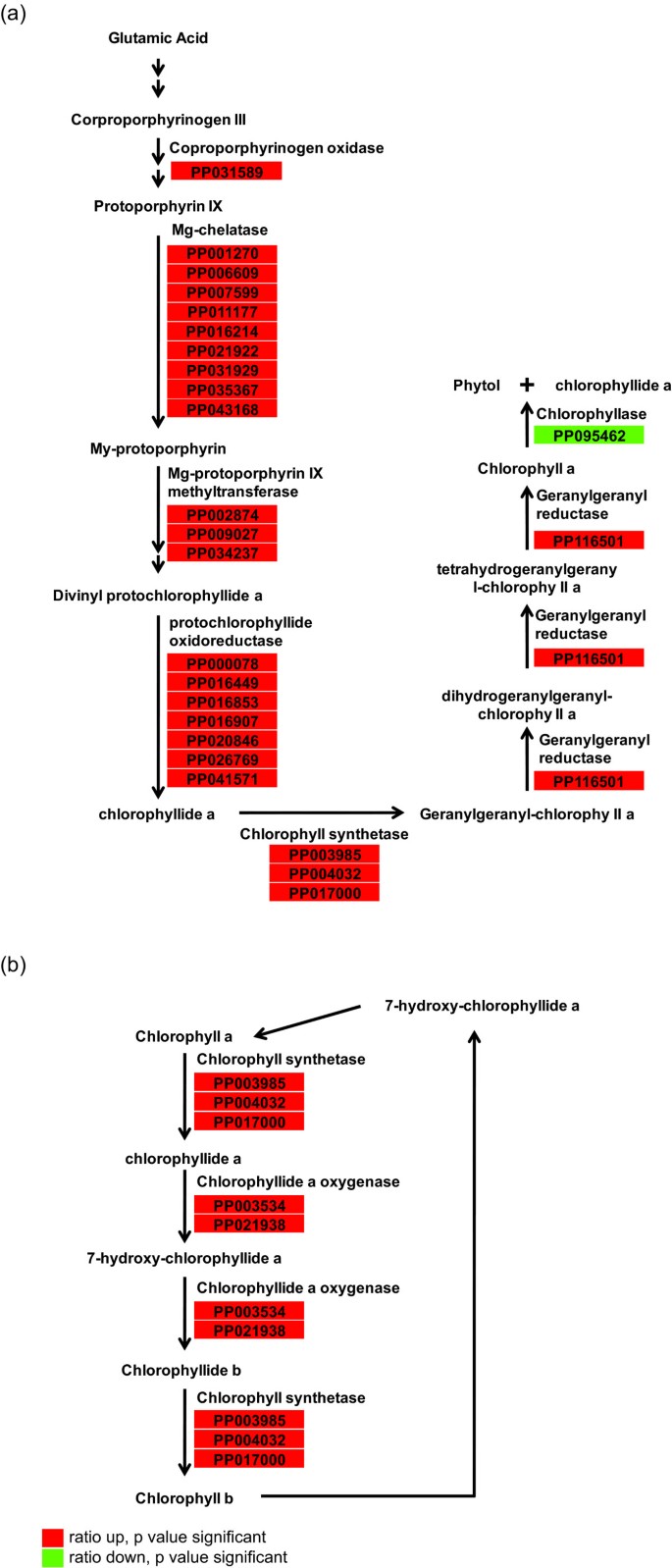
叶绿素和类胡萝卜素构成光合色素在光合作用中发挥关键作用。涉及叶绿素生物合成的许多基因被发现与白色相比,绿色凝乳中高度表达(图3.).上调基因包括Mg-chelatase这在叶绿素生物合成中起着关键调节作用。基因组未替换4.(GUN4PP005347)和基因组未替换5(GUN5,参与叶绿素生物合成的PP031929也在绿色凝乳中的较高水平表达。这两个基因是生产塑性对核逆行信号分子的那些基因中[18.那19.].许多基因在叶绿素生物合成中的上调导致叶绿素A和B中的叶绿素中的积累。同时,涉及类胡萝卜素生物合成的许多基因也受到上调(表2),表明光合色素的合成能力增强。与绿凝乳中叶绿素a和b的积累相一致,编码叶绿素结合蛋白的基因也上调(表)2).此外,编码光系统I和光系统II蛋白的基因是上调基因(表2),表明绿色凝乳组织中的叶绿体结构的发展。
叶绿素生物合成和降解途径相关差异表达基因的比对.(a)简化叶绿素a的生物合成和降解途径。(b)叶绿素周期。途径图由Plant MetGenMAP系统生成[17.].
在绿凝乳突变体中,除了光合器官的生物合成增强外,参与其他叶绿体生物发生过程的基因也有差异表达。Toc34和Toc159是Toc/Tic复合物介导蛋白从细胞质导入的重要组成部分[1].高水平Toc34(PP019500和PP051864)和TOC159(PP013646和PP007289)转录本在绿凝乳中观察到。进入叶绿体的蛋白质需要适当组装和折叠,这一过程是由一组伴侣蛋白(如HSP70和Cpn60)和蛋白质二硫异构酶介导的[3.那20.那21.].据此,在绿凝乳中发现伴侣蛋白HSP70 (PP031462、PP020739、PP094292)和蛋白二硫化物异构酶(PP012584、PP000051、PP028760)显著上调(附文件)1).
叶绿素催化叶绿素A的降解,得到叶绿素和植物的叶绿素[22.].叶绿素(PP095462)在绿色凝乳中的表达低于在白色凝乳中的表达,这可以解释叶绿素a在绿色凝乳中的积累(图3.).
叶绿体生物发生的信号基因
绿色凝乳突变体和白色凝乳花椰菜之间的大量差异表达基因表明,可以涉及信号转导级联中的高层次结构中的基因。COP / DET / FU是一组进化保护的蛋白质,代表光学发生的中央压缩机,包括叶绿体发展[11.].的表达未见变化COP1那COP10那COP11, 和Det1..COP9复合体作为叶绿体发展的抑制作用[5.那23.].出乎意料的是,我们发现COP9.(pp010178)和Fusca 12.(Fus12.)/COP9信号组复合亚基2(PP014936)在绿色凝乳中的表达水平高于在白色凝乳中的表达水平。这种高表达可能是负反馈的结果,如COP1的伴侣SPA1,它经常被发现是光诱导的[24.那25.].PIF是抑制光学发生的另一组调节剂。对于表达没有任何变化PIF3.和PIF4.绿色和白色的凝乳。有趣的是PIL2(PP058986)在绿色凝乳突变体中增加。
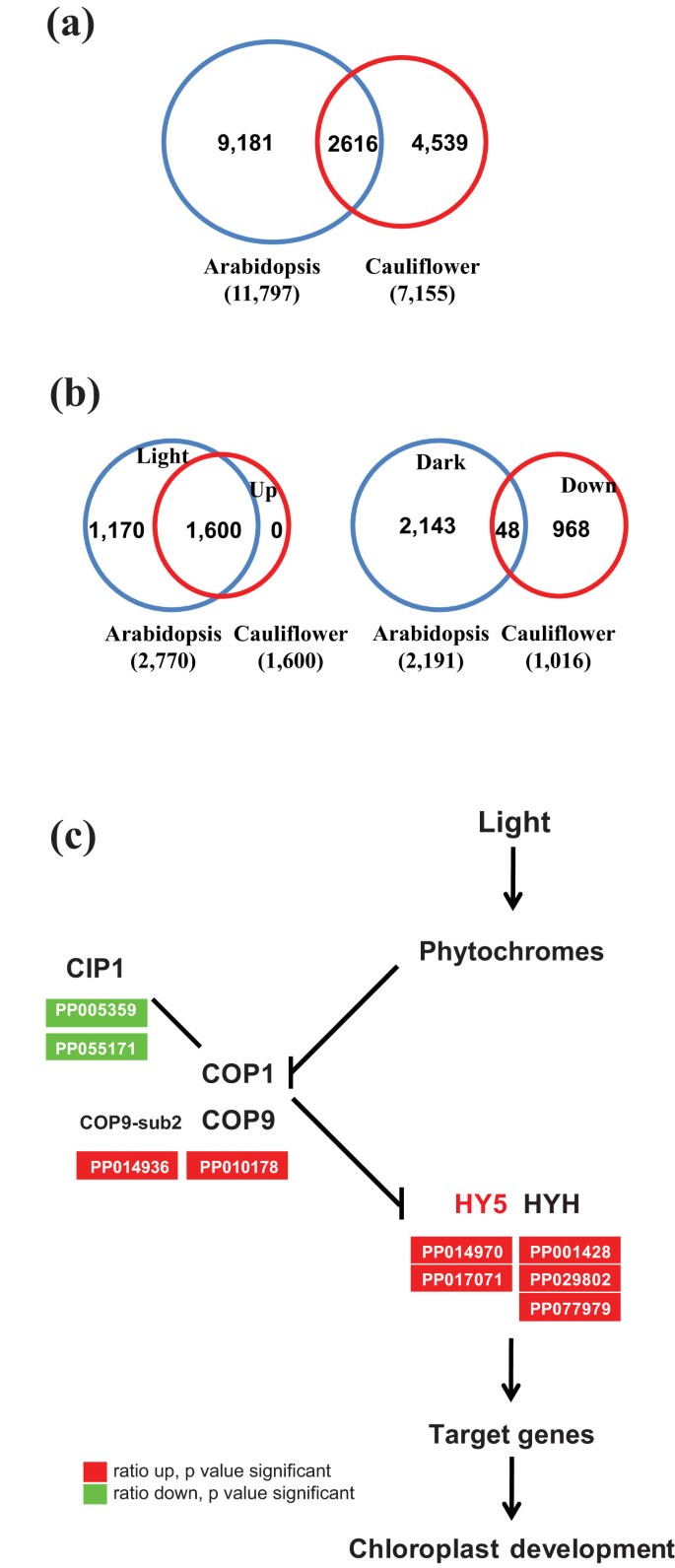
与那些光膀胱压缩机相比,Hy5是促进所有光线状况中的光学发生发育并直接调节光响应基因表达[8.那9.那26.-28.].在这里,我们发现了Bohy5.(pp014970和pp017071)和bohy5-homolog.(PP001428)在绿色凝乳的较高水平上表达而不是白色凝乳(表1和图4C).最近的一项研究是基因组图谱的绘制Hy5拟南芥中的介导的基因网络揭示了Hy5可以分别具有2770和2191的11,797个基因,分别是浅色和暗调节基因[26.].与拟南芥中HY5靶向基因的序列比较显示,共2616个菌落素HY5靶向同源物基因在绿色凝乳中差异表达(图4A).其中包括1600个上调基因和1016个下调基因(附加文件4.和5.).在光照条件下,1600个上调基因均为hy5靶向基因,而在黑暗条件下,48个下调基因均为hy5靶向基因(图)4B.).在1600个上调的hy5靶向基因中,有98个转录因子,包括拟南芥同源盒(ATHB-1PP003454),Phytochrome相关蛋白1(PP002569),Phytochrome相互作用因子3般的2(pp058986)和INDOLE-3-ACETIC酸诱导(IAA1PP013005)。44个转录因子包括RAP2.2(PP072648),APETALA1(pp029050),助线响应因子6(pp006891),和短的下胚轴2(PP011787)在绿色凝乳中下调。大量转录因子的显着改变可能导致对叶绿体生物发生和/或其他方法产生深远的影响。
比较的数量Hy5-介导的基因[26.]基于CALLOPAL的叶绿体开发中,用细菌凝固凝固凝固和光信号通路的简化模型进行差异表达基因。[11.].(a)Venn图,显示拟南芥中Hy5靶向基因与花椰菜的绿色凝固中的全差异表达基因之间的常见基因的数量。(b)VENN图,显示在花椰菜的绿色凝固的2616个曲线曲线的2616种同源物中的拟南芥中HY5调节基因之间的常见基因的数量。(c)相关差异表达基因对光信号通路的对准进行叶绿体发育。缩写如下:CIP1,COP1-交互蛋白1;COP1,组成型光学骨膜1;COP9,组成型光学骨膜9;COP9-SUB2,COP9信号组复合亚基2;HY5,细长的休氏5;hyh,hy5-homolog。
讨论
下一代测序平台(如Illumina GA测序系统)的大规模转录组测序已被证明是基因组水平基因表达分析的一种强大而有效的方法,并提供了比微阵列技术的几个优势[29.].由于RNA-seq方法提供了基因丰度的数字表示,并且统计数据通过泊松分布很好地建模,即使是一次复制也已被证明是足够的[30.].目前,RNA-SEQ方法已被广泛用于调查植物和动物的转录om,特别是对于具有全基因组序列的人来看[31.].已经开发了一些工具来绘制RNA-seq数据以参考基因组并量化转录本的表达[32.].然而,相对较少的报道表明,在没有参考基因组的情况下使用RNA-SEQ方法进行研究。在本报告中,我们使用RNA-SEQ方法来研究绿色凝乳突变体中的基因表达变化,以阐明叶绿体生物发生和发育的遗传基础。RNA-SEQ读取随着花椰菜的公共供应组装德诺维使用“方法”一节中描述的新型装配策略。共获得118000个ungene,其中7155个基因在绿凝乳突变体中表达至少3倍。其中,大量的基因参与了包括叶绿体发育在内的光形态建成,证明了RNA-seq方法在没有完全测序基因组的物种中成功地利用基因表达谱。
叶绿体的生物发生和发育是在许多过程的协调作用下进行的[3.那4.].环境信号和塑核因素都会影响这些过程。叶绿体发育的光调节已被充分证明[3.那4.那33.].光信号通路由植物致藻,转录因子和许多中间体组成,其控制光学血管血管血球发育。建议COP / DET / FUS蛋白在抑制非光合组织中抑制叶绿体发育的功能[4.].这些调控因子功能突变的丧失,如cop1和Det1.已被证明导致异位叶绿体发育,导致拟南芥根部绿化[5.那6.].事实是COP1和Det1.保持不变,并且在花椰菜的绿色凝固中改变了大量的光响应基因表明,光学调节等级中的其他调节基因负责绿色凝乳中的叶绿体发育。
在光信号级联中,HY5在光信号和叶绿体开发中起重要作用。Hy5接收上游信号,通过直接与这些基因的启动子的G盒直接结合到大量基因[9.那26.那27.].在这里,我们观察到更高水平HY5绿色凝乳突变体中的转录物。此外,Hy5靶向基因的2616个花椰菜同源物在绿色凝乳中差异表达。明显地,在2616个基因中,1600个是绿色凝胶化花椰菜的上调基因。所有1600个上调基因都是Hy5靶向基因的灯光表达了升高的表达的重要作用Bohy5.在绿色凝乳花椰菜突变体中介导叶绿体发育。此外,已知COP1负控制HY5活动[12.].虽然COP1在绿色凝乳和白色凝乳之间的表达水平相同,我们发现CIP1在绿凝乳中显著减少(图4C).拟南芥CIP1与细胞骨架有关,并已被假设以影响核和细胞质中COP1的分配[34.].低水平的CIP1可能影响了细胞核内的COP1活性,导致绿凝块中叶绿体异位发育。因此,Bohy5.信号转导级联中的高层次结构中的其他基因可以负责或协同工作,以调节叶绿体生物发生和在其他白色组织中的发育,产生尖锐的绿色凝乳突变表型。
最终,叶绿体的发展需要许多方法的协调作用,包括光合络合物的生物合成,核编码蛋白质的生物合成,进入叶绿体,进口蛋白的加工以及光合素的组装[3.那4.].实际上,发现许多参与光合色素生物合成以及颜料结合蛋白如叶绿素A / B结合蛋白的基因在我们的Green Curd Cailiflower的全基因组曲线上上调。大多数叶绿体蛋白质是核编码的,通过TOC / TIC VOLOCOCON复合物进入叶绿体[1].增加的表情Toc绿色凝乳突变体中的基因支持叶绿体靶向蛋白质进口的增强活性。进口蛋白质折叠并加工以形成功能性蛋白质。只需要长期参与其中涉及的分子伴侣HSP70和CPN60 [3.那20.].最近的一项研究表明,蛋白质的折叠也需要蛋白质二硫异构酶[21.].与蛋白导入活性增加一致,蛋白折叠和组装相关基因在绿凝乳突变体叶绿体发育中高度表达。
结论
在本研究中,我们使用RNA-seq在没有参考基因组的物种中比较了全基因组范围内的基因表达。本研究鉴定了大量与叶绿体发育相关的基因,并提出了提高表达的潜在作用Bohy5.和/或绿色豆腐花椰菜异位叶绿体发育的光信号通路的高层调控基因。我们的研究结果表明,RNA-seq作为基因组时代的一个强大工具,可以加速基因的功能鉴定,并有助于剖析作物自然发生变异的遗传基础。
方法
植物材料
白色凝乳花椰菜品种瘦腿(芸苔属植物oleraceal . var。葡萄孢属)和绿色凝乳突变线ACX800用于本研究。花椰菜植物在23°C或田地中在14小时光/ 10-H-暗循环下的温室中生长。在温室中,通过400μmol光子M的光强度提供自然的日光。- 2S.-1.收获新鲜凝乳组织,立即在液氮中冷冻,并在-80℃下储存,用于RNA提取和叶绿素提取。
RNA提取及cDNA文库构建用于测序
使用TRIzol试剂根据制造商说明(Invitrogen, Carlsbad, CA)从凝乳组织中提取总RNA,然后用RNeasy进一步纯化®植物迷你套件(Qiagen,瓦伦西亚,加利福尼亚州)。使用MRNA测序样品制备试剂盒(Illumina,San Diego,Ca,USA),构建来自5微克总RNA的绿色和白色花椰菜的CDNA文库。在康奈尔大学生科学核心实验室中心的Illumina / Solex基因组分析仪II系统上进行测序。
RNA-seq数据处理与分析
首先将原始Illumina RNA-SEQ读取读取使用内部Perl脚本去除低质量区域和适配器序列。为了消除rRNA序列污染,然后使用Bowtie将读取与花椰菜核糖体RNA(RRNA)序列对齐[35.],允许最多两个不匹配。从2010年6月收集了总共约60,000个Cauliflower Sanger Ests。这些EST在NCBI UNIVEC数据库中筛查了大肠杆菌基因组和花椰菜RRNA序列,除去那些污染物序列。使用IASSEMBLER组装所得到的高质量EST in unigeneshttp://bioinfo.bti.cornell.edu/tool/iAssembler.经过处理的Illumina序列然后使用蝴蝶结与花椰菜EST-unigenes对齐[35.],允许最多两个不匹配。一种德诺维然后使用Abyss进行未对准读取的组装[36.].使用IASSEMBLER进一步组装从ESTS和未对准的Illumina读取的unigenes。在映射到Est-Unigenes和德诺维比较每个单基因对应序列的转录本计数信息,得到RPKM(每千碱基外显子模型reads per million mapping reads)归一化后的相对表达水平[37.].使用Stekel描述的R统计方法测定绿色和白色凝固之间的差异基因表达的重要性等.[38.],并使用错误发现率对多次测试的原始p值进行调整[39.].假发现率≤0.01,倍数变化不小于3的基因被鉴定为绿凝乳和白凝乳差异表达基因。
为了鉴定在绿色凝乳突变体中影响的生物学过程,通过分配基因本体(GO)术语来注释差异表达的基因。鉴定了差异表达基因在一些特定生物过程中的潜在作用。此外,我们根据使用该路径工具的组装花椰菜unigenes的注释信息创建了代谢途径数据库[40].然后将途径数据库整合到Plant MetGenMAP系统中[17.]以确定受显著影响的途径。
通过定量RT-PCR验证RNA-SEQ
用oligo-dT引物和上标法合成cDNA®逆转录酶III(Invitrogen,Carlsbad,CA)。通过使用SYBR Green PCR母组合(Applied Biosystems,Ca)进行QRT-PCR。循环条件涉及在95℃下变性10分钟,然后在95℃下为40℃,60℃。分析解离曲线以验证RT-PCR的特异性。所选基因的相对表达被标准化为诱导肌动蛋白基因[14.].报告的值代表了三次独立试验中两次生物重复的平均值。所使用的基因特异性引物列于附加文件中6..
叶绿素的决心
将五十毫克的凝固研磨在液氮中,加入1ml 80%丙酮以提取叶绿素。在12,000g离心5分钟后,将上清液转移到新管中并在OD中测量645和od.663.叶绿素浓度采用MacKinney系数计算,公式如下:叶绿素a = 12.7*(OD663)-2.69 *(OD645)和叶绿素B = 22.9 *(OD645) * -4.48 (OD663)[41.].
绿色凝乳中叶绿体的共聚焦分析
新鲜的绿色凝固花椰菜组织被手工切断和检查在Leica TCS SP5激光扫描共聚焦显微镜(Leica Microsystems,外显子,PA USA)下检查,以检测叶绿素激光激发的自发荧光,在680nm处为488nm和发射过滤器。
缩写
- COP1:
-
组成型光学骨膜1
- Det1:
-
退硫化1
- HY5:
-
细长的下胚轴5
- Phya:
-
光敏色素的
- PIF3:
-
植物色谱相互作用转录因子3
- FAR1:
-
远红障碍反应1
- Cry2:
-
加密影像2
- phot2:
-
PHOTOTROPIN 2
- LSH7:
-
光敏缺口7
- CIP1:
-
COP1交互蛋白1
- LHCB5:
-
照相系统II的光收获复合物
- GUN5:
-
基因组非耦合5
- LHCB1.5:
-
光电极II光收集复合基因1.5
- Toc159:
-
在叶绿体外壳膜的摇音器159
- HSC70-1:
-
叶绿体热休克蛋白70-1
- FtsH8:
-
ATP依赖性肽酶/ ATP酶/金属肽酶
- G4:
-
叶绿素合成酶。
参考文献
- 1。
黄志强,王志强,王志强,等:叶绿体生物发生机制的研究进展。细胞生物学杂志。2009,21:494-500。
- 2。
莱斯特:基因组时代的叶绿体研究。趋势通讯,2003,19:47-56。
- 3.
Pogson BJ,Albrecht V:叶绿体生物发生和发展的遗传解剖:概述。植物理性。2011
- 4.
Waters Mt,Langdale Ja:制作叶绿体。2009年,28:2861-2873。
- 5。
Wei N,Deng XW:作用的作用COP / DET / FU拟南芥幼苗开发的光控制基因。植物理性。1996,112:871-878。
- 6。
Chory J,Peto CA:突变Det1.基因影响细胞型特异性的光调节基因的表达和叶绿体发育拟南芥.美国国家科学院学报。1990年,87:8776 - 8780。
- 7.
PIF3是叶绿体发育的抑制因子。美国国家科学院学报。2009年,106:7654 - 7659。
- 8.
大山T,志村Y,冈田K:拟南芥hy5基因编码一种调节刺激诱导的根和下杆基的刺激蛋白的BZIP蛋白。基因开发。1997,11:2983-2995。
- 9.
Chattopadhyay S,Ang LH,Puente P,Deng XW,Wei N:拟南芥Bzip蛋白HY5在介导基因表达的光控制中直接与轻响应促进剂相互作用。植物细胞。1998年,10:673-683。
- 10。
赛jo Y, Sullivan JA, Wang H, Yang J, Shen Y, Rubio V, Ma L, Hoecker U, Deng XW: COP1-SPA1相互作用确定光敏色素a介导的HY5活性调控的关键步骤。基因工程学报,2003,17(4):442 - 447。
- 11.
LAU OS,DENG XW:植物激素信号传播时间:光和激素的集成商。CurrOp植物BIOL。2010,13(5):571-577。
- 12.
Ang LH,Chattopadhyay S,Wei N,Oyama T,Okada K,Batschauer A,Deng XW:COP1和HY5之间的分子相互作用定义了用于光控制的调节开关拟南芥发展。Mol细胞。1998,1:213-222。
- 13。
Robertson EJ,Pyke Ka,Leech RM:ARC6.,一种极端的叶绿体分裂突变体拟南芥也改变了茎和根尖的前质体增殖和形态。中国生物医学工程学报。
- 14。
Lu S,Van Ej,周X,Lopez Ab,O'Halloran DM,Cosman Km,Conlin BJ,Paolillo DJ,Garvin DF,Vrebalov J等:花椰菜或者该基因编码一种富含半胱氨酸结构域的DnaJ蛋白,介导高水平的-胡萝卜素积累。植物营养与肥料学报。2006,18(3):369 - 372。
- 15.
Paolillo DJ, Garvin DF, Parthasarathy MV:染色体或者花椰菜(芸苔属植物oleraceal . var。葡萄孢属).原生质。2004,224:245-253。
- 16。
吴佳,张玉玲,张海清,黄华,Folta KM,卢佳:全基因组表达谱葡萄属amurensis使用SOLEXA测序技术响应柔软霉菌的葡萄。BMC植物BIOL。2010,10:
- 17.
Joung JG,Corbett Am,Fellman Sm,Tieman DM,Klee Hj,Giovannoni JJ,Fei Z:Plant Metgenmap:植物系统生物学一体化分析系统。植物理性。2009,151:1758-1768。
- 18.
Larkin RM,Alonso JM,Ocker Jr,Chory J:Gun4,叶绿素合成和细胞内信号调节剂。科学。2003,299:902-906。
- 19.
Mochizuki N, Brusslan JA, Larkin R, Nagatani A, Chory J:拟南芥基因组未替换5(GUN5)突变体揭示了Mg-Chelatase H亚单位在塑性化对核信号转导中的累积。美国国家科学院学报。2001,98:2053-2058。
- 20。
Latijnouwers M,Xu XM,Moller SG:拟南芥基质70-KDA热休克蛋白对叶绿体开发至关重要。Planta。2010年,232:567-578。
- 21。
Shimada H,Mochizuki M,Ogura K,Froehlich Je,Osteryoung Kw,Shirano Y,Shibata D,Masuda S,Mori K,Takamiya Ki:拟南芥特异性叶绿体生物发生因子Cyo1是蛋白质二硫化物异构酶。植物细胞。2007,19:3157-3169。
- 22。
土谷:叶绿素降解的关键酶——叶绿素酶的克隆:脂肪酶基序的发现和茉莉酸甲酯的诱导。美国国家科学院学报。1999年,96:15362 - 15367。
- 23。
Wei N, Chamovitz DA, Deng XW:拟南芥COP9是一种新的信号复合物,介导光对发育的调控。Cell. 1994, 78: 117-124。
- 24。
Hoocker U,鹌鹑pH:Phytochrome A特定的信号传导中间Spa1直接用COP1相互作用,拟南芥中的光信号的组成抑制器。J Biol Chem。2001,276:38173-38178。
- 25。
Hoocker U,Tepperman JM,鹌鹑pH:spa1,一种对Phytochrome特异的WD重复蛋白发射信号转导。科学。1999年,284:496-499。
- 26。
张海英,何华,王小春,王晓峰,杨学忠,李丽,邓晓伟:基因组图谱的构建HY5-介导的拟南芥基因网络,涉及转录和转录后调控。植物学报,2011,65:346-358。
- 27。
Lee J,He K,Stolc V,Lee H,Lee H,Gao Y,Tongprasit W,Zhao Hy,Lee I,Deng X:转录因子Hy5基因组结合位点的分析揭示了其在光明调节中的分层作用。植物细胞。2007,19:731-749。
- 28。
李,李G,高年代,马丁内斯C、G,周Z,黄X,李JH,张H,沈Y,等:拟南芥转录因子细长的下胚乳5在Phytochrome的反馈调节中发挥作用。植物细胞。2010年,22:3634-3649。
- 29.
赫德PJ,纳尔逊CJ:下一代测序与微阵列在表观遗传研究中的优势。简短的Funct基因组学。2009,8:174-183。
- 30.
Brenner S,Johnson M,Bridgham J,Golda G,Lloyd DH,Johnson D,Luo S,McCurdy S,Foy M,Ewan M,等:Microbead阵列的大规模平行签名测序(MPS)基因表达分析。NAT BIOTECH。2000,18:630-634。
- 31。
李P,Ponnala L,Gandotra N,Wang L,Si Y,Tausta Sl,Kebrom Th,Pr,Patel R,Myers Cr等:玉米叶片转录组的发育动态。NAT Genet。2010年,42:1060-1067。
- 32。
赵魏黄X, X,唱T, Q,冯Q,赵Y,李C,朱C,陆T,张Z, et al: 14个农艺性状的全基因组关联研究大米一起。《自然》2010,42:961-967。
- 33。
m鱼牛:叶绿体发育和基因表达。Annu Rev植物植物植物Mol Biol。1988,39:475-502。
- 34。
Matsui M, Stoop CD, von Arnim AG, Wei N, Deng XW:拟南芥COP1蛋白特异性相互作用在体外用细胞骨架相关蛋白,CIP1。美国国家科学院学报。1995,92:4239-4243。
- 35。
Langmead B, Trapnell C, Pop M, Salzberg SL:人类基因组短DNA序列的超快和记忆效率比对。生物工程学报。2009,10:
- 36。
Birol I,Jackman SD,Nielsen CB,钱JQ,Varhol R,Stazyk G,Morin Rd,Zhao Y,Hirst M,Schein Je,等:新创使用ABySS进行转录组组装。生物信息学。2009,25:2872-2877。
- 37。
Mortazavi A,Williams Ba,MCCue K,Schaeffer L,Wold B:通过RNA-SEQ进行映射和定量哺乳动物转录om。自然医学。2008,5:621-628。
- 38。
来自多个cDNA文库的基因表达比较。基因组Res. 2000, 10: 2055-2061。
- 39。
Benjamini Y, Hochberg Y:控制错误发现率——一个实用而强大的多重测试方法。中国航空航天大学学报(自然科学版),1995,33(5):489 - 494。
- 40.
Karp PD, Paley S, Romero P:路径工具软件。生物信息学。2002,18:S225-S232。
- 41.
离体叶绿体中的铜酶。多酚氧化酶在甜菜属.植物理性。1949,24:1-15。
致谢
我们感谢王永强帮助我们分析BoHY5-有针对性的基因。我们感谢来自弗吉尼亚大学的李磊和张慧勇分享了拟南芥中hy5靶向基因的列表。我们感谢D. Reed帮助我们在地里种植花椰菜。美国科学院-农业研究中心基础基金资助项目;中科院/SAFEA创新团队国际合作项目资助项目(20090491019)。美国农业部是一个机会均等的提供者和雇主。本出版物中提及的商品名称或商业产品仅为提供具体信息的目的,并不意味着美国农业部的推荐或认可。
作者信息
隶属关系
通讯作者
额外的信息
作者的贡献
XZ设计了研究,进行了分子和生化分析,并写了稿件。ZF执行了生物信息学数据分析。TWT参与了项目的初始设计和讨论,并编辑了稿件。LL构建了研究并参加了稿件的写作。所有作者都阅读并批准了稿件的最终版本。
作者的原始提交的图像文件
权利和权限
开放访问本文由BioMed Central Ltd授权发表。这是一篇开放获取的文章,是根据知识共享署名许可协议(https://creativecommons.org/licenses/by/2.0.),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
周旭,费正,谭豪瑟et al。绿色凝乳花椰菜中异位叶绿体发育的转录体分析(芸苔属植物oleraceal . var。葡萄孢属).BMC植物BIOL.11,169(2011)。https://doi.org/10.1186/1471-2229-11-169
已收到:
公认:
发表:
关键字
- 叶绿素
- 蛋白二硫化物异构酶
- 叶绿素生物合成
- 叶绿体发育
- 叶绿体生源论