- 研究文章
- 开放获取
- 发表:
CYP98A22,一种专门从而为绿原酸合成的酚醛酯3'-羟化酶,作为增强Furanocoumarin浓度的新工具太阳之graveolens
BMC植物生物学体积12文章编号:152(2012)
摘要
背景
呋喃香豆素是一种已被证实具有治疗作用的分子,仅在少数药用植物中产生,如太阳之graveolens.在活的有机体内,这些分子对植物性昆虫的攻击起保护作用。呋喃香豆素是苯丙素家族的成员,其生物合成途径始于苯丙素家族p -coumaroyl辅酶a。属于CYP98A细胞色素P450家族的酶已被广泛描述为芳香酶元-羟化酶的各种底物,如p -香豆素酯衍生物,并参与香豆素如东莨菪素的合成。在呋喃香豆素生产植物中,这些酶直接催化与呋喃香豆素生物合成途径连接的下游步骤,并可能间接影响它们的合成。
结果
在本工作中,我们描述了第一个CYP98A编码基因的克隆和功能特征r . graveolens.使用烟草benthamiana作为一种异体表达系统,我们已经证明该酶添加了3-OHp -香豆素酯衍生物,但更有效的转换p -香豆素醌化成绿原酸比代谢p -coumaroyl shikimate。UV-B胁迫下,植物相应基因表达量增加。的r . graveolens cyp98a22开放的阅读框和同源的拟南芥Cyp98a3.开放阅读框在稳定的转基因植物Ruta中过度表达。对这两个植物系列的东莨菪素和呋喃香豆素的生产情况进行了分析。详细分析表明,这两个基因都能促进呋喃香豆素的合成,但CYP98A22不像CYP98A3那样影响东莨菪素的合成。
结论
CYP98A22过表达正向影响中呋喃香豆素的浓度R. graveolens。因此,该基因是一种有价值的工具,可以改造植物,使其具有更好的治疗价值,也可能对植食昆虫更具抵抗力。
背景
植物对环境的适应和在应激条件下的生存,如病原攻击,需要次生代谢产物,如多酚。这些分子广泛分布在植物界,目前已知的酚结构有8000多种,从简单的分子,如酚酸,到高度聚合的物质,如单宁[1].呋喃香豆素就是这类多酚的一种。尽管它们在植物生命中很重要,但它们的生物合成在分子水平上仍然相对缺乏记录。这些分子主要存在于芸香科、伞形科、豆科和桑科4个植物科中,作为植物抗毒素在植物防御系统中发挥不同的适应环境功能[2或在植物-昆虫相互作用中[3.].这些分子还显示出显著的物理化学性质,使它们具有潜在的毒性。它们可以通过抑制细胞色素P450 (P450)酶的活性来干扰酶的反应[4,5].它们还通过嘧啶碱的光环加成作用与核酸相互作用[6].这些特性使呋喃香豆素在治疗上有吸引力。例如,呋喃香豆素衍生物几十年来一直被用于治疗银屑病和白癜风等皮肤病[7].此外,呋喃香豆素在各个治疗领域还有其他应用,如多发性硬化症的对症治疗[8]、T细胞淋巴瘤光化疗[9,或多药耐药肿瘤的化疗[10].因此,增加植物中呋喃香豆素的产量以满足医药需求是有益的。为了达到这一目标,必须了解呋喃香豆素的生物合成途径,并确定如何提高这些分子的生产。
呋喃香豆素生产植物不是科学界的模范植物。因此,人们对它们的基因组和编码它们生物合成途径中酶的基因知之甚少。到目前为止,只有四个基因的功能特征被确定。两个p450,补骨脂素合成酶和当归素合成酶,已被描述,并专门参与这些分子的合成。这些合成酶分别催化补骨脂素和当归素中marmesin和columbianetin的转化[11,12].另一项研究报道了ao甲基转移酶在Ammi majus它催化了bergaptol转化为bergapten [13].最后,菲2+/α-酮戊二酸依赖性双加氧酶最近在太阳之graveolens,能够代谢p-香豆素辅酶a导致伞形素酮的合成,它是呋喃香豆素的直接前体[14].
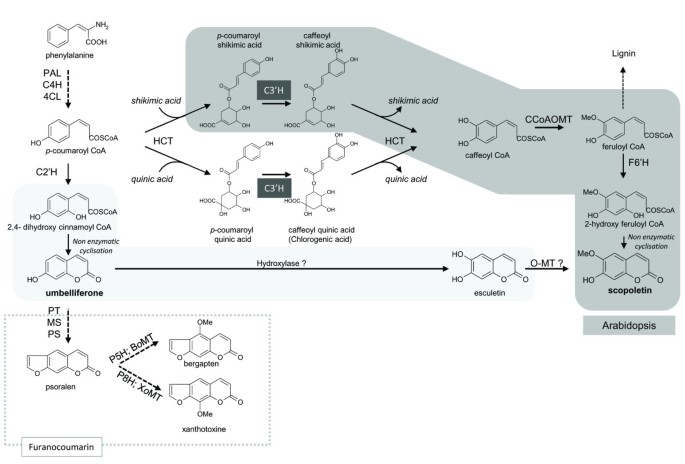
CYP98A (C3'H)是属于细胞色素P450家族的酶,能催化细胞色素元羟基化的p -香豆酸衍生物,苯丙酸途径的一个重要步骤(图1).这元-羟基化不是在游离状态下进行的p-香豆酸,但在上面p -香豆酸与莽草酸、奎宁酸、酪胺或苯乳酸酯化[15].在大多数研究中,这些酶对5-表现出优先亲和力O-shikimate和5 -O-D-quinate酯的反式p香豆酸(16- - - - - -18而4-香豆蔻酰-3 '、4 ' -二羟基苯基乳酸和p-香豆素酪胺也是分别形成迷迭香酸和咖啡酪胺的前体分子[18- - - - - -20.].最近,另一项研究证实了CYP98A家族获取植物花粉发育机制新功能的复杂进化过程[21].其他研究已经确定了这些酶在植物对不同分子的反应中的作用,如水杨酸衍生物和异烟酸[22], UV-C处理后相应基因的表达水平大幅提高[23].因此,CYP98A亚家族在苯丙素途径中起主要作用,其作用并不局限于直接合成咖啡酯衍生物,对植物代谢的影响更大。
简化的苯丙生物合成途径(PAL:苯氨裂解酶,C4H:肉桂酸4-羟化酶,4CL: 4-香豆素辅酶a连接酶,HCT:羟基肉桂酰转移酶,C3'H:肉桂酰酯3 ' -羟化酶),C2'H:p-香豆蔻酰辅酶a2 ' -羟化酶、PT:戊烯酰转移酶、MS: marmesin合酶、PS:补骨脂素合酶、P5H:补骨脂素5-羟化酶、BoMT:佛手酚o-methyltransferase, P8H:补骨脂素8-羟化酶,XoMT: xanthotoxolo-methyltransferase, F6'H:阿铁酰辅酶a羟化酶,CCoAOMT: caffeoyl CoA O-methyltransferase黑色虚线箭头:多步反应。
在目前的工作中,我们描述了识别和在体外/在活的有机体内新基因CYP98A22的酶学特征p-香豆蔻酯3'-羟化酶r. graveolens,这是第一个由呋喃香豆素生产工厂鉴定的CYP98。采用半乳糖诱导菌株pYeDP60/WAT11在酵母菌中的异体表达,以及在紫花苜蓿叶片中的异体瞬时表达n benthamiana与TBSV p19沉默抑制基因一起,iii)稳定表达r . graveolens植物。我们的结果清楚地表明,CYP98A22优先羟基化p -香豆素醛酸比p -香豆素莽草酯,因此似乎参与了绿原酸的代谢。叶片UV-B光胁迫下的表达量进一步分析CYP98A22揭示了一个增加cyp98a22信使rna的积累。最后,对转基因香豆素和呋喃香豆素进行了分析r . graveolensoverexpressingcyp98a22或cyp98a3结果表明,两种植物中呋喃香豆素的浓度均有增加,而东莨菪素的积累仅在CYP98A3植物中可见。因此,本研究表明CYP98A22可以作为调节呋喃香豆素含量的工具R. graveolens。
结果
鉴定CYP98A正交基因r . graveolens
识别CYP98A我们使用了基于pcr的方法和Morant等人描述的CODEHOP策略[24].首先,我们重点鉴定了属于CYP98A亚家族的基因。为此,我们对数据库中CYP98A的9个序列进行比对,确定了两个肽共识域(EWAMAEL和PFGAGRR),并定义了退化引物。取幼鱼基因组DNA进行PCR反应r . graveolens幼苗。一个389个核苷酸的DNA片段,与编码细胞色素P450的基因的内部序列相对应,随后被扩增并克隆。利用Blast工具进行Genbank同源性搜索,结果显示,从该菌株中分离出一个C3'H,在氨基酸水平上同源性达到89%Ocinum basilicum(AAL99200.1)。从幼嫩叶片中提取RNA,构建SMART cDNA文库,采用PCR技术分离相应的全长开放阅读框r . graveolens苗(14],如材料和方法中所述。结果序列(GenBank JF799117,附加文件1)全长1527 bp,编码508个氨基酸,与拟南芥CYP98A3的同源性为81%。
在体外CYP98A22的生化特性
为了鉴定CYP98A22的活性,将开放阅读框克隆到pYeDP60质粒中,并在酿酒cerevisaeLarbat和合作者所描述的WAT11菌株[11].在450nm处用CO差分光谱检测P450的功能表达。不幸的是,对于表达CYP98A22的酵母,在常规或改良的培养条件(诱导长度从12小时增加到24小时,诱导温度从28°C降低到18°C)中培养的细胞制备的微粒体无法检测到峰值。尽管无法检测到表达水平,但使用之前描述的P450家族酶的底物进行了培养。我们无法通过HPLC-DAD检测到任何显著的活性p -coumaroyl奎尼酸,p -coumaroyl shikimate,p-coumaroyl酪胺和p-三香豆素亚精胺为底物。与此同时,表达CYP98A3的酵母制备的微粒体功能良好,与其他结果一致,说明微粒体的制备是有效的。
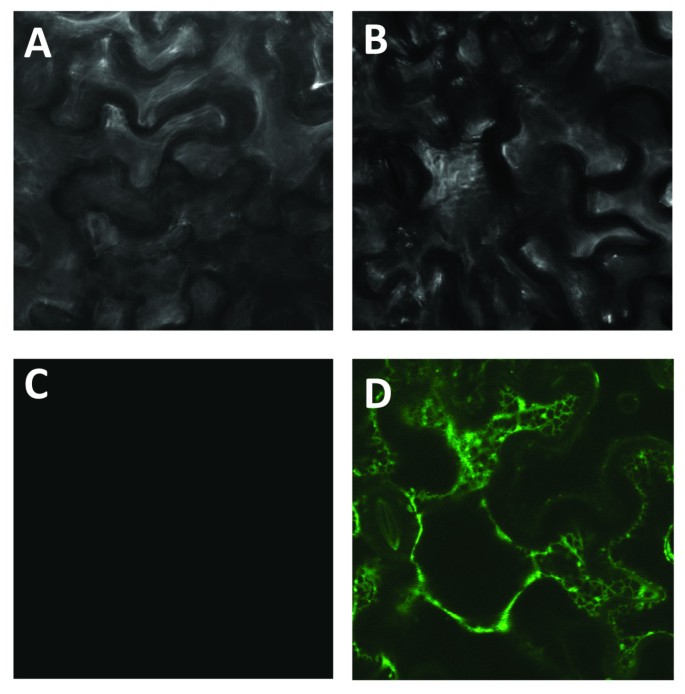
酵母表达系统中CYP98A22活性的缺失导致我们在另一种外源表达系统中产生该蛋白,例如烟草benthamiana,使用一种修改过的Voinnet协议et al。[25].为了初步监测相应蛋白的表达,我们将YFP蛋白融合到CYP98A22基因的C端。重组编码序列克隆到双质粒pBIN-GW [14并引入到LBA4404中根癌土壤杆菌应变(14].年轻的叶子n benthamiana渗透了农用pBIN- cyp98a22 - yfp或空pBIN质粒转化LBA4404。用pBIN61-P19转化的农杆菌共渗。在P19和CYP98A22-YFP共表达的情况下,在内质网水平观察到强烈的荧光信号(图)2D),而对照空质粒没有检测到信号(图2这些实验证明了这一点n benthamiana是表达CYP98A22的有效体系。
为了评估CYP98A22的功能,我们使用重组pBIN质粒进行第二组实验cyp98a22作为一个单一序列(不存在YFP)。与该质粒转化的农杆菌共渗n benthamiana叶子和重组农包含pBIN61-P19。同时,作为两个独立的对照,用不同的植株接种农用pBIN-CYP98A3或pBIN-GW空质粒转化。接种后4天,从浸润物中制备微粒体n benthamiana如材料和方法部分所述。对这些微粒体进行了检测在体外100μM的各种潜在底物,即p -coumaroyl shikimate,p -coumaroyl奎尼酸,p-tricoumaroyl亚精胺或p -coumaroyl酪胺。CYP98A22和CYP98A3两种蛋白在存在的情况下均未检测到代谢p-tricoumaroyl亚精胺或p -coumaroyl酪胺,但p -coumaroyl shikimate和p -结果表明,香豆蔻酰喹酸酯的保留时间和紫外光谱与胆碱酯和喹酸酯的保留时间和紫外光谱相似。使用LC/MS分析确认了咖啡酰产品的身份(见附加文件)2和3.).用空质粒进行渗透时,未观察到任何底物的代谢,表明来自于胞内的CYP98A的表达水平n benthamiana没有高到需要考虑的程度。V我/ K米和明显K米用质谱滴定法测定CYP98A22的动力学参数。结果表明,具有较高的表观亲和力(K米3.4倍),同时催化效率(V我/ K米9倍高)p -香豆素醌比醌p -coumaroyl shikimate(表1额外的文件4).
在足底CYP98A22的生化特性
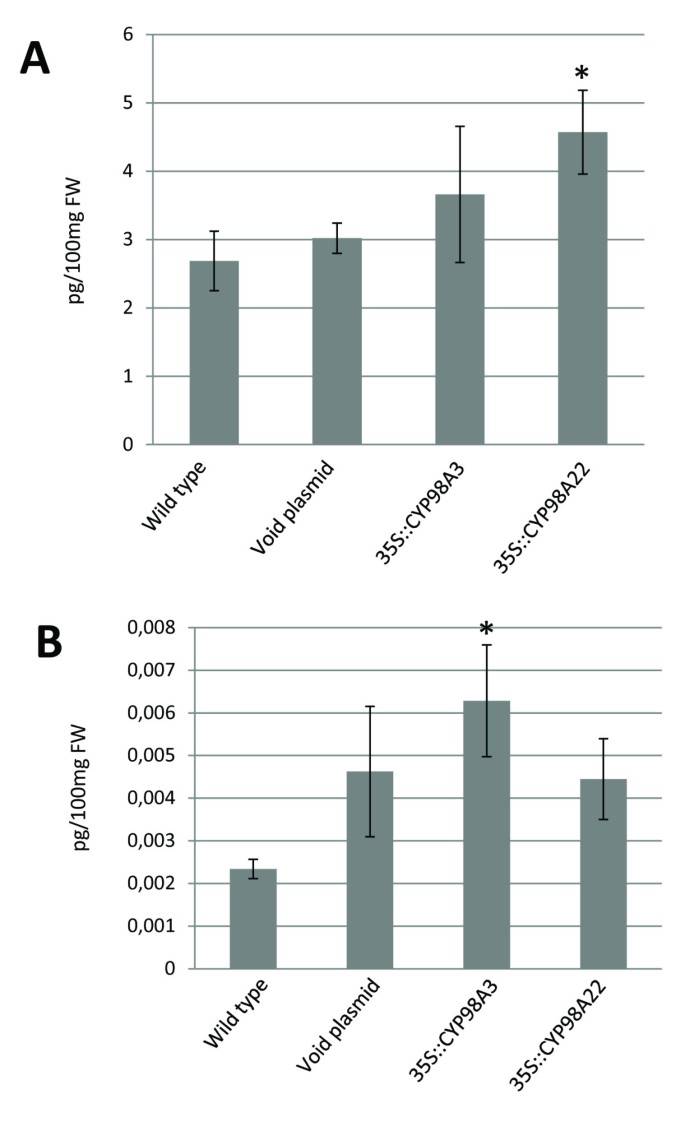
采用液相色谱-质谱联用技术(LC/MS)对野生型叶进行了初步的植物化学分析n benthamiana发现这些组织含有大量的p -香豆素,莽草酯和奎宁酯。因此,我们假设在足底CYP98A22在表皮细胞中瞬时表达后,可以检测其功能特征,因为存在该酶的潜在底物。这种方法有两个主要优点:准确性在体外结果可以证明,在蛋白质纯化过程中酶活性损失的风险降低了。为此目的,我们渗透进去n benthamiana叶子与重组农含pBIN35S::CYP98A22, pBIN35S::CYP98A3或空的pBIN-GW载体。用含有pBIN61-P19的农杆菌对所有浸润进行分析。经LC/MS分析,浸提液中绿原酸和莽草酸咖啡酯衍生物含量均有所增加CYP98A短暂的过度表达(图3.一个和3.B).当比较每个分子的积累与过表达的关系时cyp98a3或CYP98A22,我们观察到CYP98A22对绿原酸的产生更有效(图3.A)而CYP98A3似乎更专注于咖啡酰莽草酯的合成(图3.B)这些结果与获得的结果一致在体外结果表明,CYP98A22在植物微粒体中具有较强的特异性p -香豆素奎宁酸(绿原酸的前体)。
cyp98a22在r . graveolens
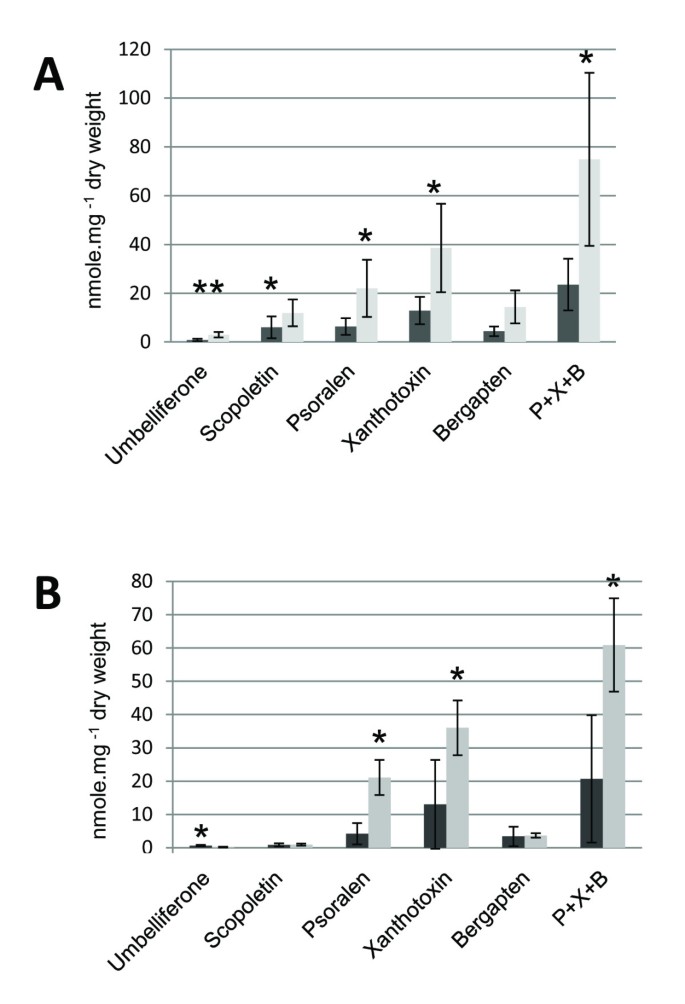
将CYP98A22和/或CYP98A3与香豆素或呋喃香豆素的合成建立联系,转基因r . graveolens产生了哪些过表达的相应基因.相同的重组农菌株,用于在n . benthamiana用于稳定转化(pin - cyp98a22或CYP98A3)。转换协议按照Lièvre所描述的方式执行et al。[26].利用PCR技术,在分子水平上鉴定了4株35S:CYP98A22和9株35S:CYP98A335 s - cyp98a22(内生cyp98a22基因未被扩增)和cyp98a3序列。对于每一株植物,样本被分成两半。前半部分进行RNA提取,real-time PCR确认转基因表达水平。后半部分用于提取酚分子,用高效液相色谱进一步分析。这些分析结果与一组野生型植物的提取结果进行了比较。东莨菪素、伞素酮和三种主要呋喃香豆素(补骨脂素、佛手柑烯和黄毒素)的含量r . graveolens进行了分析。对于35S:CYP98A3植物(图4A),东莨菪素和伞形素的浓度分别增加了2倍和3.6倍;p < 0.05)。对于35S::CYP98A22(图4B)植物,东莨菪素的产量没有受到影响,而伞形素酮的产量显著下降(3.2倍,p < 0.05)。结果显示,两种植物的呋喃香豆素含量均有显著增加(35S:CYP98A3植物增加3.2倍(p < 0.05), 35S:CYP98A22植物增加2.9倍(p < 0.05))(图3)4A和B)。
cyp98a22的组织特异性表达模式r . graveolens
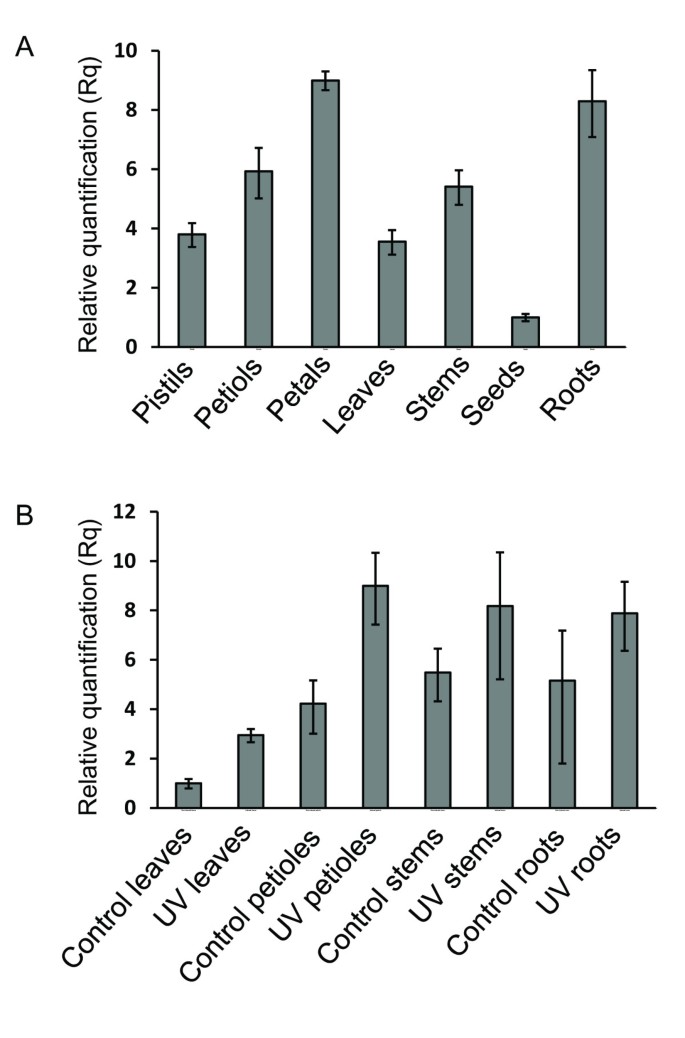
从3个月大的不同器官中提取总RNAr . graveolens植物(叶、种子、花瓣、雌蕊、根、茎)的相对表达模式cyp98a22采用实时PCR方法。选择两套引物进行定量分析cyp98a22这两种探针得到了相似的结果。结果显示该mRNA有广泛的表达模式(图5事实上,mRNA在所有被测试的组织中都被检测到,并且不局限于木质化组织。结果表明,在根和花瓣中表达量最高,在叶柄和雌蕊中表达量也极显著。而茎、叶和种子的表达量则低得多。
uv - b处理r . graveolens
如不同作者所述[14,27,呋喃香豆素的生物合成r . graveolens植物可通过暴露于UV-B辐射而增强.经24小时UV-B光(312 nm)照射后,紫花苜蓿的叶、茎、叶柄和根r . graveolens收集植物,提取总RNA和呋喃香豆素。作为对照,同样的萃取在未经紫外线处理的植物上进行。采用液相色谱-质谱联用(LC-MS)对经处理和未处理的植物中的bergapten、黄毒素、补骨脂素、marmesin和umbellliferone进行了定量分析。结果表明,紫外光处理后,紫外光处理植株中伞形花序酮含量增加了3.5倍(1.4 ~ 0.1 mg g)-1FW)与对照植株(0.4 _ 0.1 mg g-1FW),如Vialart所述et al。[14].对于其他分子,没有统计学上的差异可以证明。在Vialart等人发表的同一套材料上进行了实时PCR实验。的表达cyp98a22而叶柄、茎和根则没有显著的变化(图5B)。
讨论
P450 CYP98A基因亚家族的功能在文献中已经被广泛讨论了10多年。超过60种不同的基因已被测序并在国际P450数据库(http://drnelson.uthsc.edu/cytochromep450.html)作为属于这个亚家族的成员。这些蛋白质具有各种各样的功能。它们的活性被经典地描述为3' c催化羟基化p -coumaroyl shikimate和pcioumaroyl奎尼酸(15,23,28].然而,其他基质也被描述,如4-p-coumaroyl-3 -dihydroxyphenyllactate“4”(19],p -coumaroyl酪胺(18或亚精胺酯[21].在代谢的酶中p -香豆素莽草酯,一些被证明羟基化p -香豆蔻酰基喹酸酯的较低速率和效率[15],而另一些则根本无法代谢这两种基质[28].在某些情况下,这些酶被描述为对新陈代谢有更大的影响。例如,Schoch及其合作者[17研究表明,C3'H的存在是生物合成许多不同化合物的必要条件,如木质素、紫外线吸收色素、抗氧化剂、香料、香料和香豆素。综上所述,所有这些数据都表明这种酶起着核心作用(图)1)和苯基丙素途径的关键作用,并间接影响几个分子的合成。在这项工作中,我们假设从呋喃香豆素生产植物分离的同源基因可能影响这些分子的合成,并在应对各种胁迫中发挥重要作用。
关于…的基因组我们所知甚少r . graveolens是一家生产呋喃香豆素的工厂。在核酸或蛋白质数据库中只有很少的资料(少于80份),并且没有与aCYP98A同源基因被发现。然而,每个P450亚家族都有几个保守的共识结构域,这使得利用基于序列的PCR方法克隆和鉴定植物细胞色素P450基因成为可能。因此,我们采用了一种PCR方法,利用退化引物[24从…中分离出一个基因r . graveolens可能编码一个c ' h的基因组。开放阅读框架(ORF)的翻译产物,cyp98a22(Genbank JF799117),与数据库中25条肽段序列进行比较。结果表明,该蛋白与参与木质素前体合成的经典C3'H酶聚类,其中首个功能描述为C3'H的CYP98A3酶聚类,未与分化型CYP98酶聚类拟南芥其中CYP98A8和CYP98A9参与合成N10-monosinapoyl -N1N5-二羟基阿铁酰亚精胺,花粉的重要成分[21].这第一组数据似乎表明,这种酶可能是一种传统的C3'H,有可能被代谢p -coumaroyl奎尼酸和p -coumaroyl shikimate。
利用酵母表达系统的植物细胞色素p450的生化特性[29由于这些膜结合蛋白的低丰度和不稳定性,通常很难找到。因此,表达p450的几种不同的异体系统,包括酵母,大肠杆菌杆状病毒,在文献中有描述。为了对CYP98A22进行酶学表征,我们选择了Pompon和合作者所描述的酵母表达系统[29广泛用于P450家族蛋白的异种表达和酶活性表征。这种系统对某些酶的生产是有效的[30.但其他植物酶的生产受到限制。文献中提出了各种改进建议,包括改变媒体和文化条件[31],即核苷酸序列的修饰或交换(基因的部分或全部编码)[32,33]或更换膜锚[32][12].在这种系统中,通常使用一氧化碳差分谱来评估P450的表达水平。达到…的表达cyp98a22在美国,他们采用了其中一些策略。尽管在任何测试策略中,CO光谱均未观察到450 nm处的峰,但我们使用制备的微粒体使用以下底物进行代谢测试:p -coumaroyl奎尼酸,p -coumaroyl shikimate,p -coumaroyl酪胺,p -tricoumaroyl亚精胺。没有检测到任何底物的转化,而代谢p -在CYP98A3酵母微粒体存在下观察到香豆蔻酰喹酸和shikimate。这种缺乏表达至今还不能解释,但使我们转向另一种蛋白质异体表达系统。
为了测定CYP98A22的活性,我们使用n benthamiana作为一种替代的异种表达系统。利用粒子轰击作为转移T-DNA的技术,细胞色素p450在植物花瓣的瞬时转化已经在文献中描述[34,35].该系统的使用也被报道用于生物碱植物抗毒素生物合成途径中属于CYP71A亚家族的P450的功能表征[36].
为了验证该植物异体表达系统对CYP98A22的表达效率,我们首先构建了由CYP98A22和黄色荧光蛋白(YFP)组成的融合蛋白。将该重组ORF置于CaMV 35S启动子的控制下,并将其农渗于牛蒡子的表皮细胞中n benthamiana.由于没有观察到荧光,第二组浸润是在一个质粒的存在下进行的,允许表达番茄浓密矮病毒沉默抑制蛋白P19,正如Voinnet所描述的et al。[25].在这种情况下,对渗透叶片的分析显示了一个强烈的荧光信号定位于内质网。这一结果与Ro和合作者的工作一致,他们证明了肉桂酸4-羟化酶(C4H),一种苯基丙酸途径的细胞色素P450酶,结合在ER膜中[37].我们的研究结果表明,该植物系统在基因沉默抑制蛋白存在的情况下能够有效地表达CYP98A22的功能。
为实现该酶的功能表征,构建了一套含有ORF的质粒cyp98aA22和cyp98a3在pBIN载体的35S启动子的控制下,先农渗n benthamiana在TBSV P19存在下。作为第一次尝试,我们在渗透后4天从叶子中制备了微粒体,酶学测试表明,两者都是p -coumaroyl奎尼酸和p -香豆素莽草酯通过CYP98A22和CYP98A3羟基化成相应的咖啡因。而CYP98A22则表现出更高的效率p -以香豆素醌为底物p -香豆素莽草酯,而CYP98A3似乎优先代谢p -coumaroyl shikimate。第一个实验揭示了n benthamiana工厂系统是一种更有效的表达工具和在体外CYP98A22的特征比酵母系统。利用该植物异体系统进行CYP98A22的表达也提供了一种快速检测CYP98A22的方法在活的有机体内有关蛋白质的活性。除了一池p -香豆素醌酯和莽草酯,烟草中主要的苯基丙酸是绿原酸[38].这些分子在植物中的存在为确定过表达的CYP98A酶的活性和突出这些酶的天然功能提供了一个有趣的工具。在含有pin - cyp98a22的重组农杆菌侵染的叶片和未侵染的叶片上进行绿原酸和莽草酸的代谢谱和定量分析。结果表明,绿原酸含量显著增加。
为了完成这项研究,我们使用real-time PCR检测了组织特异性表达模式。事实上,如前所述,CYP98A P450亚家族的大多数成员都能催化高效的3 ' -羟基化p -香豆素莽草酯和更慢的咖啡基奎宁酸的合成[15,39].因为羟基化p-香豆素-shikimate是单酚木质素前体形成的关键步骤,这一观察到的活性,以及在茎和维管束中所描述的大多数C3'H的相对高水平表达,表明这些基因在木质素化中发挥重要作用[15,16,39].我们在研究中得到的关于表达模式的结果cyp98a22是有些不同。不像其他C3'H,cyp98a22显示广泛的表达式模式。在花瓣和根中表达较强,而在叶柄、茎和雌蕊中表达较弱。
综上所述,这些结果表明,即使CYP98A22与CYP98A3在系统发育上有关联,它也可能发挥着更复杂的作用,或者至少是不同的作用在足底。事实上,咖啡酰莽草酸在木质素化中起着重要作用,而咖啡酰喹酸衍生物,如绿原酸,被描述为生长调节剂、抗病因子、抗氧化剂和影响水果感官品质的化合物[40,41].CYP98A22更专注于绿原酸合成的能力是其参与胁迫反应的证据。
为了探究这一假设,将植株置于Vialart所描述的UV-B光照下24小时et al。[14].虽然呋喃香豆素的含量与未处理的植物相比没有增加,但UV-B诱导刺激了伞形素的合成,伞形素是这一途径的前体。此外,这些分析表明cyp98a22与未处理的叶片相比,紫外线处理的叶片中基因显著增加(3倍)。近年来,启发实验被应用于Cynara cardunculus引出…的表达cyp98a49使用紫外线- c灯[23].虽然这并没有提供无可辩驳的证据,但这些元素与CYP98A22参与对几种压力的反应的假设是一致的r . graveolens.现在必须深入探讨这些初步结果。
东莨菪素是一种重要的防御化合物,广泛存在于高等植物中,有两条生物合成途径(图)1).第一种通过阿铁酰辅酶A操作的路线由Kai和合作者演示[42在拟南芥中,这意味着转化p-香豆素莽草酸通过CYP98A3转化为咖啡基莽草酸,上游为阿铁酰coa [43].敲除后东莨菪素含量显著降低cyp98a3突变体,证实了拟南芥C3'H在该化合物合成中的作用。提出了一种从植物中获得东莨菪素的替代途径达芙妮mezereumL (43),Agathosma puberula[44其中伞形素和艾可素是东莨菪素的直接前体。它是未建立的r . graveolens如果这两种途径同时存在,或者只有其中一种普遍存在。研究CYP98A酶在东莨菪素合成中的作用r . graveolens,转基因鲁塔植物也过表达cyp98a3或cyp98a22生成的地方。所做的分析在体外在35S::CYP98A3植株中,东莨菪素含量显著增加,而在过表达植株中,东莨菪素含量显著增加cyp98a22与对照相比,东莨菪素含量没有任何变化。CYP98A3的结果与Kay的结果一致et al。[45他描述了C3'H在拟南芥东莨菪素合成中的关键作用。同时,在CYP98A22上得到的结果与我们的结果吻合得很好在体外调查得到n benthamiana,表明该酶在绿原酸的合成中具有优先作用vs在上述第一生物合成路线中的东莨菪素前体。通过对其他香豆素的分析,我们发现过表达CYP98A对转基因植物中呋喃香豆素的浓度有显著影响。这是一个意想不到的结果,因为C3'H并不直接参与呋喃香豆素的合成(图)1).呋喃香豆素含量增加的确切原因尚不清楚,需要进一步的代谢组学研究来阐明。
结论
本研究结果表明,CYP98A家族的成员即使具有高序列同源性,在所有植物中也不具有相同的功能。事实上,CYP98A22似乎更专注于绿原酸的合成r . graveolens.如前所述,呋喃香豆素是人类的药用分子。在足底,这些分子已被描述在植物防御植物食性昆虫的攻击。选择合成更多这些分子的植物将有助于它们的生产。根据我们的研究结果,CYP98A22是一个很好的候选基因:它对中呋喃香豆素的合成有影响r . graveolens.这些特性可用于代谢工程策略,以提高治疗感兴趣的分子的生产。这项工作也证实了代谢网络的研究为药用植物的生产开辟了广阔的研究领域。
方法
互补脱氧核糖核酸库
提取总RNA太阳之graveolens使用Plant Rneasy试剂盒(Qiagen)的植株。cDNA文库的制备方法如Vialart等[14].
CYP98A的扩增与克隆r . graveolens
CYP98A基因的CODEHOP扩增引物设计
用Clustal W进行肽序列比对CYP98A1 (AF029856),CYP98A2 (AF022458),CYP98A3 (AC002409),CYP98A6 (AB017418),CYP98A8 (AC011765),CYP98A9 (AC011765),CYP98A13 (AAL99200),CYP98A19 (AY064170),和CYP98A20 (AY065995)。将特异性引物对EWAMAEL CYP98A序列和PFGAGRR P450大共识域进行定向,得到98-11DIR: 5 ' -GAGTGGGCTATGGCTGARHTNRT-3 '和98-1R: 5 ' -CCTCCTGCCNGCNCCRAANGG-3 '。引物5′端未简并,密码子使用是基于类化合物,哪个也属于芸香料家庭。3 '端是完全退化的。PCR条件的设定与之前的研究中描述的一样[24],杂交起始温度为70℃,每一步降低1℃。
5 '和3 '端放大
利用设计的针对λTriplEx的CDS III和SMART IV引物(SMART cDNA Library Construction Kit, Clontech),结合部分内部序列设计的引物cyp98a22利用CODEHOP方法扩增基因。cyp98a22PCR扩增(98FLREV: 5 ' -GGGGTACCTTACAAATCAGCAGCAACACGTTT-3 ', 98FLDIR: 5 ' - ggggtaccatgggttctcccactcatccc -3 ')Kpn在5 '和3 '端插入I限制位点。该基因编码CYP98A从pYeDP69-CYP98A3质粒中扩增出3 [15],使用引物98A3DIRBam: 5 ' -GGGATCCATGTCGTGGTTTCTAATAGCG-3 '和98A3REVEco: 5 ' -GGAATTCTTACATATCGTAAGGCACGCG。PCR进行使用下列条件:94°C 5分钟,30 94°C的周期为15秒,15秒50°C, 72°C 90秒之后,最终在72°C扩展步骤10分钟。介绍了PCR碎片进入pCR8-GW-TOPO-TA矢量根据制造商的建议。
pYeDP60重组质粒的构建
重组pCR8质粒含有cyp98a22序列插入pYeDP60酵母表达质粒[29].空pYeDP60和pCR8质粒包含cyp98a22消化了Kpn用MinElute gel Extraction Kit (Qiagen)进行琼脂糖凝胶电泳。的cyp98a22插入物与pYeDP60载体混合,使用Invitrogen公司的T4 DNA连接酶进行连接。由此产生的克隆获得了大肠杆菌用菌落PCR检测细胞,确定编码序列的插入和方向。
YFP融合蛋白的构建及cyp98a22编码序列的克隆
设计cyp98a22c端融合与荧光报告是一个两步程序。第一套PCR反应的目的是得到cyp98a22有一个18个核苷酸的3 '端重叠在YFP(正向引物98FLDIR,反向引物98A22YFPREV: 5 ' -CCTTGCTCACCATGTGGCGACCGGTACCCCCCAAATCAGCAGCAAC-3 ')YFP在5 '端有一个额外的序列对应于最后18个核苷酸cyp98a22(正向引物98A22YFPDIR: 5 ' - gttgctgctgatttggggggggtaccggtcgccacatggtgagcaagg -3 ',反向引物YFPREV: 5 ' - ttacttgtacagctcgtccatgcc -3 ')。在第二组PCR反应中,将前一次PCR的产物混合,使用CYP98A22直接引物和YFP反向引物进行扩增,生成嵌合产物cyp98a22-YFP融合基因。按照制造商的建议将重组序列插入到pCR8载体(Invitrogen)中。
pBIN-GW质粒的亚克隆
将pCR8质粒中插入的基因按Invitrogen公司推荐的LR重组方式转移到pBIN-GW质粒中。将pBIN重组质粒导入LBA4404农应变([46]),所得克隆用于瞬时表达n benthamiana叶子还是稳定的转化R. graveolens。
酵母表达
的酿酒酵母WAT11菌株被转化为Pompon所描述的[29使用不同的pYeDP60重组质粒。相应蛋白的表达和微粒体的制备按Larbat等人的描述进行[11].
瞬时表达n benthamiana
为n benthamiana瞬时蛋白表达,4- 6周龄植株瞬时转染农pBIN 35S:98A3, pBIN 35S:98A22, pBIN 35S:98A22- yfp and pBIN61-P19 in accordance with the先前公布的协议[47].5毫升过夜农培养物成球,用水洗三次,水重悬。叶与农杆菌共渗(最终OD值)6000.2)包含一个pBIN-98结构和农杆菌属(在最后的OD6000.4)包含pBIN61-P19。用1毫升注射器(无针)轻轻按压下表皮进行浸润。
浸润性荧光分析n benthamiana叶子
接种96小时后观察到荧光(以融合蛋白的形式)。为了使用共聚焦显微镜观察荧光蛋白,将叶盘切除,安装在载玻片和盖玻片之间,用水真空渗透。用激光扫描共聚焦显微镜(Fluoview, FV10i, Olympus)观察叶盘。YFP的激发和发射波长分别为488 nm和505 ~ 545 nm。所呈现的图像是单焦点切片。图像处理使用ImageJ(美国国立卫生研究院,http://rsb.info.nih.gov/ij/)和Photoshop 6.0(最终图像组装;Adobe系统公司,圣何塞,加州)。
植物微粒体制备及酶活性测定
在接种后96小时收获约4克新鲜叶子,用液氮冷冻,并在研钵中研磨。细胞碎片重悬在0.1 M含有蛋白酶抑制剂(Roche)鸡尾酒的KPi缓冲液(pH 7.0)中,10000 g离心30分钟。上清液经奇迹布过滤,用SORVALL WX80超离心机以100,000 g离心1 h。小心地去除产生的上清,将颗粒重悬于200 μl 0.1 M KPi缓冲液(pH 7.0)中。所有微粒体制剂均在4℃下制备。
酶的合成p -coumaroyl奎尼酸和p -香豆蔻酰莽草酯按Morant的描述进行et al。[18].酶的测定是按照Larbat和合作者的描述进行的[11].过表达CYP98A22的微粒体与0.2 mM NADPH在含有100 μM的20 mM磷酸钠缓冲液(pH 7.0)中孵育p -coumaroyl shikimate或p -coumaroyl奎尼酸和p -香豆素酪胺或三香豆素亚精胺。反应在28℃下进行30 min,加入0.1 M HCl终止反应。动力学参数测定的衬底范围为4μM、5、7.5、10、20、30、50μMp -香豆蔻酰莽草酯和1μM, 2,4,5,7.5, 10,20,30 μ mp -coumaroyl奎尼酸。反应混合物在10000 g离心30 min,上清50 μl,采用反相高效液相色谱(LiChrospher 100 RP-18柱)-质谱联用分析。HPLC程序设置如下2O, 0.1%甲酸)和缓冲液B(100%甲醇,0.1%甲酸);用缓冲液B中10%的等温溶液5分钟,然后从10到80%的缓冲液B线性梯度15分钟,最后一个洗涤步骤。用二极管阵列检测器在330 nm处测量羟基化产物的吸光度。如Matsuno等人所述,使用电喷雾质谱仪在负离子模式下分析代谢产物caffeoyl shikimate和quinate的特性[21].明显的K米用SigmaPLOT 12.0 (Systat software Inc)软件将两种基质获得的数据拟合到Michaelis-Menten方程中。
绿原酸和莽草酸的衍生物n benthamiana和量化
浸后4天,收集6片独立渗透的叶片,用研钵液氮分别压碎。每一种制剂共0.1 g,在1ml 80%甲醇中提取奎尼衍生物分子,剧烈旋转1 min, 13,000 g离心20 min,取上清,蒸发干燥。固体提取物在100%甲醇中重悬,然后进行高效液相色谱分析。根据Hoffmann等人的描述,对绿原酸进行了跟踪和鉴定[48].与萃取过程开始时加入的外标物杉木素进行定量比较。
LC/MS分析咖啡酰衍生物
HPLC-MS系统由二元溶剂输送泵和线性离子阱质谱仪组成(LTQ-MS, Thermo Scientific, San Jose, CA, USA)。LTQ配备了在ESI负离子模式下工作的大气压电离界面。数据使用Xcalibur软件(2.1版)进行处理。质谱仪的操作参数如下。喷雾电压为4.5 kV,毛细管加热温度设置为300℃。护套、辅助气体和扫气的流速分别设定为40、10和10(以min-1为任意单位)。毛细管电压设置为-36 V,分裂透镜设置为44 V,前透镜设置为3.25 V。以0.1 g L的异吡啉为标准溶液,对各参数进行优化-1)的流动相[水+乙酸0.1% /甲醇+乙酸0.1%(90/10)],流速为5 μl min-1.通过质谱对咖啡酰莽草酸异构体进行检测2(335)特异性和全扫描(100-400 m/z)。采用奎宁酸咖啡酯和莽草酸咖啡酯标准溶液定量。
植物材料和UV-B处理
的r . graveolens种子在土壤中发芽。温室条件下的实验设置与Vialart和合作者所描述的类似[14].
实时聚合酶链反应
为了检测组织特异性基因的表达,从100 mg的新鲜组织中提取mRNA,这些新鲜组织分别来自叶、根、茎、叶柄、花瓣、种子和花r . graveolens植物使用RNeasy植物-迷你工具包(Qiagen)。高容量rna -cDNA主混合(应用生物系统)用于第一链cDNA的合成。每个器官共1 μg RNA用寡核苷酸(dT)进行逆转录。17作为底漆。在使用前,将获得的cDNA样品稀释1:100。使用以下程序进行实时PCR。特定的16S核糖体RNA引物来自r . graveolens作为数据规范化的内部控制(Rg16SDIR: 5 ' -CATTCGGCCCGTCTTGAA-3 ' forward和Rg16SRev: 5 ' -CCGTTGACTCGCACACATGT-3 ')。设计了两对引物进行定量分析cyp98a22.第一套引物序列为:98RTPCRDIR1: 5 ' -CACGGAGTTGGCGAAGGA-3 ', 98RTPCRREV1 5 ' -GGTGCCTGTCAGCCAATTG-3 '。第二套引物序列为:98RTPCRDIR2: 5 ' -ACAGCAGAGTGGGCAATGG-3 ', 98RTPCRREV2 5 ' - cctgtgctttgttgcactcta -3 '。三组探针采用Primer Express 3.0软件(Applied Biosystems)设计,使用标准线性曲线法确定其效率。同一基因在各器官的相对转录水平表示为某一特定器官的16S归一化转录水平与该基因在所有被测器官的平均表达量的log2比。
植物稳定的转变
的变换r . graveolens如前所述执行[26利用PCR方法在分子水平上对再生的转基因植株进行了表征。用Plant DNeasy Kit (Qiagen)提取基因组DNA。利用特异性引物进行PCR扩增。针对35S启动子设计了正向引物。该引物对所有被试植物均相同(35SDIR100: 5'-CACTATCCTTCGCAAGACCCTTCCTCTATATAAGGAA-3')。来确定转基因的存在cyp98a22和cyp98a3,我们使用了与上面描述的克隆步骤相同的反向引物。
系统发育分析
使用Clustal X软件对25条CYP98A基因序列进行比对。另外一个分散的CYP序列作为外群序列加入到比对中。利用邻域连接法建立了分子系统发育树。使用TreeView软件对树进行可视化。
参考
- 1.
植物酚类物质的提取、分析及其抗氧化和抗癌作用。分子工程学报。2010,15(10):7313-7352。10.3390 / molecules15107313。
- 2.
芹菜中的补骨脂素和其他线性糠香豆素类植物抗毒素。植物化学。1983,22(11):2595-2597。10.1016 / 0031 - 9422(83) 80173 - 3。
- 3.
关键词:呋喃香豆素,细胞色素P450,单加氧酶,特异性,底物接触率中国科学(d辑:地球科学),2003,22(增刊2):593- 598。
- 4.
8-甲氧补骨脂素和其他几种呋喃香豆素对细胞色素P450 2B1的失活机制。生物化学。1998,37(38):13184-13193。10.1021 / bi981198r。
- 5.
来自补骨脂素生产植物(Ruta graveolens)的一个C4H基因的克隆和鉴定。生物化学学报。2004,42(1):71-80。10.1016 / j.abb.2003.12.013。
- 6.
Dall'Acqua F, Vedaldi D, Recher M:呋喃香豆素与不同碱基组成的DNA之间的光反应。光化学。1998,27:33-36。10.1111 / j.1751-1097.1978.tb07561.x。
- 7.
局部补骨脂素紫外光A治疗银屑病、白癜风和湿疹的疗效观察。中华皮肤科杂志。2008,33(3):344-345。10.1111 / j.1365-2230.2007.02627.x。
- 8.
Pereira LE, Villinger F, Wulff H, Sankaranarayanan A, Raman G, Ansari AA:选择性kv1.3通道阻滞剂5-(4-Phenoxybutoxy)补骨脂素在恒河猴体内的药代动力学,毒性和功能研究。中国生物医学工程学报,2007,32(10):1338-1354。10.3181 / 0705 - rm - 148。
- 9.
Plumas JL, Drillat P, Jacob MC, Richard MJ, Favrot MC:体外光化学治疗克隆T细胞增殖。金银珩。2003,90(8-9):763-770。
- 10.
Kawase M, Sakagami H, Motohashi N, Hauer H, Chatterjee SS, Spengler G, Vigyikanne AV, Molnar A, Molnar J:具有肿瘤特异性细胞毒性和多药耐药逆转活性的香豆素衍生物。中国生物医学工程学报。2005,19(4):705-711。
- 11.
Larbat R, Kellner S, Specker S, Hehn A, Gontier E, Hans J, Bourgaud F, Matern U:第一个呋喃香豆素生物合成单加氧酶补骨脂素合成酶的分子克隆和功能表征。中国生物医学工程学报。2007,32(1):1 -5。
- 12.
Larbat R, Hehn A, Hans J, Schneider S, Jugdé H, Schneider B, Matern U, Bourgaud F:角呋喃香豆素生物合成首个P450单加氧酶CYP71AJ4的分离和功能鉴定。中国生物医学工程学报。2009,31(4):427 - 434。
- 13.
陈志强,陈志强,陈志强,等。呋喃香豆素生物合成的研究进展。生物工程学报,2003,23(4):429 - 434。王志强,王志强,王志强,等。10.1111 / j.1432-1033.2004.03995.x。
- 14.
Vialart G, Hehn A, Olry A, Ito K, Krieger C, Larbat R, Paris C, Shimizu B, Sugimoto Y, Mizutani M, et al .:一种2-氧戊二酸依赖的双加氧酶具有对香豆素辅酶a2 ' -羟化酶活性(C2'H),这是植物合成伞形素酮的一个缺失步骤。植物学报,2012,70:460-470。10.1111 / j.1365 - 313 x.2011.04879.x。
- 15.
schch G, Goepfert S, Morant M, Hehn A, Meyer D, Ullmann P, werk - reichhart D:拟南芥中CYP98A3是酚酯的3'-羟化酶,是苯丙酸途径中缺失的一环。中国生物医学工程学报。2001,27(4):569 - 574。10.1074 / jbc.M104047200。
- 16.
Sullivan ML, Zarnowski R:红三叶草香豆酸3'-羟化酶(CYP98A44)能够羟基化对香豆油-shikimate,但不能羟基化对香豆油-苹果酸:对phaselacid的生物合成的影响。植物学报。2010,231(2):319-328。10.1007 / s00425 - 009 - 1054 - 8。
- 17.
Schoch GA, Morant M, Abdulrazzak N, Asnaghi C, Goepfert S, Petersen M, Ullmann P, werick - reichhart D:苯丙类途径的间位羟基化步骤:途径及其调控的新复杂性。环境化学学报。2006,4(3):127-136。10.1007 / s10311 - 006 - 0062 - 1。
- 18.
陈志强,陈志强,陈志强,等:细胞色素P450家族在小麦中的催化活性、复制与进化。植物营养与肥料学报。2007,32(1):1- 9。
- 19.
杨志强,杨志强,杨志强,等。迷迭香酸生物合成中彩叶植物CYP98A14和NADPH的cDNA克隆及功能分析。acta botanica sinica(云南植物学报),2009,29(3):429 - 434。10.1007 / s11103 - 008 - 9420 - 7。
- 20.
Matsuno M, Nagatsu A, Ogihara Y, Ellis BE, Mizukami H:紫草CYP98A6编码4-香豆素-4′-羟基苯基乳酸3-羟化酶,参与迷smarinic酸生物合成。中国海洋大学学报(自然科学版)。
- 21.
Matsuno M, Compagnon V, Schoch GA, Schmitt M, Debayle D, Bassard JE, Pollet B, Hehn A, Heintz D, Ullmann P, et al .:花粉发育新的酚类途径的进化。中国科学:地球科学。2009,32(5):591 - 598。10.1126 / science.1174095。
- 22.
Basson AE, Dubery IA:由3,5-二氯水杨酸和2,6-二氯异烟酸诱导的菜豆细胞色素P450 cDNA (CYP98A5)的鉴定。植物营养与肥料学报。2007,19(4):421-428。10.1016 / j.jplph.2006.02.006。
- 23.
Moglia A, Comino C, Portis E, Acquadro A, De Vos RCH, Beekwilder J, Lanteri S: C3的分离与映射?H基因CYP98A49及其在UV-C胁迫下的表达。植物学报,2009,28(6):963-974。10.1007 / s00299 - 009 - 0695 - 1。
- 24.
王志强,王志强,王志强,等。基于CODEHOP策略的植物基因家族的遗传多样性研究。植物生态学报。2002,2:7-10.1186/1471-2229-2-7。
- 25.
关键词:番茄矮缩病毒,p19蛋白,基因沉默,瞬时表达植物学报,2003,33(5):949-956。10.1046 / j.1365 - 313 x.2003.01676.x。
- 26.
Lièvre K, Hehn A, Thi LeMinh T, Gravot A, Thomasset B, Bourgaud F, Gontier E: Agrobacterium tumefaciens介导的药用植物Ruta graveolens的遗传转化。植物科学学报,2005,168(4):883-888。10.1016 / j.plantsci.2004.11.001。
- 27.
低强度紫外线辐射对呋喃香豆素向叶表面挤出的影响。J Chem Ecol(历史档案)。[j] .地理学报,1998,19(5):939-952。
- 28.
Mahesh V, Million-Rousseau R, Ullmann P, Chabrillange N, Bustamante J, Mondolot L, Morant M, Noirot M, Hamon S, De Kochko A, et al .:来自咖啡树的两个对香豆素酯3'-羟化酶基因的功能特征:绿原酸生物合成候选基因的证据。acta botanica sinica(云南植物学报),2007,32(1):1 - 4。
- 29.
在优化的氧化还原环境中,动植物p450的酵母表达。方法酶法。1996,272:51-64。
- 30.
拟南芥nadph -细胞色素P450还原酶与P450 CYP73A5偶联的克隆、酵母表达及特性研究。中国生物化学学报,1998,16(3):427 - 434。10.1074 / jbc.272.31.19176。
- 31.
江洪,Morgan JA:酿酒酵母P450单加氧酶系统的优化。生物技术学报。2004,85(2):130-137。10.1002 / bit.10867。
- 32.
李志刚,李志刚,李志刚,等。P450和P450还原酶蛋白在单子叶植物中表达的研究进展。生物化学学报。2000,37(1):161-169。10.1006 / abbi.2000.1867。
- 33.
陈志强,陈志强,陈志强,等。P450和P450还原酶cdna的部分编码及其在植物和酵母中的表达。方法酶法。2002,357:343-351。
- 34.
细胞色素p450 CYP78A2的瞬时表达提高花色素苷产量。植物学报,2010,28(2):302-308。10.1007 / s11105 - 009 - 0153 - 9。
- 35.
关键词:蝴蝶兰,细胞色素P450基因,荧光定量pcr,荧光定量pcr生物技术学报。2003,25(22):1933-1939。
- 36.
Nafisi M, Goregaoker S, Botanga CJ, gllawischnig E, Olsen CE, Halkier BA, Glazebrook J:拟南芥细胞色素P450单加氧酶71A13在camalexin合成中催化吲哚-3-乙醛肟的转化。植物学报。2007,19(6):2039-2052。10.1105 / tpc.107.051383。
- 37.
杨树(Populus trichocarpa x Populus deltoides)肉桂酸4-羟化酶的功能特征和亚细胞定位。植物营养与肥料学报。2001,22(1):1 - 8。10.1104 / pp.126.1.317。
- 38.
王伟,李胜,赵旭,林波,杜勇:高效液相色谱-库仑阵列检测烟草绿原酸等6种次生代谢产物。中国华学汇。2007,25(6):848-852。
- 39.
关键词:拟南芥,CYP98A3,芳香3-羟基化,拟南芥基因的发育调控及在酵母中的表达。植物生理学报。2002,30(1):210-220。10.1104 / pp.008649。
- 40.
Ogunkanmi AB, Tucker DJ, Mansfield TA:一种改进的脱落酸和其他抗蒸发剂生物测定法。新植绿。1973,72:277-282。10.1111 / j.1469-8137.1973.tb02033.x。
- 41.
陈志强,陈志强,陈志强,等:绿原酸对菊蓟马抗性的影响。植物营养与肥料学报。2009,30(3):457 - 461。10.1104 / pp.109.138131。
- 42.
Kai K, Mizutani M, Kawamura N, Yamamoto R, Tamai M, Yamaguchi H, Sakata K, Shimizu BI:拟南芥中2-氧戊二酸依赖性双加氧酶对阿铁酰辅酶a进行邻羟基化合成东莨菪素。植物学报,2008,55(6):989-999。10.1111 / j.1365 - 313 x.2008.03568.x。
- 43.
瑞香素的合成。中国科学:地球科学,1998,16(3):417 - 417。
- 44.
杨志强,杨志强,杨志强:微柔毛不对称体形成微柔毛蛋白的中间体。植物化学。1988,27:391-395。10.1016 / 0031 - 9422(88) 83105 - 4。
- 45.
Kai K, Shimizu B, Mizutani M, Watanabe K, Sakata K:拟南芥香豆素的积累。植物化学学报。2006,67(4):379-386。10.1016 / j.phytochem.2005.11.006。
- 46.
Trieu AT, Burleigh SH, Kardailsky IV, Maldonado-Mendoza IE, Versaw WK, Blaylock LA, Shin H, Chiou TJ, Katagi H, Dewbre GR, et al .农杆菌在紫花苜蓿幼苗或开花植物中的渗透转化。植物学报,2000,22(6):531-541。10.1046 / j.1365 - 313 x.2000.00757.x。
- 47.
王东平,王东平,马绍峰:一种高效绿色生物反应器用于烟草治疗蛋白的制备。生物技术学报,2010,28(2):214-221。10.1016 / j.biotechadv.2009.11.008。
- 48.
Hoffmann L, Besseau S, Geoffroy P, Ritzenthaler C, Meyer D, Lapierre C, Pollet B, Legrand M:沉默羟基肉桂酰辅酶A shikimate/quinate羟基肉桂酰转移酶影响苯丙类生物合成。植物学报。2004,16(6):1446-1465。10.1105 / tpc.020297。
承认
作者要感谢Cedric Paris (LCA- ENSAIA - Nancy - France)的质谱分析)。
作者详细信息
1Université de Lorraine UMR 1121, Agronomie et environmental,南希-科尔马,ENSAIA 2 avenue de la forêt de Haye, 54505, Vandoeuvre-lès-Nancy,法国。2INRA UMR 1121, Agronomie et environment, Nancy-Colmar, ENSAIA 2 avenue de la forêt de Haye, 54505, Vandoeuvre-lès-Nancy,法国。3.法国斯特拉斯堡,67000,歌德街28号,CNRS UPR 2357。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
在目前的手稿中所描述的工作没有财务或非财务上的竞争利益。
作者的贡献
KF进行酵母和植物瞬时表达和酶学表征。OA进行了代谢组学和转录组学分析以及YFP融合构建。DS构建了转基因太阳之graveolens并进行了相应的分析。VG的待遇r . graveolens并进行了相应的分析。制备并合成了肉桂酯衍生物。DW参与设计的工作用酵母表达系统(WAT11-CYP98A3) HA进行了层发生分析和基因的分离和克隆。HA和BF构思了这项研究,参与了设计。AH和BF协调完成了书面稿件。所有作者阅读并批准了最终的手稿。
Fazeelat Karamat, Alexandre Olry对这项工作做出了同样的贡献。
电子辅料
12870 _2012_1116_moesm1_esm.doc
附加文件1:A)对9个CYP98A (CYP98A1 (AF029856))进行校准;CYP98A2 (AF022458);CYP98A3 (AC002409);CYP98A6 (AB017418);CYP98A8 (AC011765);CYP98A9 (AC011765);CYP98A13 (AAL99200);CYP98A19 (AY064170);CYP98A20 (AY065995)。只有蛋白质的c端被表示出来。 The conserved sequences used to design the CODEHOP primers are highlighted in yellow. B) Nucleotidic and peptidic sequence of CYP98A22 (Genbank JF799117). (DOC 30 KB)
对香豆蔻酰基喹酸代谢产物的鉴定。
附加文件2:A)代谢产物的MS分析:B) caffeoyl quinate的MS分析;C)女士2代谢产物分析:D) MS2咖啡酰奎宁酸的分析。(TIFF 19 MB)
代谢产物鉴定
额外的文件3:p -coumaroyl shikimate。A)代谢产物的质谱分析;B)莽草酸咖啡酯的质谱分析;C)女士2代谢产物分析:D) MS2咖啡酰齐天的分析。(TIFF 19 MB)
视K测量
额外的文件4:米CYP98A22。反应速率与不同浓度p -香豆蔻酰莽草酯(4μM-50μM) (A)p -香豆蔻酰喹酸酯(1μM-30 μM米使用SigmaPLOT 12.0软件将数据拟合到Michaelis-Menten方程中。(TIFF 18 MB)
作者为图像提交的原始文件
权利和权限
开放获取本文由BioMed Central Ltd授权发表。这是一篇开放获取的文章,是根据知识共享署名许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
Karamat, F. Olry, A. Doerper, S.et al。CYP98A22,一种专门从而为绿原酸合成的酚醛酯3'-羟化酶,作为增强Furanocoumarin浓度的新工具太阳之graveolens.BMC植物杂志12日,152(2012)。https://doi.org/10.1186/1471-2229-12-152
收到了:
接受:
发表:
关键字
- 绿原酸
- 黄色荧光蛋白
- 东莨菪亭
- Umbelliferone
- 贝加斯滕