抽象的
背景
rna沉默是一种保守的基因调控和监视机制,在植物中也被用作抗病毒的主要防御机制。不同的病毒特异性双链rna结构被沉默机制识别,导致病毒rna的降解,或如begomovirus那样,导致其DNA基因组的甲基化。病毒产生特定的RNA沉默抑制蛋白(RSS)来阻止这些宿主防御机制,当这些蛋白干扰沉默机制时,它们也干扰内源性沉默反应。在本文中,我们描述了如何表达AC2 RSS,由非洲木薯马赛克黄绒血症改变烟草的转录谱(尼科尼亚塔哈瓦姆)叶子和鲜花。
结果
诱导AC2 RSS的转基因烟草植物表达清楚的表型无论是在叶和花中的变化。这些植物的转录强烈改变,在叶和花的总的1118和251个差异表达基因,分别。三种最上调的转录组分别与压力有关,细胞壁的修改和信令,而三个最下调的组分别与翻译,光合作用和转录。这显示出很多的基因表达的改变的出现是相关的茉莉酮酸酯和乙烯的增强的生物合成,以及由这些激素调节,或对逆行由缩小光合活性和糖代谢信令引起的基因和途径的随后的增强.这些结果与HC-Pro的RSS表达植物的早期转录谱的比较发现,部分相同的基因都是由两种RSSS引起的,但它们的表达水平在AC2通常高于HC-Pro的RSS表达植株。所有的一切,都发现了大量的成绩单改建具体到每一个表达的转基因植物的RSS。
结论
转基因烟草中的AC2 RSS干扰了沉默机制。它引起应激和防御反应,例如通过诱导茉莉酸盐和乙烯的生物合成,以及随后由这些激素调控的基因表达改变。糖代谢的改变可能导致核糖体蛋白编码基因的显著下调,从而降低一般翻译水平。
背景
基因在植物中沉默
在所有真核生物中,保守的rna沉默分子机制构成了一个非常复杂的遗传调控网络。这些调控途径的共同特征是由双链(ds) RNA序列诱导。在植物中,这些是由RNAse III型DICER-LIKE (DCL)酶,HYPONASTI LEAVES1 (HYL1), SERRATE (SE)和DAWLE (DLL)蛋白协助切割的[1]变成21-25个核苷酸长的rna,称为(微)mirna或(短干扰)siRNA。在切割时,短RNA片段的3 '端被依赖于s -腺苷蛋氨酸的甲基转移酶HEN1甲基化[2],并加载到效应复合物中,称为RITC(RNA诱导的转录沉默复合物),或者在仓促蛋白的辅助中显然将其转运到细胞质[3.和负载RISC (RNA诱导沉默复合物)在[4].丽氏络合物含有siRNA,前4和以前6以通过组蛋白和DNA甲基化介导转录沉默(TGS)以重复或过度表达的DNA序列,导致异粒醇维持,转座迁移率和转基因沉默的控制。该RNA依赖性DNA甲基化(RDDM)机械至少利用DNA定向的RNA聚合酶PIRV和POLV,RNA依赖性RNA聚合酶2(RDR2),DICER样3(DCL3)enzyme,前4,前5,前6和DNA甲基转移酶(DRM2)[5[染色质 - 重塑蛋白质(DRD1),结构 - 维持 - 染色体 - 蛋白质(DMS3)和RDDM效应分子KTF1,其结合POLV和RECORANTS生成的支架转录物44次结合的SIRNA以形成RDDM效应复合物[6,7].
以RNA序列为靶点的RISC复合物,通过切割或翻译阻滞引起靶mrna的转录后沉默(PTGS) [8].miRNA介导的PTGS被使用,例如,以调节多种不同的转录因子,其中许多都需要在植物器官的发育分化的时间和空间表达,并且还调节沉默途径的各种组件,从而背调节这些途径本身。此外,许多的miRNA,以及各种siRNA的过多是已知参与遗传响应和信令各种激素和生物和非生物胁迫诱导的级联(在[审查9- - - - - -13.])。
小RNA靶向这些的沉默复合物,以分别部分或完全互补的DNA或RNA序列。在这些目标分子的效应物介导等转录基因沉默(TGS)或转录后基因沉默(PTGS)或减小的平移速度多个必不可少的调节功能(通过审查[8,14.])。在植物RNA沉默作为对病毒的主要防御机制。
植物RNA沉默的抑制
为了抵消沉默介导的宿主防御,植物病毒编码各种病毒rss [15.].RNA沉默的功能性抑制似乎是任何病毒成功入侵并在宿主植物中积累所必需的,在RNA沉默抑制的功能被发现之前,一些RSSs已经被确定为必要的病毒致病性因子和症状决定因素[16.].它的感兴趣的是,由不同的病毒家族编码的RSS因子彼此没有相似性,并且许多病毒产生其RSS活性作为一些基因产物的二次功能,其在病毒生命周期中也具有一些其他功能,例如某些基因产物。在复制中,小区到单元或系统性移动或封装(在[17.])。由于消声装置的高度复杂性,它可以在多个步骤中受到干扰,而且不同旋转导向系统的消声机制也非常不同。宿主的沉默机制及其与病毒RSSs的分子相互作用在过去十年中得到了深入研究[8,10.,17.- - - - - -20.它们似乎是中断和分析RNA沉默途径的极好工具。
植物中的原野毒病毒和沉默抑制
Begomoviruses,具有圆形SSDNA基因组,产生相反取向的转录物。它们形成部分DSRNA结构并激活植物的RNA沉默机械,但可以通过产生活性RSSS来抵抗这种抑制[21.- - - - - -23.].沉默不是(至少完全)针对病毒RNA转录物的靶向,而是针对病毒复制中间体,即由复制病毒DSDNA形成的小体组结构,与组蛋白蛋白结合[21.].沉默是由Tgs的介导的,即这些病毒DSDNA序列的甲基化,这导致抑制其复制和转录[24.].已知总共有三种不同类型的RSS被编码非洲木薯花叶现在,Geminivirus(ACMV)被归类为Begomovirus [23.,25.].主要的RSS已被确定为转录激活蛋白AC2,编码的意义与begomovirus迷你染色体相反。
在此,我们分析了表达ACMV begomovirus衍生的ac2rss的转基因烟草植株的转录组和蛋白质组。将这些基因表达谱中检测到的变化与我们早先在表达HC-Pro RSS的类似转基因烟草植株中检测到的变化进行了比较马铃薯病毒Y potyvirus[26.],揭示了这两种RSS在转基因烟草植株中功能机制的基本异同。
结果
烟草植物的表型表达AC2 RSS
本研究使用了一个先前描述过的转基因烟草系,在一个组成型CaMV 35S启动子下表达双生病毒AC2 RSS [27].表达AC2 RSS的转基因烟草植株(附加文件1)在与先前表达HC-Pro的转基因烟草植株相同的生长条件下同时生长[26.].核AC2蛋白在转基因烟草植株中表达后,叶片和花均发生了明显的表型变化,包括年轻转基因植株的叶脉和叶片的不同畸形(图)1一个和1b)。这些畸形逐渐消失,因为植物变老,但六周叶仍然存在一些表型变化;叶子比野生型植物中的叶子更窄,苍白的绿色(图 1C).生长习惯是短粗的。下部叶片常呈黄色,根颈和根系发育较野生型弱,成熟株体积略小于野生型。花蕾有时缠绕在其他花蕾上(图)1e)。花的结构往往,但不总是大幅畸形;花瓣中生长一起具有圆形或更经常地为矩形形状。花丝也经常改变额外的花瓣(图 1G-1我)。
AC2表达植物中的实验设计和差异基因表达
AC2 RSS表达植物的基因表达分析的同时执行HC-Pro表达的转基因烟草植物通过使用相同的野生型和空向量(pBIN61)表达控制植物被用于转基因HC-Pro表达植物,使用三个生物复制。利用Chipster程序(CSC, Espoo, Finland)将表明对照和AC2表达植株之间差异基因表达的强度值归一化。来自叶子和花朵样本的强度值分别归一化,就像HC-Pro样本一样[26.),(附加文件2).在AC2转基因和对照样品之间的表达两倍的变化被认为是差异表达的显著水平。差异表达基因的统计学显着性使用学生t检验测试,P值小于0.05,与假发现率(FDR)(参见附加文件3.额外的文件4额外的文件5额外的文件6).微阵列结果通过RT-qPCR进行验证。RT-qPCR和阵列结果在上调和下调转录本,以及在叶和花中都有很好的相关性(表1)1).表达没有变化的转录本作为参考转录本[28].
表现出在表达植物的转基因AC2的叶片和花中分配给各种官能团的差异表达转录物的数量 2.叶片和花中变异的转录本总数分别为1118和251个。392年共有726个转录上调和下调,与三大组织的差异记录相关信号,细胞壁的修改,和压力,而三个最抑制转录组相关的蛋白质合成,光合作用和转录调控。结果如表所示2是基于功能类别中的基因计数,与我们之前发表的研究结果类似[26.而不是过度呈现的分析。
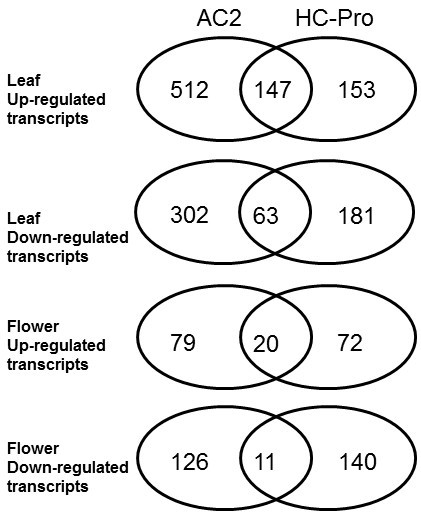
在ChC-Pro表达植物的叶片中上调的大约一半的转录物也在转基因AC2表达植物的叶子中进行上调(图 2),但有超过500个转录本仅在AC2表达的植物中上调。在叶片的转录下调中也发现了同样的模式;有300多个转录本仅在AC2表达的植物中下调。花中差异表达的转录本数量要低得多,但也包括AC2和HC-Pro表达植物之间的常见和特定转录本(图)2).另请参阅附加文件7HC-Pro和AC2 RSS表达植物之间的功能类别显示过少。
烟草中AC2的表达可诱导明显的防御反应
AC2 RSS的在转基因植物中的表达诱导许多免责辩护和氧化应激相关的转录物,转录物,包括用于全身获得性抗性(SAR),ROS清除和呼吸爆发氧化酶(表 3.,附加文件8)在表达转基因植物的HC-Pro RS中未检测到这些[26.].采用NBT染色法检测超氧自由基,DAB染色法检测H2O2表示AC2表达植物叶片中的不同玫瑰数量。发现玫瑰数量仅在表达烟草植物的一个月大的AC2(图 3.),而较旧的ROS积累的数量与野生型叶子(数据未显示)相似。
有趣的是,在两个月大的转基因AC2表达植株的下叶中经常检测到超敏反应(HR,或坏死病变)(图)3.F-3.H)。在类似年龄的野生型烟草的叶子中,从未检测到这些种类的坏死病变。这表明特别是患有氧化应激的年轻显影叶,其中检测了罗斯相关转录物的增强水平。
茉莉酸生物合成和茉莉酸响应基因
在转AC2基因的植物叶片中,茉莉酸(JA)合成相关的多个基因表达上调。其中一些基因在HC-Pro表达的植物中也上调,但在这些植物中上调的水平要低得多[26.].还上调编码茉莉酸介导的茉莉酸介导的调节蛋白的基因(表格 3.,附加文件7).茉莉酸酯(例如ja - ile)的存在诱导这些JAZ阻遏物的蛋白酶体降解,从而激活转录,例如从包含MYC结合位点的启动子(在[29])。许多ja响应基因,如防御和应激相关转录本也上调。茉莉酸信号级联也正调控茉莉酸自身生物合成的基因(从叶绿体18:3脂肪酸到JA) [29,30.],以及生物合成乙烯[31,32].表3.显示茉莉酸生物合成相关转录本、茉莉酸调控基因以及一些众所周知的茉莉酸响应基因,包括1-氨基环丙烷-1-羧酸氧化酶(ACC氧化酶)转录本,从其ACC前体生物合成乙烯所需[31,32]在转基因AC2表达植物的叶中。另外,乙烯响应因子1(ERF1)的转录物,其负责介导乙烯响应基因表达的转录因子[32]上调约五倍。
在表达转基因植物的AC2中,叶绿素生物合成和光合作用基因被下调
大多数表型变化发生在杨,少于两个月的植物,但在AC2表达植物的较旧叶子中未检测到许多差异。年轻转基因植物的叶子(最多两个月大)比野生型烟草的叶子更为黄色,表明其颜料含量的变化。颜料分析显示,它们的叶绿素A和B的量减少(附加文件9),与野生型植物相比,同一植物中的花青素积累也明显降低。由于与叶绿素生物合成相关的许多基因清楚地调节,叶片中叶绿素中叶绿素量的量并不令人惊讶(表 4).表4还描述了光系统II和I相关基因转录本的下调,以及与初级碳代谢相关的转录本。
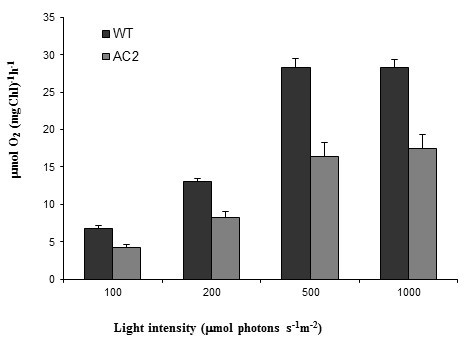
由于编码光合机械蛋白的基因有明显的变化,因此从从AC2和野生型叶片中分离的囊盂样品测量光响应氧化。与野生型烟叶的转基因AC2,在野生型烟叶(图中)在转基因AC2的叶片中,在野生型烟叶中显着降低光合氧气和淀粉的量。 4和5).结果类似,但比早期发表的HC-Pro RSS表达植物的结果更加清晰[26.].
下调翻译因子和核糖体蛋白转录本的积累
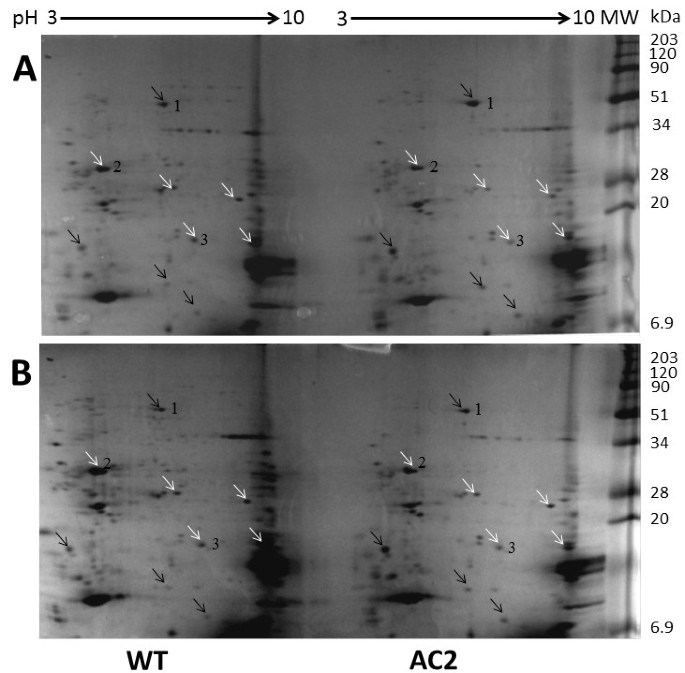
在转基因AC2表达植物的转录组中,最显著的变化之一是翻译因子和核糖体蛋白亚基编码基因的下调(见表)1和表5,附加文件7).共52个与翻译机制相关的转录本下调,包括细胞质大(60S)和小(40S)核糖体蛋白亚基以及叶绿体核糖体蛋白亚基(50S和30S)的编码基因。核糖体rna的分布也有变化(图)6),表达AC2的烟草植株中23S rRNA的数量和比例明显降低。因此,与野生型烟草相比,AC2表达叶片的总蛋白相对鲜重的含量降低了约30%10.).将表达烟草AC2的野生型和AC2表达烟草叶片的蛋白质组进行比较,将等量的蛋白质提取物(250μg)载入2D-SDS-PAGE分析(图)7),即ac2植物样品的蛋白质斑点强度实际上有所增强,因为ac2植物的总蛋白质含量确实低于野生型植物。与野生型植物样品相比,ac2植物的蛋白质组包含多个变化。令我们惊讶的是,表达烟草AC2和HC-Pro的植物的蛋白质组发生的变化与在HC-Pro表达植物中观察到的变化非常相似[26.[虽然一般来说,更多蛋白质在AC2表达中被抑制而不是表达烟叶的HC-Pro。
使用2D-SDS-PAGE分离出野生型(WT)和AC2表达(AC2)转基因烟叶的总蛋白质样品的蛋白质组学分析。用等电聚焦法在第一个维度分离的蛋白用SDS-PAGE在另一个维度分离。野生型和表达总蛋白的AC2样品在大sds -聚丙烯酰胺凝胶中进行第二级检测。黑色箭头表示蛋白上调点,白色箭头表示蛋白下调点。数字表示先前通过质谱方法鉴定的蛋白斑点(1,RBCL;2、OEE33和3、CYP2) [26.].显示了两个代表性的2D-SDS-PAGE结果。
沉默相关基因的表达
有趣的是,微阵列数据显示,参与DNA甲基化的一些沉默相关转录本发生了改变(见表)6).两个上调转录本(KTF1和AGO5)已被描述在rna导向的DNA甲基化中发挥作用[33,34].基于其结合24nt小rna的能力,AGO5可以影响小病毒rna定向DNA甲基化(RdDM)。在CNG或CNN环境中,AGO5对CG基序而不是C残基有影响。为了抵消这些基因产物增加的DNA甲基化,抑制因子沉默1 (suppressor of Silencing1, NtROS1)作为沉默的负调控因子被上调。此外,两种染色质甲基转移酶和染色体的结构维持,也提示其功能新创DNA甲基化,下调。
为了研究DNA甲基化水平的可能变化,我们还对一些包含至少三个甲基化敏感限制性内切酶位点的基因组DNA区域进行了pcr扩增实验。这些分析表明,甲基化至少在ERF1和AP24基因的编码区增加,但在18S RNA中没有(图)8).然而,其他基因片段显示出甲基化状态没有变化(数据未显示)。
甲基化敏感限制性内切酶结合PCR扩增检测甲基化。野生型和ac2表达烟草叶的染色体DNA被分离并切割Bam嗨(1)或BamHI和下丘脑-垂体-肾上腺轴的II(2)限制酶。使用额外文件中呈现的引物扩增DNA片段11..Osmotin AP-24 (一个)及乙烯反应因子1 ERF1 (B)显示AC2 DNA片段甲基化,而18S rRNA未检测到甲基化(CAC2 DNA片段与野生型DNA样本比较。数据由四个生物副本组成。
编码S-腺苷-1-蛋氨酸(SAM)生物合成的基因既不是编码SAM-再循环的基因,如HC-Pro表达植物中的调节下降[26.].因此,似乎SAM提供用于反式甲基化反应的甲基的甲基在AC2表达植物中不受影响。有趣的是,在表达烟草植物的AC2中,大群组蛋白转录物被下调(表 6,附加文件12.),而在HC-Pro表达的烟草植株中,一组类似的组蛋白转录本上调。一些组蛋白乙酰转移酶上调,可能导致染色质结构的开放,从而增加转录活性。另一个有趣的现象是,在AC2表达的植物中,细胞周期相关的转录本下调,而在HC-Pro表达的植物中,类似的转录本也上调(Additional file)12.).
讨论
在这项工作中,我们分析了表达来自ACMV的AC2 RSS的转基因烟草植株的转录组谱,ACMV目前被归为Begomovirus属的一种成员。研究表明,这种单一的RSS蛋白会导致基因表达的巨大变化。这些变化可能是由至少三个已确认的调节节点引起的,这些节点都干扰了大型代谢网络。第一个节点是茉莉酸盐和乙烯等植物激素的诱导,导致茉莉酸盐和乙烯响应基因的表达。众所周知,茉莉酸盐和乙烯都高度参与防御和应激调节基因表达,茉莉酸盐激素也负责诱导氧化应激[30.,35].第二个节点的监管似乎是与光合终端产品导致的转录和翻译调控的变化。叶绿体在此逆行信号的作用是至关重要的。结果表明光合作用光照和黑暗反应明确下调。第三调节节点似乎是由在细胞周期包括参与DNA复制和染色质结构的改变的转录沉默涉及修改。
烟草AC2转基因植株的防御和胁迫反应
在AC2 RSS的诱导更明显的防御和应激相关基因表达的转基因烟草植物中的表达,而这在我们以前的研究中表达HC-Pro的RSS植物中发现[26.].虽然在这两种转基因植物中诱导了许多类似的防御和应激相关转录本,但只有在AC2表达植物中大量转录本得到了增强,最显著的差异是这些植物中诱导了与清除ROS相关的转录本(见表)3.,附加文件8).这些包括过氧化氢清除剂(H2O2)和超氧化物相关的氧自由基。ROS的存在也可以通过幼叶中自发的HR损伤得到证实(图)3.).此外,还诱导了与系统性获得性抗性(SAR)相关的转录本,可能是通过诱导Avr决定相关基因(见表)3.)(在[36])。氧化还原稳态的平衡似乎也受到表达转基因烟草植物的AC2 RS的影响,因为几种功能在细胞中的氧化还原状态下起作用,如谷胱甘肽-S-转移酶,谷氨酸毒素和硫氧化丝在叶子中调节(表 3.).总而言之,这可能影响了AC2 RSS表达烟草细胞氧化还原反应的基因调控[37].
光合作用也受茉莉酸调节
光合作用是植物细胞中几乎所有代谢和分化反应的关键调节器,但它也通过逆行信号调节基因表达。我们的研究结果清楚地指出,许多在光合作用相关的转录本(表)4),以及光合作用氧的演化(图4)在AC2表达植株中显著降低。有趣的是,茉莉酸激素已经被证明可以调节光合作用相关的转录本拟南芥[38],以下调分离的大麦类囊体的氧演化(即希尔反应活性)[39],上调防御,应激,衰老和细胞壁相关的转录物,并引起氧化应力在植物中和蛋白质的因此也改变氧化还原状态[37].因此,在AC2表达植物中观察到的所有这些效应可能与茉莉酸生物合成上调有关[38].此外,降低的光合作用可能改变了糖代谢,从而导致核和叶绿体之间的逆行信号传导的主要次要影响。例如,它可以解释蛋白质合成(例如核糖体蛋白,翻译因子等)的变化,细胞壁合成和染色体/组蛋白修饰相关的转录物(表 5和6,附加文件7)在表达AC2的植物中。
一些研究表明,能源匮乏和不同的应力改变能源依赖型的转录调控[40,41],与不同生物合成过程相关的转录本,特别是蛋白质合成(如翻译因子和核糖体蛋白编码转录本)的急剧下调和分解代谢反应的上调,以恢复细胞上的能量剥夺。
影响AC2表达植物的蛋白质合成
结果清楚地表明,在转基因植物AC2蛋白的表达对两个相关蛋白质合成和蛋白质降解的转录物的主要作用(图 7).多种转录本水平的降低在一定程度上引起了蛋白质合成的下调,但同时也引起了核和质体核糖体蛋白、核糖体RNA或翻译因子编码基因的下调(表)45和附加文件7和附加文件12.).不仅影响蛋白质的合成,而且影响蛋白质的降解。演示分析(附加文件)7)表明半胱氨酸和天冬氨酸蛋白酶在表达AC2 RSS的植物叶片中均上调。也有蛋白酶体蛋白降解的迹象(附加文件12.).有趣的是,这表明双生病毒C2蛋白可能是蛋白质降解的蛋白酶体调控的关键[42,43].研究表明,C2蛋白能够与蛋白酶体复合物(如SCF E3连接酶复合物)相关蛋白结合,从而抑制茉莉酸相关基因的表达拟南芥(也可以看看 [44])。然而,我们的结果清楚地表明,双生病毒蛋白AC2具有相反的作用;茉莉酸信号增强和茉莉酸响应基因调控[45]和无影响到相关的转录物既不SA合成也不SA应答基因表达[46].
在表达转基因植物的AC2中改变细胞周期,基因组甲基化和组蛋白表达
已知原豚病毒通过与细胞组蛋白相关的双链DNA中间体复制它们的单链DNA基因组以形成MINOCHROMOSOMES [24.].因此,begomovirus诱导成熟植物细胞中DNA复制机制的积累是非常重要的。这很可能是通过改变细胞周期和转录调节来实现的,例如,感染白菜叶卷曲geminivirus(Calcu)已被证明在病毒感染细胞中诱导细胞周期的变化[47].有趣的是,我们的结果也表明AC2 RSS的表达可能对细胞周期有影响(附加文件12.),提供可复制的环境并阻止有丝分裂所需基因的表达[48,49].Our results demonstrated that the expression AC2 RRS in transgenic plants up-regulated transcripts involved in DNA methylation (KTF1 and AGO5) and down-regulated transcripts involved in histone synthesis (Table 6).这表明,尽管转录活化剂AC2抑制了ACMV的天然宿主中的沉默(DNA甲基化),并且显然增强了这些宿主中的病毒复制,但在烟草(非宿主到ACMV)中,它诱导防御机制,领先to opposite direction, i.e. to increase of methylation and decrease of the histone synthesis.
结论
在转基因烟草植株中AC2 RSS的表达可以引起烟草植株明显的表型变化,尽管烟草不被认为是ACMV的天然寄主。本研究提示AC2过饱和度可能的作用机制。首先诱导茉莉酸和乙烯激素响应调控级联反应,其次降低光合速率和碳代谢。应激和防御反应基因表达增强,包括活性氧(ROS)的诱导和应答。所有这些管理节点可能已经相互连接。此外,细胞周期和转录调控以及DNA甲基化和组蛋白丰度等基因组结构也发生了变化。因此,AC2在烟草中的沉默抑制活性似乎表明其增强了茉莉酸和乙烯的生物合成,而已知的茉莉酸和乙烯是通过RNA沉默调控和抑制的[50].上调这些植物激素是有关的各种各样的压力有关的基因,并在植物严重发育缺陷的诱导。有趣的是,双粒病毒RSS的自然沉默抑制机制,即,DNA甲基化的减少,并没有出现在该非宿主植物,而是观察到相反的效果,显然涉及到诱导的植物防御。
方法
植物材料
野生型烟草(尼科尼亚塔哈瓦姆)、空载体控烟(pBIN61)以及表达AC2转基因烟草植株[27在相对湿度为60%、温度为22℃的温室条件下,光照时间为16h (150 μmol光子m-2S.-1)和8小时黑暗。叶样品(顶部的第三片)取自一个月大的植物,植物在那个时间约为20厘米的高度。叶子和花样从同一植物中取出。在打开前一天服用花样。将叶子和花样在液氮中直接冷冻并储存在-80℃。
RNA提取、cDNA标记、微阵列杂交和微阵列芯片扫描
根据制造商的建议,使用tris- reagent (Bioline, UK)从野生型和转基因植物的叶子和花中分离出总RNA。采用RNeasy净化柱(QIAGEN inc.)进一步纯化总RNA。美国)。cDNA标记、总RNA和已标记cDNA的质量检查、在Agilent的4x44K烟草芯片(设计ID 21113)上杂交、洗涤和扫描芯片以类似的方式进行,与已经发表的HC-Pro微阵列样品同时进行[26.].
微阵列数据分析
使用Chipster,基于R项目的统计计算程序(科学计算(CSC)的中心,芬兰)视觉程序([进行所有的数据处理51[, Agi4x44k预处理,Lopez-Romero, 2010)。为了比较不同样品的强度值,将野生型和空载体对照烟草样品(6)与转基因AC2表达叶片样品(3)一起归一化。花朵样本以类似的方式归一化在一起。用中值信号值和中值背景值对三个生物重复进行归一化处理。添加一个背景偏移值(50)以防止在归一化过程中出现负值。使用“分位数”参数对数组进行规范化。数组结果已存入ArrayExpress,登录号为E-MEXP-3724。差异表达的转录本重新注释,如早期发表的Soitamo等人2011 [26.].微阵列结果通过使用MapMan程序和功能类别富集分析通过使用PageMan程序[可视化52,53].
差异表达基因的验证
array结果根据MIQE指南进行RT-qPCR验证[28].RT-qPCR是从与先前微阵列实验相同的RNA样本中进行的。根据制造商的建议(产品号EPO451, Fermentas),用RevertAid h - M-MuLV逆转录酶从1 μg纯化的叶或花总RNA中合成cDNA。将产生的cDNA稀释后,用3μl进行RT-qPCR (Maxima SYBR Green /Fluorescein qPCR MasterMix (2X) (Product # KO242, Fermentas))。用于RT-qPCR的基因特异性内参及样本引物列于附加文件11..对于每一个三次生物学重复,三四个技术重复运行,以最大限度地减少移液错误。RT-qPCR反应在含有野生型(参考)和AC2转基因样品在96孔板上运行。在RT-qPCR的是使用Bio-Rad公司的iQ5机器来执行。结果进行使用根据BIO-RAD的的iQ5默认设置定量循环(CQ)方法(增量增量CQ)来计算。所有的引物对产生的只有一个DNA解链曲线的峰值表示的引物特异性高。并计算平均值(标准误差)的标准误差三到五年生物学重复的。
叶片中氧自由基的检测
通过使用与这些自由基反应的污渍来检测过氧化氢和超氧化物阴离子。使用DAB(0.1mg / ml DAB pH至3.8使用NaOH)来检测过氧化氢的存在,使用NBT(25mm Hepes / KOH 7.4中的0.1mg / ml NBT)检测超氧基自由基的存在[54].在小型培养皿中以20ml dab或NBT溶液进行染色整个叶子。在染色溶液下从茎中切割叶子以获得新的表面积以进行污渍渗透。然后叶子在黑暗中保持过夜。第二天早上,使用96%乙醇从叶中取出叶绿素。乙醇改变几次,直到所有叶绿素被移除(至少24小时)。饲养叶片的图片从中除去所有叶绿素。
光合作用和叶绿素定量测量
在4mL类囊外隔离缓冲液(0.3M山梨糖醇,50mM HEPES / KOH 7.4,5mM MgCl2,1mM EDTA和1%BSA)。悬浮液通过过滤的Miracloth和2ml类囊体悬浮液在Eppendorf离心机沉淀12 000xg 2分钟。将沉淀物重新悬浮于100微升的O2- 电极测定缓冲液(0.3M山梨糖醇,50毫摩尔的Hepes / KOH pH 7.4的,5毫摩尔MgCl2, 1毫米KH2宝4).在Clark型O型中直接测量了氧的演化2-电极,以0.5 mM DCBQ为电子给体。叶绿素浓度根据Porra等人计算[55].基于相等的总叶绿素量化比色皿中的样品。根据Neff和Chory从野生型和AC2的野生型和AC2的三毫米叶片中测量花青素浓度[56].
蛋白分离和2D-PAGE
从野生型和HC-Pro的表达的转基因植物的叶子的蛋白质样品用TRIsure试剂(生物在线)的RNA分离同时隔离。该协议从TRIzol试剂(Invitrogen公司INC。美国),其适于和执行根据制造商的建议。蛋白质浓度用Lowry法进行测定。蛋白首先由Bio-Rad实验室分离7cm的IPG根据制造商的建议条pH值3-10。蛋白的250微克每一个条带装载。含有野生型和转基因HC-Pro的聚焦蛋白样品条带然后在千变万化II仪(Bio-Rad)上大的凝胶同时运行,以产生这两个条带的聚焦蛋白的类似的流动性。然后蛋白凝胶根据制造商的建议,脱色并拍照固定和胶态考马斯蓝染料染色(PageBlue染色试剂盒,Fermentas公司)。
DNA甲基化敏感限制酶切割后PCR扩增检测DNA甲基化
根据Plant (Nucleospin Plant II, Macherye-Nagel Germany)的基因组DNA协议,从野生型和表达烟草叶片的AC2中分离出DNA。DNA被其中任何一种切断Bam嗨,或Bam嗨下丘脑-垂体-肾上腺轴的二世限制性内切酶。切割的碎片被放大使用Taq.聚合酶与2毫米氯化镁2.扩增引物见附加文件11..设计引物,使片段在扩增区域内包含3个CCGG位点。甲基化的下丘脑-垂体-肾上腺轴的中检测到防止DNA和扩增的PCR产物的裂解的DNA片段II位点。
参考文献
- 1。
方勇,王志强:拟南芥microRNA生物发生相关蛋白的鉴定。中国生物医学工程学报,2007,17(9):818-823。10.1016 / j.cub.2007.04.005。
- 2。
杨Z,思想YW,Yu B,Chen X:Hen1识别21-24NT小RNA双链体并将甲基沉积到3'末端核苷酸的2'oh上。核酸RES。2006,34(2):667-675。10.1093 / nar / gkj474。
- 3.
吴国平,李国华,李国华:拟南芥microrna的核加工与输出。美国国家科学院学报。[j] .环境科学学报,2003,22(4):457 - 461。10.1073 / pnas.0405570102。
- 4.
沃切莱特:阿贡植物。植物科学进展,2008,13(7):350-358。10.1016 / j.tplants.2008.04.007。
- 5.
Matzke M,Kanno T,Daxinger L,Huettel B,Matzke AJ:RNA介导的染色蛋白在植物中的沉默。CurrOgin Cell Biol。2009,21(3):367-376。10.1016 / J.CEB.2009.01.025。
- 6.
沃兹沃思S,Dunoyer,P:植物RNA沉默免疫力和病毒的反防御策略。第1-35。在:分子植物 - 微生物相互作用。eds。Bouarab等。2009年,1-35。
- 7.
作者认为,细菌效应蛋白对microRNA通路的抑制作用是一种有效的途径。中国科学:地球科学。10.1126 / science.1159505。
- 8.
Voinnet○:起源,生物合成和植物微小RNA的活性。细胞。2009年,136(4):669-687。10.1016 / j.cell.2009.01.046。
- 9.
生物应激相关的microrna:鉴定、检测、调控和功能分析。方法:中国生物医学工程学报,2010,592:183-202。10.1007 / 978 - 1 - 60327 - 005 - 2 - _13。
- 10。
Ruiz-Ferrer V,Voinnet O:植物小RNA在生物应力响应中的角色。Annu Rev植物Biol。2009,60:485-510。10.1146 / annurev.arplant.043008.092111。
- 11.
Sunkar R,周X,Zheng Y,Zhang W,Zhu JK:通过高通量测序鉴定水稻中的新型和候选MiRNA。BMC植物BIOL。2008,8:25-10.1186 / 1471-2229-8-25。
- 12.
Voinnet O:植物微生物相互作用的转录后RNA沉默:鲁莽和多功能性。CurrOp植物BIOL。2008,11(4):464-470。10.1016 / J.PBI.2008.04.006。
- 13.
Chellappan P,夏Ĵ,周X,高S,张X,Coutino G,巴斯克斯男,张宽,晋H:从miRNA的网站的siRNA靶基因的调解DNA甲基化。核酸RES。2010年,38(20):6883-6894。10.1093 / NAR / gkq590。
- 14.
内源性小RNA通路的专门化和进化。中国科学(d辑):地球科学(英文版),2007,18(11):884-896。10.1038 / nrg2179。
- 15.
植物RNA沉默的病毒抑制。植物学报。2004,5(1):71-82。10.1111 / j.1364-3703.2004.00207.x。
- 16.
李文霞,李文霞,纪丽华,丁世文,鲍康比:烟草转基因沉默的病毒致病性决定因素。中国海洋大学学报(自然科学版),1998,17(22):6739-6746。10.1093 / emboj / 17.22.6739。
- 17.
RNA沉默的诱导和抑制:来自病毒感染的见解。中国生物医学工程学报。2005,6(3):206-220。10.1038 / nrg1555。
- 18.
李志强,李志强,李志强,等。囊泡病毒p19蛋白介导的RNA沉默抑制的分子机制。机械工程学报,2004,23(4):876-884。10.1038 / sj.emboj.7600096。
- 19.
Lakatos L, Csorba T, Pantaleo V, Chapman EJ, Carrington JC, Liu YP, Dolja VV, Calvino LF, Lopez-Moya JJ, Burgyan J:小RNA结合是一种常见的抑制多种病毒抑制子RNA沉默的策略。机械工程学报,2006,25(12):2768-2780。10.1038 / sj.emboj.7601164。
- 20。
丁斯文:基于rna的抗病毒免疫。中国免疫学杂志。2010,10(9):632-644。10.1038 / nri2824。
- 21。
关键词:双生病毒;RNA沉默;植物科学进展,2005,10(3):144-151。10.1016 / j.tplants.2005.01.005。
- 22。
Chellappan P,Masona MV,Vanitharani R,泰勒NJ,Fauquet CM:与在转基因木薯诱导的基因沉默相关联的ssDNA病毒广谱抗性。植物mol biol。2004年,56(4):601-611。10.1007 / s11103-004-0147-9。
- 23。
PatiL BL,Fauquet CM:Cassava Mosaic Geminiviruses:实际知识和观点。莫尔植物途径。2009,10(5):685-701。10.1111 / J.1364-3703.2009.00559.x。
- 24。
Raja P,Sanville Bc,Buchmann Rc,Bisaro DM:病毒基因组甲基化作为对抗身的表观防御。J病毒。2008,82(18):8997-9007。10.1128 / JVI.00719-08。
- 25.
Fauquet CM,Bisaro DM,Briddon RW,布朗JK,哈里森BD,Rybicki EP,斯滕格尔DC,斯坦利记者:对物种分类标准修订划界家庭联体病毒科,双生和物种的更新列表。拱门病毒学杂志。2003年,148(2):405-421。10.1007 / s00705-002-0957-5。
- 26.
Soitamo AJ, Jada B, Lehto K: HC-Pro沉默抑制基因显著改变烟草叶片和花的基因表达谱。植物营养与肥料学报。2011,11:68-10.1186/1471-2229-11-68。
- 27.
sidiqui SA, Sarmiento C, Truve E, Lehto H, Lehto K:转基因烟草(N. tabacum)和本氏烟草(nictiana benthamiana)中不同病毒RNA沉默抑制子的表型和功能效应。植物营养与肥料学报。2008,21(2):178-187。10.1094 / mpmi - 21 - 2 - 0178。
- 28.
Bustin Sa,Benes V,Garson Ja,Hellemans J,Huggett J,Kubista M,Mueller R,Nolan T,Pfaffl MW,Shipley GL,Vandesompele J,Wittwer CT:MIQE指南:公布定量实时PCR的最低信息实验。Clin Chem。2009,55(4):611-622。10.1373 / Clinchem.2008.112797。
- 29.
Memelink J:通过茉莉酸盐激素调节基因表达。植物化学。2009,70(13-14):1560-1570。
- 30.
Avanci NC, Luche DD, Goldman GH, Goldman MH:茉莉酸酯是一种具有多种功能的植物激素,包括植物防御和繁殖。中国生物医学工程学报,2010,31(1):1 - 8。10.4238 / vol9-1gmr754。
- 31.
林志强,钟树生,Grierson D:乙烯研究进展。农业工程学报。2009,60(12):3311-3336。10.1093 / jxb / erp204。
- 32。
在植物防御中,乙烯响应因子1整合了来自乙烯和茉莉酸途径的信号。植物学报。2003,15(1):165-178。10.1105 / tpc.007468。
- 33。
他XJ,HSU YF,朱S,威尔茨比基,Pontes O,Pikaard CS,Liu HL,王CS,Jin H,Zhu JK:拟南芥中RNA定向DNA甲基化的效应是Argonaute 4-和RNA结合蛋白.细胞。2009,137(3):498-508。10.1016 / J.Cell.2009.04.028。
- 34。
Takeda A, Iwasaki S, Watanabe T, Utsumi M, Watanabe Y: argonaute蛋白从小RNA双链中选择引导链的机制不同。植物生理学报。2008,49(4):493-500。10.1093 /卡式肺囊虫肺炎/ pcn043。
- 35。
孙建强,姜海林,李春云:番茄系统蛋白/茉莉酸介导的系统防御信号。植物学报。2011,4(4):607-615。10.1093 / mp / ssr008。
- 36。
徐志强,王志强,王志强,等。植物抗病毒机制的研究进展。微生物学报,2005,3(10):789-798。10.1038 / nrmicro1239。
- 37.
朱敏,陈素梅:茉莉酸甲酯对拟南芥氧化还原蛋白响应的蛋白质组学研究。蛋白质组学杂志。2009,73(1):30-40。10.1016 / j.jprot.2009.07.005。
- 38.
郑志刚,李丽珊,杨淑芳,李敏,李俊杰,崔永德,郑俊杰:基于微阵列技术的拟南芥茉莉酸响应基因的筛选。植物学报,2019,46(7):1053-1063。10.1007 / s00299 - 007 - 0311 - 1。
- 39.
3 . Maslenkova LT, Zanev Y, Popova LP:不同浓度茉莉酸对大麦类囊体氧进化活性的影响。植物生理学报。1999,13(4):1316-1320。10.1104 / pp.93.4.1316。
- 40.
植物胁迫和能量信号的转录网络的中心整合者。自然科学学报。2007,448(7156):938-942。10.1038 / nature06069。
- 41.
Baena-Gonzalez E,Sheen J:收敛能量和应力信号传导。趋势植物SCI。2008,13(9):474-482。10.1016 / J.Plants.2008.06.006。
- 42.
Lozano-Duran R, Bejarano ER:双生病毒C2蛋白可能是双生病毒scf介导的泛素化选择的关键。植物信号行为。2011,6(7):999-1001。10.4161 / psb.6.7.15499。
- 43.
在拟南芥中,双生病毒通过改变csn介导的SCF E3连接酶的去泛素化来破坏泛素化,并抑制茉莉酸信号通路。植物学报,2011,23(3):1014-1032。10.1105 / tpc.110.080267。
- 44。
杨JY,岩崎男,町田C,町田Y,周X,蔡NH:I2C1,TYLCCNV的致病因素,AS1改变叶片的开发和禁止选择性茉莉酸反应相互作用。基因开发。2008年,22(18):2564至2577年。10.1101 / gad.1682208。
- 45。
Lewsey MG, Murphy AM, Maclean D, Dalchau N, Westwood JH, Macaulay K, Bennett MH, Moulin M, Hanke DE, Powell G, Smith AG, Carr JP:病毒RNA沉默抑制因子对两种防御信号通路的破坏。植物营养与肥料学报。2010,23(7):835-845。10.1094 / mpmi - 23 - 7 - 0835。
- 46。
苗杨,Zentgraf U:拟南芥WRKY53和ESR/ESP在叶片衰老中的拮抗作用是由茉莉酸和水杨酸平衡调节的。植物学报。2007,19(3):819-830。10.1105 / tpc.106.042705。
- 47。
Ascencio-Ibanez JT, Sozzani R, Lee TJ, Chu TM, Wolfinger RD, Cella R, Hanley-Bowdoin L:拟南芥基因表达的全球分析揭示了双孢病毒感染过程中影响病原体反应和细胞周期的一系列复杂变化。植物营养与肥料学报。2008,31(1):1 - 8。10.1104 / pp.108.121038。
- 48。
Nagar S,Hanley-Bowdoin L,Robertson D:宿主DNA复制是由分化植物细胞的Geminivirus感染引起的。植物细胞。2002,14(12):2995-3007。10.1105 / TPC.005777。
- 49.
汉利-鲍登L,Settlage SB,Orozco的BM,纳加S,罗伯逊d:双生病毒:模型植物DNA复制,转录和细胞周期调控。爆击启生物化学分子生物学杂志。2000年,35(2):105-140。
- 50。
miR319靶点对茉莉酸酯生物合成和衰老的控制。中国科学(d辑:地球科学),2008,26(6):592 - 598。
- 51.
绅士RC,凯里VJ,贝茨DM Bolstad B, Dettling M, Dudoit年代,埃利斯B, Gautier L,通用电气Y,贵族J, Hornik K, Hothorn T, Huber W, Iacus年代,伊R, Leisch F,李C, Maechler M,罗西尼AJ, Sawitzki G、C史密斯,史密斯G, Tierney L,杨司法院,张J: Bioconductor:打开软件开发计算生物学和生物信息学。中国生物医学工程学报。2004,20(4):514 - 514。
- 52.
Usadel B,内格尔,Thimm O, Redestig H, Blaesing OE, Palacios-Rojas N, Selbig J, Hannemann J,引起MC, steinhaus指出D, Scheible WR, Gibon Y, Morcuende R, Weicht D,迈耶,施迪M:可视化工具的延伸MapMan允许数组的统计分析,显示相应的基因,与已知的反应。植物营养与肥料学报。2005,32(3):429 - 434。10.1104 / pp.105.060459。
- 53.
Usadel B, Nagel A, Steinhauser D, Gibon Y, Blasing OE, Redestig H, Sreenivasulu N, Krall L, Hannah MA, Poree F, Fernie AR, Stitt M: PageMan:用于生成、显示和注释概要图的交互式本体工具。生物信息学杂志。2006,7:535-10.1186/1471-2105-7-535。
- 54.
傅兰雅MJ,Oxborough K,Mullineaux下午,贝克NR:在叶光氧化应激反应成像。J Exp Bot。2002年,53(372):1249年至1254年。10.1093 / jexbot / 53.372.1249。
- 55.
Porra RJ,Thompson WA,Kriedemann PE:测定具有四种不同溶剂的叶绿素A和B的精确消光系数和同时方程:通过原子吸收光谱验证叶绿素的浓度。Biochim Biophys Acta。1989,975:384-394。10.1016 / S0005-2728(89)80347-0。
- 56。
植物光敏色素A、光敏色素B和隐花色素1在拟南芥发育中的相互作用。植物生理学报。1998,118(1):27-35。10.1104 / pp.118.1.27。
确认
Turku BioteCnology的芬兰微阵列和测序中心(FMSC)被确认为标记CDNA,杂交,扫描芯片并产生原始微阵列数据。MikaKeränen博士承认帮助数据分析和科学计算(CSC,ESPOO,芬兰)的数据分析和中心。研究得到了芬兰学院的支持,授予数字127203和128943。
作者信息
隶属关系
通讯作者
额外的信息
相互竞争的利益
作者没有非金融、金融或专利相关的竞争利益。
作者的贡献
AJS种植并收集了用于实验的植物材料。本工作由KL策划,AJS和BJ共同进行实验工作和显著改变的转录本的重新注释。手稿由AJS和KL撰写。所有作者均已阅读并批准本稿件。
电子辅料
12870 _2012_1156_moesm2_esm.pdf
附加文件2:叶子和花样品的强度值的质量控制。图形盒图显示了来自野生型和转基因AC2表达植物叶片和花朵样本的强度值的微阵列数据。(PDF 334 KB)
上方和下方的叶子表达AC2或HC-Pro的RSS功能分类的介绍分析。
附加文件7:使用PageMan程序(MapMan 3.5.1R2)进行分析。功能分类后的数字表示差异表达基因的log2值和有色框的强度,FDR<0.05的p值的z-scores [53].(PDF 796 KB)
12870 _2012_1156_moesm8_esm.pdf
附加文件8:生物应激相关转录本的视觉展示。在表达AC2或HC-Pro RSS的叶和花样本中,数据包括p值小于0.05 (FDR)的上调或下调转录本。(PDF 575 KB)
12870 _2012_1156_moesm9_esm.xlsx
附加文件9:野生型和AC2表达植物叶片中叶绿素和花青素的含量。(XLSX 16 KB)
12870 _2012_1156_moesm10_esm.xlsx
附加文件10:表达野生型和AC2的烟草叶片对鲜重(FW)和干重(DW)的总蛋白含量。(XLSX 12 KB)
细胞反应概述中涉及的转录本的视觉呈现。
附加文件12:数据包括表达AC2或HC-Pro RSS的叶子样本中上调或下调的转录本.(PDF 427 KB)
作者为图像提交的原始文件
下面是作者提交的原始图片文件的链接。
权利和权限
本文在BioMed Central Ltd.的许可下发布了这是一个开放的访问文章,根据Creative Commons归因许可(http://creativecommons.org/licenses/by/2.0)提供任何介质中的不受限制使用,分发和再现,所以提供了正确的工作。
关于这篇文章
引用这篇文章
双生病毒AC2 RNA沉默抑制基因的表达改变烟草中糖和茉莉酸响应基因的表达。BMC植物杂志12,204(2012)。https://doi.org/10.1186/1471-2229-12-204
收到了:
接受:
发表:
关键词
- 转基因烟草植物
- 转录的基因沉默
- 快递厂
- 野生型烟草
- 沉默抑制