摘要
背景
植物是无柄的,因此必须感知并适应环境的变化。邻居的存在会导致资源和空间有限的竞争局面。在分子水平上对这种情况的复杂适应性反应知之甚少。
结果
利用微阵列,我们分析了全基因组表达的变化拟南芥植物受到内部竞争。叶子和根转录组通过竞争强烈改变。差异表达的基因富集在参与营养缺乏(主要是N,P,K),光质感知的基因中,以及对非生物和生物应激的反应。有趣的是,通用昆虫的表现Spodoptera littoralis在浓密种植的植物上显着降低,表明竞争下的植物会显示出对草食病的抗性。
结论
本研究提供了受种内竞争影响的基因的综合列表拟南芥.其结果是一种独特的反应,涉及到与光照、营养缺乏、非生物胁迫和防御反应相关的基因。
背景
由于他们的术语性质,植物不断调整到他们的变化环境。温度波动,土壤中水含量的变化以及病原体攻击是植物必须应对的一些环境因素。特别是,植物邻居的存在经常降低包括光,水和营养的资源的可用性。这种争取普通有限的资源,导致生长,生存和繁殖力降低,被定义为“竞争”。此外,由于植物通常具有被动种子分散,因此可以在植物邻居之间发生竞争,而来自相同物种(有内部竞争)的植物邻居,甚至更多,从密切相关的人中[1].
竞争不仅指植物对有限资源的被动利用,还指对邻居干扰的积极响应。现在已经明确的是,植物能够以不同的方式探测邻居并与之互动。在地面上,邻居的存在会导致植物的光照强度和质量下降。在光资源受到限制之前,植物会表现出形态和生长反应,以达到更有利的光环境。这些反应的触发信号是光敏色素感光器检测到较低的红光与远红光的比值(R:FR),这是邻近叶片选择性吸收红光的结果[2].易挥发性有机化合物(VOC)的释放也是已知是植物植物相互作用的重要参数[3.].例如,植物激素乙烯是一种挥发性有机化合物,植物暴露在低质量和低强度的光照下会过量产生。乙烯在冠层中的积累被证明参与了遮荫反应[4].
在地下,现在有一致的证据表明,根系不仅对养分有效性有反应,而且对邻近的根系也有反应。例如,Pisum sativum.[5能区分自己的根(自我)和邻近植物的根(非自我)。一些研究报告称,当竞争对手在基因上与焦点植物相关或不相关时,它们的根生长存在差异[6,7].但是,如果这些答复基于具体识别过程,或者是不同竞争能力的后果,仍然争议[8,9].
植物如何感知到的邻居并在分子水平响应竞争环境仍然很大程度上是未知的。施密特和鲍德温提供的第一个答案[10.的转录反应Solanum nigrum.竞争。利用包含568个基因的DNA微阵列,作者表明,竞争导致基因表达的重要变化,包括主要涉及应激信号和防御途径的基因。这项工作首次揭示了植物对竞争反应的分子机制。最近的一项研究分析了全基因组对竞争的反应拟南芥发现了数百种上调或下调的基因,包括防御和光合作用的基因[11.].然而,这两项研究都仅研究了对叶片竞争的转录反应。为了更加了解竞争中涉及的分子机制,我们进行了完整的转录组分析拟南芥分别分析了受种内竞争影响的植物叶片和根系的基因表达变化。器官特异性转录组标记被鉴定出来,并揭示了竞争激活与营养饥饿、生物和非生物胁迫相关的基因。此外,我们还发现了多面体草食动物的幼虫Spodoptera littoralis在有竞争的植物上比在单一植物上表现更好。
结果
内含性竞争对绩效的影响拟南芥植物
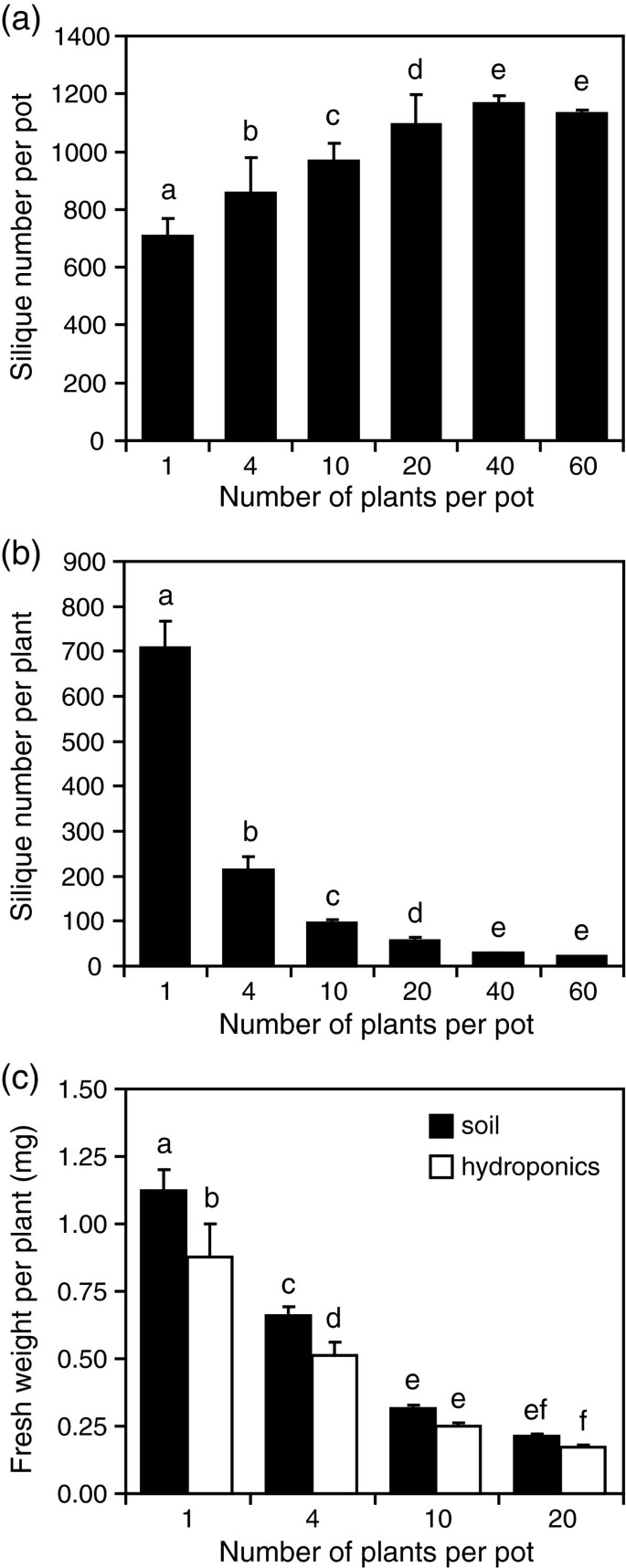
我们研究了种内竞争对种群适应度和生存的影响拟南芥植株生长密度为每盆1至60株,每盆380厘米3.土壤。这相当于156至9360株植物的密度2, 分别。在罐中产生的单数随着植物密度的增加而显着增加,但每罐40株植物的密度达到最大值(6420 / m2)(图1A).然而,随着密度的增加,单株角果产量显著下降(图)1B.).植物生物质也受到竞争的影响。每株植物的平均鲜重量也随着密度增加而显着降低,植物在每罐20株植物(3120 / m)2)比单独生长的植物轻4倍(图1C.).
我们还监测了收获日期的植物存活率。如果一种植物能产生角果,它就被认为是一种幸存者。在密度低于10株/盆(1560株/m)时,存活率没有显著影响2),在密度为20株(存活率97%)和40株(98%)时(数据未显示),受影响较小。然而,在60株/盆的密度下,存活率降低到89%,这表明这个密度太高,不能让所有植株完全完成它们的循环。
由于从生长在土壤中的根系中提取RNA往往伴随着完整根系的低恢复和土壤颗粒对酶反应的抑制作用,我们测试了一种水培生长系统作为土壤的替代。我们选择了焙烤的粘土珠,它构成了一种惰性材料,在保持高水分水平的同时,良好的曝气。我们比较了在土壤中和在增加密度的烘烤粘土珠中植物的生长。总的来说,在水培条件下生长的植株明显轻于在土壤中生长的植株(图)1C.).然而,它们对竞争同样敏感,随着密度的增加,生物量显著减少。此外,植物在烘烤的粘土珠中存活的情况与在土壤中相似(未显示),植物能够完成它们的整个生命周期。这些结果表明,这种水培体系与传统土壤的竞争反应相似。因此,我们选择在密度为20株/盆(3120/m)的烤粘土珠中生长的植物进行转录组分析2),它与未经个人死亡的强烈竞争,并将其与植物进行比较而不会竞争(每锅1株植物,156 / m2).
叶子和根转录组的变化因竞争而变化
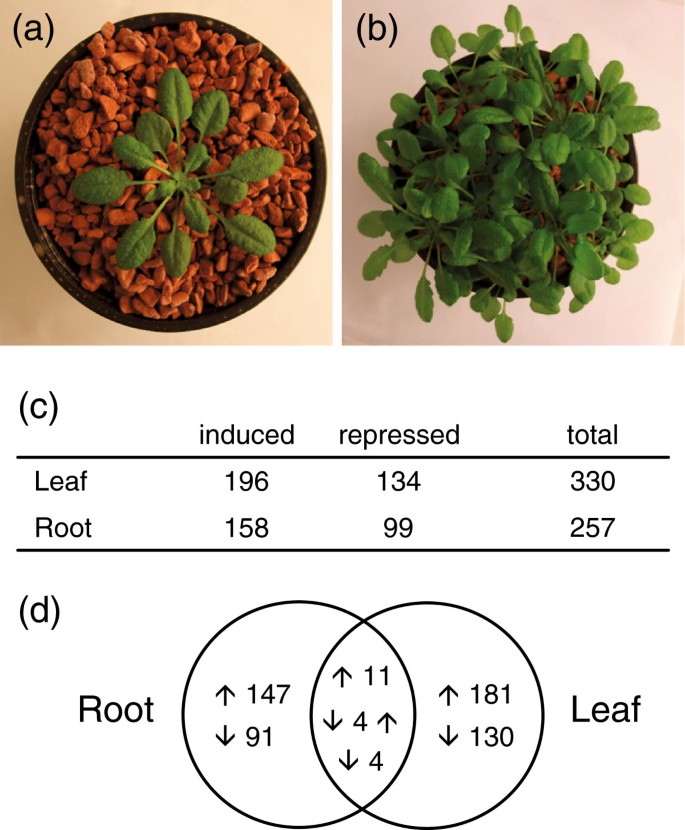
为了探讨竞争对基因表达的影响,我们从单独生长的植物中提取RNA,或者每罐20株植物的密度(图2AB)。叶或根样品与含有22,473个基因特异性标签的微阵列杂交[12.].该实验独立重复七次,以产生差异表达基因的稳健列表,并能够检测基因表达的适度变化,具有良好的概率。在叶片中,诱导196个基因,抑制了134个基因,而在根部158基因中诱导,抑制99个(图2C).有趣的是,大多数表达差异的基因都是器官特异性的。然而,在叶片和根中均有显著表达差异的基因(19个)显著多于随机预期(累积超几何分布,P = 1.6 × 10)9;数字2D;额外的文件1).这表明叶子和根之间的竞争反应的一个小但重要的部分。
为了验证微阵列数据,我们选择了响应竞争的5个差异表达基因,并对独立植物样本进行了实时定量PCR (qPCR)分析。对所有选择的基因和两个器官的表达谱进行了验证,表明qPCR结果与微阵列结果完全一致(参见附加文件)2).
竞争反应基因的功能分类
为了确定竞争反应所涉及的关键生物过程,我们对差异表达基因进行了基因本体学(GO)富集分析。在叶片中,最重要的官能团包括对非生物刺激的反应,化学刺激,以光刺激(对红色或远红光的反应,以及对光强度的反应)和内源性刺激(参见附加刺激3.).其他丰富的GO条款包括对生物刺激和其他生物的反应。该分析还揭示了与营养素相关的生物过程的富集,尤其是氮代谢。
在根中,富集最显著的氧化石墨烯术语是“定位”,它对应于物质或细胞实体被运输到和/或维持在特定位置的任何过程。氧化石墨烯的两个富集项与营养物质有关:阳离子转运和硫化合物代谢过程。与叶子相比,“对刺激的反应”在根的差异表达基因列表中也占了很大比例,尽管存在的类别较少。此外,竞争似乎影响根的次级代谢(见附加文件)3.).
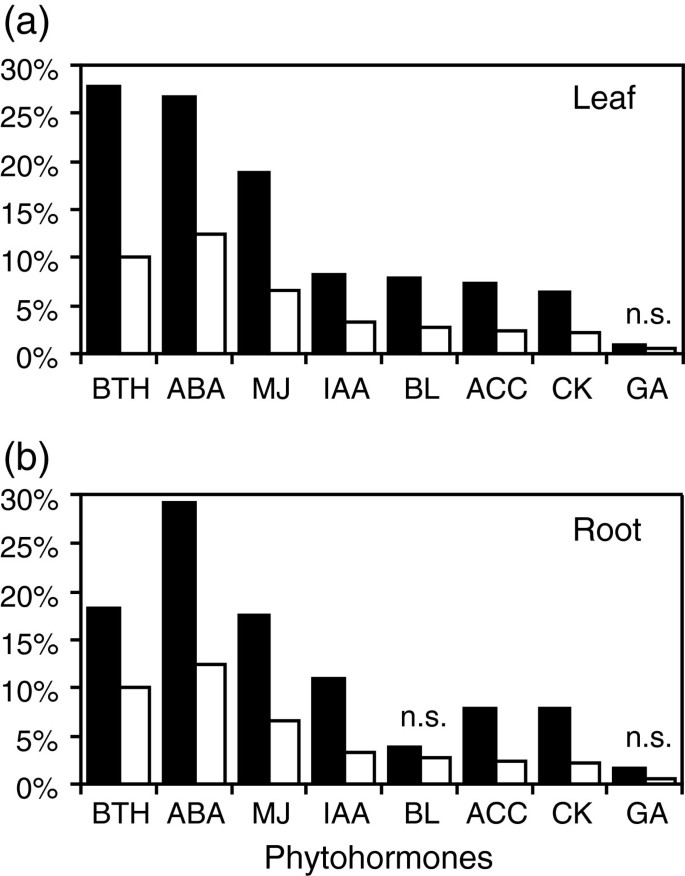
植物激素是许多生物过程的关键调节器,包括生长和防御。为了确定植物激素是否参与了对竞争的响应,我们从文献中寻找激素响应基因的显著富集[13.- - - - - -15.].首先,大多数植物激素响应基因在叶和根的表达数据中被过度表达,这表明竞争导致了一个重要的生物重编程,这意味着植物激素的作用(图)3.).例外是胃肠杆菌素响应基因,在竞争响应基因中没有显着过度地表示,而芸苔类固醇响应基因仅在叶数据集中过度表示。其次,三种最丰富的类别包括响应水杨酸类似物苯并噻唑(Bth),脱落酸(ABA)和茉莉酸甲酯(MJ)的基因,这些激素主要参与生物和非生物胁迫的反应(图3.).
竞争对植物激素响应基因的影响。叶片中竞争响应基因(黑条)的比例(一个)和根(b),也对给定的植物激素处理有反应。数值与整个拟南芥基因组中植物激素响应基因的比例(白色条)进行比较。采用Fisher’s exact检验确定每个比例是否与其在整个基因组中的相应比例存在显著差异(P < 0.001)。没有显著差异的配对被标记为“n.s”。”(不重要)。激素响应基因列表来自Nemhauser等人[13.王等人。[14.].苯并噻二唑(水杨酸类似物);脱落酸ABA;乔丹,甲基jasmonate;提单,油菜素内酯;IAA, indole-acetic酸;ACC, 1-氨基环丙烷-1-羧酸(乙烯前体);CK, cytokinine;GA,赤霉酸。
GSEA对竞争转录组的全局分析
植物同时竞争许多限制资源(营养,水,空间,光线),并且必须整合几个环境提示。因此,对竞争的转录组响应可能难以解释。为了获得更好地识别生物过程,使竞争反应的基础,我们进行了表达数据的基因集浓缩分析(GSEA)。GSEA是一种强大的分析方法,具有考虑整个转录组的优点,而不是任意选择的上调或下调基因的列表[16.].GSEA提供了归一化的富集评分(NES),其反映了从实验中朝向顶部(诱导基因)或底部(抑制基因)或底部(抑制基因)的基因列表中的基因列表中的归一性浓缩评分(NES)。
我们选择植物可以在其环境中暴露的条件,包括营养饥饿,非生物应激和生物应激。搜索文献和微内数据库,我们从实验获得转录组数据是原始数据,并且复制水平足以允许稳健的统计分析。对于每个数据集,我们使用类似的选择标准建立了上调和下调基因的列表(日志2表达比≥1且≤−1,FDR <0.05)。利用这些基因集,我们将叶片和根系竞争数据集置于GSEA中,目的是找到竞争与任何选定条件之间的相关性(见方法)。
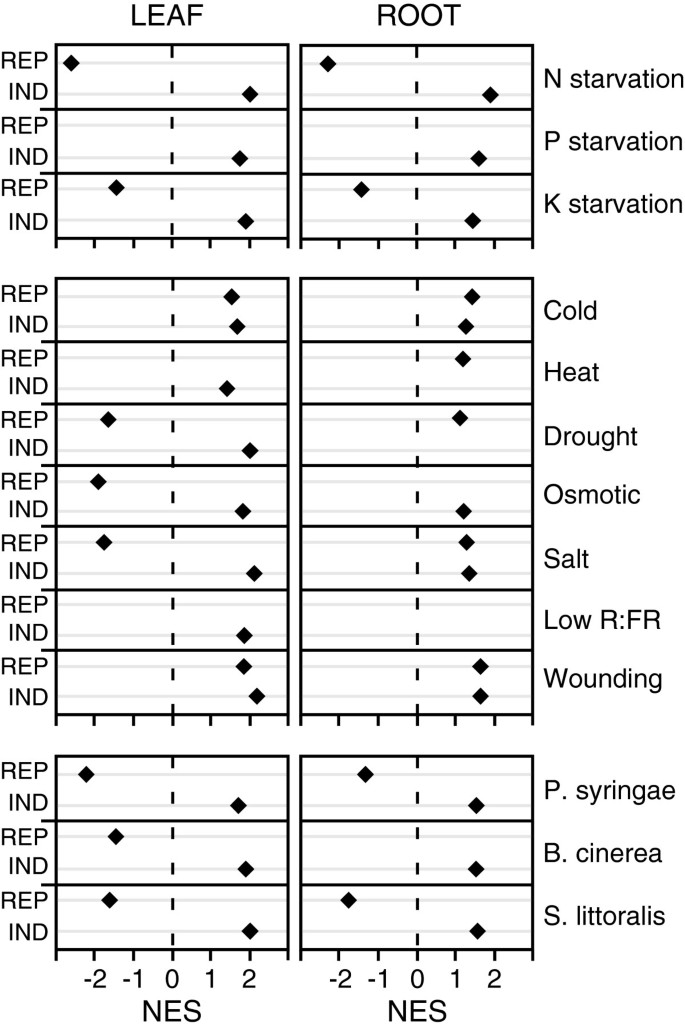
在竞争过程中,与营养饥饿相关的基因在叶和根转录组中显著富集。受N、P或K饥饿影响的基因同样受到竞争的影响(图)4).只有P饥饿抑制的基因未富含叶片或根转录om。这些数据表明,竞争触发了近似,但不相同的转截面的变化,以营养缺陷。此外,对于参与铁和硫缺乏的基因没有检测到富集(未显示)。
对于与非生物胁迫有关的病症,再次在叶子和根部转录om中的基因集浓缩富集(图4).引人注目的是,根内竞争诱导的基因中,冷、盐和伤反应基因都很丰富。特别是,在竞争过程中,通常被这些非生物胁迫抑制的基因被诱导。在叶片中,干旱、渗透胁迫和盐胁迫诱导或抑制的基因在竞争诱导或抑制的基因中富集。有趣的是,寒冷和创伤反应基因在竞争诱导的基因中富集,无论它们属于抑制基因还是诱导基因(图)4).最后,低R:FR比值诱导的基因在叶片竞争诱导的基因中显著富集。因此,在转录组水平上,受竞争胁迫的植物与受几种非生物胁迫的植物表现出相似之处,但也表现出特定的差异。
最后,与生物胁迫相关的基因集在根和叶的转录组中发现了显著富集。基因引起的P.两,B.灰质和年代.littoralis在竞争诱导的基因列表中富集了侵袭,而这些应力压抑的基因也被竞争压抑,除了B. Cinealea的抑制基因,未在根系中竞争下调的基因中未富集的基因(图4).这表明,在分子水平上,竞争与细菌、真菌和草食动物的攻击有相似之处。
该分析的一个限制是使用非常幼儿的实验获得许多基因集(参见附加文件4).因此,由于植物年龄,我们可能低估了竞争中富集的基因集数量。
对竞争响应基因的详细分析
竞争改变了几种在矿物运输和代谢中起作用的基因的表达。在叶中,抑制了与N同化相关的几种基因(硝酸盐还原酶(NIA2),硝酸还原酶(NIR1.),谷氨酸脱氢酶(GDH2.),谷氨酰胺合成酶(GS2),而杜尔3.诱导编码由硝酸盐饥饿引起的尿素/ h +对称的尿素/ h +对称(表1).相反,在根中诱导几种离子转运蛋白,包括两个硝酸盐转运蛋白(NRT2..2,NRT2..5),杜尔3., P转运体(PHTI.;4)和一个潜在的K转运体(CHX17.).一个参与K从根向茎分配的基因被抑制(sk).这些结果表明,在高密度下生长的植物通过升压离子转运蛋白来对营养成分的竞争反应,并在叶片中降低营养增量。
通常参与不同防御途径的基因在叶子和根的上调基因列表中发现了(表1).包括在内JR1.,HPL和硫代葡萄糖苷生物合成基因(CYP81F2,BAT5.,BCAT4.),已被证明在坏死营养真菌、伤害性或食草性的攻击中受茉莉酸途径的调节[17.,18.].该列表还包含PR-4和抗病蛋白(At1g72940, At2g14080, At4g19925),它们参与对由水杨酸途径控制的生物营养细菌病原体的响应(http://www.genevestigator.com.,[15.])。这些发现表明,处于竞争中的植物可能通过激活防御机制来预测潜在的敌人。此外,竞争引发了通常与生物应激相关的非生物应激相关基因的表达。其中包括与干旱胁迫有关的基因(ERD1.,DI19)、热应激(HSP70.,HSF4.)和氧化应激(RbohE)(表1).
植物激素调节许多生长和发育过程,以及对压力的反应。我们发现,以20株/盆的密度生长的植物比单独生长的植物的生物量小4倍(图)1).这与涉及激素生物合成或信号传导的许多基因的差异表达相关(表1).例如,调制植物素传输和信号传导的几个基因(IAA29.,Saur.-就像,IAA2,ARF2,AUX1)和油菜素内酯生物合成(BR6Ox2.)在叶片中被竞争上调,而ABA (ABA1.),cytokinin(CKX4.)和赤霉素(GA4.)抑制生物合成。根中乙烯生物合成基因上调(场方程,ACC氧化酶).此外,我们确定了几种已知响应低R:Fr比率的基因(表1).这些基因涉及光信号(HFR1,凤凰,飞毛腿),在制冷调节伸长过程中(哈特2.,XTR7.),或在植物中的运输(ASA1),表明高密度生长的植物检测到光质量的变化,并触发了生长素调节的生长反应。
植物通过落叶中的次要新陈代谢进行衰减竞争。控制类黄酮的基因(CHS,F3h.,异黄酮还原酶),甾醇(SMT3.),萜烯(法呢基转移酶)或蜡(Cer1.)的生物合成受到抑制(表1).有趣的是,一些编码木质素生物合成酶的基因(HCT.,CAD4.,FAH1,4氯)和R2R3-MYB转录因子(MYB48)已知参与木质素生物合成的[19.]的表达上调,表明在竞争过程中刺激了次生生长(表1和额外的文件1).
已经证明了许多物种以应对局部密度的变化来改变行为和生长模式。例如,细菌产生若干类型的信号分子,允许它们根据其局部群体的密度协调基因表达。我们在微阵列数据中搜索了特定于竞争的基因。理由是鉴定与植物植物相互作用有关的基因,并且不会响应竞争造成的间接影响。为此目的,我们搜索了在我们实验中竞争的基因,但没有表现出在Genevestigator MicroArray数据库中的多种处理或条件中表现出的表达的变化(http://www.genevestigator.com.;[15.])。该分析结果显示,几乎所有竞争对重基因也受到至少其他条件的影响。有趣的是,一种编码推定羟类脱氢酶的一种基因(HSD4.,AT5G50590)在先前测试的许多条件下没有差异表达,因此显然仅对竞争作出响应。HSD4由根竞争引起的根,但不是叶子(表1和额外的文件1)通过QPCR在独立的RNA样品上证实这种差异表达(见附加文件2).HSD1是HSD4的一种紧密同源物,它被证明在生长和发育中发挥作用[20.].因此,HSD4为进一步研究与竞争直接相关的过程提供了一个有趣的候选基因。
在叶和根的19个基因中,没有发现任何保守的生理过程,但有趣的是,这些基因中有5个转录因子(HAP2B, BEL1, MYB111, NAP和一个C3HC4锌指蛋白)(补充文件)1).
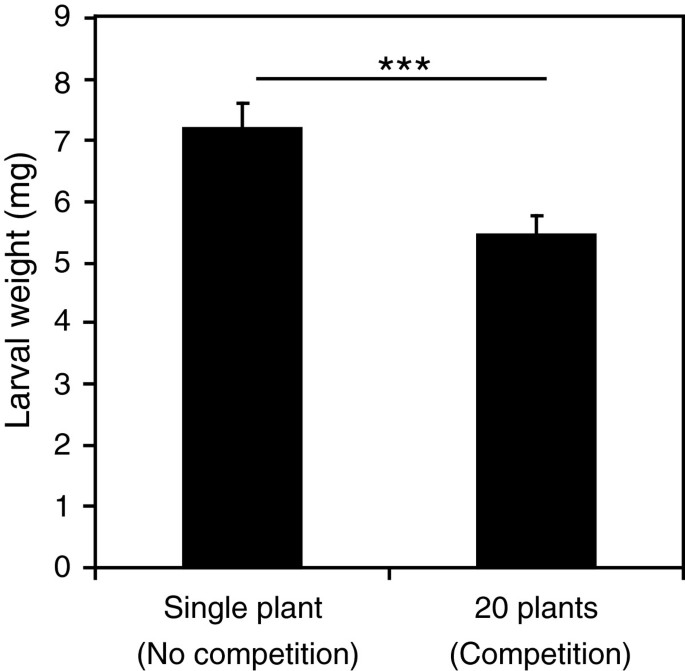
Spodoptera littoralis在竞争环境下表现较差的工厂
竞争诱导许多与防御相关的基因,我们的GSEA分析显示了由生物应激引起的基因富集,包括草食性年代.littoralis.因此,我们假设在竞争环境中生长的植物可能会准备昆虫攻击。为了测试这个假设,我们挑战了拟南芥植物单独生长在一个花盆或密度为20株每盆与新生儿年代.littoralis幼虫。令人惊讶的是,我们发现幼虫喂养7天对经历竞争的植物显着较小,即在单身植物上喂养的植物(图5).这些结果表明,在竞争中生长的植物导致昆虫表现降低。
讨论
尽管有大量关于植物竞争的研究,但我们对竞争的遗传和分子基础仍然知之甚少。在这项研究中,我们证明了种内竞争拟南芥改变叶片中330个基因和根中257个基因的表达。由于我们在花盆中收集了所有的植物,这些数字可能会被低估,因为边缘植物可能不会经历与中心植物相同的条件或信号,从而稀释了表达比例。去除边缘植物可能会发现更多严格响应植物密度和竞争的基因。这在地上部分很容易做到,但在中心植物和边缘植物之间错综复杂的根部就比较困难了。
通过竞争监管的基因似乎属于非常不同的途径或类别。这种多样性明显反映了竞争的性质,这是几种单独的压力和条件的组合。使用GSEA,我们观察到在高密度的植物中的N,P和K缺乏症的典型反应,并且通过竞争诱导了几种N,P和K转运蛋白基因。这可以解释为对一般营养饥饿的反应,因为已知这些转运蛋白基因通过其运输的营养素的缺乏诱导,并且可以在逻辑上解释用于以高密度生长的植物观察到的新重量减少的一部分。
在地面上,浓密的树冠对光线的竞争导致了光强度的降低,但也降低了到达树叶的质量。植物光敏色素光感受器对R:FR比值的变化通过最大限度的生长和取向反应,这一现象被称为避荫综合征(SAS)。大量关于SAS的机制和转录反应的研究表明,与SAS相关的生长变化需要生长素[2,21.,22.].最近,表明低R:Fr比改变了制冷剂流出销形成的3(PIN3)的调节剂的细胞位置,导致缺口生长增加。有趣的是,Arabidopsis Pin3.突变体被混合培养的野生型植物脱开,展示了竞争期间SAS和养鸡的重要性[23.].因此,我们在叶片中观察到遮荫反应诱导的基因集正富集,包括与生长素相关的基因,表明竞争触发了SAS。尽管我们的实验是在有荧光灯的生长室内进行的,荧光灯提供了比自然条件下更高的R:FR比率,但在高密度生长的植物中观察到SAS基因被诱导,表明这些植物无论如何都能检测到光质量的变化。这可能表明,在浓密植物冠层水平上,R:FR比值的变化足以改变光敏色素的光平衡,并引发下游表达的变化。这些变化在自然光照环境中可能被放大,因为在自然光照环境中,R:FR比值的变化更为剧烈。在自然界中,竞争对SAS基因表达的影响有待进一步研究。此外,在我们的实验中,被报道在SAS期间受到抑制的基因没有显著改变。这种部分遮光响应可能是由于其他因素对经典遮光响应的调制。在树叶中,包括乙烯在内的挥发性有机化合物等其他成分可以调节SAS [3.,4].或者,可以通过响应地下竞争的根到射击信号来调节叶子中的SA。
在根和叶中,竞争改变了许多参与非生物和生物胁迫的基因的表达。先前的研究表明,竞争改变了许多应激反应基因的表达年代.nigrum.[10.].一个研究Centaurea maculosa.植物研究表明防御相关次级代谢产物在种内竞争下在植物体内积累[24.].然而,我们发现基因表达的整体轮廓响应于竞争而不对应于可以特异性归因于单个应力的典型轮廓。相反,我们观察了几个输入导致的签名。众所周知,某些营养素的缺乏可以诱导与非生物应激或防御有关的反应。例如,k和n饥饿导致依赖于茉莉酸的一些防御基因的激活[25.,26.],而缺铁则会触发依赖水杨酸的基因的表达[27.].对干旱和高温组合的转录反应由一个独特的信号组成,只包括两种单独胁迫的一些基因[28.].同样,对竞争的转录反应是不同环境线索整合后的原始反应。
竞争效应的一个显著特征是对食草动物和细菌和真菌感染作出反应的基因的富集。这就提出了一个问题:这种富集是强调了植物间相互作用的生物反应,还是营养缺乏、生长减少或光质量变化的间接后果。有关根源歧视的报告[5]及亲属认可[6,7]倾向于支持竞争植物中存在检测过程的假设。但是,我们无法在亲属和非亲属工厂之间提供任何证据拟南芥[9].此外,尚未报告根系歧视现象拟南芥.在竞争背景下,有必要更好地理解防御基因表达的研究。
我们的结果表明,毛毛虫的表现降低了拟南芥植物受到竞争。虽然我们不能排除这种效果是由于植物较低的植物的营养价值较高,但缺乏初级代谢基因的诱导,相反,防御基因的上调可能被解释为这些抗性植物。在一些研究中报道了这种对防御的竞争的积极影响,被描述为“国防压力利益假设”[29.,30.].然而,另一份报告显示,蚜虫和叶虫在受竞争影响的植物上数量更多[31.],而Agrawal [32.发现竞争对防御代谢物积累或食草性没有影响。在拟南芥,年代.福克佩达幼虫在高密度的植物上大于生长低密度的植物[33.].然而,在最后一个例子中,植物在单个盆中生长,无根际竞争。相反,生态学表明,低营养环境中的植物缓慢生长,投入组成型防御,并受到富裕营养环境中生长的植物的植物影响较小[34.].同样,最近的研究表明拟南芥植物通过上调茉莉依赖基因而致缺乏k缺乏,并且它们更耐血液攻击[35.].因此,防御竞争的结果似乎取决于物种,邻居的身份,环境条件或攻击者的性质。总共,这些不同的结果为对竞争的复杂和协调的反应而争辩,这可能在某些情况下有利于防御病原体。测试是否响应竞争和降低的幼虫性能时,还需要测试防御基因是否归类是有趣的。拟南芥植物与它们的近亲竞争,或者这种竞争是否也发生在种间竞争中。此外,密集生长的植物可能会创造一个潮湿的微环境,有利于真菌或微生物病原体的感染。因此,了解通过竞争诱导的防御基因是否在其他生物胁迫中发挥作用,包括真菌或细菌感染,将是一件有趣的事情。
结论
综上所述,本研究揭示了在分子水平上对竞争的反应是来自地面和地下不同信号整合的结果。其结果是一种独特的反应,涉及到与光照、营养缺乏、非生物胁迫和防御反应相关的基因。这一研究结果提供了受种内竞争影响的基因的综合图谱拟南芥.未来的研究应集中在竞争响应基因在植物-植物互作中的确切作用,以及竞争对后续胁迫和病原菌攻击的抗性。
方法
植物材料及生长条件
拟南芥所有试验均采用生态型Columbia (Col-0)。种子在80%乙醇和0.4%次氯酸钠溶液中浸泡10分钟,然后用95%乙醇漂洗4次,在无菌过滤器上干燥。将干种子播种在含有½Murashige和Skoog培养基(MS;用0.25%的蔗糖和0.8%的植物琼脂(Sigma)。种子在4°C冷暗室分层处理3 d后,转入22°C气候室,光周期16 h/8 h, 120 μmol photons m .−2 · s−1由欧司朗Lumilux L58W/830暖白灯提供(有关灯的规格,请参阅附加文件5), 50%的相对湿度。将一周大的幼苗移栽在直径9厘米(体积380厘米)的花盆中3.),包括用于标准培养的土壤或用于水培培养的焙烤粘土珠。植物在22℃条件下生长,光周期16 h/8 h, 120 μmol光子m−2 · s−1, 50%的相对湿度。
对于水培培养,罐装罐装粘土珠(吨碎片,血针,http://www.seramis.de.).每天用水喷雾滋润新近的幼苗,并在透明盖下保持5天。每4天,用水交替浸没盆或用肥料液体浸泡(0.57mm NH)4没有3., 0.182 mM P2O5, 0.212 mM K2O和微量(<20 μM)的MgO, S, Fe, Mn, B, Cu, Na, Cl, Mo和Zn;Wuxal水力、马格/先正达公司http://www.syngenta-agro.ch).多余的溶液被除去了。培养2周后,在加水液中加入1次Fe-Sequestrene (0.13 mM fe -乙二胺-N,N′-bis(2-羟基苯乙酸),1.6 mM K2O, 0.4 mM NH4没有3.;西奎斯特林快速,马格http://www.maag-profi.ch.).
竞争实验
将一周大的幼苗以不同密度(每盆1株(156株/米))移植到土壤或焙烤粘土珠中2)至60株(9360株/米)2).幼苗在表面均匀置于表面,以确保植物之间的类似竞争。在托盘中随机排列罐以最小化位置效应。为了测量Silique数量,生长植物直至其生命周期(约2个月)完成。对于鲜重量测量,植物生长30天。
微阵列杂交和数据分析
植物在每罐中的一个或20株植物的密度下水贫化40天。从盆中除去植物,用水迅速洗涤,以除去附着在根部的过量的珠子。然后单独收集来自四个罐(密度1)和一个罐(密度20)的叶子和根部,并立即储存在液氮中。提取RNA,逆转录,并如前所述用Cy3-或Cy5-DCTP标记[18.].标记的cDNA与含有22'473基因特异性标签的拟南芥转录组微阵列(CATMA)微阵列进行杂交[12.].采用染料交换设计进行微阵列杂交。扫描、归一化和数据分析已经在前面描述过了[18.].为了解决多种比较问题,我们使用为基因组研究开发的方法计算FDR [36.].基于1.5倍变化的阈值和FDR <0.1,选择竞争期间差异表达的基因。数据来自七个独立的生物复制。微阵列数据已在ArrayExpress(http://www.ebi.ac.uk/arrayexpress/),加入编号e - mep -3735。
定量PCR分析
独立的植物样本准备从植物水产的密度或20植物总RNA制备每锅。叶子和根从四个锅(密度1)和一个锅(20)密度使用RNeasy®植物迷你工具包包括DNase我列消化根据制造商的指示(试剂盒,http://www.qiagen.com.).对于cDNA合成,使用Superscript®Vilo™cDNA合成试剂盒(Invitrogen)来逆转1μg总RNA(http://www.invitrogen.com.)在最终体积为20μl,并且在不含核酸酶的水中稀释5次CDNA。定量实时PCR分析在含有1μl稀释的cDNA的最终体积为20μl,每次底漆0.2μm,1×QPCR MasterMix Plus forSybr®Greeni(Eurogentec,http://www.eurogentec.com.).反应按如下热循环程序进行:50°C 2 min, 95°C 10 min, 95°C 40次循环15 s, 55°C 20 s, 72°C 1 min。引物效率是通过对每个基因的扩增子进行连续稀释来确定的。相对mRNA丰度归一化为两个参考基因(SAND家族蛋白At2g28390;GAPDH At1g13340)。本研究使用的引物见附加文件6.这个实验独立进行了三次。
数据处理与分析
使用HyperGeometric测试进行Agrigo奇异富集分析进行富集分析[37.].所有其他参数都设置为默认值拟南芥以基因组为背景。
基因集富集分析(Gene Set Enrichment Analysis, GSEA)从文献和公开的微阵列数据中收集了与营养饥饿、非生物和生物胁迫相关的表达数据。对于每个数据集,使用洛桑大学开发的接口进行分析(基因表达数据分析接口(GEDAI)) [38.].通过拟合每个基因的线性模型,评估fold change和调节t-statistics p值,鉴定差异表达基因。使用Storey和Tibshirani的FDR方法对多次测试的p值进行了校正[36.].根据显著调控基因(log2比率≥1和≤−1,FDR <0.05)的平均对数倍变化排序,可定义诱导基因的顶级基因子集(最多100个基因)和抑制基因的顶级基因子集(最多100个基因)。为了建立代表每种情况的基因集,将排列好的基因列表合并为显著诱导基因的核心列表和显著抑制基因的核心列表(详细的基因列表,见附加文件)4).然后,根据根和叶转录组数据的平均对数倍变化对基因进行排序。对根或叶芯片数据集进行GSEA,以检测来自不同条件的基因集是否在数据中显著富集。GSEA是使用GSEA桌面应用程序使用“GseaPreranked”工具执行的[39.].用加权富集统计量计算富集分数,用2500个排列计算显著性水平。标准化富集评分(NES)被认为是显著的,其名义p值<0.05,FDR q值<0.25。
昆虫生物测定
Spodoptera littoralis(埃及棉虫卵)从Syngenta (Stein,瑞士)获得,并在10°C下保存,直到进一步使用。将卵置于覆盖塑料膜的烧杯中,置于生长室(22°C, 65%相对湿度,100 μmol m-2 sec-1,10小时光/ 14小时暗光周期)以允许孵化。在40天内,每罐的密度生长植物。将八个罐(密度1)或两个罐(密度20)置于透明塑料盒中,25个新孵化年代.littoralis将幼虫分散在每个盒子的植物叶片上。在整个实验过程中,由于叶片材料过多,幼虫能够在花盆之间自由移动。7 d后,用精密天平测量幼虫体重。这个实验重复了三次。
参考
- 1。
Novoplansky A:明智地采摘战斗:竞争下的植物行为。植物细胞环境。2009,32:726-741。10.1111 / J.1365-3040.2009.01979.x。
- 2。
富兰克林ka:避免阴影。新植物。2008,179:930-944。10.1111 / J.1469-8137.2008.02507.x。
- 3.
王志强,王志强:植物挥发性有机化合物与植物竞争。植物科学进展,2010,15:126-132。10.1016 / j.tplants.2009.11.007。
- 4。
wang y, wang y, wang y, wang y, wang y:对乙烯敏感烟草的冠层研究,发现乙烯是植物和植物信号转导中的新元素。植物学报,2004,38:310-319。10.1111 / j.1365 - 313 x.2004.02044.x。
- 5。
Falik O,Reides P,Gersani M,Novoplansky A:在根中的自我/非自我歧视。J ECOL。2003,91:525-531。10.1046 / J.1365-2745.2003.00795.x。
- 6。
Dudley Sa,文件al:年度植物中的kin识别。Biol Lett。2007,3:435-438。10.1098 / rsbl.2007.0232。
- 7。
Milla R,Forero DM,Escudero A,Iriondo JM:与兄弟姐妹一起成长:合作的共同点或植物中的激烈竞争。Proc Royal Soc B:Biol Sci。2009,276:2531-2540。10.1098 / RSPB.2009.0369。
- 8。
植物的亲缘识别:一个未解决的神秘行为。中国生物医学工程学报。2011,31(4):489 - 494。
- 9。
Masclaux F, Hammond RL, Meunier J, Gouhier-Darimont C, Keller L, raymond P:竞争能力而非亲缘关系影响拟南芥种质的生长。植物生态学报,2010,29(6):751 - 756。10.1111 / j.1469-8137.2009.03057.x。
- 10。
龙葵对茉莉酸甲酯和竞争的转录反应:温室和野外研究。生态学报。2006,20:500-508。10.1111 / j.1365-2435.2006.01122.x。
- 11.
Geisler M,Gibson DJ,Lindsey KJ,Millar K,Wood AJ:上调光合作用基因,对压力防御基因的下调,是拟南芥射击与惯性竞争的反应。机器人螺柱。2012,53:85-96。
- 12.
Allemeersch J, Durinck S, Vanderhaeghen R, Alard P, Maes R, Seeuws K, Bogaert T, Coddens K, Deschouwer K, Van Hummelen P, Vuylsteke M, Moreau Y, Kwekkeboom J, Wijfjes AH, May S, Beynon J, Hilson P, Kuiper MT: CATMA微阵列的基准。拟南芥转录组分析的新工具。植物营养与肥料学报。2005,32(4):489 - 494。10.1104 / pp.104.051300。
- 13。
Nemhauser JL,Hong F,Chory J:不同的植物激素通过大部分原始反应来调节类似过程。细胞。2006,126:467-475。10.1016 / J.Cell.2006.05.050。
- 14。
王东,董晓东:植物系统获得性抗性转录网络中调控节点的基因组识别方法。公共科学图书馆。2006,2:e123-10.1371/journal.ppat.0020123。
- 15。
Zimmermann P,Hennig L,Gruissem W:Genevestigator。拟南芥微阵列数据库和分析工具箱。植物理性。2004,136:2621-2632。10.1104 / pp.104.046367。
- 16。
Subramanian A,Tamayo P,Mootha VK,Mukherjee S,Ebert Bl,Gillette Ma,Paulovich A,Pomeroy S1,Golub Tr,Lander ES,Mesirov JP:基因集浓缩分析:一种基于知识的解释基因组表达概况的方法.美国科学院。2005,102:15545-15550。10.1073 / pnas.0506580102
- 17。
de Vos M, Van Oosten VR, Van Poecke RMP, Van Pelt JA, Pozo MJ, Mueller MJ, Buchala AJ, Métraux J-P, Van Loon LC, Dicke M, Pieterse CMJ: Signal signature and transcriptome changes of Arabidopsis during pathogen and insect attack. Mol Plant Microbe Interact. 2005, 18: 923-937. 10.1094/MPMI-18-0923.
- 18。
Reymond P, Bodenhausen N, Van Poecke RM, Krishnamurthy V, Dicke M, Farmer EE:对专一型和多面手型草食动物反应的保守转录模式。植物营养学报。2004,16(3):362 - 368。10.1105 / tpc.104.026120。
- 19。
OH S,Park S,Han K-H:拟南芥中二次生长的转录调控。J Exp Bot。2003,54:2709-2722。10.1093 / JXB / ERG304。
- 20.
李F,Asami T,Wu X,Tsang EWT,Cutler Aj:一种推定的羟类脱氢酶,参与调节植物生长和发育。植物理性。2007,145:87-97。10.1104 / pp.107.100560。
- 21.
Carabelli M, Possenti M, Sessa G, Ciolfi A, Sassi M, Morelli G, Ruberti I:冠层遮荫通过生长素诱导的细胞分裂素氧化酶活性导致叶片发育迅速而短暂的停滞。基因工程学报,2007,21(4):457 - 461。10.1101 / gad.432607。
- 22。
Tao Y, Ferrer J-L, Ljung K, Pojer F, Hong F, Long JA, Li L, Moreno JE, Bowman ME, Ivans LJ, Cheng Y, Lim J, Zhao Y, Ballaré CL, Sandberg G, Noel JP, Chory J: Rapid synthesis of auxin via a new tryptophan-dependent pathway is required for shade avoidance in plants. Cell. 2008, 133: 164-176. 10.1016/j.cell.2008.01.049.
- 23。
Keuskamp DH, Pollmann S, Voesenek LACJ, pepeters AJM, Pierik R:通过PIN-FORMED 3 (PIN3)运输生长素控制了比赛中的避荫和适应性。美国科学院。2010年,107:22740 - 22744。10.1073 / pnas.1013457108。
- 24。
Broz Ak,Broking CD,De-La-Pena C,Lewis Mr,Greene E,Callaway RM,Sumner LW,Vivanco JM:植物邻居身份影响植物生物化学和与防御有关的生理学。BMC植物BIOL。2010,10:115-10.1186 / 1471-2229-10-115。
- 25。
Ashley Mk,Grant M,Grabov A:植物对钾缺乏的反应:钾转运蛋白的作用。J Exp Bot。2006,57:425-436。
- 26。
施melz EA, Alborn HT, Engelberth J, Tumlinson JH:氮素缺乏增加了玉米挥发性释放、茉莉酸积累和乙烯敏感性。植物营养与肥料学报。2003,33(4):429 - 434。10.1104 / pp.103.024174。
- 27。
Kieu NP,Aznar A,Segond D,Rigault M,Simond-Cote E,Kunz C,Soulie MC,专家D,Dellagi A:铁缺乏影响植物防御反应并赋予Dickeya Dadantii和Botrytis Cinerea的抵抗力。莫尔植物途径。2012年,在新闻界。
- 28。
Rizhsky L,梁H,舒曼J, Shulaev V, Davletova年代,Mittler R:当防御通路发生碰撞。拟南芥对干旱和热胁迫的响应。植物营养与肥料学报。2004,29(4):453 - 457。10.1104 / pp.103.033431。
- 29。
Boege K:对竞争和草食病的响应:对多特质表型可塑性的自然选择。生态。2010,91:2628-2637。10.1890 / 09-0543.1。
- 30.
西门子DH,Lischke H,Maggiulli N,SchürchS,Roy Ba:竞争中抵抗和耐受性的成本:防御压力受益假设。EVOL ECOL。2003,17:247-263。10.1023 /答:1025517229934。
- 31.
CIPLINI DF,Bergelson J:三分之一的竞争会影响芸苔NAPUS L.的生长和食草动物损伤。植物ECOL。2002,162:227-231。10.1023 /答:1020377627529。
- 32.
Agrawal AA:乳草的抵抗力和易感性:竞争,根草食草和植物遗传变异。生态。2004,85:2118-2133。10.1890 / 03-4084。
- 33.
刘志强,刘志强,刘志强,等:植物抗茉莉酸盐敏感性的光敏色素调控。美国科学院。2009年,106:4935 - 4940。10.1073 / pnas.0900701106。
- 34。
COLEY PD,Bryant JP,Chapin FS:资源可用性和植物抗手道防御。科学。1985,230:895-899。10.1126 / Science.230.4728.895。
- 35。
Armengaud P,Breitling R,Amtmann A:冠状不敏感1(COI1)介导拟南芥拟南芥对外部钾供应的转录反应。莫尔植物。2010,3:390-405。10.1093 / MP / SSQ012。
- 36。
Story JD,Tibshirani R:基因面研究的统计学意义。基因组Biol。2003,100:9440-9445。
- 37。
杜Z,周X,林y,张Z,苏Z:农业小组:农业社区的GO分析工具包。Nucl酸res。2010,38:W64-W70。10.1093 / nar / gkq310。
- 38。
Liechti R, Csárdi G, Bergmann S, Schütz F, Sengstag T, Boj SF, Servitja J- m, Ferrer J, Van Lommel L, Schuit F, et: EuroDia: beta细胞基因表达资源。数据库。2010,2010:baq024-10.1093/ Database /baq024。
- 39。
GSEA-P:一种用于基因集富集分析的桌面应用。生物信息学。2007,23:3251-3253。10.1093 /生物信息学/ btm369。
致谢
我们要感谢Roland Reist(先正达,斯坦因,瑞士)的善意提供Spodoptera littoralis鸡蛋,FrédéricSchütz和Robin Liechti为他在生长植物中的帮助下有关数据分析和Blaise Tissot的讨论。我们感谢Tino Dornbusch测量我们灯的光谱组成。这项工作得到了生物学和医学研究委员会基金,洛桑大学,瑞士国家科学基金会的支持。
作者信息
从属关系
相应的作者
附加信息
相互竞争的利益
提交人声明他们没有竞争利益。
作者的贡献
女性生殖器切割和公共关系组织构思了这项研究,设计了研究并协调了项目。女性生殖器切割进行了竞争实验、分子遗传学研究和统计分析。FB、FS和CG-D参与种植植物、进行微阵列实验和进行生物分析。女性生殖器切割、LK和PR负责起草和修改由共同作者贡献的手稿。所有作者阅读并批准了最终的手稿。
电子补充材料
由竞争诱导或抑制的基因列表。
附加文件1:这个Excel表格包含了一个明显受竞争调节的基因列表拟南芥叶子。基因有一个表达比率(log2)≥0.59或≤- 0.59,且FDR <0.1。(XLS 156 KB)
12870 _2012_1174_moesm2_esm.pdf
附加文件2:QPCR验证微阵列数据。QPCR验证微阵列数据。通过QPCR在独立样品上分析在叶片和根组织中差异表达的所选基因的表达。表达差是根据实验计算的,比较每罐20株植物的密度生长的植物和单独生长的植物。值(±SE)被标准化为参考基因,是三种生物重复的平均值。显示了微阵列数据进行比较。(PDF 251 KB)
12870 _2012_1174_moesm3_esm.pdf
附加文件3:差异表达基因的基因本体(GO)分析。不同基因本体论(GO)类别中差异表达基因的富集。叶片或根样品中竞争诱导或压抑的基因被分类为不同的GO类别,具有Agrigo单数富集分析。(PDF 49 KB)
12870 _2012_1174_moesm4_esm.xls
附加文件4:用于GSEA分析的基因集的列表和原点。该Excel表包括用于GSEA分析的基因列表。从文献或微阵列数据库中提取出响应于不同治疗或条件的基因显着诱导(IND)或压抑(REP)。发布的数据集的来源和描述作为单独的Excel表。(XLS 206 KB)
12870 _2012_1174_moesm5_esm.pdf
附加文件5:灯规格。欧司令Lumilux L58W / 830暖白色灯的光谱组成。(PDF 252 KB)
作者的原始提交的图像文件
权利和权限
开放访问本文在“生物资源”中央有限公司的许可下公布了这是一个开放式访问条款,分配根据创意公约归因许可证的条款(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
Masclaux,F.G.,Bruesso,F.,Schweizer,F。et al。种内竞争的转录组分析拟南芥揭示与营养获取和一般应激反应途径相关的器官特异性信号。BMC植物BIOL.12,227(2012)。https://doi.org/10.1186/1471-2229-12-227
收到了:
接受:
发表:
关键字
- 拟南芥
- 基因表达
- 内脏竞争
- 食草性
- 非生物压力
- 生物压力