摘要
背景
在植物中,5的RRNA基因通常用作单独的串联(S型布置),或者较少,与35S rDNA单元(L型)相提并论。到目前为止,联系基因的活性仍然未知。我们研究了来自含有链接35秒S单元的奥斯特科伊的几种物种中的5次基因的均匀性和表达。另外,使用亚硫酸氢盐测序测定它们的甲基化状态。应用原位杂交的荧光露出RDNA阵列的亚核位置。
结果
我们发现,大多数(4/6)物种的l型单元均质完成,但并非所有物种都完成。两个物种包含主要的L型和次要的s型单位(称为L年代类型)。连接基因主导5s rDNA的表达,而单独的串联基因似乎不表达。菊科的成员进化出了聚合酶III启动子的功能变异,其中居住的C-box元件与传统被子植物motif差异高达30%。在此基础上,提出了一个比较松散的植物C-box共识序列:(5’-RGSWTGGGTG-3’)。与未连接的类似物相比,5s类似物显示出严重的DNA甲基化。FISH发现35个S- 5s序列与核仁周边密切相关,提示5 S基因的转录可能发生在该区域。
结论
结果表明,5 S基因的特异连锁排列与5 S基因的表达和功能完全相容。这种非凡的5s基因动态表现在不同的水平上,如染色体内位置的变异、单位结构、表观遗传修饰和调控基序的巨大差异。
背景
核核糖体DNA (rDNA)编码5 S、5.8 S、18 S和26 S rRNA,属于在细胞代谢中起核心作用的最重要的管家基因[1].在植物基因组中,每个基因可能有几百到数万个高度同质的拷贝。这些基因的高拷贝数可能对确保植物发育过程中蛋白质合成需求的增加很重要[2],但也有人提出其他功能,如稳定细胞核[3.].每个大35秒(动物中45秒)RDNA单元含有18秒,5.8秒和26秒的rRNA基因,内部转录的间隔物(ITS)和代际间隔物(Igs)(用于审查[4])。在一个或多个基因座的串联阵列中组织了35个单元。编码120bp长转录物的5秒RDNA已经被认为是占据种子植物中的单独染色体位置(以下,所述染色体)[5- - - - - -9].然而,5 s和35秒基因的物理联动占据了链子藻类中的rDNA的组织,以及早期发散的土地植物如苔藓[10,11].这些研究导致了这样一种假设,即从35 S单元“释放”的5 S基因可能发生在一个共同的被子植物祖先从早期分化的植物中分离出来。然而,35个S- 5s单元(以下简称l型)的连锁排列后来在该属的一些种中被发现艾蒿(来自菊科,被认为是被子植物中系统发育最丰富的类群之一),首先基于细胞遗传学证据[12,13],并经分子研究证实[14].另外的研究表明,多达25%的菊科成员具有不寻常的l型rDNA排列[15,16]最近发现了L-Alify在活性化石迷毒植物中发现银杏[17].L-或S型是否是Agiosperm种类中的祖先RDNA状态仍有待确定。在大多数L型基因组中,5秒的插入发生在26s基因下游的1kb内的Ig中,并且相应的转录物仅在相对的DNA链中编码而不是26 s rRNA [15,16].
虽然在细胞中,必须具有rRNA分子的化学计量比率,但相对于个体基因的转录调节存在的基本差异。由RNA聚合酶I(POL I)产生的大的多函数35s转录物是内核解压的,以产生成熟的18s,5.8s和26秒的rRNA分子[4].位于26-18秒的非基间间隔内的Pol I启动子与转录因子的复合物结合[18].而5 S基因的转录是由RNA聚合酶III (RNA polymerase III, Pol III)进行的,除了TFIIIA、TFIIIB和TFIIIC转录因子外,还需要基因内部的启动子。Pol III内部启动子的三部分结构包括a -box、IE(内部元件)和C-box,这些元件在动植物中高度保守[19].表观遗传工具是参与两种rRNA基因调控的另一层表达控制。非转录基因副本的沉默是由复杂的表观遗传机制介导的,这些机制依赖于染色质修饰,包括DNA甲基化[20.,21].
而有越来越多的真核生物基因组具有5 S基因的l型排列[10,11,22它们的表达模式和表观遗传修饰尚未被研究。剩下的问题是哪些(如果有的话)关联基因表达和功能。在这项工作中,我们着重解决了以下几个问题:
- 1)
L型和s型位点是否同时出现在一个给定的基因组中?如果,那么它们中的哪一个有助于5s的表达?
- 2)
5 S RRNA池是多少均匀的?是S-和L型基因之间的调节元素吗?
- 3)
基因的DNA甲基化和染色质凝聚模式是怎样的?
我们通过RT-PCR、克隆和测序等方法分析表达。亚硫酸氢盐测序和FISH测定DNA甲基化和染色质缩合水平。
方法
植物材料
我们选择了已知的代表性物种,以发展5s rdNA的主要L-或s型排列,以覆盖所有三个有关的有态相关的结构(Anthemideae,Gnaphalieae和heliantheae联盟),其35-5秒(Igs)先前已经排序。物种的叶子或种子材料艾蒿苦艾酒,答:tridentata,花椒,向日葵,Helichrysum bracteatum.,醋氏木质叶氏甲骨甲骨;,Matricaria matricarioides,万寿菊patula(所有的菊科)和Linum alpinum.(Linaceae)从野生种群中获得或购买。植物在生物物理学研究所(Brno,CZ)的温室生长。桌子1列出研究资料的来源。
核酸提取,PCR和RT-PCR分析
采用CTAB方法分离基因组DNA [14].使用Rneasy植物迷你套件(德国Qiagen,德国)从叶片材料中提取RNA。用涡轮增压治疗纯化的RNATM值DNase(Ambion,Applied Biosystems,USA)以摆脱DNA污染的痕迹。为了制备cDNA,通过使用随机非全引物的上标逆转录酶(Invitrogen,USA)通过上标逆转录酶(Invitrogen,USA)逆转2μg的RNA。通过PCR使用以下引物分析GDNA和CDNA:5SGF:5'-GGTGCGATCATACCCCACT-3',5SGR:GGTGCAACACGAGGACTT-3',IGS1692: 5 ' -CGGAACYACCAAAGCGAGTAAG-3 '(新设计)和26Spr1: AGACGACTTTAAATACGCGAC [23].用Taq聚合酶(Roche, Germany)对引物所定的5个S区进行扩增,PCR程序如下:在94℃下循环3分钟;29-35(取决于放大器)周期在55°C为20 s, 72°C为30 s, 92°C为20 s;72°C拉伸7分钟。PCR产物在1.2%琼脂糖凝胶上分离,用溴化乙锭染色并拍照(Ultralum,美国)。将5个S转录本对应的片段克隆到pDrive载体(Qiagen, Germany)中,利用T7和SP6引物从两个方向进行插入测序。
亚硫酸氢盐测序
使用Epitect Bisulfite套件(德国Qiagen,德国)对纯化的GDNA(〜100 ng)进行亚硫酸氢盐处理。扩增借助于双层计划设计的非编码DNA链的引物[24]为正向引物5'-GTTCGGATTCAAAAAAAGGGGT-3'和反向引物5'-CGATCATACCARCACTAAT-3'。PCR程序为:94℃- 3min循环一次;35个循环,94°C - 20 s, 55°C - 20 s,72°C - 20 s;延伸72°C - 7分钟。PCR产物在1.2%琼脂糖凝胶上分离,用PCR纯化试剂盒(machery - nagel,德国)纯化,并克隆到TA载体(pDrive, Qiagen,德国)。利用载体SP6和T7引物进行pcr筛选阳性克隆。每个样本中有11到13个克隆进行了测序(Eurofins MWG Operon, Germany)。
荧光原位杂交(鱼)
新的根尖Helichrysum bracteatum.用0.05%秋水仙碱水溶液在室温下预处理2.5 - 4 h,用3:1 (v/v)乙醇:乙酸固定。原生质体采用纤维素水解酶(0.4%果胶酶(Macerozyme R10, Duchefa,荷兰),0.4%细胞裂解酶[Sigma C8274,美国]和0.4%纤维素酶[Onozuka RS, Duchefa,荷兰)在柠檬酸缓冲液中),滴在显微镜载玻片上,用液氮和70%乙醇冷冻干燥。FISH前用50 μg mL预处理-1在潮湿的室内37℃下rnasea为1小时。在2×SSC中洗涤三次(2×标准盐酸盐+ 0.1%(W / V)十二烷基硫酸钠)中,将载玻片脱水在乙醇系列(50%,70%和100%)中脱水并空气干燥。用胃蛋白酶处理除去细胞质的残余物(10μgml-1在10毫米盐酸,4分钟室温)。洗涤,乙醇脱水,1× PBS, 3.7%甲醛固定10 min, 2× SSC洗涤3次,再次脱水,风干。杂交混合物含50 ng μL-1(1000 Ng /幻灯片),Cy3标记(GE Healthcare,Chalfont,St Giles,England)5 S探测器116bp-long插入克隆烟草5 s rRNA基因[24]和20ngμl-1(400 ng/玻片)35 S rDNA探针(光谱绿色标记的26 S rRNA基因的2.5 kb片段,Abbott分子,IL,美国)。FISH杂交混合物(每片20 μL)由标记的DNA探针、50%硫酸右旋糖酐溶液4 μL、纯甲酰胺10 μL、TE缓冲液0.5 μL和20 × SSC 2 μL组成,75℃变性15 min,立即冷冻。将此方法应用于载玻片,在使用平板的热循环器中进行变性:75°C 5 min, 65°C 2 min, 55°C 2 min, 45°C 2 min,并转移到预热的潮湿的室中,放入培养箱中。37℃杂交过夜后,用2× SSC洗涤,然后0.1× SSC(高强度),42℃分别洗涤10 min,室温下用2× SSC、4× SSC + 0.1% Tween 20洗涤。PBS冲洗载玻片,并将载玻片装入含有DAPI (1 μg/mL)的vectasshield (Vector Laboratories, Burlinghame, CA, USA)中-1).使用配备数码相机的奥林巴斯AX 70荧光显微镜观察FISH信号。使用ISIS软件(MetaSystems, Altlussheim, Germany)对图像进行分析和处理。
生物信息化方法
序列用BioEDIT Sequence Alignment Editor 7.0.9.0编辑器组装[25和一致的。用CyMATE软件对亚硫酸氢盐数据进行处理并计算甲基化密度[26].二级结构建模通过MFOLD Web服务器的在线工具(RNA研究所,纽约州立大学奥尔巴尼大学艺术和科学学院)进行。通过BLAST进行公共数据库搜索[27].从5s RNA数据库下载额外的5s序列作比较用途[28].
结果
基因组DNA的PCR
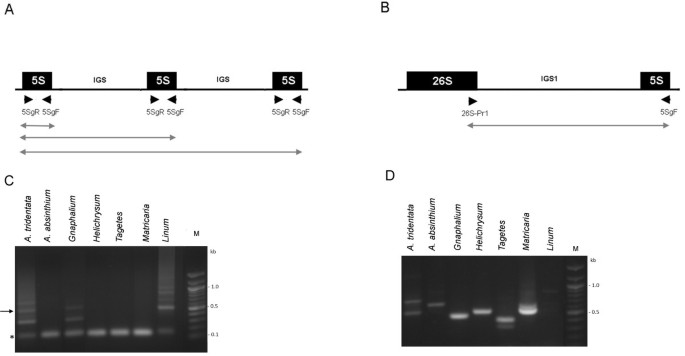
以往的Southern blot杂交显示在细胞中有大量的35-5 S单元连接艾蒿苦艾酒,艾tridentata,Helichrysum bracteatum.,Matricaria matricarioides和万寿菊patula.在这里,我们希望确定这些基因组中是否存在未连接的(s型)单位。为了提高灵敏度,我们采用了几种PCR策略(见图)1),利用特异性引物对5 S和26 S编码区进行分析。在连锁排列的情况下(5s拷贝两侧非5s DNA),只有对应于~120 bp单体的产物会被扩增(图)1A).相应的,单体带在A. Absinthium,H.Bracteatum,M. Matricarioides和t. patula..在串联排列的情况下,会形成单体和低聚物,后者源自聚合酶对相邻单元的读入。这种情况发生在Linum alpinum.这种物种通常进化出一种独立的DNA单元排列,并显示出几个寡聚带延伸到一个未解决的高分子量片段的涂片上(图)1C)。显着地,类似的梯子虽然具有较短的周期性答:tridentata和G. luteolbum.(虚弱的)。除了亚麻属植物,使用26SPr1-5SgF引物进行反应(图1b)产生1-2条带的<1kb,确认所有研究的菊科物种中链接的RDNA基因型(图1D)。
接下来,我们分析了串联排列的基因答:tridentata通过克隆与三聚体相对应的低聚PCR产物(图1C,箭头)。对Genbank: JX101914-JX101916的3个质粒克隆进行测序,发现克隆含有5 S基因的三聚体(#4)和二聚体(#3和#7)。小s型单位的特征是异常短的基因间隔(附加文件1),其大小(58 bp)明显不同于植物中5个S- 5s间隔层的平均大小(100-900 bp) [29,30.].克隆彼此高度同源并达到L型拷贝(图2).两个基因拷贝(克隆3和克隆4)在A-box调控元件中存在突变。
基因组和cDNA序列的对准。从测序的26S-18 S间隔物中取出GDNA,并且大多数对应于在26 S基因下游的5秒rdNA1 [13].一个gDNA克隆(12_2)来源于一个内部缺失的5s rDNA2变体。三个序列(S_4a-c)来源于克隆的5 S-5 S三聚体答:tridentata.注意,S4_C单体中的四个突变。使用5SGF和5SGR引物从扩增获得cDNA克隆。盒装保守的监管要素。
因此,答:tridentata并有可能g . luteoalbum包含5 S基因的连接和分离构型的rDNA。然而,基因拷贝的比例转移到连接35个S- 5s单位。因此,这种类型的基因组排列被称为“L年代“。
5 S cDNA序列的尺寸和克隆分析
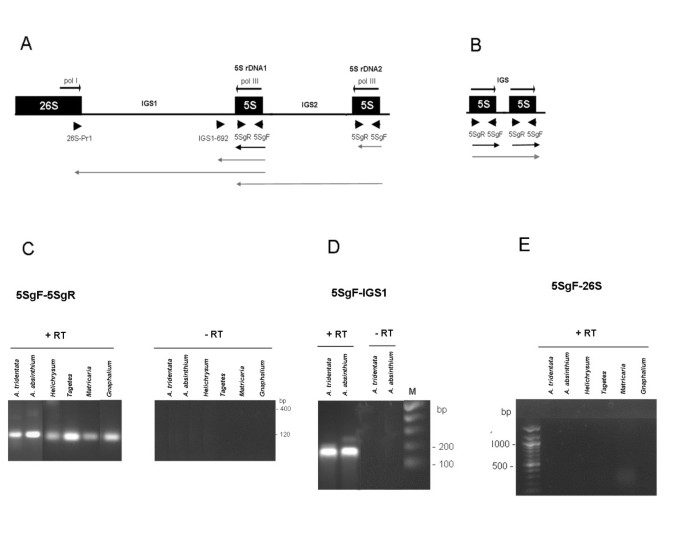
为了研究5 S基因的表达,我们分析了5个主要连锁基因型的物种(A. Absintehium.答:tridentataH. Bracteatum.m . matricarioides和t. patula.)[15].使用不同的底漆套进行rt-PCR检查几个潜在的5秒轨迹转录物(图3.A, B). 5SgF/5SgR引物可以扩增出一个约120 bp的基因区域,该区域对应于一个几乎完整的成熟的5s转录本。较长的产物将对应于聚合酶读通到邻近的单位。它们可能来自独立的串联阵列(图)3.b)或来自26 s-18 s间隔物中的第二个不完整的5 s rdna2副本(图3.A).第二个~180 bp的IGS1扩增子692/ 5SGF引物涉及整个5 S的基因区域加上约60bp的下游IgS1序列。最后,第三种RT-PCR(26sPr1/ 5SGF引物集)映射电位5S-IGS1-26的转录物。基因5SGF / 5SGR引物实际上扩增了所有cDNA模板的〜120bp片段(图3.c)与成熟5秒转录物的典型长度一致。与基因组PCR相反,在RT-PCR反应后没有可视化低聚或高分子量片段。IGS1.692/5SgF引物也可扩增预期大小的条带答:tridentata和A. Absintehium.cDNA(图3.故选DPr1/ 5SGF引物未扩增CDNA的任何产品(图3.E)虽然他们确实扩增了基因组DNA的一个特定片段(图)1D)。
5 S表达的RT-PCR分析。(A) 35 S- 5s单元的一部分示意图。所有物种中存在5秒的RDNA1;在某些情况下发现了另外5秒的RDNA2A. Absintehium.单位 [14].(B中较小的5s - 5s串联电路的原理图表示答:tridentata.引物的位置用箭头表示。下面的箭头线表示推测的由(一部).黑色编码区成绩单。灰色转录物,其含有IGS序列的可变部分。循环条件:(C) - 29个循环;(D-E.) - 35周期。“+ RT”和“-RT”表示与或不具有逆转录步骤的反应。
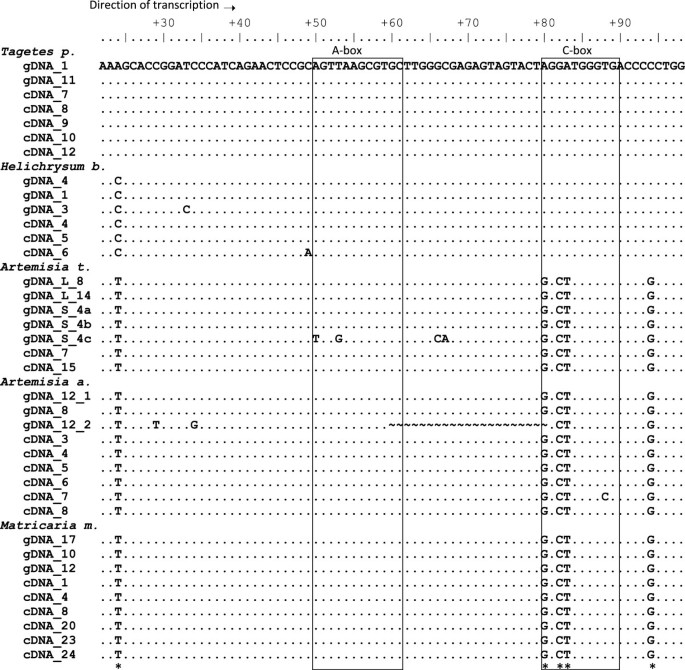
对扩增产物进行纯化、克隆和测序。cDNA克隆与gDNA克隆的比对如图所示2.显然,在每种物种中,cDNA克隆几乎与衍生自5秒rdNA1的GDNA克隆相同。轻微的差异归因于少数随机突变。类似地,较长间隔序列的对准(IGS1692/5SgF)的cDNA和基因组克隆也显示了几乎完全的身份(附加文件2).因此,由基因组和cDNA序列构成的系统发生的系统发育树状图(ML,NJ)揭示了物种特异性聚类(未示出)。虽然GDNA和cDNA克隆的比较未能揭示大量肿瘤元多态性,但在整个物种上检测到最多七个保守的可变部位(所有单位发生)。令人惊讶的是,其中三个位于80-89(图中)的位置(数字)位于POL III启动子元素(C字箱)(图2).
5秒的监管主题和二级结构
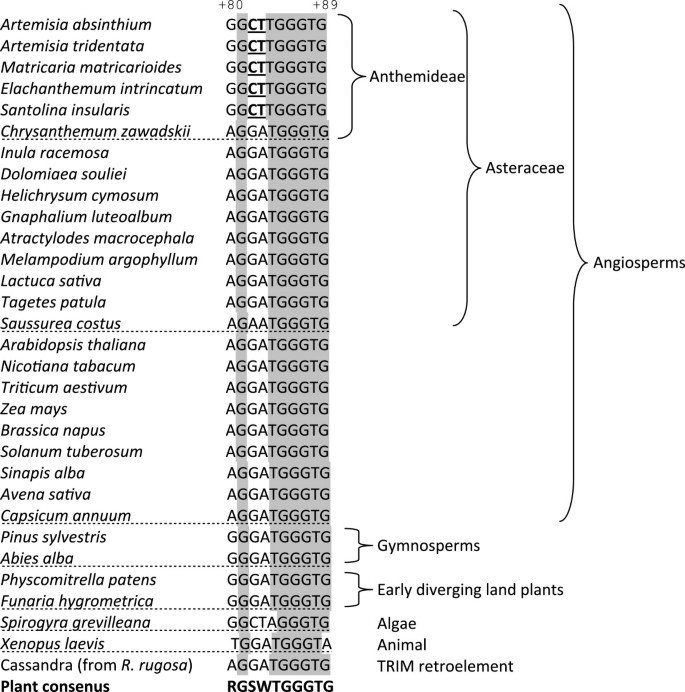
如前所述,内部Pol III启动子由a -box、内部调控元件(IE)和C-box三部分基序组成。对不同分析物种的多个克隆的测序显示,A-box和IE元件的保存水平很高(图)2).然而,仅在80-89处的内部监管区,C字箱的第三部分仅部分地保守。在5'区域中有三种取代:分别在位置+80和两个G> C处的A> g转变,分别在+82和+83处> T横向。C-Box的3'end是不变的。所有cDNA克隆(除了随机非固定突变外)A. Absintehium.答:tridentata和m . matricarioides含有相同(5 ' -GGCTTGGGTG-3 ')的C-box变体(称为C*-box),而其他研究物种显示了典型的5 ' -AGGATGGGTG-3'motif(图)2和4)[31].上游序列保守程度较低,但在所有基因组克隆中均存在约为- 20的TATA盒[15包括来自L年代物种。此外,在每个IGS1中有多个dT终止子,在最后5s基因核苷酸的直接下游有一个或两个(附加文件)2的s型基因组克隆中只发现一个终结者答:tridentata(附加文件1).我们没有识别任何重复的元素(使用REPFIND工具,Vienna服务器,http://molbioltools.ca/Repeats_secondary_structure/server),被认为与Pol I一起在转录终止中起作用[32].
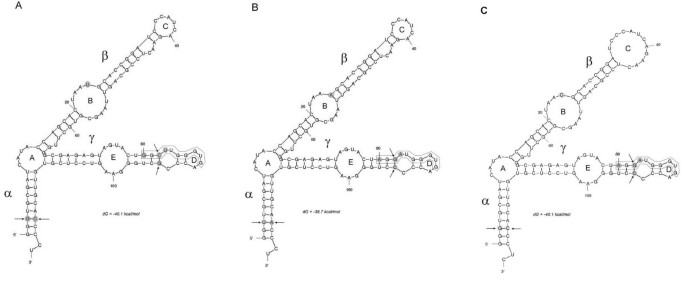
5s rRNA的二级结构被认为对其在核糖体上的功能很重要,因为它的假基因通常偏离典型的y型分子[33.].我们希望确定保守取代的影响(在给定物种的所有克隆中)对RNA分子的折叠。使用基于Web的计算机程序MFOLD Web Server [34.的5 S rRNA二级结构(A. Absintehium.t. patula.和H. Bracteatum.)发现若干突变不同的是模拟的(图5).α领域被认为是土地植物中最不保守的[11,28]在+3位点表现出单一的多态位点。在这个位点上,G > T取代被C > a取代在+118位补偿,从而保持了稳定的氢键数量。B环内的位置+24 (β结构域)变化最大,被A、C或T核苷酸占据。这个位点的多态性似乎影响了B环的大小;最小的是Tagetes..γ域由E环和D环组成,E环是高度保守的a -box的一部分,D环是C-box的一部分。显然,物种特异性突变似乎没有显著影响域结构。
DNA甲基化分析
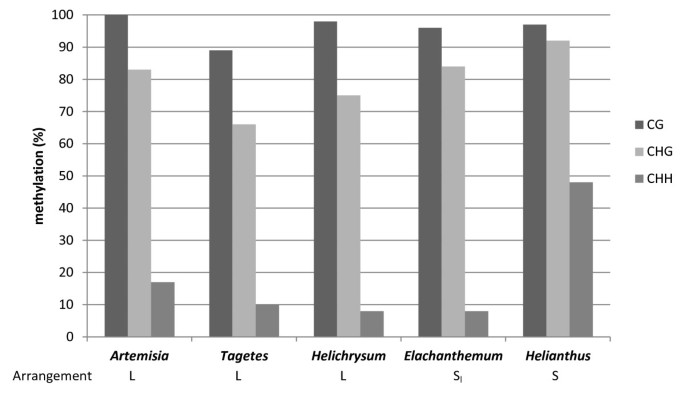
利用亚硫酸氢盐测序,我们检测了发生在两个不同基因组组织中的5 S基因的DNA甲基化,目的是解决差异排列是否影响表观遗传模式的问题。我们选取了两个具优势连锁(Artemisia Absinthium,Helichrysum bracteatum和万寿菊patula)及分开(花椒和向日葵) rDNA的排列,并分析包含引物的5s编码区域的89 bp(图1一种)。在亚硫酸氢盐处理后,克隆并测序扩增的PCR产物。亚硫酸氢盐分析的结果作为单一克隆分辨率的图表(附加文件3.),并总结于附表2和图6.CG和CHG位点比非对称的CHH位点更常见,植物DNA是典型的[37.].来自同一个体的无性系之间也存在相当大的差异2).例如,在Tagetes.,单个克隆(#17)仅含有两种甲基化Cs(11%),同时存在具有多达44%甲基化的克隆。在物种之间也发生了甲基化密度的显着变化。
鱼
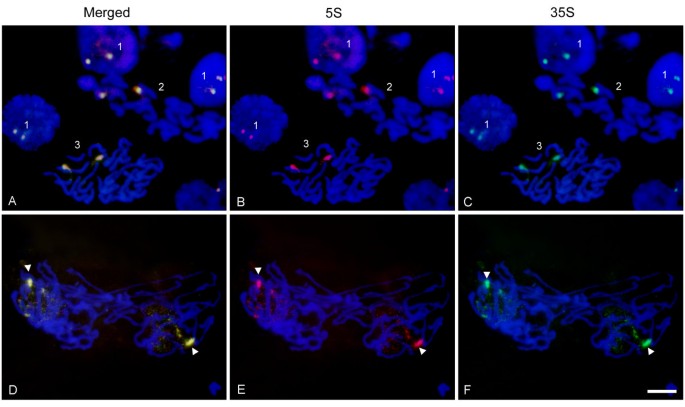
我们分析了5 S和35 S基因在细胞周期不同时期的染色质凝结模式(图)7).分别用光谱绿色和花青素Cy3标记的35 S和5 S探针与之杂交Helichrysum bracteatum.间期和中期细胞核。两个探针的信号都定位于一对同源物(字段2,图a - c),表明该物种中有一个单一的35 S-5 S位点。类似地,前期细胞核(图3,A-C)在已经浓缩的染色体上显示了两个共定位信号。在间期(第1区,图A-C),大多数细胞中可见两个暗色小体,代表核仁。35s和5s信号倾向于在核仁周围结合,在某些情况下(上视野1,图A-C),解密实的信号传播到核仁。后期/末期(D-F)染色体分裂成两条染色单体。在每个新形成的原子核中,一个同系物比另一个更早开始解密集。
亚硫酸氢盐甲基化分析综述。测序区域涉及5 S编码区域的中心部分。数据是从每个物种的11-13个克隆中收集的(附加文件)4).y轴-沿无性系的mC平均频率,以总Cs的比例表示。
讨论
在较高的真核生物(植物和动物)中,5 S基因作为单独的阵列(S型),或者更少地与大35秒(L型)相连。在过去已经彻底研究了S型基因的表达,但在任何这些生物中尚未解决L型基因的表达。在这里,我们认为,在几种代表性植物物种中,表达了链接的5个基因并占据促进细胞5的RRNA池。
l型基因组中s型位点丰度低
以前的Southern blot和FISH分析显示菊科几个属的35个S-5 S单位均质[14] [15].目前的PCR分析显示了较小的5 S-5 S串联以及两个物种中的主要35-5秒(艾tridentata和醋氏木质叶氏甲骨甲骨;).单独的序列可能来源于未与Southern blot上的26s探针杂交的位点[14].定量估计表明,它们在L中所代表的5s rDNA不到10%年代基因组[14].与链接35S-5 S基因的对比,5S-5S串联含有A型元素(2/7单体)的突变,表明非功能性拷贝的发生。然而,需要分析更多的克隆以获得阵列之间的差异突变频率的统计支持。在其他L型基因组中没有S型串联(图1)进一步表明它们通过链接单元频繁损失和/或快速替代。问题出现在染色体上的次要S型基因座的位置。虽然鱼在中期染色体上答:tridentata未能揭示单独的35秒和5秒信号,在间期间,某些网站的标记更强烈地标记为5S或35秒rdNA探针[14].因此,我们倾向于假设较小的5s - 5s串接发生在接近35s - 5s阵列或分散在它们之间。
因此,可以在不同植物属中区分出四种类型的rDNA排列:(i) l型,其中35个S- 5s单元被均质完成(例如,Helichrysum,Matricaria和Tagetes),(ii)l年代-Type,其中主要是链接的35个S-5 S单位以及轻微的分离5 S串联(艾蒿和醋栗),(iii)sl型,其特点是主导独立的5s - 5s串接,35个S- 5s单元丰度较低。elachanthemum复杂似乎是这一群体的代表[15和(iv) S型,其中基因组包含大多数被子植物典型的独立的5s序列。
35个S- 5s序列的转录
L.年代基因组港口主导L型单位和次要S型单位。然而,两个基因座编码可能转录的基因。由于仅在细胞中仅在细胞中转录的一部分rRNA基因(其静脉曲根上灭活),因此测定5 s rRNA转录物的起源,特别是在L中感兴趣年代- 和l型基因组。通过以下观察结果支持连接5S基因的显性表达:(i)鉴定了延伸到超出第一终止信号之外的IGS1的伯序列转录物,这表明转录的5次序列实际上是由于分数以来的连接5次基因。检测IGS1序列,(ii)在L中没有从Tandemly布置的5 S-5 S单元中检测到读取转录物年代型物种,答:tridentata(iii)根据预形成的RNA折叠模拟,连锁基因衍生的RNA采用了功能分子的二级结构,最后,(iv)连锁阵列包含欠甲基化和解密的染色质组分(见表)2和图6),很可能与活性基因相对应。因此,我们推测在L年代和l型基因组在总rRNA库中的比例很小(如果有的话)。
5 s和35秒链接的一个后果可能是通过RNA POL I和POL III酶引起的两种基因的推定转录(图3.).绿豆(Vigna Radiata.), 35s转录终止发生在26s rRNA编码区3'端下游65 bp和315 bp内[32].在黄瓜(Cucumis巨大成功),在IGS中观察到多个终止信号,第一个终止信号位于26s基因下游350 bp [42.].在Tagetes., 5 S rDNA1的功能插入刚好发生在最后26 S基因核苷酸下游约200 bp内(附加文件2和[13]),提供长35S-5S前体形成的可能性,也许是双链RNA。但是,我们无法识别包含26秒和5次序列的任何转录物(图3.).因此,这两个基因的转录很可能在IGS1中有效终止,或者基因在细胞核中被分隔(下文进一步讨论)。
如前所述[14,一些基因在A. Absintehium.含有远向26s基因的第二5秒插入(5srdna2)。但是,PCR产物对应于5S rdNA2转录(图2)在已测序的克隆中未检测到,这支持了它可能代表一个假基因,因此没有转录的假设。然而,这种重复可能具有进化意义,因为在马尾中观察到一个具有功能的和一个无功能的5s拷贝的类似重复,EquiseTum Hyemale.[11].明显的并行性可能指向不同生物中的5次集成的常见机制,和/或类似的生物体中的选择压力维持基因官能度。
POL III启动子变体的演变:更新的植物C盒共识序列
与大多数其他基因不同,5S rDNA在内部控制区域(ICR)内含有基本调节元件。结果,5秒rRNA携带基因的启动子序列,从中转录,允许研究cDNA序列中的调节元件。这些元素的序列和位置(A-和C盒,图2)在真核节上高度保守[31].因此,令人惊讶的是,来自部落的几种与Anthemideae的几种密切相关的物种演变了C字母(C *)的变体,其与缓解植物共识多达30%(图4).该基序存在于各种物种的cDNA克隆中,发现cDNA和GDNA序列之间的全部一致性,在基因组内几乎没有变化。因此,承载C * -Box变体的单元似乎是功能的。在藻类中发现了C * -box的最接近的相对水绵.因此,我们提出了一个修订的,更轻松的工厂C盒共识主题,以5'-RGSWTGGGTG-3'写出。大多数变化位于盒子的5'一半。令人惊讶的是,该区域的突变实际上导致转录减少拟南芥[43.].其中+82 G > T和+84 T > C替换分别导致转录部分或完全丧失;在我们的新版本中,C*盒包含C at +82,而T at +84保持不变。这表明+ 84t可能是C-box功能的关键,而5 '半中的其他三个核苷酸可能更可变。此外,二级结构似乎不受C-box多态性的影响(图)5)表明RRNA-TFIIIA互动可能不会受损。然而,由于三种突变中的两个是非补偿的,因此它们对三级结构的影响[44.也不能排除其他因素的影响。
似乎在启动子变体的发生与RRNA基因的基因组排列之间并没有简单的相关性。例如,在某些情况下发现C * -Box,但不是所有L型物种。系统发育研究表明其在部落Anthemideae中的优先事件,但再次,并非所有成员似乎都忍受(图4).序列分歧可能宁愿反映在该组植物中经常消除/均质化循环的基因座的整体动态。在这种情况下,Asteraceae物种在染色体上显示了RDNA基因座的不同位置[13,16,49.],大大基因组大小变化[50.],35秒和5秒标记之间的某些系统发育不一致[51.,甚至端粒和rDNA重复序列之间的重排[52.].C*-box变种似乎是最近起源的,可能是在不到几百万年前菊花科从菊科的其余部分分化之后进化而来的[53.].为了更好地了解这种C盒分歧,可以在许多其他菊科物种中分析5次启动子以及与它们结合的转录因子是有趣的,以便检测到他们可能的共同演变。值得注意的是,已知TFIIA快速发展(酵母和动物基因仅占20%相似性),并且其初级成绩单的剪接似乎受到植物中出现的5秒插入的影响[54.].
连接和分离的5s rDNA的DNA甲基化模式相似
S-and L型物种均显示CG,CHG和CHH甲基化模式,典型的植物重复DNA [37.].一致的是,不同基序的甲基化密度呈相同的下降趋势:CG > CHG > CHH,与前人对5 S甲基化的研究一致[41.,55.].可以得出这样的结论:相对高水平的甲基化(通常高于基因组平均水平)与串联排列无关,但当5s基因被组织为单拷贝或低拷贝插入时也会发生甲基化。换句话说,串联排列似乎不是5s甲基化的必要条件。在串联排列单元中,低甲基化水平或无甲基化水平的基因被认为是活性的,而高甲基化水平的基因则是异色和非活性的[20.].克隆之间的甲基化密度的变化可能反映阵列的骨髓异质性。显着脱甲酰化基因,甲基化少于11%(表2)检测到可能来自35 S-5 S阵列的高活性部分。发现了相对高水平的甲基化,特别是在非CG基序中向日葵(年代)。Helianthus Annuus.显示5 s rdna的泌乳症位置[15,38.而甲基化程度较低的5s基因万寿菊patula和艾蒿苦艾酒位于(亚)端粒位置[12,15].在这个意义上,5秒位于近端的焦点拟南芥比其他远位基因更甲基化[56.].
染色质缩合与rDNA单位表达的关系
已知RNA Pol I(转录35s基因)存在于核仁中,RNA Pol III(转录5s基因)是一种核浆蛋白。因此,一个被一个聚合酶积极转录的35s - 5s单元不能被其他聚合酶同时转录。严格的35s和5s转录区段化也可能是我们未能检测到双向26s - 5s转录产物的原因(图)3.).可以设想几种rDNA表达的空间控制模型。首先,核仁和核质之间可能有频繁的基因重组。考虑到执行5 S和35 S基因的转录需要不同的转录机制,这是不太可能的。第二种可能性是,megabase大小序列的一部分可能由聚合酶I转录,而另一部分由Pol III转录。当然,l型基因组包含了足够多的基因(几千个拷贝[15),从而将阵列分离成转录域。最后,调控可能发生在单个染色体位点的水平上。例如,一个染色体同源物可能参与核仁的组织和35个S基因的转录,而其他同源物可能转录5个S基因。FISH实验如图7可以为这一假设提供一些实验支持。在晚期后期/ telophaseHelichrysum bracteatum.核仁显然在一个高度稀释的同源物上组装,而另一个高度浓缩,可能不参与核仁组件。在差异中没有看到这种缩合模式的这种剧烈差异,其中两种同源物上的RDNA被凝聚并与核仁外围相关(图7得了).有趣的是,5次转录的TFIIIA因素似乎集中在包括核仁核心的几个核心灶拟南芥[57.暗示链接5次基因的转录可能在核仁附近发生。
结论
通过本研究,我们获得了完全或部分均质35个S- 5s序列的物种的全部5s rRNA库中占主导地位的5s连锁基因的证据,即5s基因完全转录自这些连锁序列。在5 S基因内部调控元件中发现的异常序列变异似乎与转录完全兼容,因此,我们提出了一个更新的C-box共识序列。连锁基因的甲基化模式似乎与非连锁基因的甲基化模式相似。在核拓扑结构上,35 S- 5s排列与核仁密切相关,提示5 S转录可能发生在核仁附近,可能发生在核仁的外围。
缩写
- gDNA:
-
基因组DNA
- cDNA:
-
互补DNA
- IGS:
-
26 S和18 S rRNA基因间的间隔
- L型:
-
35s和5 s RNA基因的连接布置
- 折中观点:
-
35 s和5秒的RNA基因的单独布置
- Ls-type:
-
链接排列,S排列贡献较小
- SL型:
-
单独安排,L安排贡献较小
- 波尔我:
-
RNA聚合酶I.
- 第三波:
-
RNA聚合酶III
- ICR:
-
内部控制区域
- 鱼:
-
荧光原位杂交。
参考
- 1.
GRIMMT I:RNA聚合酶I的哺乳动物核糖体基因转录的调节。PROG核酸REM摩尔BIOL。1999,62:109-154。
- 2.
染色质开启和关闭核糖体RNA基因。细胞生物学杂志。2004,3(7):880-883。
- 3.
Kobayashi T:调节核糖体RNA基因拷贝数及其在调节酵母基因组完整性和进化适应性方面的作用。细胞mol寿命。2011,68(8):1395-1403。10.1007 / s00018-010-0613-2。
- 4.
植物核糖体基因RNA聚合酶I的结构组织和转录调控。细胞分化的结果和问题20:植物启动子和转录因子。编者按:Nover L. 1994, Springer-Verlag,柏林/海德堡,3-24。
- 5。
亚麻5s RNA基因的组织结构。中国生物医学工程学报,2019,32(4):591 - 598。10.1093 / nar / 9.22.5895。
- 6.
Campell Br,Song Y,Posch Te,Cullis Ca,镇CD:5 S核糖体RNA编码基因的序列和组织Arabidopsis Thaliana。基因。1992,112(2):225-228。10.1016 / 0378-1119(92)90380-8。
- 7。
5 S rRNA基因的序列组织和调控元件的研究。基因。1988,62(1):165-169。10.1016 / 0378 - 1119(88) 90591 - 4。
- 8。
Lapitan NLV:高等植物核基因组的组织和演变。基因组。1992,35(2):171-181。10.1139 / g92-028。
- 9.
陈志强,陈志强,陈志强:兜兰核糖体DNA和染色体进化的动态分布模式。植物生态学报。2011,29(6):591 - 598。
- 10.
Capesius I:藓类真菌核糖体RNA基因重复序列分析。acta botanica sinica(云南植物学报),2017,33(3):559-564。10.1023 /: 1005740031313。
- 11.
Wicke S,Costa A,Munoz J,Quandt D:躁动5秒:核核糖体DNA的重新安排和陆地植物中的演变。mol phylocyet evol。2011,61(2):321-332。10.1016 / J.YMPEV.2011.06.023。
- 12.
Yoshikazuh,Matoba H,Kondo K:蒿属植物属植物中的核糖体RNA基因的物理映射。(Asteraceae)。鹅圈炎。2006,59(4):312-318。
- 13.
陈志强,陈志强,陈志强:基于FISH的北美特有艾草属植物核糖体DNA (18 S-5.8 S-26 S和5 S)共定位研究。acta botanica sinica, 2017, 36(4): 549 - 554。
- 14。
陈志强,陈志强,陈志强:蒿属植物中35 S和5 S rRNA基因的连锁关系:来自被子植物的初步证据。中国生物医学工程学报。2009,18(1):85-97。10.1007 / s00412 - 008 - 0179 - z。
- 15.
Garcia S, Panero J l, Siroky J, Kovarik A:菊科5 S和35 S核糖体RNA基因(rDNA)的反复聚合和分裂是其高度动态进化的特征。植物学报。2010,33(6):593 - 598。
- 16。
Mazzella C,Rodriguez M,Vaio M,Gaiero P,Lopez-Carro B,Santinaque FF,Forle Ga,Guerra M:achyrocline(Asteraceae,Gnaphalieae)的核星学特征:稳定的核型,低DNA含量变化和RRNA基因的连接。CytoOgenet基因组Res。2010,128:169-176。10.1159 / 000290689。
- 17.
加利安JA,Rosato M,Rossello Ja:种子植物中核核糖体5 s和45次基因家族的早期进化分层:来自Live Fossil Gymnosperm Ginkgo Biloba的证据。遗传(EdInb)。2012,108(6):640-646。10.1038 / hdy.2012.2。
- 18。
SAEZ-Vasquez J,Pikaard CS:RNA聚合酶I全酶 - 启动子相互作用。J Biol Chem。2000,275(47):37173-37180。10.1074 / JBC.M006057200。
- 19。
orioli a,pagali c,pagano a,teichmann m,dieci g:RNA聚合酶III转录控制元素:主题和变化。基因。2011,493(2):185-194。
- 20。
Vaillant I, Tutois S, Cuvillier C, Schubert I, Tourmente S:拟南芥5s rRNA基因的调控。植物生理学报。2007,48(5):745-752。10.1093 /卡式肺囊虫肺炎/ pcm043。
- 21.
拟南芥中异色sirna和DDM1可以独立沉默异常的5s rDNA转录本。公共科学图书馆。2009,4 (6):e5932-10.1371/journal. pon.0005932。
- 22.
Bergeron J,Drouin G:与真菌物种的RDNA单位有关的5 S核糖体RNA基因的演变。Curr Genet。2008,54(3):123-131。10.1007 / s00294-008-0201-2。
- 23.
Komarova NY,Grabe T,Huigen DJ,Hemleben V,Volkov Ra:人工茄属Allopolyploids中的rDNA组织,差异表达和甲基化。植物mol biol。2004,56(3):439-463。10.1007 / s11103-004-4678-x。
- 24.
Kovacova V,Janousek B:Bisprimer-A植物和哺乳动物DNA样品基于亚硫酸氢盐的基因组测序设计的程序。j eredity。2012,103(2):308-312。10.1093 / jhered / ESR137。
- 25.
大厅TA:BioEdit:适用于Windows 95/98 / NT的用户友好的生物序列对齐编辑器和分析程序。Nucl酸Symp Ser。1999年,41:95-98。
- 26。
Hetzl J,Foerster Am,Raidl G:Mittelsten Scheid O:Cymate:血硫酸盐测序后植物基因组DNA甲基化分析的新工具。工厂J. 2007,51(3):526-536。10.1111 / J.1365-313x.2007.03152.x。
- 27。
Altschul SF,Madden TL,Schaffer AA,张J,Zhang Z,Miller W,Lipman DJ:Papped Blast和Psi-Blast:新一代蛋白质数据库搜索程序。核酸RES。1997,25(17):3389-3402。10.1093 / nar / 25.17.3389。
- 28。
Szymanski M,Barciszewska Mz,Barciszewski J,SpecHt T,Erdmann VA:核糖体5 S核糖核酸核苷酸序列的汇编:真核5 S RRNA。Biochim Biophys Acta。1997,1350(1):75-79。10.1016 / s0167-4781(96)00147-9。
- 29.
植物5s rDNA具有多个核小体位置。基因组学杂志。2006,49(7):840-850。10.1139 / g06 - 039。
- 30。
植物5s - dna的研究进展。acta botanica sinica(云南植物研究),2017,30(4):531 - 534。
- 31。
Specht T, Szymanski M, Barciszewska MZ, Barciszewski J, Erdmann VA: 5s rRNA和5s rRNA基因序列的编辑。核酸学报1997,25(1):96-97。10.1093 / nar / 25.1.96。
- 32。
绿豆核糖体RNA基因的转录终止发生在间隔区175bp的重复元件内。王志强,王志强,王志强,等。10.1007 / BF00331282。
- 33.
Belkhiri A,Klassen GR:在糖磷酸盐的RDNA中邻近5秒rRNA基因的5 s rRNA序列分叉。Curr Genet。1996,29(3):287-292。
- 34.
Zuker M:用于核酸折叠和杂交预测的MFOLD Web服务器。核酸RES。2003,31(13):3406-3415。10.1093 / nar / gkg595。
- 35.
Luehrsen KR,Fox Ge:真核细胞质5升核糖体RNA的二级结构。Proc Natl Acad SCI U S A. 1981,78(4):2150-2154。10.1073 / pnas.78.4.2150。
- 36.
Barciszewska Mz,Erdmann Va,Barciszewski J:植物细胞质5秒钟的动态构象。植物化学。1994,37(1):113-117。10.1016 / 0031-9422(94)85008-9。
- 37.
高等植物DNA甲基化:过去、现在和未来。生物化学学报。2011,1809(8):360-368。10.1016 / j.bbagrm.2011.04.006。
- 38。
关键词:Helianthus argophyllus, 5S和18 S- 5.8 S- 25s核糖体DNA,染色体特征,物理定位基因组学杂志。1999,42(1):110-115。
- 39。
Garcia S,Garnatje T,Kovarik A:植物RDNA数据库:核糖体DNA基因座数据,包括植物中的其他核科学和细胞遗传学信息。染色体瘤。2012,10.1007 / S00412-012-0368-7。
- 40.
Mathieu O,Yukawa Y,Sugiura M,Picard G,Tourmente S:5 S RRNA基因表达不受拟南芥中的DNA甲基化抑制。工厂J.2002,29(3):313-323。10.1046 / J.0960-7412.2001.01212.x。
- 41。
富日期K j,Matyasek r,Kovarik A:拟南芥和Secale Cereale的5秒RRNA基因中5-甲基胞嘧啶残留的分布。Mol Genet基因组学。2002,268(4):510-517。10.1007 / S00438-002-0761-7。
- 42。
Zentgraf U,Ganal M,Hemleben V:黄瓜rRNA前体的长度异质性(Cucumis sativus)。植物mol biol。1990,15(3):465-474。10.1007 / BF00019163。
- 43。
Cloix C,Yukawa Y,Tutois S,Sugiura M,Tourmente S:在体外分析拟南芥转录5 S RRNA基因的转录所需的序列。工厂J.2003,35(2):251-261。10.1046 / J.1365-313x.2003.01793.x。
- 44。
Erdmann VA, Barciszewski J:核糖体5s RNA:三级结构和与蛋白质的相互作用。中国科学(d辑),1996,17(1):1- 11。10.1111 / j.1469 - 185 x.1996.tb00740.x。
- 45.
Kalendar R, Tanskanen J, Chang W, Antonius K, Sela H, Peleg O, Schulman AH: Cassandra逆转录转座子携带独立转录的5 S RNA。中国科学(d辑:地球科学),2008,31(5):593 - 598。10.1073 / pnas.0709698105。
- 46.
陈芳,陈慧慧,王桂玲,王静,于明明,肖PC:利用ITS DNA和5s rRNA测序鉴定雪莲属植物及其濒危药材。中国生物医学工程学报。2008,27(8):889-892。10.1055 / s - 2008 - 1074551。
- 47.
STUESSY TF,BLOCH C,Schneesweiss H,Rebernig C,Villasenor J:Melampodium(Asteraceae)的系统发育和染色体进化。S AFR J BOT。2008,74(2):379-379。
- 48.
Gnavi G,Bertea Cm,Usai M,Maffei Me:由精油组合物,5S-RRNA-NTS测序和EcoRV RFLP-PCR的Santolina Insularis Chemototis的比较表征。植物化学。2010,71(8-9):930-936。
- 49.
Weiss-Schneeweiss H, Stuessy TF, Siljak-Yakovlev S, Baeza CM, Parker J:南美种Hypochaeris(菊科,Lactuceae)的核型进化。acta botanica sinica(云南植物学报). 2003,31(4):457 - 461。
- 50。
acta botanica yunnanica(云南植物研究中心);acta botanica yunnanica(云南植物研究中心);acta botanica yunnanica(云南植物研究中心)植物生态学报,2003,5(3):274-284。10.1055 / s - 2003 - 40790。
- 51.
Morgan Dr,Korn RL,Mugleston SL:洞察Machaerantherinae(Asteraceae:Astereae)的洞察力进化:5秒的核糖体RNA间隔物变异,估算用于不协调的支持,构建网状发作。我是J机器人。2009,96(5):920-932。10.3732 / AJB.0800308。
- 52.
李杰,他,张l,胡y,杨f,ma l,huang j,li l:端粒和45 s rdna序列在Chrysanthemum segetum l. protoplasma的染色体上是在结构上的。2012,249(1):207-215。10.1007 / s00709-011-0279-0。
- 53。
o Oberprieler C:环地中海菊科菊花科的时间和空间多样性。植物分类学报,2005,54(4):951-966。10.2307 / 25065480。
- 54。
Barbazuk WB:植物中的保守替代拼接事件揭示了5 S RRNA调节TFIIIA的古老出现。RNA Biol。2010,7(4):397-402。10.4161 / RNA.7.4.12684。
- 55。
拟南芥5号染色体左臂的染色质-异染色质过渡区甲基化。染色体学报,2002,10(6):455-466。10.1023 /: 1020936229771。
- 56。
Vaillant I,Tutois S,Jasencakova Z,Douet J,Schubert I,Tourmente S:拟南芥中串联重复5秒rRNA基因的低甲基化和高甲基化。工厂J. 2008,54(2):299-309。10.1111 / J.1365-313x.2008.03413.x。
- 57.
陈志强,陈志强,陈志强:拟南芥转录因子IIIA和核糖体蛋白L5的鉴定与表达。核酸学报2003,31(9):2424-2433。10.1093 / nar / gkg335。
致谢
我们要感谢Jiříširokō(科学院,CZ学院)的建议,以便他的洞察力评论。本研究由捷克共和国的拨款机构(P501-10-0208和P501/12 / G090),科学学会(RVO68081707)和西班牙语和加泰罗尼亚政府(项目CG12010-22234-C02-01和02 / BOS,分别为项目2009SGR00439)。SG受益于Beatriu dePinós.博士后合同与支持每一个大学的矿泉犬I Recerca(Cur)del Favically d'Mecondia我Coneixement de la Generalitat de Catalunya(加泰罗尼亚政府),短期EMBO(欧洲分子生物学组织)奖学金。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
提交人声明他们没有竞争利益。
作者的贡献
SG和AK设计了这项研究并写了这篇论文。SG进行了大部分分子生物学和细胞遗传学实验;AK进行了分子和生物信息研究,并起草了纸张,LCK分离的RNA并制备的CDNA。所有作者阅读并认可的终稿。
电子辅料
5 S低聚物的测序
额外的文件1:答:tridentata。排序克隆的对齐。编码区域以粗体字母。盒子a和c是黄色阴影。TATA框和终端信号分别为红色和蓝色。星号表示突变。(PDF 143 KB)
来自a的长5 s-igs1克隆的对齐
附加文件2:.苦艾.比对3个cDNA和2个基因组(gDNA)克隆,包含5个S基因和基因间序列。终止信号有下划线。(PDF 145 KB)
12870 _2012_1029_moesm3_esm.pdf
附加文件3:26 S- 5s基因间隔体的结构。基因组克隆的排列。第一个~30个核苷酸代表26 S基因的3 '端。最后一个核苷酸属于5s编码区。显示了35s基因的阅读链;5s由底部链编码。突出显示了Pol III转录的终止信号。注意间隔长度不均一性。(PDF 74 KB)
12870_2012_1029_moesm4_esm.pdf.
附加文件4:5s rDNA基因区域的亚硫酸氢盐分析(中心部分)。描述:CyMATE程序输出非编码链的排序显示。填充符号-甲基化Cs;空的符号非甲基化的Cs。图下面的数字表示在对齐中的C留数。序列多态性是造成矩阵间差异的主要原因。(PDF 159 KB)
作者的原始提交的图像文件
权利和权限
开放获取本文在“生物资源”中央有限公司的许可下公布了这是一个开放式访问条款,分配根据创意公约归因许可证的条款(https://creativecommons.org/licenses/by/2.0.)提供任何介质中的不受限制使用,分发和再现,所以提供了正确的工作。
关于这篇文章
引用这篇文章
陈志强,陈志强,陈志强,等。植物中5个S rRNA基因的表达及其表观遗传修饰和调控元件差异。BMC植物BIOL.12,95(2012)。https://doi.org/10.1186/1471-2229-12-95
已收到:
接受:
发表:
关键词
- 5秒表达
- 艾蒿
- Asteraceae.
- C盒子
- DNA甲基化
- Pol III启动子分歧
- rDNA组织