抽象的
背景
myo-肌醇(Ins)在种子发育早期的代谢中起着重要的作用,它决定了一些种子贮藏成分的分布关系,如抗营养因子、蔗糖半乳糖(也称为寡糖)和植酸(PhA) (myo- 肌醇1,2,3,4,5,6-六升kis.磷酸盐)。前者是一组低聚糖,其在种子成熟时起着干燥起作用。它们不容易被单胃动物的动物消化,从而引起了血腥的性质。植酸高度负电,其螯合必需矿物的正离子并降低其生物利用度。它也是磷酸盐相关水污染的主要原因。我们的目标是调查竞争性转移作为普通基质对植物和蔗糖半乳糖苷的生物合成的影响。
结果
我们研究了Ins在种子发育过程中的初始代谢模式甘蓝型油菜并确定了种子发育的早期阶段以Ins快速部署到各种途径为标志,主要由极性(Ins磷酸盐)和非极性(磷脂)物种的相互转换。在种子发育早期阶段的时间过程实验中,我们发现Ins是胚乳和种皮的一个非常重要的组成部分,但在这两个组织中都没有发生植酸生物合成。在种子发育和成熟过程中,植酸积累似乎主要局限于胚内。在我们的方法中,基因myo肌醇甲基转移酶(IMT.),与MESEMBRYANTHEMUM CRYSTLINUM(冰厂),被转移到显著在种子特异性启动子,水平和phableolin的控制下。在种子发育过程中引入这种新的代谢步骤,促使Ins转化为相应的单甲醚,OnonInolol,并影响植物积累。我们能够生产纯合的转基因系,其平均植酸水平的19% - 35%。另外,棉花糖含量和相关糖的变化发生在增强的蔗糖水平。发芽率,活力和其他种子参数不受影响IMT.转基因过度表达。
结论
种子发育过程中宏的竞争甲基减少种子抗营养成分,并同时保持足够的磷矿储量提高其营养特点。这样的做法应该有可能提高油菜籽的市场价值有可能的,其他作物和。
背景
myo-肌醇是一系列衍生物生物合成的重要组成部分,从简单的肌醇磷酸盐到具有重要细胞功能的复杂膜相关产品。它可以异构化和(或)甲基化形成各种物种特异性的对映体和甲基醚。其中一些,包括Ins,已经被注意到主要在渗透胁迫的植物中积累,并被认为是渗透保护代谢物[1].
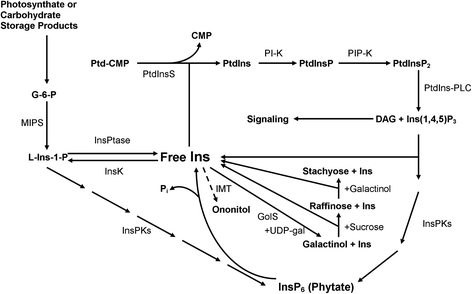
Ins也是许多抗营养成分如蔗糖半乳糖(如RFO)和肌醇多磷酸盐(如PhA)的生物合成的中心6).PhA的合成在种子发育过程中占主导地位,是种子磷的主要储存形式。在萌发时,Ins及其结合的磷酸盐都被水解释放。
PhA的抗营养特性在于其对正电荷物种如必需矿物质(如铁和锌)和蛋白质的强亲和力,显著降低它们对人类和动物的生物利用度。因此,油菜种子中存在的高水平PhA阻碍了纯粕的充分开发,低估了其作为全球主要作物的潜力。
相比之下,PHA已被作为具有抗肿瘤性质的有效抗氧化剂和某些类型癌症的风险降低的有效抗氧化剂[2].除了降低失控的细胞增殖,PHA是也被认为导致逆转为正常表型的恶性细胞的分化原因[3.].此外,PhA已被证明在许多细胞事件中发挥关键作用,如信号传导[4,细胞凋亡5,6],神经保护[7,以及作为酶辅助因子的功能[8].PHA的抗氧化性能也被证明抑制自由基形成和较低的脂质过氧化,使其成为非常有效的天然食品和饲料防腐剂[9].此外,最近已经显示了PHA,以保护显影种子免受氧化应激[10.].由于PhA的看似矛盾和独特的作用,并考虑到低含植酸的种子和(或)膳食的农艺价值,完全消除PhA并不是我们的预期目标。
植酸生物合成是一个独特的复杂过程,由一种初级底物Ins和许多从其他来源和途径注入的次级Ins聚磷酸盐底物组成[11.,12.].在主要途径中,新创Ins的合成涉及葡萄糖6-磷酸(G-6-P)氧化环化成Lmyo-肌醇-1-磷酸(L- ins -1-pmyo-inositol-1-phosphate合成酶(MIPS)。已经证明,通过玉米的诱变直接或间接地影响这种酶的产生[13.,14.]和大豆[15.或在水稻上采用基因工程方法[16.,17.],大豆[18.]和油菜[19.] PHA积聚可以减少20-94.5%,伴随无机磷酸盐(P我).在报道的各种转基因方法中,MIPS-RNAi [18.] 和MIPS-Cosup抑塑[19.]转基因在相应成熟种子中产生的PhA水平最低,分别为94.5和44%。然而,据报道,RNAi方法导致了种子发育受阻[18.].因此,鉴于INS是许多基本细胞成分的生物合成中的关键衬底的事实,我们决定评估其代谢转移的后果与完全消除MIPS并比较每种方法的效果。我们推断,虽然Ins的代谢转移可能不会干扰其生物合成,但它可能更好地限制其参与PhA的产生。
第一个MIPS产物L-Ins-1- p,由于双酶系统的活性,似乎与游离Ins处于准平衡状态-myo-肌醇-1-磷酸单磷酸酶将L-Ins-1-P转化为游离Insmyo肌醇-1-激酶再生它(方案1).取决于自由INS要求的刚性vs。L-INS-1-P在发育中的种子,每个基片的相对丰度通过在两个相对的反应的动力学的差异最终确定。我们假设无宏的是连续被排除在这种准平衡代谢分流通过甲基化,可能会推动自由宏的方向准平衡。这为以后限制值PhA生物合成两个基板(Ins与L-INS-1-P)的参与。为此,我们研究的过表达的编码基因IMT(EC 2.1.1.129)从效果M. Crystallinum.[20.[转基因的种子pHa积累显著在两种不同的种子特异性启动子,napin和phaseolin [21.].我们还研究了加强的背景下平移的效果IMT.在种子发育过程中基因产物的积累和PhA的减少。
虽然M. Crystallinum IMT.(Mcimt)已被用于研究转基因植物中甲基化甲基羟基醇的渗透性质[22.- - - - - -25.,目前的研究是种子特异性mcimt介导的代谢转移通过减少种子作物植酸生物合成的第一个例子体内Ins的甲基化。
结果
3.H -myo- 培养种子中的肌醇代谢显著
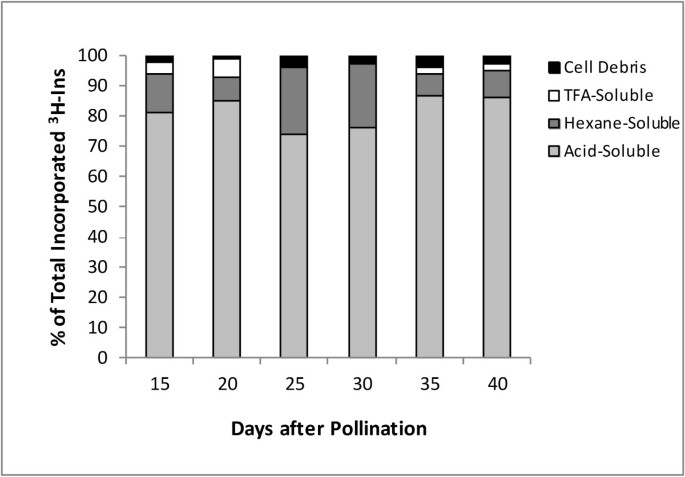
在活的有机体内贴标发展显著种子3.H -myo- 肌醇,以及随后的不同细胞组分的分馏(酸可溶,己烷溶于,三氟乙酸[TFA] - 溶解)和细胞碎片显示相对掺入3.H -myo- 在每个部分中的肌醇(图1).酸溶部分含有游离Ins、Ins单磷酸盐和Ins聚磷酸盐。正己烷可溶部分主要由含ins的磷脂组成。tfa可溶部分和细胞碎片主要包括紧密结合的膜组分,如糖基磷脂酰肌醇(GPI)蛋白锚26.].在15到20 DAP之间,大部分标签在含PhA的酸溶馏分中回收。20 DAP后,酸溶性的相对含量下降3.H -myo-肌醇标记的部分发生直到至少30 DAP。在相应的正己烷可溶馏分中,标签掺入的相对量同时增加。在30 DAP后,酸溶部分的相对掺入率再次增加,并保持高水平,直到至少40 DAP。
种子发育过程中植酸的积累甘蓝型油菜
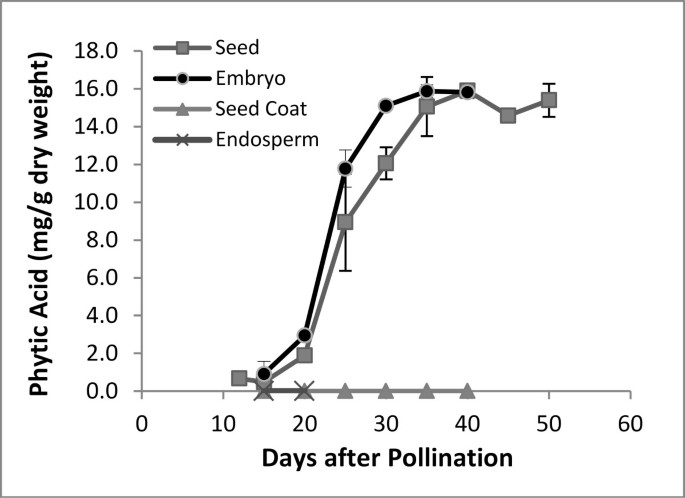
HPLC分析表明,PhA在种子发育的非常早期阶段(12 DAP)就开始积累。它的积累在20 DAP时更加明显,并继续递增,在35 DAP左右达到最大值(图)2).这个时间窗口(12-35 DAP),因此,在用于在油菜籽植酸还原分子策略域定向重要。尽管如此项显示为存在于胚乳和种皮在所有阶段检查的事实(图3.b),在任何组织中没有发现植物积累(图2).
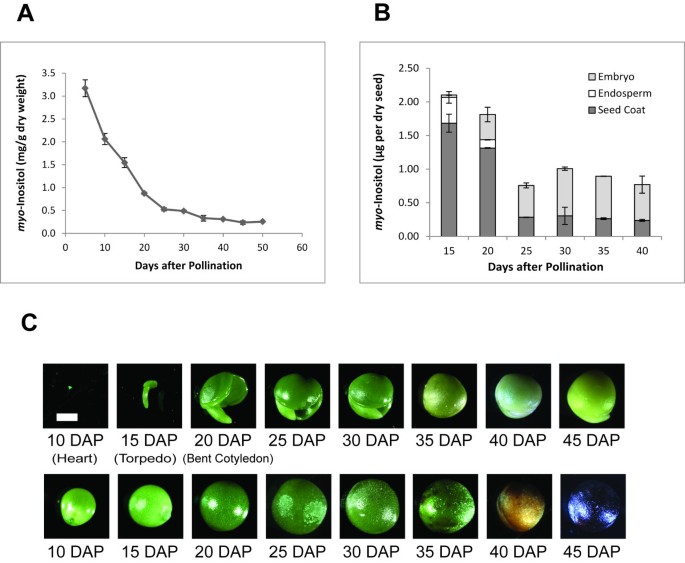
分析myo -在不同发育阶段的整个和解剖种子中的肌醇。(一个)下降水平myo -肌醇(Ins)期间显著种子发育以整粒种子的Ins含量表示。对授粉后5 ~ 50 d西星种子不同发育阶段的Ins进行了分析。每个数据点代表三次生物重复的平均值±SE(标准误差)。(B)myo-肌醇在种子发育过程中不同组织中的分布。测定了不同发育时期种皮、胚乳和胚中的Ins含量。这些数据代表了单个种子在种皮(深灰色柱)、胚乳(白色柱)和胚(浅灰色柱)中的分布量。每个数据点代表三次生物重复的平均值±SE(标准误差)。(C)在种子发育的各个阶段的相对于种子涂层(底行)的相对尺寸相对于种子涂层(底部行)。白条表示1毫米的长度。
的变化myo-肌醇水平
在种子发育的早期阶段,在INS水平稳步下降,从5 DAP高达25 DAP(图出现3.A).这些水平在30日行时继续下降,在45日行时达到最低点。5-20 DAP期间,Ins水平的急剧下降与PhA最初的逐渐积累相一致(图)2)以及非极性衍生物的水平的增加(图1在15 - 30 DAP)。在30 DAP时,随着PhA水平的升高,Ins水平又迅速下降(图)2),以牺牲非极性分量为代价(图1).
同时,随着胚胎在不同阶段继续膨胀(图)3.C),种皮和胚乳中的Ins水平从最高点开始下降,而胚组织中的Ins水平从15-20 DAP开始逐渐增加(图2)3.B).此时,PhA在胚胎中的生物合成速率开始增加(图2).在种子涂层或胚乳中没有观察到PHA合成。
生成转基因素显著带着myo- 氨基醇甲基转移酶基因
转基因系从构造PN产生IMT.(IMT在Napin启动子下)和PPHIMT.(IMT在phaploolin启动子下)。在转基因的萘普隆和Phableolin基团中,80%的线显示出降低的PHA水平。从每个启动子组中选择具有最高PHA还原的转基因系以进行后续实验。这些被纯合子自拍,并且在术语方面被证明是持续稳定的IMT.基因完整性和植酸还原。每组选取1个品系进行进一步研究,即N-11 (napin)和Ph1-18 (phaseolin)。品系Ph2-15和Ph3-19来源于另外两个转化事件,并以同样的方式进行选择。这些株系与Ph1-18株系的不同之处在于它们在翻译语境中发生了变化IMT.基因(表格1).在所有转基因品系的发芽率均为100%新鲜种子,没有不从种Westar控制不同。此外,经过几代人的IMT.转基因没有表现出种子产量的变化。
IMT.表达在转基因种子发育过程中逐步发生显著
在这两种转化株系(使用napin和phaseolin启动子)中,IMT的产生通过Western blot分析得到验证,这也表明在未转化的种子发育中没有任何原生的IMT等效物显著(图4A和4B)。虽然IMT.转录物开始在发展转基因种子的20 dap时出现,如phableolin线所例类的(图4a),蛋白质印迹分析显示相应的蛋白质在25 dap之后仅在可检测量中产生。两者的累积模式IMT.转录本及其相应蛋白在进行性增加到40 DAP方面具有相似性。同样,napin -IMT.在25 DAP的蛋白表达方式相似(图)4B)。
转基因种子产生酶活性IMT和D-ononitol
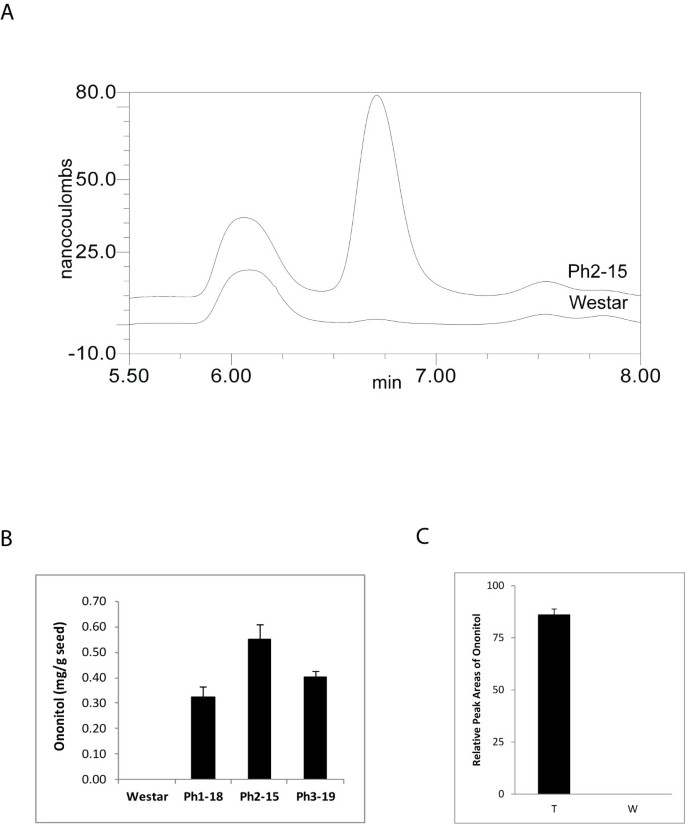
成熟转基因种子的HPLC分析显示了一种新的化合物的存在和积累,该化合物与真实的D-ononitol标准品共洗脱(图)5A和5B).从40-DAP转基因种子中提取的总可溶性蛋白能将Ins转化为D-ononitol,进一步证实了转基因株系中新引入的IMT活性在体外IMT酶活性测定(图5C)。野生型种子以及转基因叶片的类似萃取物未能产生该产品。此外,在转基因成熟种子样品(未示出)中的Ins峰之前立即洗脱的未识别的化合物,其在野生型样品中不存在。该化合物不与拼色醇的真实样品共振。
转基因植物种子中植酸含量降低,无机磷酸盐含量增加
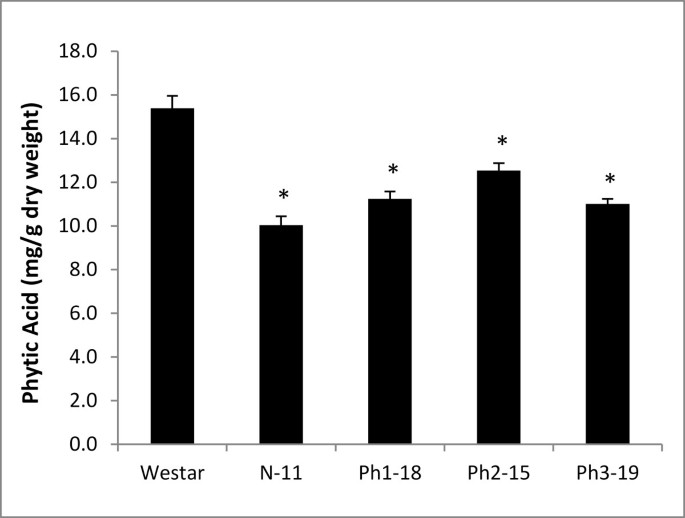
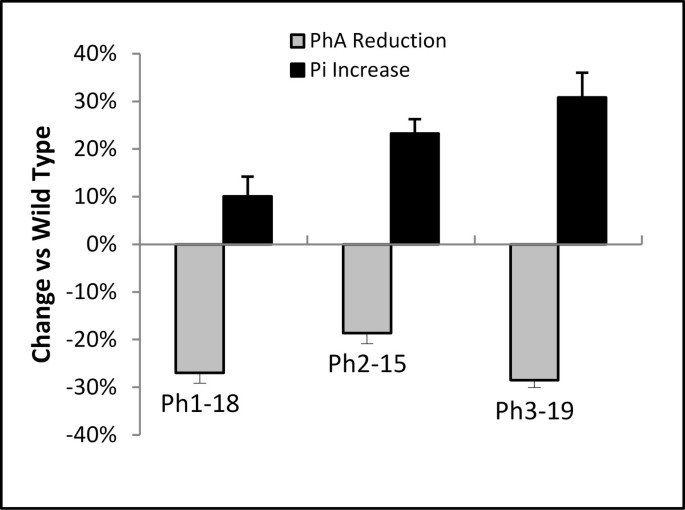
成熟萘普林含量的HPLC分析 -IMT.转基因种子显示PhA水平降低了35%。高效液相色谱分析也显示成熟的phaseolin-的PhA减少19-29%IMT.种子,尽管翻译上下文修改(图6).此外,P我水平从10%增加到31%,这与早期观察一致(图7).
碳水化合物分析
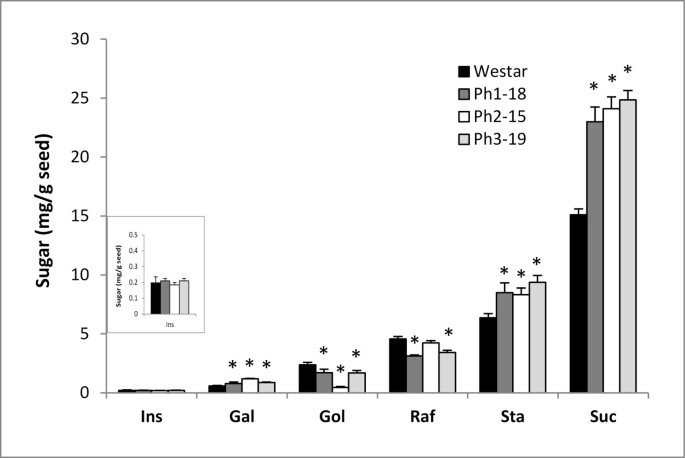
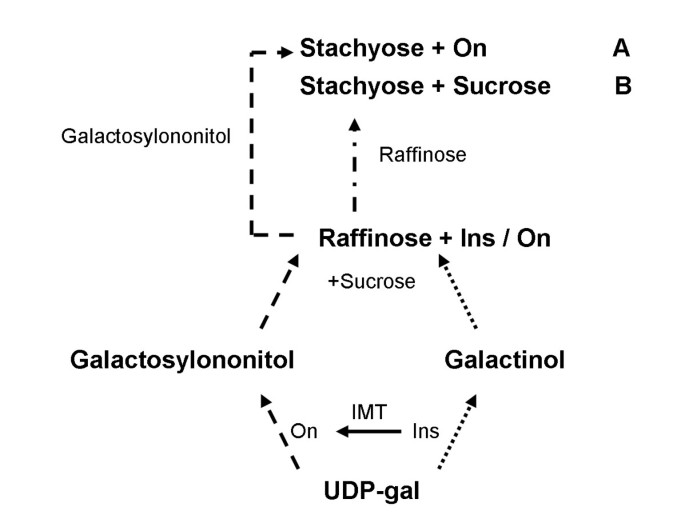
在成熟转基因种子中观察到与Ins代谢相关的碳水化合物种类(如半乳糖醇、RFO和蔗糖)的变化。在研究的三个品系中,这些变化与三个途径(PhA、半乳糖醇和ononitol生产,Scheme)对可用Ins的竞争一致1).这种竞争似乎导致吡啶醇生物合成的降低,其下游效应是通过半乳糖和蔗糖水平的增加反映,其中棉糖水平的伴随地减少。然而,棉子糖水平的降低似乎伴随着Stachyose的比例增加(图8).
讨论
相对融合3.在不同部分的发展中的H-Ins显著种子,呈现在图中1,描绘了在早期到发展阶段的中期,磷脂和PHA生物合成宏参与的动态图像。数据表明之间的水平相互转化的发生3.H-INS及其极性和非极性磷酸化变体。其上的证据是在20和30个Dap中看到,其中在己烷和酸可溶性级分中似乎发生了大量变化。
20-25个Dap中酸溶级分的相对含量的观察到的降低反映了利用myo非极性化合物(如磷脂)生物合成中的肌醇。观察到在同一时期,在正己烷可溶馏分中出现了相对标记掺入量的平行增加,这支持了这一观点。经过30 DAP后,酸溶性组分的相对掺入率再次增加,而非极性组分的掺入率下降,反映了在此期间PhA的快速积累(图)2).这可能是,已知含有含有含磷磷脂的水解导致种子中的植物积累增加显著[11.].
通常情况下,新形成的种皮是由细胞的四层起来,最外表皮和栅栏细胞层(其从胚珠的外珠被开发)和实质和内皮细胞层(其从内胚珠珠被导出)[27.].在5dap,种子内部大部分空间被分化的珠皮和少量胚乳填充。在15-20 DAP,大多数Ins位于被解剖种子的种皮(图3.b)并且其大量种子在5-15个dap中主要由该组织组成,可能被解释为籽种子涂层是INS生物合成的主要部位显著种子。支持这一过程的是丰富的蔗糖供应,在此早期,蔗糖通过韧皮部、质外体区和种皮运输[28.,29.]通过水解,通过水解作为G-6-P的来源,是INS的前体。
当胚胎在最初的球形、心形、鱼雷状和弯曲子叶阶段扩展时,胚乳按比例缩小(图)3.C), Ins主要定位于胚和种皮(图3.B)。种皮是Ins的组织最丰富的在种子发育的早期阶段是特别重要的,因为它的生物合成中起着重要作用的粘液,其他种皮多糖通过参与氧化和糖酸途径(30.].PhA的合成开始于非常早期的阶段(<10DAP),并在大约35 DAP时达到最高水平(图)2).子叶和胚轴之间的PHA积聚的分布分析显示,从20至75个DAP的80%以上的pHa累积在子叶中(80%在20-25个Dap,30 dap后增加90%)(数据未显示).在25-30 dap,作为芸苔胚胎扩大,所述非极性衍生物的积累更高(需要膜的生物合成)发生(图1).这一时期(25-30 DAP)似乎以Ins水平缓慢下降为标志,几乎达到一个平台(图)3.a),虽然并行,PHA水平继续以相对较慢的速度上升。在25次DAP之后,通过INS似乎在胚胎中达到了稳定的水平,并且在种皮层中,可以在25到30个DAP之间的明显下降延迟(图3.B)。在这个阶段,INS水平的下降伴随着PHA水平的伴随着增加(图2),以牺牲非极性分量为代价(图1),随着RFO生物合成(30-35DAP)的开始,种子接近干燥(未发表的结果)。
由于自由INS的初始磷酸化步骤以L-INS-1-P或通过其他位置磷酸酯的重构开始,因此我们的策略是探讨竞争性代谢分流在其磷酸化和随后的PHA和RFO积累中的竞争性代谢分流的影响在油菜籽中。为了实现这一目标,我们探讨了INONITOL的转换(1-D-4-O-甲基-myo-肌醇),通过在D-4位置的甲基化,通过IMT酶的作用。
观察到的PHA减少水平的变化不一定反映不同IMT.Western blot分析显示,所有选择的细胞株在取样时IMT蛋白的表达水平几乎一致(图)4A和4B).记录的PhA还原范围似乎与任一启动子相似(图6)提出了两种可能的情况之一:a)可能存在某一阈值,在该阈值下,Ins的供应和去除达到稳定平衡,PhA的减少水平限制在观测范围内;b)这些启动子下IMT活性的时间出现可能与Ins积累的最高点不同步,这可能是在小于10 DAP时达到的(图)3.A),导致PhA合成的早期开始。可能出现后一种情况,因为在Ph1-18和Ph2-15细胞系中,IMT蛋白直到25 DAP才被检测到(图2)4a)与PHA累积相反,在15-20个DAP中显示正在进行(图2).当AMIPS反义转录在谷蛋白驱动的转基因水稻中表达GluB-1推动者[17.].
基于其报告的转基因系统中的早期转录激活,例如烟草(15-16dap)[31.,32.].油菜籽蛋白启动子,其是天然的芸苔,目的是比较两个启动子的时间表达差异对PhA积累的影响。然而,由于IMT.转录从菜豆蛋白启动子没有早在转基因烟草的情况下开始,这是不可能的,以评估这种差异。菜豆蛋白启动子的复杂结构已被证明在转基因系统[该启动子的空间调节中发挥重要作用33.].此外,在同一启动子中发现了种子特异性转录调节区域,这些区域以一种时间依赖性的方式影响其激活[34.,35.].因此,当在不同的系统中表达时,pha样力启动子可能受到可能施加时间表达变化的元素的影响。这是一个事实,在我们手中,在我们手中的转录激活 -IMT.在稍后的时间点(20 dap,图)被触发4这表明该启动子可能受到发育调节程序的影响,以宿主特定的方式。
试图提高IMT.通过其平移上下文的修改翻译效率[36.,37.当在-3位核苷酸位于-3位和-2和-1的初始密码子的每个位置-2和-1处的DC核苷酸处(转基因系PH3-19,表1和图4一种)。同一线上随后阶段的翻译级别也似乎相对增强。然而,尽管在pH3-19中含有20个DAP的蛋白质水平富集,但这并未大大提高了整体PHA减少,确认需要更短时间和(或)空间上同步IMT.表达和INS生产,而不是早期增强IMT.翻译。然而,虽然种子涂层中的INS的明显舱室可以从胚胎中的IMT作用中屏蔽它,但已知种子特异性启动子在种子涂层内层中驱动基因表达,并且存在从种子涂层的INS的主动运输胚胎[38.].
在其他作物的突变系中(例如玉米[13.,39.]和黄豆[15.]),在值PhA的降低在成熟种子的磷通常伴随着一平行,尽管变量,P中增加我[15.].但是,在一些突变线中(例如玉米LPA2-1),p的崛起我可伴有其他Ins磷酸盐(Ins(1,2,4,5,6)P5;Ins (1, 4, 5, 6) P4;和Ins(1、2、6)P3.)[39.].这使得PhA的减少在这些突变体中无效,因为这些高度磷酸化的Ins物种保留了许多不利的PhA特性。在本研究中,尽管我们观察到PhA和P之间存在类似的逆关系我,任何部分磷酸化的INS中间体都没有可检测到的积累,例如isp3.,4或5.此外,过度表达IMT.没有影响种子活力或转基因油菜籽种子的萌发效率。此外,没有可测量的产量惩罚(表2).
野生型HPLC图谱中缺失ononitol,野生型蛋白提取物无法产生ononitol,结合西方分析结果,提示ononitol可能缺乏天然imt样活性显著.
在成熟的转基因种子,宏的水平没有变化显著(图8),但推测在成熟过程中,PhA、半乳糖醇和壬糖醇的生物合成被分割(图5B).因此,PhA的形成随着ononitol的积累而减少。这一路径扰动(图式1)也会降低半乳糖醇的产量,从而导致RFO积累[40]蔗糖水平显着增加(图8).奇怪的是,棉子糖含量下降的同时水苏糖含量却几乎成比例地上升。由于转基因种子中的蔗糖水平仍然很高,棉子糖和水苏糖水平的反向调制表明棉子糖可能是半乳糖供体,为随后的棉子糖链伸长:棉子糖半乳糖转移方式,在每个半乳糖残基转移到另一个棉子糖分子后,棉子糖分子将释放其蔗糖部分(图)9b)[41.,42.].鉴于半乳糖醇的有限可用性,这是可以想象的(图)8).或者,由于已知半乳糖醇的甲基化衍生物参与一些植物中的RFO合成[43.],虽然不迄今为止证明在显著我们提出了Ononitol,IMT的甲基化产物可用于形成相应的半乳糖酰基(甲基化半乳糖醇),其仍然可以部分地参与RFO-链伸长率至高级低聚物,STOOlyose(图9由于这并不能解释观察到的蔗糖水平的增加,我们假设这两种途径可能是协同工作的。水苏糖和蔗糖积累的不同程度(图8)可以指示两条路线的不同动力学(图9A和9B)。
结论
的早期阶段芸苔种子发展似乎是由极性INS磷酸盐和非极性物种的互核互联的主导。尽管在早期阶段期间,INS在胚乳中的显着大量产生,但在这些组织中没有发生PHA积累。相反,PHA积累似乎主要限于胚胎整个种子发育和成熟。
除了降低显影种子中的PHA水平外,INS的竞争性甲基化导致种子碳水化合物的分布和累积模式的变化,从而提高了膳食的消化和代谢能量曲线,如较高含量所示营养有用的糖,蔗糖。虽然奖酶糖糖与STOOSHYOSE的比例改变,但RFO的总体平衡似乎不受影响。由于在发展中甲基化而没有遇到有害影响芸苔种子。
从本研究中明显看出,以前的一种答案将作物种子中的植物中的骨质减少到一种水平的水平,这可以在结合的模型中找到没有不利影响产量和表型的显着有益的生物利用度的水平多种机制的添加剂效应齐先作用,单独的独立贡献。这种方法可以在不同步骤中选择性抑制Ins磷酸化以最佳的植物还原。尽管如此,如果通过,目前的策略可能会提高油菜市场价值以及其他作物。
方法
植物材料及化学品
冰工厂(MESEMBRYANTHEMUM CRYSTLINUM)如前所述,种子萌发,生长,盐处理和取样[20.,44.].的种子显著(西星)植物,生长在生长室条件下(16小时的白天在20°C/8小时的夜间在15°C的光周期)在成熟时收获。采集不同发育阶段的种子。在双目解剖显微镜下,将发育中的种子在冰上分离成种皮和胚。新鲜的种子被手术刀切开一半。用移液管采集15和20个DAP的胚乳。用超纯水冲洗种皮和胚3次。多余的水用滤纸吸收了。将发育中的种子和解剖组织立即用液体氮冷冻2.这些被冷冻干燥24小时,然后提取用于PhA和Ins分析。
Ononitol标准购自Glycosyn Technologies,下赫特,新西兰。
在活的有机体内培养种子的标记3.H-Myo-肌醇
从植株上切取不同发育阶段(15-40 DAP)的角果,立即将切出的角果端置于10 ml无菌培养基中,50 ml试管中添加5μCi3.H -myo- 肌醇并在生长室中孵育两天。收获种子并在液氮中粉碎,然后用己烷(脂质级分),0.5N HCl(含植酸酸溶解级分)和三氟乙酸(TFA可溶性细胞碎片馏分)连续萃取。在闪烁计数器中评估每个级分中的放射性。
植酸提取
成熟油菜籽(350毫克)在甲醇4毫升氨(10%重量/重量)[匀浆45.),然后漩涡。孵育10分钟后,加入3 ml己烷,样品旋转离心(RCF 2500)。弃去液相,用3ml己烷重新提取种子球,离心,弃去上清液。用5ml无水甲醇洗涤3次,用6ml 0.5 N HCl重悬,室温保存15分钟。将浆液离心,上清液通过0.45 μm GHP Acrodisk过滤器(Gelman Science)过滤,然后进行高效液相色谱分析。在这一阶段,样品保存在-20°C。PhA从50 ~ 100 mg不同发育阶段的种子中提取。解剖材料采用种皮(20 mg)、胚乳(20 mg)、胚:15 DAP (10 mg)、20 DAP (50 mg)和老胚(100 mg)。按比例调节盐酸的萃取量。
HPLC植酸分析条件
植酸analysis was performed on a Waters 660E multi-solvent delivery system equipped with in-line degasser AF, 717plus Autosampler and a Sedex 55 (S.E.D.E.R.E.) evaporative light scattering detector at 50°C, 2 bar, gain 7. The HPLC system was controlled and data processed by the Waters Millennium™ 2010 Chromatography Manager, version 2.15.01. Samples were chromatographed on an IC-Pak Anion HC, 150 mm × 4.6 mm column (WAT026770, Waters), at 22°C, with 100 mM nitric acid at a flow rate of 1.0 ml/min. A Waters IC-Pak Anion Guard-Pak (WAT010551) was used as the pre-column. A fritted filter guard (A-103X Rep Frit (BLK) 0.94 × 0.25 from Upchurch Scientific) was placed in front of the pre-column. Injections, typically 75 μl of undiluted sample, were in duplicate with a separate result generated for each injection. A calibration curve was prepared for each run with the levels of standards at 25, 50, 75 and 100 μg. Standards were prepared with phytic acid dodecasodium salt C6H6O24.P6Na12.·9h.2o(sigma),其溶解在相同的浓度HCl中,其用于将样品(0.5n)萃取至10μg/μl的浓度。将浓缩的溶液在0.5N HCl中稀释至1.0μg/μl。将25,50,75和100μL稀释标准物重复注入25,50,75和100μL稀释的标准,并且在平均保留时间为3.9分钟检测植酸。
HPLC条件碳水化合物分析
糖从种子中提取,并通过HPLC分析,如所述[40].简单地说,除另有说明外,将10个种子的脱脂组织复制,用80:20 v/v乙醇-水在70°C下提取30分钟,然后离心并蒸发上清至干燥。样品在18-MΩwater中重建,通过0.45 μm尼龙过滤器过滤后进行高效液相色谱分析。为了适应种子早期的分析,萃取和重组体积与样品重量成正比。
半乳糖苷,myo-肌醇和D-ononitol在CarboPac™MA1色谱柱(4 mm × 250 mm)上分离,然后在CarboPac™MA1保护柱(4 mm × 50 mm)上用500 mmol L分离-1等温NaOH在0.40 mL min-1作为洗脱液,使用Dionex ICS-3000系统(Dionex Corp., Sunnyvale, california)通过高性能阴离子交换脉冲安培检测(HPAE-PAD)进行检测。标准galactinol,myo- 肌醇(Sigma-Aldrich,St.Louis,Mo)和D- ononitol(Glycosyn Technologies,Dower Hutt,新西兰)。
葡萄糖、半乳糖、果糖、蔗糖、水果糖和棉糖在CarboPac™PA1色谱柱(2 mm × 250 mm)上分离,然后在CarboPac™PA1防护柱(2 mm × 50 mm)和氨基陷阱防护柱(2 mm × 50 mm)上用25 mmol L分离-1等人类NaOH在0.25毫升分钟-1为洗脱剂,用HPAE-PAD检测。标准是半乳糖、果糖、蔗糖、棉子糖、水苏糖(Sigma-Aldrich, St. Louis, MO)和葡萄糖(Fisher Scientific, Hampton, NH)。
无机磷酸盐分析
无机磷酸盐(p我)在成熟的转基因种子中进行了测定[46.].
克隆IMT.和植物转型
将盐胁迫下的新鲜冰植物叶片组织在液氮中冷冻并粉碎成细粉。用TRIzol®Reagent (Invitrogen)提取总RNA。保利(A)+采用已发表的方法分离RNA [47.].利用Roche反转录试剂盒生成第一条cDNA链,并根据已发表的序列(Accession No. No.),利用序列特异性引物(正向5 ' -TTTTTGGATCCAAGAGAA aaaaaaatgactactacac -3')和反向5 ' -TTTTTGCGGCCGCATAAAGGCAAATCATACACTG-3 ')进行PCR扩增。M87340)。反应开始于94°C加热2 min,接着是94°C加热1 min, 52°C退火1 min, 72°C延伸3 min的35个循环。PCR产物(1418bp)用PCR纯化试剂盒(Promega)纯化后,用酶切酶切BAM你好,不是我,他的网站分别纳入正向和反向引。将消化的DNA片段亚克隆到PSPORT1(Invitrogen)中并测序。这IMT.基因亚克隆到pRD400 [48.],其含有纳帕尼促进剂,用于产生质粒pnimt。制作了具有修改的翻译背景的IMT基因的其他版本[36.,37.] (桌子1).这些以及母体转基因在pha样力促进剂下克隆到PRD 400中以产生pPhimt1-3。所有构建体都转移到农杆菌肿瘤术菌株GV3101含有短路配合的辅助质粒PMP90,其次是农杆菌属介断的转换甘蓝型油菜(栽培种Westar)49.].
过度表达IMT.在e Coli.以及抗体的产生
将IMT cDNA片段克隆到细菌表达质粒,PPROEXHTB(Invitrogen)中。通过将IPTG添加到培养基至终浓度为1mm的终浓度来诱导蛋白质表达。这大肠杆菌培养物在37℃培养3小时后收获。用Ni-NTA琼脂糖(Qiagen)在变性条件下纯化his标记蛋白。纯化的蛋白(43 Kda)用于培养抗IMT酶的多克隆抗体[50.]随后用于西方分析转基因素。
南方和北方印迹分析
使用Wizard®基因组DNA纯化试剂盒(Promega)从叶组织中提取基因组DNA。通过使用RNEasy植物总RNA试剂盒(QIAGEN)对从转基因和野生型植物的种子产生的RNA提取。南部和北部分析使用搭扣-N+膜(Amersham)的基本操作如下所述[51.].
转基因植物IMT酶学分析及Western分析
从正在发育的种子(大约40 DAP)以及转基因株系和野生型植物的叶片中提取的总蛋白被用于imt酶活性的测定,正如前面所述[20.].
对于西方分析,如上所述从显影种子中提取总可溶性蛋白质[44.].TND缓冲液,90mM Tris-HCl(4℃下pH 8.3),加入9mm DTT和2mM Leupeptin(100μl)至50mg在液氮中粉碎的冷冻种子。通过收集上清液制备可溶性蛋白质样品。使用BSA作为标准,使用Bradford测定法测定每个样品中的蛋白质浓度。蛋白质样品(每次15μg)用于蛋白质印迹分析。通过页面分离样品并在硝酸纤维素膜(Bio-rad)上呈印迹[51.].使用Bio-rad Immun-Blot®Assay试剂盒进行免疫反应。
缩写
- DAP:
-
天授粉后
- Ptd-CMP:
-
磷脂基胞嘧啶单磷酸盐
- 磷脂酰肌醇:
-
磷脂酰肌醇
- π:
-
磷脂酰肌醇激酶
- ptdinsp:
-
磷脂酰肌醇一磷酸
- 高尔:
-
半乳糖醇合成酶
- RFO:
-
棉糖寡糖。
参考
- 1。
Luley-Goedl C,Nidetzky B:糖苷作为兼容溶质:生物合成和应用。NAT PROD REP。2011,28:875-896。10.1039 / C0NP00067A。
- 2。
膳食IP6和肌醇对癌症的保护。农业科学与技术。2006,55:109-125。10.1207 / s15327914nc5502_1。
- 3.
IP6:一种新型的抗癌药物。中国科学:地球科学。10.1016 / s0024 - 3205(97) 00092 - 1。
- 4.
摘要:肌醇六磷酸在维持植物对病原菌的基本抗性中的作用。植物学报,2008,56:638-652。10.1111 / j.1365 - 313 x.2008.03629.x。
- 5。
Schröterová L, Hasková P, Rudolf E, Cervinka M:植酸和肌醇对大肠癌细胞增殖和凋亡的影响。中国人民大学学报(自然科学版),2010,23:787-793。
- 6。
Verghese M,Rao Dr,Chawan CB,Walker Lt,Shackelford L:植酸酸的抗毒性效果(IP6):凋亡作为可能的作用机制。lwt。2006,39:1093-1098。10.1016 / J.LWT.2005.07.012。
- 7。
徐Q,Kanthasamy Ag,Reddy MB:天然铁螯合剂的神经保护作用,植物培养型帕金森病的细胞培养模型。毒理学。2008,245:101-108。10.1016 / J.Tox2007.12.017。
- 8。
Macbeth Mr,Schubert HL,Vandemark AP,Lingam At,Hill Cp,Bass BL:肌醇六磷酸磷酸在ADAR2核心中并对RNA编辑所需的结合。科学。2005,309:1534-1539。10.1126 / Science.1113150。
- 9。
GRAF E,伊顿JW:植酸抗氧化功能。自由Radic Biol Med。1990,8:61-69。10.1016 / 0891-5849(90)90146-a。
- 10.
Doria E, Galleschi L, Galucci L, Pinzino C, Pilu R, Cassani E, Nielsen E:植酸预防种子氧化应激:来自玉米(玉米L.)低植酸突变体。J Exp Bot。2009,60:967-978。10.1093 / JXB / ERN345。
- 11.
乔治F, Das,射线H, C烈性黑啤酒,Nokhrina K, Kolla VA,凯勒凯西:芸苔属植物的表达显著Phosphatidylinositol-Phospholipase C2 (BnPtdIns-PLC2)油菜诱导基因表达的显著变化和植物激素分布模式,提高抗旱能力和促进早期开花和成熟。acta botanica sinica(云南植物学报),2009,32(6):693 - 698。10.1111 / j.1365-3040.2009.02027.x。
- 12.
水稻中肌醇磷酸酯相关酶的表达模式及其与植酸生物合成途径的关系。基因。2007,405:55-64。10.1016 / j.gene.2007.09.006。
- 13。
玉米低植酸突变体(lpa241)的表型、遗传和分子特性研究。应用计算机学报,2003,21(4):591 - 598。10.1007 / s00122 - 003 - 1316 - y。
- 14。
Panzeri D, Cassani E, Doria E, Tagliabue G, Forti L, Campion B, Bollini R, Brearley CA, Pilu R, Nielsen E, Sparvoli F: MRP家族中有缺陷的ABC转运体,负责大豆lpa1突变,影响调节植酸途径,减少种子myo- 肌醇和改变ABA敏感性。新植物。2011,191:70-83。10.1111 / J.1469-8137.2011.03666.x。
- 15.
Wilcox J,Premachandra G,Yound K,Raboy V:高种子无机P,低植物大豆突变体的分离。农作物科学。2000,40:1601-1605。10.2135 / cropsci2000.4061601x。
- 16。
Kuwano M, Ohyama A, Tanaka Y, Mimura T, Takaiwa F, Yoshida KT:转基因低植酸表型水稻的分子育种myo-肌醇3-磷酸合酶基因。中国生物医学工程学报。2006,18:263-272。10.1007 / s11032 - 006 - 9038 - x。
- 17。
水稻穗部不同部位颖果植酸基因的差异效应。植物营养与肥料学报。2009,30(4):457 - 461。10.1093 /卡式肺囊虫肺炎/ pcp071。
- 18。
金枪鱼ACS,Vianna Gr,Cuneo F,Guy de Capdeville Ja-F,Reh El,AragãoFJL:RNai介导的L-肌醇 - 1-磷酸盐合成酶基因(GMMIPS1)在转基因大豆中抑制种子发育并减少植酸含量。Planta。2006,224:125-132。10.1007 / S00425-005-0201-0。
- 19。
Georges F, Hussain AAK, Keller WA:使用包括肌醇1-磷酸合成酶基因的基因操作降低菜籽粕中植酸的方法。专利。2006,WO 00/73473 A1
- 20.
vernon dm,Bohnert Hj:兼骨髓菌株在致命烟道骨髓结晶中渗透胁迫诱导的新型甲基转移酶。Embo J. 1992,11:2077-2085。
- 21.
Keller WA,Datla R,Dong J-Z,Georges F,Hussain Aak,Selvaraj G:用于改变植物中次级代谢化合物水平的方法和组合物。专利。2007年,US7279619.
- 22.
关键词:烟草;环醇;转基因;植物学报1993,4:199-205。10.1046 / j.1365 - 313 x.1993.04010199.x。
- 23.
Sheveleva E,Chmara W,Bohnert HJ,Jensen RC:通过转基因的D-Ononitol生产的Lncreased Salt和Drougrouss烟草L.植物理性。1997,115:1211-1219。
- 24。
基于肌醇甲基转移酶基因的大豆中Ononitol和pinitol的生产中国科学:地球科学,2011,36(6):741 - 744。10.1016 / j.plantsci.2006.06.006。
- 25。
Patra B,Ray S,Richter A,Majumder Al:通过PCINO1和MCIMT1的共表达通过Co表达增强转基因烟草植物的耐受性伴随着肌醇肌醇和甲基化肌醇的增加。原生质。2010,245:143-152。10.1007 / s00709-010-0163-3。
- 26。
Paulick MG, Bertozzi CR:糖基磷脂酰肌醇锚:蛋白质的复杂膜锚定结构。生物化学学报。2008,32(6):691 - 697。10.1021 / bi8006324。
- 27。
莫伊兹·JA,韩S,Gudynait-Savitch L,约翰逊DA,三木BLA:种皮:结构,发展,成分和生物技术。体外细胞发育生物学植物。2005年,41:620-644。10.1079 / IVP2005686。
- 28。
豇豆种子发育与储量复合积累(菜豆L.)。种子sci biotechnol。2008,2:42-52。
- 29。
Morley-Smith Er,Pike Mj,Findlay K,KöckenbergerW,Hill Lm,Smith Am,Rawsthorne S:糖的运输到开发胚胎不是通过油菜籽种子的散装胚乳。植物理性。2008,147:2121-2130。10.1104 / pp.108.124644。
- 30.
Loewus Fa,Kelly S,Neufeld EF:新陈代谢myo植物中的-肌醇:转化成果胶、半纤维素、d -木糖和糖酸。生物化学。1962,48:421-425。
- 31.
Altenbach SB, Pearson KW, Meeker G, Staraci LC, Sun SM:在转基因植物中通过表达富含蛋氨酸蛋白的嵌合基因提高种子蛋白的蛋氨酸含量。植物生态学报,1998,13(4):513-522。10.1007 / BF00027311。
- 32.
大豆β-phaseolin基因在烟草种子中的发育调控表达美国国家科学院学报。1985年,82:3320 - 3324。10.1073 / pnas.82.10.3320。
- 33.
ChandraseKharan MB,Bishop KJ,Hall Tc:胚胎发生过程中B-phoneolin启动子的模块特异性调节。工厂J. 2003,33:853-866。10.1046 / J.1365-313x.2003.01678.x。
- 34.
β-phaseolin基因的发育控制需要阳性、阴性和临时种子特异性的转录调控元件,茎和根的表达需要一个阴性元件。植物学报,1992,2:537-548。10.1111 / j.1365 - 313 x.1992.00537.x。
- 35.
Kawagoe Y,Murai N:四个不同的核蛋白质认识到体外大豆种子贮藏蛋白的近端启动子β-菜豆基因赋能的时空控制。植物学报1992,2:927-936。
- 36。
在哺乳动物细胞中,AUG启动子密码子之前至少有6个核苷酸可以增强翻译。中国生物科学(英文版)。10.1016 / 0022 - 2836(87) 90418 - 9。
- 37。
李志刚,李志刚,李志刚:模式植物全基因组翻译起始位点的上下文序列分析。生物工程学报。2008,39(4):497 - 503。10.1007 / s12033 - 008 - 9036 - 9。
- 38。
Stalberg K,Ellerstrom M,Josefsson LG,Rask L:在转基因烟草中甘蓝型油菜2S种子储存蛋白启动子的缺失分析。植物mol biol。1993年,23:671-683。10.1007 / BF00021523。
- 39。
Raboy V, Gerbasi PF, Young KA, Stoneberg SD, Pickett SG, Bauman AT, Murthy PP, Sheridan WF, Ertl DS:玉米的起源和种子表型低植酸1-1和低植酸2-1.植物营养与肥料学报。2000,19(4):457 - 461。10.1104 / pp.124.1.355。
- 40.
黄志强,王志强,王志强:油籽半乳糖醇合成的下调甘蓝型油菜导致抗营养低聚糖的显著减少。植物学杂志,2009,27(4):597-603。10.1139 / b09 - 037。
- 41.
Hopf H,Gruber G,Zinn A,Kandler O:在蠕动中的Lychnose的生理学和生物合成。Planta。1984,162:283-288。10.1007 / BF00397451。
- 42.
陈海克,陈志强,陈志强:半乳糖基转移酶的研究进展。植物营养与肥料学报。2010,31(4):491 - 498。10.1016 / j.phytochem.2010.04.012。
- 43.
黄小豆种子中半乳糖醇和水苏糖的合成。植物生理学报。1998,19(4):457 - 461。10.1104 / pp.117.1.165。
- 44.
Ostrem JA,Olsen SW,Scmitt JM,Bohnert HJ:盐胁迫增加了磷酸丙酮酸羧化酶的可翻译mRNA水平MESEMBRYANTHEMUM CRYSTLINUM.植物营养与肥料学报。10.1104 / pp.84.4.1270。
- 45.
正己烷萃取和甲醇氨-水处理芥菜菜籽粕中芥菜酸的简易分光光度法测定。中国农业科学,1998,20(4):441 -448。10.1021 / jf00015a016。
- 46.
史军,王华,吴勇,王海涛,王海涛。玉米低植酸突变体lpa2与肌醇磷酸激酶基因突变有关。植物营养与肥料学报。2003,27(2):429 - 434。10.1104 / pp.014258。2月
- 47.
Aviv H,LEDER P:通过寡核苷酸 - 纤维素色谱法纯化生物活性珠素信使RNA。美国国家科学院学报。1972,69:1408-1412。10.1073 / pnas.69.6.1408。
- 48。
Datla RSS,Hammerlindl JK,Panchuk B,Pelcher Le,Keller W:用野生型基因编码NPTII基因的改进二元植物转化载体。基因。1992,211:383-384。
- 49。
莫洛尼MM,沃克JM,沙尔马KK:使用农杆菌载体甘蓝型油菜的高效转化。植物细胞报道1989年,8:238-242。10.1007 / BF00778542。
- 50.
Nelson De,Rammesmayer G,Bohnert HJ:调节细胞特异性肌醇代谢和植物盐度耐受性的运输。植物细胞。1998年,10:753-764。
- 51.
Sambrook J,Fritcech EF,Maniatis T:分子克隆,实验室手册,3埃德。冷泉港实验室新闻。1989,1:6.39-7.50。
致谢
本研究得到了NRCC-DASCI战略联盟协议支持。冰植物种子是Hans Bohnert教授的礼物。phap phableOlin启动子由Dow Agrociences作为PAGM219质粒提供。特此承认,由加拿大加拿大和陶思科委员会的补助金提供的ATTA HUSSAIN的贡献。我们还感谢Sandra Polvi进行技术支持。这是NRCC出版号码54672。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
提交人声明他们没有竞争利益。
作者的贡献
FG,Project PI,设计了概念,监督所有实验,贡献并编辑了稿件。JD,WY,CB,KN执行了实验并参与了结果的解释。WK监督芸苔属转型实验。所有作者阅读并认可的终稿。
京嘴洞,魏燕同样为这项工作贡献。
作者的原始提交的图像文件
下面是作者提交的原始图片文件的链接。
权利和权限
开放访问本文在“生物资源”中央有限公司的许可下公布了这是一个开放式访问条款,分配根据创意公约归因许可证的条款(https://creativecommons.org/licenses/by/2.0.),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
董,J。,燕,W.,Bock,C。et al。扰乱代谢动力学的myo- 发展中的肌醇甘蓝型油菜通过种子体内甲基化影响其作为植酸前体的利用,并影响其下游的代谢途径。BMC植物BIOL.13,84(2013)。https://doi.org/10.1186/1471-2229-13-84
收到了:
接受:
发表:
关键字
- 甘蓝型油菜
- 种皮
- 蛋白翻译
- Ononitol
- 种子发展
- myo -肌醇甲基转移酶
- 植酸
- 蔗糖
- 棉糖寡糖
- 半乳糖醇