- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发布:gydF4y2Ba
拟南芥反式沉默基因座的表观遗传历史及反式沉默活性接力的检测gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba2gydF4y2Ba文章编号:gydF4y2Ba11gydF4y2Ba(gydF4y2Ba2002gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
减数遗传表突变影响转基因表达不是很清楚,甚至在工厂模式物种,特别是拟南芥。拟南芥反式沉默基因座C73编码光形态发生抑制因子COP1和绿色荧光蛋白(gydF4y2BaGFP-COP1gydF4y2Ba),遗传地修饰的表达模式和gydF4y2Bacop1gydF4y2Ba- 麦克酸浓度的浓缩表型gydF4y2BaGFP-COP1gydF4y2Ba通过转录基因沉默靶向位点。gydF4y2Ba
结果gydF4y2Ba
在这里,我们通过C73轨迹描述跨沉默的另外三个特性。首先,C73和类似复杂基因座的沉默表型通过一个阶段类似的转录后沉默表观遗传学上获取过不超过两个的植物世代的过程。其次,由C73轨迹强加痕迹被遗传地保持在无消声器的使用只有零星的自发逆转至少五代。三,其他两个配对gydF4y2BaGFP-COP1gydF4y2Ba当L91携带C73的表观遗传印记时,基因座L91和E82的表观遗传修饰倾向增加,而当E82携带C73的表观遗传印记时,则没有变化。gydF4y2Ba
结论gydF4y2Ba
后者的数据表明,转基因沉默活性从一个转基因位点C73转移到另一个位点L91。这些结果扩展了我们对拟南芥中转基因相互作用的操作理解。gydF4y2Ba
背景gydF4y2Ba
已知某些基因位点以减数分裂遗传的方式修饰其他等位或非等位伴侣位点的表达。如果是等位基因,这样的非孟德尔相互作用称为突变。在非等位基因的情况下,可以使用“可遗传的转化沉默”一词。对四个编码色素生物合成转录调节因子的玉米基因座的Paramutation进行了广泛的研究[gydF4y2Ba1gydF4y2Ba].在拟南芥中也进行了Paramutation的研究gydF4y2Ba拜gydF4y2Ba吉恩家族,在gydF4y2BaA1gydF4y2Ba和矮牵牛的Chalcone合成酶(CHS)转基因座,在许多其他情况下[gydF4y2Ba2gydF4y2Ba- - - - - -gydF4y2Ba4gydF4y2Ba].拟南芥抵抗基因gydF4y2Ba拜尔港/ CPR1gydF4y2Ba表现出一种相关形式的表观遗传不稳定性[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba].与DNA序列同源性的非等位基因转基因位点也发生类似载气相同的相互作用。在这些情况下,一个主基因座倾向于抑制其目标基因座的表达('Trans-Suncing')[gydF4y2Ba7gydF4y2Ba- - - - - -gydF4y2Ba11gydF4y2Ba].变异和转化沉默是相关的过程。例如,色氨酸生物合成基因的反向重复等位基因gydF4y2Ba拜gydF4y2BaWS生态型的拟南芥沉默同源gydF4y2Ba拜gydF4y2Ba等位基因,以及不相连的gydF4y2Ba拜gydF4y2Ba基因,来自哥伦比亚生态型[gydF4y2Ba2gydF4y2Ba].同样,复杂的合成转基因由gydF4y2Ba拜gydF4y2Ba倒置重复能够反式甲基化同源,但非等位基因的目标基因液[gydF4y2Ba12gydF4y2Ba].在其他物种中也观察到了类似的事件。[gydF4y2Ba13gydF4y2Ba]]。gydF4y2Ba
在这里定义的表观遗传活动作为遗传杂散或伸缩性的伙伴关系,单独从DNA序列预测,其分子基于不完全理解。可以说是最广泛涉及的因素是存在复杂的DNA序列重复。这些重复通常是Trans-Silencer Locus或Paramutagenic Locus或其目标的一部分[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba14gydF4y2Ba- - - - - -gydF4y2Ba17gydF4y2Ba].然而,正如最近在单拷贝玉米上所显示的那样,重复有时可以定位在与受影响的位点本身相当远的地方gydF4y2Bab1gydF4y2Ba基因(gydF4y2Ba18gydF4y2Ba].除转录基因沉默外,突变与DNA甲基化只有微弱的相关性。玉米的甲基化状态gydF4y2Bar1gydF4y2Ba基因与拟南芥gydF4y2Ba拜gydF4y2Ba基因在突变过程中发生改变[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba19gydF4y2Ba],而玉米的gydF4y2Bab1gydF4y2Ba不是(gydF4y2Ba1gydF4y2Ba],但以非传统的方式,在远端副变控制区域gydF4y2Bab1gydF4y2Ba[gydF4y2Ba18gydF4y2Ba].相反,野生型拟南芥的广泛暴露gydF4y2Ba超人gydF4y2Ba一个高度甲基化和转录沉默的外等位基因的等位基因没有显示任何反式沉默[gydF4y2Ba20.gydF4y2Ba].gydF4y2Ba
基因沉默的随机性已经在许多场合被证明,例如[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba21gydF4y2Ba],包括在共抑制的初始描述[之一gydF4y2Ba22gydF4y2Ba].然而,就表观遗传活性的转基因位点而言,它们的沉默行为在连续几代中是否稳定,以及个体位点何时以及如何获得其表观遗传活性,通常都不透明。已知某些位点会自发地获得表观遗传活动[gydF4y2Ba4gydF4y2Ba],暗示表观遗传控制机制。例如,在gydF4y2Bab1gydF4y2Ba轨迹,一个特定等位基因可以从非paramutagenic,转录活性,状态自发地切换到paramutagenic,转录沉默,状态〔gydF4y2Ba23gydF4y2Ba].是否同样适用于跨沉默是没有很好地建立。gydF4y2Ba
副突变位点施加的印记是否能有效地从第一个靶位点传递到第二个靶位点是副突变系统的一个可变特征,这与异交群体中表皮等位基因转换的速度有关。参数玉米等位基因gydF4y2Bab1gydF4y2Ba和gydF4y2BaPL1gydF4y2Ba是非常有效地传递这种印记的[gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba)(又见[gydF4y2Ba3.gydF4y2Ba]),而其它基因座,虽然压印敏感,是不太有效的[gydF4y2Ba26gydF4y2Ba]或明显无效的[gydF4y2Ba8gydF4y2Ba将印记传递给次要目标。同样,拟南芥gydF4y2Ba黄牌gydF4y2Ba和gydF4y2BaPAI3gydF4y2Ba通过甲基化的基因gydF4y2BaPAI1 / PAI4gydF4y2Ba位点不将其甲基化状态转移到幼稚单线态基因[gydF4y2Ba12gydF4y2Ba].事实上,关于反式沉默能力的非等位基因传递,很少有确凿的案例[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba24gydF4y2Ba].这是否意味着等位基因(变异)和非等位基因(反式沉默)相互作用之间存在操作上的差异,还是仅仅反映了数据的缺乏?gydF4y2Ba
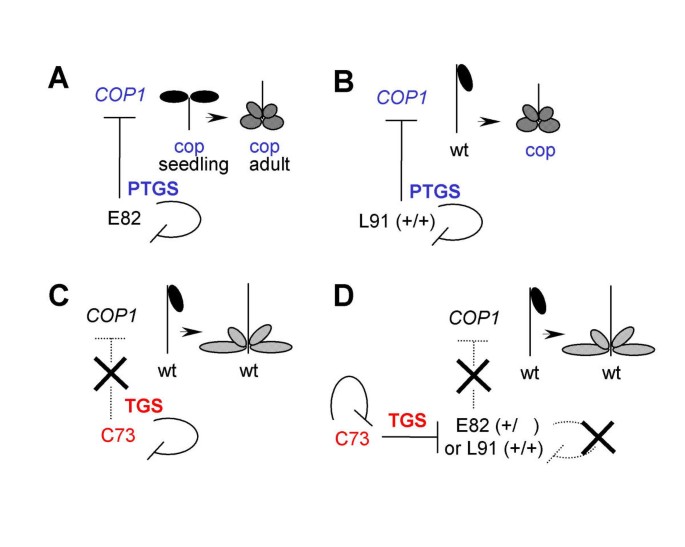
绿色荧光蛋白(GFP)和拟南芥组成型光致血管生成1蛋白(COP1)之间的平移融合已被确定为拟南芥中的反式沉默事件的记者[gydF4y2Ba27gydF4y2Ba].花椰菜花叶病毒35S启动子驱动gydF4y2BaGFP-COP1gydF4y2Ba基因座,命名为C73,例证了一个表观遗传活跃的反沉默者基因座。C73包含至少三个T-DNA拷贝,包括gydF4y2Ba35秒:GFP-COP1gydF4y2Ba基因以及由Nopaline合成酶启动子驱动的Kanamycin抵抗基因(gydF4y2Ba号:nptIIgydF4y2Ba)。C73基因座在转录(TGS)沉默,但保留了两者的局部表达gydF4y2BaNPTII.gydF4y2Ba和gydF4y2BaGFP-COP1gydF4y2Ba.gydF4y2BaGFP-COP1gydF4y2Ba遗体在幼苗根部表达,但在拍摄主要是沉默。其他gydF4y2Ba35秒:GFP-COP1gydF4y2Ba位点暴露于C73位点后,转录沉默(图)。gydF4y2Ba1gydF4y2Ba)。C73的反式沉默活性可以通过其对与目标位点相关的cop1样共抑制表型的负面影响方便地可视化。例如,L91是一个“单一T-DNA”位点,导致其纯合性依赖的共抑制gydF4y2BaGFP-COP1gydF4y2Ba转基因和内源性gydF4y2BaCOP1gydF4y2Ba在开发莲座阶段的基因(L =晚期沉默),这反过来导致特征矮化和其他方面gydF4y2Bacop1gydF4y2Ba- 般的表型[gydF4y2Ba28gydF4y2Ba].相反,E82 (type E=early)是导致纯合子依赖的低聚T-DNA位点gydF4y2BaCOP1gydF4y2Ba苗期内源基因沉默,特别是暗生长幼苗的蜕化。E82在成虫阶段也引起主要的共抑制。L91和E82都是转录后沉默(PTGS),它们都是具有类似转基因沉默特征的更大群体的代表性位点。注意PTGS通常是纯合子依赖的[gydF4y2Ba29gydF4y2Ba].C73沉默位点对PTGS位点L91或E82的反式沉默最容易表现为典型基因的缺失gydF4y2Bacop1 -gydF4y2Ba像cosuppressionphenotype(无花果。gydF4y2Ba1gydF4y2Ba) [gydF4y2Ba27gydF4y2Ba].另一个反式消声器位点C97也获得了类似的结果。gydF4y2Ba
之间的互动原则gydF4y2BaGFP-COP1gydF4y2BaTransgenes和The.gydF4y2BaCOP1gydF4y2Ba内胆gydF4y2Ba[gydF4y2Ba27gydF4y2Ba].旁边的符号gydF4y2BaCOP1gydF4y2Ba内源性基因代表暗生长的幼苗和光生长的成虫表型。gydF4y2Ba(一)gydF4y2BaE82导致显性转基因沉默gydF4y2BaCOP1gydF4y2Ba内源性基因的共同抑制。然而,需要注意的是,cop1样幼苗表型仅限于纯合子植株。gydF4y2Ba(B)gydF4y2BaL91引起纯合子依赖的转基因沉默和内源性基因的共同抑制。gydF4y2Ba(C)gydF4y2BaT3代及以后的C73植株转录沉默,不显示内源性基因共抑制。gydF4y2Ba(D)gydF4y2BaC73通过TGS突变沉默E82和L91,从而通过E82和L91靶位点抑制PTGS。gydF4y2Ba
在矮牵牛和拟南芥查尔酮合成酶(CHS)家族中,通过其对可见共抑制模式的影响来监测可遗传外等位基因的实验策略已经被开创[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba].相比较而言,gydF4y2BaCHSgydF4y2Ba反式沉默提供了敏锐的敏感性,部分由于其色素沉着表型的细胞自主,然而gydF4y2BaCOP1gydF4y2Ba本质上产生了全株表型。矮牵牛gydF4y2BaCHSgydF4y2Ba由于其不确定的生长习性,拟南芥也有助于检测表皮等位基因的体细胞转变gydF4y2BaCOP1gydF4y2Ba更适合监测幼苗和莲座植物的早期表观遗传活性。gydF4y2Ba
我们已经开始定义表观遗传活动的决定因素gydF4y2BaGFP-COP1gydF4y2Ba位点。反式沉默器和它们的目标都位于单拷贝,基因丰富的区域,只有少量重复或转座子,这些特征已经被证明在其他情况下介导表观遗传活动[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba].因此trans-silencinggydF4y2BaGFP-COP1gydF4y2Ba可能不是由转基因侧翼序列介导的[gydF4y2Ba27gydF4y2Ba].而与上述其他基因一样,反式沉默能力与转基因位点结构相关,C73和C97反式沉默基因包含多个t - dna,而其靶标E82和L91本质上分别是二聚体和单体。gydF4y2Ba
在这里,我们报告中指出,拟南芥C73和C97反式消声器轨迹显示的TGS和反式沉默首次通过后通过PTGS的过渡阶段在第一两种转基因后代的过程。初始PTGS表型的类似表观遗传不稳定性是典型的其它寡聚基因座的子集,但从来没有与单体观察到gydF4y2Ba35秒:GFP-COP1gydF4y2Ba位点。正是这种共抑制的不稳定性最初促使我们将某些基因座归类为C型而不是e型。我们还描述了关于(a)共抑制的C73反消音基因座施加的印记的遗传性gydF4y2BaCOP1gydF4y2Ba内源性基因和(b)在靶位点上转基因表达的特殊而不寻常的扩展。最后,我们的数据表明L91靶位点在暴露于C73后获得了有限的反式沉默活性,这在转基因中是不寻常的。然而,这些数据必须根据另一个新的观察来解释,即即使是相对简单的、转录活性的转基因位点也可以与具有表观遗传转基因沉默特征的非线性基因剂量效应相互作用。gydF4y2Ba
结果gydF4y2Ba
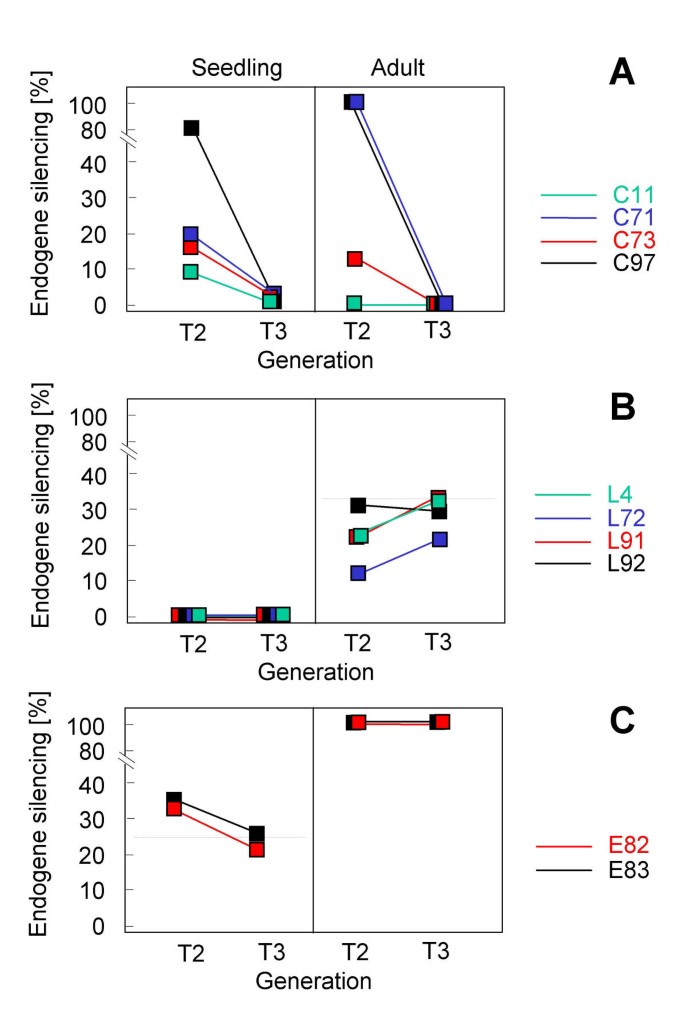
C73和C97的沉默表型是表观遗传获得的gydF4y2Ba
许多最有效的外观活性基因座是内源性而不是转基因的,因此,它们的早期表观遗传历史并不完全已知。相反,转基因在植物谱系中具有规定的起源日期。在基于转基因的系统中,Silender LocigydF4y2BaGFP-COP1gydF4y2BaC73 C97和行图2中的T2和T3世代之间它们的沉默行为(一个显然自发转换。gydF4y2Ba2gydF4y2Ba)。详细地,初级转基因植物T1植物C73的后代,其具有通过抗生素抗性的偏析确定的单个转基因座,在深色生长的T2代中分离几乎四分之一COP1样幼苗。内源沉默的这种剂量依赖性与PTGS基因座E82相同(图。gydF4y2Ba1gydF4y2Ba)。明确的证据表明转基因和内源性基因共同抑制,而不是转基因蛋白的主要负面影响,已经在L4线和其他[gydF4y2Ba27gydF4y2Ba],而COP1内源性基因抑制也与T2代C型品系的GFP-COP1沉默相关(未显示)。在成虫期,C73细胞株T2中有12%的植株明显受到共同抑制。相比之下,T2植物自交衍生的T3代(run-on transcription assay)被TGS沉默[gydF4y2Ba27gydF4y2Ba的幼苗很少,成虫也没有。在C97行中也得到了类似的结果。C97行是本研究中唯一包含两个不相连基因座的行[gydF4y2Ba27gydF4y2Ba],这可能导致T2幼苗中PTG的高发病率。这些基因座都不保留其T3中的内肌沉默能力(图。gydF4y2Ba2gydF4y2Ba)。没有gydF4y2BaCOP1gydF4y2Ba在C73或C97的T3代(未显示)之后还观察到共抑制。两个额外的低聚物的gydF4y2BaGFP-COP1gydF4y2Ba位点,C11和C71,其未针对其反式沉默的行为,还从一个共抑制状态改变在T2代中在T3(图的非共抑制状态进行测试。gydF4y2Ba2gydF4y2Ba)。与此相反,无四(单T-DNA)的L型基因座失去了内源沉默能力(图gydF4y2Ba2 bgydF4y2Ba)。某些L型品系的成体COP1共抑制从T2到T3明显增加,但无统计学意义。E型基因座E82和E83也是稳定的(图2)。gydF4y2Ba2摄氏度gydF4y2Ba)。总之,这些结果表明,某些寡聚T-DNA位点中的PTGS是不稳定的,并有向TGS发展的趋势。在C73行中,这一转变可能始于T2幼苗,这是由一小部分具有cop1样PTGS表型的T2成体植株所暗示的。gydF4y2Ba
E82基因座的转膜轨迹结构gydF4y2Ba
为了在后续的实验中更准确地区分L91和E82位点,我们对E82位点的结构进行了更详细的定义。L91位点是一个简单的T-DNA位点,位于一个确定的染色体位置。相反,用T-DNA右边界(RB)探针的Southern blots显示了两个E82的片段[gydF4y2Ba27gydF4y2Ba].早期通过TAIL-PCR分离E82侧翼序列的尝试重复发现了左边界(LB)和在3'端附近截断的部分T-DNA之间的偶然连接gydF4y2BaGFP-COP1gydF4y2Ba基因。e82基因座结构的示意图,其包含所有这些数据以及来自LB探测的印迹的数据gydF4y2BaCOP1gydF4y2Ba序列(未显示)如图所示。gydF4y2Ba3.gydF4y2Ba.该模型随后通过两种方式得到证实gydF4y2BaNdeI位gydF4y2Ba在侧翼序列中确认了从Southern印迹预测的限制性位点[gydF4y2Ba27gydF4y2Ba];特异性引物在转基因侧翼和LB-RB连接处进行PCR扩增,得到预期的产物长度(图)。gydF4y2Ba3.gydF4y2Ba)。因此,我们提出E82基因座由一个直接重复序列组成,该序列在末端由部分T-DNA以倒置的方向连接。gydF4y2Ba
的结构gydF4y2BaGFP-COP1gydF4y2Ba轨迹E82。(一)gydF4y2Ba顶部显示的排列是用右边界探针对NdeI (N)酶切基因组DNA进行Southern blot分析得出的。此外,使用序列特异性引物进行PCR检测,得到实线所示的预测产物。预测PCR产物的大小以碱基对给出。PCR产物上方的数字为面板(B)中显示相关片段的通道号。E82位点位于BAC T6A9的第1染色体42325碱基对(Genbank: AC064879)。gydF4y2Ba(B)gydF4y2Ba溴化乙啶染色凝胶图像显示了由边界序列(第1至3道,片段大小显示在左侧)和内部RB/LB连接(第4道,见右侧标记)生成的预测PCR产物。gydF4y2Ba
通过C73的转沉沉默导致可变新型转基因表达模式,包括转基因表达的空间膨胀gydF4y2Ba
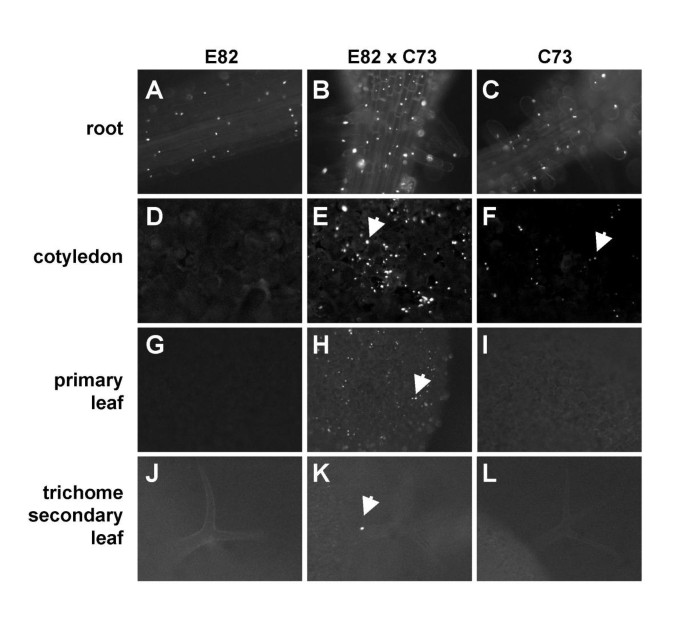
C73反式沉默位点导致了两个检测的靶位点L91和E82的转录沉默,最容易通过抑制靶位点的典型内源性共抑制来检测(图)。gydF4y2Ba1gydF4y2Ba) [gydF4y2Ba27gydF4y2Ba].如预期,L91的空间表达模式gydF4y2BaGFP-COP1gydF4y2Ba在暴露于C73时,基因受到限制,虽然未完全被废除(未显示,但参见图3。gydF4y2Ba5 dgydF4y2Ba下文)。相比之下,C73和E82分离的F2家族包含了许多具有扩展空间表达模式的植物,即转基因在子叶和前两对叶子中的表达“重新激活”,尤其是在毛状体中(图2)。gydF4y2Ba4gydF4y2Ba为了比较,单纯的E82位点和单独的C73位点在叶片中被沉默(图2)。gydF4y2Ba图4A,4D,4GgydF4y2Ba和gydF4y2Ba4 jgydF4y2Ba和无花果。gydF4y2Ba我4 c、4 f, 4gydF4y2Ba和gydF4y2Ba4米gydF4y2Ba)。这种再活化以前在dihybrid C73 / E82 F1亲本植物[被观察gydF4y2Ba27gydF4y2Ba].随后,通过检测缺失C73的F2分离株,将重新激活的表达归因于E82位点,而不是C73位点(见图)gydF4y2Ba5gydF4y2Ba下文)。综上所述,C73对L91和E82的沉默是不完全的,特别是E82在其不正常表达的器官中恢复了部分转基因表达。gydF4y2Ba
暴露于后转录后沉默的E82基因座的转基因表达的再活化gydF4y2BaGFP-COP1gydF4y2BaC73。gydF4y2Ba显示了整株幼苗的荧光显微照片。注意,GFP-COP1蛋白在每个细胞中以单个包涵体的形式积累。左栏(面板gydF4y2BaA,d,G,gydF4y2Ba和gydF4y2BaJgydF4y2Ba控制:a的后代gydF4y2BaGFP-COP1gydF4y2BaE82半合子植物。GFP-COP1仅在根是活跃。中央栏(板gydF4y2BaB,E,H,gydF4y2Ba和gydF4y2BaKgydF4y2Ba):一个的子代gydF4y2BaGFP-COP1gydF4y2BaC73×E82二杂交厂。GFP-COP1通常活跃在根,子叶和第一和第二组叶中。箭头突出了重新激活的gydF4y2BaGFP-COP1gydF4y2Ba在子叶、叶表皮以及第二组叶的毛状体中。右列(面板gydF4y2BaC、F、我,gydF4y2Ba和gydF4y2BalgydF4y2Ba控制:a的后代gydF4y2BaGFP-COP1gydF4y2BaC73半合的植物。GFP-COP1在根和子叶的保卫细胞(注意成对的点)中有活性。gydF4y2Ba
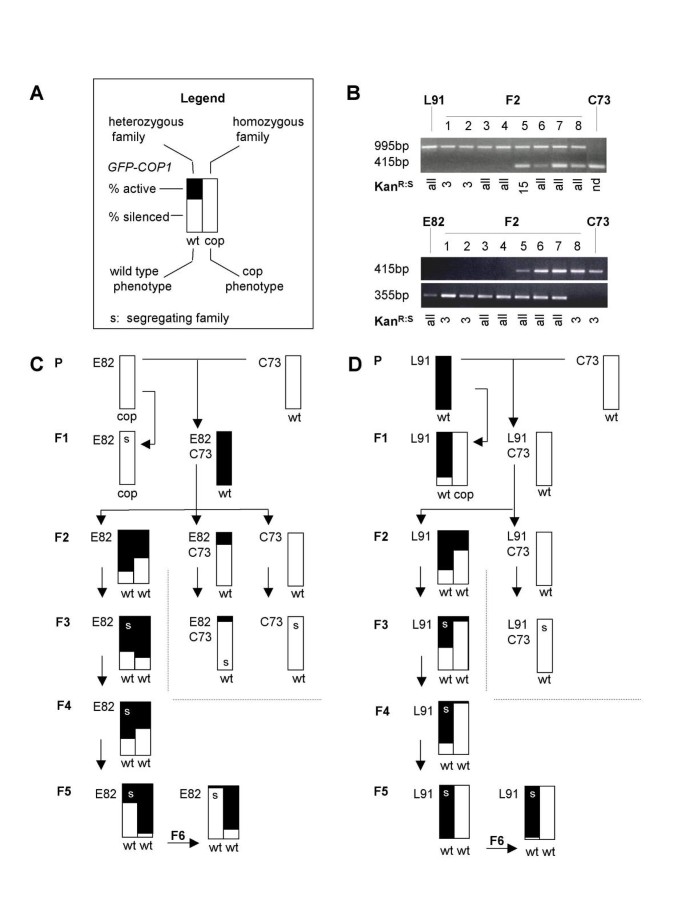
C73对L91和E82的转沉默可以稳定地遗传5代。gydF4y2BaTrans-silencing抑制了gydF4y2Bacop1gydF4y2Ba类PTGS表型的L91纯合子和E82植物,并引起E82的重新激活gydF4y2BaGFP-COP1gydF4y2Ba表达式。gydF4y2Ba(一)gydF4y2Ba图示说明表型评分方案。gydF4y2Ba(B)gydF4y2Ba诊断PCR分析。利用L91和C73或E82和C73特异性引物对F2植株的DNA进行PCR。1道:L91或E82控制。第十道:C73控制。2至9道:8株独立的F2植物。L91和E82基因的表达量由F3子代(Kan)中卡那霉素抗性标记的分离比确定gydF4y2BaR: SgydF4y2Ba或者3:1,15:1,或者全部)。gydF4y2Ba(C, D)gydF4y2Ba亲本对照、双杂交F1或其单转基因对照兄弟姐妹、单个基因型F2s及其自交后代的转基因表达(bars)和内源性基因沉默表型(cop, wt)。gydF4y2Ba(C)gydF4y2BaE82和C73gydF4y2Ba(D)gydF4y2BaL91和C73。酒吧的阴影反映了有活跃或沉默的植物的百分比gydF4y2BaGFP-COP1gydF4y2Ba转基因表达。在杂合谱系的情况下,普通家庭尺寸为32.注意:在F4代中,在大多数野生型植物中观察到具有COP1样浓缩表型的小部分植物。gydF4y2Ba
这些结果强调了反式沉默和副突变之间的相似性,因为在这两种情况下,外等位基因通常是不完全沉默的,也可能采用新的调节模式[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba10gydF4y2Ba],例如光诱导性[gydF4y2Ba33gydF4y2Ba].也许,在二聚体E82轨迹处沉默涉及其两个完整的T-DNA之间的分层关系。C73基因座可以优先靶向假设的“母母'T-DNA,这反过来失去其在E82基因座内的”从属'T-DNA后转录静音的能力。gydF4y2Ba
C73的两个目标位点遗传地保持自己的后生印记最多五个世代gydF4y2Ba
建立了L91、E82和C73位点的诊断PCR检测方法,以明确识别F2分离体,该分离体包含一个反式沉默的L91或E82靶位点,但缺少C73沉默位点(图)。gydF4y2Ba5 bgydF4y2Ba;比较1-4车道和5-8车道)。此外,通过在自交后代中分离卡那霉素抗性基因,将半合子和纯合子区分开来(比较1-2和3-4车道)。随后,我们观察了E82和L91的半合子和纯合子谱系的表型逆转率。一个传奇的得分gydF4y2Bacop1gydF4y2Ba例如cosuppression和gydF4y2BaGFP-COP1gydF4y2Ba转基因沉默模式如图所示。gydF4y2Ba5gydF4y2Ba.除非暴露于C73,否则E82植物总是gydF4y2Bacop1gydF4y2BaGFP-COP1和L91纯合子植株的基因表达相同。相比之下,如果转基因在F1中暴露于C73,那么在F2中,E82植株和纯合子L91植株是野生型,而不是共同抑制的(图)。gydF4y2Ba5度gydF4y2Ba和gydF4y2Ba5 dgydF4y2Ba,先前概述于[gydF4y2Ba27gydF4y2Ba])。在半合子和纯合子家族中,C73缺失的情况下,E82基因GFP-COP1转基因表达的再激活和内源性基因沉默的抑制都能维持4代,而C73保持沉默(图)。gydF4y2Ba5度gydF4y2Ba)。L91谱系也从C73保持了最多五代的印记。具体地,保持纯合的L91植物的COP1样宇宙抑制表型保持抑制(图。gydF4y2Ba5 dgydF4y2Ba)。gydF4y2Ba
虽然在E82和L91位点上的印记被证明是相当稳定的,但通过两种方式观察到逆转。首先,一小部分cop1-like E82和L91植物出现在F4代(图中没有反映)。gydF4y2Ba5gydF4y2Ba);第二,特别是在半合子家族中,E82的GFP-COP1表达逐渐从激活模式恢复到沉默模式(图2)。gydF4y2Ba5度gydF4y2Ba)。印迹L91系的转基因表达数据信息量较小。然而,似乎半合子的L91谱系逐渐恢复了gydF4y2BaGFP-COP1gydF4y2Ba表达式但不达到后签发的抑制所需的阈值gydF4y2BaCOP1gydF4y2Ba基因。gydF4y2Ba
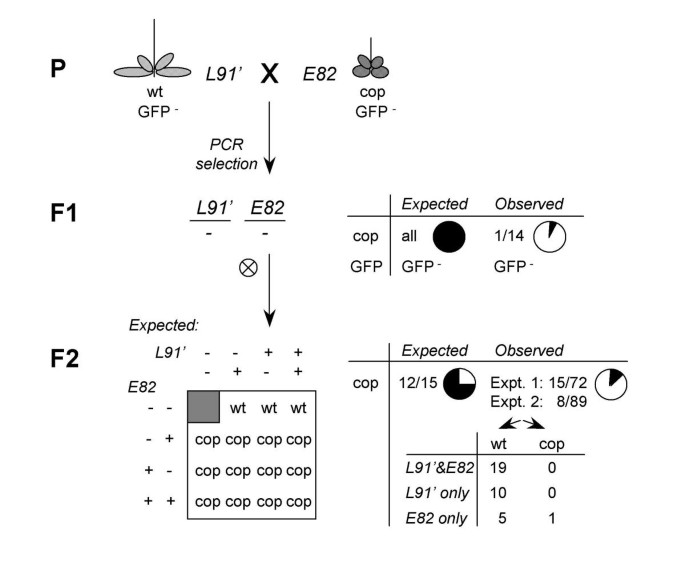
印迹传递:反式沉默的E82和L91位点是否具有反式沉默能力?gydF4y2Ba
我们的数据表明,C73位点可能是在T1和T3代之间从E型沉默向C型沉默的表观遗传转变的一部分。因此,我们有理由提出这样的问题:基因型沉默活性是否可以从C基因座进一步转移到其他基因座。测试被反式沉默的L91位点(从今以后称为L91')是否能改变一个幼稚的L91等位基因似乎有问题,因为我们无法在分子水平上区分L91'主基因和L91靶基因。相反,我们检测了L91'对一个单纯的E82位点的影响,并检测了E82'对L91的影响,因为这些位点在诊断PCR检测中是可区分的。因为L91'和E82'不再引起gydF4y2BaCOP1gydF4y2BaCasup抑制,通过遵循幼稚E82和L91基因座的宇宙抑制表型来易于监测相互作用。数字gydF4y2Ba6gydF4y2Ba提供了交叉方案的概述,实验数据如表所示gydF4y2Ba1gydF4y2Ba来gydF4y2Ba3.gydF4y2Ba.显著地,L91′位点抑制了gydF4y2BaCOP1gydF4y2Ba在大多数F1双杂交植株中,E82靶点沉默内源性基因,而一个朴素的L91位点没有沉默gydF4y2Ba1gydF4y2Ba)。在L91 × E82对照试验中,虽然基因分型只恢复了4株相关植株,但整个L91 × E82家族中沉默植株的比例较大,大于L91’和E82,且与L91和E82的加性互作(未显示)兼容。如预期,在转基因表达水平上,L91’/-;E82 / -和L91 /;对E82/-植物进行沉默gydF4y2Ba1gydF4y2Ba;无花果。gydF4y2Ba6gydF4y2Ba)。同样,在F2代中,L91′继续抑制E82对内源性基因沉默的抑制作用(表2)gydF4y2Ba2gydF4y2Ba;无花果。gydF4y2Ba6gydF4y2Ba),这通常会影响大约四分之三的F2后代。重要的是,通过对F2个体植株进行基因分型,鉴定出5株野生型样植株,仅携带E82位点而没有L91’位点,证实L91’可以在E82上留下遗传印记(表2)gydF4y2Ba3.gydF4y2Ba)。然而,另外两个数据区分了L91'和C73的反式沉默活性。首先,F2家族中明显含有内源性基因沉默的植物。在一个测试的病例中,这是由于,不足为奇的是,一个E82基因位点从L91'逃逸并恢复了其内源性基因沉默(表gydF4y2Ba3.gydF4y2Ba)。因此,L91’是一种不如C73有效的跨消声器[gydF4y2Ba27gydF4y2Ba].其次,甚至令人惊讶的是,甚至在F1中没有显示在F1中没有反式沉默的幼稚L91和E82基因座均显示F2中的E82浓缩表型的损失(表gydF4y2Ba2gydF4y2Ba)。而不是预期的87%的孟德尔比率gydF4y2Bacop1gydF4y2Ba样植物,只有38%中观察到,一个显著短缺。个人F2植物基因分型发现从随机逃生gydF4y2BaCOP1gydF4y2Ba同时含有E82和L91的植物,甚至包括一个单一的不含L91的E82植物的内源性基因沉默gydF4y2Ba3.gydF4y2Ba)。这种共抑制缺失在数百种仅含有E82的植物中没有被观察到(我们未发表的数据)。这些数据表明,在暴露于一个幼稚的L91位点后,E82发生了表观遗传修饰。gydF4y2Ba
与此相反的表观遗传活性反式沉默L91' ,E82' 却没有这样的活动。当E82' 与L91合并两个基因座合作以引起内源沉默,与未修饰的和E82 L91(表看出gydF4y2Ba1gydF4y2Ba)。这是出乎意料的,因为E82'与L91'很少或没有引起内源性基因共同抑制,或者是E82'本身。在F2子代中再次检测到真实印迹的E82'位点和朴素的L91位点之间的协同共抑制(表)gydF4y2Ba2gydF4y2Ba)。因此,E82'显然无法转化沉默一个天真的L91位点,事实上,当暴露于L91时,似乎失去了它的印记;因此,这些家庭没有进一步分析。E82’也没有转化沉默一个单纯的E83位点(没有显示)。gydF4y2Ba
综上所述,这些数据可以得出三个结论。首先,用L91和E82进行的实验表明,即使是相对简单的与PTGS相关的转基因位点也可以显示非加性基因剂量效应,这一点通过对PTGS的可遗传抑制表现出来。第二,C73反式消声器在L91位点上留下的印记确实改变了L91与非等位目标位点E82的上位性相互作用,如图F1代所示。然而,当L91处于印记状态(L91’)时,这种转化沉默效应是否更有可能被遗传,还有待确定。第三,E82位点上的印迹(E82′)比L91′位点上的印迹更不稳定,没有可转移的迹象。gydF4y2Ba
讨论gydF4y2Ba
影响核基因表达的表观遗传印记在传递到同源序列上的效率上存在差异。在玉米的经典例子中gydF4y2Bab1gydF4y2Ba基因座,印记以100%效率转换[gydF4y2Ba24gydF4y2Ba].也就是说,一个副突变等位基因变成了一个副突变等位基因。与此相反,据我们所知,没有反式沉默的转基因被证明具有遗传的反式沉默能力,这表明或许反式沉默能力在非等位基因之间传递比在等位基因位点之间传递更困难。然而,内生gydF4y2Bap1-rrgydF4y2Ba玉米等位基因在暴露于某一特定基因后确实具有副致突变性gydF4y2BaP1gydF4y2Ba-enhancer转基因[gydF4y2Ba11gydF4y2Ba].在此背景下,我们调查了拟南芥C73 Trans-Silencenter基因座触发的印记的可能继电器,具体要求由C73基因座(A)所获取的转沉沉默活动的靶向静音,并且(B)能够通过它们以遗传方式印记到天真的目标基因座。gydF4y2Ba
综上所述,印迹的E82位点(E82’)对单纯的L91位点没有显着的反沉默能力。相比之下,L91'最初能够转化沉默E82,这是通过抑制与原始E82相关的内源性共抑制表型来判断的;重要的是,未修改的L91控制点不具有这种能力(表1)gydF4y2Ba1gydF4y2Ba)。因此,我们演示了印记继电器的(a)方面。此外,由于缺失L91′的部分(而不是全部)E82分离株为野生型,因此对E82位点沉默的抑制是部分遗传的,而不是完全遗传的(表)gydF4y2Ba3.gydF4y2Ba)。然而,这些数据缺乏所证明的压印继电器的方面(b),因为令人惊讶的是,幼稚L91和E82基因座的组合也导致了可能导致E82基因座的遗传杂散沉默的非线性基因剂量效应至少有一个实例。L91'是否可以放手等位基因L91基因座仍有待测试。L91和E82之间的非线性基因剂量效应对我们来说令人惊讶,因为在烟草中,用类似的实验gydF4y2Ba35 s:格斯gydF4y2Ba转基因并没有引起表观遗传效应的怀疑[gydF4y2Ba34gydF4y2Ba].gydF4y2Ba
比较两种植物的表观遗传相互作用具有重要意义gydF4y2Ba35秒:GFP-COP1gydF4y2Ba转基因的gydF4y2Ba拜gydF4y2Ba(反式)的基因,在拟南芥的唯一其它良好表征的系统gydF4y2Ba12gydF4y2Ba].这两个基因集都由相对简单的重复结构和单线位点组成,它们本质上存在于拟南芥的单拷贝环境中([gydF4y2Ba27gydF4y2Ba和未发表的观察)。第一个比较与表观遗传变化的速度有关。在这里,将一个主位点(C73)与一个具有100%序列一致性的非等位单线位点(L91)结合,会导致立即的反式沉默,这可以从GFP-COP1表达的减少和共抑制的阻断中看出来,这在主位点存在或不存在时都能稳定地维持。相反,在gydF4y2Ba拜gydF4y2Ba基因家族,结合主位点(WS生态型gydF4y2BaPAI1 / PAI4gydF4y2Ba)具有拥有100%序列标识的非等位基因单态靶位基因座(哥伦比亚gydF4y2Ba黄牌gydF4y2Ba)导致了两代杂合子接触后的甲基化,而甲基化在另外两代后变得更加明显[gydF4y2Ba12gydF4y2Ba].同样,牵牛花也是如此gydF4y2BaCHSgydF4y2Ba基因家族中,直接重复位点CHS41的外等位基因与两种类型的靶位点(非连锁的反向重复位点或更naïve的CHS41等位基因)的相互作用最初是加性的,直到第二代才变为抑制[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba10gydF4y2Ba].gydF4y2Ba
第二个比较与表观遗传活动的传递有关。在我们的系统中,一个反式沉默的单线态基因(L91’)能够在一个世代内反式沉默一个朴素同源物(E82)。相反,反式甲基化单线态gydF4y2Ba黄牌gydF4y2Ba基因没有反甲基化一个幼稚的等位基因gydF4y2Ba黄牌gydF4y2Ba三代以内的基因[gydF4y2Ba12gydF4y2Ba].额外的实验可能最终提供对控制这种表观遗传互动效率的问题的答案。gydF4y2Ba
内源性COP1基因的共同抑制是转录后沉默的结果,而转录反式沉默位点不共同抑制COP1 [gydF4y2Ba27gydF4y2Ba].在我们手中,有四个子集gydF4y2Ba35秒:GFP-COP1gydF4y2Ba在转基因两代后,基因座从共抑制状态(真正的PTGS)转变为非共抑制状态(即TGS)。因此,这些位点被称为“复杂”位点。注意,L型和E型位点并没有失去PTGS表型(图。gydF4y2Ba2 bgydF4y2Ba)。这包括L72基因座,其具有减少的粘性抑制孔径,其可归因于其围类位置[gydF4y2Ba27gydF4y2Ba].有趣的是,反式沉默基因座C73和C97都属于“复合物”组,这增加了一个命题的分量,即与副诱变性一样,反式沉默活性是表观遗传编码的。反之,这种转变提出了一个问题,那就是最初的强转录是否gydF4y2BaGFP-COP1gydF4y2Ba基因,或者随后的PTGS相位,以某种方式设置用于随后的反式沉默活性的阶段,特别是如果多聚T-DNA位点参与。PTGS和反式沉默被类似地交织在其它情况下,例如在epimutable矮牵牛CHS41基因座gydF4y2Ba10gydF4y2Ba].PTGS常导致DNA甲基化,尽管主要发生在编码区域[gydF4y2Ba35gydF4y2Ba].然而,如果启动子序列的合适的双链RNA版本被转录,启动子的DNA甲基化(更容易与转录沉默对齐)可以由RNA介导,无论是偶然的还是设计的[gydF4y2Ba36gydF4y2Ba- - - - - -gydF4y2Ba40gydF4y2Ba].因此,可以存在PTGS基因座至TGS和相关的跨沉默的自然趋势,而相关的跨沉默,这反过来可以证明在商业植物育种计划中施加PTG。我们的数据肯定与此概念一致。这些假设可通过我们建立的模型系统进行可测试。gydF4y2Ba
结论gydF4y2Ba
1.结构复杂的转基因位点的转录后基因沉默可能是不稳定的,并可能在植物几代的过程中被转录基因沉默所取代。gydF4y2Ba
2.转基因基因表达的遗传修饰可能在五代或五代以上都是稳定的。gydF4y2Ba
3.当暴露于反式沉默基因位点时,某些拟南芥转基因与其他转基因的上位性相互作用发生改变。这些数据表明,反式沉默的能力可能在非等位基因之间转移,使人想起在突变过程中表观遗传活动的等位基因转移。gydF4y2Ba
4.共抑制表型可作为拟南芥转基因表观遗传相互作用的敏感指标。gydF4y2Ba
方法gydF4y2Ba
转基因拟南芥系与植物生长gydF4y2Ba
在GFP-COP1表达盒包含双35S增强子,翻译增强子,和35S终止子。最GFP-COP1线和GUS-COP1线L4已描述gydF4y2Ba27gydF4y2Ba,gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba].未沉默的GUS-COP1和GFP-COP1转基因对cop1突变的补充[gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba].C11和C71基因座分别包含至少三个和两个连接的t - dna,如Southern blotting所示(未显示)。植物在含1%蔗糖的琼脂凝固MS培养基上持续光照或持续黑暗中发芽,随后在22°C的生长室土壤中在荧光灯持续白光下生长。gydF4y2Ba
测试获取的跨沉默活动gydF4y2Ba
缺乏C73消音器基因座('Prime'-Label)的跨静音L91'和E82'植物以与幼稚E82和L91植物的成对组合交叉。因为无论L91'是否是雄性或女性父母,所以观察到E82的杂散沉默,所以合并来自互惠交叉的数据。针对GFP-COP1和COP1内源沉默表型检查了单独的F1毒性植物。通过诊断PCR测定检查两种不同的转基因基因座的代表性F1二氰和通过偏析分析检查。仅通过PCR基的基因分型鉴定仅含有目标基因座的F2分离物,类似于图3中示例的策略。gydF4y2Ba5gydF4y2Ba.其中GFP-COP1表达仅限于根和子叶植物被认为是沉默,而用GFP-COP1超越子叶植物可见被认为是积极的。gydF4y2Ba
PCR检测gydF4y2Ba
C73和E82位点的诊断PCR检测显示了独特的PCR产物,产生于T-DNA右边界和COP1 cDNA之间的偶然和独特的连接,这是我们在早期分离侧翼序列的尝试中恢复的。E82的引物为ATATTTGCTAGCTGATAGTGACC-3'和gatcctaggggtctcgtgattttcttgtgat -3';对于C73,它们是TGTCAGTTCCAAACGTAAAACGG-3'和GACACATCACAAGATCTTTGTAGTGC-3'。L91位点的检测基于L91侧翼序列特异性寡核苷酸(AGGCACACAAGCCCAAAAAGAC-3')和T-DNA的RB [gydF4y2Ba27gydF4y2Ba].表示E82基因座的结构的PCR片段制备如下:片段1所示。gydF4y2Ba3 bgydF4y2Ba:5'-AAACAGGATTTTCGCCTGCTGGG-3' (LB)和5'-ACATCCAAACAGAACGTGCC-3' (拟南芥)。片段2:5'-AAACAGGATTTTCGCCTGCTGGG-3' (LB)和5'-TGCTGTTCAAACCCCAAAATTC-3' (拟南芥)。片段3:5'-ATATTTGCTAGCTGATAGTGACC(RB)和5'-TGCTGTTCAAACCCCAAAATTC-3' (拟南芥)。片段4:5'-GGGGGCCATGGAGTATGAAGAGCACGAA-3' (COP1)和5'-CGGAGAACCTGCGTGCAATCCATC-3' (RB)。gydF4y2Ba
参考gydF4y2Ba
- 1.gydF4y2Ba
JE:玉米的Paramutation。植物生态学报。2000,43(4):461 - 466。10.1023 /: 1006499808317。gydF4y2Ba
- 2.gydF4y2Ba
一个新的拟南芥蓝色荧光突变体揭示了一个内源基因家族的表观遗传控制。Cell. 1995, 83: 725-734。gydF4y2Ba
- 3.gydF4y2Ba
Meyer P,Heidmann I,Niedenhof I:DNA-甲基化的差异与转基因喇叭绦虫中的一项升级现象有关。工厂J. 1993,4:89-100。10.1046 / J.1365-313x.1993.04010089.x。gydF4y2Ba
- 4.gydF4y2Ba
共抑制,花的颜色模式,亚稳态基因表达状态。中国科学:地球科学。gydF4y2Ba
- 5.gydF4y2Ba
拟南芥抗病性的表观遗传变异。基因工程学报,2002,16:171-182。10.1101 / gad.952102。gydF4y2Ba
- 6.gydF4y2Ba
两种拟南芥组成型病原应答等位基因的诱导不稳定性。美国国家科学院学报。2002年,99:7792 - 7796。10.1073 / pnas.112040999。gydF4y2Ba
- 7.gydF4y2Ba
acta botanica ica(云南植物研究中心);acta botanica ica(云南植物研究中心)王志军,1994,4:481 -485。gydF4y2Ba
- 8.gydF4y2Ba
Park YD, Papp I, Moscone EA, Iglesias VA, Vaucheret H, Matzke AJ, Matzke MA:启动子同源性介导的基因沉默发生在转录水平,导致甲基化和基因活性的减数分裂遗传改变。植物学报,1996,9:183-194。10.1046 / j.1365 - 313 x.1996.09020183.x。gydF4y2Ba
- 9.gydF4y2Ba
Iglesias VA, Moscon EA, Papp I, Neuhuber F, Michalowski S, Phelan T, Spiker S, Matzke M, Matzke AJ:烟草稳定和不稳定表达转基因基因位点的分子和细胞遗传学分析。植物学报。1997,9:1251-1264。10.1105 / tpc.9.8.1251。gydF4y2Ba
- 10.gydF4y2Ba
杨志强,杨志强。矮牵牛花基因表达模式的同源性研究。作者简介:张志强,男,博士生导师。10.1002 / (SICI) 1520 - 6408 (1998) 22:1 < 100:: AID-DVG10 > 3.3.CO; 2 r。gydF4y2Ba
- 11.gydF4y2Ba
Sidorenko LV, Peterson T:转基因诱导沉默鉴定了参与建立玉米p1基因突变的序列。植物学报。2001,13:319-335。10.1105 / tpc.13.2.319。gydF4y2Ba
- 12.gydF4y2Ba
Luff B, Pawlowski L, Bender J:反向重复触发拟南芥相同序列的胞嘧啶甲基化。acta photonica sinica, 2012, 32(3): 497 - 503。gydF4y2Ba
- 13.gydF4y2Ba
转基因基因在T-DNA重复序列中的位置依赖甲基化和转录沉默:对植物同源宿主基因转录后沉默的影响。中国生物医学工程学报。1998,18(6):691 - 697。gydF4y2Ba
- 14.gydF4y2Ba
Kermicle JL,埃格尔斯顿WB,Alleman L:在R-点画玉米paramutagenicity的组织。遗传学。1995年,141:361-372。gydF4y2Ba
- 15.gydF4y2Ba
Walker EL:玉米R1基因座的放纵与增加的胞嘧啶甲基化有关。遗传学。1998,148:1973-1981。gydF4y2Ba
- 16.gydF4y2Ba
Vaucheret H:在转基因烟草植株中对19S和35S启动子的一般消音器的鉴定:启动子序列中90 bp的同源性足以使反式失活。《生命科学》,1993,316:1471-1483。gydF4y2Ba
- 17.gydF4y2Ba
植物转录基因沉默:靶标、诱导和调控。《趋势通讯》,2001,17:29-35。10.1016 / s0168 - 9525(00) 02166 - 1。gydF4y2Ba
- 18.gydF4y2Ba
玉米b1基因上游100kb串联序列染色质结构差异与突变有关。基因发展,2002,16:1906-1918。10.1101 / gad.1006702。gydF4y2Ba
- 19.gydF4y2Ba
Walker El,Panavas T:与Zea的R1位点有关的结构特征和甲基化模式。遗传学。2001,159:1201-1215。gydF4y2Ba
- 20。gydF4y2Ba
Lindroth AM, Cao X, Jackson JP, Zilberman D, McCallum CM, Henikoff S, Jacobsen SE: CHROMOMETHYLASE3对CpXpG甲基化维持的需求。科学通报,2001,22(4):417 - 418。10.1126 / science.1059745。gydF4y2Ba
- 21。gydF4y2Ba
Mitsuhara I, Shirasawa-Seo N, Iwai T, Nakamura S, Honkura R, Ohashi Y:转基因烟草植物中转录后基因沉默的释放:沉默的非遗传机制。中国生物医学工程学报。2002,16(4):434 - 442。gydF4y2Ba
- 22.gydF4y2Ba
Napoli C, Lemieux C, Jorgensen R:在矮牵牛中引入嵌合查尔酮合成酶基因可导致反式同源基因的可逆共同抑制。acta botanica sinica(云南植物研究),2010,29(6):531 - 534。10.1105 / tpc.2.4.279。gydF4y2Ba
- 23.gydF4y2Ba
帕特森GI,索普CJ,钱德勒VL:副突变,等位相互作用,与一个稳定和可遗传的减少玉米的转录相关联gydF4y2BabgydF4y2Ba调节基因。遗传学杂志。1993,135:881-894。gydF4y2Ba
- 24.gydF4y2Ba
的转换类型继承的属性、起源和机制gydF4y2BabgydF4y2Ba玉米的基因座。遗传学。1966年,53:1035-1063。gydF4y2Ba
- 25.gydF4y2Ba
霍克里克J,Patterson G,Coe E,Cone K,Chandler V:其等位基因相互作用可致力于改变亚稳态玉米PL等位基因的活性。遗传学。1995,141:709-719。gydF4y2Ba
- 26.gydF4y2Ba
棕色DF,边缘Ra:Paramutant R的Paramutagenic ActiongydF4y2BargydF4y2Ba和R.gydF4y2BaggydF4y2Ba等位基因在玉米。遗传学。1960,45:1313-1315。gydF4y2Ba
- 27.gydF4y2Ba
秦辉,董永忠,冯阿尼。拟南芥转基因间的表观遗传相互作用:基于转基因整合位点的表征。植物杂志。gydF4y2Ba
- 28.gydF4y2Ba
邓晓伟,王志强,王志强,等。拟南芥光敏基因表达的研究进展。基因工程学报,1991,5:1172-1182。gydF4y2Ba
- 29.gydF4y2Ba
De Carvalho F,Gheysen G,Kushnir S,Van Montagu M,Inze D,Castresana C:抑制纯合植物中的β1,3-葡聚糖酶转基因表达。Embo J. 1992,11:2595-2602。gydF4y2Ba
- 30.gydF4y2Ba
Davies GJ,Sheikh Ma,Ratcliffe Oj,Zeroughd G,Filler IJ:拟南芥同源依赖性基因的遗传学;甲基化的作用。工厂J. 1997,12:791-804。10.1046 / J.1365-313x.1997.12040791.x。gydF4y2Ba
- 31。gydF4y2Ba
Martienssen Ra:玉米Mu可转换元素的表观遗传沉默。在:基因调控的表观遗传机制。编辑:Russo VEA,Martienssen Ra,Riggs AD。1996年,冷泉港实验室新闻,冷泉港,纽约。gydF4y2Ba
- 32。gydF4y2Ba
罗氏SE,里约热内卢DC:插入亚端粒异染色质的P元件的反式沉默涉及果蝇Polycomb群基因,zeste增强子。遗传学。1998,149:1839-1855。gydF4y2Ba
- 33。gydF4y2Ba
霍利克·杰比,Patterson GI, Asmundsson IM, Chandler VL:变型改变玉米pl基因座的调控。遗传学。2000,154:1827-1838。gydF4y2Ba
- 34.gydF4y2Ba
Elmayan T, Vaucheret H:强表达35S转基因的单拷贝表达可以在转录后沉默。植物学报1996,9:787-797。10.1046 / j.1365 - 313 x.1996.9060787.x。gydF4y2Ba
- 35.gydF4y2Ba
Vaistij FE,琼斯L,Baulcombe DC:的RNA靶向和在RNA沉默DNA甲基化需要的靶基因和推定的RNA依赖性RNA聚合酶的转录传播。植物细胞。2002年,14:857-867。10.1105 / tpc.010480。gydF4y2Ba
- 36.gydF4y2Ba
陈志强,陈志强:植物rna介导基因沉默的研究进展。acta botanica sinica(云南植物学报),1998,37(3):449 - 462。10.1023 /: 1005946720438。gydF4y2Ba
- 37.gydF4y2Ba
Wassenegger M: rna导向的DNA甲基化。植物学报。2000,43(4):497 - 503。10.1023 /: 1006479327881。gydF4y2Ba
- 38.gydF4y2Ba
Mette MF, Aufsatz W, van der Winden J, Matzke MA, Matzke AJ:由双链RNA触发的转录沉默和启动子甲基化。Embo J. 2000, 19: 5194-5201。10.1093 / emboj / 19.19.5194。gydF4y2Ba
- 39.gydF4y2Ba
Sijen T, Vijn I, Rebocho A, van Blokland R, Roelofs D, Mol JN, Kooter JM:转录和转录后基因沉默在机制上相关。生物谷学报,2001,11:436-440。10.1016 / s0960 - 9822(01) 00116 - 6。gydF4y2Ba
- 40。gydF4y2Ba
Jones L, Ratcliff F, Baulcombe DC:在植物中,RNA导向的转录基因沉默可以独立于RNA触发而遗传,需要Met1来维持。柯尔柏。2001,11:747-757。10.1016 / s0960 - 9822(01) 00226 - 3。gydF4y2Ba
- 41。gydF4y2Ba
von Arnim Ag,邓XW:拟南芥的光灭活光致压缩抑制因子COP1涉及细胞特异性调节其核细胞质分配。细胞。1994年,79:1035-1045。gydF4y2Ba
- 42。gydF4y2Ba
邓晓伟,王志强:转基因植物中绿色荧光蛋白融合蛋白的克隆载体。基因。1998,221:35-43。10.1016 / s0378 - 1119(98) 00433 - 8。gydF4y2Ba
- 43。gydF4y2Ba
王志强,王志强,王志强:拟南芥COP1的分子结构。通过片段互补重建活性和植物核定位信号的突变分析。植物生理学124:979-990。10.1104 / pp.124.3.979。gydF4y2Ba
致谢gydF4y2Ba
我们感谢金秉勋和安德里亚斯Nebenführ对手稿的评论。这项工作得到了美国能源部基础能源科学基金DE-FG02-9622023的部分支持。gydF4y2Ba
作者信息gydF4y2Ba
隶属关系gydF4y2Ba
通讯作者gydF4y2Ba
附加信息gydF4y2Ba
作者的贡献gydF4y2Ba
HQ设计实验,并收集数据基础图gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba5gydF4y2Ba, 和gydF4y2Ba6gydF4y2Ba和表gydF4y2Ba1gydF4y2Ba来gydF4y2Ba3.gydF4y2Ba.AGVA为数字提供数据gydF4y2Ba2gydF4y2Ba,gydF4y2Ba4gydF4y2Ba和gydF4y2Ba5gydF4y2Ba最后定稿。两位作者阅读并批准了手稿。gydF4y2Ba
作者为图像提交的原始文件gydF4y2Ba
下面是作者提交的原始图片文件的链接。gydF4y2Ba
权利和权限gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
秦,H.,Von Arnim,A.G.拟南芥跨阴谋轨迹的表观遗传历史和转发灭菌活动的继电器的测试。gydF4y2BaBMC植物杂志gydF4y2Ba2,gydF4y2Ba11(2002)。https://doi.org/10.1186/1471-2229-2-11gydF4y2Ba
已收到gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
迪伊gydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/1471-2229-2-11gydF4y2Ba
关键字gydF4y2Ba
- 目标轨迹gydF4y2Ba
- 转录基因沉默gydF4y2Ba
- 右边框gydF4y2Ba
- 表观遗传活动gydF4y2Ba
- 主轨迹gydF4y2Ba