抽象的
背景
颗粒轰击技术已成功地应用于一般谷物,特别是小麦中获得转基因。这些手术大多使用不成熟的胚胎,全年都无法获得。本研究以成熟种子为起始材料,利用六倍体小麦和四倍体小麦的愈伤组织表现出较高的再生反应,因此可用生物学方法作为遗传转化的目标组织。
结果
面包小麦(Triticum aestivum, cv.)的成熟胚愈伤组织。CPAN1676)和硬粒小麦(T. durum, cv.)PDW215)的靶距为6 cm,用1.1金微弹包覆pDM302和pAct1-F进行二次轰击。以bar基因为探针进行Southern分析,发现转基因在T0转化子中整合。bar基因在T0代和T1代都有活性,这是由磷霉素叶漆试验证明的。aestivum和T. durum的原代转化子分别约有30%和33%可育。利用bar基因特异性引物对发芽苗进行PCR分析,证实bar基因已传递到T1代。
结论
结核杆菌的转化频率为8.56%,硬结核为10%。随后,利用优化后的方法将编码晚胚发生丰富蛋白(HVA1)的大麦基因导入aestivum和T. durum。在小麦T0代和硬小麦T0和T1代中,Southern分析证实了HVA1转基因的存在。
背景
小麦是人类最丰富的能源和营养来源之一。种植的小麦中95%是六倍体小麦,用于制作面包和其他烘烤产品,其余5%是硬粒小麦(四倍体小麦),主要用于制作意大利面和通心粉(看到[4]).尽管用天然植物遗传工程师共同培养已经实现了小麦的稳定转化根癌土壤杆菌或者是粒子轰击法,粒子轰击法正在成为引种重要农艺基因的选择方法,用于品质改良、分子嫁接、核雄性不育工程、转座子标记、抗旱、真菌和害虫(详情请参阅)看到, (27]).
迄今为止,大多数小麦转化的研究都集中在少数模式品种上,所采用的程序需要持续提供未成熟的胚胎,这很难全年实现,除非利用温室种植的植物。因此成熟胚胎是产生愈伤组织的替代外植体,可作为遗传转化研究的目标组织[13.]。成熟胚衍生愈伤组织的再生反应也与未成熟胚衍生愈伤组织的再生反应相当。本研究旨在为印度面包小麦和硬粒小麦品种的转化提供一种有效的方法。愈伤组织来自于栽培品种CPAN1676的成熟胚t . aestivum和PDW215t .硬质根据其高再生潜力,选择其进行遗传转化实验。一种共同的方案是引入标记基因结构到两者t . aestivum和杜伦姆。优化后的方案随后被用于引入一个编码胚胎晚期丰富蛋白的大麦基因(HVA1)已知赋予干旱压力的耐受性t . aestivum和杜伦姆。
结果与讨论
小麦早期通过粒子轰击不成熟的胚胎转化,但是,转化频率仍然低(通常为0.1-2.5%),并且已经进行了各种尝试来增强频率[1,7,8,10.,21,22,33- - - - - -36,38,39]。小麦转化实验的成功率低,因此需要全年大量使用外植体,而用未成熟胚作为目标组织是很难实现的。表现出与未成熟胚胎相当的再生反应的成熟胚胎[17.,23- - - - - -25因此被选为在本研究期间作为转化研究的起始外在植物。早期从我们的实验室表明了成熟胚胎作为小麦转化的起始植物的适用性,对于机械隔离胚胎的细胞渗透性,具有膜透化剂的细胞渗透[18.]而对于农杆菌属- 导明的转化[28]。
鉴定具有相对高胚胎响应的外植体/品种是任何转化努力的最关键因素之一。基于更高的再生反应,品种CPAN1676t . aestivum和PDW215t .硬质选择用于遗传转化实验(未提出的数据)。
作为可选标记和GUS作为报告基因的选择介绍
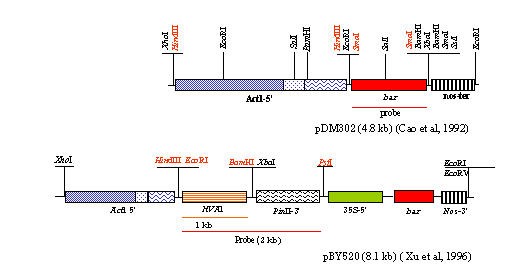
朝向实现除草剂抗性t . aestivum和t .硬质,质粒构建PDM302(ACT1-BAR-NOS)和PACT1-F(图。1)通过粒子轰击在MSE2上以成熟的胚衍生的Calli共转化。未转化的Calli没有显示MSERP的任何增长2.5(无花果。2 b)来对抗被轰击的愈伤组织(图。2摄氏度).为了消除逃逸的可能性以及还用于射击伸长率,再生植株在补充有2.5mg / L膦酸的半强度MS培养基上生长(图。二维&2 e).在747和350个外植体中小麦和t .硬质分别回收了共同激活的,64和35种植物。通过膦腈叶片涂料测定分析所得推定的转化体(图。2 f).功能性植物酒吧基因被认为是转化体。在多次实验的基础上计算了转化效率,分别为8.56%和10%t . aestivum简历。CPAN1676和t .硬质简历。分别PDW215。再生植株移栽到盆栽中进行成熟和硬化。
遗传转化的t . aestivum和t .硬质以成熟胚愈伤组织为靶组织进行粒子轰击。用pDM302/pAct1-F或pBY520或pBI101::Act1轰动愈伤组织。一个.成熟胚源性愈伤组织t .硬质显示组织化学本地化格斯pAct1-F/pDM302基因轰击后2天,基因活性增强。B和C.分别对处理和控制外植体,分别对补充有2.5mg / L膦素的再生培养基。D&E..推定的转化体t . aestivum和杜姆兰,分别在添加了2.5 mg/l磷菊酯的半强度MS培养基上生长。F.磷素叶油漆测定;转化体(左),控制(右)。G和H.推定的转化体t . aestivum和t .硬质,分别。我.在0转基因植物的t .硬质用py520轰炸后获得。J.T1的后代植株t .硬质与pBY520轰炸。
转化株的筛选
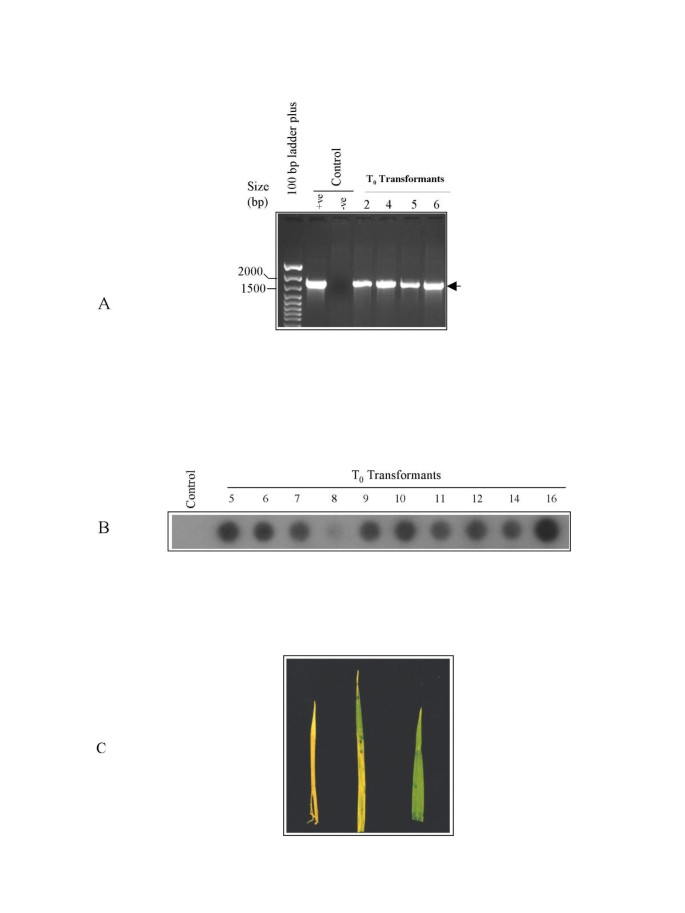
为了确认初级转化体中转基因的存在,通过特异性引物通过基因组DNA的PCR扩增测试了多种转化体。格斯,《不扩散核武器条约》二世和酒吧基因。在含有未转化植物基因组DNA的样品中未检测到扩增产物。PCR分析结果也与磷霉素叶漆分析结果一致。的格斯通过存在〜1711bp的扩增产物鉴定阳性植物(图3).转化子的PCR分析n特异性引物检测到扩增产物约721 bp(数据未显示)。的nII型转化子的阳性状态也被证实NPTII.点印迹分析(图3 b),并在叶片上喷洒巴罗霉素(图3 c).经PCR检测呈阳性的植株,喷施磷菊酯对植株无明显损伤,显示了其功能活性nII基因,而未转化对照和少数推定转化植株的叶片出现黄斑。
目前的结果证明了一个有效的选择制度的重要性。使用膦酸菊酯作为选择剂不干扰再生过程。为了消除脱氢菌,将假定转化子在含有2.5 mg/l磷菊酯的半强度MS培养基上进行茎长培养2 e).高转化效率的原因可能归因于优化的再生方案和用于恢复转化体的有效选择程序(粒子轰击后8-10周)。我们的结果支持Altpeter等人的观察结果。(1996A),通过减少生产转基因植物的总时间报告了增强的转化效率。使用未成熟的胚胎作为目标外植体,Takumi和Shimada(1996)还报告了靶向组织在稳定转化效率之前培养持续时间的积极影响。在本研究中,在轰击之前,在新鲜的MSE 2培养基上培养两周历史的成熟胚胎衍生的愈伤组一周,导致高转化效率(高达10%),如每百百人再生的转基因植物所示calli。
T的南方分析0转化株
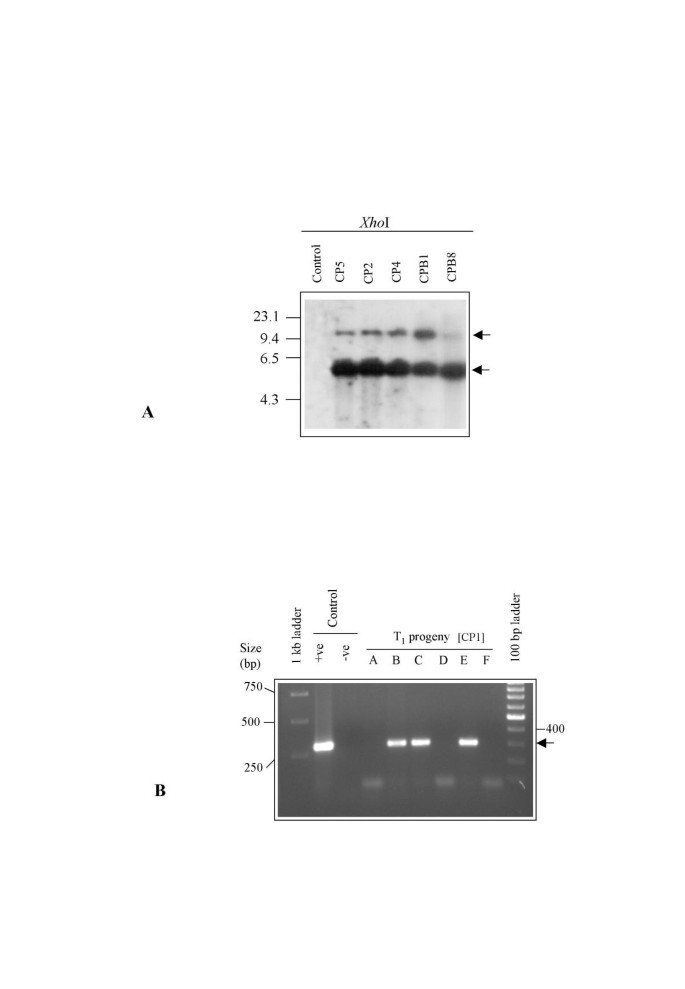
T0转化体t . aestivum和t .硬质pDM302转化的品种经Southern分析确认酒吧具体的调查。基因组DNA样品的消化hdIII,检测到一个~3.3 kb的杂交带,该杂交带对应于载体骨干酒吧编码区和n终结者。消化T的基因组DNA0转换器的CPAN1676与XHO.I,在pDM302中只切割一次,与0.6 kb杂交SmapDM302的I片段。在5个独立株系中,有4个株系含有2个条带,一个是预期的~4.8 kb条带,另一个是6.5 kb以上的条带,而CPB8株系只含有一个~4.8 kb左右的条带(图)。4).在测试的各种线路中酒吧在CP2、CP5、CP4和CPB1 4个品系中有2个拷贝,在CPB8中有1个拷贝。在三个变压器中相似大小的频带是有趣的。在这个阶段,我们只能推测它们可能是从一个普通的克隆体中产生的。因此,在这方面需要进一步的调查。同样,从12个独立的株系中分离出基因组DNAt .硬质简历。PDW215和消化用hDIII并探测0.6 kB酒吧片段。所有转基因株系均含有预期的3.3 kb条带,该条带在pDM302酶切后释放hdIII(未提供数据)。在放射自显影上也可以看到小于2 kb到6.5 kb的波段,这可能是由于多重整合所致。
后代分析
代表性的T.0转基因的t . aestivum选择14种种子,并选择(CP1)进行后代分析。在获得的14种种子中出现九种种子中的九个正常而另一个种子形成不良。种子在选择自由半强度MS培养基上发芽。经过四天,六个幼苗(A-F)发芽,转移到用于建立根系的转移塞。由于与来自对照种子的幼苗的生长较慢,因此在该阶段没有施加选择压力。在膦素叶片涂料测定之前,从10天旧的小叶片分离出基因组DNA1工厂。T1使用特异性引物的后代酒吧结果显示,在6个被检测的子代植株中,有3个植株中存在转基因4 b).发现PCR筛选(七天后)的结果与叶漆测定的观察到一致。
HVA1基因在aestivum和T. durum中的引入
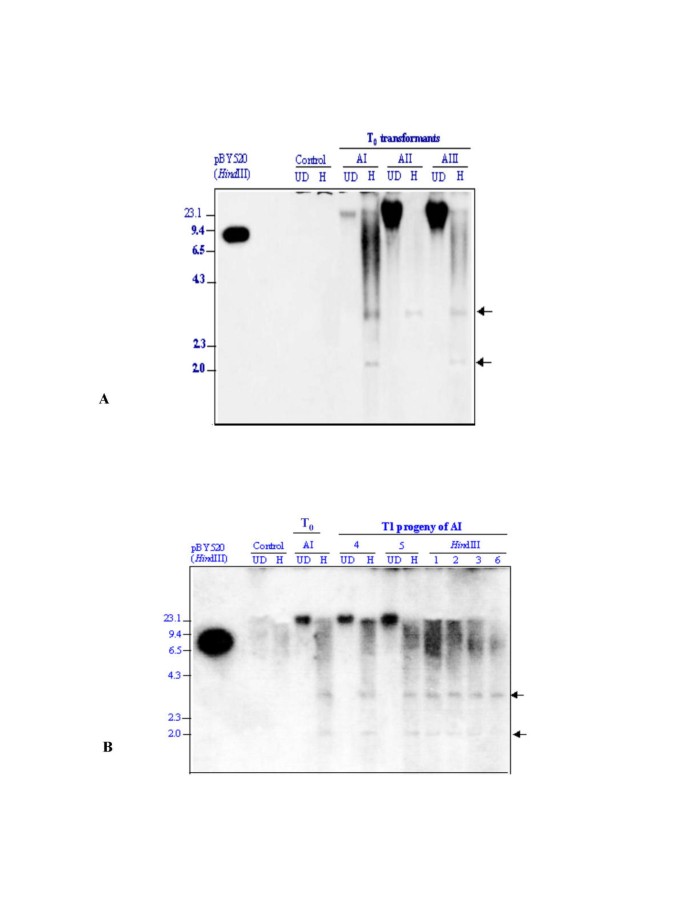
优化的转化方案被用于引入大麦胚胎发生晚期丰富蛋白(HVA1),已知赋予水缺乏耐受性的耐受性[32]。成熟胚来源的愈伤组织t . aestivumCV CPAN1676和t .硬质用质粒py520轰击CV PDW215。通过采用先前优化的粒子轰炸推定转化体的优化方法t . aestivum和t .硬质(图2 g&2 h).共培养的愈伤组织258株和287株中,获得了20株和30株植株,频率分别为7.7和10%。集成的Hvai.将基因导入小麦基因组HVA1编码区域作为探针。两个代表性植物的基因组DNAt . aestivum简历。CPAN1676被消化了hdIII。初级转化体的DNA印迹t .硬质用2 kb片段(pBY520)检测cv PDW215HVA1编码区域 -pin2-3'区域终结者确认转基因的整合。T.0转化体ai(t .硬质),选择它进行后代分析,因为它产生了16个看起来正常的种子,与对照种子样品相比较。这些植物的基因组DNA被消化hdIII和P32标记为HVA1-PIN23》片段。自辐射图上观察到的大部分植物的杂交模式与其T0父母(图5A&5B.)表明综合基因的稳定性。
在转基因植物中过表达第3组LEA蛋白的基因,有可能提高植物在环境胁迫下的存活率。HVA1aba反应基因是从什么地方分离出来的大麦芽[12.[编码第3组Lea蛋白,已成功用于稻米的工程[37]和小麦[32耐旱能力。后一组达到高水平的表达HVA1基因,由玉米泛素启动子调节在独立转基因小麦植物的叶片和根部,其遗传到后代。T.3.在土壤水分亏缺条件下,世代表现出较好的生长特性。关于对干旱条件的耐受性,在目前的情况下,在对各种转化子进行详细的分子分析之后,将在不久的将来进行试验。
结论
硬粒小麦被认为比面包小麦更顽固,到目前为止,只有两份关于其转变的报告存在[2,11.]。这两份报告还使用未成熟的胚胎衍生的外植体作为用于递送标记基因的靶组织[2和高分子量谷蛋白亚基(HMW-GS)基因[11.]。在本调查中,我们能够将标记基因与高转化频率成功地将标记基因引入面包小麦和硬质小麦。目前的研究也实现了引入酒吧和HVA1基因进入t .硬质通过粒子轰炸。本研究中获得的所有转化线显示了可选标记基因的功能活性(酒吧和nII基因)。对面包和硬粒小麦所采用的遗传转化方法是相同的,因此这一系统也有可能扩展到其他基因型。因此,目前的努力是令人鼓舞的,并进一步深入分析了两者的一体化和隔离模式t . aestivum也t .硬质将为用具有农艺重要性的基因改造印度面包和通心粉小麦铺平道路。
方法
材料和方法
植物材料和培养条件
的种子小麦简历。CPAN1676和Triticum杜伦姆简历。PDW215获自印度哈里亚纳邦哈里亚纳邦的小麦研究局获得。基于他们的在体外分化反应这些品种被选择用于遗传转化实验。通过无菌叶片从表面灭菌的种子切除成熟的胚胎,并接种在含有Mse2培养基的汽油液中(表1).将外植体在26±2℃下在黑暗中培养两周,并在16小时的光周期下保持在26±20℃,光强度为100-125mmols m-2年代-1由荧光管灯(Philips India Ltd.)提供。再生的Calli与硬化的氏菌分离,以进一步脱培喂。在MSE2上将两周历史的Calli传代培养一周,并在轰炸之前布置在90毫米的Petriplate中心。在实验后的后续阶段使用的各种介质列于表中我.
向量
质粒载体pdm302 [5]和pact1-f [19]受雇于交付酒吧和格斯基因分别是可选择和可批量标记物(图。1).质粒载体pBY520 [37有大麦HVA1基因在水稻的控制下ACT1.5的启动子和pin2- 铁门;和酒吧在35S启动子的控制下,作为可选择的标记n终结者。对于二元载体pBI101::Act的构建,水稻ACT1.从质粒pDM302中切出1.5 kb的-5'区后III片段在载体pBI101 (Clontech)中克隆。质粒经csl - etbr密度梯度离心,按照标准方案进行大规模分离纯化[30.]。
粒子轰击,选择和再生转化体
根据Sanford et al., [31]。根据制造商说明,使用Biolistic PDS-1000/He粒子输送系统(Biorad,美国),在1100 psi氦气压力和6 cms靶距下,用合适的质粒DNA包被微弹轰击外植体两次。轰击24 h后,愈伤组织转移到MSE2P5或MSE2Pm100.(见表我),两周后传代。愈伤组织在含2,4- d的选择培养基(MSE2P)上培养3周5或MSE2Pm100.),然后转移到再生培养基(MSERP2.5和MSERPm50),然后再免费接种7-10天。再生植株转入半强度MS培养基[20.添加2.5 mg/l磷霉素或25 mg/l巴罗霉素。再生苗最终被转移到苗盘上的移植插(Sigma)。生根苗被转移到含有土壤硅石(Kel Perlite,印度班加罗尔)和花园土壤(1:1)的花盆中,并在生长室(Conviron, Control Environments Limited, Winnipeg,加拿大)中生长至成熟,在21/18°C、16/8小时的光照/黑暗周期下工作。这些植物被提供了一种液体培养基[15.[建议用于小麦幼苗生长。
GUS组织化学测定
根据杰斐逊等人描述的议定书,记者基因活性在轰击的外植体中组织化学定位,[14.]。组织化学定位是通过将组织样本置于37℃的组织化学缓冲液[0.1 M磷酸钠缓冲液,pH 7.0;50 mM EDTA, pH 7.0;0.5毫米K3.铁(CN)6, 0。5毫米K4铁(CN)6, 0。1% Triton x - 1001 mg/ml X-gluc (Amresco Inc., Ohio, USA)。用70%乙醇彻底清洗外植体,然后用立体变焦显微镜(SMZU,尼康)进行观察。
nptII化验
n2功能分析
功能分析NPTII.根据Cheng等人的描述,[6]。3叶期小麦苗喷施2% (w/v)的巴洛霉素溶液和0.1%的吐温-20溶液。或者,用巴洛霉素溶液用棉花芽在叶尖上涂上1-2厘米的部分。应用巴罗霉素7天后观察疗效。
nptII点印迹试验
的nII根据Roy和Sahasrabuddhe的协议进行点印迹测定[29]。研究…的表达nII在叶片组织中,冷冻样品(~50 mg)在微离心管中使用液氮和200 μl提取缓冲液(100 mM Tris-Cl, pH 7.0, 10 mM EDTA, pH 7.0;特里同x - 100)的0.1%。蛋白质定量是根据Bradford [3.]。将含有10 μg蛋白质的粗提物与提取缓冲液共混至50 μl,再与100 μl检测缓冲液(100 mM Tris-Cl, pH 7.4;10毫米MgCl2;400μg/ ml卡那霉素硫酸盐,10μmATP,10μCI/ mL(γ-32P)ATP (3000 Ci/mmol specific activity, BRIT,印度)]在20℃下保存30分钟,然后使用点印迹仪(Schleicher and Schuell,德国)将其印迹在P81磷酸纤维素纸上(Whatman Ltd,英国)。将印迹包裹在保鲜膜中,用x射线胶片(柯达,印度)在hypercassets (Amersham,英国)中-20°C照射一段合适的时间。
膦酸菊酯叶漆测定
转基因植物的后代酒吧采用叶漆法对基因作为可选标记进行分析。按照Lonsdale等人的描述进行叶子绘画[16.]。膦腈素(150mg / L)和0.1%Tween-20的溶液在两天间隔内每周施加三次。与对照相比,没有坏死的伤害被认为是表达的证据酒吧转基因。
DNA孤立与南方分析
根据delaporta等人的研究,从小麦叶片中分离出总基因组DNA [9]。用适当的限制酶消化10至15微克基因组DNA,并在1%琼脂糖凝胶上分离并呈上尼龙膜(卫生间N,Amersham,UK)。探测器的存在格斯和酒吧基因。的格斯探针被切除Bam你好-囊我的pact1f片段跨越格斯编码区域,以及酒吧基因探针来源于pDM302,长度约0.6 kbSmaI跨越的片段酒吧编码区。使用Megaprime DNA标签试剂盒(Amersham International Inc, UK)和[α-]对探针进行放射性标记32P)根据制造商的规格,ATP(英国,海德拉巴,印度)。在37℃下在40rpm下振荡进行杂交16-24小时。按顺序洗涤印迹,通过以下溶液10分钟,每(i)50%甲酰胺,5×SSC,0.1%SDS;(ii)2x SSC,0.1%SDS;(iii)1x SSC,0.1%SDS;(iv)0.5 xssc,0.1%SDS。
基因组DNA的PCR分析
基因组DNA的PCR分析使用200-300 ng小麦基因组DNA,使用MBI Fermentas(美国)的试剂,按照制造商说明,反应体积为25 μl。PCR扩增采用perkins - elmer Gene Amp PCR system 2400进行,94°C初始变性(5 min hold), 94°C (30 s),退火(30 s), 72°C (30 s), 72°C保留(7 min) 25个循环。用正向引物和反向引物进行扩增酒吧基因分别为5'-ACC ATC GTC AAC CAC TAC ATC G-3' (酒吧5)和5'-TCT TGA AGC CCT GTG CCT C-3'(酒吧3).用于检测的引物格斯5’-ATC AGC GTT GGT GGG AAA GC-3’(格斯5)和5'-Cat TGT TTG CCT CCC TGC TG-3'(格斯3);为了放大nII基因分别为5’-TCG GCT ATG ACT GGG CAC AAC AGA-3’(nF)和5'-AAG AAG GCG ATA GAA GGC GAT GCG-3' (nr)分别。增值的退火温度酒吧,Gus.和nII基因分别为50℃,53℃和57℃。PCR产物在1x TAE中的1.6%琼脂糖凝胶上运行(Gensuler™1 KB梯子和Gensuler™100 BP Ladder Plus,MBI Fermentas,USA)。
参考文献
- 1。
Altpeter F,Vasil V,Srivastava V,Stögere,Vasil Ik:加速生产转基因小麦(小麦L.)植物。植物细胞批准。1996,16:12-17。10.1007 / S002990050166。
- 2.
Bommineni VR,JAUHAR PP,Peterson TS:转基因杜伦姆小麦通过微妙的弹出轰击孤立的scutella。j eredity。1997,88:301-313。
- 3.
Bradford MM:一种利用蛋白质-染料结合原理的快速、灵敏的微量蛋白质定量方法。生物化学学报。1976,72:248-254。10.1006 / abio.1976.9999。
- 4.
Bushuk W:小麦最终产品育种。植物学报,1998,19(3):457 - 457。10.1023 /: 1018368316547。
- 5.
曹军,段旭,麦尔洛伊,吴锐:转基因水稻抗除草剂细胞微弹介导的再生。植物营养与肥料学报,1992,11:586-591。
- 6。
程M,Fry Je,Pang S,周H,Hornaka Cm,Duncan Dr,Conner TW,WAN Y:小麦遗传转型根癌土壤杆菌.植物营养与肥料学报。1997,19(4):591 - 598。
- 7。
Chugh A,Khurana P:除草剂的抗性转基因面包小麦(t . aestivum)及二粒小麦(T. Dicoccum.)通过粒子轰炸和农杆菌属介绍的方法。Curr SCI。2003,84:78-83。
- 8。
ChuGh A,Khurana P:通过叶片基底段和面包小麦和emmer小麦的遗传转化进行体细胞胚胎发生再生。植物细胞组织与器官文化。2003,74:151-161。10.1023 /答:1023945610740。
- 9。
Dellaporta SL,Wood J,Hicks JB:植物DNA小型分析:II版。植物mol biol rep。1983,4:19-21。
- 10。
Harvey A,Moisan L,Lindup S,Lonsdale D:从Scutellum Callus重新生成的小麦作为转化材料来源。植物细胞组织器官培养。1999年,57:153-156。10.1023 /答:1006344615666。
- 11.
He GY, Rooke L, Steele S, Bekes F, Gras P, Tatham AS, Fido R, Barcelo P, Shewry PR, Lazzeri PA:意面小麦的转化(小麦属植物turgidumL. var.杜伦姆),具有高分子量谷蛋白亚基基因和面团功能修饰。中国生物医学工程学报。1999,5:377-386。10.1023 /: 1009681321708。
- 12.
Hong B,Uknes SJ,HO T-HD:编码MRNA在大麦葡萄球菌层中快速诱导mRNA的cDNA的克隆和表征。植物mol biol。1988,11:495-506。
- 13.
农杆菌介导的二粒小麦成熟期和未成熟胚的再生及基因瞬时表达研究(小麦Schuble)。中国农业科学。2002,40:1295-1303。
- 14.
杰斐逊雷,卡瓦曼·塔,Bevan MW:GUS Fusions:β-葡萄糖酶作为高等植物中的敏感和多功能基因融合标记物。Embo J. 1987,6:3901-3907。
- 15.
Lee B,Murdoch K,Kreis M,Jones MGK:一种规模转化谷物的大规模后代筛选方法。植物MOL BIOL REP。1989,7:129-134。
- 16.
Lonsdale DM,Lindup S,Moisan LJ,Harvey AJ:使用萤火虫荧光素酶识别轰炸小麦瘢痕疙瘩组织中的瞬态到稳定表达的过渡。physiol植物。1998,102:447-458。10.1034 / J.1399-3054.1998.1020313.x。
- 17。
小麦、大麦、燕麦、黑麦和小黑麦的细胞培养、体细胞胚发生和植株再生。在:谷物组织和细胞培养。编辑:Bright SWJ, Jones MGK。1985, Martinus Nijhoff, Dordrecht, 131-174。
- 18。
Mahalakshmi A,Chugh A,Khurana P:通过细胞渗透和外源性渗透的外源性DNA吸收,小麦Zygotic胚胎中的外源基因的表达。植物生物技术。2000,17:235-240。
- 19。
McELROY D,张W,CAO J,WU R:高效肌动蛋白启动子用于水稻转化的分离。植物细胞。1990年,2:163-171。10.1105 / TPC.2.2.163。
- 20。
利用烟草组织培养快速生长和生物测定的改良培养基。植物科学学报,1996,15:473-497。
- 21。
Nehra NS, Chibbar RN, Leung N, Caswell K, Mallard C, Steinhauer L, Baga M, Kartha KK:利用微弹轰击分离的盾状组织再生自育转基因小麦植株,具有两个不同的基因结构。植物学报1994,5:285-297。10.1046 / j.1365 - 313 x.1994.05020285.x。
- 22。
Ortiz JPA,Reggiardo Mi,Ravizzini Ra,Altabe SG,Cervigni Gdl,Spitteler Ma,Morata MM,Elias Fe,Vallejos Rh:潮霉素抵抗作为小麦稳定转化的有效选择标记。植物细胞代表1996,15:877-881。10.1007 / S002990050140。
- 23。
冬小麦成熟胚培养的愈伤组织诱导及植株再生小麦L.)基因型。植物细胞批准。1996,18:331-335。10.1007 / S002990050581。
- 24.
Ozgens M,Turet M,Ozcan S,Sanzak C:冬季杜伦特小麦基因型未成熟和成熟胚胎的愈伤组织诱导和植物再生。植物育种。1996,115:455-458。
- 25.
Ozias-Akins P, Vasil IK:成熟胚愈伤组织的诱导和生长。原质体。1983,115:104-113。
- 26.
Patnaik D:再生和遗传转化的研究小麦和Triticum杜伦姆通过农杆菌属共培养和粒子轰击。博士学位论文。印度德里大学。2000
- 27.
陈志强,王志强。小麦生物技术研究进展。生物技术学报。2001,4:1-29。[http://www.ejb.org/content/vol4/issue2/full/4/]。
- 28.
Patnaik D,Vishnudasan D,Khurana P:农杆菌属介导的成熟胚胎的转化小麦和Triticum杜兰姆。2001年。
- 29。
一种检测新霉素磷酸转移酶II的高效液相色谱方法(NPTII.) 基因表达。植物mol biol。1990,14:873-876。
- 30.
Sambrook J,Fricsch EF,Maniatis T:分子克隆。实验室手册。冷泉港实验室新闻,冷泉港,纽约。1989年
- 31。
Sanford JC, Smith FD, Russell JA:优化不同生物应用的生物学过程。方法酶法。1993,217:483-509。
- 32。
Sivamani E,Bahieldin A,Wraith JM,Al-Niemi T,Dyer We,Ho TDH,Qu R:改进的生物量生产率和水资源使用水缺陷条件下的转基因小麦体组成麦基的情况下HVA1基因。植物SCI。2000,155:1-9。10.1016 / s0168-9452(99)00247-2。
- 33。
Takumi S,Shimada T:通过粒子轰击的粒子轰击转基因小麦的生产:频率受培养持续时间的影响。J植物理性。1996,149:418-423。
- 34。
Vasil V, Castillo AM, Fromm ME, Vasil IK:利用微弹轰击可再生胚性愈伤组织获得抗除草剂的可育转基因小麦植株。生物技术。1992,10:667-674。
- 35。
周JT,安德森OD,Blechl AE:快速生产多种独立的肥沃转基因小麦(小麦).植物生理学报。1993,32(4):591 - 598。
- 36.
Witrzens B,Brettell Ris,Murray Fr,Mcleroy D,Li Z,Dennis Es:三种可选择标记基因的微粒轰击的三种选择标记基因的比较。AUST J植物理体。1998年,25:39-44。
- 37.
徐D,段X,王B,洪B,HO THD,Wu R:晚期胚胎发生的表达丰富的蛋白质基因HVA大麦赋予转基因水稻耐水分亏缺和盐胁迫的能力。植物营养与肥料学报,1996,19(4):429 - 434。
- 38.
张L,Rybczynski JJ,Langenberg WG,Mitra A,法国R:高效的小麦转化程序:转化的Calli与植物再生的长期形态发生潜力。植物细胞代表2000,19:241-250。10.1007 / S002990050006。
- 39.
Zhou H, Arrowsmith JW, Fromm ME, Hironaka CM, Taylor ML, Rodriguez D, Pajeay ME, Brown SM, Santino CG, Fry JE:耐草甘膦CP4和GOX基因在小麦转化中的选择标记。植物营养与肥料学报,1995,16(5):513 - 514。
确认
这项工作得到了印度政府生物技术部的财政支持,对此我们深表感谢。我们感谢曹军博士、段晓兰博士、David McElroy博士和Ray Wu博士构建了pDM302质粒;感谢Tuan Hua博士David Ho和Ray Wu博士为我们提供了质粒pBY520。DP希望感谢科学和工业研究理事会授予SRF(NET)。
作者信息
隶属关系
通讯作者
作者为图像提交的原始文件
权利和权限
关于这篇文章
引用这篇文章
帕特奈克,D,库拉纳,P.印度面包的遗传转化(t . aestivum)和意大利面(t .硬质小麦成熟胚愈伤组织的粒子轰击。BMC植物杂志3.5(2003)。https://doi.org/10.1186/1471-2229-3-5
已收到:
接受:
发表:
关键字
- 硬质小麦
- 不成熟的胚胎
- 粒子轰击
- 成熟胚
- nptII基因