抽象的
背景
紫花苜蓿(紫花苜蓿)是主要的饲料作物。遗传进展,因为它的同源四倍体和异花受粉的这种豆科植物缓慢。这个物种的遗传结构,使遗传图谱的施工难度。为了达到这一目标,并能够检测分离群体的QTL,我们使用了可用的共显性微卫星标记(SSRS),在模型豆类大多认定Medicago truncatula来自EST数据库。使用特定的映射程序构建有AFLP和SSR标记的遗传图,用于自身传递运动程序。在苜蓿制图人群中分析了四元动遗传。
结果
我们已经证明,在SSR基序的每一侧限定的引物对80%M. Truncatula.EST数据库用紫花苜蓿DNA进行扩增。利用Magali和Mercedes两个杂合子亲本杂交产生的168个个体的F1定位群体,获得599个AFLP标记和107个SSR标记。除3个SSR位点外,其余SSR位点均具有明显的四体遗传。大部分SSR位点的双还原不显著。其他位点未产生特异基因型,分离畸变可能导致显著的双还原。对于每个亲本,遗传图谱包含8组4条同源染色体。Magali和Mercedes亲本的图谱长度分别为2649 cM和3045 cM,标记间的平均距离分别为7.6 cM和9.0 cM。利用SSR标记构建了覆盖709 cM的复合图谱。
结论
与二倍体苜蓿的遗传图谱相比,我们的图谱覆盖了88-100%的基因组,接近饱和。共显性标记(SSR)的遗传和各同源群标记间的连锁排斥规律与苜蓿四体减数分裂假说一致。在107个SSR标记中,除2个标记外,四倍体紫花苜蓿与紫花苜蓿染色体上的标记顺序相似M. Truncatula.基因组,表明这两个物种之间的高水平的离子性。这些地图将是苜蓿育种的有价值的工具,并用于定位QTLS。
背景
紫花苜蓿(紫花苜蓿L.)是世界上栽培的牧草,世界上大约3200万公顷[1].它的农艺价值在于其蛋白质含量高,适宜的饲养价值和良好的环境平衡(多年生和不需要氮肥)。然而,由于同源四倍体,该物种的遗传进展缓慢[2],其中2n = 4x = 32 [3.,4],其异常和品种的合成结构。遗传联系地图的发展将是对候选基因进行映射的显着突破,以寻找农艺性状的QTL,或制备标记辅助选择。这种分析需要在遗传背景或倍性水平方面上锻炼栽培材料。
在过去的几年里,在二倍体上获得了低密度连锁图谱紫花苜蓿物种复杂[5- - - - - -7].祖母植物来自CADL植物(在二倍体水平的栽培苜蓿,由栽培四倍体苜蓿产生的二倍体植物)[6]或来自自然人,交叉在子特定水平上进行[5,7].所有这些地图由89至153 rflp,RAPD或同工酶标记组成,并跨越467.5cm [7]至659厘米[6].一张密度更大的地图M. Coerulea.和m . quasifalcata,于2000年出版[8覆盖754 cM的单倍体基因组,有868个标记(主要是rapd和RFLPs)。利用82个RFLP标记,利用两个回交群体的101个个体,构建了四倍体紫花苜蓿的连锁图谱,覆盖约470 cM,仅有7个同源群[9].多态RFLP标记的数量是苜蓿四倍体水平饱和图谱形成的限制因素。
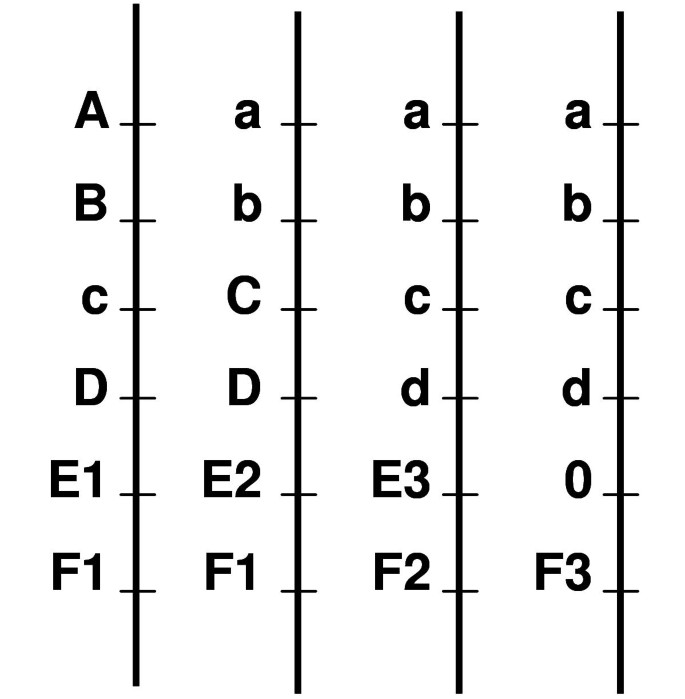
直到最近,同源多倍体植物的定位程序都是基于SDRF(单剂量限制片段)分离作为伪试验杂交分析的定位群体[10,11].同源四倍体物种的遗传图谱,如马铃薯[12,13],alfalfa [9)、茶叶(14], 玫瑰 [15,鸟足三叶草[16]和自染色体倍体物种,如甘蔗[17- - - - - -19]和草莓[20.].最近,公布了理论研究以分析基因偏析,并在自身传递物种中进行映射[21- - - - - -24]或者甚至autooctoploid物种[25].可以使用所有类型的标记:在单剂量(单剂量或SDRF)或双剂量(双链体)中存在的主要标记物,父母(双重单纯x)和Codominant标志物中存在的主要标志物(图1).现在可以根据所有共显性或显性标记来绘制同源四倍体物种的图谱,并计算配对标记之间的连锁关系,无论是在偶联阶段还是在排斥阶段。2002年发布的软件TetraploidMap [26适用于这种类型的计算。提出了一种利用模拟退火将标记排序成同源四倍体物种连锁图谱的方法[27],但没有具体的软件是目前可用。
在同源多倍体物种中,有两个事实通常是未知的:(1)整个基因组是四体遗传,还是部分基因组具有二体遗传?(2)二次折减的频率是多少?事实上,在减数分裂期间形成四价体后,两个姐妹染色单体可以在同一个配子中分离。因此,双减产生了新的配子类型,并改变了分离种群中每种配子的概率[28- - - - - -30.].它的频率可以通过共显性标记TetraploidMap软件进行计算。
在这篇文章中,我们报道了一个遗传图谱为每一个F1的人口获得父母的由交叉的个体从每个马加利和奔驰苜蓿品种和使用的建筑质量,揭示显性AFLP标记与显性微一起(SSR)标记。我们已经在使用的EST数据库确定了一系列的SSRMedicago truncatula和映射M. Truncatula.重组自交系(Huguet等等。,未发表的结果)构建苜蓿遗传地图。近年来,m . truncatula一年一度的二倍体物种Medicago属,被选为豆科的模式种[31.,32.].最近利用F2群体开发了一份遗传图谱[33.初步证据是二倍体紫花苜蓿和M. Truncatula.遗传图谱进行比对。考虑到系统发育接近M. Truncatula.和苜蓿,我们使用这些基于EST-SSR,并发表在其他一些SSR标记M. Truncatula.([34., Santoni et al. unpubl.)或紫花苜蓿[35.],建立苜蓿链接地图并对齐所有遗传图。
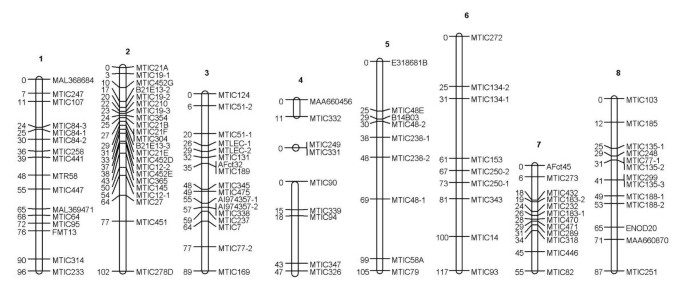
基于599个AFLP和107个SSR标记,分别鉴定出8组4条同源染色体。图谱的总长度覆盖了基因组的88%到100%。对紫花苜蓿的同源群进行了编号M. Truncatula.[8,33.].
结果
映射人口
紫花苜蓿是一种allogamous品种具有较强的近交衰退。因此,植物高度杂合和自交产生了两种自育或致命的等位基因组合还是很“弱”的植物。纯合系不能获得和F2代群体可以从由一些基因型的死亡引起的遗传偏压受到影响。所以我们的定位群体是从Mercedes4.11使用之间为母本,Magali2用作父本交叉一套168个F1个人。
AFLP标记
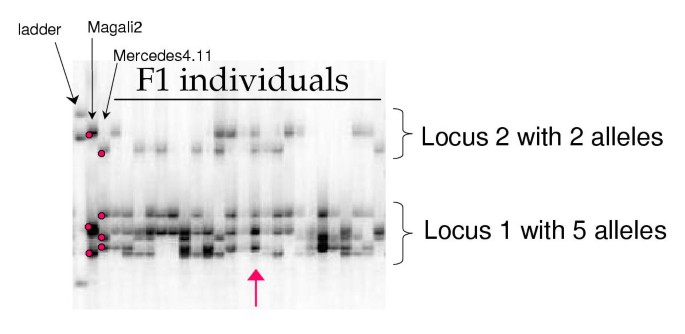
使用27 AFLP引物对,共有599个多态性标记进行评分在作图群体(表1).他们中的大多数分离为单(图1),但也有大量标记存在其他分离,主要是双链或双单链。在所有AFLP标记中,畸变标记的比例达到34.8%。
SSR标记
SSR在紫花苜蓿上的转移
SSR引物对主要来源于M. Truncatula.: 35个由Santoni等人开发([34.]和unpublish .), 1由Diwan等人出版[35.Huguet et al. [unpubl.]和187。数据)。从紫花苜蓿基因组文库中筛选出9对SSR引物[35.并在二倍体和四倍体苜蓿上进行试验。
对这232对引物进行扩增和多态性检测(见表)2).只有19%的引物对(44对)没有扩增。在81%的引物(187对)中,34%(78对)是单形的,47%(110对)是多态的。到目前为止,只有87对被用于基因分型。
SSR标记的遗传
用87对引物(表3.),共对318个等位基因(=条带)进行了评分,其中284个等位基因在定位群体中具有多态性。利用四倍体图软件的“Findgeno”程序分离每个位点的等位基因,确定亲本的基因型。单形带被排除在分离分析之外,因为单形等位基因在亲本中至少存在三倍剂量。43个位点测定亲本基因型,双减系数(α)与0无显著差异(表2)4).对于20个基因座,α显着不同于0,但父母的基因型也被发现在没有双重减少(表4).对于24个基点(表5,6),无法确定亲本基因型。从凝胶的目视阅读中怀疑不止一个位点的扩增(等位基因组之间的巨大差距被解释为存在2个不同的位点,图2)和定位群体中等位基因的分离(即存在4个以上条带的个体,或来自同一亲本的3个等位基因的个体)。从21对引物中鉴定出41个多态性位点,并进行分离分析(见表)5).父母的基因型被确定,只有6个基因座。最后对于3个底漆对(表6),可以证明多点偏析,但不可能将基因座中的等位基因与预期的隔离进行分组。对于这3个引物对,条带被视为显性标记以确定父母基因型(表6).对于显示出显着的双重减少的基因座(在表格中)4和5),所有的F1基因型都可以在没有双重还原的情况下形成。所以这些标记在F1中的分离与分离畸变没有什么不同。
在104个共显性分离的多态SSR位点中,双亲每个位点的平均等位基因数为2.9个,每个位点的平均多态性等位基因数为2.6个。这些数字必须与2个同源四倍体亲本基因型中的8个等位位点进行比较。Mercedes4.11的多态等位基因数为183个,每位点1.8个;Magali2的多态等位基因数为188个,每位点1.8个。鉴定出大量‘null’等位基因,如表所示4,5,6.
地图建设
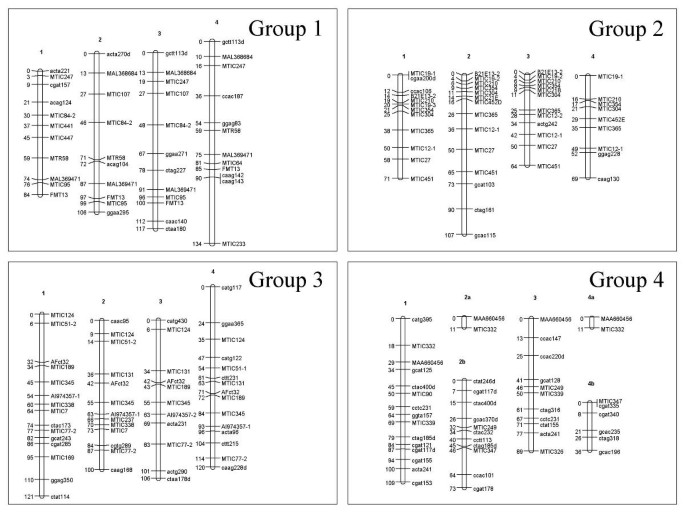
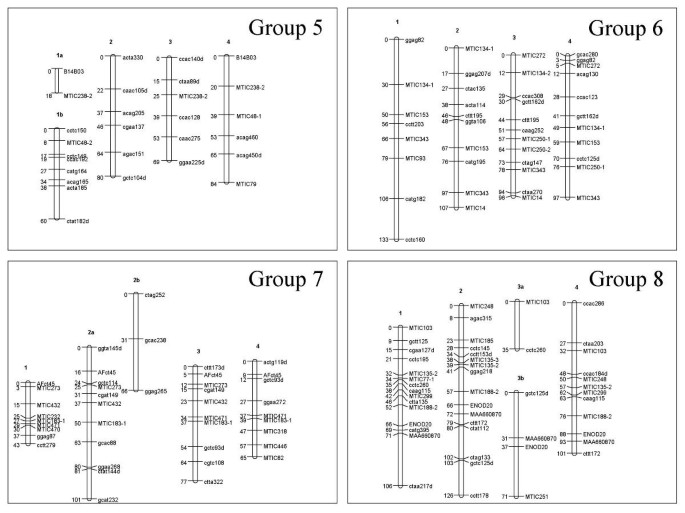
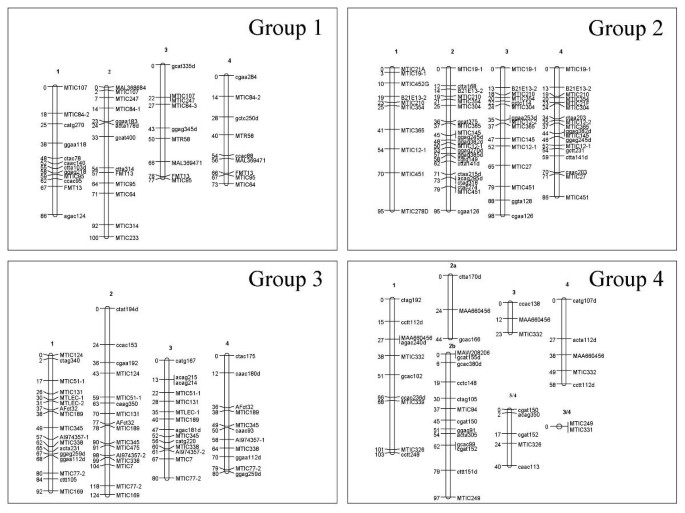
除了扭曲的双重单纯x-AFLP标记之外,所有标记(Simplex,双面,双单纯x AFLP和多等位基因SSR基因座)用于构建地图。地图结构是在3个步骤中进行的。首先,TetraploidMap计算出χ2标记间的独立性检验,得出每个亲本有8个同源群。然后在每个同源组内,无论标记的剂量如何,四倍体图决定标记之间的连锁期、重组率和LOD评分。同源群中的连锁群(即染色体)是利用连锁相信息手工识别的。在Mercedes4.11和Magali2中,除了同源群5在Magali2中只有3个连锁群外,每个同源群都有4个连锁群。最后,在JoinMap软件中输入每个连锁组的重组率和LOD评分[36.].标记的顺序计算和绘制地图。对于Mercedes4.11(图3.),地图长度为3045 cM,标记位置339个,标记间平均距离为9.0 cM。Magali2的地图(图4)覆盖2649厘米,有350个标记位置,标记之间的平均距离为7.6厘米。在这两张图谱中,扭曲的标记遍布整个基因组。
梅赛德斯4.11的遗传联系地图,同源群1至4。梅赛德斯4.11是四倍体苜蓿中F1映射群的女性父母。每个盒子包含一个组的同源染色体。这些群体与...类似地编号M. Truncatula.(T. Huguet,未发表数据)和二倍体紫花苜蓿(g .吻,珀耳斯。通讯)。每组内的染色体被从1到4任意编号,并按M. Truncatula..当JoinMap软件在2或3中拆分一个染色体的地图时,每个链接组都由数字命名为字母。染色体左侧的数量是指来自顶部的遗传距离(Kosambi cm)。染色体右侧的数量是指标记名称。SSR标记以小写字母为大写和AFLPS。AFLP标记后跟“D”具有扭曲的隔离。当几个SSR基因座来自单个引物对时,它们的名称由引物对的名称组成,然后是数字。
梅赛德斯4.11的遗传联系地图,同源群5至8。看到图中的传说3..
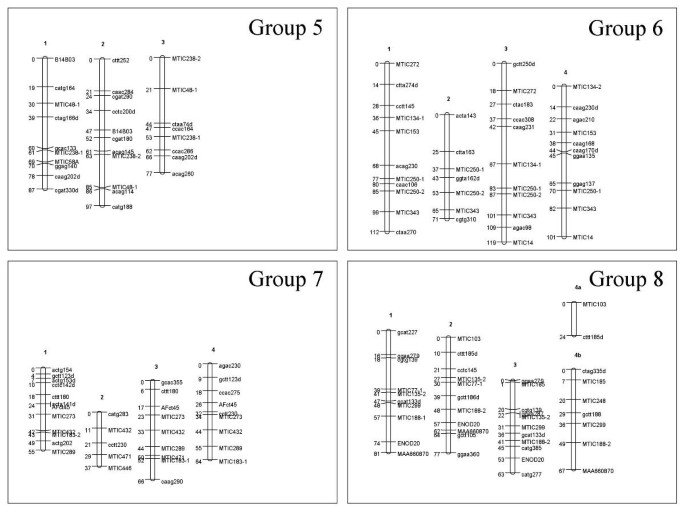
排斥键在一对同源组内的每对染色体中分布,并且对每个同源组观察到这一切(图5在Magali2例如用于同源性组8)。
马加利2号的遗传连锁图谱,同源群1 ~ 4。Magali2是Tetraploid alfalfa中F1映射群的雄性父母。看到图中的传说3..在组4中,连接基团编号为“3/4”表示,它是有联系的两个染色体3和4。
87对SSR引物中有24对具有多位点图谱。1对引物所获得的位点,除MTIC77-1和MTIC77-2分别定位于8组和3组外,其余位点均定位在相邻位点上(第2组MTIC12-1和MTIC12-2, Magali2组8组MTIC135-1和MTIC135-2等)。
复合地图
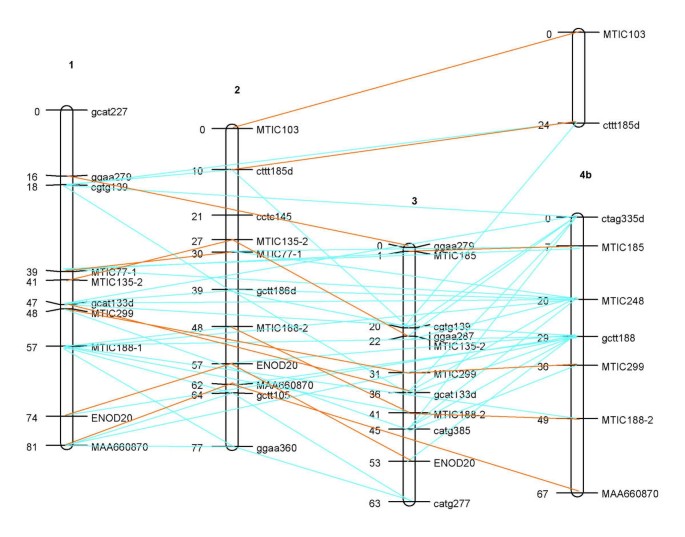
大量多态性SSR基因座使得可以基于每个同源组中每对SSR标记的重组率和LOD评分构建复合率和LOD评分。为父母而不是每位同源组的8个染色体,而是获得单个连杆组。地图的总长度(图6)达到709厘米,107个基因座。第4组发生冲突的连接,因此该染色体分为3份。标记之间的平均距离为6.6厘米。
马加利2号的遗传连锁图谱,同源群5 ~ 8。看到图中的传说3..
讨论
在四倍体栽培苜蓿密集的遗传连锁图谱的发展是理解农业价值的性状的遗传控制(个QTL)的第一步。农艺性状没有得到很好的评价野紫花苜蓿由于其匍匐生长习性,所以在野生二倍体中获得了稠密的分布图紫花苜蓿[8]难以用于农艺性状的QTL检测。例如在其他杂合子物种中,特别是在同源四倍体物种中[21[我们使用了F1种群进行映射。实际上,即使F2代在重组事件的数量方面可能是有价值的工具,即使在重组事件的数量方面也是一个有价值的工具,自行生成可能导致通过一些近交植物的死亡导致遗传偏离。我们选择易于使用方便的PCR标记:AFLP和SSR。AFLPS,因为它们是群众揭示的,有助于覆盖整个基因组。SSRS主要来自EST数据库M. Truncatula.,是共显性的、位点特异性的和可移植的。它们之前在这个模型物种中被绘制了地图,因此可以分析苜蓿和苜蓿这两个物种之间的同向性M. Truncatula..
在绘图人口中标记多样性和分离
每对AFLP引物都获得了大量的多态性标记。在作图群体的两个亲本中,近50%的SSR引物显示多态性。值得注意的是,SSR位点,使放大但单型的乐队2映射人口的父母,可能揭示多态性在其他遗传背景,因此观察到的变化在我们的实验中只是一个被低估的价值变化的程度内现有苜蓿品种。
有趣的是,作图群体的两个亲本具有相同的特征:单链、双链、双链和畸变AFLP标记的数量和比例以及SSR等位基因的数量(每个位点和每个亲本1.8个等位基因)。
发现了SSRS的大量无效等位基因,与苜蓿相比可能导致苜蓿中的突变产生M. Truncatula.在匹配SSR引物的序列中。使用在苜蓿中直接开发的SSR引物的空等位基因的数量应较低。实际上,在苜蓿(AFCT32和AFCT45)中开发的两个SSR标记中的每个SSR标记中只有一个无效的等位基因。在李[38.]和甜菜[39.当使用来自不同物种的SSR标记时,还识别了大量的无效等位基因。
一些SSR引物对(超过87)在苜蓿中产生多基因座扩增;在大豆中也观察到这[37.],李sp [38.],芸苔sp [39.],高粱[41.]、绿豆及扁豆[42.].在绘图人口中的等位基因偏析中证明了多基因座扩增。这可能是由于在进化期间的基因组区域的复制M. Truncatula.和紫花苜蓿.
在苜蓿中映射
使用AFLP和SSR标记,扭曲与否,我们鉴定了每个父母中的8组同源染色体,每种父母,每一个染色体为4个染色体。通过Codominant SSR基因座和排斥键建立染色体的同源状态。
在四倍体栽培的苜蓿中,我们获得了与AFLPS和SSR的较长次饱和的地图(分别为Magali2和Magali2和Magali2和Marcedes4.11中的单倍体基因组)比以前公布的RFLPS(用于单倍体基因组470厘米的研究)(470厘米))[9].此外,我们的地图长度接近二倍体苜蓿中获得的内容[8],754厘米。
我们提出了一种仅使用SSR LOCI构建的便携式参考图。它跨越709厘米的单倍体基因组,涵盖二倍体苜蓿基因组的94%[8].标记之间的平均距离为6.6厘米。可以选择在整个基因组上传播的有限数量的SSR标记,以在其他人群中建造地图。
包括AFLP的密集地图对于我们人群的准确QTL分析将是有价值的。复合SSR映射将有助于比较不同群体中的QTL位置。
如已发表的二倍体和四倍体苜蓿图[43.],我们发现AFCT32和MTLEC2A标记映射在另一染色体上的相同染色体(第3组)和AFCT45上(第8组)。
Alfalfa的自身传递倍性
CODOMINANT标记是用于测试基因组的自身传递体结构的足够工具[22].本研究是使用SSR标记的第一次证明苜蓿中染色体染色体的四元瘤遗传。这种自动输注图案通过属于所有同源染色体的标记物之间的排斥键来证实。最近在苜蓿中,在F1人口中的RFLP标记发现了在减数分裂的优先染色体配对[44.].我们可以假设,这一结果源于对遗传上距离较远(非休眠基因型)的群体亲本的选择紫花苜蓿还有一种非常休眠的基因型M. Falcata.).
在我们的研究中,一些位点表现出显著的双还原频率。然而,目前还没有发现仅源自双还原的基因型。这里得到的二次还原与偏析变形没有什么不同。苜蓿的双减率估计很低,因此检测它需要大量的种群分析。这一结果与紫花苜蓿减数分裂的观察结果一致,显示四价体形成比例较低[45.].然而,在绘图程序中,不能考虑双重还原[23].
隔离失真
偏析畸变在AFLP标记上达到35%。双单位和双工更频繁地扭曲而不是单纯形标记。对于SSRS,考虑到显示出显着的双重减少的基因座作为扭曲的基因座,失真的比例为25%(26个基因座超过104)。这些失真率类似于所获得的速率M. Truncatula.[33.或二倍体紫花苜蓿[5- - - - - -7].但在四倍体苜蓿中,布鲁瓦和奥斯本[9]的分离畸变率仅为5.5%,并指出同源四倍体可以减少引起畸变分离的有害等位基因的影响。然而,由于分离畸变分析局限于单纯等位基因,可能导致对分离畸变的乐观看法。在我们的地图上,扭曲标记的随机重新分配表明,没有苜蓿基因组区域特别扭曲的情况相反M. Truncatula.基因组[33.].
SSR标记的转
80%以上的SSR标记是在豆科模式种中初步形成的M. Truncatula.在苜蓿中获得扩增产物。由于它们属于同一属,这种物种在这些物种中引起扩增的能力并不令人惊讶。实际上,这些转移已经报告过年度和多年生植物Medicago四个标记属[43.]最近从EST开发的一组455个引物对的89%M. Truncatula.[46.].已经获得了一些属于某些属的SSR标记的转移已经获得甘氨酸sp [37.],李sp [38.] 和芸苔sp [39.],从基因组DNA中分离出SSRs。SSR的高可转让性使得公众可以大量使用SSRM. Truncatula.在苜蓿上。
与M. Truncatula地图的比较
在两个人身上找到的94个SSR位点紫花苜蓿和M. Truncatula.(T. Huguet,未发表的数据)表明,自物种分化以来,没有发生过主要的染色体重排。(1) MTIC272被映射到组3M. Truncatula.但是,在Magali2和(2)MTIC77-1中,仅在Magali2中存在的标记在第8组中映射,尽管MTIC77-2在父母的第3组中被映射到其中M. Truncatula..8个SSRs由于与其他标记(MTIC35、B21E13-1、B21E13-3、MTIC77-3、MTIC84-1、MTIC230和MTIC356)连锁不够,无法被定位。部分SSR标记未被定位M. Truncatula.由于在植物中没有多态性,在苜蓿:MTIC95(第1组),MTIC7(第3组),MTIC94(第4组),MTIC289和MTIC471(第7组)中被映射。
四倍体紫花苜蓿与紫花苜蓿染色体上SSR标记的顺序非常保守M. Truncatula.(T. Huguet,Unpull。数据)。可以通过重组率估算的缺乏准确性来解释未对准的病例。实际上,重组率具有标准误差,其尺寸随着绘图群体的尺寸而变化,重组率和成对的标记的类型和相[21].在同源四倍体种中,168个个体的F1作图群体中,2个单倍体标记的重组率为0.2的标准误差为0.03,1个单倍体标记和1个双倍体标记的重组率为0.07。这种同义关系对于将来的使用是非常积极的M. Truncatula.栽培四倍体苜蓿遗传学研究基因组学。
苜蓿地图的比较M. Truncatula.利用SSR标记表明,1、2、6和8号染色体的标记分布均匀M. Truncatula.同源染色体,但很明显更多的标记物是需要的组4,和上组3,5和7的上部分。
我们惊讶地注意到单倍体基因组地图长度在F2人口中M. Truncatula.四倍体紫花苜蓿(1225 cM vs 709 cM)的DNA含量约为我们的图谱的2倍,而在M. Truncatula.而四倍体紫花苜蓿[47.].
结论
利用AFLP和SSR标记组合获得了栽培四倍体紫花苜蓿的遗传连锁图谱,其长度和标记密度接近饱和。他们的比较M. Truncatula.利用SSR标记绘制的图谱反映了这两个物种间的同系性。共显性SSR标记的遗传表明苜蓿具有真正的同源四倍体,在减数分裂时染色体完全随机配对。染色体上标记的顺序非常相似。利用这些图谱鉴定农艺性状的qtl正在实验室中进行。
方法
映射人口
在法国繁殖的众多苜蓿品种中选择了两个祖父植物。一个起源于普罗旺斯型品种麦加拉,并被命名为Magali2。此基因型以前用于跨型交叉设计[48.],具有较高的一般配合饲草的消化率和株高能力。另一家工厂,Mercedes4.11,从高收益源自奔驰品种,并亲切的B.培尔提供,从利马格兰育种公司。据2个周期的选择增加疾病(后选择半纤维虫草)、害虫(Ditylenchus dipsaci.)和抗性抵抗。1999年,这两种植物手动越过梅赛德斯4.11作为女性父母。在耐力在耐力裂开之前阉割花,用70%的酒精清洗液体以清除任何花粉颗粒。玛拉利2花的花粉被收获在刷子上并应用于雌性植物的风格。共收获236种种子。2000年,在230个发芽种子中,随机采取了168株植物的子集,以代表F1制图群体。
DNA提取
在每株植物上收获杨小叶,并使用标准CTAB(十六烷基丙氨酸亚甲基铵)提取DNA [49.].
AFLP标记
妊娠分析(50.是用GIBCO BRL试剂盒AFLP™分析系统I进行],如制造商推荐的,具有一些修改旨在优化凝胶的可读性。预扩增产物稀释于水中,而不是1:50 1:10。对于一些引物对,扩增的选择性用进行33.p标记的EcoRI选择性引物由Gibco Brl推荐。反应产物在6%变性聚丙烯酰胺测序凝胶上分离,凝胶中加入1X TBE缓冲液和7 M尿素。电泳于85 W,在38 × 53 cm凝胶仪上进行约3 h 30 min。凝胶随后在75°C凝胶干燥器中放置3小时,并暴露于柯达Biomax MR x射线胶片2-5天。
对于在没有5'end标记的EcoRI引物的情况下分析的引物对,在如上所述的低落聚丙烯酰胺测序凝胶上分离出来自选择性的产品并使用银染色方法进行可视化[51.].
每个AFLP标记由两个引物的最后2个核苷酸进行识别,然后根据条带大小进行编号。只对多态条带进行评分。我们考虑了三种多态性情况:Magali2中有条带而Mercedes4.11中没有;Magali2中没有条带而Mercedes4.11中有;利用27对AFLP引物对整个群体进行基因型分析。
微卫星标记(SSRs)
所检测的232个SSR位点来源于3个来源:Diwan等发表的10个SSR标记[35.],35从SSR-富集银行对模型动物制成的M. Truncatula.([34.[S. Santoni,未发表资料),共发现187个SSR标记M. Truncatula.来自公共EST数据库(T. Huguet,未发表的数据)。
对于Diwan等发表的SSR标记[35.],按作者描述的方法进行PCR反应,用银染色法观察扩增产物。其余SSR位点的PCR产物均采用银染色法或LI-COR法检测红外2自动测序仪。银染色时,PCR反应在最终体积为20 μl的MJ Research模型PTC-100热循环器中进行。反应缓冲液包含37.5 ng模板DNA,每个脱氧核苷酸0.2 mM, 1.5 mM氯化镁2,每个引物0.4 μM, 0.5单位铂Taq DNA聚合酶(Gibco Brl)。初始Taq聚合酶活化步骤在94°C为4分钟,随后在94°C为30秒,55°C为1分钟,72°C为1分钟,共35个循环,再加上72°C为7分钟的延伸步骤。PCR产物经变性聚丙烯酰胺测序凝胶分离,进行AFLP标记。测序仪共使用3条引物:1对引物(0.4 μMeach)和1条ird标记的M13引物(0.4 μM)。在PCR扩增前几个周期,将M13引物加入到PCR产物中。标记的M13引物加入到后续的循环中,从而对PCR产物进行标记。其他PCR条件与银染色相同。扩增产物在LI-COR推荐的6.5%变性聚丙烯酰胺凝胶(LI-COR)上分离。
从2个父母植物的测试实验加2 F1植物,我们将标记分类为显示没有扩增(或非特异性扩增,显示多条带型谱),显示出扩增但具有单声腔曲线,并显示与多态轮廓的扩增。然后整个测绘群体对这些SSR基因座中的87种进行了基因分型。
标记检测与遗传
我们使用来自TETRAPLOIDMAP软件的“FINDGENO”子程序[26].它给出了每个标记的分离类型。从而确定了扭曲的AFLP标记。对SSR标记进行同源四倍体遗传检验。该软件识别亲本基因型,从亲本表型和F1植株在每个位点,没有或有双倍减少。在24个位点上,有些F1个体的等位基因数超过4个,凝胶图谱明确显示有2或3个位点扩增(图)2).在这些情况下,对每个引物对的几个位点进行评分,分离分析如上所述。因此,位点名称由引物对名称和数字(即MTIC84-1和MTIC84-2)组成。当亲本基因型鉴定失败时,引物对扩增的等位基因作为显性标记。
地图建设
TETRAPLOIDMAP软件的“集群”子程序用于创建不独立分离的标记组。根据苜蓿中染色体碱的数量,我们希望获得许多标记的8个群体。我们不得不要求9到11组,因为1到3人的群体的标记很少,所以必须被丢弃。除了在没有在3:1的比例中没有分离的父母中存在的AFLP标记外,包括所有标记,或者没有扭曲。
然后针对每个同源组,分析了每对标记的连杆(“十二步”子程序)。标记物可以被解锁,在偶联相中连接或者在排斥阶段连接。仅当LOD评分高于2时,仅考虑了连杆分析,鉴定了组成的每个同源组中的每个连杆组(染色体)的标记。Twopoint过程产生了包含每对标记的重组率和床的输出文件。使用JOINMAP 3.0软件确定每种染色体上的标记的顺序[36.,使用Twopoint程序的输出文件。我们使用了Kosambi距离和JoinMap的默认参数。以紫花苜蓿分布图进行χ 2检验2在JoinMap中检测结果偏低,部分AFLP标记被排除。
利用SSR位点构建了一个复合图谱。利用之前分配给同源染色体组的SSR,利用对位点之间的重组率,利用JoinMap构建每个组的图谱。将JoinMap的3个参数从“每个位点显示的最大连杆数”从2个降低到1个,“REC小于的使用连杆”从0.40降低到0.49,“LOD大于”从1降低到0.5。
地图的封面是通过我们地图的长度与二倍体苜蓿的密度图的长度计算的封面[8](754厘米)。
参考
- 1.
米肖R,雷曼WF,鲁博MD:世界分布和历史发展。紫花苜蓿和紫花苜蓿改善 - 农学专着没有。29,ASA-CSSA-SSSA,麦迪逊,美国。1988年,25-91。
- 2.
斯坦福EH:紫花苜蓿的四体遗传。王志强,王志强。
- 3。
Armstrong JM:苜蓿多倍体中的细胞学研究。可以j bot。1954年,32:531-542。
- 4。
Demarly Y:etude del'HéréditédeLababarrurede la Fleur Chez La Luzerne。AnnAmélior植物。1954年,4:5-20。
- 5。
Kiss GB,CsanαdiG,卡尔曼K,KalóP,ÖkrészL:建设基本遗传地图Medicago利用RFLP,RAPD,同工酶和形态标记。Mol Gen Genet。1993年,238:129-137。
- 6。
Echt CS,Kidwell Kk,Knapp SJ,奥斯本TC,McCoy TJ:二倍体苜蓿中的联系映射(紫花苜蓿).基因组。1993年,37:61-71。
- 7。
布鲁默EC,布顿JH,Kochert G:在二倍体紫花苜蓿的RFLP地图的开发。Al Appl Genet。1993年,86:329-332。
- 8。
Kaló P, Endre G, Zimαnyi L, Csanàdi G, Kiss GB:二倍体苜蓿连锁图谱的构建(紫花苜蓿).Al Appl Genet。2000,100:641-657。10.1007 / S001220051335。
- 9。
BRORWER DJ,奥斯本TC:四倍体苜蓿的分子标记联系地图(紫花苜蓿L.)。Al Appl Genet。1999年,99:1194-1200。10.1007 / S001220051324。
- 10.
吴熊,烧焦W,鼻子Me,Tew T1,Moore pH,坦克斯利SD:使用单剂量限制碎片检测和估计多倍体中的联动。Al Appl Genet。1992,83:294-300。
- 11.
余凯飞,陈建平。四倍体紫花苜蓿随机扩增多态性DNA标记的分离及其分子定位策略。基因组学。1993,1:844-851。
- 12.
马铃薯四倍体抗晚疫病性状的连锁分析(英文)Phytophthora Infestans.).Mol Gen Genet。1998年,259:150-160。10.1007 / S004380050800。
- 13。
Bradshaw JE, Hackett CA, Meyer RC, Milbourne D, McNicol JW, Phillips MS, Waugh R:数量抗性相关的AFLP和SSR标记的鉴定Globodera pallida(石头)在四倍体土豆(茄属植物tuberosum无性系种群tuberosum),以进行标记辅助选择。中国科学(d辑):地球科学(英文版)。10.1007 / s001220050886。
- 14。
Wachira FN, Hackett CA, Paul S, Powell W, Waugh R:基因连锁图谱的构建山茶花Sinensis.(茶)。遗传。2000,85:346-355。10.1046 / j.1365-2540.2000.00769.x。
- 15.
Rajapakse S,Byrne DH,Zhang L,Anderson N,Arumuganathan K,巴拉德Re:两倍的四倍体玫瑰的遗传联系地图。Al Appl Genet。2001,103:575-583。
- 16。
Fjellstrom rg,Steiner Jj,Beuselink Pr:RFLP,PCR和Isozyme Loci的四元组联动测绘Lotus corniculatusL.作物SCI。2003,43:1006-1020。
- 17。
Al-Janabi SM, Honeycut RJ, McClelland M, Sobral BWS: Saccharum spontaneum的基因链接。遗传学。1993,134:1249-1260。
- 18。
Da Silva Jag,Sorrells Me,Burnquist W,Tanksley SD:RFLP联系地图和基因组分析蔗糖spontaneum.基因组学。1993,36:782-791。
- 19。
Grivet L,D'Hont A,Roques D,Feldmann P,Lanaud C,Glaszmann JC:RFLP在培养甘蔗中测绘(糖SPP。):在高度多倍体和非霉素中的基因组组织杂交中的基因组组织。遗传学。1996,142:987-1000。
- 20.
Lerceteau-Köhlere,Guéring,Laigrets F,Denoyes-Rothan B:八倍体草莓中的混合性和多差论遗传的特征(Fragaria.×ananassa)。中国科学:地球科学。2003,27(6):619-628。10.1007 / s00122 - 003 - 1300 - 6。
- 21.
Hackett Ca,Bradshaw Je,Meyer RC,McNicol JW,Milbourne D,Waugh R:四倍体物种中的联动分析:模拟研究。Genet Res CAMB。1998,71:143-154。10.1017 / S0016672398003188。
- 22.
罗ZW,哈克特CA,Bradshaw Je,McNicol JW,Milbourne D:预测治疗基因型和基因偏析,用于四元族遗传。Al Appl Genet。2000,100:1067-1073。10.1007 / S001220051388。
- 23.
罗ZW,哈克特CA,Bradshaw Je,McNicol JW,Milbourne D:使用分子标记的四倍体物种中的遗传联系地图的构建。遗传学。2001,157:1369-1385。
- 24.
吴锐,曾志斌:一种分析异交四倍体植物基因分离的多倍体模型。中国生物医学工程学报。
- 25。
Ripol MI, Churchill GA, da Silva JAG, Sorrells M:同源多倍体遗传图谱的统计方面。基因。1999,235:31-41。10.1016 / s0378 - 1119(99) 00218 - 8。
- 26。
罗志伟:四倍体图谱(TetraploidMap),四倍体群体连锁图谱计算软件。2002年,(ftp://ftp.bioss.sari.ac.uk/pub/cah/].
- 27。
Hackett CA, Pande B, Bryan GJ:利用模拟退火技术构建同源四倍体物种的连锁图谱。中国科学(d辑),2003,26(6):417 - 417。
- 28。
BEVER JD,费尔伯F:autopolyploidy的理论群体遗传学。牛津监测网EVOL生物学。1992年,8:185-217。
- 29。
Thompson JD,Lumaret R:多倍体植物的演化动态:起源,建立和持久性。趋势ECOL EVOL。1992年,7:302-307。10.1016 / 0169-5347(92)90228-4。
- 30.
Demarly Y: Génétique des tétraploïdes et amélioration des plantes。安Amélior Plantes, 1963, 13: 307-400。
- 31.
Barker DG,Bianchi S,Blondon F,Dutéey,Duc G,Govament P,Gallusci P,GénierG,Guy P,Muel X,Tourneur J,DénariéJ,Huguett T:Medicago truncatula,用于研究分子遗传学的模型植物根瘤菌豆科植物共生关系。植物学报1990,8:40-49。
- 32.
煮d:Medicago truncatula:制作中的模型!。植物生物学目前的意见。1999年,2:301-304。10.1016 / s1369-5266(99)80053-3。
- 33.
Thoquet p,ghérardim,journet ep,kereszt a,anéjm,prosperi JM,Huguet T:模型豆类的分子遗传联系地图Medicago truncatula:是比较豆类基因组学和分离重要农艺基因的重要工具。acta botanica sinica(云南植物学报). 2002,27(2):1- 4。[http://www.biomedcentral.com/1471-2229/2/1].
- 34.
Baquerizo-Audiot E,Desplanque B,Prosperi JM,Santoni S:二倍体豆类微卫星基因座的特征Medicago truncatula(桶医生)。分子生态学报。2001,1:1-3。10.1046 / j。1471-8278 .2000.00001.x.
- 35.
Diwan N, Bhagwat AA, Bauchan GR, Cregan PB:简单序列重复(Simple sequence repeat, SSR) DNA标记Medicago物种。基因组学。1997,40:887-895。
- 36.
Van Ooijen JW, Vorrips RE: JoinMap®3.0版,用于计算遗传连锁图的软件。国际植物研究所。荷兰瓦赫宁根,2001年
- 37。
Peakall R,Gilmore S,Keys W,Morgante M,Rafalski A:大豆的交叉物种扩增(大豆)在属中的简单序列重复(SSR)和其他豆类属属:对植物中SSRS的可转移性的影响。分子生物学和演化。1998,15:1275-1287。
- 38。
Aranzana MJ, Pineda A, Cosson P, dirleanger E, Ascasibar J, Cipriani G, Ryder CD, Testolin R, Abbott A, King GJ, Iezzoni AF, Arús李基因组。Al Appl Genet。2003,106:819-825。
- 39。
Rae SJ,aldam C,Dominuez I,Hoebrechts M,Barnes SR,Edwards KJ:开发和将微卫星标记的开发和掺入甘蔗(甜菜属属)。Al Appl Genet。2000,100:1240年至1248年。10.1007 / s001220051430。
- 40。
陈志强,王志强,王志强,等。微卫星标记在水稻基因组分析中的应用芸苔.2油菜A、C基因组微卫星定位及遗传定位Brassica oleracea.L. Al Appl Genet。2001,102:695-699。10.1007 / S001220051699。
- 41。
Tao YZ, Jordan DR, Henzell RG, McIntyre CL:利用不同来源的探针构建高粱RIL群体的遗传图谱,并与其他高粱图谱进行比较。中国农业科学,1998,19(4):429 - 436。
- 42。
Humphry ME, Konduri V, Lambrides CJ, Magner T, McIntyre CL, Aitken EAB, Liu CJ:绿豆的研制(Vigna Radiata.)RFLP联系地图及其与Lablab的比较(扁豆紫色)揭示了两个基因组之间高度的共线性。《中国科学院院刊》2002年第5期。10.1007 / s00122 - 002 - 0909 - 1。
- 43.
黄志强,王志强,王志强,等:二倍体和四倍体紫花苜蓿SSR标记的定位。应用电子学报。2000,101:165-172。10.1007 / s001220051465。
- 44.
马CX,卡塞拉G,沉ZJ,Osborn的TC,吴R:从苜蓿为例:统一映射数量性状基因座中的二价四倍体使用单剂量的限制性片段的框架。Genome Res。2002,12:1974-1981。10.1101 / gr.320202。
- 45.
McCoy TJ,Bingham等:苜蓿的细胞学和细胞遗传学。in:alfalfa和苜蓿改善,asa-cssa-sssa农艺专着29,麦迪逊,美国。1988年,737-776。
- 46.
6 .王磊,王丽娟,王丽娟,王丽娟,王丽娟:紫花苜蓿est - ssr标记在紫花苜蓿属植物分类中的应用。植物遗传资源学报。2003。
- 47.
布朗登F,玛丽D,布朗S,康多罗西A:基因组大小和碱基组成紫花苜蓿和M. Truncatula.物种。基因组学。1994,37:264-270。
- 48.
紫花苜蓿品质性状的遗传控制紫花苜蓿L.)。Austr J Agric Res。2000,53:401-407。10.1071 / AR01104。
- 49.
植物DNA微型制剂:VersionII。植物学报1983,1:19-21。
- 50.
Vos P, Hogers R, Bleeker M, van de Lee T, Hornes M, Frijters A, Pot J, Peleman J, Kuiper M, Zabeau M: AFLP: DNA指纹识别的新技术。核酸学报1995,23(3):497 - 498。
- 51.
Bassam BJ,Caetano-Anolles G,Gresshoff PM:聚丙烯酰胺凝胶中的DNA快速敏感银染色。肛门生物化学。1991,19:680-683。
致谢
我们非常感谢C.A. Hackett(苏格兰生物数学与统计,苏格兰作物研究所,邓迪,英国)在使用四倍体地图软件方面的帮助。我们感谢F. Durand, P. Cormenier, C. Ecalle, A. Gilly, J. Jousse, D. Henri, D. Bousseau, J. b . Pierre, C. Gibelin和S. Berland的标记分型或设备维护。这个项目得到了横向结构行动的支持Medicago truncatula“INRA(2000- 2002年)的。
作者信息
从属关系
相应的作者
作者的原始提交的图像文件
下面是作者提交的原始图片文件的链接。
权利和权限
关于这篇文章
引用这篇文章
Julier, B, Flajoulot, S, Barre, P。et al。栽培四倍体苜蓿两种遗传连锁图谱的构建紫花苜蓿)使用微卫星和AFLP标记。BMC植物BIOL.3,9(2003)。https://doi.org/10.1186/1471-2229-3-9
收到了:
接受:
发表:
关键字
- 映射人口
- 同源组
- 隔离扭曲
- AFLP标记
- 减少两倍