抽象的
背景
随着近年来植物AsA生物合成的研究进展,人们对阐明植物AsA生物合成的相关因素越来越感兴趣l-抗坏血酸(AsA)含量一个主要的目标是确定在诸如水果和块茎等库器官中是否合成了AsA原位从进口的光合同化物或在源组织中合成并通过韧皮部转运。在目前的工作中,我们检验了一个假设,即长途运输参与了AsA在马铃薯块茎中的积累,这是欧洲饮食中AsA最重要的来源。
结果
使用EDTA渗出技术我们确认抗坏血酸的在马铃薯植物的韧皮部的存在和表明在源叶的AsA含量变化之间和韧皮部渗出物的相关性。羧基荧光和硝酸银的比较3.染色提示在发育的块茎中AsA的共塑卸载。块茎发育过程中AsA的分布变化与进口光合产物的分布变化相似,进一步支持了这一假设。通过前体供给源叶来操纵叶片中AsA含量,导致正在发育的块茎中AsA含量增加。
结论
我们的数据提供了抗坏血酸的长途运输马铃薯发生的假设强有力的支持。我们还表明,韧皮部抗坏血酸含量和抗坏血酸积累汇机关可以通过在枝叶抗坏血酸含量的操作可以直接增加。我们现在正在试图建立进口抗坏血酸的定量贡献整体抗坏血酸积累通过转基因方法开发的马铃薯块茎。
背景
l- 血液酸(ASA),维生素C的还原形式,是许多生物系统的必需抗氧化剂,必须通过人类,灵长类动物和一些无法合成内源的其他动物的饮食获得[1].对所有这些生物体来说,AsA的主要饮食来源是植物,这种微量营养素摄入不足会导致衰弱性疾病(坏血病)的发作,最终导致死亡。尽管它与人类明显相关,但我们对植物如何合成AsA的了解仍然是初步的。直到1998年,有证据支持的AsA植物生物合成途径才被提出[2].最初的建议被描述为拟南芥ASA缺陷型突变体(vtc1),它们在途径酶的活性上有缺陷[3.].此后,其他asa不足答:芥已经识别出突变体,这些突变体似乎不受任何已知途径基因的影响[4,5].此外,植物中AsA积累的上调已经通过与拟生物合成途径无关的生物合成基因的异位过表达实现[6- - - - - -9].这导致的另外的步骤的提案,枝或替代路线到原始途径[7,9,10].
植物AsA生物合成的许多最新进展都是通过对烟草或其他模式系统的研究获得的拟南芥[2,3.,9,11].另一方面,我们对作物植物(如水果和蔬菜)可食用部分AsA积累的控制机制的理解,这些部分是维生素C的主要饮食来源[12仍然有限。一个问题是,与光合代谢相关的AsA功能相比,叶绿体外的AsA功能知之甚少[13].对于库器官AsA含量的巨大变异,我们也没有生物学或分类学上的解释,例如camu camu (camu)果实中AsA含量可以超过3000 mg/100 g FW。Mirciaria dubia) [14]或小于10毫克/ 100 GFW如对于葡萄,苹果或李子的情况下[15].非绿色蔬菜的变异性也很大[16而干种子则完全不含AsA。[17]]。这些例子突出了贮藏器官对AsA含量的高度耐受,为开发富含AsA的作物产品提供了生物学上的可行性。为此,需要回答的一个关键问题是AsA在库器官中的积累是否是生物合成的结果原位或从树叶进口。最近Franceschi和Tarlyn [18]观察到长距离运动14C-ASA从叶片到鲜花和诸如模型系统中的根提示,如答:芥和紫花苜蓿.我们实验室的研究表明,AsA存在于许多作物植物的韧皮部中,我们也观察到植物韧皮部能够支持多种前体的活性AsA生物合成[19].我们之前已经表明,在黑醋栗浆果如黑醋栗浆果中的器官形成后,在器官形成后,ASA积累的速率最高[20.]土豆块块[21]当汇活动性被强烈激发时[22].在一起,这些发现表明,下沉源关系可能在定义水槽器官中的ASA累积方面发挥重要作用。
在这项工作中,我们扩大了我们的马铃薯块茎中ASA上积累的调查,维生素C在欧洲饮食的主要来源[23].我们在这里提出证据,表明在马铃薯块茎中AsA积累的长途运输的含义。此外,我们还发现,人工增加叶片中AsA含量会导致韧皮部AsA的富集和块茎匍匐茎中AsA的积累。我们的发现对提高作物营养价值的策略的发展具有启示意义。
结果
韧皮部中AsA的检测
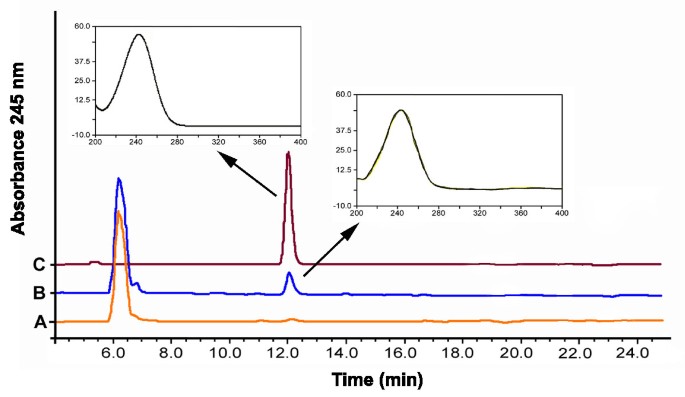
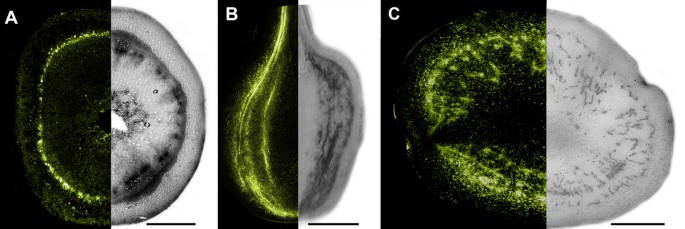
无花果。1在缓冲液中含有任一EDTA或氯化钙从切断叶柄收集马铃薯叶源韧皮部渗出物显示HPLC色谱2.总AsA(亚撒t;l-抗坏血酸+脱氢抗坏血酸)在245 nm处出现最大的吸收峰。在cal存在的情况下收集渗出物2而不是EDTA,所有的渗出峰都被强烈地减少了,这是由于胼胝质凝胶化导致的渗出减少[24].在EDTA或CaCl存在下测试真实AsA(最终浓度0.1 μM)的稳定性2在90分钟以上的两种情况下,均观察到渗出缓冲液氧化小于5%(数据未显示)。在与乙醇AgNO孵育的马铃薯茎和块茎切片中,组织化学方法证实了AsA对维管组织的定位3.在3°C(无花果。2).在茎的脉管系统中观察到强烈的金属银沉积。在块茎中,金属银沉积物以短束或清晰的斑点形式出现,有时在髓周区,有时也在皮层中。尽管AgNO3.由于处理之间的干扰,不能在相同的部分上进行染色和CFDA治疗,以金属银沉积物的图案和茎和块茎部分的荧光分布观察到明确的相似性。没有Agno.3.在1% CuSO预孵育的对照切片中观察到染色418 h,以氧化AsA(数据未显示)[25].
AsA在块茎发育中的分布
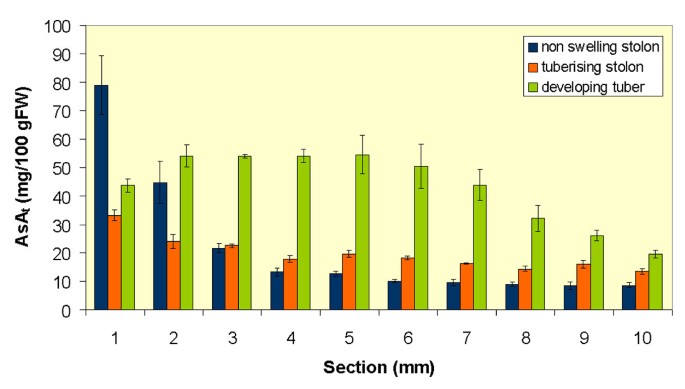
无花果。3.显示ASA.t匍匐茎和正在发育的块茎的轴向分布。在非肿胀匍匐茎中AsAtAsA含量在根尖部最高,基部急剧下降,较多的基部含有约10%的AsAt在顶端发现的内容物。结节状匍匐茎显示AsA降低50%t顶端切片的内容。这伴随着根尖下3-10毫米切面的增加。在块茎发育过程中,AsA含量有很大的增加t含量在根尖下区域,对应于肿胀区。
AsA运输
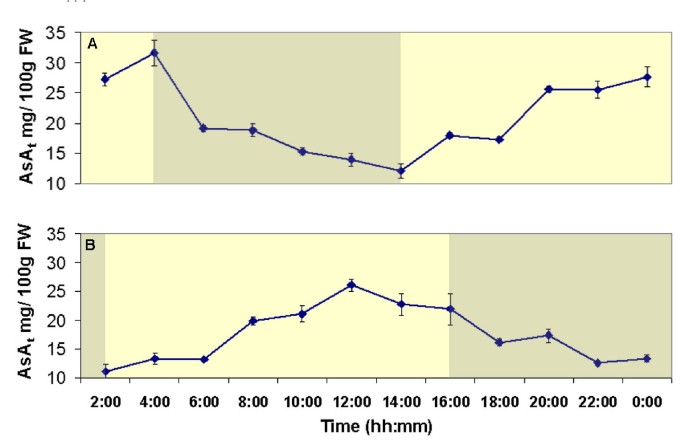
数字4显示AsA的变化t马铃薯植株的源叶含量与人工昼夜黑暗/光照周期柜适应环境14天。橱柜是真实生活中分阶段使在其照明政权不同阶段植株可在任何给定的时间。ASA的t对两箱同时采集的植株进行源叶含量监测24 h。在暗期结束时,叶AsAt含量约为12毫克/ 100 GFW,后者逐渐增加了人工日出。在10小时之后,叶子ASAt含量增加到大约30 mg/100 gFW,之后趋于稳定。在人工日落之后,AsAt浓度在6-10小时内逐渐回落至约12 mg/100 gFW。
桌子1显示了亚撒t光期或暗期植株在12.00 h收集源叶和结瘤匍匐茎的含量(在叶片中在预湿的气氛中收集韧皮部分泌物90 min后)。表中还报道了色谱AsAt来自源叶和同一植物的核心叶片收集的Phloem渗出物的峰值区域。渗出物数据被报告为峰面积,因为无法建立收集的渗出物的确切体积。在来自ASA的两倍的光相植物中的叶子t暗相植物叶片中AsA含量无显著差异ttuberising从两组植物匍匐茎的内容。ASA的t光相叶片分泌物的色谱峰面积是暗相叶片的1.8倍。在结节状匍匐茎中,渗出峰面积的增加更为明显(4.6倍)。
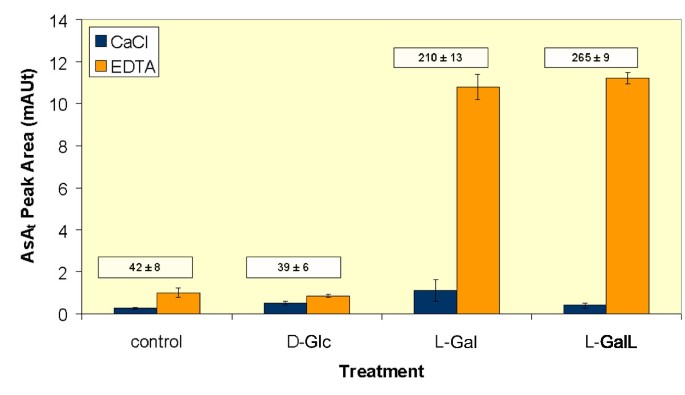
叶片AsA之间的相关性t内容和AsAt在使用皮瓣技术提供一系列AsA生物合成前体后,在温室种植的植物中也研究了韧皮部渗出液的水平[18].数字5显示色谱AsAt从叶片预处理24小时的叶子的峰面积为20 mm MES pH 5.5,2mm CaCl2单独(对照)或含有最终浓度为25mm的前体D葡萄糖(D-Glc)导致叶片AsA轻微下降(10%)t内容与控制相比但是ASA没有重大变化t在渗出液中检测到。相比之下,供应l半乳糖(l-gal)或者l-galactono-1 4-lactone (l-GalL)增加AsAt叶片含量(分别为4.9倍和6.2倍)和分泌物含量(分别为10.8倍和11.2倍)。在所有的治疗中,用氯化钙代替EDTA2在收集井中,AsA显著降低t渗出液色谱图中的峰面积。
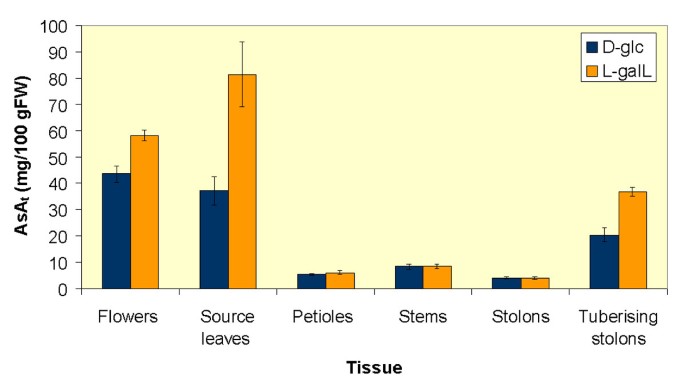
人工增加AsAt通过供应直接ASA前体获得整株植物源叶的全部内容l-胆囊经皮瓣技术移植24小时至最下面四个节的所有末端小叶。在潜伏期结束时AsAt源叶的含量是对照植株的2.2倍。6).亚撒t与对照相比,花(33%)和块茎(80%)等库器官的含量也显著增加。AsA无变化t在叶柄、茎或非块茎匍匐茎中可观察到水平。
讨论
在马铃薯韧皮的asa
我们之前的研究表明,用HPLC分析蚜虫截柱获得的马铃薯源叶韧皮部汁液时,AsA代表柱保留的245 nm处的最大吸收峰[19].在本研究中,我们通过不同方法从马铃薯植物的不同器官收集的Phloem样品获得了非常相似的结果。EDTA渗出技术[24].抗坏血酸的本地化的血管组织茎和块茎发展进一步证明利用组织化学ASA和硝酸银之间的特异性相互作用3.在低温下形成金属银矿床[25].特别是,金属银在正在发育的块茎中的分布模式反映了这些贮藏器官典型的韧皮部紧密吻合[26类似于韧皮部网络,它参与了供给的植物中标记同化物的卸载14有限公司2[22].这进一步证明了硝酸银染色和荧光在块茎中分布的相似性。我们之前已经证明,CF在马铃薯块茎发育中的分布可以用来识别这些器官中的共形成层韧皮部卸载[22],因此在发育的块茎中CF和金属银沉积物的分布相似,说明韧皮部AsA向贮藏薄壁细胞的转移是随着同化物的质量流动发生的。AsA的变化进一步支持了这一假设t块茎诱导后匍匐茎轴上的分布与放射性标记植物中蔗糖含量和同化物分布的变化非常相似14有限公司2[22].AsA的下降t在结节状匍匐茎的顶端,伴随其在亚顶端区域的积累可能反映了该区域的共形成层卸载的诱导,从而导致库活动从顶端远端迁移。然而,这种模式也与沿着轴的有丝分裂指数的变化有关,这是块茎诱导和匍匐茎顶端区域细胞分裂停止的结果[27]及其在膨胀区次级分生组织中的活化[28].鉴于AsA在细胞分裂中的作用,这可能是相关的[29].
马铃薯的长途asa运输
在初步实验中,我们观察到ASA的昼夜变化t土豆成熟源叶子的含量。昼夜光合组织中ASA含量的昼夜振荡是已知的[例如[30.以及叶片中AsA积累的光诱导作用[例如:[31把器官沉下去。已经观察到光诱导的特定AsA生物合成酶的表达[例如:[30.]]以及ASA生物合成助焊剂的一般增加[11].通过在光/暗状态不一致的橱柜中种植植物,我们能够同时在叶片AsA差异最大的黑暗或光明阶段取样植物t内容发生。叶亚撒t含量呈现出日变化,最大水平(在光相观测)比在黑暗中观测到的最低水平高2倍。光期植物源库器官的韧皮部渗出液均表现出显著的高AsAt水平比从黑暗阶段的植物获得的流出物。事实上,抗坏血酸t从光相植物的核心毒品中渗出物的含量超过深度植物的4倍。我们的研究结果表明,源叶ASA生物合成的变化迅速影响了韧皮肌ASAt导致运输的内容新创直接合成AsA显影水槽。这在实验中也得到了证实,其中外源性AsA前体如lgall或l-gal通过襟翼技术提供给来源叶,一种导致大幅作用的处理t在韧皮部渗出物中富集。我们还把助理检察官的人数增加了一倍多t源叶的含量由整株植物“大量”供给外源物质l-胆碱处理24 h后,大部分源叶的AsA含量显著增加t增加水槽器官,如鲜花和开发块茎。
据我们所知,这是第一次证明AsA在叶片中的积累导致贮藏器官中AsA的增加,这可能解释了光照射对水果和蔬菜中AsA含量的积极影响[32].在韧皮部抗坏血酸浓度反映在叶肉AsA含量变化的快速变化表明抗坏血酸在存储叶子不会发生,不像同化碳水化合物的情况下。我们很容易推测,抗坏血酸产生的叶肉细胞内直接采取了由SE / CC复合物易位,也如从结果中推导出报告Franceschi酒店和Tarlyn [18].已经在许多植物膜中研究了ASA转运的动力学,例如血浆,叶绿体膜,鳞片状膜和调色剂[33].然而,迄今为止,虽然已经鉴定了编码推定的核碱基/抗坏血酸转运蛋白(NAT)的至少12个基因已经鉴定了传输蛋白。拟南芥基因组。NAT属于整体膜转运蛋白的超家族,它们在生物膜上移动嘌呤,嘧啶或抗坏血酸,其还包含特异于抗坏血酸的哺乳动物转运蛋白[34].这些转运体的功能特征正在研究中[35].由于植物韧皮部包含抗坏血酸生物合成的酶完全补19],我们已经推测抗坏血酸从叶肉的韧皮部间接转让可能涉及的运输非充电中间l跨膜加。我们在这里展示了l- 半乳糖或l-胆到源叶导致韧皮部分泌物中AsA的富集和块茎匍匐茎和正在发育的块茎中AsA的积累。此外,我们还观察到l- (1 -14马铃薯的来源韧皮部Gal(资料未显示),如已在n benthamiana[19].
结论
我们在这里提供的证据,在马铃薯植株中的长途运输,证实了早期的发现答:芥和紫花苜蓿[18,提示AsA源库易位可能是植物中普遍存在的现象。尚待确定的是,韧皮部衍生的AsA(无论是在叶肉还是在韧皮部本身合成的)对马铃薯块茎中AsA总体积累的相对贡献。从正在发育的马铃薯块茎中切下的切片可以从各种基质中合成AsA (Hancock和Viola,未发表)。此外,microtubers获得在体外以蔗糖为唯一碳源在黑暗中培养的节节扦插的AsA含量与大田种植的块茎相似[21].特别是,这些结果尤其难以调和,并且在块茎ASA积累中长途ASA运输的主要作用的假设中难以调和。将需要在组织和器官特异性下调ASA生物合成的转基因马铃薯植物的发展,以解决这个问题。
方法
植物材料和生长条件
土豆植物cv。Desiree在堆肥的自然光下的未加热的凉凉凉锅中种植了40厘米的罐子。为了使植物对人工光/黑暗循环,在35天至三洋FitoTron 1700受控环境机柜后转移植物,并在14小时内保持14天,每天和夜间温度为22°C和15°C分别。光由60 W白炽灯提供,提供900μmolm的光子通量2年代-1在树冠顶部。相对湿度保持在恒定的70%,植物每天浇水。在所有情况下的实验之后,从种植40-60天tuberising植物上进行。整个文本匍匐茎被定义为不溶胀(沿着端子15毫米均匀直径)或tuberising(肿胀直径2-5毫米)。直径5-10毫米之间肿胀被定义为发展块茎。
植物组织中AsA的定量分析
用含有5 mM三(2-羧基乙基)磷酸盐酸盐TCEP (9:1 v/w)的冰冷5%偏磷酸(MPA)在研钵和杵中提取组织。然后将样品置于冰中60分钟,以使脱氢抗坏血酸还原为AsA,因此,所有数据均报告为总AsA池(AsAt)即减少l- 血液酸+脱氢血脂酸。然后在1℃和ASA下以16000g以16000g离心5分钟的样品t在上清液中,根据Hancock等[36].简而言之,将20μl样品上清液注入300×7.8mm Id Coregel 64h离子排除柱(相互作用色谱,San Jose,Ca,USA),其中4×3mm ID Carbo-h+保护柱(PHENOMENEX,Macclesfield的,UK)保持在50℃。流动相为8毫米高2所以40.6 ml min-1亚撒t采用Gynkotech UVD 340S二极管阵列探测器(Dionex, Camberley, UK)在245 nm波长下进行检测。
韧皮部中AsA的检测
利用King和Zeevart开发的改良方法从源叶或结核匍匐茎的叶柄中收集韧皮部渗出物[24].在切除器官的切除后,在水下除去一部分叶柄(5mm)或匍匐茎(10mm),冲洗样品,切割端转移至含有200μl15mMEDTA pH 7.5的0.6ml反应管。在叶柄的情况下,将样品在20℃下转移到预加湿的气氛中,并在黑暗中收集90分钟的渗出物。在匍匐茎的情况下,从剩余的切口收集渗出物,剩余物留在植物上,湿纸围绕反应管的顶部缠绕以最小化蒸发。对照样品并行地运行,其中叶柄或匍匐茎在5mM CaCl中孵育2pH 7.5诱导胼胝质胶凝,减少渗出[24].在孵育结束时,将MPa和TCEP加入到样品中以分别为5%和5mm的终浓度。离心后(16000克,1°C,5分钟),ASAt如上所述浓度通过HPLC测定。在块茎使用硝酸银抗坏血酸的组织化学定位3.方法如前所述[19].简单地说,块茎被手切成大约2mm的切片,在蒸馏水中洗涤,用5% (w/v) AgNO固定和染色3.用含5% (v/v)冰醋酸的66% (v/v)乙醇水溶液在3°C黑暗中溶解24小时。在乙醇氢氧化铵(95% (v/v) 70%乙醇,5% (v/v) nhh中洗涤两次15分钟后停止反应4OH ACS试剂,Sigma-Aldrich, Dorset, UK) [25].最后将组织转移到70% (v/v)乙醇中,在3°C下保存,然后拍照。
羧基荧光素在马铃薯植株中的运输
通过如前所述的荧光可传送分子羧脲核(CF)可视化通过马铃薯茎进入显影块茎的Phloem Transports。22].用20ml羧基氟尿嘧啶二乙酸酯(CFDA)溶液标记植物(1mg mL-1)通过使用塑料注射器的叶背面开放气孔引入的。该乙酰化的化合物是能穿过细胞膜扩散不像其在体内被内源性酯酶生产的,并且被用作从韧皮部为韧皮部股线的标记物和共质体卸载其脱乙酰化衍生物CF [37].在进行手切片(2mm)并使用MRC2000共聚焦显微镜(Bio-Rad, Hemel Hemstead, UK)对茎和库组织进行荧光检测之前,将植株放置5小时转移CF。
为叶子提供前体
叶亚撒t使用“襟翼”技术的适应来操纵水平[18].在末端小叶中脉两侧切开15 mm的切口,将形成的“皮瓣”放入0.6 ml eppendorf管中,管中含有500 μl 20 mm MES pH 5.5, 2 mm CaCl2孵育期结束时,叶片在液氮中研磨,在含5 mM TCEP (9:1 v/w)和AsA的5% MPA中提取tHPLC测量的含量。为了测量Phloem渗出物,在水中切除处理的小叶,并置于Eppendorf管中,用于收集韧皮渗透物,如前所述。在一些实验中,所有茎上的四个下节点的末端小叶(每株植物8至10之间)同时供应500μl20mmmes pH 5.5,2mM CaCl2单独或含25毫米l-GalL处理24 h。每个处理用4株独立的植物。在孵化的最后,单个植株被分离成花、源叶、叶柄、植株茎、非结节状匍匐茎(末端15mm)或结节状匍匐茎(膨大部分)。组织立即在液氮中冷冻并冻干。冻干后的组织磨成粉末,在5% MPA、5 mM TCEP (19:1 v/w)和AsA中提取每个组织的3 × 1 g组分t用高效液相色谱法分析每个提取物的含量,给出每个组织的平均值。植株中未发现直径大于5毫米的块茎。
参考
- 1.
Nandi A, Mukhopadhyay CK, Ghosh MK, Chattopadhyay DJ, Chatterjee IB:陆地脊椎动物维生素C生物合成的进化意义。生物医学杂志。1997,22:1047-1054。10.1016 / s0891 - 5849(96) 00491 - 1。
- 2.
维C在高等植物中的生物合成途径。自然科学。1998,393:365-369。10.1038/30728。
- 3.
康克林PL,诺里斯SR,惠勒GL,威廉姆斯EH,斯米尔诺夫N,最后RL:国内生产总值甘露糖的植物抗坏血酸(维生素C)的生物合成中的作用遗传证据。国家科学院院刊USA。1999年,96:4198-4203。10.1073 / pnas.96.7.4198。
- 4.
Conklin Pl,Saracco SA,Norris SR,最后RL:鉴定抗坏血酸缺陷拟南芥突变体。遗传学。2000,154:847-856。
- 5.
Jander G, Norris SR, rosley SD, Bush DF, Levin IM, Last RL:拟南芥后基因组时代的图基克隆。植物生理学报。2002,29(4):457 - 461。10.1104 / pp.003533。
- 6.
Jain Ak,Nessler Cl:植物中抗坏血酸生物合成障碍的代谢工程。mol繁殖。2000,6:73-78。10.1023 /答:1009680818138。
- 7。
Agius F, González-Lamothe R, Caballero JL, Muñoz-Blanco J, Botella MA, Valpuesta V:通过a的过表达提高植物体内维生素C水平D-galacturonic酸还原酶。生物技术。2003,21:177-181。10.1038 / nbt777。
- 8。
Radzio JA, Lorence A, Chevone BI, nesler CL:l- gulono -1,4-内酯氧化酶的表达挽救维生素c缺乏拟南芥(职业训练局)突变体。植物生态学报。2004,33(4):489 - 494。10.1023 / B: PLAN.0000023671.99451.1d。
- 9。
laurence A, Chevone BI, Mendes P, nesler CL:myo肌醇加氧酶为植物抗坏血酸的生物合成提供了一个可能的切入点。植物营养与肥料学报。2004,29(4):457 - 461。10.1104 / pp.103.033936。
- 10.
Wolucka BA, van Montagu M: GDP-甘露糖3',5'-epimerase形成GDP-l-gulose,一个假定的中间物新创植物中维生素C的生物合成。中国生物医学工程学报。2003,27(4):493 - 498。10.1074 / jbc.M309135200。
- 11.
Gatzek S,Wheeler GL,Smirnoff N:反义抑制l半乳糖脱氢酶在拟南芥为其在抗坏血酸合成中的作用提供证据,并显示光调制l半乳糖合成。植物学报,2002,30:541-553。10.1046 / j.1365 - 313 x.2002.01315.x。
- 12.
粮农组织/世界卫生组织专家磋商会,曼谷,泰国:维生素c在人体维生素和矿物质需求中的作用,2002,ESN出版物,73-86。
- 13.
斯米尔诺夫N:的作用及其在植物中抗坏血酸代谢。安博特。1996年,78:661-669。10.1006 / anbo.1996.0175。
- 14.
Justi KC, Visentainer JV, Evalazio de Souza N, Matsushita M:贮藏紫金Myrciaria dubia果肉的营养成分和维生素C稳定性。拉美裔美国人。2000,50:405-408。
- 15.
食品标准局:McCance和Widdowson的《食品成分》,2002,剑桥:皇家化学学会
- 16.
夏威夷水果和蔬菜中维生素C和类黄酮的含量。食品学报,2004,17:1-35。10.1016 / s0889 - 1575(03) 00066 - 8。
- 17。
小麦种子萌发初期抗坏血酸盐的合成和过氧化物酶活性。植物营养学报。1997,10:894-900。10.1034 / j.1399-3054.1997.1000415.x。
- 18。
Franceschi VR Tarlyn NM:l-抗坏血酸在植物源叶韧皮部积累并运输到库组织。植物营养与肥料学报。2002,30(4):449 - 456。10.1104 / pp.007062。
- 19。
HANCOCK RD,MCRAE D,Haupt S,Viola R:合成l韧皮部中的抗坏血酸。生物谷bioon . 2003, 3: 7-10.1186/1471-2229-3-7。
- 20.
Viola R, Brennan RM, Davies HV, Sommerville L:l-抗坏血酸的积累酷栗初步林志强,王志强,王志强,等。
- 21.
Viola R, Vreugdenhil D, Davies HV, Sommerville L:积累l马铃薯块茎匍匐茎尖的-抗坏血酸(茄属植物tuberosoml .)。植物生理学报,1998,22(6):514 - 514。
- 22.
Viola R, Roberts AG, Haupt S, Gazzani S, Hancock RD, Marmiroli N, Machray GC, Oparka KJ:马铃薯块茎化涉及质外体向共质体韧皮部卸载的转换。植物学报。2001,13:385-398。10.1105 / tpc.13.2.385。
- 23.
Davey MW, Van Montagu M, Inze D, Sanmartin M, Kanellis A, Smirnoff N, Benzie IJJ, Strain JJ, Favell D, Fletcher J: Plantl-抗坏血酸:化学、功能、代谢、生物利用度和加工效果。中国食品科学。2000,20(4):427 - 434。10.1002 / (SICI) 1097 - 0010 (20000515) 80:7 < 825:: AID-JSFA598 > 3.3.CO; 2 y。
- 24.
王国王,Zeevart Jad:通过螯合剂来增强从切叶片的Phloem渗出。植物理性。1974年,53:96-103。
- 25.
奇诺伊NJ:在醇,酸性硝酸银试剂抗坏血酸的组织化学定位的特异性。Histochemie。1969年,20:105-107。10.1007 / BF00268703。
- 26.
工艺介绍:马铃薯筛管结构及运输。植物生理学杂志。1993,8:81-104。
- 27.
leeshem b,讽刺的假释:在休眠开始和结束的土豆射击中的有丝分裂的速率。安博特。1972,66:687-691。
- 28.
Vreugdenhil d,许X,荣格JS,面包车Lammern AAM,尤因EE:与块茎形成在单节点相关联的马铃薯初始解剖变化(茄属植物tuberosum岩屑:重新评估。《南京大学学报(自然科学版)》1999,84:675-680。10.1006 / anbo.1999.0950。
- 29。
Potters G, De Gara L, Asard H, Horemans N:抗坏血酸和谷胱甘肽:细胞周期的守卫者,犯罪的伙伴?植物营养与肥料学报。2002,20(4):537-548。10.1016 / s0981 - 9428(02) 01414 - 6。
- 30.
田青木,向kai F, Asai N, Nakajima N, Kubo A, Aono M, Saji H:光控基因编码的表达l-半乳糖-γ-内酯脱氢酶影响抗坏血酸池的大小拟南芥.植物科学学报,2003,23(4):591 - 598。10.1016 / s0168 - 9452(03) 00122 - 5。
- 31.
抗坏血酸代谢与氧化应激的关系。生物化学学报,1996,24:472-478。
- 32.
李SK,卡迪尔AA:穗和影响园艺作物的维生素C的含量采后因素。采后生物学TECHNOL。2000,20:207-220。10.1016 / S0925-5214(00)00133-2。
- 33.
Heremans N,Foyer Ch,Potters G,Asard H:抗坏血液功能和植物相关的运输系统。植物理性生物化学。2000,38:531-540。10.1016 / s0981-9428(00)00782-8。
- 34.
Tsukaguchi H, Tokui T, Mackenzie B, Berger UV, Chen XZ, Wang Y, Brubaker RF, Hediger MA: A family of哺乳动物Na+- 依赖l抗坏血酸转运蛋白。《自然》1999 399:70-75。10.1038/19986。
- 35.
李强,舒尔特斯NP:拟南芥基因座At5g62890是一个抗坏血酸转运蛋白家族成员,在心皮传递束和绒毡层细胞中优先表达。植物科学学报,2002,21(4):457 - 461。10.1016 / s0168 - 9452(02) 00086 - 9。
- 36.
杨志强,杨志强,杨志强:生物合成l-抗坏血酸(维生素C)酿酒酵母.微生物学杂志。2000,32(4):434 - 434。10.1016 / s0378 - 1097(00) 00155 - 5。
- 37.
罗伯茨AG,圣克鲁斯S,罗伯茨IM,在此之前DAM,特金R,Oparka KJ:韧皮部卸在水槽叶烟草benthamiana.荧光溶质与荧光病毒的比较acta botanica sinica(云南植物研究),1997,9:1381-1396。10.1105 / tpc.9.8.1381。
确认
这项工作得到了苏格兰环境和农村事务部的支持。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
LT承担了大部分的生理生化实验。RDH参与了研究的设计和协调、生化实验和手稿的撰写。SA参与了生理生化和组织化学实验。公司承担了国家食品药品监督管理局土豆植株的标识和银染工作,并参与了数字的制作。RV构思了研究,参与了研究的设计和协调,并起草了研究手稿。
作者为图像提交的原始文件
权利和权限
关于这篇文章
引用这篇文章
Tedone, L., Hancock, R.D., Alberino, S.et al。长途运输的l-抗坏血酸BMC植物杂志4,16(2004)。https://doi.org/10.1186/1471-2229-4-16
收到了:
接受:
发表:
关键字
- TCEP.
- 脱氢抗坏血酸
- 水槽的器官
- 源离开
- 韧皮部渗出物