摘要
背景
硬粒小麦(Triticum Turgidum.L. var.硬质)北美大草原土壤种植的谷物经常超过拟议的国际贸易标准。为了了解负责芽和谷物中升高的CD累积的生理过程,在一对近代杜兰氏粥小麦线的幼苗中研究了CD摄取和易位,高低,晶粒的CD积累。
结果
在短期研究(<3小时)使用109cd标记的营养液在时间和浓度上没有差异109CD通过根积累。相比之下109尽管全植物相同,从根延长曝光(48-60h)射击中的根部易位以拍摄(48-60小时)均为1.8倍109CD累积在线。在同一时期,109高Cd积累系根压木质部分泌物中Cd的含量比高Cd积累系高1.7 ~ 1.9倍。两条线之间没有区别65锌的积累或分配可以解释不同品种间的差异109CD易位。
结论
这些结果表明,通过直接控制灌浆过程中Cd从根向地上部的转移,或通过控制地上部可转移到籽粒的Cd库的大小,限制根向地上部的Cd转移可能限制了硬粒中Cd的积累。
背景
镉(Cd)倾向于在北美草原土壤中生长的粮食作物中积累,这些土壤中Cd的有效性自然提高[1那2].与面包小麦相比(Triticum Aestivum.L.),杜兰姆小麦(T. Turgidum.L. var.硬质)具有在谷物中积累Cd的遗传倾向[3.],其水平往往超过谷物中镉的国际建议限值[4.那5.].因此,有必要开发低Cd积累的硬粒品种和农艺管理措施,以最大限度地减少Cd的土壤-植物转移。尽管在了解土壤因素和农艺管理如何影响作物中Cd积累方面已经取得了进展[1],负责杜兰粒籽粒升高的生物过程仍然明显差。
杜兰姆小麦显示谷物中CD积累的相当大的基因型变异[4.-6.].在幼苗的幼苗叶片中的高和低积聚近代近代线的粒子中的镉积累与幼苗叶片的CD积累相关[2].这表明营养阶段中CD积累的差异可能是谷物中CD积累的重要决定因素,或者至少指示谷物填充过程中的CD输送到谷物。幼苗芽中CD积累的基因型变异可能来自土壤中CD摄取的差异,或从植物内的CD运动差异。
CD的根吸收和根部拍摄易位已经表征了各种物种,包括小麦[1].这些过程直到最近才被作为硬粒小麦高镉积累的可能解释。哈特等等。[7.比较了面包小麦和硬粒小麦幼苗对Cd的吸收和转运。面包小麦品种具有较高的全株和根系吸收率,以及较高的向地上部的转运率[7.,表明这些因素对硬粒小麦籽粒镉积累量的增加没有影响。高镉积累和低镉积累硬粒小麦品种Berkelaar和Hale的短期试验[8.], Cd积累量低的品种根系对Cd的吸收速率较高。Archambault等等。[9.在一对高和低积聚的近代母线中,幼苗的短期根CD吸收没有差异。经过较长的(> 24小时)暴露后,在高CD累积的ISOLLINE中,CD的易位率为1.5至2倍[9.].
这些研究的矛盾结果可能部分反映实验条件的差异,例如在短期摄取研究中没有解吸方案去除细胞壁结合CD [8.那9.,或长期研究中从吸收溶液中几乎完全消耗Cd [9.].根系吸收和根-茎转位的相对重要性的差异也可能是由于实验选择的基因型造成的。在哈特的工作中等等。[7.那10],面包小麦对Cd的根系和全株吸收率以及向地上部的转运率较高,与锌的吸收和转运模式相似。这些品种根系吸收Cd和Zn的研究进展[11揭示了Cd之间竞争的相互作用2+和锌2+,提示Cd和Zn在根细胞膜上可能存在共同的转运系统。硬粒小麦和面包小麦Cd吸收和转运的差异[j]。7.]可以简单地反映Zn吸收的差异,而不是CD累积的内在差异。
最近对硬粒小麦近等基因系的田间试验表明,籽粒镉积累等值线的差异与锌或其他阳离子的积累无关[5.].在这些ISOL ine中调节CD和Zn积累的机制的表观独立性提供了重新检查谷物中CD积累与CD的根部摄取和根部对晶体的关系的机会。本研究的目的是确定根部吸收和根到拍摄的易位吗?109两种近代近代硬浆小麦线幼苗的CD与分离物中的倾向累积成熟晶粒中的CD。我们还研究了吸收和易位65以确定等值线之间是否有差异109Cd积累是特定于Cd的。
结果
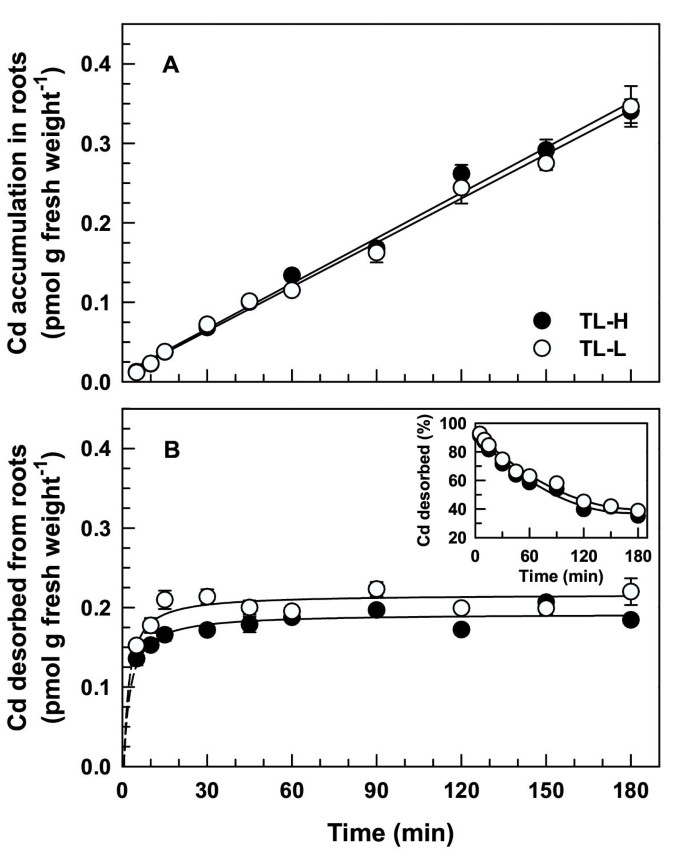
短期,时间依赖109根中的Cd积聚(除去解吸级分)是线性的至少180分钟(图1),在高和低CD累积的ISOLINE之间没有显着差异(F80= 1.41,p = 0.238)。解冻109Cd在根中的积累迅速(10-15分钟)饱和(图1 b),在低cd积累等值线(F80= 47.9, p < 0.001)。可解吸组分占主导地位109CD累积在根部(解吸+非解释),暴露时间小于120分钟(图1).180分钟后,可解吸109Cd在TL-H和TL-L根系中的积累量分别占总积累量的35和39%(图3)1 b插图)。在这两条等值线中,根尖(1cm)中镉的积累速率是根基中的2.1倍(图)2).ISOLINES之间没有显着差异109根提示中的CD累积(f1,20= 1.15, p = 0.295)或底(F1,20= 2.83, p = 0.108)。180分钟后,109Cd从根到茎的转运可以忽略不计(<1%的不可解吸积累),等值线之间没有差异(数据未显示)。按时间的65在180分钟内的解吸和未解吸的零馏分中的Zn积聚与观察到的109Cd(数据未显示)。在短期时间依赖性上,等值线间无显著差异65解吸根锌积累(F80= 0.82, p = 0.368)。
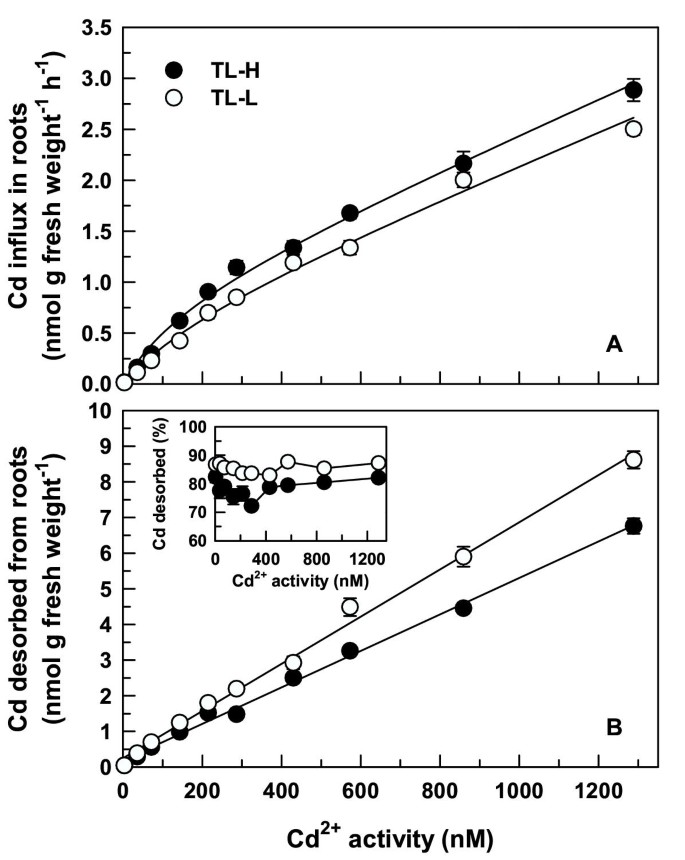
CD浓度依赖的摄取动力学2+在4 - 1288 nM (5-1800 nM总Cd)的活性范围内,两条等值线的特征是平滑的非饱和曲线(图)3).这些曲线可以被图形地解剖到可饱和和线性的组分中。通过将双曲线(MICHAELIS-MENTEN动力学)和使用以下等式(MICHAELIS-MENTEN动力学)和线性函数与原始数据的线性函数的总和来导出可饱和和线性组分的动力学常数:
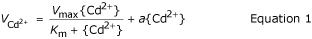
在{Cd2+}是Cd2+活动,V.Cd2+是光盘2+吸收速率,V.最大限度那K.m,一种动力学参数。R.2拟合曲线的值分别为T1-H和TL-L的0.977和0.982(表1).单独描述CD的动力学2+-influx如等式一样1对于两个等值线(相似的R2值),但是绘制曲线的绘制残差的系统变化使得该模型的拟合与要不正确的数据建立拟合(数据未示出)。虽然CD涌入2+在大多数Cd中,TL-H的含量略高于TL-L2+活动大于100纳米(t≥2.05,p < 0.05)时,可饱和物(K.m那V.最大限度)和线性(一种)分量在两条等值线上统计相似(表1).在单独的实验中,Cd2+较低浓度范围(0.05-100 nM)内流呈线性,等值线之间没有差异(数据未显示)。为Cd的高、低积累等值线的差异2+流入特性可以忽略不计,没有进一步的实验进行表征饱和和线性成分。许多早期的研究已经提供了强有力的环境证据,证明线性成分是由不可解吸的细胞壁结合组成的[7.那10那12].
可解吸Cd的浓度依赖性积累2+根数随Cd的增加呈线性增加2+活动(图3 b),在低镉积累等值线(F80= 81.1, p < 0.001)。与短期吸收实验一致,可解吸Cd2+在30分钟内暴露于广泛的生理相关的CD后,由根累积累积2+活动(图3 b而TL-L组略高于TL-H组(F80= 124,p <0.001)。CD之间存在显着变化2+活性为可解吸Cd的比例2+(F9,80= 4.44, p < 0.001),尽管这完全是由于一个Cd的低值2+活动(286海里)。可解吸Cd的比例无显著变化2+在剩下的Cd中2+活动。
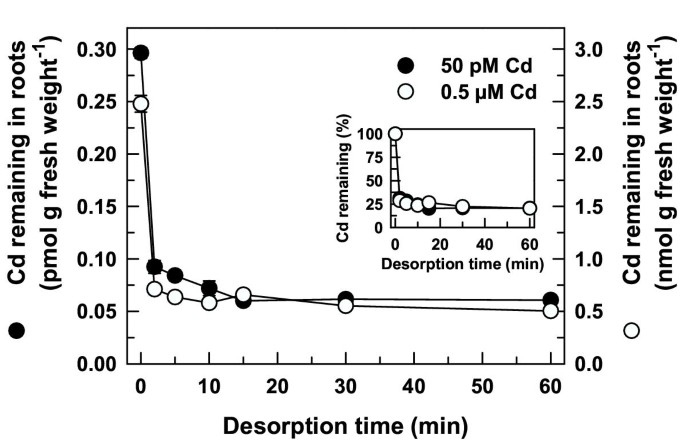
用50μmDTPA以完全营养溶液的解擦液迅速且与摄取溶液中的Cd浓度无关(图4.).在30分钟摄取不同浓度的109CD(50 pm和0.5μm),大部分109在前2分钟内去除解吸的Cd。解吸10 ~ 15分钟后,几乎没有额外的109从根部放出的Cd。的比例109两种Cd浓度在60分钟后的解吸效果相同(80%,图)4.插图)。在高(TL-H) cd积累等值线中也测量了类似的解吸曲线(数据未显示)。
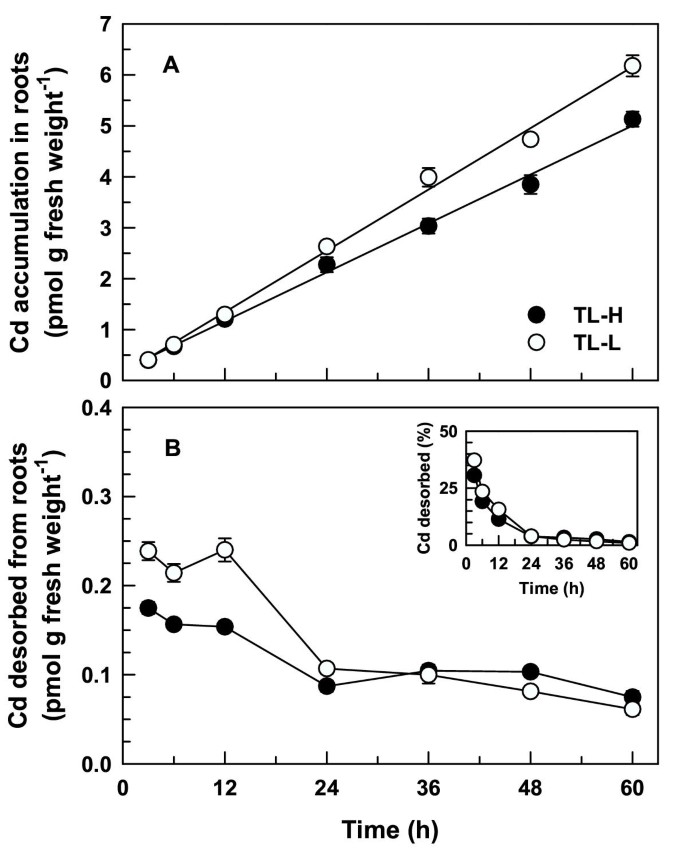
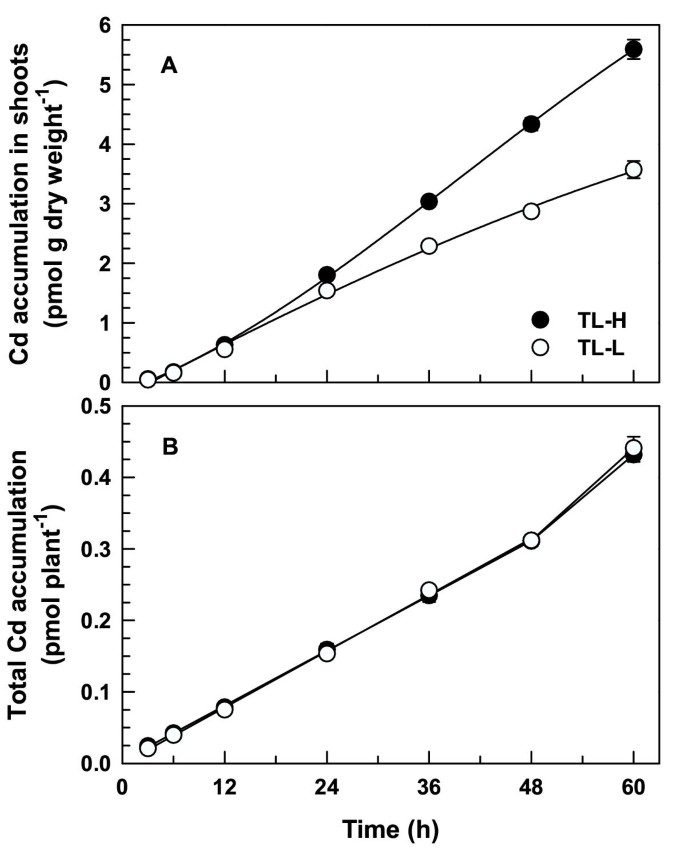
长期暴露幼苗109Cd表明,两条等值线之间Cd的分配存在差异。按时间的109Cd在解吸根中的积累在60 h内呈线性(图)5),而TL-L累计更多109持续暴露24-60小时后,Cd比TL-H的含量高(t≥2.09,p < 0.05)。的数量109Cd在3-12小时后(约0.2 pmol g鲜重)从根中解吸-1,图5 b)与短期研究中的解吸量相似(图1 b).对于超过12小时的摄取期109根系解吸Cd下降约50%,根系解吸Cd的数量和比例在等值线间无显著差异109CD从根中解吸(t≤1.82,p> 0.05)。在60-H吸收周期之后,解冻109Cd积累占总量的比例不到1.5%109Cd在两个等值线的根中的积累(图5 b插图)。更大的109TL-L根中的CD累积是易易位慢的结果109CD到这个isoline的枝条(图6),而不是更大的吸收根系。全株等值线间无显著差异109CD累积在此期间(f84= 0.28,p = 0.601;数字6 b).这109当暴露时间大于12 h时,TL-H的地上部镉含量显著高于TL-L (t≥2.09,p < 0.05)。在一个60-h的上限,根到拍摄109TL-H中的CD易位比在TL-L中高1.8倍(表2).
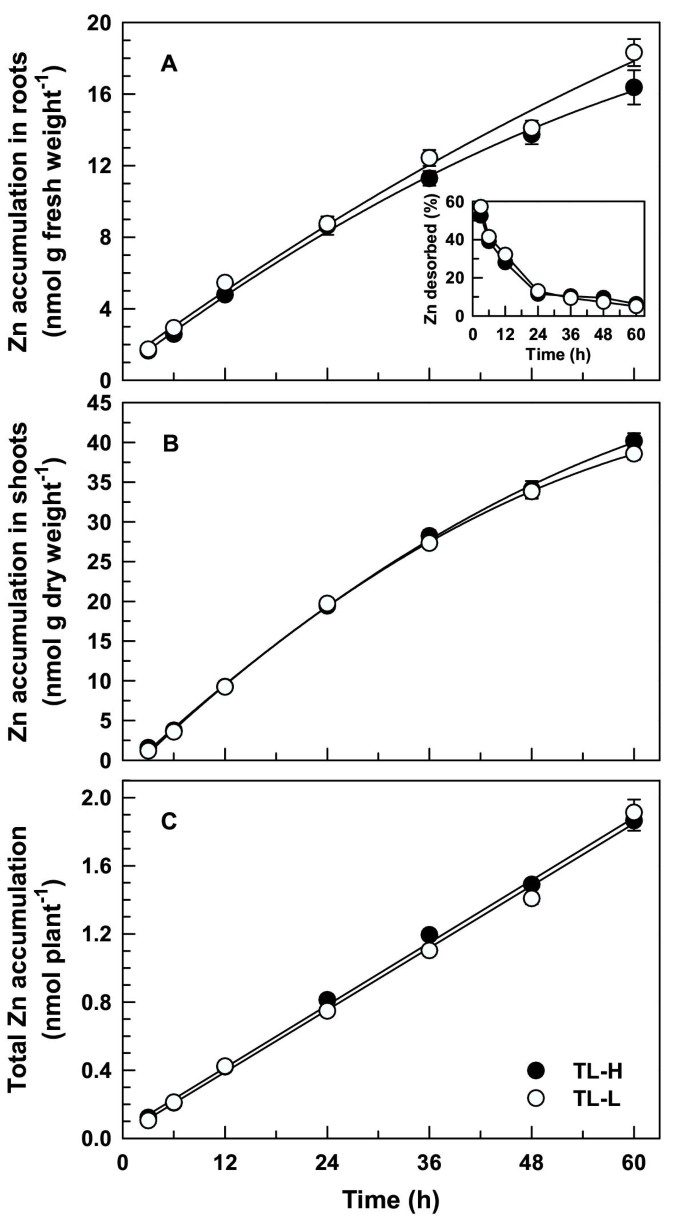
与此相反109CD,没有显着差异65两条等值线之间的锌分配(F84<0.01,p = 0.947;桌子2).相似的,等值线之间没有显著差异65Zn射击射击(f84= 1.81,p = 0.182;数字7B.或全植物(f84= 2.94,p = 0.090;数字7C.).长期65Zn累积在根中(图7A)在TL-L中略高于TL-H (F84= 7.64,p = 0.007)。
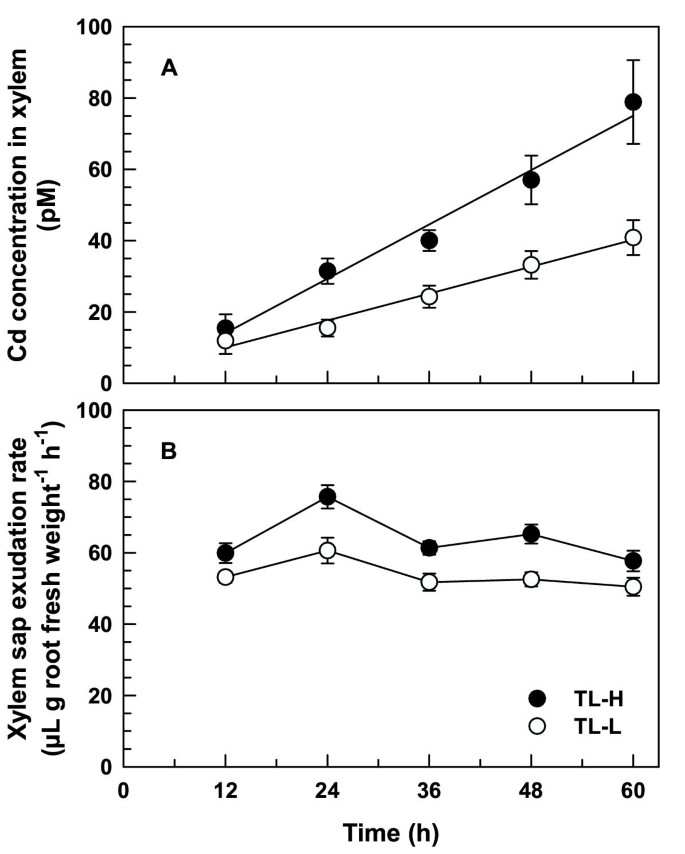
的时间进程109Xylem Sap根压渗透物中的Cd浓度(图8A)类似于109地上部镉积累。这109Xylem SAP中的Cd浓度线性增加至多60小时,TL-H显着高于TL-L,用于摄取周期超过12小时(t≥2.07,p < 0.05)。在60小时的摄取期后109在高Cd积累等值线上,木质部汁液中Cd浓度增加1.9倍。这109木质部汁液中Cd浓度与Cd浓度呈正相关109Cd在两个等值线上的积累量(TL-H和TL-L的r分别为0.863和0.705)。TL-H组的汁液渗出率始终较高(F90= 33.3, p < 0.001;数字8B.).
讨论
本研究提供了证据表明CD从根部易位到幼苗中射击的幼苗和CD堆积粒蓝的杜兰麦小麦的积累。高晶粒Cd Isolarine(TL-H)平均为1.8倍高的CD易位(拍摄109CD / root109Cd率,表2)在连续暴露于无毒CD浓度的48-60小时后,比低晶粒Cd Isolare(TL-1)。在同一时期,109在高CD累积的ISOLINE中,根压XYLEM渗出液中的CD浓度为1.7至1.9倍(图8A).在早期的研究中,具有相同的近代线109芽中的CD积累和拍摄/根109Cd积累比对苗期高积累系和低积累系的鉴定效果较好[9.].然而,该研究没有明确建立CD通过根的基因型变异,有助于芽CD积累中的分离性差异。在短期摄取实验中(<8小时)根系没有差异109CD吸收,但遵循更长的曝光(> 24小时)109高谷CD ISOLALE的根和芽中的CD积累较高[9.].本研究结果表明,根-地上部镉转运的基因型差异是地上部镉积累等值线差异的唯一原因。根系对Cd的吸收在等值线之间没有差异(图)1那2那3.)或全植物(图6 b),可以解释根-茎间Cd转运的差异。
在不同的作物品种中,Cd在根中的保留是导致地上部和籽粒中Cd积累较低的一个因素。在盆栽土壤试验中,4个硬粒小麦品种幼苗地上部镉积累的差异与根-地上部转移的差异有关[13].在高Cd土壤中生长2周后,4个品种的单株Cd积累总量相似,但2个高Cd品种的地上部Cd含量较高,根-地上部Cd转移量较高,根系Cd含量较低[13].大豆的差异(大豆Cd在种子中的积累量也与营养期根-茎的转运有关。在3-4周龄大豆植株中,Cd向地上部的转运占全株Cd积累的比例,高Cd积累品种高2.6-3.2倍[14].在一对土豆(茄属植物tuberosum)品种,块茎CD浓度的差异可以在低CD累积品种的根系中进行3倍的CD保留3倍以下[15].玉米基因型变异(Zea Mays.)对于在CD污染的土壤中生长的19种近交系中的CD积累,溶液培养与内部分布的差异有关[16].尽管两组几乎相同的全植物CD积累,高CD玉米线中的射击CD积累量高于低CD系高达7倍[16].与这些结果相反,哈特等等。[7.发现,面包小麦品种(低谷物CD)具有较高的全植物和根CD摄取率,以及比杜兰小麦品种(高晶粒CD)的枝条更高的CD易位。我们的结果与HART之间的矛盾等等。[7.可能与锌吸收和转运的基因型差异有关。
锌的短期积累和长期积累在等值线之间没有差异。在60 h的吸收周期内,当Cd转运等值线之间的差异变得明显时,两条等值线中茎、根锌浓度、全株锌积累量和锌分配量几乎相等(图2)7., 桌子2).这结果与哈特的工作形成鲜明对比等等。[7.那10].在使用杜伦姆和面包小麦品种的一系列实验中,在面包小麦品种中,CD和Zn的摄取和易位比杜兰姆小麦品种更高[7.那10].最近与这些品种的研究表明CD2+和锌2+以互换方式竞争抑制根吸收[11],建议CD和Zn竞争血浆膜的共同转运蛋白。其他研究还证明了Zn对CD通过根镉吸收的抑制作用[17-19].重金属离子,如Cd2+,很可能是通过其他二价阳离子(如锌)的转运体穿过植物膜2+,CU2+,Fe.2+,或2+)表现出差的选择性[20.].最近的分子研究表明,许多阳离子转运体具有广泛的底物范围,能够吸收非必需金属,如Cd。例如,重金属转运体cDNA、ZNT1,从超累加器克隆Thlaspi Caerulescens.,显示用于调解两个Zn的吸收2+和Cd2+在酵母中表达时(酿酒酵母) [21].硬粒小麦和面包小麦在Cd吸收和转运方面的差异[7.]可能仅仅反映了这些品种在锌吸收和转运方面的相似差异[10而不是Cd积累的内在差异。本研究中Cd和Zn易位的独立性为这些同线中低Cd性状的特异性提供了额外的证据。田间试验表明,Cd在籽粒中积累等值线的差异与其他阳离子的积累无关[5.].
将摄取到痉挛性结合中的互联网上的影响是二价阳离子根除的研究中的一个主要问题。二价阳离子在骨质中的结合可以代表根部的大部分金属积聚,特别是在短时间内进行[22].在没有或不充分去除离体中结合的Cd的研究中,根对Cd的短期(<3 h)时间依赖性积累的特征是快速的曲线积累阶段,随后是较慢的线性积累阶段[17那23-25].在暴露之后,具有大量竞争阳离子或螯合剂的解毒根已经成功消除CD或Zn积累的曲线阶段[7.那12那25].这些结果与由快速饱和,可解吸的组分和线性的未解吸组成的根部组成的短期Cd积聚一致,这是一项清晰地显示的杜兰麦根根(图)中清楚地显示的图案(图1).快速饱和的解吸组分(图1 b)可能与细胞壁成分的阴离子电荷交换结合[22].解吸组分的饱和反映了CD之间的平衡2+和其他阳离子与细胞壁位点结合,而不是用CD的结合位点的绝对饱和度2+.显然,根有更大的能力,可解吸的Cd绑定(图3 b那4.).虽然解吸根的Cd积累呈线性,随时间而变化,但在接近原点的地方与y轴相交(图)1),表明从骨盆中完全除去Cd,不可解吸的细胞壁结合级分的可能性不能折扣,如其他研究用CD和Zn所示[7.那10那12那18那19那26].
在本研究中,用含有50 μM DTPA的完整营养液在2℃下解吸根系30分钟,以螯合Cd。该方法从根系解吸Cd的数量和相对比例取决于暴露时间和Cd浓度。在快速的初始饱和后,Cd从根部的解吸量保持不变,持续12 h(图)1 b那5 b).在更长的暴露期后,CD下降从根部下降(> 12小时,图5 b)可能是由于在此期间吸收溶液中Cd的消耗增加了2倍,因为可解吸池的大小直接取决于根系接触到的外部Cd浓度(图)3 b).在较短的暴露时间内(<120 min),可解吸Cd池占根系Cd积累总量的比例占主导地位,但随着暴露时间的增加,可解吸Cd池的吸收迅速下降(图)1 b插图,5 b插图)。而根系可解吸的Cd积累总量所占比例与外源Cd浓度无关。在大范围的Cd浓度(50 pM至1.8 μM)下暴露30分钟后,可解吸分数持续较高,TL-H和TL-L的可解吸分数分别在72-82%和75-87%之间(图)1 b插图,3 b插图,4.插图)。这一结果与镉和锌的几项研究形成了鲜明对比[7.那10那18],其中可解吸的Cd或Zn的比例随吸收溶液浓度的增加而增加。
在短期实验中,TL-L的根中Cd的解吸量略高(图)1 b那3 b)不太可能解释在这条等值线上Cd向芽的转运减少。Cd持续暴露24 h后才记录Cd易位等值线的差异(图)6那8A, 桌子2).此时,根系中可解吸Cd积累量小于Cd总积累量的4%,且高、低Cd积累等值线无差异(图2)5 b插图)。
时间的积累109短期内的CD是线性的(图1那2长期(图5)实验。此外,CD积累的速率在短期内相似(0.11pmol g鲜重-1H-1对于分离物)和长期(0.08和0.10pmol Grame Fress Wexport-1H-1这表明,即使在长时间暴露(高达60 h)后,Cd的外流也有限制或Cd的内流受到抑制。这种依赖时间的Cd积累的稳定性可能与这些实验中较低的外部Cd浓度(50 pM)有关。即使60小时后,10950 pM时,根系中Cd的积累量小于0.5%1091.8 μM Cd处理0.5 h后,根系中Cd的积累量(图2)3).以前在短期内报道了根系中CD的线性时间依赖性积累[7.那18那23]及长期[7.那19]实验中使用的镉浓度较高,但无毒(≤0.5 μM)。在短期内等值线之间没有差异109整个根系对Cd的吸收(图1)或根尖(图2).比率越高109根尖处的镉流与直接测量的镉相一致2+沿面包小麦根的通量[27].
CD的浓度依赖性动力学2+涌入的特征是光滑的,对于分离物(图)的光滑,不饱和曲线(图3).在Cd的其他研究中也观察到没有浓度依赖性饱和度[7.那11那26]和Zn [10那12].这些数据集已被解析成可饱和和线性的动力学组件。通过使用低温的组合消除可饱和成分来抑制代谢活性和脂质无脂肪细胞壁制剂,已经将线性动力学组分解释为代表在胎儿中的CD的不可解吸的结合,而剩余的可饱和组分是结果载体介导的血浆膜的运输[7.那10那12].Cd2+这两条等值线的流入曲线也显示了饱和分量和线性分量(表)1).饱和组分和线性组分的动力学常数在两条等值线上相似。没有明显的差异K.m和V.最大限度CD的值2+等值线之间的吸收表明,高粒-镉等值线的地上部Cd积累更多,并不是根系Cd流入速率差异的直接结果。此外,Cd略大2+在Cd时流入TL-H2+大于100 nM的活性不能解释所观察到的地上部镉积累模式。在低得多的Cd浓度(50 pM)下,Cd吸收的等值线差异不存在,记录了Cd转运的明显差异。Cd浓度依赖性无差异2+硬粒小麦和面包小麦品种也有大量流入的报道[7.那11].
虽然Cd的模式2+本研究的内流(可饱和组分和线性组分)与其他已发表的数据相似,可饱和组分的动力学常数与其他研究报道的动力学常数不同。这K.mCD为166至227 nm的值2+在本研究中测量的摄取高于面包和硬粒小麦(20-67 nM [7.那11]),大豆(76-88 nm [18)),卢普斯·阿尔巴斯(42 nm [19])。这V.最大限度本研究中测量的值(0.67-0.87 nmol g-1H-1)明显低于其他研究的报告。例如,V.最大限度面包和硬质小麦的测量值(26-38 nmol g-1H-1[7.那11),是本研究测量值的30至55倍。亲和力越低(越高)K.m) 和V.最大限度乳糜泻2+这里涌入在这里可能反映了摄取溶液的背景组成(完全营养溶液)。在上述实施例中,低离子强度背景溶液(0.2-0.5mm CaCl2或卡索4.)使用。增加其他二价阳离子的浓度有望抑制Cd2+质膜电负性降低引起的内流[28],多种阳离子对内流的非竞争性抑制[19那24]或针对特定阳离子转运蛋白的直接竞争,例如在CD之间观察到2+和锌2+[11那18].例如,添加10μmznso4.吸收溶液(0.2 mM CaSO4.)增加K.mCD的值2+从59-67 nM (0.2 mM CaSO4.单独)至190-404 nM [11].
地上部镉的积累主要是由蒸腾作用产生的质量流驱动的。减少蒸腾作用的处理,如施用脱落酸以诱导气孔关闭[29或增加芽周围的相对湿度[23,大大减少了Cd向茎部的转运。而地上部Cd积累高、低等值线的差异与蒸腾作用无关。在没有蒸腾作用的情况下,根压木质部分泌物中Cd浓度等值线差异的时间和大小(图2)8A)紧密遵循完整植物中根到拍摄CD易位的模式(图6).在玉米中,来自高CD累积线的根压木耳中的CD浓度高于低CD累积线[30.],地上部Cd浓度与蒸腾速率无相关性[16].
尽管在没有透过流动的情况下收集了木质SAP,但Xylem SAP渗出的速率率之间存在一致的差异(图8B.).在高cd积累等值线中,导致木质部汁液大量渗出的因素尚不清楚,但可能包括等值线中根系构型、根系水力导度或主要溶质的木质部负荷的具体差异[22].在我们的实验过程中,木质部汁液渗出率保持稳定,表明在这个实验系统中,根系的代谢活动没有下降。
将CD易位限制在低晶粒CD离子中的芽中的生理机制尚未识别。在CD吸收到根对称中,可以影响CD易位对芽的过程包括在根细胞内的CD封存,使旋转速度转移到替代品中,加载到木质中的Xylem,以及Xylem Sap中的Cd络合。对杜兰姆小麦低CD累积特征的遗传研究表明,谷物CD浓度大大控制了单一基因[6.].最近的成熟植物的研究表明,通过韧皮柱的旗叶对谷物的CD输送到CD输送的TL ISOLINE对[31].单基因性状不太可能解释木质部和韧皮部Cd装载或运输的基因型差异,因为这些途径的生物学特性明显不同[22].相反,在低粒-镉等值线上Cd向地上部的运输受限可能是由于根共浆中Cd的大量封存。Cd会在根和芽组织中被隔离到化学复合物或物理室,如液泡中,从而降低其装载到木质部和韧皮部的可用性。
方法
植物的生长
一对近等基因硬粒小麦(Triticum Turgidum.L. var.硬质),高(8982-TL-H)和低(8982-TL-L)籽粒Cd积累量[32,用于这些实验。田间研究表明,高线在成熟粒中积累的Cd浓度是低线的2.5倍[2那5.].将每个离子的种子在1.2%NaOcl中灭菌20分钟,冲洗,并在0.005g L的溶液中吸收24小时-1Vitavax (Uniroyal Chemical Ltd, Calgary, AB, Canada)用于限制真菌生长。将发芽后的种子置于尼龙网孔上,悬浮在10 L的含1.0 mM Ca(NO . 1)的加气营养液(pH 6.0)上3.)2, 0.4 mM KNO3.,0.3毫米NH4.没有3., 0.3 mM Mg(NO3.)2, 0.1 mM K2HPO.4., 0.1 mM K2所以4.,10μmFe(III) - 乙二胺二(O-氧化羟基乙酸)(Sigma E-1273),2.0μmml2,6.0μmh3.博3., 0.5 μM ZnSO4.,0.15μmcuso4.、0.1 μM Na2MoO4..所有溶液均在双去离子水(>18mΩ纯度)中制备。幼苗在黑暗中生长2d,在生长室中进一步4d,具有350μmolm的光子通量密度-2年代-1处理前12 h,去除颖果,在连续光照条件下(75 μmol m .)将幼苗转移到新鲜营养液中-2年代-1光子磁通密度)和恒温(20°C)。所有实验使用与植物培养相同的完整营养溶液(见上文),加入放射性标记的CDCl2.通过加入载体的镉浓度小于100μm的浓度109CDCL.2(167-318 bq ml-1).高浓度的镉是由CdCl的组合制备的2和109CDCL.2(100 - 125点109CD,337-634 BQ ML-1).一些时间课程实验我们双重标记为109Cd和65锌,取代ZnSO4.和65ZnCl.2(0.5μm.65Zn,407-409 bq ml-1).用GEOCHEM-PC计算化学形态[33]预测了97%的镉以游离金属(Cd2+)的所有实验镉浓度(25 pM-1.8 μM)。在吸收溶液中选择低浓度的Cd,以尽量减少Cd与根细胞壁成分的结合,并模拟土壤溶液中的Cd2+在未受污染的农业土壤中可能出现的浓度。
摄取实验
用去离子水冲洗TL-L和TL-H完整的6 d老苗的根,然后将根转移到含有15 mL放射性标记营养液(pH 6)的塑料吸收管中(每管3-5株)。根暴露5-180 min(短期),或3-60 h(长期)。在长期实验中,每12小时更换一次摄取溶液。在吸收期结束时,根在去离子水中冲洗两次,并在15 mL冰水(2℃)含50 μM DTPA(二乙三胺五乙酸)的无放射性同位素完全营养液中解吸30分钟,以螯合解吸阳离子。在吸收和解吸过程中轻轻摇动吸收管,但不通气。解吸后,根部被吸干、切除、称量和干燥。根系吸收Cd的空间变异是通过采集每株最长的3根并将其分离为根尖(1 cm)和其余基部来确定的。
109Cd在木质部汁液中
如上所述培养幼苗。在萌发后(当粗孔为15至20mm时),将穿孔的0.6ml微量离心管帽放在植物精孔上(盖上向下的帽顶部)上。经过另外4级的生长,帽形成了一个坚定但不限制的,在拍摄的底部周围支撑套环。制备过量的套环植物以确保仅选择均匀,并且选择植物进行实验。在处理之前,套环配有Parafilm以穿孔的闪烁小瓶(1个植物)。然后将帽连接到含有15ml放射性标记的20ml塑料闪烁小瓶(25μm109CDCL.2;167 Bq毫升-1)营养解决方案。根暴露了12-60 h,吸收方案每12 h所取代。结束时吸收期,芽被切除的衣领(5 - 7毫米以上根冠过渡),和根压木质部分泌物收集6 h在滤纸子弹(绘画纸号41)放在树桩上。为了尽量减少渗出物的蒸发损失,滤纸子弹和茎柄被封闭在一个0.6 mL的微型离心管中,该离心管连接在环上。采集汁液后,对滤纸子弹称重、干燥并进行化验109光盘。
分析
将根和芽在70℃下干燥3天,然后测定109Cd和65Zn使用双通道伽马计数器(Beckman Gamma 4000)。不同的最大能量排放109CD(88 kev)和65Zn (1116kev)允许使用通道比法同时分析双标记样品。收集消耗的吸收和解吸溶液,以及水漂洗来确定109Cd和65Zn耗尽来自摄取解决方案,并验证添加的恢复109Cd和65锌。耗尽10930分钟后(时间过程和浓度依赖性实验),吸收溶液中的Cd平均为10%,180分钟后(短期时间过程实验)为17%,所有12小时暴露期间(长期时间过程实验)的Cd平均为33%。耗尽65来自摄取溶液的Zn在180分钟(短期时间课程实验)后平均为10%,并且在所有12小时暴露期(长期时间课程实验)超过13%)。恢复添加109Cd和65Zn通常分别超过95和97%。通过在日志之后通过双向分析进行分析数据E.(原始数据)或arcsin的平方根(百分比数据)转换时,需要规范化的数据。当等值线与治疗(时间或浓度)之间存在显著交互作用(p < 0.05)时,学生的t-test用于检测各处理水平(时间或浓度)等值线对之间的差异。
参考文献
- 1.
Grant Ca,Buckley WT,Bailey Ld,卖F:镉积累在农作物中。可以j植物sci。1998年,78:1-17。
- 2.
maughlin MJ, Parker DR, Clarke JM:金属和微量营养素-食品安全问题。农业科学学报,1999,30(4):457 - 461。10.1016 / s0378 - 4290(98) 00137 - 3。
- 3.
关键词:镉,镉,铅,小麦,土壤镉,土壤铅Agron Abs, 1982, 34。
- 4.
李玉梅,李玉梅,李玉梅:向日葵、硬粒小麦和亚麻籽粒低镉表型的筛选。植物学报1997,94:23-30。10.1023 /: 1002996405463。
- 5.
Clarke JM, Norvell WA, Clarke FR, Buckley WT:镉和其他元素在近等基因硬粒系颗粒中的浓度。植物科学学报,2002,32(4):427 - 434。
- 6.
Clarke JM,淡乐D,Kopytko GL:五个硬质小麦十字架中的镉浓度的遗传。农作物科学。1997年,37:1722-1726。
- 7.
Hart JJ, Welch RM, Norvell WA, Sullivan LA, Kochian LV:面包和硬粒小麦品种完整幼苗的镉结合、吸收和转运特性。植物营养与肥料学报,1998,16(4):427 - 434。10.1104 / pp.116.4.1413。
- 8。
Berkelaar E,HALE B:两种杜兰小麦品种幼苗根系形态与镉积累的关系。可以j bot。2000,78:381-387。10.1139 / CJB-78-3-381。
- 9。
Archambault DJ,Marentes E,Buckley W,Clarke J,Taylor GJ:一种快速,苗木的生物测定,用于识别杜兰姆小麦的低镉积累个体(Triticum Turgidum.l .)。acta physica sinica, 2001, 32(5): 457 - 461。10.1023 /: 1004037901460。
- 10.
HART JJ,Norvell WA,Welch RM,Sullivan La,Kochian LV:锌吸收,束缚和易位的表征在面包和杜兰麦品种的完整幼苗中。植物理性。1998,118:219-226。10.1104 / pp.118.1.219。
- 11.
HART JJ,Welch RM,Norvell Wa,Kochian LV:在面包和杜兰姆幼苗根系中的镉和锌之间的运输相互作用。physiol植物。2002,116:73-78。10.1034 / J.1399-3054.2002.1160109.x。
- 12.
根锌的生理特性2+锌超蓄积体和非蓄积体植物对茎叶的吸收和转运Thlaspi..植物理性。1996,112:1715-1722。
- 13.
Cieślińskig,van Rees Kcj,Huang Pm,Kozak LM,罗斯塔德HPW,Knott Dr:由土壤类型的杜兰姆小麦和亚麻选择的镉摄取和生物累积,受土壤类型的影响。植物土壤。1996,182:115-124。
- 14.
田志刚,阿恩,杉山,高桥:大豆对镉吸收和分配的基因型差异。植物生态学报,2003,31(4):457 - 461。10.1023 /: 1023079819086。
- 15.
邓巴KR, McLaughlin MJ, Reid RJ:两个马铃薯品种对镉的吸收和分配(茄属植物tuberosuml .)。中国生物医学工程学报,2003,19(4):349-354。10.1093 / jxb / 54.381.349。
- 16.
Florijn PJ,Van Beusichem ML:玉米自交系中镉的摄取和分布。植物土壤。1993,150:25-32。
- 17.
meyers- verbeke J, De Graeve M, François M, De Jaegere R, Massart DL:小麦对Cd的吸收。acta botanica sinica(云南植物学报),2010,29(4):593 - 598。
- 18。
大豆对镉的吸收动力学研究。植物生理学杂志。1993,3:844-848。
- 19。
Costa G,莫雷尔JL:镉吸收卢普斯·阿尔巴斯(l):镉排泄,可能是耐镉机制之一。植物营养学报。1993,16:1921-1929。
- 20.
Reid RJ:植物微量营养素摄取机制。AUST J植物理体。2001,28:659-666。
- 21.
Pence NS,Larsen PB,EBBS SD,Letham DLD,Lasat MM,Garvin DF,EIDE D,Kochian LV:Zn / CD超读物器中重金属运输的分子生理学Thlaspi Caerulescens..中国科学(d辑:地球科学),2000,19(4):491 - 498。10.1073 / pnas.97.9.4956。
- 22.
Marschner H:高等工厂的矿物营养第二版。伦敦,英国:学术出版社;1995年。
- 23.
2 . Hardiman RT, jacby B: Cd在菜豆中的吸收和转运(菜豆).植物营养学报,2004,29(6):643 - 648。
- 24.
Berkelaar E,HALE BA:杜兰姆小麦根的镉积累:用于柠檬酸盐的碱基对游离离子模型的例外。环境毒素化学。2003,22:1155-1161。
- 25.
水稻幼苗根系吸收镉、锌的动力学研究。植物营养与肥料学报,2004,30:527-432。
- 26.
缺铁胁迫对植物重金属转运的影响。植物营养与肥料学报。1998,16(4):591 - 598。10.1104 / pp.116.3.1063。
- 27.
Piñeros MA, Shaff JE, Kochian LV:一种镉选择性微电极的研制、表征和应用Thlaspi.物种和小麦。植物理性。1998,116:1393-1401。10.1104 / pp.116.4.1393。
- 28.
基于膜-表面电势的离子通量。植物营养与肥料学报。2001,28(4):427 - 434。
- 29.
印度芥菜中镉的迁移和积累机制。植物营养与肥料学报。1995,19(4):427- 434。
- 30.
玉米自交系镉分布与植株结构和生理特性的关系。植物生态学报,1993,15(4):417 - 418。
- 31。
关键词:镉,镉,硬粒小麦,近等基因系,成熟期中国生物医学工程学报,2001,21(4):457 - 461。10.1093 / jexbot / 52.360.1473。
- 32.
基于镉浓度的5对硬粒小麦近等基因遗传资源的登记。作物科学,1997,37:297。
- 33.
Parker Dr,Norvell Wa,Chaney RL:Geochem-PC:用于IBM和兼容的个人计算机的化学分料计划。化学平衡和反应模型。SSSA规范42编辑:Loeppert Rh,Schwab AP,Goldberg S. Madison,Wi:美国土壤科学学会;1995年:253-269。
确认
这项研究得到了加拿大自然科学与工程研究理事会的战略基金192991和246719的资助。我们感谢John Clarke(加拿大农业和农业食品公司,Swift Current, SK)赠送的硬粒小麦种子,以及Jodi Tomchyshyn提供的技术援助。
作者信息
从属关系
相应的作者
附加信息
作者的贡献
NSH和GJT对研究的概念、设计和分析以及手稿的准备都做出了同样的贡献。NSH进行了实验。两位作者都阅读并批准了最终的手稿。
作者为图像提交的原始文件
以下是与作者的原始提交的图像的链接。
权利和权限
关于这篇文章
引用这篇文章
王志强,王志强,王志强,等。不同镉积累量硬粒小麦近等基因系对镉吸收和转运的影响。BMC植物杂志4,4(2004)。https://doi.org/10.1186/1471-2229-4-4
收到了:
公认:
发表:
关键词
- 硬质小麦
- 摄取解决方案
- 面包小麦品种
- 硬质小麦品种
- 完整的营养解决方案