抽象的
背景
在绿藻和植物的叶绿体中组装稳定的光收集复合物(lhc)需要合成叶绿素(Chl)B.,一种涉及CHL的7-甲基氧合的反应一种到甲酰基。该反应使用分子氧,并通过叶绿素催化一种氧气酶(CaO)。CaO的氨基酸序列预测蛋白质中的单核铁和rieske铁 - 硫中心。CHL合成机制B.以及叶绿体中该反应的定位是理解LHC组装的关键步骤。
结果
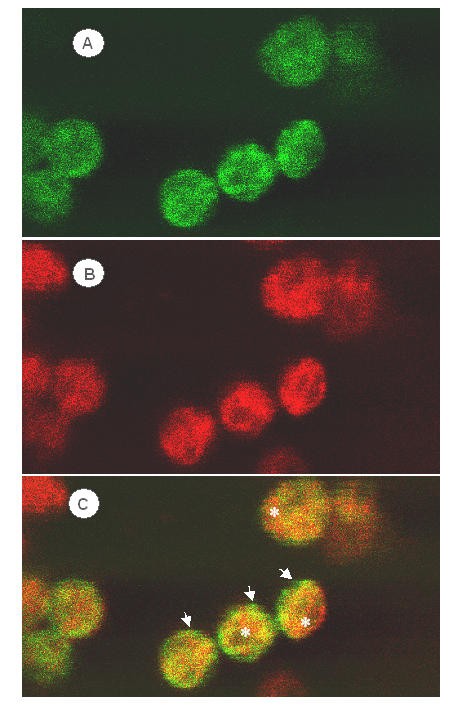
用共聚焦荧光显微镜观察到在豌豆幼叶中瞬时表达的CAO-GFP融合蛋白在成熟叶绿体外围和类囊体膜上的荧光。然而,当细胞膜部分脱脂的细胞衣藻reinhardtii连续波15用蔗糖梯度分解,仅在叶绿体包膜内膜上用免疫印迹法检测全长CAO。CAO的电子顺磁共振谱包括g = 4.3时的一个共振,归属于预测的单核铁中心。与预测的Rieske铁硫中心光谱不同,在g = 2.057时观测到一个近似对称的约100高斯峰谷信号,对铁硫中心的温度特性敏感。在g = 2.0042时,通过一个各向同性的9高斯峰谷信号显示蛋白中有一个非常稳定的自由基。融合后的蛋白质碎裂125一世-确定了保守的酪氨酸残基(Tyr-422衣原体和tyr-518拟南芥)作为基种。自由基被叶绿素猝灭一种,表明它可能参与了酶的反应。
结论
在成熟叶绿体的叶绿体包膜和类囊体膜上发现CAO,而暗生叶绿体只在包膜内膜上发现CAOC. Reinhardtii.细胞。这种定位进一步支持了包膜作为Chl的起始位点B.叶绿体发育过程中lhc的合成和组装。对蛋白质中酪氨酸自由基的鉴定有助于了解Chl的机制B.合成。
背景
叶绿体的发育,无论是来自原质体还是黄体,都涉及到丰富的类囊体膜系统的组装,这是一个复杂但高度协调的过程,需要叶绿素(Chl) [1那2].在类囊体膜内,光合作用的反应主要是由光收集复合物(lhc)吸收的光能驱动的。植物和绿藻中的lhc含有几乎等量的Chl一种和排名B.与一系列蛋白质(LHCB1至LHCB6的LHCB1至LHCB6和LHCA1至LHCA4的LHCA4相关联,其范围为大约20kDa至30kDa [3.].这些蛋白质编码在核基因组中,在胞质核糖体上合成,作为n端靶向延伸的前体,并导入质体[1].主要复合物LHCII的原型载脂蛋白(Lhcb1)结合3个叶黄素分子和14个Chl分子,其中8个Chl分子一种和6个ChlB.[4.-7.].
CHL.B.是由Chl一种通过7-甲基氧化形成甲酰[8.].已经采集了广泛的证据,以满足CHL的要求B.用于积累稳定的LHC。例如,chlB.没有,如果不是所有主要的LHC贫民蛋白,则缺乏大多数[9.-11].相反,过度表达叶绿素(克隆)一种氧气酶(CaO),催化氯化酰胺合成的酶B.,在拟南芥增加了光收获天线的大小[12,表明植物中lhc的数量是由Chl的合成控制的B..Eggink等人。[13提出了在Chl中附加的电负性氧原子B.导致氯π电子系统进一步向分子外围重新分布,从而增加中心Mg原子上的正电荷,从而导致Lewis酸强度的增加。因此,lhc的稳定性可能是由于Chl之间配位键的加强B.以及电负性的含氧配体,因为它们具有额外的库仑引力。几个ChlB.分子也氢键合到氨基酸侧链,进一步增强与蛋白质的相互作用[7.].
分离并鉴定了CAO的基因和cDNA衣藻reinhardtii[14].随后,曹cDNA被克隆到拟南芥[11,其他几种植物和藻类,以及进行光合作用的原核生物,普罗仑和Prochlorothrix.[15].虽然现存的曹基因依次和长度变化,推导的氨基酸序列预测保守的非血红素,单核铁和rieske铁 - 硫中心[12那15].的发展史曹基因序列,加上遗传证据[11那14那16),表示,曹是单拷贝基因,是光合系统合成CHL的能力B.在植物的演变中只有一次一次,这是一个重要事件。没有chlB.在植物中有突变曹基因座表明,直译蛋白,如TiC55和致死的叶斑(LLS1)蛋白[17],没有CAO活动,尽管用CHL发现的第二位抑制突变B.-少突变株C. Reinhardtii.[18建议类似的蛋白质可能获得CaO活动(参见讨论)。为了进一步了解CaO催化的反应,我们开始研究酶。我们证实CaO是一种膜结合蛋白,并确定其细胞内定位。催化亚基,编码拟南芥Cao.cDNA,表达于大肠杆菌.在重组蛋白的EPR光谱分析中,发现了一个稳定的自由基的存在,这可能与反应机理有关。
结果
Cao的细胞内位置
确定CaO在叶绿体中的定位,幼豌豆植物的叶子与曹编码序列在3'端框架融合到GFP的编码序列。来自CAMV35S启动子的瞬时表达后二十四小时,GFP的绿色荧光定量地定位为叶绿体,并出现在整个叶绿体中(图1),包括囊体膜,其通过CHL的红色荧光表示(图1 b).如图所示的覆盖图1 c,未发现绿色荧光与红色荧光直接对应。特别是在质体的外围,GFP的绿色荧光似乎占优势(箭头),而Chl的荧光主要在叶绿体内(星号).本实验表明,在发育的叶绿体中,CAO位于包膜和类囊体膜上,但包膜相对富集程度高于类囊体膜。
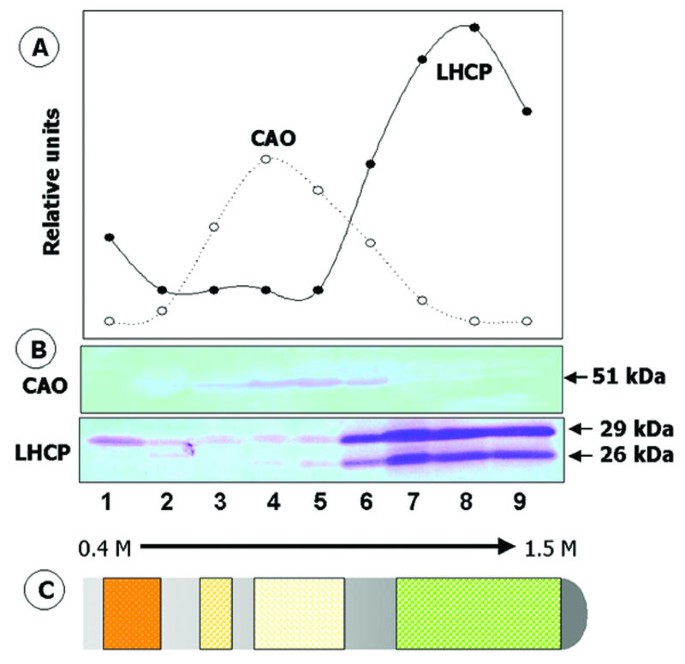
通过生化方法定位Cao,均质化拟南芥叶子或破碎衣原体将细胞离心以分离膜和可溶性蛋白质。在这些细胞级分中蛋白质电泳后的免疫印迹分析表明,用膜定量回收CaO,当用1M NaCl(未示出)洗涤膜时未释放。来自细胞的膜c . reinhardtii连续波15在蔗糖梯度上分离,然后在梯度级分中蛋白质电泳后的免疫斑分析。CaO在膜中恢复,具有包络膜的浮力密度特征(ρ= 1.10至1.13g cm3;0.8 ~ 1.0 M蔗糖)和类囊体膜(ρ≈1.17 g cm)3;约1.3米蔗糖)[19],与图中所示的结果一致1.因为我们之前发现类囊体标记LHCP是在梯度的低密度区域检测到的[20.]含有封套的区域可能污染囊体膜。因此,有利于生长的能力c . reinhardtii连续波15细胞在黑暗中减少类囊体膜的数量,并更清楚地确定CAO是否存在于包膜中。将在黑暗中培养3天的细胞样本置于蔗糖梯度上,会出现一个黄色的、略浑浊的条带,密度(ρ≈1.12 g cm)3)的典型内层包膜在梯度的中间被分解(图2,馏分3-6)。在这些级分中检测到具有抗血清的唯一免疫反应性多肽,对CaO的抗血清是51 kda质量,尺寸预测曹基因产物(14].这些免疫反应性膜清楚地与残留的类囊体膜分离,其含量的CHL含量和通过用针对LHCP的抗体免疫染色,其在级分6-9中回收。在这些后几个部分中未检测到完整的CaO。
等密度蔗糖梯度分析CAO的分布。膜的c . reinhardtii连续波15个细胞在28°C的黑暗环境下生长3天,在0.4 - 1.5 M线性蔗糖梯度的顶部分层。如方法所述离心后,收集各馏分,用10% (w/v)三氯乙酸沉淀各馏分中的蛋白质,并通过电泳溶解。首先用抗CAO的血清检测凝胶,然后用抗lhcp IgG检测凝胶[21].(A),免疫反应条带密度扫描的图示(B)。(C),可见膜量在梯度中的位置示意图。Chl(绿色)表示残留的类囊体膜的位置,靠近底部,中间有一条黄色带,顶部有一个橙色的富含类胡萝卜素的部分。
在中部区域中检测到低水平的成熟大小的LHCP,并且在梯度的顶部附近,以浮力密度的外壳密度[19那20.].之前的工作 [13那21[通过免疫电解显微镜显示,最初在叶绿体发育过程中最初掺入包膜的膜中,组装成LHC,然后转移到其主要留气部位,囊泡膜。这些结果与Bovet等人用纯化的包膜膜回收的少量成熟的LHCP。[22那23,被膜结合激酶磷酸化,可能代表在导入过程中暂时与包膜相关的LHCP。
重组CAO的EPR谱大肠杆菌
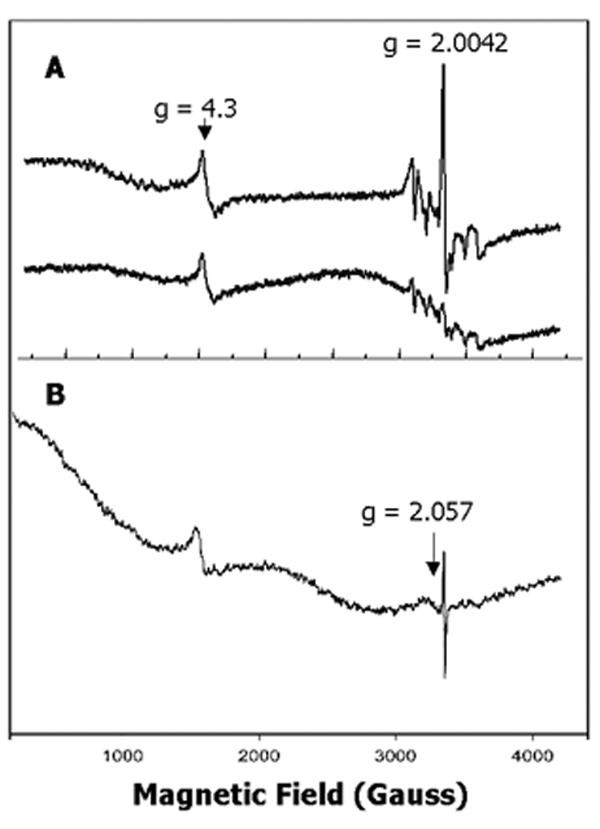
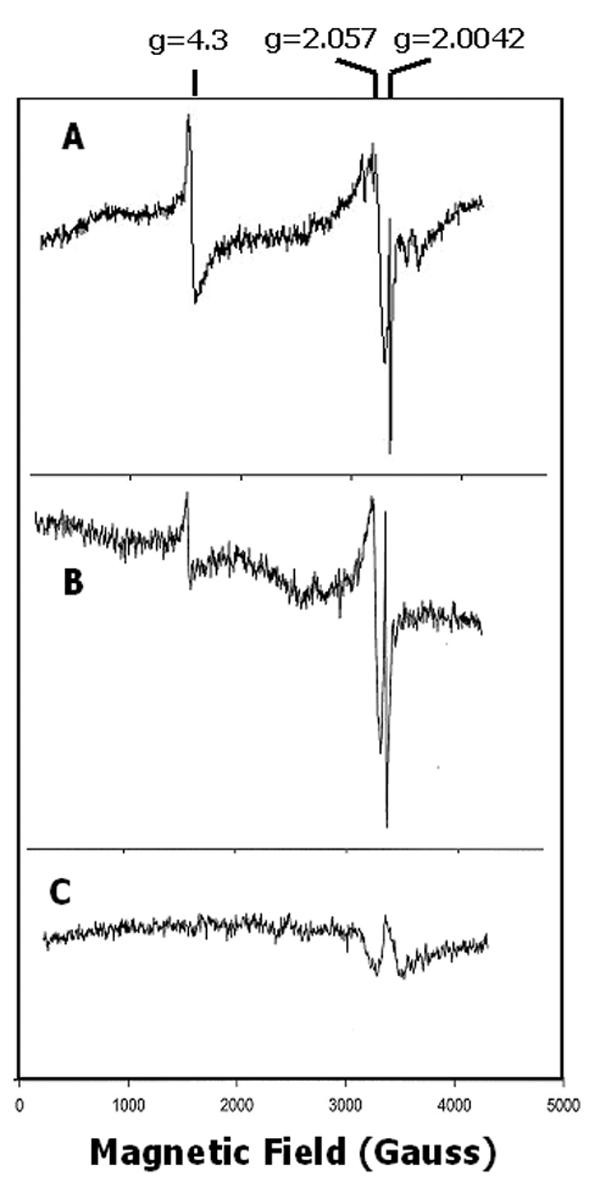
的表达拟南芥Cao.cDNA被诱发大肠杆菌在20℃下,最大化正确折叠酶的恢复[24].在125 K下测量的膜组分的初始EPR光谱显示了几种不同的顺磁物种的存在(图)3上跟踪)。在g = 4.3时,一个窄信号被认为是高自旋非血红素铁3+近似最大菱形环境(E/D≈1/3)。在3000 ~ 3600高斯之间的区域有六组小峰,这是由于低水平的污染锰2+.在随后的实验中,Mn2+用0.1mm EDTA的膜洗涤消除信号(图3 b).虽然g = 4.3信号通常是由不定常铁引起的3+, EDTA洗涤并没有明显减弱这一信号,加入还原剂如二硫苏糖醇或抗坏血酸盐(未显示)也没有减弱这一信号,这应该会将游离铁还原为EPR-silent铁2+.因此,G = 4.3信号似乎指示预测的单核铁中心的组装,其可能免于环境或通过周围蛋白质结构稳定。(该结论由下面的数据增强,用于用洗涤剂溶解的膜。)
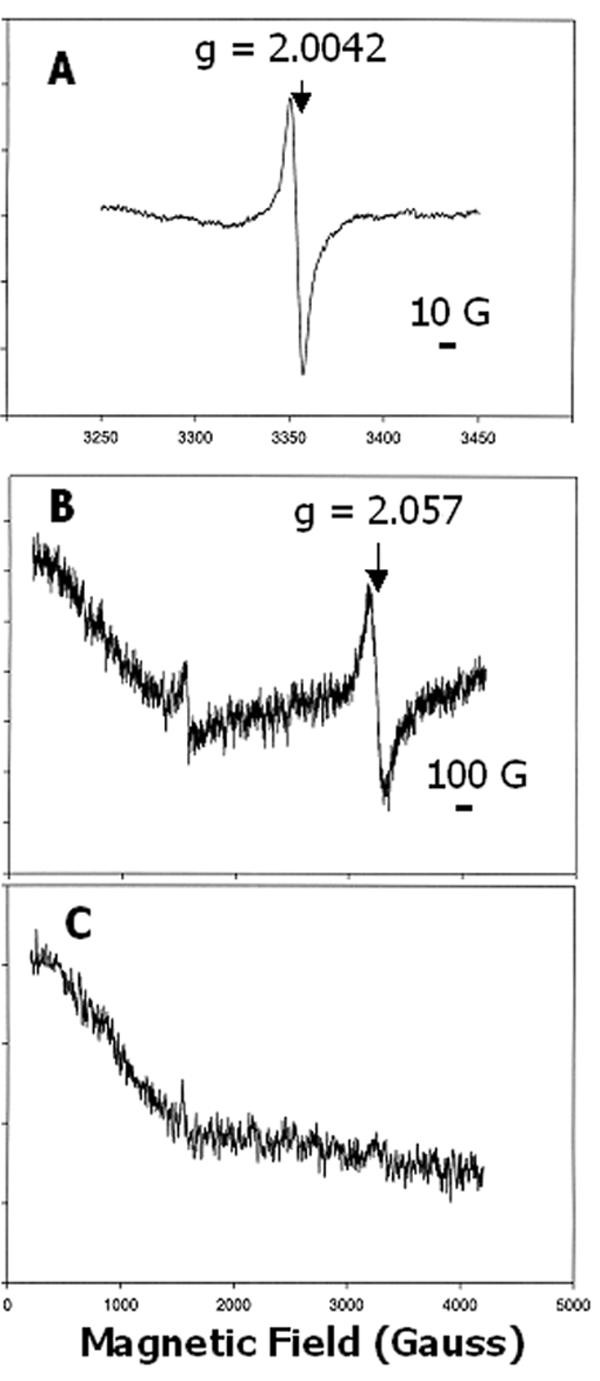
该光谱最显著的特征是一个有机自由基在g = 2.0042处的信号特征(图)3,上迹线和图3 b).添加的背影一种对样品淬灭自由基(图3,较低的痕量),这表明在CaO中仍居中仍在催化活性。自由基光谱的各向同性特征,具有9个高斯峰到槽线宽,如图所示的扩展规模所示4A用于用0.1mM EDTA洗涤的样品。自由基物种存在大肠杆菌膜(25那26[因此,实现足够的CAO过度表达,促进CAO的EPR光谱而不会从内源信号干扰的情况下分析是很重要的。我们观察了来自未受否认的膜样品的内源性基团大肠杆菌幅度大致相等的细胞在强,内源性高旋转,Fe3+信号在g≈6,可能来自细胞色素[27](未显示)。G≈6信号,并通过从内源性自由基的暗示低于过表达的CAO样品的检测(图3和3 b).用于EPR光谱的样品的电泳显示出54kDa多肽,重组CaO的质量预期(见下文),其在来自细胞的级分中突出曹诱导表达,但在非诱导细胞的样本中没有(见下文)。
表达的CAO的EPR谱图大肠杆菌.(A),膜组分在扩展x轴上的光谱,表明g = 2.0042自由基的各向同性特征;12扫描;14 K. (B), 0.1 mM EDTA洗涤和添加Chl后的膜组分光谱一种(5 μM),揭示了g = 2.057信号的宽、各向同性特征;4扫描;7 K. (C),样品如(B)添加巯基乙醇(0.5%,v/v)后;1扫描;7 K。面板(A)和(B)中的棒子表示磁场刻度。相对于图中的光谱,谱的y轴被扩展了5倍(B)和10倍(C)3,用于呈现数据。
当EPR光谱测量温度降至15 K以下时,g = 2.057出现了一个宽信号(图2)3 b).该信号的几乎对称性质,具有约100高斯的峰到槽线宽,如图所示4B.加入氯以淬灭自由基。当温度升高到20 K以上(未显示)时,这个信号急剧减弱。有趣的是,在环境氧化样品中加入还原剂如二硫苏糖醇或二亚硫酸盐并没有显著影响信号的强度。但加入巯基乙醇后,信号消失(图4C.).除了较小的极性巯基乙醇更少于较低的极性巯基醇之外,我们对还原剂的不同效果没有明显的解释。尽管该信号的形状和位置类似于Cu的EPR谱2+[28-30.[除巯基乙醇外,其对温度和抗还原剂的抗性的敏感性并不支持这一任务。Cu的稳定性常数2+用EDTA (31也反对在样品用EDTA洗涤后保留金属。
免疫尿液的EPR光谱
为了确定重组蛋白的光谱是否与天然酶相同,通过用针对C-甲基C-末端片段升高的抗血清的免疫沉淀获得蛋白质。选择该蛋白质的区域作为抗原,以避免与含有保守的Rieske或单核铁结构域的其他氧化还原活性蛋白交叉反应。从洗涤剂溶解的提取物中回收CaO的EPR光谱拟南芥叶子(图5A)与用重组蛋白获得的结果相似。在单个核铁中心g = 4.3处和g = 2.057处发现了强烈的信号,与自由基的光谱重叠。在加入二亚硫酸盐或抗坏血酸盐后,我们没有从自由基光谱中检测到预测的Rieske铁硫中心上场的信号。当用于测量的微波功率在7 K时从2 mW提高到100 mW时,光谱在形状上没有显著差异(未显示)。免疫沉淀反应的曹c . reinhardtii连续波15细胞(图5B.)提供了类似于用样品获得的光谱拟南芥.准备从衣原体细胞通常被Mn污染2+(未示出),但如图所示5B.,在分析之前用0.1mM EDTA洗涤的样品缺少Mn2+信号。EDTA处理对g = 4.3信号的大小没有显著影响,说明g = 4.3信号不是由Fe污染引起的3+.铁的稳定性常数略高于EDTA而不是锰[31],支持这种治疗作为对不偶急转过渡金属的适当控制。此外,这些样品由洗涤剂 - 溶解的膜制备,其应排除在膜颗粒内的简单捕获铁。
用免疫前血清制备的对照样品,用0.1 mM EDTA洗涤,g = 2.0042和g = 4.3信号缺乏自由基光谱(图)5C).在一些实验中,免疫前控制包含一个低幅度信号,与g = 2.057信号重叠,但背景结构与免疫纯化CAO中信号的峰谷位置不匹配,在其他样本中也不存在(见图)4C.).免疫沉淀物分析衣原体通过电泳显示IgG的重和轻链和14kDa和20kDa的三种另外的多肽(未示出)。这些多肽可能与酶有关,但没有与抗CaO的抗体反应。通过胰蛋白酶碎片质谱法获得的初步证据提供了14个KDA组分作为硫氧嗪的初步鉴定,而该分析表明20kDa多肽是次要的LHCB。Cao迁移在IgG的重链附近。
碘化反应与
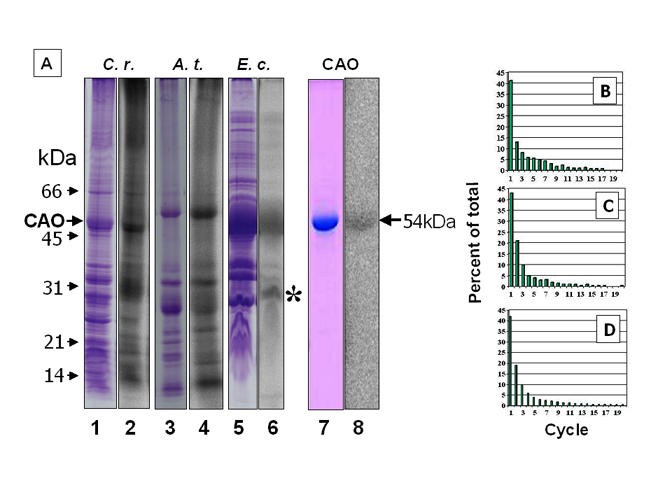
各向同性g = 2.0042信号表明蛋白质中存在稳定的自由基,这是酪氨酸的酚类自由基的特征。确认自由基发生在氨基酸残基上,从大肠杆菌那拟南芥和衣原体用na孵育125我据报道,据报道,酪氨酸激进术是特别的反应[32那33,并通过电泳将蛋白质分解。对干燥凝胶的放射自显影分析显示,在膜中有一种51 kDa的蛋白标记衣原体(数字6A第1和2车道)和56公里拟南芥膜(图6A其他蛋白质也被标记,特别是一种32 kDa的蛋白质,可能是反应中心蛋白D2,其酪氨酸自由基已知可与碘反应[32].
整合125一世-变成膜蛋白衣原体(通道1、2),拟南芥(第3、4条线)和大肠杆菌(车道5,6)。CaO被从凝胶电擦拭,如泳道5所示,重新运行(车道7,8)。车道2,4,6和8分别是Coomassie蓝染色的车道1,3,5和7的广播图。车道1至6来自同一凝胶。在泳道6中的26 kda片段标有一个星号.(b),通过免疫沉淀的深色细胞的洗涤剂 - 溶解的提取物纯化CaOc . reinhardtii连续波15日,贴上125一世-,用胰蛋白酶消化并如方法所述进行N-末端降解。(c),CaO被从生长的绿色细胞纯化C. Reinhardtii.并被视为(b)以下。(d),125我标记为Cao拟南芥如(b)中所述分析。每个部分中的放射性被绘制为20个循环中释放的总释放的百分比。
曹中表达大肠杆菌,作为粗膜样品(图6A,车道5和6)或纯化后(图6A,车道7和8),作为54kDa多肽迁移。根据N-末端序列分析,终端两种氨基酸源自PQE70载体,然后在Lys-51开始于碱基序列。在Lane 6,26kDa的较小的标记多肽(标有星号),是在Pro-298开始的Cao的C末端片段。该片段可能是由Lys-296的类似胰蛋白酶裂解产生并除去随后的N-末端MET-297。其他两个主要多肽的N-末端序列6A,泳道6,39kDa和35kDa质量,分别对应于丰富的植物OMPC和OMPA,其没有显着标记。在电泳后与蛋白质的放射性回收放射性,表明自由基物质与蛋白质相关,而不是辅因子。
基于其相对于Lys或Arg残余物的位置鉴定标记的氨基酸。酪氨酸残基发生在这些胰蛋白酶切割位点下游的前15个位置的9个位置。从黑暗成长的曹C. Reinhardtii.细胞是免疫尿的和125我标记了。用胰蛋白酶消化样品,对混合物进行连续的N-末端降解循环。大多数放射性在循环1中释放(图6B.).循环2中的放射性量可能是将样品从反应小瓶中传递到馏分收集器的不完全转移的结果。基本上使用由浅种细胞制备的CaO获得相同的结果(图6C).在曹城只有tyr422c . reinhardtii连续波在胰蛋白酶消化后,15应该是N-末端。用免疫纯化的Cao获得了类似的结果拟南芥(数字6D.),Tyr-518作为相应的残留物。当。。。的时候拟南芥曹中表达大肠杆菌,数据与图6D.(未显示)。在剩余的循环中释放出的低水平的放射性表明125一世-具有高度特异性,胰蛋白酶的消化基本完成。
讨论
chl的作用B.在大型强子对撞机的组装
在藻类菌株中的启动期间,研究了类囊体膜,特别是LHCII的组装,特别是在藻类菌株中形成C. Reinhardtii.无法在黑暗中合成氯。在黑暗中生长消耗类囊体膜叶绿体的能力,随后合成Chl一种和排名B.当细胞暴露在光线下时,这些复合物以线性速率形成,这是该系统的主要优点[34-36].这些实验结果表明,类囊体膜从叶绿体包膜发出,并产生小泡[34].其他系统也获得了叶绿体开发期间封套期间封套内膜的肠道和混蛋的广泛证据[2那37-39].LHCPS是膜的主要蛋白质最初检测 - 通过免疫电池通过暴露于深色的细胞通过免疫电池显微镜引发叶绿体发育后的叶绿体发育后的几分钟内[21].从chl转移能量B.去的背影一种在此期间表明LHCII的组装[21].在没有合成Chl的情况下,免疫电镜在细胞质中检测到LHCPs,而在叶绿体中检测不到[40.].这个信息,加上对Chl的要求B.以累积LHCPs [9.-11[导致得出结论,进口LHCP所需的初始事件和LHCII的组装发生在叶绿体封套中。
本地化的曹
曹被从黑暗中恢复过来衣原体膜中的细胞浮力密度小于囊体膜的浮力(图2),包络内膜的特征[19那41.].体内CAO蛋白的质量衣原体通过电泳估计,是从DNA序列预测的值[14].因此,在将蛋白整合到海藻包膜后,CAO似乎没有被处理,这是由于其n端序列与in基因编码的典型转运序列缺乏相似性雅拓.这些结果表明了Chl的合成B.是LHC组件的一个重要步骤,在这些细胞的前几分钟的绿化中发生在信封中[34那35].该结论与CHL的要求一致,特别是CHLB.,以将LHCPs保留在叶绿体中[1].Reinbothe等。[42.[还报道了大麦Etiochorroplast信封的内膜上的Cao Ortholog。对包络定位的额外支持是Jäger-Vottero等人报道的纯化叶绿体包膜膜的EPR光谱。[43.],这与重组CaO的EPR光谱基本相同,并从中回收了Cao拟南芥和衣原体抗体细胞(图3.那4.和5.).其他单核铁/铁硫蛋白,如TIC55,发生在内封膜中[44.那45.,这可能提供了Jäger-Vottero等人检测到的Rieske中心[43.全包膜的。西方的污点c . reinhardtii连续波带有Tic55抗体的15个蛋白质没有染色接近预期大小的蛋白(55 kDa),而是染色了约42和35 kDa的多肽(未显示)。Tic55抗体可能与体内其他铁硫蛋白发生交叉反应衣原体.
通过gfp融合蛋白的荧光显示,在成熟叶绿体的类囊体膜中存在CAO(图)1)建议在胞质溶胶中合成后掺入包膜膜中并随后与膜囊泡一起转移到囊体膜中的包膜膜中掺入包膜膜中。作为膜囊泡的其他材料[2那34那37那38].但是,我们不能排除类囊体膜中CAO-GFP融合蛋白的存在是CaMV35S启动子过表达导致定位错误的结果的可能性。其他参与Chl生物合成的酶,如s -腺苷L.-蛋氨酸:mg -原卟啉IX甲基转移酶,在成熟叶绿体中显示双重分布[46.那47.].这些酶在封套中具有比囊体膜更高的特异性活性,并且来自封装到囊体的囊泡交通将为这些位置提供简单的解释。
Cao的EPR光谱
Jäger-Vottero等[43.]在包膜光谱中检测到g = 2.057信号,当温度升高到40 K时,信号消失,我们在工作中证实了这一点。g = 2.057信号明显不是Cu引起的2+在样品中,虽然相似,因为与Ca,Cu的EPR光谱的信号相反2+可以在室温下测量。此外,用EDTA的洗涤应该除去CU2+.Jäger-Vottero等[43.]提示g = 2.057信号对温度的敏感性表明存在一个异常的铁硫中心,可能是一个改良的Rieske中心。这个信号的身份还有待确认。
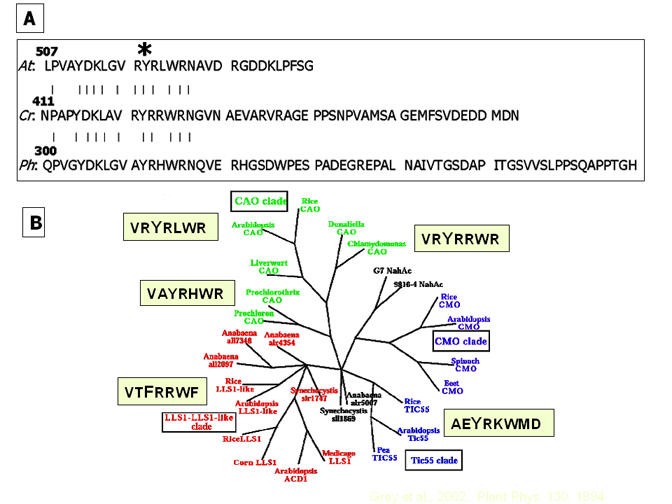
Jäger-Vottero等[43.]还在包络膜中检测到显着稳定的激进。在实验中,通过氩气下的NADPH减少了自由基的振幅,但通过氧合增加了几倍的样品,这导致了基团由喹啉辅因子氧化到半醌形式的结论。纳入125一世-进入我们实验中的蛋白质(图6.)却证明了信号是由蛋白质本身发出的。可能含有自由基的候选物质是酪氨酸和色氨酸残基[48.].我们试图通过其与蛋白质内胰蛋白酶裂解位点的距离来识别特定的残基。如图所示6B.那6C和6D.,大部分的放射性物质在第1个循环中用蛋白测序仪从胰蛋白酶消化中释放出来。唯一应该在第一个循环中释放的酪氨酸残留物是tyr422衣原体Cao(Tyr-518拟南芥),它存在于原核生物中保守的富含精氨酸的序列中Protochlorothrix Hollandica到更高的植物(图7A).保守区域下游的序列出现随机,这突出了酪氨酸和周围残留物的表观重要性。CHL中的PRO0890基因B.- 涉及原核生物Prochlorocccus Marinus.SS120编码具有预测非血红素铁和Rieske结构域的蛋白质[49.]与Cao Clade中的基因远方相关[图7B.].虽然该蛋白在植物和藻类中与CAO的同源性较低,但含有酪氨酸的序列- R308VIVRHyrkfmknk.321-,富含碱性氨基酸,位于单个核铁中心的c端,可能具有如图所示的性质7A.推测的CAO蛋白Prochlorocccus Marinus.与Tic55相比,MED4和MIT9313在系统发育上更接近CAO [50.].
自由基的稳定性是令人印象深刻的,它的形成似乎不需要基质。中表达的蛋白与自由基信号的相对大小大肠杆菌大于免疫沉淀的Cao衣原体或拟南芥.此外,电泳后从凝胶中洗脱CAO,并受铁硫中心重建条件的影响[51.那52.产生了一个小的基信号(未显示)。在一个非常富含精氨酸残基的序列中,假定的带有自由基的tyr422的位置表明,高度正电荷的环境可能是自由基稳定的一个因素。同源蛋白如Tic55含有保守的酪氨酸,但有一个相邻的酸性谷氨酸,而致命叶斑病蛋白LLS1的酪氨酸残基被苯丙氨酸取代[见参考文献]17)和图7B.].Chl的第二位点可逆物B.表示“不”的突变体C. Reinhardtii.[18]提高这些蛋白质可以通过该区域的突变获得CaO活性的可能性。
特异性的抗血清
用于制备抗血清的抗原拟南芥CAO为凝胶纯化的c端片段,从Ser-361到c端Gly-536(见方法)。Rieske和单核铁结构域在同源蛋白和其他氧化还原蛋白中是保守的,位于蛋白质n端三分之二的位置,为防止与其他蛋白发生交叉反应,将其排除在该片段之外。免疫印迹的大肠杆菌其中表达CAO cDNA仅通过全长CAO表达反应,并且当存在时,如图所示的CAO的26kDa片段6A.来自的完整或破碎的叶绿体拟南芥产生了与成熟的预期尺寸相对应的单个带,全长CaO(未示出)。来自蔗糖梯度的馏分免疫印迹,其包含包络内膜衣原体还提供了一个单一的免疫反应蛋白(图2).作为制备工具,免疫沉淀蛋白的EPR谱与表达的CAO的谱基本一致大肠杆菌,不使用抗血清制备。此外,125免疫沉淀蛋白的i -标记模式与表达的蛋白相同曹cDNA in.大肠杆菌.这些数据表明,这些实验中使用的抗血清对CAO具有特异性。
CAO的酶活性
Bednarik和Hoober [53.观察到Pchlide的转化一种克莱德B.在NADPH和菲咯啉与来自黄色细胞的膜c . reinhardtii y1.对该反应中需要菲罗啉的原因还没有找到解释。PCHLIDEB.在绿色植物中检测到[54.]当抑制7-甲酰基还原酶活性时,在光学大麦幼苗中[55.].PCHLIDEB.和排名B.也在集胞藻属转化后细胞曹cDNA [56.].Oster等人。[57.报告说,氯化物B.用克拉德合成一种而不是以7-羟甲基氯化物为中间体,在反应中催化体外曹重组。然而,需要进一步的工作来建立最优条件的分析体外和cao的活性衬底体内.
如在加入CHL后激进信号的消失所示一种(数字3), CAO中的自由基可能从底物中提取一个氢原子。这种类型的反应是众所周知的自由基,并被认为引发p450催化的单氧作用[58.].一种酪氨酸自由基(Em= 0.94 V)[48.]在催化部位建立一个足够强的氧化还原中心,用于CHL(IDE)的氧化一种(E1= 0.86 v) [59.].生成的Chl自由基可能与单核铁中心的氧复合物反应生成7-羟甲基Chl中间体。我们无法检测重组蛋白的持续活性,这表明它可能无法执行不止一次的翻转事件,并且催化活性的基本亚基缺失。加氧酶,无论催化中心含有亚铁血红素、二铁或单核铁,一般都是多亚基复合物,含有额外的蛋白质,用于将电子从还原剂如NADPH转移到反应位点[例如。, 参考 [60.-62.]]。在这方面,我们对抗CAO抗体制备的免疫沉淀中硫氧还蛋白和少量Lhcb物种的初步鉴定,为实现催化活性提供了可能的途径体外.Lhcb的可能关联特别有趣,因为ChlB.当抑制LHCP的合成时没有积累[35].在进行中的实验包括基于我们的EPR数据开发测定以了解该反应的机制。
结论
之前的免疫电子显微镜定位了LHCPs进入膜的初始整合,以及LHC组装的动力学,确定了叶绿体发育开始期间这些过程的位置是包膜。CAO在包膜内膜上的定位进一步支持包膜作为LHC组装和类囊体生物发生的主要位点。在这种酶中发现了一种稳定的酪氨酸自由基,被Chl所猝灭一种,提示Chl的合成B.由自由基介导的反应引发。重组CaO表明显着活性的不可能表明,最佳催化氧合酶活性需要额外的辅助蛋白。这些新颖的观察结果提供了对这些过程的进一步调查可以基于的基础。
方法
cDNA和生物
这拟南芥Cao.cDNA [14[PQE70并表达成大肠杆菌菌株M15/pREp4,由Oster等人描述[57.].在50 mM Hepes缓冲液中,pH为7.5,通过15 k psi的法国压力电池传代两次,使细胞破裂。细胞的c . reinhardtii连续波如图15所示,在黑暗中不合成CHL的细胞壁菌株,如前所述生长[63.].两周老的主要叶子拟南芥(var. Col-0)用剃须刀片切碎,用沃林搅拌器均质,然后用粗棉布过滤。样品3kg离心AV.和上清液级分以200kg离心AV.静置30分钟,获得膜粒。
瞬态表达系统和共聚焦显微镜
将CaMV35S启动子、TMV Omega序列和AtCAO-GFP基因导入pGreenII0029的多克隆位点。在豌豆保卫细胞中瞬时表达,25 μl的金颗粒(直径1 μm, 30 mg ml-1将50%甘油)与5μl质粒DNA(〜5μg)混合。加入25μl2.5Mcacl后2和10μl0.1M的亚胺胺,在室温下在金颗粒上沉淀,连续摇动,将DNA沉淀3分钟。在悬浮在30μl100%乙醇中,在70%乙醇中洗涤金丸粒。在宏携带器上发现了等份的金色,并使用Pds 1000He Biolistic装置(Bio-rad Laboratories,Hercules,CA)在1.3k psi下转换豌豆保护细胞。在MRC 1024系统(BIO-RAD)上记录转化和荧光图像后,将轰击的叶片安装在塑料板上24小时,并将荧光显微镜(Carl Zeiss,Jena,Germany)记录在配备Plan-Fluar100×物镜.使用Krypton-Argon激光作为激发源,在488nm处,记录522和680nm处的荧光强度。
蔗糖梯度离心
膜颗粒从衣原体悬浮在50 mM Hepes中,pH 7.5,并应用于0.4 - 1.5 M含10 mM Hepes, pH 7.5和1 mM EDTA的线性蔗糖梯度。Beckman SW41转子的梯度以250公斤离心AV.梯度分离,经10 ~ 20%聚丙烯酰胺梯度凝胶电泳[64.],蛋白质被渗透到Imobilon-p膜上(Millipore,Bedford,MA)和如前所述的免疫染色[21].
制备的抗体
抗血清是针对碎片产生的拟南芥使用PMAL融合系统(新英格兰Biolabs,Beverly,MA)融合给麦芽糖结合蛋白。一部分曹用5'-GGAATTCAGTGTCCCAAGTTTGGTGAA-3'和5'-GCTCTAGATTAGCCGGAGAAAGGTAGTTT-3'引物扩增cDNA克隆(103D24),覆盖Ser-381到c端gry -536区域。将PCR产物用XbaI和EcoRI连接到pMAL-c2载体上,并对插入的质粒进行测序。重组蛋白(4.3 mg)按说明书纯化,用Xa因子进行剪切,SDS-PAGE纯化抗原片段。考马斯氏蓝染凝胶片用于兔多克隆抗血清由抗体公司,戴维斯,CA。
免疫沉淀反应
拟南芥将叶(10g)在50mM Hepes缓冲液中均化,pH7.5,并通过奶酪布过滤。N-十二烷基 - β-D.- 将摩尔苷加入到2%(w / v)中,并将样品以3kg离心AV.5分钟去除颗粒状物质。上清液(30 ml)与0.5 ml抗CAO血清轻轻摇匀孵育90 min。加入足够的蛋白a琼脂糖(Sigma Chemical Co., St. Louis, MO)结合抗血清中的所有IgG,在3 kg离心孵育90 min后恢复免疫复合物AV.免疫复合物也从破裂的,log-phase细胞c . reinhardtii连续波15如所述拟南芥叶子。用pH为7.5的50 mM Hepes缓冲液洗涤3次,用pH为7.5的0.1 mM EDTA洗涤1次,以去除外源Mn2+.
电子顺磁共振光谱
用配备有牛津ESR900液氦流程和Bruker Te的Bruker E580光谱仪获得连续波EPR谱。102矩形标准腔,温度从6到14 K。其他典型的测量条件有:磁场调制幅值,10高斯;调制频率:100khz;微波功率,图5 mW3.和4.图中为2mw5.;微波频率,9.40 GHz;水平分辨率,1024分;总信号平均每光谱时间,约22分钟;收益,60 dB;时间常数,0.082秒。CHL.一种从丙酮提取物中纯化衣原体通过制备HPLC与甲醇作为洗脱溶剂的细胞[35N .溪流,溪流2并溶解在少量乙醇中。在EPR分析之前,立即在室温下混合样品,然后在液体中冷冻2.
碘化反应与
膜颗粒(3至5mg蛋白)来自大肠杆菌那C. Reinhardtii.和A. Thaliana.悬浮在50 mM Hepes中,pH 7.5,含50 mM NaCl,与55 kBq无载体Na125I (Amersham Biosciences, Piscataway, NJ)在25°C (50 μl最终体积)下静置20分钟。加入10体积丙酮沉淀蛋白,用丙酮洗涤2次,电泳分解[64.].凝胶在BioDesignGelWrap™(BioDesign, Inc., New York, NY)薄片之间干燥,并用Storm 840磷酸化成像仪(Molecular Dynamics, Piscataway, NJ)获得无线电自动成像。如上所述制备的免疫沉淀衣原体和拟南芥悬浮在200 ~ 400 μl 50 mM Hepes中,pH 8.0,含50 mM NaCl, 3 MBq Na125我在25°C下持续15分钟。然后通过加入5Vol丙酮沉淀样品并用丙酮洗涤两次。通过用50mM HEPES,pH8.0中的1%SDS萃取从琼脂糖珠中从琼脂糖珠中回收蛋白质,在沸水浴中用1分钟,然后用缓冲液洗涤5μl。通过用5体积的丙酮沉淀回收蛋白质,并在n流下干燥2.大约1毫克蛋白质在200 ~ 300 μl 20毫米nhh中4.HCO3.用200 μg胰蛋白酶(Worthington, Lakewood, NJ)在38°C下消化20 h,在50°C下干燥,然后用气相蛋白测序仪(型号2090,Beckman/Porton, Fullerton, CA)对n端Edman进行降解。收集每个测序周期中释放的氨基酸衍生物,在Whatman 3mm纸上斑点,并用磷酸化成像仪和ImageQuant软件(Molecular Dynamics)进行定量。
缩写
- 曹:
-
Chlide一种加氧酶
- chl:
-
叶绿素
- 克莱德:
-
叶绿素
- epr:
-
电子顺磁共振
- GFP:
-
绿色荧光蛋白
- 大型强子对撞机:
-
聚光复杂
- LHCII:
-
与照相有关的光收获复合物II
- LHCP:
-
脱辅基蛋白的大型强子对撞机
- MW:
-
毫瓦
- psi:
-
磅每平方英寸
参考文献
- 1.
李志强,李志强,李志强:叶绿体中光收集复合体II的组装和类囊体膜的形成。Photosynth Res. 1999, 61: 197-215。10.1023 /: 1006313703640。
- 2.
类囊体膜的生物发生和起源。Acta botanica sinica(云南植物研究),2001,21(4):531 - 534。10.1016 / s0167 - 4889(01) 00153 - 7。
- 3.
Jansson S:一个导游LHC.基因及其亲属拟南芥.植物科学进展。1999,4:236-240。10.1016 / s1360 - 1385(99) 01419 - 3。
- 4.
Kühlbandtw,王DN,富士义y:电子晶体学植物光收获复合物的原子模型。自然。1994年,367:614-621。10.1038 / 367614A0。
- 5。
王志强,王志强,王志强:高等植物主要光照复合体II的类胡萝卜素结合位点。中国生物医学工程杂志。1999,27(4):593 - 598。10.1074 / jbc.274.42.29613。
- 6。
Das SK,Frank Ha:颜料组合物,光谱性能和叶片和叶绿素之间的能量转移效率在照相系统II的主要和次要颜料 - 蛋白质复合物中。生物化学。2002,41:13087-13095。10.1021 / bi0204802。
- 7。
刘Z,闫H,王k,kuang t,张j,gui l,x,chang w:2.72埃分辨率下菠菜主要光收割复合物的晶体结构。自然。2004,428:287-292。10.1038 / Nature02373。
- 8。
Porra RJ,SchäferW,Cmiel E,Katheder I,Scheer H:叶绿素甲醛群的衍生B.在分子氧的高等植物中。EUR J Biochem。1994年,219:671-679。
- 9。
Królm,spangfort md,猎人NPA,Öquistg,Gustafsson P,Jansson S:叶绿素A / B.-结合蛋白、色素转换和叶绿素中早期光诱导蛋白B.无重的大麦突变体。植物理性。1995,107:873-883。10.1104 / pp.107.3.873。
- 10.
Bossmann B,Grimme LH,Knoetzel J:蛋白酶稳定的LHCB1在类蛋白膜中的整合依赖于叶绿素B.在等位基因Chlorina-F.大麦的2个突变体(大麦芽l .)。植物学报。1999,22:551-558。10.1007 / s004250050517。
- 11.
Espineda Ce,Linford As,Devine D,Brusslan Ja:TheAtCAO基因,编码叶绿素一种氧合酶,是叶绿素所必需的B.综合拟南芥.美国国家科学院学报。1999年,96:10507 - 10511。10.1073 / pnas.96.18.10507。
- 12.
研究表明,叶绿素A加氧酶(CAO)的过度表达增加了光系统II的天线尺寸拟南芥.植物学报,2001,26:365-373。10.1046 / j.1365 - 313 x.2001.2641034.x。
- 13.
Eggink Ll,Park H,Hoober JK:叶绿素的作用B.在光合作用:假设。BMC植物生物学。2001,1:2-10.1186 / 1471-2229-1-2。
- 14.
Tanaka A,Ito H,Tanaka R,Tanaka NK,尤田K,冈田K:叶绿素一种加氧酶(CAO)参与叶绿素的生成B.从叶绿素的形成一种.美国国家科学院学报。1998,95:12719-12723。10.1073 / pnas.95.21.12719。
- 15.
Tomitani A, Okada K, Miyashita H, Matthijs HCP, Ohno T, Tanaka A:叶绿素B.藻胆素是蓝藻细菌和叶绿体的共同祖先。《自然》,1999,400:159-162。10.1038/22101。
- 16。
叶春华,马斯洛夫,博舍提:叶绿素B.-和氯氧叶酸缺乏突变体衣藻reinhardtii.acta botanica sinica(云南植物学报),1991,25(4):491 - 497。
- 17。
杨志强,杨志强,杨志强,等:玉米光致死亡的研究进展LLS1.细胞是由成熟的叶绿体介导的。植物生理学报。2002,30(4):492 - 498。10.1104 / pp.008441。
- 18。
Nikoulina kv,Chekunova em,Rüdigerw,Chunayev As:叶绿素回复的遗传分析B.有缺陷的突变体的衣藻reinhardtii.俄罗斯j eneet。1997年,33:474-479。
- 19。
acta optica sinica, 2010, 31 (4): 559 - 564 . acta optica sinica, 2010, 31 (4): 559 - 564 . acta optica sinica, 2010, 31 (4): 559 - 564 . acta optica sinica, 2010, 31(4): 559 - 564。2生化鉴定。中国生物化学杂志。
- 20.
Eggink LL,Park H,Hoober JK:封装在叶绿体中的光收获络合物组装中的作用:LHCP在叶绿体和叶绿体中的叶绿体开发过程中的分布衣藻reinhardtii.在叶绿体中:从分子生物学到生物技术。编辑:Argyroudi-Akoyunoglou JH,Senger H. 1999,DONDRECHT:KLUWER,161-166。
- 21.
白色RA,Wolfe GR,Komine Y,Hoober JK:在绿化期间叶绿体和细胞质中的光收获复合苯并蛋白的定位衣藻reinhardtii在38°C。照片合成技术,1996,47:267-280。
- 22。
Bovet L,MüllerMo,Siegenthaler Pa:与菠菜叶绿体包膜膜相关的26-和14-KDA磷蛋白是光束的光收获络合物的不同膜结合的POOSL和丝网-1,5的小亚基- 磷酸羧酸盐酶 - 氧酶。Planta。1995年,195:563-569。
- 23。
菠菜叶绿体中包膜蛋白和磷酸葡萄糖合成酶的体外和细胞器磷酸化。植物科学学报,1997,128:169-180。10.1016 / s0168 - 9452 (97) 00160 - x。
- 24。
Wingfield Pt:重组蛋白的生产。在蛋白质科学的当前方案中。编辑:Coligan JE,Dunn BM,Speicher DW,Wingfield Pt,Ploegh HL。2000年,纽约:John Wiley&Sons,1:5.0.1-5.3.18。
- 25。
Schmidt Cl,Hatzfeld Om,Petersen A,Link Ta,Schäferg:表达的Solfolobus acidocaldarius正确插入[2Fe-2S]簇的Rieske铁硫蛋白II (SOXF)大肠杆菌.Biochem Biophys Res Communce。1997年,234:283-287。10.1006 / BBRC.1997.6599。
- 26。
Hägerhäll C, Magnitsky S, Sled VD, Schröder I, Gunsalus RP, Cecchini G, Ohnishi T: An大肠杆菌突变体喹啉:富马酸还原酶含有在近端醌结合位点稳定的EPR可检测的半醌。J Biol Chem。1999,274:26157-26164。10.1074 / JBC.274.37.26157。
- 27.
Basu P,Katterle B,Andersson Kk,Dalton H:膜相关形式的甲烷单氧酶甲基球菌capsulatus(浴)是一种铜/铁蛋白。Biochem J. 2003,369:417-427。10.1042 / BJ20020823。
- 28.
Knowles PF,Brown Rd,Koenig Sh,Wang S,Scott Ra,McGuirl Ma,Brown De,Dooley DM:半乳糖氧化酶活性位点的光谱研究。inorg chem。1995年,34:3895-3902。
- 29.
Klinman JP:单核铜蛋白功能化有机底物的机制。化学修订版,96:2541-2561。10.1021 / cr950047g。
- 30.
Roberts AG, Bowman MK, Kramer DM:某些金属是细胞色素的抑制剂B.6.F复杂的'Rieske'iron-Sulfur蛋白质域移动。生物化学。2002,41:4070-4079。10.1021 / BI015996K。
- 31.
Dawson RMC,Elliott DC,Elliott WH,Jones Km:生化研究数据3RD版。牛津:Clarendon Fpress;1986年。
- 32.
Takahashi Y,Satoh K:通过肽映射分析鉴定光学系统II核心复合物中D1-蛋白的光学碘化氨基酸残基。Biochim Biophys Acta。1989,973:138-146。
- 33.
Proshlyakov DA, Pressler MA, DeMaso C, Leykam JF, DeWitt DL, Babcock GT:呼吸的氧激活和减少:氧化还原活性酪氨酸244的参与。自然科学学报。2000,29(4):457 - 461。10.1126 / science.290.5496.1588。
- 34.
Hoober JK,Boyd Co,Paavola LG:紫花板膜的起源衣藻reinhardtiiy-1 38°C。植物生理学报,1998,16(4):591 - 598。
- 35.
黄志强,王志强,王志强,等衣藻reinhardtii y1 38°C。植物营养与肥料学报,2003,21(4):591 - 598。
- 36.
Hoober JK, Park H, Wolfe GR, Komine Y, Eggink LL:装配飞行采集系统。衣藻叶绿体和线粒体的分子生物学研究1998:363 - 376。
- 37.
MorréDJ,Selldéng,Sundqvist C,Sandelius AS:基质低温隔室衍生自叶绿体包膜内膜。植物理性。1991,97:1558-1564。
- 38.
Kroll D, Meierhoff K, Bechtold N, Kinoshita M, Westphal S, Vothknecht UC, Soll J, westthoff P:VIPP1,核基因拟南芥基础膜形成是必不可少的。美国国家科学院学报。2001,98:4238-4242。10.1073 / PNAS.061500998。
- 39。
陈志刚,王志刚,王志刚:叶绿体内囊泡运输系统的研究进展。FEBS Lett. 2001, 506: 257-261。10.1016 / s0014 - 5793(01) 02931 - 3。
- 40。
PARK H,HOOBER JK:叶绿素合成调节叶绿体中的光收获复合物II的诱导素的保留衣藻reinhardtii.植物营养学报。1997,101:135-142。10.1034 / j.1399-3054.1997.1010118.x。
- 41.
叶绿体蛋白进口机械元件的分离。中国科学:地球科学。
- 42.
Reinbothe C, Buhr F, Pollmann S, Reinbothe S:体外用蛋白氯化物重构光收获POR-苯氯化物络合物一种和B..中国生物医学工程学报。2003,27(6):815 - 824。10.1074 / jbc.M209738200。
- 43.
jäger-vottero p,Dorne A-J,Jordanov J,Douce R,Joyard J:叶绿体包膜膜中的氧化还原链:用于存在电子载体的光谱证据,包括铁 - 硫中心。美国国家科学院学报。1997,94:1597-1602。10.1073 / pnas.94.4.1597。
- 44.
Caliebe A,Grimm R,Kaiser G,LübeckJ,Soll J,Heins L:氯塑蛋白进口机械含有Rieske型铁硫簇和单核铁合蛋白。Embo J. 1997,16:7342-7350。10.1093 / EMBOJ / 16.24.7342。
- 45.
KüchlerM,Decker S,HörmannF,令人姐妹们,Heins L:蛋白质进口到叶绿体中涉及氧化还原蛋白。禁止J.2002,21:6136-6145。10.1093 / EMBOJ / CDF621。
- 46。
Joyard J, Teyssier E, Miège C, Berny-Seigneurin D, Maréchal E, Block MA, Dorne A-J, Rolland N, Ajlani G, Douce R:质体包膜的生化机制。植物营养与肥料学报,1998,19(4):427 - 434。10.1104 / pp.118.3.715。
- 47。
Block MA, Tewari AK, Albrieux C, Maréchal E, Joyard J:植物s -腺苷L.-蛋氨酸:mg -原卟啉IX甲基转移酶位于包膜和类囊体叶绿体膜。中国生物化学杂志。2002,29(4):427 - 434。10.1046 / j.0014-2956.2001.02643.x。
- 48。
酶催化中的蛋白质自由基。化学学报,1998,19(5):457 - 461。10.1021 / cr9400875。
- 49。
Dufresne A, Salanoubat M, Partensky F, Artiguenave F, Axmann IM, Barbe V, Duprat S, Galperin MY, Koonin EV, Le Gall F, Makarova KS, Ostrowski M, Oztas S, Robert C, Rogozin IB, Scanlan DJ, de Marsac NT, Weissenbach J, winker P, Wolf YI, Hess WR:蓝藻细菌的基因组序列Prochlorocccus Marinus.SS120,几乎最小的氧式营养基因组。美国国家科学院学报。2003,100:10020-10025。10.1073 / PNA.173211100。
- 50.
Hess WR,Rocap G,Ting CS,Larimer F,Stilwagen S,Lamerdin J,Chisholm SW:光合仪器Prochlorococcus:通过比较基因组学的见解。Photosynth Res。2001,70:53-71。10.1023 /答:1013835924610。
- 51.
何伟,马金华:氯化汞破坏光系统I的铁硫中心B的重建。照片合成技术,1994,41:381-388。
- 52.
郑玉英,于林,郭永强:铁硫中心的重构B.导致NADP完全恢复+HG处理的照相中的拍摄我复合物synechocccus.PCC6301 sp。照片合成技术,1995,46:249-255。
- 53.
Bednarik DP,Hoober JK:叶绿素的合成B.从原叶绿素酸脂衣藻reinhardtiiy-1。自然科学进展。
- 54.
叶绿体生物发生:单乙烯基原生叶绿素的检测(ide)B.在植物。中国生物医学工程学报。
- 55.
Reinbothe S, Pollmann S, Reinbothe C原位转换原叶绿素酸脂B.对原叶绿素酸脂一种在大麦。J Biol Chem。2003,278:800-806。10.1074 / JBC.M209737200。
- 56.
Xu H, Vavilin D, Vermaas W:叶绿素的存在B.在集胞藻属sp。PCC 6803扰乱四吡咯生物合成,增强叶绿素降解。J Biol Chem。2002,277:42726-42732。10.1074 / JBC.M205237200。
- 57.
Oster U,Tanaka R,Tanaka A,RüdigerW:编码叶绿素关键酶的基因的克隆和功能表达B.生物合成(Cao)来自拟南芥.工厂J.2000,21:305-310。10.1046 / J.1365-313x.2000.00672.x。
- 58.
Hata M,Hirano Y,Hoshino T,Tsuda M:细胞色素P-450的单氧化机制。J am Chem Soc。2001,123:6410-6416。10.1021 / Ja000908p。
- 59.
叶绿素的电化学性质。希尔·博卡拉顿:CRC出版社;1991:287-315。
- 60。
Pikus JD,Studts JM,Achim C,Kauffmann Ke,MünckE,Steffan RJ,McClay K,Fox BG:重组甲苯-4-单氧化酶:四种蛋白质复合物的纯化Dion和Rieske组分的催化和MössbaueR。生物化学。1996,35:9106-9119。10.1021 / BI960456M。
- 61。
甲烷单加氧酶体系中组分间的相互作用甲基球菌capsulatus(浴)。生物化学。1999年,38:12768-12785。10.1021 / Bi990841M。
- 62。
Mitchell KH, Studts JM, Fox BG:羟化酶活性位点残基和效应蛋白结合的联合参与par到昊图公司甲苯4-单加氧酶区域特异性的调节。生物化学学报。2002,31(4):388 - 388。10.1021 / bi012036p。
- 63。
Wolfe Gr,Park H,Sharp WP,Hoober JK:在细胞质泡沫中的灯收获络合物植物衣藻reinhardtii(绿藻门)。中国科学(d辑:生命科学),1997,33:377-386。
- 64。
Hoober JK,Millington Rh,D'Angelo LP:紫杉醇膜主要多肽之间的结构相似之处衣藻reinhardtii.拱生物学生生物糖。1980,202:221-234。
确认
我们感谢Drs。P. Mulineaux和R. Hellens, John Innes中心和生物技术与生物科学研究理事会,感谢他们的pGreenII0029和Jürgen Soll博士,部门für Biologie I, Ludwig-Maximilians-Universität-München的抗体。L.L. Eggink获得美国国家科学基金会研究生培训基金ge9553456的资助。这是来自亚利桑那州立大学光合作用早期事件研究中心的587号出版物。
作者信息
从属关系
相应的作者
附加信息
作者的贡献
LLE进行了生化研究、免疫印迹和重组CAO的表达。LLE和RL进行了EPR研究。DCB进行了肽测序和质谱分析。JB制备了抗CAO的抗血清,并对其进行了表征。AY和AT在豌豆叶片中瞬时表达,并用共聚焦荧光显微镜进行分析。AT构建了CAO质粒,用于表达该蛋白大肠杆菌.JKH进行了实验125一世-并起草手稿。所有作者阅读并认可的终稿。
作者的原始提交的图像文件
权利和权限
关于这篇文章
引用这篇文章
Eggink,L.L.,Lobrutto,R.,Brune,D.C.等等。叶绿素的合成B.:氯化物的定位一种加氧酶和催化亚基中稳定自由基的发现。BMC植物BIOL.4,5(2004)。https://doi.org/10.1186/1471-2229-471-2229-4-5
收到了:
公认:
发表:
关键词
- 类囊体膜
- 叶绿体开发
- 信封膜
- 叶绿体被膜
- Chlamydomonas细胞