抽象的
背景
actin是一种古代分子,显示哺乳动物和植物施用之间的90%以上的氨基酸同源物。所涉及的肌动蛋白分子的区域F-肌动蛋白装配在很大程度上是保守的,而且很可能是哺乳动物的肌动蛋白能够纳入微丝在植物细胞中,但没有实验证据直到现在。
结果
通过不同技术可视化洋葱灯泡尺寸表皮细胞中的微细丝显示,除了细胞质之外,罗丹明-Phalloidin还染色了核,而GFP-小鼠苯胺杂交蛋白没有进入细胞核。应用荧光标记的肌动蛋白的显微注射物用于研究植物细胞中核微磁的存在。注射荧光兔骨骼肌的比率成像肌动蛋白和微内膜细胞的阴脂蛋白染色表明,哺乳动物肌动蛋白能够掺入植物f-accin中。该掺入优选地在核和植物细胞的Perinucleclecare区域中发生,而部分植物微丝,主要是在细胞质的周边,不包含哺乳动物肌动蛋白。
结论
微注射的哺乳动物肌动蛋白能够进入植物细胞核,而哺乳动物肌动蛋白进入植物f -肌动蛋白则优先发生在细胞核和核周区域。
背景
actin是一个古代分子,被认为在20亿年前的真核生物发作时发现它的起源[1].氨基酸序列的比较表明哺乳动物和植物肌动蛋白之间90%以上的同源性[2].参与肌动蛋白 - 肌动蛋白触点(F型肌动蛋白组件)的肌动蛋白分子的区域在很大程度上是保守的,并且已经证明,来自进化的遥远生物的actins能够与哺乳动物骨骼肌肌动蛋白共聚[3.], [4].因此,哺乳动物的肌动蛋白有可能与植物细胞中的微丝结合,但目前尚无实验证据。
肌动蛋白和微管蛋白的荧光类似物已被用于动物细胞的细胞骨架动力学研究。哺乳动物荧光标记的神经微管蛋白已被证明与植物微管结合[5],但活细胞中植物微丝的荧光染色是间接使用phalloidin衍生物进行的[6],GFP小鼠瞳孔融合蛋白[7],荧光标记为fimbrin [8].异源荧光的肌动蛋白纳入到植物微丝的内源性池的能力一直受到质疑[9,10但是,为什么哺乳动物的肌动蛋白在少数已发表的实验中没有与植物微丝结合仍不清楚[10,11].在目前的工作中,我们采用市售兔肌动蛋白与Alexa氟结合®,一种具有长荧光寿命的染料,作为活细胞中微丝可视化的工具。
肌动蛋白已在不同生物体的细胞核内发现,包括植物(载于[12),但核肌动蛋白的功能尚未明确。
约肌动蛋白的兔骨骼肌纳入微丝在洋葱鳞片表皮细胞的细胞核的能力,在此,我们目前的实验证据。
结果
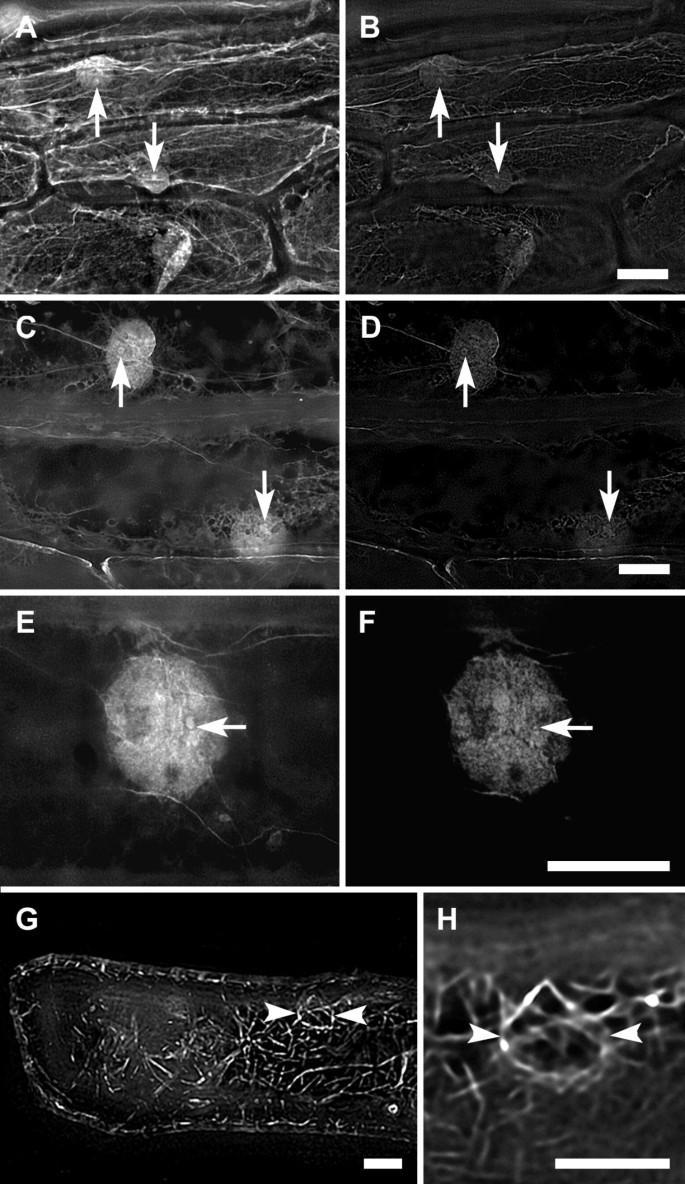
洋葱鳞茎染色细胞的罗丹明-Phalloidin染色揭示了细胞质中的细微细丝致密网络。另外,冻结破碎和酶介导的透明方法显示在核中具有不同1-2μm的光斑状结构的弥漫标记(图。1 1 1 a、1 b, c, d, e, 1 f).虽然细胞核内未发现明显的丝状结构,但phalloidin染色显示F-actin存在于植物细胞核内。
GFP-塔林装饰在细胞质微丝,其中“核篮”,但在细胞核中没有检测到标签(图1 g, 1 h).
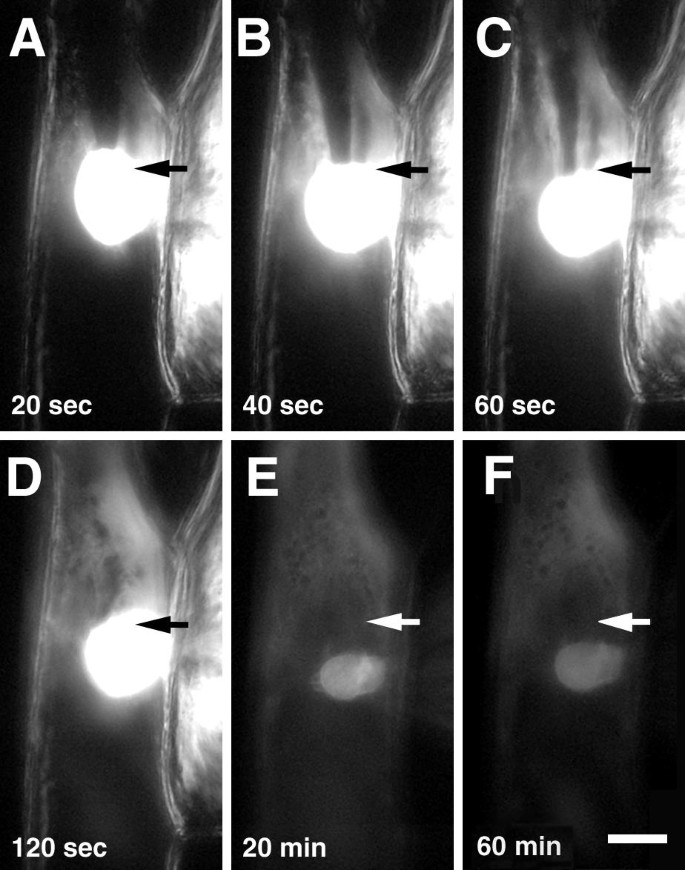
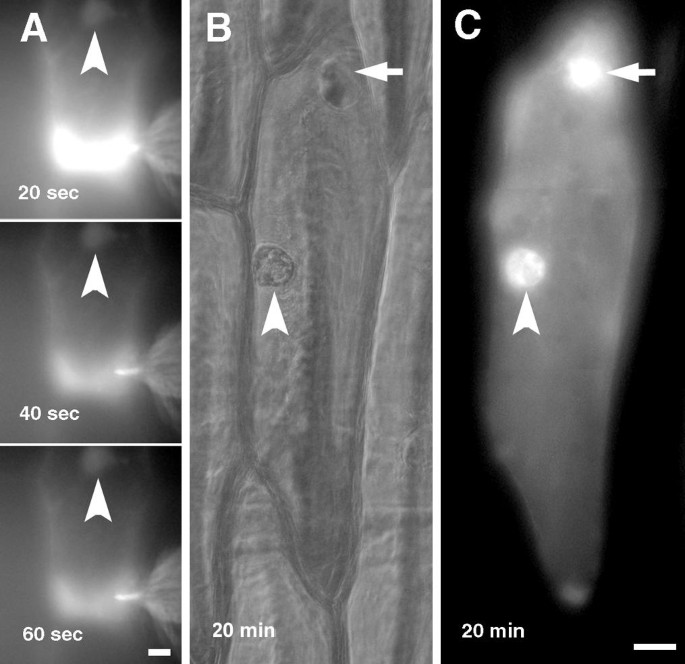
荧光肌动蛋白注射到洋葱鳞片表皮细胞的丰富细胞质区域:核周区域或小区(图的角落。2和3.).荧光标记迅速遍布细胞的细胞质,并在注射后几分钟内强烈地染色核(图。2 e).高浓度的荧光肌动蛋白从注射部位相对缓慢地下降,而在细胞核中几乎看不到荧光的动态变化(图)。2和3.).肌动蛋白侵入细胞核不依赖于注射部位;注射到核周区域的细胞的细胞核(图。2)或细胞的角落(图。3.)注射开始后一分钟内变成荧光。
期间注射的细胞在室温下温育1小时,显微注射肌动蛋白的标签没有显示的分布(图的定性变化。2 f).然后将细胞固定并用Phalloidin染色,以监测注射肌动蛋白的掺入微丝。在固定,渗透和洗涤微内注射肌动蛋白缀合物的荧光消失后消失(图。4),表明G-actin在手术过程中被冲走,actin-Alexa Fluor®488作为f -肌动蛋白留在细胞内。注射细胞的f -肌动蛋白染色与未注射细胞相似(图。1 1 1 a、1 b, c, d, e, 1 f),这表明肌动蛋白荧光的注入对肌动蛋白骨架的结构没有影响。大多数微丝既表现出绿色(注射肌动蛋白,图4)和红色(阴影蛋白染色,图。4 b)标记,而所有注射的(绿色)肌动蛋白用phalloidin标记(图。4摄氏度).一些大的F-actin电缆,大部分位于细胞周边,仅用阴蛋白缀合物标记(图。4 d),表明注射肌动蛋白没有纳入这些微丝。细胞核和注射的细胞的核周区用绿色和红色的荧光染料被类似地标记,得到黄色色重叠的RGB图像(图4 e),表明该区域的所有微丝掺入注射肌动蛋白。
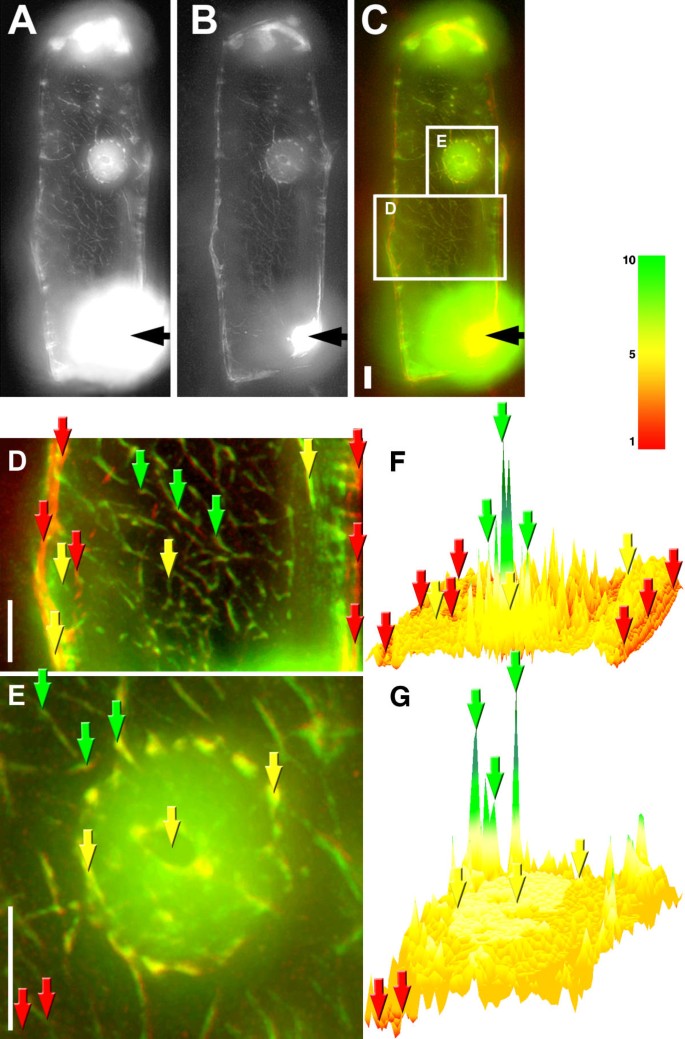
显微注射的肌动蛋白Alexa氟的比率成像®488标记和罗丹明-phalloidin染色。显微注射的肌动蛋白Alexa氟®在注射actin-Alexa Fluor 1 h后洋葱鳞片表皮细胞488标记和phalloidin染色®488共轭,图像反褶积后通过核中心区域的单个光学切片,一个, Alexa萤石®488标签。B,罗丹明 - 黄藻染色。C,覆盖一个(绿色)和B(红色的)。D,细胞质。E,核。F和G,显示的绿/红信号比率图像D和E,分别。黑色箭头表示注射部位。单元格中绿色/红色比率高的点的例子,绿色箭头;绿/红比值低,红色箭头;中绿色/红色比例,黄色箭头。柱,10 μm,色柱为F和G,绿色/红色信号的相对值。
的绿色(注射肌动蛋白)和红色(鬼笔环肽染色)比的图像清楚地表明,虽然注射荧光哺乳动物肌动蛋白和鬼笔环肽染色的照片是第一眼类似,中的细胞质注射肌动蛋白形成大的微丝束具有相对低的鬼笔环肽信号注射细胞(图4 f,绿色箭头),而部分微丝显示出强烈的阴辐素染色,但含有非常少的注射夹蛋白(图。4 f,红色箭头)。细胞质中只有少量微细丝,显示出相同的绿色和红色信号,导致注射肌动蛋白/阴蛋白信号比的培养基值(图。4 f,黄色箭头)。
在核中,绿色/红色信号的比率几乎同样分布,并且具有中间值(图。4 g(黄色箭头)在细胞核周围的高低值之间。虽然细胞核包含一些纤维结构,但在细胞核周围可以看到微丝的“核篮”元素(图。4 e),这些结构没有反映在比率图像上(图。4 g).
讨论
本文采用不同的方法对植物微丝进行了可视化研究。GFP-talin杂交蛋白标记活细胞微丝与固定细胞phalloidin染色的主要区别在于活细胞细胞核无荧光。gfp小鼠talin融合蛋白的作者观察到烟草BY-2细胞核中弱的弥漫性标记[7],而我们的研究结果表明弥漫但在核强毒伞素染色。这种差异可能与GFP-踝蛋白的至微丝束而鬼笔环肽污渍所有F肌动蛋白丝中固定的细胞的结合。此外,GFP-踝蛋白的杂合蛋白的相对高的分子量可以影响它的核的侵入。
对哺乳动物肌动蛋白在活细胞中与植物微丝结合的能力进行了半定量研究。微注射的荧光肌动蛋白和连续的phalloidin染色显示了相似但不相同的细胞。actin-Alexa Fluor的比率成像®488偶联和罗丹明-phalloidin信号被应用于揭示外源性肌动蛋白进入现有微丝的掺入率。尽管阴茎毒素可能以不同的亲和力与哺乳动物和植物的F-actin结合,但没有理由相信在目前的实验条件下,部分微丝未染色-因此,phalloidin染色被认为是注射细胞中所有F-actin丝的标记。一个例外可能是皮质肌动蛋白短丝,已被证明难以保存和成像[13].
注射细胞的比例图像显示,一部分植物微丝没有与外源性肌动蛋白结合或掺入率无法检测(红色微丝),另一部分微丝是由微注射的肌动蛋白新形成的(绿色微丝)。比值图像上的绿色显示这些微丝主要由注射的肌动蛋白组成,因为与先前的phalloidin染色的微丝(比值图像上的红色微丝)的信号比例相比,这些微丝的绿/红信号比例较高。
/鬼笔环肽的中间值(黄色)注射肌动蛋白比例(主要是在细胞的核区域)的存在表明,内源性F-肌动蛋白的一部分已将显微注射荧光肌动蛋白。非注射细胞的阴脂蛋白染色表明,F-actin存在于洋葱泡形表皮细胞的细胞核中,表明注入细胞的核区域中的中间绿色/红色比是因为外源actin侵入细胞核。
还存在部分注射夹的肌动蛋白没有形成F-肌动蛋白或掺入现有的微丝,而是附着在现有的微丝中。然而,阴辐素染色证实了F-actin和注射肌动蛋白的分致化,表明所有actin-alexa氟®在细胞固定和渗透后可见的488缀合物形成了F-肌动蛋白细丝。基于使用荧光显微镜的观察的当前工作也不能排除新形成的F-actin长丝的一部分通过通过肌动蛋白长丝交联蛋白与现有的微通孔分成与现有的微通孔的可能性。Fimbrin [8,14].然而,所有已知的植物肌动蛋白丝交联蛋白并没有对微丝进行不同的修饰,因此这种交联不能解释细胞质中不同的绿/红比值。
我们无法观察微内注射细胞中荧光长丝的动态和移动性。这种观察结果与早期的结果一致,即荧光类似物细胞化学与哺乳动物肌动蛋白的含量不适用于植物细胞[9,10].同时,它也对嵌合兔-植物微丝的功能提出了质疑。然而,我们没有观察到微注射荧光肌动蛋白的毒性作用。细胞质流动一直持续到注射细胞固定,虽然不可能确定流动轨迹的来源。注射没有改变细胞核的位置。因此,注射细胞的微丝系统并未出现明显的失败,但哺乳动物肌动蛋白是否与植物微丝共存或作为植物微丝的一部分仍不清楚。活洋葱细胞中可见微丝缺乏动态和流动性可能与哺乳动物和植物肌动蛋白核苷酸交换率的差异有关[15可以调节微丝的行为。
先前在植物细胞中应用荧光标记的哺乳动物肌动蛋白模拟细胞化学的尝试失败了,因为兔肌动蛋白似乎会毒害活的植物细胞[9,10而玉米花粉肌动蛋白在同样的针浓度下也能完美地工作。在目前的工作中,actin-Alexa Fluor®使用488缀合物,因为它具有比古典荧光素或罗丹明衍生物更好的光稳定性和更亮的荧光。这种缀合物的应用使得可以观察到将针浓度保持低至5μm的注射夹肌蛋白(即低于65μm的13倍[10)以避免潜在的毒性作用。此外,使用手动喷油器将喷射量控制在最小。这些预防措施对于将哺乳动物肌动蛋白微注射到植物细胞中至关重要,尽管我们不能排除洋葱鳞片表皮是这些实验更好的模型系统的可能性。结果表明,哺乳动物肌动蛋白对植物细胞的毒性作用可能是浓度依赖性的,也可以通过模型系统的选择来避免。
微注射的荧光肌动蛋白在数秒内被快速运输到细胞核内,并且G-actin被注射到植物的F-actin丝中优先发生在这个区域。虽然注射的荧光肌动蛋白(显示注射肌动蛋白的位置)和phalloidin染色(显示内源性和新形成的f -肌动蛋白丝的位置)的图像在定性上非常相似,比率成像显示,注射肌动蛋白在注射细胞的细胞核和细胞质之间的合并有显著差异。
植物细胞核中的肌动蛋白的存在已被显现免疫细胞化学和通过阴脂蛋白染色[16,17].科林斯与同事[17[核沟和入侵的F-Actin的定位还显示出其在核运输中的作用。虽然在植物细胞中尚未直接显示肌动蛋白的运输,但在肌动蛋白-Alexa氟的高浓度和相对较低的分子量(约43kd)的高浓度和相对低的分子量(约43kd)的actin-alexa fluor的侵入性的情况下,微内注射夹肌蛋白的侵入不是意外的结果®488共轭。然而,在注射开始后的短时间内,细胞核内出现相对明亮的荧光,而细胞质中的荧光则表明,肌动蛋白侵入细胞核并非简单的浓度依赖性扩散。虽然目前的研究没有揭示肌动蛋白在核内加入植物f -肌动蛋白的动态,但phalloidin染色和比例成像显示注射的哺乳动物肌动蛋白优先加入核内。虽然兔骨骼肌肌动蛋白的氨基酸序列[18]含有与从植物中发现的信号相同的核输出信号[19].G-肌动蛋白成F-肌动蛋白的结合动力学的研究是涉及肌动蛋白同种型的结构。在植物组织中的肌动蛋白异构体的差异表达进行了研究[20.]但没有任何关于他们的亚细胞定位的情况。因此,目前可用的数据不允许对植物细胞核中哺乳动物肌动蛋白的优先掺入的分子基础进行猜测。
目前的工作表明,哺乳动物的肌动蛋白能够纳入微丝在活的植物细胞,特别是在核。核微丝的功能知之甚少,但他们可能在一个工作的光所识别的核肌球蛋白与RNA聚合酶的相互作用至关重要II [21].然而,在荧光标记的肌动蛋白作为植物细胞骨架的研究中,哺乳动物肌动蛋白的差异掺入植物微丝的原因和机制仍然阐明。
结论
微注射的哺乳动物肌动蛋白能够进入植物细胞核,而哺乳动物肌动蛋白进入植物f -肌动蛋白则优先发生在细胞核和核周区域。
方法
用罗丹明-phalloidin (Molecular Probes, USA)对洋葱鳞茎鳞片表皮细胞进行冷冻粉碎和酶介导渗透的F-actin染色,如前所述[22].
对于GFP-倒下表达,将洋葱鳞片的表皮细胞层置于2%琼脂糖层的层内。用GFP-小鼠瞳孔融合cDNA转化细胞[7生物学上使用PDS - 100/He®装置(Biorad,USA),1,0μm金颗粒和1300 psi破裂盘。轰击后,将组织在室温下在黑暗中温育24-48小时。
用于显微注射和随后的染色罗丹明,圆角件洋葱鳞片表皮放入Attofluor®细胞室(Molecular Probes,美国)在玻璃盖玻片上,在盖玻片和组织之间留下一层2%琼脂糖,但不在表皮上。用硅胶管片将组织附着在细胞室上。来自兔子肌肉的肌动蛋白,Alexa Fluor®用G缓冲液(5 mM Tris, pH 8.1, 0.2 mM CaCl)稀释488偶联物(Molecular Probes, USA)2根据制造商的浓度为0.2mg / ml(5μm针浓度),0.2mm ATP),0.2mm ATP),在室温下离心14,000rpm,并注入10洋葱灯泡尺寸表皮细胞细胞质,用EPPendorf(德国)细胞电车油5176.注射毛细血管在电池中保持至少20分钟,通过在显微注射期间监测细胞质流来控制注射细胞的活力。Alexa Fluor®488用奥林巴斯IMT-2反射光荧光显微镜观察,注射时使用XF-100滤光片(Omega Optical, Inc, USA)和40 ×长工作距离物镜,phalloidin染色后使用40 ×油物镜,NA 1.3。记录采用数码CCD相机(CF 8/1 DX,德国KAPPA)和KAPPA ImageBase Time软件,在注射过程中驱动电子快门(美国Applied Scientific Instruments),或在固定和染色细胞成像过程中使用z -步进相机。
监测注射细胞中荧光肌动蛋白的运动的过程1小时,然后将表皮染色在细胞室中,用罗丹明-Phalloidin 6单位/ ml在2mM Tris pH 8.0,0.1%皂苷,2%多聚甲醛(EM等级,电子显微镜科学,美国)1小时,并用2mm Tris pH 8.0洗涤30分钟。用标准的LONGPASE过滤器用于罗丹明的标准光素染色。Autodeblur 9.1(AutoQuant Imaging,Inc.,USA)3D DeconVolution用于每个细胞的90-120光学切片(0.15μmZ步骤)。
绿/红色信号的比的图像,从10个像素宽的(0.3微米,分别为0.2微米为细胞质和细胞核区,)使用ImageQuant软件(分子动力学,USA)的图像的条纹构成。前比率图像的计算以消除噪声相机的沿着条10的像素部分的数字值进行平均。
参考文献
- 1.
Doolittle RF:用氨基酸序列重建病史。中国生物医学工程学报,1996,1:191-200。
- 2.
肌动蛋白结合蛋白的结构模块:一个新的分类。Acta botanica sinica(云南植物研究),2003,28(4):531 - 534。10.1016 / s0167 - 4889(98) 00152 - 9。
- 3.
Mortara RA:对锥虫肌瘤肌动蛋白的研究。I.免疫化学和生物化学鉴定。J Protozool。1989,36:8-13。
- 4.
Vandekerckhove J, Weber K:在高等哺乳动物中至少有6种不同的肌动蛋白表达:基于氨基酸末端tryptic肽的氨基酸序列分析。中国生物医学工程学报,2003,21(4):457 - 461。
- 5.
张丹丹,王志强,王志强,等。植物细胞微管动力学研究进展[j]。中国科学(d辑:地球科学),1998,16(4):514 - 514。
- 6。
微丝与微藻迁移核和细胞皮层相关。活细胞的研究。中国生物医学工程学报。
- 7。
Kost B,Spielhofer P,Chua NH:一种GFP小鼠山雀融合蛋白标签植物体内肌动蛋白长丝,并在种植花粉管中可视化肌动蛋白细胞骨架。工厂J. 1998,16:393-401。10.1046 / J.1365-313x.1998.00304.x。
- 8。
荧光标记的膜蛋白在活的植物细胞中装饰动态的肌动蛋白丝网络。植物学报。2001,21(3):339 -395。10.1007 / s004250000494。
- 9。
Hepler PK,Cleary Al,Gunning Bes,Wadsworth P,Wastieneys Go,Zhang DH:生活植物细胞中的细胞骨骼动态。细胞BIOL INT。1993,17:127-142。10.1006 / cbir.1993.1050。
- 10.
玉米花粉中肌动蛋白的纯化及其在植物细胞中的作用。植物学报。1997,9:1445-1457。10.1105 / tpc.9.8.1445。
- 11.
斯泰格CJ,赫西PJ:肌动蛋白和肌动蛋白调节蛋白。一年生植物评论。赫西PJ:通过编辑。2004年,10:32-80。
- 12.
细胞骨架蛋白和基因调控:在细胞核中的形式、功能和信号转导。Sci抽烟可以。2002、139:PE30。
- 13.
在胡萝卜细胞的整个细胞周期中,肌动蛋白网络存在于细胞质中,并与分裂的细胞核相关。中国生物医学工程杂志。
- 14.
Kovar DR, Drobak BK, Staiger CJ:玉米异形蛋白的异构体在功能上是不同的。植物学报。2000,12:583-598。10.1105 / tpc.12.4.583。
- 15.
可伐大卫河,杨Pinfen,销售温菲尔德S.,德勒巴克比约恩K.,斯泰格克里斯托弗·J .:莱茵衣藻产生不寻常的生物化学特性的profilin的。J Cell SCI。2001年,114:4293-4305。
- 16.
Skubatz H,Orellana MV,Yablonka-Reuveni Z:在Voodoo Lily附录的核心中存在actin的细胞化学证据。组织学j.2000,32:467-474。10.1023 /答:1004140215519。
- 17。
Collings DA, Carter CN, Rink JC, Scott AC, Wyatt SE, Allen NS:植物核可包含广泛的沟槽和内陷。植物营养学报。2000,12(4):427 - 434。10.1105 / tpc.12.12.2425。
- 18。
柯林斯JH,Elzinga L:肌动蛋白的兔骨骼肌的一级结构。完成和氨基酸序列的分析。J Biol Chem。1975年,250:5915-5920。
- 19。
Haasen d,科勒C,纽豪斯G,梅克尔T:在植物蛋白的核出口:AtXPO1是在拟南芥富含亮氨酸的核出口信号出口受体。植物杂志1999年,20:695-705。10.1046 / j.1365-313X.1999.00644.x。
- 20.
米格RB,麦金尼EC,Kandasamy MK:Isovariant动态扩展和缓冲复杂系统的响应:在不同的植物肌动蛋白基因家族。植物细胞。1999,11:995-1006。10.1105 / TPC.11.6.995。
- 21.
Pestic-Dragovich L,Stojiljkovic L,Philimonenko AA,Nowak G,Ke Y,Settlage Re,Shabanowitz J,Hunt DF,Hozak P,De Lanerolle P:核心中的肌球蛋白I同种型。科学。2000,290:337-341。10.1126 / science.290.5490.337。
- 22.
Wasteneys GO,Willingale-TheuneĴ,Menzel的d:冻结粉碎:一个简单的和透高等植物细胞壁有效的方法。J MicroSC。1997年,188(PT 1):51-61。10.1046 / j.1365-2818.1977.2390796.x。
确认
这项工作得到了爱沙尼亚科学基金会补助金4220和4932的支持。
作者信息
从属关系
相应的作者
附加信息
作者的贡献
HP进行了显微注射,显微镜和图像分析。ET构思了这项研究,并参与了其设计和协调。这位作者都读到并批准了最终手稿。
作者为图像提交的原始文件
权利和权限
关于这篇文章
引用这篇文章
铺设,H,Truve,E.将哺乳动物肌动蛋白的掺入植物细胞核中的微丝。BMC植物杂志4,7(2004)。https://doi.org/10.1186/1471-2229-4-7
收到了:
接受:
发表:
关键词
- 细胞质流
- 比率图像
- 兔骨骼肌
- Phalloidin染色
- 细胞核周围的区域