抽象的
背景
花器官的特性是由多种MIKC MADS-box转录因子组合作用确定的。TM8MADS-box基因是孤立于植物番茄突变体的分生组织超过20年前,但仍不知道从功能的角度来看,尽管存在在被子植物和裸子植物,一些物种窝藏超过基因的一个副本。本研究报告的特征TM8这是在基因表达改变的转基因番茄植株中进行的。
结果
番茄植物也在表达中TM8或该基因的嵌合抑制子形式(TM8: SRDX)准备。在TM8上调植物可以观察具有较差的花粉具有不良的异常雄蕊,并改变了几种花卉同一性基因的表达,其中B-,C-和E-功能,而在其他螺纹中没有明显的形态学修饰。在表达的植物中获得椭圆形卵巢和水果,也获得了舱室arpicTM8: SRDX阻遏基因。这种卵巢显示出各种Carpel相关基因的修饰表达。在其他花螺纹中没有明显的修改。后一种植物还具有齿形叶和畸形的花脱落区。通过使用酵母两种杂交测定,可以表明TM8能够用大甲基酵母相互作用。
结论
绝经改变的影响TM8在生殖结构上的表达表明该基因在番茄花的发育中起着一定的作用。MACROCALYXMADS-box基因在发育完全的花的四个轮状花序中均有表达,且在数量上呈现与之相反的变异TM8在不规则的雄蕊和子房。因为TM8蛋白相互作用在体外只有与A功能疯子箱蛋白质macrocalyx只有,对于番茄生殖结构的正确分化,TM8和Macrocalyx蛋白之间可能的相互作用可能是重要的。
背景
花卉归气突变体的可用性和相应基因的分离代表了我们对花形成分子基础的理解的转折点。这些研究主要是在拟南芥,金鱼草majus和佩妮矮牵牛,并导致了各种MADS-box转录因子的特性,这些转录因子被证明能够启动导致花器官实际形成的遗传程序[1]、[2].
番茄(茄属植物lycopersicon)是一个在世界范围内具有巨大经济重要性的物种,目前在番茄遗传资源中心(http://tgrc.ucdavis.edu).然而,在20世纪90年代提出ABC模型时,还没有发现番茄花的同源性突变体,因此,近年来研究的重点是利用外源探针筛选番茄MADS-box基因,从成熟的野生型花的mRNA和cDNA文库中分离出MADS-box基因anantha花分生组织,分别[3.].在anantha突变:花的分生组织在花朵形成之前被阻断,它们无限期地分枝,形成菜花状的花序。4].
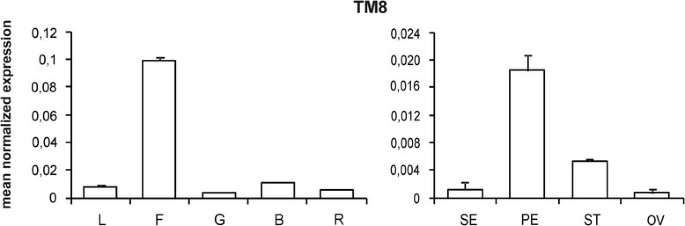
因此,几个疯盒编码CDNA被隔离并命名TM(番茄契尼),后面跟着一个数字。特别是,从花的阻滞分生组织anantha突变体是孤立的一个名为的基因TM8,并被视为沿着花形成途径的“早期”基因TM4.,而TM5,TM6.和TM16被视为沿同一途径的“晚期”基因[3.].Northern blot检测表明TM8在雌蕊、花药和花瓣中均有表达,但表达量远低于其他MADS-box基因。萼片和叶片中未检测到转录本[3.但这一结果可能是由于与更现代的分析方法相比,北方技术的灵敏度较低。
在一项全面的工作,旨在表征番茄MADS-box基因家族,Hileman等.[5]分离出大量新基因,并通过半定量RT-PCR分析其与已知基因的表达情况。由此可见TM8不仅表达在生殖装置中,而且表达在叶子中。
可能是由于拟南芥中TM8的同源基因的缺失,使得该基因对进一步的研究兴趣不大。然而,由于对可能的功能的了解有限TM8最近被海曼斯强调了吗等.[6谁建议其功能表征可能是“特别兴趣,以完成我们对MIKC的理解c基因功能”。
事实上,在分离出第一个番茄MADS-box基因后,同一个研究小组试图通过制备转基因反义植物来对每个基因进行功能特征分析。然而,据我们所知,唯一的参考结果与获得TM8是在Lifschitz发现的吗等.[7据报道,12个转基因植株中有3个表现出严重的子房变形和完全不育。此外,单性结实症的发病率极高。
从发现的20多年以来TM8基因有关其功能的信息仍然非常稀缺,我们认为兴趣研究该基因在番茄中发挥的可能作用。为此,我们制备了转基因番茄植物过度表达它,而且还在表达嵌合基因的转基因植物TM8融合到SRDX转录阻遏域的序列[8]、[9].结果表明,TM8不仅对花药有重要作用,而且对子房和果实的形成也有重要作用。此外,还观察到叶片的一些表型变化,这与观察到的正常表达相一致TM8在这个器官。
结果
的功能表征TM8是通过制备基因表达改变的转基因植物进行的。利用在X60760序列上设计的特异性寡核苷酸,通过RT-PCR实验获得其相关cDNA [3.].由此获得的cDNA在两条链上都进行了测序,它的编码区实际上比X60760序列长60个核苷酸。特别是,42和18个核外核苷酸分别定位于K和C结构域(未显示)。特异性引物能够区分X60760序列和TM8用我们分离的序列对从花和果实中提取的基因组DNA和cDNA进行PCR实验。结果(附加文件1)显示这两个序列都存在于番茄基因组中,这与已发表的基因组数据一致[10.].然而,只有我们隔离的较长的序列似乎在我们的番茄植物的花朵和水果中表达(即CV佛罗里达州娇小),因此我们决定使用后一种cDNA用于制备转基因佛罗里达州娇小植物。
表达植物的表型表达过度表达的TM8基因
获得了22条独立的航线35 s: TM8从叶片中提取基因组DNA进行PCR分析(见方法-转基因植物的生成)。大多数转基因株系与未转基因株系相比,在宏观上没有任何差异,但有3个株系在雄蜂中产生了异常的花朵(图)1).
通常情况下,番茄花药形成一种圆锥,包围着花柱的上部(如图)1, 1 d)。在异常转基因株系中,花药没有形成规则的球果,而且出现更多(图)1b,1e)或更少(图1c)展开。这种形态异常表明,还可以影响花药的功能,因此对三种不同的线进行了花粉活力测定,显示出各种程度的次张放雄蕊。从表中可以看出1,与未转化的植物相比,所有三种转基因系与未转化的植物相比,具有极低量(16%)可行的花粉的线#16,表现出高度降低的花粉活力。按照上述数据,所有三种转基因系列产生了每种水果显着减少的种子,线#16只产生无籽果实(表1).由于具有最强表型的线(即#16)产生无籽水果和由另外两条线产生的非常小的种子是可行的,所以可以仅与初级转化体进行的分子表征。
植物的分子表征过度表达的TM8基因
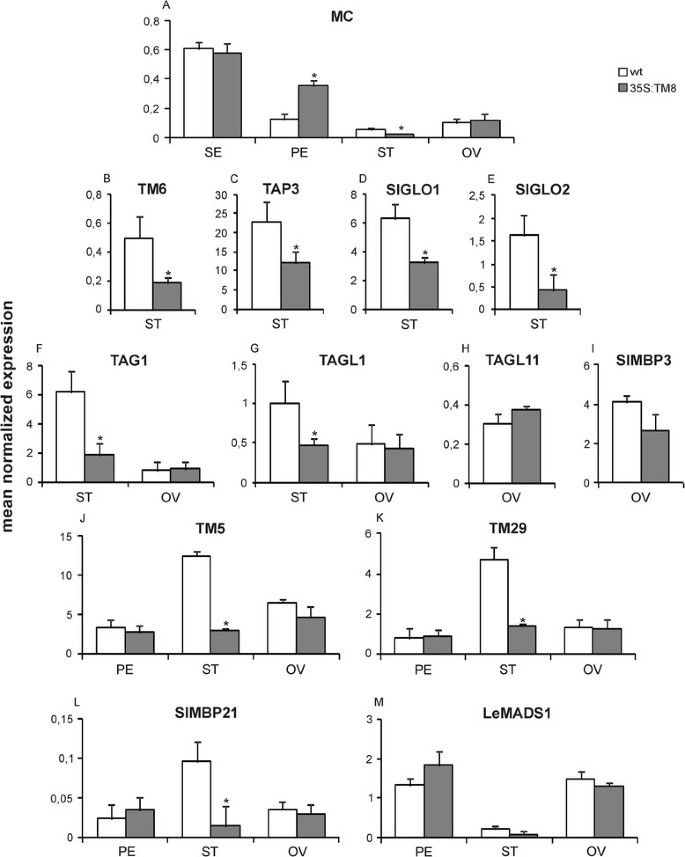
在不可变的花朵中TM8基因一般在所有四轮螺纹中表达在非常低的水平中,在花瓣中发现最高的转录量,其次是花药,萼片和卵巢(图2).分析在三种不同的转基因系和两个未转化的植物上进行(附加文件2),图中所示值均为三种转基因植株和两种未转化植株的手段。唯一明显的表型效应TM8在雄蕊(即轮3)中发现过表达的植物,据此对该轮正常表达的MADS-box基因的表达谱进行了研究。四个基因(即。TM6.,TAP3(番茄APETALA3),SlGLO1和SlGLO2(番茄茄1和茄2)]是已知的番茄属B类[3.]、[11.]、[12.].TM8过表达抑制了这四个基因在雄蕊中的表达(图)3.B, C, D, E),而在花瓣中,它们的表达出现增加(附加文件3.).
考虑到花瓣中b功能基因的表达改变,我们还检测了花瓣中b功能基因的表达MACROCALYX(MC),被认为是番茄的a功能基因[5]、[13.],因此根据拟南芥花发育的ABC模型,应该同时在花瓣和萼片上表达[1].正如所料,MC在萼片和花瓣中都有表达,但在花药和子房中也有转录本(图3.一种)。实际上,萼片分别具有最高的转录量,然后是花瓣,卵巢和花药。在转基因的花朵中MC在萼片和卵巢中显示出不变的表达水平,而基因转录物出现在花瓣中增加,并且在次展示的花青中减少。
SEPALLATA由于SEP蛋白与ABC转录因子形成高阶复合物,因此它对所有花轮的形成都非常重要。在番茄的五9月基因被发现,TM5,TM29,SlMBP21(茄属植物MADS-box蛋白21),LeMADS1(Lycopersicon esculentum MADS1),凛(RIPENING-INHIBITOR)[3.]、[13.]- [15.],因此也对其表达式进行了分析TM8过度表达的植物。有趣的是,这TM5,TM29和SlMBP21与对照花药相比,在展开的花药中,基因的表达量显著降低3.第2轮、第3轮和第4轮中转基因植株与未转基因植株无明显差异LeMADS1(图3.m)和凛,后者通常以极低的级别表达(数据未显示)。
在番茄四个基因中[即标签1(番茄无性生殖的1),TAGL1(番茄AGAMOUS-LIKE 1),塔尔11.(番茄糯11),SLMBP3(Solanum Lycopersicon Mads-Box蛋白3)]形成无性生殖的亚家族[3.]、[15.]、[16.,尽管真正的C函数用标签1和TAGL1基因,其余两个为D功能基因。有趣的是,C功能基因在转基因雌蕊中没有表达差异,而在转基因张开雄蕊中表达显著下降(图)3.F, G)。关于塔尔11.和SLMBP3这些基因在卵巢中有高水平的表达,但在两组之间没有观察到差异TM8表达和未转化的植物(图3.你好)。
表达的植物的表型特征TM8: SRDX嵌合阻遏基因
的表达式35 s: TM8: SRDX这种结构实际上是以显性阻遏因子的形式表达基因[8]而且这种技术最近用于番茄来研究这一角色TAGL1水果中的疯子箱基因[17.也包括Sl-ERF。B3基因(18.].在基于基因组DNA进行的PCR测定的基础上判断,获得了15种独立的转基因素,其中大多数显示出叶子形态的可见改变(图4一种)。特别是,从非常年轻的幼苗开始,明显的叶片换蛋白是显而易见的。此外,在所有线中,转基因叶与未转化的叶片呈较暗的绿色,并且通过测量叶绿素含量来证实这一点(图4b)。
35 s: TM8: SRDX植物表型。(一种)野生型番茄植物(左)和植物的线条35 s: TM8: SRDX# 2(右)过度表达TM8: SRDX并具有标记的叶片缩影(见插页)。(b)叶绿素A和B含量在野生型(白色)和35 s: TM8: SRDX(灰色)叶子。值代表三个不同的转基因株系和两个未转化植株的平均值。柱状图是离均值的标准差。用星号表示学生t检验与对照组差异显著(P <0.05)。野生型番茄花序(C)以及线的花序35 s: TM8: SRDX#6(d),后者有较长的花梗。环境扫描电子显微镜(ESEM)拍摄的野生型花脱落带(e)和线的异常花脱落区35 s: TM8: SRDX#2(F).野生型卵巢的ESEM照片(G)和长圆形的子房线35 s: TM8: SRDX#2(H).野生水果(我知道)和线条的水果35 s: TM8: SRDX有椭圆形形态的(j)并且没有种子(l).
花和果的花梗比未转化的花梗长(图4C,D),即使在ESEM显微镜下观察,脱落带也没有显示正常组织(图)4e,f)。雄蕊看起来像野生型,而转基因植物的第四轮出现异常。特别是,卵巢和水果有一块椭圆形,而不是圆形(图4G,H,I,J),所有转基因品系均产生无核果实(图4K, L和表1),因此所有后续的分析都必须使用初级变压器进行。
植物表达的分子特征TM8: SRDX嵌合阻遏基因
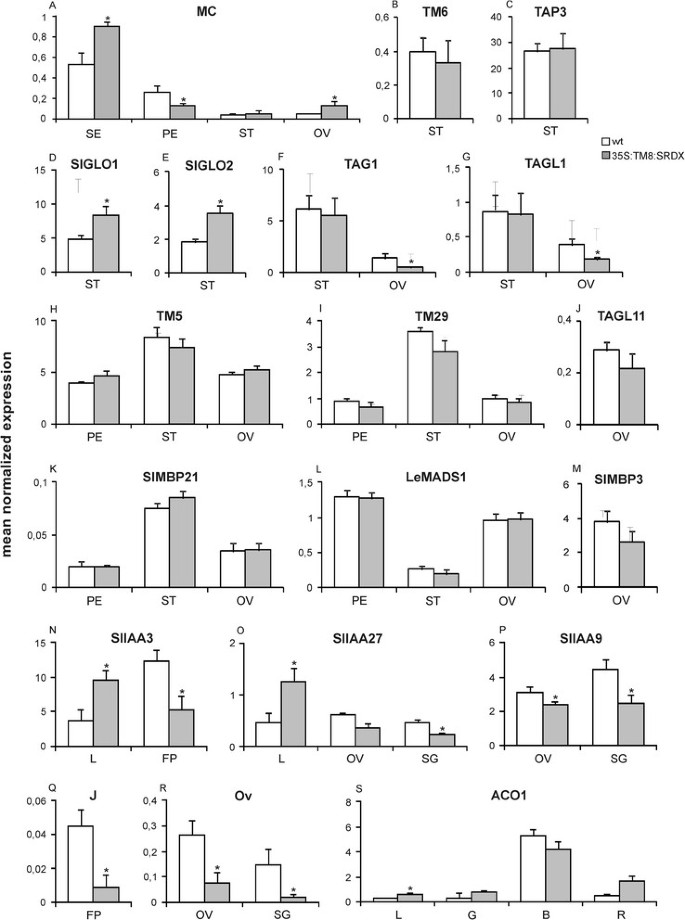
对三种不同的转基因株系和两种未转化植株进行了分析,这里显示的值分别为三种转基因植株和两种未转化植株的平均值。通过实时PCR进行评估(附加文件4)的嵌合阻遏基因在转化植株中表达,因此出现了不同于基因过表达所诱导的异常表型,可归因于嵌合阻遏基因的表达。
众所周知,在番茄中joint(J)Mads-Box基因控制花和水果花序中的脱落区的正确形成[19.].由于在我们的植物中这样的脱落带没有显示出正确的组织,表达joint在这些异常区域进行分析,该基因的转录量与未转化基因相比显著减少(图5问)。
转录因子编码基因的相对表达35 s: TM8植物。不同基因在野生型(白色)和的相对表达TM8: SRDX过表达(灰色)组织:萼片(SE),花瓣(PE),雄蕊(ST),子房(OV),花梗(FP),叶(L)和不同发育阶段的果实[小绿(SG),成熟绿(G),破碎(B)和红色(R)]。面板从一个到米显示MAD-BOX转录因子编码基因的表达,每个面板都包含所检查基因的名称。面板从N到O显示编码不同Aux/IAA蛋白的基因表达,这些蛋白的具体名称在其专门的面板中被报道。最后,小组问,R和年代显示的表情joint(J),卵圆形的(OV)和ACO1基因,分别。通过实时荧光定量PCR分析得到表达数据(归一化表达的平均值)。值代表三个不同的转基因株系和两个未转化植株的平均值。柱状图是离均值的标准差。用星号表示学生t检验与对照组差异显著(P <0.05)。
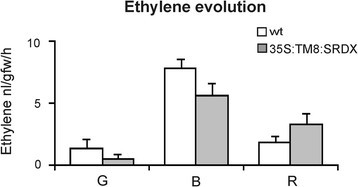
有标记的叶子上凸第一眼就表明这些叶子产生了过量的乙烯,然而,尽管增加了乙烯的表达ACO1基因(图5S),已知参与番茄乙烯生物合成[20.[我们的实验条件下,不能测量乙烯生产。可能在叶片中,乙烯的产生低于所用仪器的灵敏度阈值,因为激素可以在TM8中测量,其中SRDX果实,其原因在于与未转化的量相当的量(图6).
在深色种植的幼苗中,已知在乙烯诱导的钩形形成中,通过养蛋白发挥作用,也已经显示了两种激素之间的相互作用,也用于叶子互换[21.].为了了解生长素是否也参与了我们转基因植物叶片的上生,决定研究那些编码Aux/IAA蛋白的基因的表达,这些基因的作用已经被阐明。
的SlIAA3(茄属植物IAA 3)基因的表达同时受到生长素和乙烯的调控[22.].该基因的下调降低了乙烯诱导的叶片上向性,因此表明该基因的表达与上向性的速率有直接的关系[22.].在具有强烈缩影的转基因植物中,在细长的花束中减少了叶子中这种基因的表达显着增加(图5N)。
最近,基因SlIAA27(茄属植物lycopersicon IAA27)已鉴定另一种Aux/IAA蛋白的编码[23.].特别地,已经表明它的沉默导致形成细长的水果,这些水果看起来像由此产生的那些35 s: TM8: SRDX番茄植物。而且,这是SlIAA27沉默植物的叶片叶绿素含量降低。有趣的是,在我们的转基因叶片中,叶绿素含量增加SlIAA27基因显示出增加的表达,而在细长的水果中,与未转化的果实相比,转录量显微出现降低(图5o)。
关于SlIAA9(Solanum Lycopersicon IAA9),其下调导致占疗效的形成[24.类似于在TM8: SRDX表达植物。有趣的是,在后者的植物SlIAA9基因在卵巢和非常年轻的果实中具有显着降低的表达(结构前10天),即当样种子被发生时(图5P)。
研究了各种疯子箱基因的表达,参与了生殖结构的形成TM8: SRDX表达植物。四个已知的番茄B类基因,TM6.和TAP3未表现出明显的表达改变,而两者SlGLO1和SlGLO2在雄蕊中具有显着增加的表达(图5b,c,d,e)和花瓣(附加文件5).的表达式MC基因在花药中不受影响,但在其他三个轮中不受影响。萼片转录量增加,花瓣转录量减少,异常子房转录量减少MC表达水平显著增加(图5A).四个基因属于无性生殖的亚科,标签1和TAGL1(C类基因本身)在卵巢中表达减少,而在雄蕊中没有变化(图)5f,g),而在这两个螺纹中没有发现任何变化塔尔11.和SLMBP3(图5J, M)。最后,五SEPALLATA第2轮、第3轮和第4轮的基因表达无明显变化,而第2轮、第3轮和第4轮的基因表达略有下降TM29在单一转基因花药中(图5h,i,k,l)。
的基因卵圆形的在番茄中已知参与果实形状的测定,其降低的表达可能与水果形态的变化有关[25.].的TM8: SRDX表达植株产生伸长的子房和果实卵圆形的卵巢和非常小的果实中的转录物显着减少(经过过早10天),这是对最相关的发展阶段卵圆形的表达和建立水果形状(图5R)。
最后,在伸长的果实中既产生乙烯又表达ACO1基因基本上与未转化的果实的那些相当,因此证实椭圆形水果可以经历正常的成熟过程(图5和和图6).
MADS-box蛋白质相互作用
鉴于引人注目的参与TM8在番茄生殖结构发育过程中,我们检测了TM8蛋白可能与其他参与这些结构发育的MADS-box转录因子相互作用的能力。为此,我们利用酵母双杂交技术进行了大量的试验。酵母双杂交技术是一种广泛用于评价MADS转录因子异二聚和/或同二聚能力的方法在体外[26.]、[27.].
TM8无法使用四种番茄B型MADS箱转录因子(TM6,TAP3,SLGLO1和SLGLO2)形成同源二聚体或复合物。当用无关节或三个SepAllata样蛋白(即TM5,TM29和SLMBP21)测定TM8测定时,观察到形成杂二聚体的相同缺陷性,其同位素基因在花中显示出明显影响的鲜花中的显着影响TM8表达(表2).类似地,TM8与Tag1或Tagl1,两个番茄C型疯箱蛋白没有杂二种。事实上,TM8-TAG1复合物可能非常弱促进一个报告基因的转录(ADE2), 同时他3没有转录。而且,弱者ADE2仅在使用TM8作为诱饵和标签作为捕食时才观察到激活,因此这些结果表明这种相互作用不固定。有趣的是,我们的酵母双杂化测定显示TM8可以用MC界二聚体(表2).TM8-MC相互作用非常稳定,因为它被检测到TM8作为诱饵,当MC是诱饵蛋白时。此外,在两种情况下,TM8-MC复合物能够激活两种报告基因的转录(他3和ADE2,见表2).
讨论
制备了表达改变的转基因番茄植株,以进行功能鉴定TM8.特别是,在TM8在第3轮中发现过表达植株宏观异常,主要是雄蕊张开,花粉活力差。关于MADS-box基因,Pnueli首次报道了展开和不育的雄蕊等.[28.[反义番茄植物,具有下调表达的TM5这是一种e功能基因。在这些植物中,其他MADS-box基因,TM6.和标签1其中,在表达中不受影响。AMPOMAH-DWAMENA等.[14.]在番茄植物中获得展开和无菌雄蕊TM29而另一个e -功能基因则发生了异位下调,且这种下调并不影响其表达TM5和标签1MADS-box基因。最后,在番茄植株中发现雄蕊展开,各种b功能基因的表达减少或缺失[12.]、[29.].
上述发现特别有趣,因为它们表明,在同一物种中,不同MADS-box基因的一个或另一个表达减少,可以以明显相似的方式影响雄蕊的形态和功能。因此,由于单个基因的下调可以引起相同的异常表型,因此,在番茄中,b功能基因和两个e功能基因的蛋白产物可能同时存在TM5和TM29相互依赖地参与了导致第三轮分化的过程。
本研究的结果进一步增加了番茄3号轮分化分子网络的复杂性。事实上,除了已经提到的四个b -功能基因和两个e -功能基因之外,还有SlMBP21,另一个e功能基因,两者兼而有之标签1和TAGL1,两个c功能基因,和MACROCALYX,一个假定的a功能基因,在异常展开的雄蕊中明显下调TM8过度表达的番茄植物。由于所有上述基因在异常雄蕊中显着降低了表达,因此该发现表明,在螺纹3中,必须具有各种疯箱蛋白的特定组合和剂量平衡,以便具有正确的雄蕊分化。在花瓣(螺纹2)所有四种B函数基因和MACROCALYX出现显着上调TM8过度表达的花瓣。相反,在TM8: SRDX表达花瓣:SlGLO1和SlGLO2基因也出现了类似的上调TM6.和TAP3基因的表达没有变化,而MACROCALYX表达下降。由于两种转基因植物的花瓣形态没有明显的差异,可见两种转基因植物花瓣的表达变化MACROCALYXB函数基因不足以显着改变瓣膜形态。
但是,关于表达的数据MC在我们的转基因植株中表明该基因一定在整个番茄花的分化中发挥了一定的作用。事实上,尽管MC被认为是一种诱导的A函数基因,其在完全分化的花朵中的表达不限于前两个螺纹,因为一个人期望在规范ABC模型的基础上进行期望[1].相反,MACROCALYX在所有4轮中均有表达,在张开的花药和异常的子房中表达均有显著变化。
花器官的特性是由不同的MIKC MADS-box转录因子以组合方式作用的[1].通过这些蛋白质形成的分子网络使用酵母两种杂交测定进行了广泛探索[26.]、[30.].这些研究也在番茄中进行了[12.]、[15.]、[29.],但TM8蛋白可能与其他MADS-box转录因子的相互作用尚未检测。因此,我们决定利用该技术鉴定那些能够与TM8形成异源二聚体的番茄MADS盒蛋白。
与拟南芥不同,番茄有两种ap3样蛋白,TAP3和TM6 [3.]、[11.],以及两个pi样蛋白SlGLO1和SlGLO2 [12.],代表B类功能。B型MADS箱蛋白没有一个能够在我们的酵母中形成TM8的二聚体。酵母两种杂合测定也排除在外,TM8能够同性全调。TM8也没有与Tagl1和Tag1相互作用。关于TAG1,我们录制了弱激活ADE2报告基因,但我们无法在缺乏组氨酸的培养基上观察到生长,这表明他3没有激活。因此,TM8和TAG1似乎不太可能形成二聚体体内.
TM8在酵母中与番茄sepallata样MADS box蛋白[TM5, TM29和SlMP21]没有物理上的相互作用31.]]在我们的转基因植物中具有改变的表达模式,也是无懈的[19.].有趣的是,TM8能够在酵母中与大甲基酵母相互作用,二聚体TM8-MC可以促进报告基因的转录,ADE2和他3.这证实,用于酵母测定的嵌合TM8蛋白正常折叠。
在ABC模型提案后二十年,因果关系引入了修改等.[32.在“花器官鉴定:20年的abc”综述中,解释了大多数植物物种缺乏a -功能的原因。Schwarz-Sommer和同事介绍了一个新的(a)函数[33.]重要的是定义花卉公司的身份并产生被认为是花卉器官的地面状态的萼片。我们的数据似乎表明,该模型也可能对番茄花施加,并且TM8蛋白的活性可能通过与Macrocalyx蛋白的相互作用来介导。
过度表达TM8: SRDX阻遏物嵌合体对繁殖和营养结构进行了宏观影响。虽然它已在番茄中显示[5]在两个裸子植物中[34.] TM8样基因也表达于叶子中,后者发现是出乎意料的,因为Lifschitz等.[7]只报告了它们的生殖结构异常TM8反义番茄植株,而在我们转基因植株中,叶片表现出明显的上向性,与未转化植株相比,叶片更绿。花梗也与野生型不同,因为它们没有区分正确的脱落带。对于后一目的,已知MADS-box基因的正确表达joint对于番茄花花序中的正常脱落区的差异是必要的[25.和预期的一样,在异常的剥离带TM8: SRDX花梗也是表达joint与缺陷的脱落区域一致地显着减少。
在植物中,一种特定激素的生理活动也可能依赖于它与同一组织中其他激素的相互作用,这已经在乙烯和生长素中多次得到证实[35.]、[36.].在番茄中,它被证明SlIAA3作为Aux/IAA蛋白的编码基因,该基因可同时受到生长素和乙烯的正调控,当外源乙烯处理该基因的反义番茄植株时,与野生型植株相比,该基因的表观反应降低[36.].有趣的是,在TM8: SRDX表达植株上叶表达量显著增加SlIAA3基因,而在延长的花束中发现显着减少的转录物量。因此,无法测量由齿形叶产生的乙烯可以简单地反映对乙烯的需要只是激活表达SlIAA3基因,因此激素不能大量产生。有关生长素可能参与的建议也来自于其他表型特征35 s: TM8: SRDX植物,如细长的水果,他们的卧式和叶子的深绿色。事实上,在这些异常情况下,养肝信号转导途径中涉及的其他基因显示出在其证明的功能的基础上被预期改变的表达[22.]- [24.].然而,TM8与生长素之间可能存在的联系尚不清楚。
至于观察到的生殖结构的表型异常TM8: SRDX植物,它们似乎只影响轮生。特别是,所有的果实都是单性果,Lifschitz已经描述了这一特征等.[7] 他们的TM8反义番茄植物。与此相反,雄蕊外观正常,花粉活力与野生型相当,明显是心皮轮的问题所致。事实上,转基因卵巢在发育结束之前都是拉长的形状,所以成熟的果实也会是椭圆形的,而不是像未转基因的那样是圆形的。番茄果实的形状受多种基因的控制[37.特别是较低的表达卵圆形的基因已经被证明是形成梨形番茄的关键因素[25.].最近,Rodriguez.等.[37.]证明了这一点卵圆形的也可以参与形成椭圆形西红柿,这也是如此35 s: TM8: SRDX水果自卵圆形的基因在子房和非常年轻的果实(即果实成形时)中的表达量显著降低。
C函数标签1基因由pnueli显示等.[38.]用雄蕊和心皮表达,并对这两个器官的正确分化具有基本重要性。特别地,他们发现基因的下调表达导致相关畸形的外观,其中报道了雄性和女性无菌。在番茄中标签1和TAGL1是真正的C函数基因塔尔11.和SlMBP3d功能基因。有趣的是,注意到两者的表达标签1和TAGL1与它们在生殖结构分化过程中所起的作用一致。在TM8过表达的两种基因在异常雄蕊中的表达量显著降低,而在正常子房中的表达量则相反TM8: SRDX表达植株雄蕊中两种基因表达量正常,异常子房中表达量显著降低。与野生型相比,后者卵巢的d-功能和e -功能基因的表达均无明显变化,上述数据强化了野生型的作用标签1和TAGL1番茄心皮发育的基因[17.]、[38.]、[39.].
结论
发现后不久,表达概况TM8通过北部分析研究基因,作者发现了高素体数量anantha其他疯狂箱子基因的花卉素质(即TM5和TM6.)无法检测到。由于这个原因TM8基因被定义为花卉分化过程中的“早期”基因,其他基因被定义为“晚期”基因[3.].以上的表达模式表明,早TM8基因可能,在一些尚不清楚的方式,调节晚期基因的表达,这种想法似乎与这项工作的结果一致,至少就螺纹3和4的分化以及其他疯子的表达- 盒基因涉及。研究表达之间的关系将是有趣的TM8和蟾蜍的活性,已知对水果集和发展很重要的激素[40].
最近,Gramzow等人[41.)表明,TM8-在裸子植物中,基因也很常见。因此,尽管对这种类型的基因观察到的通常观察到的表达水平较低,但其参与生殖结构的形成可能是在种子植物中广泛保护TM8样基因的原因。
方法
植物材料
番茄植物(Lycopersicon esculentum简历。在帕多瓦大学生物学系的标准条件下,在25°C和16小时光周期的控制温室中生长。在上述温室中种植番茄不需要批准。种子取自美国佛罗里达州迈尔斯堡的番茄种植者供应公司(www.tomatogrowers.com).在花开花期采集花的萼片(SE)、花瓣(PE)、雄蕊(ST)、子房(OV)和花梗(FP)。果实在开花后10天小绿(SG)、成熟绿(G)、破碎绿(B)和成熟红(R)等不同发育阶段收获,叶片完全展开(L)。所有组织和水果样品均冷冻保存在−80°C。
RNA提取和基因表达分析
根据Chang的方法,从不同组织中提取总RNA等.[42.].通过紫外(UV)吸收光谱检查RNA产率和纯度,而通过琼脂糖凝胶中的电泳确定RNA完整性。
从不同组织中获得的RNA样本通过高容量cDNA Archive Kit (Applied Biosystems,www.lifetechnologies.com.),使用随机六聚体作为引物。3 μg总RNA, 1.5 U dna酶I (Promega,www.promega.com.),用作起始模板。通过标准实时PCR进行基因表达分析。所选基因的引物序列列于附加文件中6.内标由肌动蛋白基因组成。用基因AMP 7500序列检测系统(Applied Biosystems)进行PCR。得到的C.T通过对每个样品的平均三个独立计算的归一化表达值进行平均来分析值。表达值作为Q-Gene软件的等式2计算的三份子酸的归一化表达值的平均值给出,[43.].
转基因植物的产生
通过克隆GWa通道盒(Invitrogen,www.lifetechnologies.com.)进入PBinar载体SmaI限制性位点,在35s Camv启动子和Nopaline合酶(NoS)终止子之间[44.].
获取35 s: TM8构建TM8(番茄马德斯8)使用底漆(FW 5'- CattgaagaAtggGagag-3'和RV 5'-AggTagcaattgaAgctctg-3')的全长cDNA(登录号kf270624)被PCR扩大了PCR扩大TM8序列(X60760),随后被克隆到PCR®8/ gw / Topo载体(Invitrogen)中。
使用网关LR克隆酶酶混合物(Invitrogen)TM8通过同源重组,将cDNA克隆到pBINAr_GWa质粒中。
占主导地位压缩机构建体(35 s: TM8: SRDX)是通过产生EAR抑制域(SRDX)之间的平移融合而创建的[8]和3 '结尾TM8利用引物FW 5 ' - CATTTGAAGAATGGGGAGAG -3 '和RV 5 ' - ttttaagcgaaacccaaacggagttctagatccagcgagtcccttagaaagtaactc -3 '(后者含有SRDX抑制域)进行RT-PCR实验。随后的TM8: SRDX如前所述,amplicon被引入到pBINAr_GWa中。
通过测序确定克隆的cdna的身份。DNA测序由意大利帕多瓦的BMR基因组公司(www.bmr-genomics.it).序列操作、分析和比对使用LASERGENE软件包(DNASTAR,www.dnastar.com).
所得的二元质粒被插入根癌土壤杆菌(菌株LBA4404)的细胞,然后用它来转化番茄根据Fillati等.[45.].利用引物对花椰菜花叶病毒(CaMV) 35S启动子(5 ' - ggggaattcggtggctcctacaaatg - 3 ')和引物进行PCR,确定了转基因植株对卡那霉素的抗性TM8编码序列(用于35 s: TM8construct: 5 ' - TCATCCCTTAGAAAGTAACTCACT- 3 '35 s: TM8: SRDX: 5 ' - ttctagatccagatcgagtcccttag - 3 ')。
花粉活力测试
使用MTT [MTT:3-(4,5-二甲基噻唑基-2)-2,5-二苯基四唑粒溴铵测定法定花粉活力]测定法46.].简而言之,将来自感兴趣的植物中的十朵花的花香引入含有MTT 1%(w / v)的溶液中(Sigma-Aldrich,www.sigmaaldrich.com.)和蔗糖5%(w / v)。在光学显微镜下每株植物10分钟1000分钟(Leica DM5000,www.leica-microsystems.com/).如果它们变得深粉红色,花粉晶体被认为是可行的。在80°C下孵育2小时的野生型花药用作阴性对照。
显微镜分析
通过环境扫描电子显微镜(ESEM),帕多瓦大学(University of Padua)的CUGAS设施在低压条件下观察了没有任何处理的番茄组织(花的部分和花梗)。www.unipd.it/cugas/).
乙烯测量
通过将整个水果或叶片(根据需要50-60mL,根据需要)封闭,用透明包装物密封并在室温下保持乙烯生产来确定乙烯生产。在1小时后,将1ml空气样品从每个罐中取出以进行乙烯测量。气相色谱仪(Perkin-Elmer F17;诺沃克,康纳,www.perkinelmer.com)用于定量乙烯浓度。
酵母双杂交和三元陷阱测定
ypad,sd和适当的辍学媒体已被描述[47.].酵母双杂交试验使用酵母菌株AH109(克隆技术,www.clontech.com)[48.].携带Gal4 DNA结合结构域的PGBTKT7矢量(CLONTECH)用于表达诱饵蛋白质,而PGADT7载体[49.,携带GAL4激活域,用来表达猎物蛋白。双杂交蛋白相互作用是通过在28°C缺乏组氨酸或腺嘌呤和添加不同数量的3-氨基-1,2,4-三唑(3-AT)的培养基上生长酵母菌落来评估的。
用于克隆番茄MADS盒基因的引物全部列在附加文件中7.
加入数量
的TM8本工作中使用的序列将出现在Genbank中,其登录号如下:KF270624。
附加文件
参考
- 1。
Coen Es,Meyerowitz em:螺纹的战争:控制花发育的遗传相互作用。自然。1991年,353:31-37。10.1038 / 353031A0。
- 2。
黄志强,黄志强,黄志强:MADS-box基因的主要分支及其在开花植物发育和进化中的作用。环境科学学报。2003,29(4):489 - 494。10.1016 / s1055 - 7903(03) 00207 - 0。
- 3.
Pnueli L,Abu-Abeid M,Zamir D,Nacken W,Schwarz-Sommer Z,Lifschitz E:番茄的疯子盒基因家族:患者在花卉发育期间的时间表达,以及来自的归属基因花青素和拟南芥.植物学报1991,1:255-266。10.1111 / j.1365 - 313 x.1991.00255.x。
- 4。
Helm J: Vergleichende Betrachtungenuber die Entwicklung der Enfloreszenz bei Lycopersicum esculentum Mill。那是一个错误的变种人。左切特,1951,21:89-95。
- 5。
陈敏,陈志强,陈志强,陈志强:番茄MADS-box基因家族的分子和系统发育分析。中国生物化学学报。2006,23(3):495 - 498。10.1093 / molbev / msl095。
- 6。
MADS-box基因与植物发育:黑暗面。中国生物医学工程学报。2012,31(6):589 - 594。10.1093 / jxb / ers233。
- 7。
Lifschitz E, Brodai L, Hareven D, Hurwitz C, Prihadash A, Pnueli L, Samach A,Zamir D:番茄花发育的分子定位。番茄分子生物学。Yoder J. Lancaster PA编辑,美国:Technomic出版公司;1993:175 - 184。
- 8。
Hiratsu K, Matsui K, Koyama T, Ohme-Takagi M:拟南芥中包含抑制域EAR基序的嵌合抑制子对靶基因的显性抑制。植物学报,2003,34:733-739。10.1046 / j.1365 - 313 x.2003.01759.x。
- 9。
Matsui K,Ohme-Takagi M:使用耳动抑制域的血液抑制活性检测植物中的蛋白质 - 蛋白质相互作用。工厂J.2010,61:570-578。10.1111 / J.1365-313x.2009.04081.x。
- 10。
番茄基因组联盟:番茄基因组序列提供了深入了解肉质水果的进化。自然科学。2012,485:635-641。10.1038 / nature11119。
- 11.
Kramer Em,Dorit RL,爱尔兰VF:控制花瓣和雄蕊开发基因的分子演变:Theapetala3和Pistillata Mad-Box基因谱系中的重复和分歧。遗传学。1998,149:765-783。
- 12.
茄科植物花同源性B基因的隐性变异为新功能的进化提供了分子基础。acta botanica sinica(云南植物研究),2010,22(4):562- 578。10.1105 / tpc.110.076026。
- 13。
在番茄成熟抑制因子(rin)位点上发现了一个调控果实成熟的MADS-box基因。中国科学:地球科学。10.1126 / science.1068181。
- 14。
关键词:番茄,TM29,单性果,发育,花回复性植物营养与肥料学报。2002,30(4):413 - 417。10.1104 / pp.005223。
- 15.
Wang X, Wang X ., Wang X ., Duvall MR ., Mao L .:番茄mads结构域蛋白的相互作用研究。中国生物医学工程学报。2008,29(5):593 - 598。10.1093 / jxb / ern094。
- 16。
Busi MV, Bustamante C, D’angelo C, Hidalgo-Cuevas M, Boggio SB, Valle EM, Zabaleta E: MADS-box基因在番茄种子和果实发育过程中的表达。植物生态学报。2003,32(4):491 - 498。10.1023 /: 1025001402838。
- 17。
Itkin M, Seybold H, Breitel D, Rogachev I, Meir S, Aharoni植物学报,2009,60:1081-1095。10.1111 / j.1365 - 313 x.2009.04064.x。
- 18。
Liu M, pirello J, Kesari R, Mila I, Roustan JP, Li Z, Latché A, Pech JC, Bouzayen M, Regad F:番茄Sl-ERFB3基因的显性抑制版本通过乙烯信号和反应组分的反馈调控实现乙烯超敏反应。植物学报,2013,76:406-419。10.1111 / tpj.12305。
- 19。
Mao L,Begum D,Chuang HW,Budiman Ma,Szymkowiak EJ,Irish Ee,Wing Ra:无懈可击是一种控制番茄花脱落区的疯狂箱基因。自然。2000,406:910-913。10.1038 / 35022611。
- 20.
黄志强,王志强,王志强,等:番茄1-氨基环丙烷-1-羧酸氧化酶基因家族的表达差异。植物学报1996,9:525-535。10.1046 / j.1365 - 313 x.1996.09040525.x。
- 21.
Lin Z,Arciga-Reyes L,Zhong S,Alexander L,Hackett R,Wilson I,Grierson D:SLTPR1,番茄四肽重复蛋白,与乙烯受体NR和leetr1相互作用,调节乙烯和养蛋白的反应和发育。J Exp Bot。2008,59:4271-4287。10.1093 / JXB / ERN276。
- 22.
Wang H, Wang H, Li Z, Mila I, Frasse P, Latché A, Pech JC, Bouzayen: Sl-IAA3,番茄Aux/IAA在生长素和乙烯信号转导中的作用。中国生物医学工程学报,2003,30(4):457 - 461。10.1093 / jxb / erp009。
- 23.
Bassa C, Mila I, Bouzayen M, Audran-Delalande C:与下调Sl-IAA27相关的表型支持番茄Aux/IAA家族成员的功能多样性。植物营养与肥料学报。2012,31(4):591 - 598。10.1093 /卡式肺囊虫肺炎/ pcs101。
- 24.
王H,Jones B,Li Z,Frasse P,Delalande C,Regad F,Chaabouni S,LatchéA,Pech JC,Bouzayen M:番茄AUX / IAA转录因子IAA9参与水果发育和叶片形态发生。植物细胞。2005,17:2676-2692。10.1105 / TPC.105.033415。
- 25.
刘建军,刘建军,刘建军,等:一类新的梨形番茄果实发育调控基因。中国科学(d辑:地球科学),2002,32(5):591 - 598。10.1073 / pnas.162485999。
- 26.
Davies B, Egea-Cortines M, de Andrade SE, Saedler H, Sommer H:花同源性MADS盒蛋白之间的多种相互作用。中国海洋大学学报(自然科学版),1996,15:433 - 443。
- 27.
马丽华,李马华,李春华,李春华:INCOMPOSITA:一种控制对虾叶片发育和花分生组织特性的mds -box基因。发展。2004,131:5981-5990。10.1242 / dev.01517。
- 28.
Pnueli L, Hareven D, Broday L, Hurwitz C, Lifschitz E: TM5 MADS box基因介导了番茄花内部三个轮的器官分化。植物学报。1994,6:175-186。10.1105 / tpc.6.2.175。
- 29.
两个番茄APETALA3基因的功能分析表明,它们在调控花发育中的作用是多样化的。acta botanica sinica(云南植物研究中心),2006,28(6):743 - 748。10.1105 / tpc.106.042978。
- 30.
de Folter S, Immink RG, Kieffer M, Parenicová L, Henz SR, Weigel D, Busscher M, Kooiker M, Colombo L, Kater MM, Davies B, Angenent GC:拟南芥MADS Box转录因子的综合相互作用图谱。acta botanica sinica, 2017, 36(6): 733 - 736。10.1105 / tpc.105.031831。
- 31.
Liu D ., Wang D ., Qin Z ., Zhang D ., Yin L ., Wu L ., Li A ., Mao L .: SEPALLATA MADS-box蛋白SLMBP21与JOINTLESS和MACROCALYX形成蛋白复合物对番茄花脱落带发育的影响。植物保护学报,2014,33(4):591 - 598。10.1111 / tpj.12387。
- 32。
因果关系B,Schwarz-Sommer Z,Davies B:花卉器官身份:20年的ABC。Semin Cell Dev Biol。2010年,21:73-79。10.1016 / J.SEMCDB.2009.10.005。
- 33。
关键词:金鱼草,花发育,同源基因,遗传调控中国科学:地球科学。10.1126 / science.250.4983.931。
- 34。
Lovisetto A, Guzzo F, Tadiello A, Toffali K, Favretto A, Casadoro G: MADS-box基因的分子分析可以追溯到裸子植物肉质果实的发明。生物科学进展。2012,29(4):417 - 418。10.1093 / molbev / msr244。
- 35。
在拟南芥的下胚轴中,乙烯反应基因HOOKLESS1是必需的。细胞。1996,85:183-194。10.1016 / s0092 - 8674(00) 81095 - 8。
- 36。
Chaabouni S,LatchéA,Pech JC,Bouzayen M:Tomato Aux / Iaa3和无钩状的重要演员在顶端钩形成过程中养肝和乙烯之间的相互作用。植物信号表现。2009,4:559-560。10.4161 / PSB.4.6.8748。
- 37。
Rodríguez GR, Muños S, Anderson C, Sim SC, Michel A, Causse M, McSpadden Gardener BB, Francis D, van der Knaap E:分布太阳,卵形,LC, 和Fas.在番茄种质和果实形状多样性的关系中。植物理性。2011,156:275-285。10.1104 / pp.110.167577。
- 38。
Pnueli L,Hareven D,Rounsley SD,Yanofsky MF,Lifschitz E:番茄静脉基因的分离标签1转基因植物中的仇恨作用分析。植物细胞。1994年,6:163-173。10.1105 / TPC.6.2.163。
- 39。
VREBALOV J,PAN I,Arroyo AJM,McQuinn R,Chung M,Poole M,Rose J,Seymour G,Grandillo S,Giovannoni J,Irish Vf:肉质果实膨胀和成熟是由番茄调节的防碎的基因TAGL1.acta botanica sinica, 2009, 31(4): 441 - 446。10.1105 / tpc.109.066936。
- 40.
Spena A, Rotino GL:单性结实。最先进的技术。被子植物胚胎学的最新进展。Bhojwani SS编辑,Soh WY。荷兰:Kluwers学术出版社;2001:435 - 450。10.1007 / 978 - 94 - 017 - 1203 - 3 - _17
- 41.
Gramzow L,Weilandt L,Theißeng:疯子在针叶树中出现基因组:在撒上种子植物中的祖先套装基因。安乐伦敦。2014,114:1407-1429。10.1093 / AOB / MCU066。
- 42.
一种简单高效的从松树中分离RNA的方法。植物学报1993,11:113-116。10.1007 / BF02670468。
- 43.
Muller Py,Janovjak H,Miserez Ar,Dobbie z:通过定量实时RT-PCR产生的基因表达数据。生物技术。2002,32:1372-1379。
- 44.
刘XJ,PRAT S,Willmitzer L,Frommer WB:CIS调节元件指导簇绒和蔗糖 - 诱导的嵌合类诱饵诱导剂/ GUS-基因融合的表达。Mol Gen Genet。1990,223:401-406。10.1007 / BF00264446。
- 45.
黄志强,王志强,王志强:草甘膦抗性基因的高效转移根癌土壤杆菌向量。生物技术。1987,5:726-730。10.1038 / nbt0787 - 726。
- 46.
王志勇,葛勇,Scott M, Spangenberg G:转基因和非转基因高羊茅花粉活力和寿命Festuca arundinacea.)(Poaceae)植物。我是J机器人。2004,91:523-530。10.3732 / AJB.91.4.523。
- 47.
谢尔曼F:酵母开始。方法酶。1991年,194:3-21。10.1016 / 0076-6879(91)94004-v。
- 48.
基于基因组文库的酵母双杂交选择研究。遗传学。1996,144:1425-1436。
- 49.
Harper JW,Adami Gr,Wie N,Keyomarsi K,EllEdge Sj:P21 CDK相互作用蛋白CIP1是G1细胞周期蛋白依赖性激酶的有效抑制剂。细胞。1993年,75:805-816。10.1016 / 0092-8674(93)90499-g。
致谢
gc由意大利的dell 'Università e della Ricerca (MIUR)的Ministero dell ' isstruzione资助。S.M.和F.R.得到了Cariplo基金会的支持(SeeFruit 2011-2257)。
我们感谢A. Botton博士在乙烯测量方面的帮助和A. Pavanello博士的技术帮助。
作者信息
从属关系
通讯作者
额外的信息
相互竞争的利益
提交人声明他们没有竞争利益。
作者的贡献
MD制备了构建体并制备了转基因植物,进行了它们的表型表征,并进行了分子分析;SM和Fr制备的构建体并进行双杂交测定并解释结果;进行分子分析;GC构思了研究,协调并写了这篇论文。所有作者都批评并批准了稿件的最终版本。
电子补充材料
基因组和RT-PCR分析。
附加文件1:TM8基因组和RT-PCR分析。(PDF 317 KB)
相对表达
额外的文件2:TM8基因在转基因35 s: TM8线条。(PDF 144 KB)
b型MADS-box转录因子编码基因的相对表达
额外的文件3:35 s: TM8花瓣。(PDF 33 KB)
相对表达
额外的文件4:TM8: SRDX转基因中的嵌合基因35 s: TM8: SRDX线条。(PDF 67 KB)
b型MADS-box转录因子编码基因的相对表达
额外的文件5:35 s: TM8: SRDX花瓣。(PDF 35 KB)
作者的原始提交的图像文件
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。
除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。
要查看本许可证的副本,请访问https://creativecommons.org/licenses/by/4.0/.
创作共用及公共领域专用豁免书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
达米纳托,马西埃罗,S,瑞蒂尼,F。et al。描述的TM8,在番茄花中表达的疯子箱子基因。BMC植物BIOL.14,319(2014)。https://doi.org/10.1186/s12870-014-0319-y
已收到:
接受:
发表:
关键字
- MADS-box基因
- 茄属植物lycopersicon
- TM8基因
- TM8蛋白质相互作用
- 番茄花开发
- 2台混合动力分析