抽象的
背景
植物细胞壁是涉及植物生长、环境相互作用和防御反应各个方面的动态结构,是地球上最丰富的含碳聚合物可再生来源。为了平衡刚性和延伸性,细胞壁成分的组成和完整性需要严格调节,例如在细胞伸长过程中。
结果
我们证明了突变MED25 / PFT1和MED8介质转录复合物的亚基抑制了糖 - 过敏的胚轴伸长表型hsr8-1突变体,由于阿拉伯糖缺乏细胞壁缺陷,不允许正常的细胞伸长。这种抑制独立于光和茉莉酸(JA)信号。基因表达分析表明,诱导的基因表达hsr8-1它们编码的酶和蛋白质参与细胞膨胀和细胞壁增强,在PFT1-2突变系中,编码转录因子的基因表达参与减少下胚轴细胞伸长,编码细胞壁相关酶和蛋白的基因表达上调pft1-2。PFT1也需要多种葡萄糖诱导基因的表达,包括细胞壁成分和酶的编码,花青素生物合成的调控和酶的成分,以及类黄酮和硫代葡萄糖苷生物合成途径。
结论
这些结果证实了MED25和MED8亚基是调节细胞伸长和细胞壁组成的基因对细胞壁缺陷和糖应答基因表达的转录调控所必需的。
背景
糖是普遍的营养物质,为能量的生产、储存和大多数代谢物的合成提供碳骨架。在植物中,主要的碳汇是细胞壁[1是一种动态结构,它既提供了支撑植物的刚性,又提供了允许细胞生长的可塑性。对参与细胞壁多糖合成和组装的酶有广泛的知识[2- - - - - -4,但有关环境刺激和光合产物有效性如何在细胞生长过程中促进细胞壁形成的研究相对较少。
糖可以作为代谢中间体和信号分子[5而用糖处理植物则可以促进植物的生长。将糖的有效性和促进生长联系起来的一个机制是通过外源糖刺激生长素的合成[6[可以通过促进细胞伸长率间接地影响细胞壁形成。糖水平也可以将细胞壁形成与托尔戈尔压力的维持联系起来。编码正常细胞膨胀所需的细胞壁相关激酶(Wak)的基因中的突变也表现出降低的真空转化酶活性[7].这导致外源性糖幼苗保持膨压和生长的增加的依赖性,并表示WAKs可以在保持膨压,其中驱动器单元扩张,和细胞壁形成之间的平衡有关。膨压和细胞壁之间的相似的链接被通过中断纤维素合成并观察所得到的应激反应和扭曲的细胞通过渗透支持和糖的可用性[救出所示8].一些细胞壁基质结构突变体的糖敏感也突出了糖信号与细胞壁完整性控制之间的相互作用mur4,mur1和mur3[9].的hsr8-1(高糖反应8-1的)等位基因MUR4,在UDP-Arabinose合成中存在缺陷,表现出糖超敏基因表达和生长反应[9].的pleitropic监管locus1(prl1)突变被鉴定为抑制基因hsr8-1糖过敏表型。PRL1(多效调节位点1)编码一个WD40蛋白,它是剪接体复合体的一个组成部分prl1突变具有多种复杂的表型,包括糖超敏反应[10].这些发现表明,受损的细胞壁成分可能被主动感知,从而导致转录反应,从而改变细胞壁成分和生长[11].
最近,这种控制细胞壁完整性和植物生长的转录调控因子的存在被证实[12,13].木质素缺乏突变体的生长发育和木质素缺乏ref8通过破坏转录调节复合物Mediator的两个亚基,MED5a和MED5b而恢复。在这里,我们发现MED25/PFT1 (MEDIATOR25/PHYTOCHROME AND FLOWERING TIME 1)和MED8是Mediator转录复合物的另外两个亚基,它们能够抑制糖敏感的短下胚轴和基因表达表型hsr8-1突变体。我们表明这些介体亚基是需要在编码细胞壁组分和生物合成活动的一组基因的改变的表达中所必需的hsr8-1突变体[9].我们发现,其中一个亚基MED25/PFT1也是几个糖应答基因(包括那些编码细胞壁修饰酶的基因)的协调诱导所必需的。这些结果表明,介导复合物的MED25和MED8亚基通过连接糖应答基因和细胞壁基因表达发挥整合作用。
结果
一种新的抑制因子的鉴定hsr8-1糖过敏生长
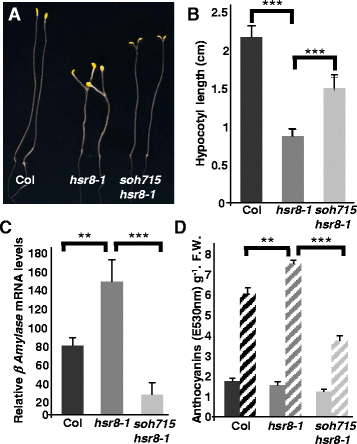
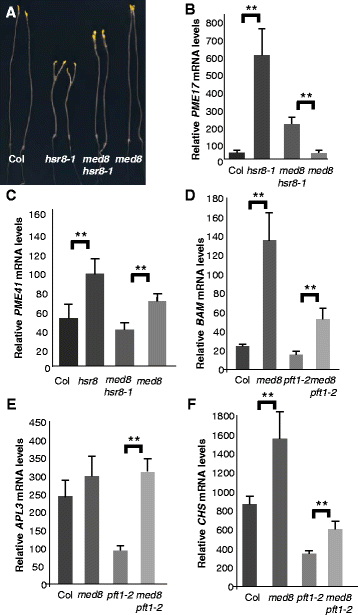
的高糖response8-1突变体,其具有减少的细胞壁阿拉伯糖[14,显示一系列糖过敏表型[9].其中,黑黑的长着hsr8-1与野生型相比,幼苗对葡萄糖的响应下胚轴伸长减少,轻生长的幼苗对糖调节基因表达和花青素含量表现出超敏感。为了确定细胞壁组成改变和糖反应的可能机制,我们筛选了短下胚轴表型的抑制子hsr8-1突变体。我们种植了M2的快中子诱变苗hsr8-1在有葡萄糖存在的黑暗中进行14天的种群,并筛选下胚轴较长的个体。八抑制hsr8-1(全音阶)被隔离,几种缺失是遗传映射的,而且soh715hsr8-1选择隐性突变体进行进一步分析。数据图1A和1B显示中间脊髓基长度soh715hsr8-1与野生型Col和hsr8-1.的hsr8-1糖敏感表型,β-淀粉酶升高(BAMmRNA的积累和花青素含量也受到抑制soh715hsr8-1突变体,BAMmRNA的积累和花青素含量降低hsr8-1比野生型植株低(图。1 c和d).这些结果表明了soh715突变抑制hsr8-1糖过敏表型。
识别抑制器hsr8-1糖敏感下胚轴在黑暗中伸长。一个糖敏感下胚轴伸长hsr8-1和hsr8-1soh715在黑暗中的垂直板上的1%葡萄糖上生长。bCol下胚轴长度的定量测量hsr8-1和hsr8-1soh715.幼苗在含1%葡萄糖的MS培养基上在黑暗中垂直生长14天。误差条代表SD (n > 30). ***,p< 0.001与Col相比hsr8-1和hsr8-1到soh715 hsr8-1(学生的t-测试)。所示数据代表了三个独立的实验。c实时荧光定量PCR分析β淀粉酶Col的mRNA水平,hsr8-1和hsr8 -1soh715葡萄糖反应的抑制因子。在含0.5%葡萄糖的MS培养基上恒光培养。7 d后,在无MS葡萄糖液体培养基中转移24 h,然后在含3%葡萄糖的3% MS培养基中处理6 h。误差条代表三个生物重复的标准差。所示数据代表了三个独立的实验。**,p< 0.01比较Col tohsr8-1;* * *,p< 0.001比较hsr8-1到soh715 hsr8-1(学生的t-测试)。通过内参基因的转录水平计算相对转录水平(RTL)TUB6(At5g12250)。d色素苷在葡萄糖作用下的积累hsr8-1和hsr8-1soh715.幼苗在含1%葡萄糖(固体棒)或3%葡萄糖(虚线棒)的MS培养基上连续光照培养7天。误差条代表三个生物重复的标准差。**,pCol与hsr8-1相比< 0.01;* * *,p< 0.001比较hsr8-1到soh715 hsr8-1(学生的t-测试)。所示数据代表了两个独立的实验
soh715是等位基因吗PFT1-2突变
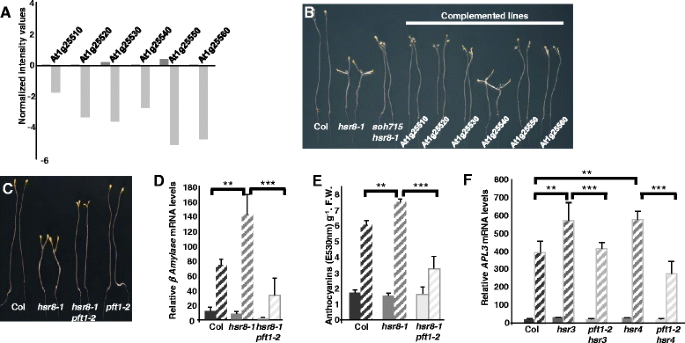
映射soh715双突变体与野生型Landsberg杂交erecta..隔离soh715hsr8-1在F2群体中选择双突变株、长下胚轴植株进行基因分型鉴定hsr8-1纯合子的植物。双soh715hsr8-1突变体占1/4TH.而不是预期的1/16TH..初步遗传分析(数据未显示)显示soh715轨迹映射到染色体1的区域HSR8还有地图,确认了soh715和hsr8-1突变可能与基因有关。基于转录的克隆方法[15然后用它来识别映射区域中的缺失。基因表达在hsr8-1和SOH175HSR8-1苗用的是ATH1基因芯片评估。基因表达水平的比较,可知在染色体1上连续6个基因在表现出强烈减少RNA水平soh715hsr8-1相比hsr8-1(At1g25510,At1g25520,At1g25530,At1g25540,At1g25550,At1g25560;图2A).这一结果,结合初步的基因定位数据,表明包含6个基因的缺失在1号染色体上抑制了hsr8-1表型。要识别所涉及的基因,我们补充了soh715hsr8-1突变背景有6个基因组片段,每个片段包含一个基因和缺失位点的侧翼区域。只有含有At1g25540的基因组片段恢复了hsr8-1短的下胚轴表型(图。2B.).抑制hsr8-1暗发育表型soh715hsr8-1因此,突变体是由AT1G25540缺失引起的,编码Med25 / PFT1蛋白[16,17].为了证实这一观察结果,一个双突变体hsr8-1和功能缺失的T-DNA插入等位基因在At1g25540被称为PFT1-2进行了分析。当葡萄糖的存在下生长在黑暗中HSR8-1PFT2-1双突变体的中间下胚轴长度与soh715hsr8-1(无花果。2C).积累的增加BAM成绩单和花青素hsr8-1对葡萄糖治疗的反应PFT1-2突变(无花果。2 d和e).数字2f.表明PFT1-2也能抑制升高的葡萄糖反应APL3葡萄糖过敏突变体中的表达hsr3[18),hsr4,这是Arp2/3复合体ARP3亚基的误义突变(数据未发表)。因此损失PFT1基因功能抑制hsr8-1下胚轴细胞伸长缺陷与糖敏感基因表达。
hsr8-1糖超敏表型被抑制PFT1-2突变。一个通过在抑制线中调节的六个基因簇的微阵列分析鉴定soh715hsr8-1相比hsr8-1.在本整个微阵列数据集的归一化后获得的那些在Y轴值。深灰色条和浅灰色条表示对所得到的值hsr8-1突变和hsr8-1soh715分别抑制线。b糖高敏感暗发育,HSR8-1,SOH715HSR8-1和soh715hsr8-1与缺失的6个基因中的每一个互补。幼苗在含1%葡萄糖的MS培养基上在黑暗中垂直生长14天。只有包含At1g25540基因的基因组片段拯救了黑暗的发育表型。c糖高敏感暗发育,hsr8-1,双突变体HSR8-1PFT1-2和PFT1-2.按照上文(B)的方法种植幼苗。d实时荧光定量PCR分析β淀粉酶Col的mRNA水平,hsr8-1和双突变体HSR8-1PFT1-2对葡萄糖的反应。在含0.5%葡萄糖的MS培养基上恒光培养。7 d后,移栽至MS无葡萄糖液体培养基中24 h,然后用含3%葡萄糖的MS培养基处理6 h。误差条代表三个生物重复的标准差。所示数据代表了三个独立的实验。**,p< 0.01比较Col tohsr8-1;* * *,p< 0.001比较hsr8-1到HSR8-1 PFT1-2(学生的t-测试)。通过内参基因的转录水平计算相对转录水平(RTL)TUB6(At5g12250)。e色素苷在葡萄糖作用下的积累hsr8-1和双突变体HSR8-1PFT1-2.幼苗在含1%葡萄糖(固体棒)或3%葡萄糖(虚线棒)的MS培养基上连续光照培养7天。误差条代表三个生物重复的标准差。所示数据代表了两个独立的实验。**,pCol与hsr8-1相比< 0.01;* * *,p< 0.001比较hsr8-1到HSR8-1 PFT1-1.(学生的t-测试)。f实时荧光定量PCR分析糖反应APL3基因mRNA水平关口,hsr3,pft1-2hsr3, hsr4,PFT1-2HSR4.和PFT1-2响应葡萄糖.Hsr3和hsr4是ARP2/3复合体亚基中的糖敏感突变[18].在含0.5%葡萄糖的MS培养基上恒光培养。在7天之后,将幼苗转移至不含葡萄糖的液体MS培养基中24小时,并然后处理过的6小时用含有为0%葡萄糖(实心条)或3%的葡萄糖(虚线柱)的MS培养基。误差条代表三个生物重复的标准差。**,p< 0.01比较Col tohsr3和坳hsr4;* * *,p< 0.001比较hsr3到hsr3 pft1-2和hsr4到hsr4 pft1-2(学生的t-测试)。通过内参基因的转录水平计算相对转录水平(RTL)TUB6(At5g12250)
细胞壁成分改变PFT1-2
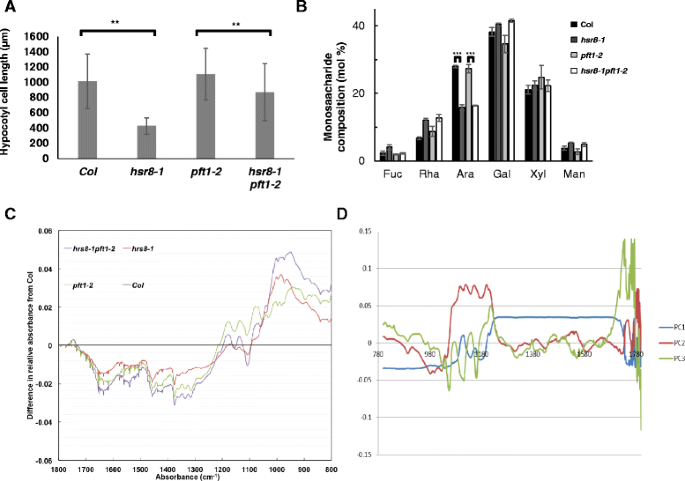
数字3A表明下胚轴伸长减少hsr8-1,它的压制PFT1-2,是由于细胞长度的变化而不是细胞数。抑制短的幼髓表型hsr8-1经过PFT1-2不是由于细胞壁单糖组合物的变化,如HSR8-1PFT1-2双突变体具有同样减少的阿拉伯糖水平hsr8-1(无花果。3B.).深种CL的幼粒细胞壁组成的额外分析,hsr8-1, hsr8-1pft1-2和PFT1-2使用傅里叶变换红外光谱(FTIR)进行突变体幼苗[19].数字3C显示了相对于野生型Col的差异谱,主成分分析(PCA)识别出三个主成分,当映射为得分负载时(图。3d).PC1解释了基因型之间的细胞壁组合物的〜80%,在光谱上显示出非常宽的变化,在800-1200cm-1之间,相对于哥伦比亚的1200-1800cm-1耗尽。虽然PC2和PC3解释了较少的变化(分别分别为〜15%和4%),但这些原理成分鉴定了基因型之间更具体的光谱的变化。在PC2中,1120和1097cm-1之间的正负载可以分别反映基因型之间的木葡聚糖和果胶的变化[19].PC3识别1660和1776cm-1之间的正载荷,可能反映蜡和酚醛组合物的差异[19].额外的文件1:图S1为突变体PC1、PC2、PC2的散点图。三种pc的每一种基因型之间都存在显著差异。
Col细胞伸长与细胞壁组成的比较hsr8-1,PFT1-2和HSR8-1PFT1-2.一个通过扫描电镜图像测量下胚轴细胞长度。n10个细胞分别来自5个下胚轴。**,p< 0.01比较hsr8-1上校,hsr8-1到PFT1-2和HSR8-1 PFT1-2(学生的t-测试)。b14日龄光生长幼苗细胞壁材料的单糖组成(5个生物重复)。Fuc聚焦;Rha鼠李糖;Ara树胶醛醣;Xyl木糖;人甘露糖。。* * *,p< 0.001,比较Col和的阿拉伯糖水平hsr8-1,PFT1-2到HSR8-1 PFT1-2(学生的t-测试)。c利用傅立叶变换红外光谱分析暗培养下胚轴组织细胞壁材料的成分。数据用相对吸光度与野生型Col的差异表示。dFTIR数据的主成分分析。PC1, PC2和PC3的分数负荷在波长范围上绘制,以显示主要的方差
抑制hsr8-1经过PFT1-2不依赖于凤凰,PHYB.或jasmonate通路
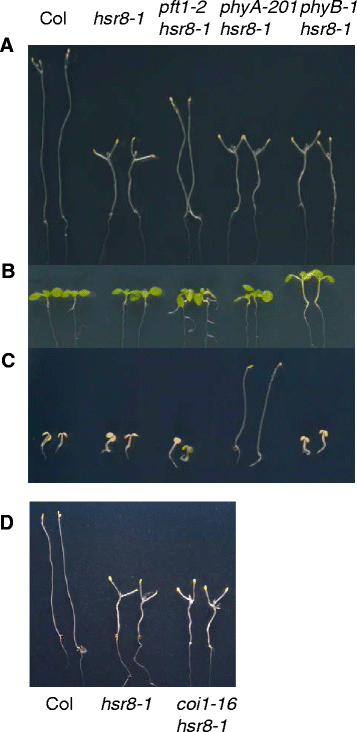
MED25/PFT1首次被鉴定为响应亚最佳光照条件的开花正调控因子PFT1.突变体在远红光下表现出稍长的下胚轴,在长日照下表现出开花晚的表型[16].在我们的筛选中发现了具有较长的下胚轴的突变体,并且由于phyA与糖反应有关[20.,我们评估光敏色素信号通路在抑癌中的作用hsr8-1糖过敏。无论是Phya-201.[21)和phyB-1[22突变抑制hsr8-1黑暗发育表型(图。4A).幼苗也在恒定的白光下生长(图。4B.)和恒远红光(图。4C)来确认巴- 201 hsr8 - 1和PHYB-1HSR8-1双突变体显示特征凤凰和PHYB.表型,与pft1-2hsr8-1双突变体。
PFT1独立的行为凤凰和PHYB.和斋月响应途径在抑制中hsr8-1下胚轴伸长表型。一个山坳糖过敏暗发展,hsr8-1,HSR8-1PFT1-2,巴- 201 hsr8 - 1,PHYB-1HSR8-1突变体。幼苗在含1%葡萄糖的MS培养基上在黑暗中垂直生长14天。bCol的下丘脑表型,hsr8-1,HSR8-1PFT1-2,巴- 201 hsr8 - 1,PHYB-1HSR8-1在白光下生长的突变体。幼苗在白光恒定的MS无糖培养基上生长7天。c远红光下胚轴表型hsr8-1,HSR8-1PFT1-2,巴- 201 hsr8 - 1,PHYB-1HSR8-1突变体。在恒定的远红光下在MS无糖培养基上生长幼苗。d糖敏感下胚轴伸长hsr8-1,coi1-16hsr8-1突变体。树苗生长在(一个)
PFT1是茉莉酸(JA)信号通路的调节因子[23].由于细胞壁缺陷可以通过斋月信号传导途径触发防御响应[24,25,我们测试了依赖于ja的防御反应是否被激活hsr8-1而如果PFT1-2抑制hsr8-1通过JA信号通路的糖过敏症。的表达VSP1,VSP2和ERF1,这是由JA强调的,未调控hsr8-1与深色幼苗的Col相比(附加文件1:图S2)。这说明JA通路未被诱导hsr8-1对其细胞壁缺陷的反应。与JA不敏感突变体杂交coi1-16[26)确认;的coi1-16hsr8-1双突变体具有相同的短下胚轴表型hsr8-1(无花果。4D.).因此抑制hsr8-1短下胚轴表型PFT1-2是独立于JA和光敏色素信号通路的。
微阵列分析PFT1-2-相关基因表达
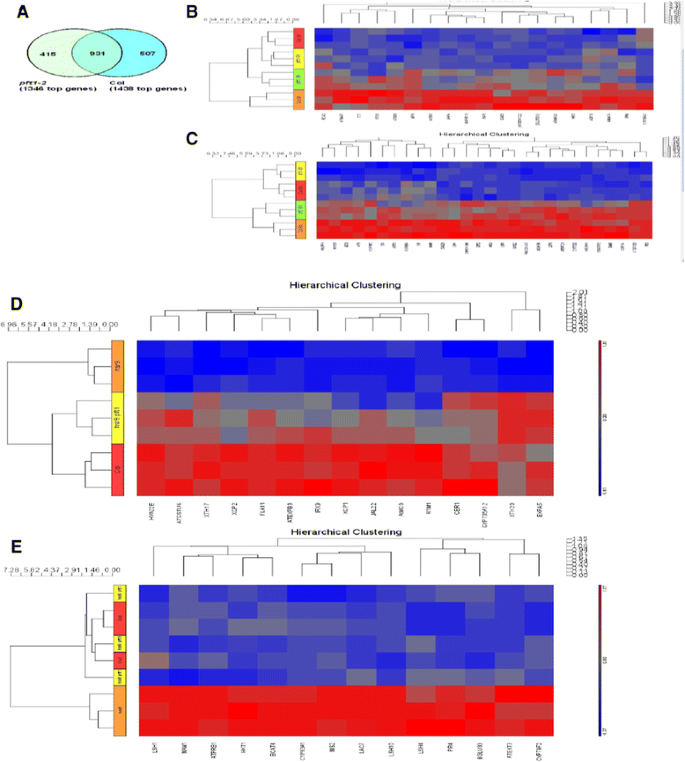
PFT1编码中介复合物的亚单位25,在真核生物中转录的保守调节因子[17,27].因此我们评估了PFT1调控光生长幼苗对葡萄糖反应的基因表达,以及它如何在暗发育过程中控制基因表达hsr8-1遗传背景。葡萄糖反应基因表达,三个独立的重复PFT1-23 %葡萄糖或0 %葡萄糖处理6 h后,收集7日龄轻生野生苗。双向方差分析(附加文件)2)显示,在3%葡萄糖反应中,有1438个基因在Col中差异表达,1346个基因在Col中差异表达PFT1-2(无花果。5A),其中931个基因在两种基因型对葡萄糖的反应中有差异表达。共有92个基因在-2和+2之间发生倍性变化,其中47个基因在葡萄糖诱导下>2倍,其中19个基因未表现出明显的葡萄糖依赖性PFT1-2其中28例的葡萄糖依赖诱导明显降低PFT1-2(无花果。5B.和c).五类基因的表达或完全或部分依赖PFT1对葡萄糖反应的表达增加。6个基因的表达参与调控,生物合成和运输所需的花青素PFT1包括中央监管机构在内MYB75 / PAP1[28].编码硝酸盐、磷酸盐和硫酸盐摄取转运体和磷酸盐摄取调节剂的五个基因SPX3,还需要PFT1对葡萄糖反应的表达增加[29,30.].七个基因编码酶(主要是细胞色素p540)在硫代葡萄糖苷的生物合成需要PFT1对葡萄糖的反应。参与调控硫代葡萄糖苷(GSL)生物合成的4个MYB转录因子基因[31,32],MYB28 / HAG1要求PFT1增加表达式。13个基因编码各种各样的应激反应所需的基因PFT1对葡萄糖的反应。其中包括两个天哪(冷监管)相关的基因,NCED3参与ABA的生物合成AFP1基因编码一种ABI5结合蛋白,即热激转录因子HSFA2,一个PIRIN参与ABA信号的基因,bZIP44参与调节脯氨酸脱氢酶ECA2编码ER Ca2+参与应激反应的转运体。最后,需要几个编码细胞膨胀蛋白的基因PFT1包括参与膜修饰的两个脂质转移蛋白(LTPs)和参与细胞壁延伸的Expansin 4 [33,34].
确认并扩展这些微阵列分析,我们测量了影响PFT1关于微阵列实验中鉴定的一小组富特征葡萄糖响应基因的表达[35].Q-RTPCR分析结果显示葡萄糖诱导基因APL3,BAM,GBSS1.,GPT2和PDC1所有已经减少在表达PFT1-2(附加文件1:图S3A-S3E),并证实微阵列数据显示降低的表达APL3和BAM.在花青素合成途径中编码酶的基因的表达(FLS的,CHS和TT6)也通过Q-RTPCR评估,它们都表现出降低的表达PFT1-2(附加文件1:图S3F-3H)。最后,花青素水平降低到野生型的45%PFT1-2(附加文件1图S2I),证实了PFT1在花青素合成调控因子和酶的表达中发挥的重要作用。
在山口的14天龄黑暗生长的苗基因表达,HSR8-1,HSR8-1PFT1-2和PFT1-2在三个独立的RNA样本中使用微阵列分析。双向方差分析(附加文件3.)鉴定出76个上调或下调≥2倍的基因hsr8-1与COL相比,44个基因之间不同hsr8-1和HSR8-1PFT1-2。共有29个基因受到了不同的调控hsr8-1对坳至hsr8-1vs.HSR8-1PFT1-2.这些基因根据它们的表达模式(图聚类。5 d和e).在15个基因中有显著下调的hsr8-1与Col和上调相比pft1-2hsr8-1相比hsr8-1(即,需要PFT1压制其表达hsr8-1), 10编码参与细胞壁形成、角质层形成和细胞膨胀的蛋白质。这些包括XTH17和XTH20,编码木葡聚糖内转糖苷酶/水解酶,裂解和重新排列木葡聚糖[36)),IRX9编码参与木聚糖合成的木糖基转移酶[37].EXPB5和EXP5编码细胞壁蛋白expansin B3和expansin 5,促进细胞壁膨胀,CER1编码角质形成的酶,FLA11编码一种参与细胞粘附的筋膜素型阿拉伯半乳糖蛋白,RTM编码甘露糖结合凝集素JAL22.编码一种可能参与细胞壁组分到质膜运输的er -高尔基转运体。编码木质部细胞程序性死亡肽酶的3个基因的表达XCP1,XCP2以及元胞酶编码基因MC9减少在hsr8-1和增加HSR8-1PFT1-2.同样,两个应激诱导基因的表达,HVA22和GSTU6谷胱甘肽- s -转移酶的编码hsr8-1与Col相比,增加了HSR8-1PFT1-2相比hsr8-1.
一组不同的14个基因的表达增加hsr8-1与Col相比并减少HSR8-1PFT1-2相比hsr8-1(无花果。5e.).这些基因的表达增加需要PFT1hsr8-1.依赖光的短下胚轴的三个成员(LHS1 4和10)基因家族,编码ALOG(拟南芥LSH1和水稻G1)转录因子家族保守核蛋白[38]和编码甲硫氨酸和脂族葡糖苷生物合成酶的五种基因[31]所需的PFT1增加表达hsr8-1.编码细胞壁富含羟脯氨酸的糖蛋白Extensin 3、参与木质素生物合成的漆酶和β-葡萄糖苷酶33的三个基因也需要PFT1增加在hsr8-1与上校相比HKT1.,编码一个参与从木质部提取钠的蛋白,以类似的模式表达。
为了扩展这些分析,q-RTPCR分析细胞壁成分和表达增加的酶的基因hsr8-1与Col相比[9]是在双突变体进行pft1-2hsr8-1.这些分析表明,在hsr8-1的EXT3,EXT4,编码细胞壁糖蛋白PME17和PME41.,编码果胶甲基酯酶,在HSR8-1PFT2-1(附加文件1:图S4),确认了增加的表达EXT3在微阵列数据和扩大细胞壁相关基因的范围需要PFT1在hsr8-1.
MED8对于编码细胞壁成分的选定基因的表达也是必需的,但它是葡萄糖诱导基因表达的抑制因子
中介人情结拟南芥由至少27个亚基[的17,因此,我们检测了PFT1/MED25以外的其他亚基,以确定其在糖和细胞伸长介导的基因表达中可能的作用。med8突变体表现出与PFT1-2相对于病原体的响应,开花时间和器官大小[39,40].此外,MED8的酵母同源物被证明参与糖信号[41.].测试Med8的参与,hsr8-1与功能缺失的T-DNA插入相交叉med8分析了突变体和黑暗发育幼苗中的下胚轴长度。如图1所示。6A,med8抑制了hsr8-1短的下胚轴表型同延伸PFT1-2(与Fi. 1a比较)。因此,我们测量了同一组四个人的表达PFT1-响应性细胞壁相关基因显示在附加文件1:图S4hsr8-1和med8hsr8-1在黑暗中生长的幼苗。数字图6b和c显示了其中两个的表达式,PME17和PME41.,大幅减少med8hsr8-1相比hsr8-1.光照条件下葡萄糖诱导的基因表达分析med8幼苗显示出的是,在观察到相反的效果PFT1-2突变体:med8突变体显着增强了三种基因的表达,具有良好的对葡萄糖的反应,BAM,APL3和CHS(无花果。6d e和f).这种增加在双突变体中始终较低med8pft1-2这表明MED8和PFT1对葡萄糖诱导的基因表达有相反的作用。
Med8亚基在糖响应性生长和基因表达中起着作用。一个糖高敏感暗发育,hsr8-1, med8hsr8-1和med8突变体。幼苗在含1%葡萄糖的MS培养基上在黑暗中垂直生长14天。b和c实时荧光定量PCR检测细胞壁修饰编码基因PME17和PME17的mRNA水平AtPME41在坳,hsr8-1,med8hsr8-1和med8。幼苗按(一个)以上。误差条代表三个生物重复的标准差。**,p< 0.01比较Col tohsr8-1,Med8 HSR8-1到med8(学生的t-测试)。相对于内参基因的转录水平计算相对转录水平(RTL)TUB6(At5g12250)。d到f实时荧光定量PCR分析BAM,APL3,和CHSCol的mRNA水平,med8, pft1-2和双突变体med8pft1-2对葡萄糖的反应。在含0.5%葡萄糖的MS培养基上恒光培养。7天后,将幼苗转移到无葡萄糖液体MS培养基中24小时,然后用3%葡萄糖处理6小时。误差条代表三个生物重复的标准差。**,p< 0.01比较Col tomed8和PFT1-2到med8 pft1-2(D);**,p< 0.01比较PFT1-2到med8 pft1-2(E);**,p< 0.01比较Col tomed8和PFT1-2到med8 pft1-2(F)(学生t-测试)。通过内参基因的转录水平计算相对转录水平(RTL)TUB6(At5g12250)
讨论
一种抑制暗生长的短下胚轴表型的突变体的遗传筛选hsr8-1幼苗确定了八个全音阶突变体。一个突变体,soh715hsr8-1,在黑暗中生长时具有中间胚轴长度(图。1和b),并通过基因表达和花青素积累来评估对葡萄糖的超敏反应(图。1 c和d).中可见的细长的子叶叶柄hsr8-1[9也在一定程度上受到了压制soh715基因座(图。1和2B.)但是研究的主要表型是下胚轴伸长的差异,其被显示为由于细胞伸长增加(图。3A).soh715被确认为PFT1(无花果。2B.)[16],编码介体转录复合物的亚基[27并被双突变体证实HSR8-1PFT1-2(无花果。2C),并在随后的分析中使用。PFT1.突变体对光敏色素介导的信号表现出更长的下胚轴[16,42.],增加PhyA下游的信号通路,并与PhyA基因相互作用HY5[43.].数字4可见,深发展表型hsr8-1不依赖于phyA或PhyB,而hsr8-1没有显着影响白色和遥远的光线反应。此外,黑暗发育表型hsr8-1不依赖于茉莉酸盐的反应[23].我们的结论是,pft1介导的下胚轴伸长减少的抑制hsr8-1是不依赖于PFT1充当phytochrome-和JA-介导的应答的一部分,这表明PFT1功能通过一个独立的机构(一个或多个),以减少阿拉伯糖缺陷型突变体的暗发育过程中的下胚轴细胞伸长。
中介复合物是一种功能保守的基因表达调节因子,由大约30个亚基组成,形成一个复合物,与核心启动子组件(如RNA聚合酶II)结合的转录因子结合[17,27,44.].中介在染色质中也有结构作用,通过形成与内聚物的复合物,该复合物与启动子的染色质环相关联[45.].PFT1 / Med25形成与转录因子相互作用的复合物的尾部区域的一部分,而Med8是与核心启动子组分相互作用的头部区域的一部分[27].在后生动物,许多不同的转录调控网络的融合上中保[27,越来越多的证据表明,不同的转录因子与尾部区域的不同亚基相互作用。在植物中,PFT1 / MED25和MED8表达JA响应性和真菌抗性基因的表达需要[23,46.]对器官大小对拮抗作用[40,47.].PFT1 / MED25也是抗旱基因表达所必需的[42.],也直接参与光反应和促进开花[16,43.,48.].中介亚基MED5a/5b抑制一组苯丙素和木质素生物合成基因的表达[12,13,提示MED5a/5b可能在缓解苯丙酸突变体引起的生长抑制中起直接作用ref8-1通过细胞壁传感途径。
聚类分析用于识别暗生幼苗中有差异调节的两组基因hsr8-1与Col和in相比PFT1HSR8-1相比HR8-1.这些组合包含了所需的基因PFT1增加或减少的表达hsr8-1黑暗的幼苗生长。在15个基因中hsr8-1与Col相比,表达增加HSR8-1PFT1-2相比hsr8-1,参与细胞壁形成的十种编码蛋白质(图。6A).他们的表达谱表明,这些基因的表达在阿拉伯糖缺乏细胞壁由PFT1,在那里它们可能会限制细胞壁的膨胀和/或补偿改变的细胞壁组成积极减少。在这些是基因木葡聚糖链修饰(XTH17和XTH20)36,49.],和XTH17其具有木葡聚糖endotransferase-水解酶活性[50.]涉及墙的加强和扩大,以回应阴影的暗示[51.,52.].编码扩展蛋白5和B3的基因的表达也通过PFT1在压抑hsr8-1.这些细胞壁蛋白可能通过放松木葡聚糖-纤维素相互作用来促进细胞壁延伸[53.].
14个编码调控蛋白、生物合成酶和细胞壁蛋白Extensin 3的基因表达显著升高hsr8-1与Col相比,减少表达HSR8-1PFT1-2相比hsr8-1(无花果。5D).转录调控因子ALOG家族成员LSH1、4、10 3个基因的表达也同步增加hsr8-1在一个PFT1依赖模式。过表达LHS1导致低胚轴细胞伸长率[38,提示pft1介导的LSH.家族成员可以直接减少下胚轴细胞的伸长hsr8-1.增加的表情伸展蛋白3和伸展蛋白4在hsr8-1(附加文件1图S3)依赖于PFT1,提示细胞内细胞壁缺陷hsr8-1突变体可能被延伸蛋白增强,而表达减少伸展蛋白3和伸展蛋白4在HSR8-1PFT1-2可能有助于增加与细胞伸长率相关的细胞壁可伸展性。
在细胞壁正常的Col植物中,PFT1在高糖水平下,参与细胞壁延伸和细胞延伸的7个编码蛋白的基因表达增加:棒曲霉素4通过破坏纤维素和木糖葡聚糖纤维素之间的氢键来编码蛋白质松动墙壁的蛋白质[34),LTP3和LTP4编码蛋白质涉及细胞膜沉积和细胞壁松动[33].PIF4和PIF5激活LTP3和棒曲霉素B1基因表达和促进细胞伸长率[54.[Phyb在光线中负面调节这一点。这与PFT1在PHYB响应中的已知作用一致[16,43.提示PIF4和PIF5可能与PFT1协同作用,通过激活光和葡萄糖信号促进细胞伸长LTP.和棒曲霉素基因的表达。
葡萄糖水平强烈影响植物生长,葡萄糖介导的转录反应的一个关键特征是参与营养获取和次生产物合成的基因编码酶和转运体的快速协调表达,以及参与ABA反应的基因的共表达[35,55.].微阵列分析鉴定了葡萄糖诱导表达完全或部分依赖的不同种类的基因PFT1 / MED25.这些基因编码细胞壁和细胞扩张相关蛋白、花青素、类黄酮和硫代葡萄糖苷生物合成的调节蛋白和酶、营养吸收的调节蛋白和转运蛋白、ABA信号转导和生物合成蛋白,以及各种应激反应蛋白(图1)。5B.和c).硫代葡萄糖苷生物合成中编码酶和调节蛋白的七个基因[32] 必需的PFT1对葡萄糖反应的表达增加。在里面hsr8-1突变体PFT1硫代葡萄糖苷合成的5个基因编码酶的表达也需要MAM1通常由葡萄糖调节。硫代葡萄糖苷生产的作用hsr8-1目前尚不清楚,但pft1介导的hsr8-1JA上的表型表示可能不涉及压力响应[23].值得注意的是,葡萄糖诱导的表达MYB75,编码一个关键的花青素途径调节因子[28是完全依赖的PFT1.最近,研究表明MED5a和5b可抑制苯丙素途径基因的表达[12,13],在整合生物合成能力以应对增加的碳供应方面确立中介体的中心作用。最后,PFT1-编码硝酸盐、磷酸盐和硫酸盐转运体的基因依赖表达[56.和磷酸盐摄取调节剂SPX3,进一步展示了PFT1 / Med25在平衡营养物供应和碳可用性方面的重要协调作用。
PFT1功能的降低并不能重建野生型细胞壁阿拉伯糖含量hsr8-1,如细胞壁单糖分析所示(图。3B.),可能是因为hsr8-1功能缺失是等位基因的吗MUR4,它编码拟南芥中唯一已知的udp -阿拉伯糖合成酶[14].只有细胞壁阿拉伯糖和聚焦的大量减少导致下胚轴在黑暗中伸长减少[9它被低浓度的硼酸盐拯救了。硼酸交联鼠李乳囊藻酸盐II和被认为加强细胞壁,表明细胞壁组成和结构的变化导致延长减少hsr8-1[9].利用傅立叶红外光谱对暗发育的下胚轴细胞壁材料进行了细胞壁多糖分析,发现其吸收光谱有复杂的定量变化hsr8-1与野生型Col和in相比HSR8-1PFT1-2相比PFT1-2和Col(图3C和d).虽然基因型之间存在显着差异,但这些差异的主要成分在广泛的波长范围内显示出变化,这些波长被排除鉴定具有改变水平的特异性多糖。
结论
我们的分析表明了中心作用在参与细胞伸长,多个生物合成途径,应激反应,和营养获取响应于改变的碳可用性转录反应拟南芥中保复杂的MED25和MED8亚基。
方法
植物材料和生长条件
所有实验均在哥伦比亚遗传背景进行。的HSR8-1,HSR3和HSR4如前所述分离突变体(Li等人。[9];Baier等人。[57.])。抑制器突变体是从一个孤立的hsr8-1快节中子化群体(种子被匈牙利的Kfki-原子能研究所30-40灰色照射)。含有T-DNA插入的植物PFT1(SALK_129555),称为PFT1-2,MED8(SALK_592406),称为med8,从欧洲拟南芥砧木中心(NASC,诺丁汉大学,英国)获得。种子表面消毒后,播种在含有0.9%琼脂和不同浓度葡萄糖的Murashige和Skoog (MS)培养基上。种子在4°C分层3 d,在22°C连续光照下生长。在暗培养试验中,种子在含1%葡萄糖的MS培养基上生长,光照8 h,然后在完全黑暗中垂直生长2周。葡萄糖处理实验:在含0.5%葡萄糖的MS培养基上培养7天,然后转入不含葡萄糖的MS液体培养基。24 h后,将培养基改为含3%葡萄糖的MS培养基,6 h后采集幼苗。为了测定花青素含量,幼苗在含1%或3%葡萄糖的MS固体培养基上生长7天。
基因的筛选和克隆soh715突变
单独筛选3200 M2诱变品系,以增加下胚轴长度hsr8-1在1%葡萄糖的黑暗环境下生长。将潜在的抑制突变体转移到土壤中,重新筛选M3后代。的soh715通过杂交到Landsberg来绘制突变图谱erecta.对F2种子进行长下胚轴筛选,并对纯合子进行基因分型hsr8-1使用LightCycler®480系统和Hybprobes®技术进行突变(罗氏应用科学和TIB MOLBIOL GmbH)。这些植物被认为是纯合的soh715并用于突变的初始映射。一旦确定了突变的大致位置,总RNAhsr8-1和soh715hsr8-1使用RNeasy植物迷你试剂盒(QIAGEN)提取,并用于Affymetrix GeneChip阵列表达分析,以鉴定缺失的基因组区域(Affymetrix,Santa Clara,CA,USA)。我们鉴定了六个连续的下调基因集群soh715hsr8-1- 1号染色体上可能由于缺失而映射的区域。的soh715hsr8-1用含有六种基因序列的基因组片段转化突变体,缺失中的六种基因。额外的文件4表S3描述了TOPO®XL PCR克隆试剂盒(Invitrogen公司)用于克隆基因组片段的引物。将克隆的基因亚克隆到pCAMBIA1300二元载体中的ApaⅠ限制场所和用途农杆菌属介导的转化。转基因T1植物在30μg/ ml潮霉素上筛选,并互补soh715hsr8-1长下胚轴表型在T2代被评估。
下胚轴和花青素的测定
下胚轴长度从14日龄的暗生幼苗(n= 30)通过扫描板和使用ImageJ软件(http://rsb.info.nih.gov/ij/).提取并定量花青素,如[57.].
细胞壁的分析
通过在96%乙醇中沸腾10分钟,均质化,反复甲醇:氯仿(2:3V / v)萃取,在室温下干燥前,在96%乙醇中脱水,在室温下在96%乙醇中萃取,在室温下脱水。干燥50μg的等分试样,用2M TFA(三氟乙酸)处理在120℃下1小时,然后再次干燥。然后将样品重悬于5%(v / v)乙腈中并注射到M扫描高性能阴离子交换色谱系统中,具有脉冲凹法检测(HPAEC-PAD)。使用作为摩尔%表示的标准和值检测单糖。傅里叶变换红外吸光度光谱从800到4000厘米收集−1使用BioRad FTS 175C分光光度计。将胚轴材料研磨并夹在金刚石元件上。获得了三种生物重复的两种光谱。使用Genstat版本15进行原理分析分析。
基因表达
用RNEasy植物迷你试剂盒(QIAGEN)提取总RNA并进行DNA酶。2μg用于锚定寡聚(DT)23的逆转录(MMLV-RT,Invitrogen)。使用LightCycler®480Sybr Green I Master 2x(Roche应用科学)和在附加文件中列出的基因特异性引物进行定量实时PCR4:表S3。引物特异性和效率通过标准和熔化曲线分析得到证实。相对于内参基因的转录水平计算相对转录水平(RTL)TUB6(AT5G12250)如下:RTL = 1000 * 2- (Cptarget-CpTUB6).将3个总RNA生物复制样本杂交到Affymetrix genchip拟南芥ATH1基因组阵列(Affymetrix, Santa Clara, CA, USA)进行全基因组转录组分析。所有步骤都是在诺丁汉拟南芥种群中心进行的。使用Partek Genomics Suite 6.6软件(Partek Incorporated, St Louis, USA)分析基因表达数据。对原始CEL文件进行归一化,使用分位数归一化的RMA背景校正、log base 2转换和校正GC内容的平均探针集汇总。差异表达基因(DEG)通过双向方差分析确定P-值使用FDR(错误发现率)方法进行调整,以纠正多次比较。DEG被认为是显著的P- 折叠变化(FC)≤0.05,≥2的FDR <0.05的折叠变化≤0.05。使用Partek中的默认设置执行分层群集。两个不同簇中的所有对象之间的平均距离被用作两个簇之间的距离的度量,并使用使用算术平均值的未加权对组方法测量。然后将簇合并(凝聚),直到所有数据(基因)都在一个簇中。
支持数据的可用性
微阵列数据可在ArrayExpress数据库(www.ebi.ac.uk arrayexpress)在加入号码E-MTAB-2297下。
缩写
- Anova:
-
方差分析
- 一个日志:
-
拟南芥LSH1和水稻G1
- BAM:
-
β淀粉酶
- 天哪:
-
冷调节基因
- 红外光谱:
-
傅里叶变换红外光谱学
- GSL:
-
芥子油苷
- 是:
-
茉莉酸
- LTP:
-
脂质转运蛋白
- ᅟ:
-
Med25 / pft1介质25/光敏色素与开花时间1
- 主成分分析:
-
主成分分析
- PRL1:
-
多效调节基因座1
- WAK:
-
细胞Wall-Associated激酶
参考文献
- 1.
等。研究植物细胞壁的系统方法。科学。2004;306:2206-11。
- 2.
Reiter wd。植物细胞壁的生物合成和性质。植物学报2002;5:536-42。
- 3.
盖斯勒DA,Sampathkumar A,Mutwil男,佩尔森S.布设砖:细胞壁生物合成的后勤方面。CurrOp植物BIOL。2008; 11:647-52。
- 4.
纤维素合成的细胞生物学研究。植物学报。2014;65:69-94。
- 5。
植物的糖敏感和信号转导:保守的和新颖的机制。植物学报2006;57:675-709。
- 6。
Sairanen I, Novak O, Pencik A, Ikeda Y, Jones B, Sandberg G, et al.;可溶性碳水化合物通过PIF蛋白调节拟南芥生长素的生物合成。植物细胞。2013;24:4907-16。
- 7。
Kohorn Bd,Kobayashi M,Johansen S,Riese J,Huang L-F,Koch K,等。转化酶活性和细胞生长所需的拟南芥细胞壁相关激酶。工厂J. 2006; 46:307-16。
- 8。
王志强,王志强,王志强,等。植物细胞壁胁迫对植物生长的影响[J]。植物j . 2009; 57:1015-26。
- 9。
李永强,李志强,李志强,等。拟南芥细胞壁向细胞核的信号转导介导糖响应性生长和发育。植物细胞。2007;19:2500-15。
- 10.
剪接体激活复合物:一种多效性调节因子的分子机制。植物学报2012;3:9。
- 11.
王志强,王志强,王志强,等。植物生长调控和细胞壁信号转导的研究进展。植物学报2012;63:381-407。
- 12.
Bonawitz ND, Kim JI, tomatsu Y, Ciesielski PN, Anderson NA, Ximenes E, et al.;介质的破坏挽救了木质素缺乏的拟南芥突变体的发育不良。大自然。2014;509:1-17。
- 13.
Bonawitz ND, Soltau WL, Blatchley MR, Powers BL, Hurlock AK, Seals LA等。在拟南芥中,转录共调节复合物中介的亚基REF4和RFR1对苯丙氨酸稳态是必需的。J Biol Chem. 2012; 287:5434-45。
- 14。
Burget如。植物中l -阿拉伯糖的生物合成:拟南芥MUR4基因编码的高尔基定位的UDP-D-Xylose 4-Epimerase的克隆与表征植物细胞。2003;15:523-31。
- 15.
Mitra RM, Gleason CA, Edwards A, Hadfield J, Downie JA, Oldroyd GED,等。共生结节发育所需的Ca2+/钙调素依赖性蛋白激酶:转录克隆的基因鉴定中国科学院院刊2004;101:4701-5。
- 16。
植物光质对开花时间的调控。大自然。2003;423:881-5。
- 17。
Bäckström S, Elfving N, Nilsson R, Wingsle G, Björklund S从拟南芥(Arabidopsis thaliana)中纯化的植物介质鉴定PFT1为Med25亚基。摩尔细胞。2007;26:717-29。
- 18。
Jiang K, Sorefan K, Deeks MJ, Bevan MW, Hussey PJ, Hetherington AM。ARP2/3复合物介导了拟南芥细胞的肌动蛋白重组和气孔运动。植物细胞。2012;24:2031-40。
- 19。
Largo-Gosens A,Hernandez-Altamirano M,Garcia-Calvo L,Alonso-Simon A,Alvarez J,Acebes JL。傅立叶变换中红外光谱应用,用于监测植物细胞壁的结构可塑性。前植物SCI。2014; 5:303。
- 20.
Dijkwel PP,Huijser C,Weisbeek PJ,蔡氏NH,Smeekens SC。在拟南芥光敏色素信令的蔗糖控制。植物细胞。1997; 9:583-95。
- 21.
Nagatani A,Reed JW,Chory J.植物植物理遗中缺乏拟南芥突变体的隔离和初始缩小。1993年; 102:269-77。
- 22.
Koornneef M,Rolff E,Spruit CJP。拟南芥(L.)Heynh中的光抑制下胚轴伸长的遗传控制。z pflanzenphysiol。1980; 100:147-60。
- 23.
Kidd BN, Edgar CI, Kumar KK, Aitken EA, Schenk PM, Manners JM,等。介导复合物亚基PFT1是拟南芥茉莉酸依赖防御的关键调控因子。植物细胞。2009;21:2237-52。
- 24.
埃利斯C,特纳JG。拟南芥突变体cev1组成型茉鲸酸盐和乙烯信号途径,增强了对病原体的抗性。植物细胞。2001; 13:1025-33。
- 25.
关键词:拟南芥,纤维素合成,木质素化,防御反应植物j . 2003; 34:351 - 62。
- 26.
王志强,王志强,王志强,等。COI1连接茉莉酸信号和育性到拟南芥的SCF泛素连接酶复合物。植物j . 2002; 32:457 - 66。
- 27.
Malik S, Roeder RG。后生动物中介物共激活复合物作为转录调控的综合枢纽。Nat Rev Genet, 2010; 11:761-72。
- 28.
关键词:拟南芥,MYB75/PAP1基因,蔗糖特异性诱导,花青素合成植物杂志。2005;139:1840-52。
- 29.
Lejay L,Tillard P,Lepetit M,Olive FD,Filleur S,Daniel-Vedele F等人。拟南芥植物的N-和C状态分子和功能调节两种NO3吸收系统。工厂J. 1999; 18:509-19。
- 30.
调节硫酸盐同化的分子机制:漫长道路上的第一步。植物科学学报2014;5:589。
- 31.
郭锐,沈伟,钱洪,张敏,刘丽,王强。茉莉酸和葡萄糖协同调控拟南芥硫代葡萄糖苷的积累。J Exp Bot. 2013; 64:5707-19。
- 32.
giolashvili T, Yatusevich R, Berger B, Müller C, Flügge U-IR2R3-MYB转录因子HAG1/MYB28是拟南芥中蛋氨酸衍生硫代葡萄糖苷生物合成的调控因子。植物j . 2007; 51:247 - 61。
- 33.
等。脂质转移蛋白增强烟草细胞壁的延伸。植物细胞。2005;17:2009-19。
- 34.
张志强,张志强,张志强,等。叶片发育过程中多个扩展蛋白基因的诱导抑制作用。植物杂志。2012;159:1759 - 70。
- 35.
李Y。通过使用相关矢量机通过微阵列分析和启动子分类建立葡萄糖和ABA调节的转录网络。Genome Res。2006; 16:414-27。
- 36.
XTH基因家族:木葡聚糖重建中酶结构、功能和系统发育的最新进展。植物杂志。2010;153:456 - 66。
- 37.
吴安明,李志强,李志强,等。拟南芥IRX9/IRX9- l和IRX14/IRX14- l糖基转移酶基因对的分析揭示了半纤维素葡醛酸聚糖生物合成的关键贡献。植物杂志。2010;153:542-54。
- 38。
Zhao L ., Nakazawa M ., Takase T ., Manabe K.过表达LSH1,一个未鉴定基因家族的成员,导致幼苗发育的光调节增强。植物j . 2004; 37:694 - 706。
- 39。
Kidd BN, Cahill DM, Manners JM, Schenk PM, Kazan k K.调解者复合物在植物中的不同作用。Semin Cell Dev Biol. 2011; 22:741-8。
- 40.
徐锐,李亚梅。拟南芥中介复合物亚基8对器官大小的调控。植物信号行为。2012;7:182-3。
- 41.
me8p介导因子与己糖激酶2相互作用:在酿酒酵母葡萄糖信号通路中的意义。中华医学杂志。2002;319:703-14。
- 42.
引用本文:王志强,王志强,王志强,等。拟南芥Med25介导亚基整合环境线索控制植物发育。美国国家科学研究院2011;108:8245-50。
- 43.
PFT1介导复合物亚基干扰COP1和HY5在拟南芥光信号调控中的作用。植物杂志。2012;160:289 - 307。
- 44.
Conaway RC, Conaway JW。中介复合物的功能和调节。Curr Opin Genet Dev. 2011; 21:225-30。
- 45.
Kagey Mh,Newman Jj,Bilodeau S,Zhan Y,Orlando Da,Van Berkum Nl,等。介质和休尼蛋白连接基因表达和染色质建筑。自然。2010; 467:430-5。
- 46.
欧布,尹k-q,liu s-n,杨y,gu t,wing hui Jm,等。拟南芥转录因子的高通量筛选系统及其在Med25依赖性转录调节中的应用。莫尔植物。2011; 4:546-55。
- 47.
徐河,李玉。汉语拟南芥中介质复杂亚基25的最终器官规模控制。发展。2011; 138:4545-54。
- 48.
Iñigo S, Alvarez MJ, Strasser B, Califano A, Cerdán PD。PFT1是植物中介复合物的MED25亚基,在拟南芥中通过CONSTANS依赖和独立的机制促进开花。植物j . 2012; 69:601-12。
- 49.
Kaewthai N, Gendre D, Eklof JM, Ibatullin FM, Ezcurra I, Bhalerao RP, et al.;拟南芥III-A组XTH基因编码正常生长所必需的主要木葡聚糖内水解酶。植物杂志。2012;161:440-54。
- 50.
朱晓峰,万JX,孙勇,施YZ,Braam在Ĵ,李GX等。用木聚糖Endotransglucosylase-Hydrolase31赋予木葡聚糖Endotransglucosylase行动木聚糖Endotransglucosylase-Hydrolase17相互作用和影响铝敏感性拟南芥。植物理性。2014; 165:1566年至1574年。
- 51.
Miedes E,Suslov D,Vandenbussche F,Kenobi K,Ivakov A,Van der Straeten D等。Xyloglucan内甘油糖苷基酶/水解酶(xth)过表达影响了拟核拟南芥缺杆基的生长和细胞壁力学。J Exp Bot。2013; 64:2481-97。
- 52.
Sasidharan R,Chinnappa CC,斯塔尔男,Elzenga JTM,横山R,西谷K,等人。避荫期间光质介导的叶柄伸长率在拟南芥由木葡聚糖Endotransglucosylase /水解酶涉及到细胞壁改性。植物理性。2010; 154:978-90。
- 53.
Cosgrove DJ。膨胀蛋白松开植物细胞壁。自然。2000; 407:321-6。
- 54.
De Lucas M,DavièreJ-M,Rodríguez-falcónm,佩蒂林M,Iglesias-Pedraz Jm,Lorrain S等人。浅色和胃纤维蛋白控制细胞伸长的分子框架。自然。2008; 451:480-4。
- 55.
Baena-González E,辛J.汇聚能量和压力信号。植物科学进展。2008;13:474-82。
- 56.
Koprivova A,Calderwood A,Lee B-R,Kopriva S. Do PFT1和HY5在拟南芥中的光线调节硫酸盐同化吗?费用。2014; 588:1116-21。
- 57.
等。拟南芥中显示增加糖特异性基因表达、生长和发育反应的突变体的特征。植物杂志。2004;134:81 - 91。
确认
这项工作得到了玛丽·居里硕士奖学金的支持。(PIEF-GA-2009-236779)和BBSRC授予M.W.B. BB/F007582/1和BB/J004588/1 (GRO)。莱斯特大学的克里·富兰克林博士帮助植物在不同的光照条件下生长,英属哥伦比亚大学的哈里·布鲁默博士提供了拟南芥的种子xth31xth32.双突变体。
作者信息
从属关系
相应的作者
额外的信息
利益争夺
两位作者宣称他们没有相互竞争的利益。
作者的贡献
MS-A和MWB设计实验,MS-A、CS、HF和NM进行实验,MC-U和SM进行微阵列实验并分析数据,MWB和MS-A撰写手稿。所有作者阅读并批准了最终的手稿。
附加文件
附加文件1:图S1。
从细胞壁组合物的FTIR测量中鉴定的原理组分1,2和3的散点图。图S2。茉莉酸的反应基因没有上调hsr8.实时荧光定量PCR分析VSP1, VSP2和ERF1Col和hsr8。幼苗在含有1%葡萄糖的MS培养基上在黑暗中垂直生长14天。误差条代表三个生物重复的标准差。**,p< 0.01比较Col tohsr8-1(学生的t-测试)。图S3。糖调节基因在单突变体中的表达PFT1-2.(a)至(e)葡萄糖响应基因mRNA水平的定量实时PCR分析APL3,Bam, gbss1, gpt2, pdc1在山口和PFT1-2响应葡萄糖.在含0.5%葡萄糖的MS培养基上恒光培养。7 d后,移栽至无糖MS液体培养基(固体棒)中24 h,然后用3%葡萄糖(虚线棒)处理6 h。误差条代表三个生物重复的标准差。所示数据代表了三个独立的实验。**,p< 0.01比较血糖反应PFT1-2(学生的t-测试)。(G)和(H)花青素生物合成基因mRNA水平的实时定量PCR分析CHS, TT6和FLS在山口和PFT1-2响应葡萄糖.在含0.5%葡萄糖的MS培养基上恒光培养。7 d后,移栽至无糖MS液体培养基(固体棒)中24 h,然后用3%葡萄糖(虚线棒)处理6 h。误差条代表三个生物重复的标准差。所示数据代表了三个独立的实验。**,p< 0.01比较血糖反应PFT1-2(学生的t-测试)。相对于内参基因的转录水平计算相对转录水平(RTL)TUB6(At5g12250)。(I)在coland和PFT1-2对葡萄糖的反应。幼苗在含1%葡萄糖(固体棒)或3%葡萄糖(虚线棒)的MS培养基上连续光照生长7天。误差条代表三个生物重复的标准差。**,p< 0.01比较血糖反应PFT1-2(学生的t-测试)。所示数据代表了两个独立的实验。图S4。PFT1调节编码细胞壁相关基因的基因的表达。编码果胶甲基酯酶的基因的定量实时PCR分析PME17(一),PME41.(B)和伸展蛋白AtEXT3(C)和AtEXT4在坳(D),hsr8-1,pft1-2hsr8-1和PFT1-2.在1%葡萄糖存在下,在MS培养基上垂直垂直生长幼苗。误差条代表三个生物重复的标准差。面板A-D **,p< 0.01比较Col tohsr8-1(学生的t-测试);面板B和D **,p< 0.01比较pft1-2 hsr8-1到PFT1-2(学生的t-测试)。通过内参基因的转录水平计算相对转录水平(RTL)TUB6(At5g12250)。(PPTX 97 kb)
额外的文件2:
Col和Col和Col和Col的Anova表葡萄糖响应基因表达表PFT1-2.(XLS 1314 kb)
额外的文件3:
基因表达的方差分析表hsr8-1,HSR8-1PFT1-2和PFT1-2.(XLS 68 KB)
额外的文件4:
基因扩增和Q-RTPCR中使用的引物。多克斯(100 kb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
塞格拉-阿尔诺,史密斯,乌里韦et al。介导复合物亚基MED25/PFT1和MED8在细胞壁阿拉伯糖组成变化和葡萄糖处理的转录反应中是必需的拟南芥.BMC植物BIOL.15,215(2015)。https://doi.org/10.1186/s12870-015-0592-4
收到了:
接受:
发表:
关键字
- 差异表达基因
- 棒曲霉素
- 细胞壁成分
- 细胞壁的形成
- 介质复合体