抽象的
背景
矮牵牛是研究叶片扦插不定根(AR)形成过程的模型。切断插枝会导致茉莉酸盐的短暂增加,这被认为是生根的早期、短暂和关键事件。在这里,茉莉酸盐在矮牵牛花插枝AR形成中的作用已经通过反向遗传方法进行了研究。
结果
为了降低内源茉莉酸的水平,产生了表达茉莉酸的转基因植株矮牵牛氧化烯环化酶(PhAOC)-RNAI构造。转基因植物表现出强烈减少PhAOC转录和蛋白水平以及减少的积累CIS.与野生型和空载体表达植物相比,血管酸和Jasmonoyl-isoleudin酸钠-12-氧代植物。降低内源性茉鲸的水平导致形成较少数量的AR。然而,这种效果不伴随改变的毒素和氨基环丙烷羧酸盐(乙烯,乙烯前体)或通过受损的唾液和乙烯诱导的基因表达。茉莉酸缺乏症既不会改变细胞壁转化酶的活性也不是可溶性糖的累积。
结论
JA缺陷型切屑中的AR数减少表明,茉莉酸盐作为Petonia野生型抗体的阳性调节剂。然而,豆瓣野生型切屑尿酸盐水平的伤口引起的兴起似乎对增长的唾液和乙烯水平和水槽建立不具有因果关系。
背景
叶状物茎切割中的不定根(AR)形成是许多观赏植物种类繁殖的重要过程。植物的植物繁殖依赖于射击切割能力,以有效地产生这种根源。然而,物种之间的巨大变化在其能力中形成AR [1].AR在形成过程中的根从非根组织发展,多天线植物部分,如下胚轴,叶和茎[2].人工鱼礁的起源植物种类和器官或组织的不同而不同,他们从[发展3.].人工鱼礁总是从小区相邻血管组织开发,可以从下胚轴柱鞘细胞,韧皮部或木质部薄壁细胞,年轻的次生韧皮部的细胞,或interfascicular形成层细胞开始。在拟南芥蒂利亚纳作为研究AR形成的一个常用模型,完整幼苗的提前黄化可诱导生根。在获得糖或激素或转入光后,它们在完整的下胚轴上生根[4- - - - - -7].在该模型系统中,形成AR形成而不会破坏根芽相关影响[4].这与叶状插枝相反,叶状插枝与供体植物分离,并伴有损伤,与整个植物状况的功能完整性隔离[8].无论是黄化前的幼苗还是扦插叶,AR的形成都是一个复杂的过程,受到多种内源和外源因素的影响,包括植物激素、光照、伤害和胁迫[2].在内源因子中,植物激素是AR形成最重要的调节因子——生长素和乙烯(ET)明显发挥着核心作用,但它们之间相互作用;在复杂的网络中与其他植物激素和环境线索结合[3.].
为了佩妮矮牵牛,一种在叶状扦插上AR发育的模式植物,提出了一个涉及AR形成的代谢反应的三相机制[9]包括:(i)建立一个信宿的,(ⅱ)一个恢复阶段和(iii)维持阶段的。在第一阶段,插条引线的切除至(JA)在伤口植物激素茉莉酸快速和短暂的增加,可溶性的连续积累和不溶性碳水化合物[9].假设伴随着JA升高的伤害引发了建立促进随后的AR形成所需的水组织。在那之后,切割杆基座的伤口诱导的JA积累被认为是一种早期的瞬态和批判性的事件佩妮岩屑。值得注意的是,在拟南芥中,完整的kaasmonals jasmonals负面调节不定种植,并且他们的稳态受到植物的控制[10.].
茉莉酸酯是植物中普遍存在的信号化合物,在生物和非生物胁迫以及发育过程中积累[11.].JA及其分子活性代谢物(+)-7 iso-茉莉酰异亮氨酸(JA-Ile)是脂源化合物,由α-亚麻酸通过脂肪加氧酶(LOX)途径的七个不同分支之一合成[12.,13.].LOX和两种后的酶促步骤位于体积中,并涉及由烯丙烷合酶和联烯氧化物环酶(AOC)的作用导致中间体形成CIS.12-oxo-phytodienoic酸(OPDA)。进一步的反应发生在过氧化物酶体并形成JA,它在胞质内被酶转化为JA- ile。JA- ile被证明介导共受体蛋白CORONATINE INSENSITIVE1 (COI1)和JASMONATE ZIM DOMAIN (JAZ)的结合,从而触发JA反应[14.- - - - - -17.].
在JA途径内,AOC催化步骤被认为是关键步骤,如此,促进了在JA和JA-ILE等天然环戊酮中发生的对映体形式的专用形成[18.,19.].在培养豆植物中,AOC体组成型在茎组织中,并且持续高活动[9].此外,PhAOC属于创面诱导基因,其转录水平随JA/JA- ile内源性升高而升高[9].
利用逆转录基因技术研究JA在矮牵牛叶片切花AR形成中的作用PhAOC用于生成RNAi结构,用于稳定的植物转换以部分抑制PhAOC表达。我们的数据清楚地表明,这种抑制性显着降低了机械伤口后叶片中的测试的纳萨酸盐的积累。另外,抑制PhAOC导致AR形成延迟。为了了解JA水平减少可能影响AR形成的洞察力,转基因植物的切割碱基碱用于相对分析IAA和氨基环丙烷羧酸甲酯(EV,ET的前体)的水平,还可以进行细胞壁转化酶的转录水平(CWI)编码基因以及糖含量。
结果与讨论
在脂质衍生的化合物中,十八烷丙二醇酸酯和茉莉酸盐在植物对生物和非生物胁迫的反应中具有至关重要的作用,也具有在发育过程中的作用[20.].JA有人建议是调节AR [形成几个内源性因素之一4].对于矮牵牛切割,它们的切除特征在于JA水平的快速和瞬态增加,然后诱导编码JA生物合成基因的基因和参与水槽建立的蛋白质,例如细胞壁转化酶(CWIS)[9,21.].
生成转基因植物,减少茉满面水平
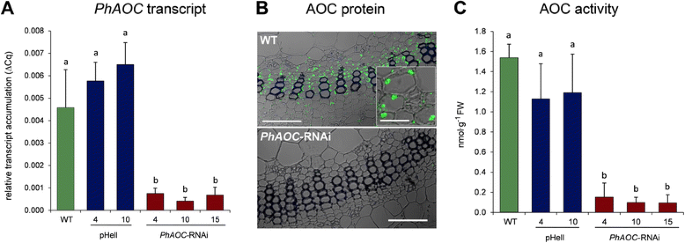
为了阐明茉莉酸盐在矮牵牛AR形成中的作用,通过转基因方法降低了内源茉莉酸盐的含量。通过rnai介导的下调编码AOC基因的表达,产生了JA生物合成受损的转基因植物。矮牵牛花的AOC是由一个单拷贝基因编码的1:图S1)。一个180磅的片段,覆盖了中间部分PhAOC-coding区域被用来生成所述PhAOC-Rnai构造,它是通过培养植物植物的A. Tumefaciens.介导转化。表达PHAOC-RNAI.受到烧花瓶马赛克病毒35s启动子的控制,从而在所有植物组织中赋予本构型表达。T1植物与野生型植物和表达空载体的植物一起生长pHellsgate(pHell)作为对照。三转基因PhAOC-RNAI线路表现出显着减少PhAOC成绩单(无花果。1A)被选中。这PhAOC-RNAI线4,10和15表现出残留PhAOC与对照相比,9-17%的转录水平。这减少了水平PhAOC-transcript引起的减少的AOC蛋白含量以检测不到的量如由免疫印迹分析(附加文件1:图S2)。如通过免疫细胞学分析可视化,在野生型茎中,AOC位于内部韧皮细胞的塑性体内以及两亲岩体赤藓杆菌的木质蛋白细胞(图。1B.,上部显微镜)。我在PhAOC-RNAi线,但蛋白含量低于检测限(图。1B.,低级显微照片)。因此,插穗PhAOC-RNAi线表现出相比于对照,以9-18%一显著减少AOC-活性(图1C).
积累PhAOC转录物,AOC蛋白和茎碱的活性佩妮矮牵牛表达PhAOCrnai。(一个)茎碱从野生型的多叶屑(WT,绿色)收集,两行表达空载体(pHell,蓝色)和三行表达PhAOC-RNAi结构(红色)在切除后1小时。相对PhAOC转录本积累表现为2−ΔCt与内参基因相关的值PhRSP13采用qRT-PCR检测。(b)使用与AOC的抗体结合的抗体结合在茎碱的横截面中检测到免疫细胞蛋白质。注意以细胞内的不同点(INSET在WT)中可见的塑体中AOC的发生。栏杆分别占100μm和25μm的概述和插图。(c)AOC酶活性作为Nmol G.−1FW的酶促形成OPDA。每个值用8个独立的生物学重复的平均值±SE表示。不同的字母表示统计上不同的值(单因素方差分析与Tukey的HSD测试,P< 0.05)
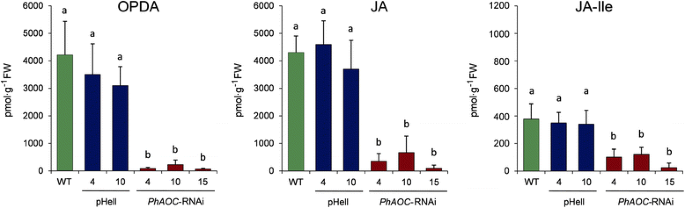
机械伤口是一种众所周知的触发,以诱导JA生物合成[20.]并且在喇叭花中也导致斋常数的瞬态崛起[9].为了检查是否下调PhAOC在转基因植物转录水平足以调节内源性茉莉水平,OPDA,JA和JA-ILE的内容叶一小时后机械损伤进行测定。OPDA,JA和JA-ILE的事实上,伤口引起的水平显著降低PhAOC-Rnai行比控制在(图。2).最重要的是,生物活性茉莉酸JA-Ile的水平下降了四倍。所有这些数据表明,成功地抑制了PhAOC转基因植物中的表达伴随着在切割切除后在茎底发生的伤口应激减少的茉莉酸盐积累。
不定根的形成在植物中具有降低茉莉水平
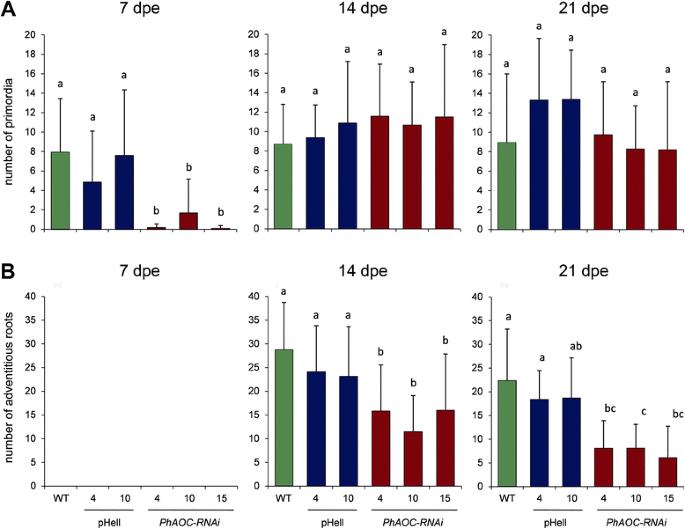
使用上文描述的转基因系中,问题被解决不定根发育是否由茉莉酮酸酯的水平降低的影响。为了这个目的,所有的植物品系的叶类钻屑无需任何外部添加剂以珍珠岩为中性底物转移。后后7,14,和21天切除(DPE)根原基的数量和出现不定根测定(图3.).7 dpe分析的所有品系的茎基部尚未出现不定根。而根原基则明显减少PhAOC-RNAI植物与野生型和空载体对照植物相比(图。3).的原基数PhAOC-RNAi株系减少70 - 90%。在随后的两个分析时间点上,这种对根原基的影响不再被检测到。在14dpe处,所有插枝都出现不定根(图。3 b).在这里,扦插PhAOC-RNAI植物的根源显着较少,而不是控制的扦插:扦插的根数PhAOC-RNAi线4和15分别降低到70%,而的钻屑的根数PhAOC-RNAi系10减少到对照的50%。减少的根的数量出现从插枝PhAOC-RNAi植物仍然可见在21 DPE,尽管在较小的程度(图3.).这些数据表明,在JA水平降低的植株中,AR的形成被推迟,导致14和21 dpe处的根数减少。
这些数据表明,JA缺乏导致AR的数量减少,但AR的形成本身并没有被消除。因此,伤诱导的茉莉酸盐可能是矮牵牛AR形成的促进剂,因此可能是正调控因子。这与JA在矮牵牛和其他根属植物AR形成中的作用是一致的体外状况。马铃薯(Solanum Tuberosum.)[22.]和豌豆(Pisum sativum.)[23.]茎插条,和烟草(尼科尼亚塔哈瓦姆)薄细胞层[24.结果表明,在外源生长素存在的情况下,JA协同促进AR的形成。然而,这些数据与拟南芥完整下胚轴中AR形成的数据形成对比,其中JA通过COI1信号通路抑制AR启动[10.].这些明显的矛盾表明,在AR形成或器官和器官和培养的特异性差异方面可能存在可能改变生长素和JA调节AR的平衡的培养和培养的特异性差异。3.].事实上,完整的幼苗、去根的老植株和插枝不仅在生根组织上,而且在生长素需求、敏感性和生根突变表型上都有显著差异[25.].这同样适用于矮牵牛花的断根幼苗,在茉莉酸盐处理后,ARs的数量减少了2:表S1)。较低浓度(0.1-1.0μm)的用OPDA,JA和JA-ILE的治疗没有改变AR号码。然而,所有化合物的较高浓度(10μm)显着降低了根系,而100μmJa甚至完全抑制Ar形成。与Jasmonate治疗相比,用助素2,4-二氯苯氧基乙酸(2,4-D)或ACC处理的被生根幼苗显着显着超过对照植物(附加文件2:表S1)。JA和2,4-D或ACC的综合应用表明,2.4-D和ACC,抑制了JA对ARS发展的抑制作用,JA没有减少2.4-D和ACC的促进效果(额外的文件2:表S2)。
茉莉酸盐水平减少对根部形成中植物素和乙烯作用的影响
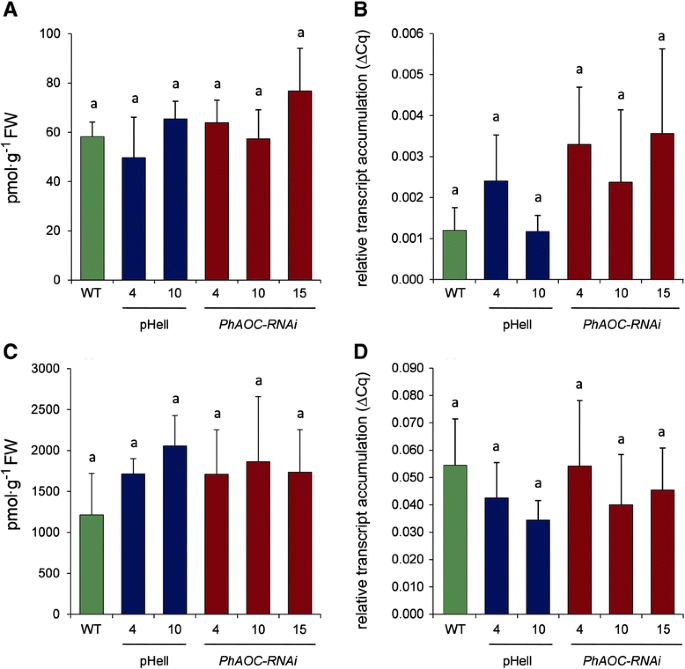
易于接受ET和毒素在通过不同阶段刺激AR形成过程中起重要作用[4].因此,在JA缺陷的切屑中测定IAA和ACC的水平,ET的前体。并行地,通过测定喇叭花的转录水平来监测毒素诱导的和诱导的基因表达GH3.同源物(PHDEVA-20-C01),Acc Oxidase1.(phaco1.), 分别。在2在野生型插条,游离IAA水平大约瞬时增加两倍和24 HPE随后的增加转录物的积累PHDEVA-20-C01(附加文件1:图S3),而ACC水平增加约24 HPE内200倍[21.].因此,游离IAA和ACC水平以及转录本的积累PHDEVA-20-C01和phaco1.分别在24和48 HPE的切屑的茎碱中测量(图。4).在IAA免费内容和PHDEVA-20-C01转录水平PhAOC-Rnai线条和控件(图。4a,b).类似的结果就获得了到ET应答基因的ACC水平和成绩单积累phaco1.(无花果。4C,d),这两者也没有显示JA缺陷型植物和野生型/转化控制之间的显着差异。
下调的影响PhAOC对吲哚乙酸(IAA)、氨基环丙烷-1-羧酸(ACC)的积累有显著影响PHDEVA-20-C01和phaco1.茎基的转录物佩妮矮牵牛岩屑。(一个)及(c),均以pmol g给予−124 HPE的FW(b) 相对的PHDEVA-20-C01转录产物积累及(d) 相对的phaco1.转录物积累,两者都显示为2-Δct.与内参基因相关的值PhRSP13在48 hpe。从野生型(WT,绿色)、表达空载体的2个株系(pHell,蓝色)和表达aPhAOC-rnai构造(红色)。每个值用8个独立的生物学重复的平均值±SE表示。不同的字母表示统计上不同的值(单因素方差分析与Tukey的HSD测试,P< 0.05)
这些结果表明,尽管发现植物蛋白,等和Ja,但虽然发现植物素,等,但在许多植物响应对不同的效应(协同或拮抗),但JA水平的水平降低并未改变扦插中的植物素和等的水平和作用。20.].养羊酸被认为是叶形切割中AR形成的电感 - 在枝条脱落之后,植物蛋白的胸腺岩极性转运有助于茎底的养羊累积[26.].自由生长素在茎基很可能上升助长了AR形成的早期事件[1,21.,27.,28.].此外,AR形成也取决于等于的动作[29.,30.],在切割过程中伤害后合成[27.].很容易推测,在AR形成过程中,JA独立于生长素和ET发挥作用,因为转基因扦插中JA水平的降低推迟了AR的形成,而不改变生长素和ET的水平和信号转导。不能完全排除激素水平和相关基因表达的改变可能发生在其他时间点,而不是分析的时间点。然而,这不是很可能的,因为在每种情况下使用的时间点表示野生型剪切中各自激素/转录水平瞬态最大值的时间点(附加文件1:图S3和[21.])。
茉莉酸盐水平减少对根部形成过程中倒析和糖水平的影响
CWI是质外韧皮部卸载运输蔗糖的关键酶,将茉莉酸的作用与初级代谢联系起来[31.].它可以建立某些组织的水槽功能,从而提供一种灵活性和适当调整到广泛的内部和外部刺激的机制[32.].检测茉莉酸水平的改变是否会影响编码CWI基因的诱导,从而影响库的建立[9],转录水平3 cl9414分别在4 hpe和6 hpe时测定CWI活性1).这两个时间点表示的野生型屑的切除后的各自的最大[9].比较切割杆基地PhAOC-Rnai具有野生类型和空的向量控制,没有差异3 cl9414转录水平和CWI活性。此外,测定葡萄糖、果糖和蔗糖的水平。在野生型扦插中,这三种化合物的水平在192hpe达到最高水平,这是在茎基中可以检测到第一个分化的根原基的时间点[9].此时发现了根原基数量的显着减少PhAOC-RNAI切割与对照相比(图。3.).在192 hpi水平下,3种基因型的茎基中葡萄糖、果糖和蔗糖含量均无显著差异(见表2)1).
这些结果表明,甘露酸盐的伤口诱导的升高可能对水槽建立不具有因果性,这是在诱导诱导矮牵牛的ar形成的必要步骤中的假设[9]和豌豆[23.].对于矮牵牛花扦插中AR形成的开始,定义了一个“库建立阶段”,这可能是由伤口诱导的JA上升控制的,进而导致基因编码的酶降解蔗糖[9].对来自不同发育阶段的植物的豌豆插枝的分析也得出了类似的相关性[23.].与少年植物的切割相比,来自旧植物的切屑表现出ja的推迟积累和损害的AR形成,这应该是由陷阱建立延迟引起的[23.].然而,通过转基因方法显示的结果与两种情况形成鲜明对比,并证明了JA生物合成减少并未导致喇叭花切割中的碳水化合物水平改变。
结论
本研究证实了aPhAOC-RNAi结构导致矮牵牛扦插中JA生物合成的严重下调,并伴有AR形成的改变。叶片扦插根原基和AR数量减少PhAOC- 与野生型和空的矢量控制相比之下的植物支持贾斯乃斯作为培养的植物叶状叶片中的AR形成正常调节剂。由于AR形成没有完全废除但相当延迟,茉莉酸盐可能是AR形成的加速器。此外,通过JA缺乏症和CWI的基因表达以及基因表达和CWI的基因表达和活性是不太可能的,并且对这些植物中的AR形成延迟是因果的。已知其他植物激素的分析参与AR形成,例如Cytokinins或Trigoloons [2,将需要解开茉莉酸如何调节AR的形成。
方法
植物材料及生根实验
佩妮矮牵牛简历。Mitchell在最近描述的情况下种植[33.].植物在生长室(温度22℃,湿度60%,每天10小时光照),用自来水浇灌培养,并用特殊Hakaphos(COMPO GmbH公司明斯特,德国)反复受精。
用于生根实验的扦插从至少三个月的储物厂切除。如前所述进行生根实验[9].在特定时间点,使用1厘米切割底座(生根区)的根原基和根,AOC蛋白质的免疫学检测的计数或在液氮中迅速冷冻并贮存直到使用在-80℃下。
药理学实验
幼苗在½MS培养基中在无菌条件下发芽生长[33.].两周幼苗的根中除去去生根小植株在22℃,长日照照明条件下转移上培养皿与½MS培养基(补充有激素所指示的)和14 d垂直培养(参见附加文件1:图S4)。同期植入于未补充的½mS培养基上生长的小植株确定激素处理的植物的根数。
一代的PHAOC-RNAI.植物
从中扩增180bp的片段PhAOC使用:的cDNA(GenBank登录号EU652410)检测到DNA-聚合酶以及附加文件中列出的寄生2:表S3,克隆到PENTR / SD / D-TOPO-载体(Gateway®Cloning, Invitrogen),并转入RNAi载体Phellsgate 8.[34.].此外,CCDB.基因Phellsgate 8.被切除以接收没有RNAi盒(Phell)的空载体对照质粒。转换后根癌土壤杆菌GV3101的叶盘P. Hybrida.简历。用重组农杆菌转化Mitchel,利用附加文件中所列引物,通过聚合酶链反应筛选再生植株(T0代)2:表S4和如先前所描述[29.,35.].两个独立的pell和三个独立的pellPhaoc-从T0植株中选择RNAi品系(T1代)进行进一步分析。从每一个转基因株系中培育出8株植物,并分别作为“母株”进行扦插,以供进一步分析。
定量RT-PCR分析
RNA分离和的转录物积累的判定PhAOC,phaco1(SGN-U207414)PHDEVA-20-C01(SGN-U212243)以及3 cl9414(PHCWI)进行qRT-PCR,如[9] 使用细胞质核糖体蛋白S13的P. Hybrida.(PhRSP13;SGN-U207968)作为内参基因。这个基因是根据[36.]并提前进行了甚至在切割杆基地中的转录水平进行测试(附加文件1:图S5)。每个反应混合物含有15ng RNA当量cDNA和1PM基因特异性引物。所有测定均在每个技术复制至少八个生物学复制上进行。通过比较CQ方法计算相对基因表达[37.].使用Primer Express软件(Applied Biosystems,Warrington,UK)设计了实时PCR引物。引物序列在附加文件中给出2:表S5。
蛋白提取,免疫印迹分析,AOC活性测定
蛋白从1克均质植物材料中提取,用50 mM磷酸钠缓冲液,pH 7,含2% PVPP和0.05% Tween 20,如前所述[38.].所得植物提取物用于两种方法,免疫印迹分析根据[38.以及测定AOC活性。后者是根据[39.],并作以下修改。蛋白提取物含有35 μg总蛋白,重组蛋白HV.AOS活性(4 nkat;[40]、磷酸钠缓冲液(50 mM;pH 7.0),最终体积为200 μl。反应由40 nmol 13(年代)-HPOT。在4℃温育10分钟后,通过酸化停止反应。ME-OPDA被添加为内标。用2ml二乙醚萃取并进行提取物的蒸发,然后用0.2M NaOH(甲醇)处理以激活反式异构化的CIS.- (+) - OPDA。在4℃下温育60分钟后,停止反应,通过中和用2N HCl。将反应混合物用2毫升二乙醚提取,蒸发,并使用进行HPLCEurospher100 C18 4毫米专栏(Macherey-Nagel,Düren,德国)和75%(v / V.)溶剂B中的溶剂A(甲醇)(H中0.2%乙酸2o)在1毫升/分钟。r.的分数T.12.0-13.4 min(opda)随后分开了独立分离CIS.- 和反式异构体通过HPLC用EC 200/4 Nucleotex的β-PM柱(Macherey-nagel)和65%(v / V.)溶剂A在溶剂B中的浓度为1 ml/min。采用内标法计算OPDA的绝对含量。酶形成百分率CIS.-opda根据[41].
免疫细胞化学
如所描述的进行在茎基AOC的免疫细胞化学检测[42].用4%固定小茎(W / V.)万甲甲醛/ 0.1%(v / V.Triton X-100磷酸盐缓冲盐水(135 mM, NaCl, 3 mM KCl, 1.5 mM KH2宝4和8mM的钠2HPO4)并嵌入在聚乙二醇1500(Merck公司,达姆施塔特,德国)。5米微米厚的横切片用于与兔多克隆抗体进行免疫标记产生针对重组LeAOC [40]稀释1:1000。在相同的稀释液中使用预防血清用作对照并显示出没有信号。作为二次抗体,根据制造商的说明使用与Alexafluor488(Life Technologies,Carlsbad,CA,USA)共轭的山羊抗兔IgG。通过使用LSM510 META(Carl Zeiss GmbH,Jena,Germany)通过共聚焦激光扫描显微镜分析部分。
初始数量的确定
为计数原基数,将每个切割基底0.5 cm固定在2% (v / V.)甲醛,0.1%(v / V.)的Triton X-100在缓冲液(50mM PIPES,5mM的硫酸镁4,5mM的EGTA,pH值6.9)在室温下搅拌两小时。固定茎段切割成使用VT1000S切片机(Leica仪器,努斯洛,德国)300个微米的部分。使用Axioplan显微镜(Carl Zeiss)进行显微镜分析。
IAA、ACC、JA、JA- ile和OPDA的测定
用10ml甲醇萃取从至少三个切屑堆积的约0.5g均匀的植物材料(长度约1cm的茎碱的茎碱)用10ml甲醇萃取。量化IAA和ACC,[13.C6iaa和(2H4] -ACC分别在提取前以适当的量加入作为内标。过滤匀浆,置于填充3ml Dea-Sephadex A25(Amersham Pharmacia Biotech Ab,乌普萨拉,瑞典)的柱上。用3ml甲醇洗涤柱,在提取物E1中蒸发后得到。随后,用3ml 0.1,1.0和1.5M甲醇洗涤柱。在E2中蒸发后,在甲醇中用4×3ml 3m乙酸的洗脱产生以下洗脱。
要确定ACC内容,请按照[21.].如由[描述提取物的E2使用方法1制备型HPLC分离43].r.的分数T.蒸发10.5 ~ 11.9 min,用100 μl甲醇溶解,200 μl醚重氮甲烷20℃甲基化10 min,然后蒸发,用70 μl CH溶解3.CN和IAA含量由气相色谱-质谱法测定,详情由[43].
JA,JA-Ile和OPDA分别由[所述测定43]使用每种样品的1g鲜重的均质植物材料。对于这些测定,叶片在1小时后机械缠绕并收获。
所有测定至少从八个独立的生物复制中完成,每个生物重复由一个植物代表,从中切除切屑。
转化酶活性和可溶性糖含量的测定。
如先前所述,测定转化酶活性[44].通过偶联的酶测定法测定可溶性糖含量的测定,如[44].
统计分析
采用SPSS 17.0 (SPSS Inc., Chicago, IL, USA)软件进行统计分析。所有数据集分别用Kolmogorov-Smirnov检验和Levene检验进行正态分布和方差齐性检验。单因素方差分析之后采用Tukey的HSD检验进行显著性检验。
缩写
- ACC:
-
氨基环丙烷-1-羧酸
- AOC:
-
丙二烯氧化物环化酶
- ar:
-
不定根
- CWI:
-
细胞壁转化酶
- JA:
-
茉莉酸
- JA-Ile:
-
Jasmonoyl异亮氨酸
- OPDA:
-
CIS.-12氧代phytodienoic酸
- 2,4-D:
-
2,4-二氯苯氧基乙酸
参考
- 1。
De Klerk G,Van der Krieken W,De Jong J.形成不定根的形成:新概念新的可能性。体外细胞驱动Biol植物。1999年; 35:189-99。
- 2。
下胚轴不定根的器官发生不同于侧根的发育。植物科学学报。2014;5:495。
- 3。
森佐贝利尼C,Pacurar DI,佩罗I.不定根和侧根:异同。Annu Rev植物Biol。2014; 65(1):639-66。
- 4.
Da Costa CT,De Almeida Mr,Ruedell Cm,Schwambach J,Maraschin FDS,Fett-Neto AG。当压力和发展齐头并进时:扦插偶然生根的主要激素控制。前植物SCI。2013; 4:133。
- 5.
Della Rovere F, Fattorini L, D 'Angeli S, Veloccia A, Del Duca S, Cai G,等。拟南芥的SHR、SCR转录因子和AUX1生长素流入载体控制着植物不定根和木质素发生之间的转换体外培养的薄细胞层。Ann Bot。2015; 115(4):617-28。
- 6.
Della Rovere F,Fattorini L,D'Angeli S,Veloccia A,Falasca G,Altamura MM。在拟南芥的不定根顶点中的静态中心植物素和细胞蛋白控制形成。Ann Bot。2013; 112(7):1395-407。
- 7.
Takahashi F,Sato-Nara K,Kobayashi K,Suzuki M,Suzuki H.糖诱导拟南芥幼苗的不定根。j植物res。2003; 116(2):83-91。
- 8.
在生存和全球园艺的范围内屑的不定根形成的碳水化合物Druege U.参与。在:Niemi K,Scagel C,编辑。林木和园艺植物不定根的形成 - 从基因到应用程序。喀拉拉邦:研究路标;2009.187-208。
- 9.
Ahkami AH,Lischewski S,Haensch K-T,Porfirova S,霍夫曼Ĵ,Rolletschek H,等人。不定根形成在分子生理学佩妮矮牵牛扦插:伤口反应和初级代谢的参与。新植物。2009; 181(3):613-25。
- 10。
Gutierrez L,Mongelard G,Flokovák,pūcurardi,诺哈克o,Staswick P等人。植物蛋白通过调节茉莉酸性稳态来控制拟南芥不定目的根起因。植物细胞。2012; 24(6):2515-27。
- 11.
Clarke Sm,Cristescu Sm,Miersch O,Harren FJM,Wasternack C,Mur Laj。茉莉酸盐用水杨酸作用,以赋予基础热能拟南芥蒂利亚纳.新植物。2009; 182(1):175-87。
- 12.
维克BA,齐默尔曼DC。茉莉酸的生物合成:用于植物脂氧合酶具有生理作用。生物化学生物物理研究通讯。1983; 111:470-7。
- 13。
脂氧合酶途径。植物学报2002;53:275-97。
- 14.
陈志强,陈志强,陈志强,等。JAZ家族的阻遏子是茉莉酸信号通路中缺失的一环。自然。2007;448(7154):666 - 71。
- 15.
Thines B,Katsir L,Melotto M,Niu Y,Mandaokar A,Liu G,等。Jaz Repressor Proteins是SCF的目标COI1茉莉信令期间复杂。自然。2007; 448(7154):661-5。
- 16.
Fonseca S,Chini A,Hamberg M,Adie B,Porzel A,Kramell R等人。(+) - 7-ISO-jasmonoyl-l-异亮氨酸是内源性生物活性的茉鲸酸盐。NAT CHEM BIOL。2009; 5(5):344-50。
- 17.
Sheard Lb,Tan X,Mao H,Withers J,Ben-Nissan G,Hinds Tr等。含硅磷酸盐增强的Coi1-Jaz Co-actory的茉莉酸族感知。自然。2010; 468(7322):400-5。
- 18.
Laudert D,Schaller F,Weiler E.转基因尼科尼亚塔哈瓦姆和拟南芥蒂利亚纳植物过表达氧化烯合成酶。足底。2000;211:163-5。
- 19.
家用B,滕策尔I,Miersch O,Maucher H,Kramell R,齐格勒J,等。番茄花组织特异性脂氧化物类签名 - 丙二烯氧化物环化酶在不同的花器官和维管束中高表达。植物杂志2000; 24:113-26。
- 20。
Wasternack C,遗址B. jasmonals:生物合成,感知,信号转导和植物应激反应,生长和发育的作用。2007年植物学年度审查的更新。Ann Bot。2013; 111:1021-58。
- 21。
德鲁奇U,弗兰肯P,Lischewski S,Ahkami Ah,Zerche S,Hause B等人。转录组分析显示乙烯作为刺激剂和植物素作为矮牵牛扦插在不定根形成的调节因子。前植物SCI。2014; 5:494。
- 22。
Ravnikar M,Vilhar B,Gogala N.茉莉酸对马铃薯茎节点和原生质体培养的刺激作用。J工厂增长调节。1992; 11(1):29-33。
- 23。
随着植物营养向生殖转换,不定根的数量下降,并与生长素稳态的改变有关。中国生物医学工程学报。2015;66(5):1437-52。
- 24。
Fattorini L,Falasca G,Kevers C,Mainero罗卡L,扎德拉C,Altamura的M.不定根通过茉莉酮酸甲酯在烟草薄的细胞层增强。足底。2009; 231(1):155-68。
- 25。
da Rocha CL, Troleis J, Mastroberti AA, Mariath JEA, Fett-Neto AG。不定芽生根方式不同拟南芥蒂利亚纳.植物医学杂志。2012;14(1):100 - 9。
- 26.
Garrido G,RamónGuerreroJ,Angel Cano E,Acosta M,Sánchez-Bravo J.原产地和底座运输IAA负责康乃馨切割的生根。physiol植物。2002; 114(2):303-12。
- 27.
Blakesley D, Davis TD。生长素代谢与不定根形成。In: Haissig BE,编辑。不定根形成生物学。纽约:Plenum出版社;1994.143 - 53页。
- 28.
Sorin C,Bussell JD,Camus I,Ljung K,Kowalczyk M,Geiss G等人。在拟南芥中偶然生根的养羊酸和光照控制需要Agronaute1。植物细胞。2005; 17(5):1343-59。
- 29.
Clark DG,Gubrium Ek,Barrett Je,Nell Ta,Klee Hj。在乙烯不敏感植物中的根部形成。植物理性。1999; 121(1):53-60。
- 30.
涩K,百里KG,西亚迪JA,Loucas HM,Underwood的BA,Nourizadeh S,等人。核心角色Phein2.在植物发育过程中的乙烯反应佩妮.植物理性。2004; 136(2):2900-12。
- 31。
Roitsch T, González M-C。植物转化酶的功能和调节:甜的感觉。植物科学进展。2004;9(12):606-13。
- 32。
Roitsch T,Balibrea M,Hofmann M,Proels R,Sinha A.细胞外转化酶:关键代谢酶和PR蛋白。J Exp Bot。2003; 54:513-24。
- 33。
矮牵牛花扦插在光照下生根时,暗暴露显著改善了不定根的形成,提高了碳水化合物的可用性。植物生理学报。2010;167(7):547-54。
- 34。
韦斯利SV,Helliwell CA,史密斯NA,王男,劳斯DT,刘谦等。构建植物高效,有效和高通量基因沉默的设计。植物杂志2001; 27(6):581-90。
- 35。
米尔IM。农杆菌介导的矮牵牛叶盘的转化。在:罗耀拉 - 巴尔加斯V,巴斯克斯 - Flota楼编辑。植物细胞培养协议,第一卷。318.纽约:Humana公司出版社;2006.265-72。
- 36。
Mallona I,Lischewski S,魏斯Ĵ,家用B,参考基因进行定量实时PCR EGEA-科蒂内斯M.验证在叶和花发育期间佩妮矮牵牛.BMC植物BIOL。2010; 10(1):4。
- 37。
Schmittgen TD,Livak KJ。通过比较C(T)法分析实时PCR数据。NAT PROTOC。2008; 3:1101-8。
- 38.
Stenzel I,Hause B,Maucher H,Pitzschke A,Miersch O,Ziegler J,等。伤口反应和血管束特异性生成伤口信号中番茄酸盐的联烯氧化物环依赖性。工厂J. 2003; 33:577-89。
- 39.
Ziegler J,Hamberg M,Miersch O,Parthier B.干玉米种子氧化物环酶的纯化和表征。植物理性。1997年; 114(2):565-73。
- 40。
Ziegler J, Stenzel I, Hause B, Maucher H, Hamberg M, Grimm R, et al.;环氧烯环化酶的分子克隆:建立十八烷类和茉莉酸类立体化学的酶。生物化学学报2000;275:19132-8。
- 41。
齐格勒Ĵ,Wasternack C,到汉堡M.在丙二烯氧化物环化酶的特异性。脂质。1999; 34:1005至15年。
- 42。
Isayenkov S,MROSK C,Stenzel I,Strack D,遗留B.抑制毛状根毛发根系Medicago truncatula降低茉莉酸水平和菌根化程度Glomus mortraradice..植物杂志。2005;139(3):1401 - 10。
- 43。
Miersch O,NeumerkelĴ,Dippe男,滕策尔I,Wasternack C.羟基化茉莉酮酸酯是通常发生的茉莉酸的代谢产物,并有助于部分关断在茉莉信令。新植物。2008; 177(1):114-27。
- 44。
Schaarschmidt s,qu n,strack d,sonnewald u,遗留b。局部诱导ALC.由乙醛在转基因烟草植物中的基因开关。植物细胞生理。2004; 45(11):1566至1577年。
确认
我们感谢Birgit Ortel(IPB Halle)在IAA和ACC量化中获得帮助。克劳斯Wasternack和Alain Tissier(IPB Halle)非常公认用于批判性读取手稿。
资金
这项工作由德国莱布尼茨协会的“Pakt für Forschung und Innovation”资助。
作者信息
隶属关系
通讯作者
附加信息
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
作者的贡献
SL和BH设计研究。SL,DG和AM进行研究和分析数据。BH与SL的协助下撰写文章。所有作者阅读并认可的终稿。
作者的信息
不适用。
可利用数据和材料
不适用。
附加文件
附加文件1:图S1。
基因组结构PhAOC.图S2。AOC蛋白在茎基中的积累佩妮矮牵牛表达PhAOCrnai。图S3。吲哚乙酸(IAA)的积累PHDEVA-20-C01茎基的转录物佩妮矮牵牛岩屑。图S4。AR在形成的去根苗P. Hybrida.用不同浓度的茉莉酸处理。图S5。qRT-PCR分析推测内参基因用于茎基的转录本分析佩妮矮牵牛岩屑。(docx 1376 kb)
附加文件2:表S1。
幼苗的ars数量P. Hybrida.用各种浓度的奥氧化物,2,4-D和ACC处理野生型。表S2。幼苗的ars数量P. Hybrida.野生型未治疗或用茉莉酸(JA)单独或与2,4-D或ACC组合处理。表S3。用于克隆的引物序列35年代::PhAOC-RNA.我进入pentr。表S4。用于选择转基因植物的底漆序列。表S5。底漆序列phoc, PhACO, Ph2-GH3, Ph3CL9414, PhRSP13在实时定量PCR使用。(DOCX 26 KB)
权利和权限
开放访问本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
Lischweski,S.,Modow,A.,Guthörl,D。等等。茉莉酸盐在矮牵牛扦插中呈呈不定根形成作用。BMC植物杂志15,229(2015)。https://doi.org/10.1186/s12870-015-0615-1
已收到:
接受:
发表:
关键词
- 不定根形成
- 养阴
- 细胞壁转化酶
- 扦插
- 乙烯
- 茉莉酸
- JA-isoleucine
- 佩妮矮牵牛