- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
低温诱导的DNA高甲基化减弱gydF4y2BaRhAGgydF4y2Ba,一个gydF4y2Ba无性生殖的gydF4y2Ba和增加玫瑰的花瓣数(gydF4y2BaRosa HybridagydF4y2Ba)gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba15gydF4y2Ba文章编号:gydF4y2Ba237gydF4y2Ba(gydF4y2Ba2015gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
花的发育是被子植物繁殖的中心环节,受多种内源和外源刺激的调控。环境温度对花期的控制起着关键作用;然而,温度调节花器官分化的机制仍然是未知的。gydF4y2Ba
结果gydF4y2Ba
在本研究中,我们发现低温处理显著增加了玫瑰(gydF4y2BaRosa HybridagydF4y2Ba),通过促进雄蕊花瓣化。定量RT-PCR分析结果显示gydF4y2BaRhAGgydF4y2Ba,玫瑰的同系物gydF4y2Ba拟南芥无性生殖的gydF4y2Bac -功能基因,与低温调控花的发育有关。沉默的gydF4y2BaRhAGgydF4y2Ba模拟低温处理对花瓣发育的影响,通过增加花瓣雄蕊的产量显著增加花瓣数量。gydF4y2Ba原位gydF4y2Ba杂交研究进一步表明低温限制了其空间表达区。对DNA甲基化水平的分析表明,低温处理提高了DNA甲基化水平gydF4y2BaRhAGgydF4y2Ba启动子,并且在CHH位点低的温度条件下甲基化的特定启动子区,鉴定由硫酸氢盐测序。这表明,表观遗传DNA甲基化有利于环境温度调制gydF4y2BaRhAGgydF4y2Ba表达。gydF4y2Ba
讨论gydF4y2Ba
我们的结果提供了突出的作用gydF4y2BaRhAGgydF4y2Ba这为花器官发育的调控增加了一层新的复杂性。gydF4y2Ba
结论gydF4y2Ba
我们建议gydF4y2BaRhAGgydF4y2Ba通过调节花瓣发展起着玫瑰花图案的重要作用,而低温下增加花瓣数量,至少部分地通过抑制gydF4y2BaRhAGgydF4y2Ba表达式gydF4y2Ba通过gydF4y2Ba增强DNA CHH的高甲基化gydF4y2BaRhAGgydF4y2Ba启动子。gydF4y2Ba
背景gydF4y2Ba
花的图案是被子植物繁殖所必需的,包括四种器官的同心轮状排列:萼片和花瓣,组成花被,形成外面的两个轮状;雄蕊和心皮,分别是雄性和雌性的生殖器官,形成内部的两个轮。ABCE模型是花发育的一个被广泛接受的模型,最早于20年前提出,描述了四类同源基因的组合活动如何决定花器官的特性[gydF4y2Ba1gydF4y2Ba- - - - - -gydF4y2Ba5gydF4y2Ba].根据Abce模型,Sepals由A-和E-Class基因,瓣,B-和E级基因,B-,C-和E-Class基因的雄蕊和C-和Carpels指定E级基因。gydF4y2Ba
在gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba,已经鉴定出几个同型同源基因,包括两个a类基因,gydF4y2BaAPETALA1gydF4y2Ba(gydF4y2BaAP1gydF4y2Ba),gydF4y2BaAPETALA2gydF4y2Ba(gydF4y2BaAP2gydF4y2Ba),两个b类基因,gydF4y2BaAPETALA3gydF4y2Ba(gydF4y2BaAP3gydF4y2Ba),gydF4y2BaPISTILLATAgydF4y2Ba(gydF4y2BaπgydF4y2Ba),一个C级基因,gydF4y2Ba无性生殖的gydF4y2Ba(gydF4y2BaAG)gydF4y2Ba)和四个e级基因,gydF4y2BaSEPALLATA1gydF4y2Ba(gydF4y2BaSEP1gydF4y2Ba),gydF4y2BaSEP2gydF4y2Ba,gydF4y2BaSEP3gydF4y2Ba, 和gydF4y2BaSEP4gydF4y2Ba[gydF4y2Ba4gydF4y2Ba].所有四类基因,除了gydF4y2BaAP2gydF4y2Ba,编码MADS-box家族转录因子。这些蛋白质已经被提议形成更高阶的复合物,这是器官特异性遗传程序正确转录所必需的[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba6gydF4y2Ba- - - - - -gydF4y2Ba9gydF4y2Ba].具有若干模型植物物种的遗传和分子研究表明,由于替换一个器官类型而不是另一个器官类型,所以α,b-,c-和e-class基因中的突变均导致异常的花朵[gydF4y2Ba9gydF4y2Ba- - - - - -gydF4y2Ba11gydF4y2Ba].gydF4y2Ba
许多观赏植物,包括玫瑰(gydF4y2BaRosa HybridagydF4y2Ba)、牡丹(gydF4y2Ba牡丹gydF4y2Ba),康乃馨(gydF4y2Ba石竹类植物caryophyllusgydF4y2Ba)和茶花(gydF4y2Ba山茶gydF4y2Ba),有更多的花瓣(称为重瓣花),因此是受欢迎的花园植物,因为它们的外观吸引人。人们已经作出了努力来描述涉及重瓣花形成的遗传机制,并对各种物种进行了研究,包括gydF4y2Ba答:芥gydF4y2Ba,已经显示了表达的缺失gydF4y2BaAG)gydF4y2Ba导致生殖器官向花被器官的转化,以及花分生组织的不确定性,导致艳丽的重瓣花[gydF4y2Ba12gydF4y2Ba- - - - - -gydF4y2Ba15gydF4y2Ba].ranunculid,gydF4y2BaThalictrum thalictroidesgydF4y2Ba,下调的gydF4y2BaAG)gydF4y2Ba同族体gydF4y2BaThtAG1gydF4y2Ba已经被证明导致雄蕊和心皮向萼片器官的同源性转换,以及花的确定性的损失。此外,据报道,与K-domain缺失突变ThtAG1蛋白质,这是确定重瓣花观赏品种,不能与假定的e级蛋白质ThtSEP3交互,提出深C基因的双重作用,保护和C - e级蛋白质之间的相互作用的花卉图案(gydF4y2Ba9gydF4y2Ba].玫瑰的遗传定位研究发现,单花冠与双花冠的表型与一个单一的显性位点有关gydF4y2BaBlfo.gydF4y2Ba或gydF4y2Bad6gydF4y2Ba[gydF4y2Ba16gydF4y2Ba- - - - - -gydF4y2Ba18gydF4y2Ba],以及若干qtl [gydF4y2Ba19gydF4y2Ba- - - - - -gydF4y2Ba21gydF4y2Ba].的orthologuegydF4y2Ba无性生殖的gydF4y2Ba(gydF4y2BaRhAGgydF4y2Ba)也被鉴定并证明在玫瑰的花瓣加倍中起重要作用gydF4y2BaRhAGgydF4y2Ba不与gydF4y2BaBlfo.gydF4y2Ba或花瓣数量的QTL [gydF4y2Ba18gydF4y2Ba,gydF4y2Ba22gydF4y2Ba].空间的限制gydF4y2BaRhAGgydF4y2Ba表达域可能导致器官身份从雄蕊向花瓣的同源性转换,是中国和地中海沿岸驯化中心选择重瓣花的关键因素[gydF4y2Ba23gydF4y2Ba].的作用gydF4y2BaAG)gydF4y2Ba在雄蕊转化到花瓣中已被证明与A类基因相关gydF4y2BaAP2gydF4y2Ba在gydF4y2Ba答:芥gydF4y2Ba的相互对抗gydF4y2BaAG)gydF4y2Ba和gydF4y2BaAP2gydF4y2Ba是花卉图案ABC模型的中心原则[gydF4y2Ba1gydF4y2Ba].然而,最近的研究表明,微RNA miR172,这可能是gydF4y2BaAG)gydF4y2Ba- 独立,是限制的主要因素gydF4y2BaAP2gydF4y2Ba而雄蕊或花瓣的发育取决于两者之间的平衡gydF4y2BaAP2gydF4y2Ba和gydF4y2BaAG)gydF4y2Ba而不是两种基因的相互排斥[gydF4y2Ba15gydF4y2Ba].gydF4y2Ba
除了遗传决定外,被子植物的花瓣数量也受植物激素的调节,包括生长素和赤霉素[gydF4y2Ba24gydF4y2Ba- - - - - -gydF4y2Ba26gydF4y2Ba],并通过环境提示,如光和气温度[gydF4y2Ba24gydF4y2Ba,gydF4y2Ba27gydF4y2Ba].例如,早期的报告显示,过高或过低的温度都可能导致花器官的畸形,特别是花瓣和雄蕊[gydF4y2Ba24gydF4y2Ba].低温(5℃)培养康乃馨促进了花内二次生长中心的形成,花瓣数量的显著增加是由于这些中心产生了更多的花瓣[gydF4y2Ba24gydF4y2Ba].在玫瑰,降低的温度可能会导致所谓的“大头”的表型,这是伴随着花瓣的数量增加和减少数量雄蕊[gydF4y2Ba28gydF4y2Ba- - - - - -gydF4y2Ba30.gydF4y2Ba].然而,到目前为止,有关温度依赖性调节花瓣数的机制尚不清楚。这里,我们提出一个假设gydF4y2BaAG)gydF4y2Ba基因参与了温度调节,控制花瓣数量,从而形成重瓣花。gydF4y2Ba
几个世纪以来,玫瑰一直是花卉业中最具经济价值的观赏植物之一。花卉图案作为一种广泛分布的切花栽培花卉,是决定其观赏价值的关键性状。在目前的研究中,我们发现低温处理导致的异常花比对照花的花瓣更多。我们发现了一个玫瑰c类基因,gydF4y2BaRhAGgydF4y2Ba,其沉默导致花瓣数量增加。总体空间分布gydF4y2BaRhAGgydF4y2Ba低温条件下,花芽中转录因子明显降低,进一步研究表明低温暴露导致了花芽DNA的高甲基化gydF4y2BaRhAGgydF4y2Ba启动子。我们得出这样的结论:gydF4y2BaRhAGgydF4y2Ba扮演花图案和低温增加的玫瑰鲜花花瓣数量,至少部分,通过限制表达的重要作用gydF4y2BaRhAGgydF4y2Ba.gydF4y2Ba
结果gydF4y2Ba
低温对玫瑰雄蕊花瓣化的影响gydF4y2Ba
为研究低温对月季花瓣发育的影响,对2年生月季进行25/15°C(昼/夜)、20/10°C和15/5°C的不同温度处理。我们发现,与对照处理(25/15°C)相比,20/10°C或15/5°C较低的温度条件下,花朵形成畸形,花中心形状不规则(图5)。gydF4y2Ba1 dgydF4y2Ba).如图所示。gydF4y2Ba1模拟gydF4y2Ba,这些花典型的表型是两个生长中心和花的大小大于对照组(附加文件gydF4y2Ba1gydF4y2Ba:图S1)。花的纵向切片显示,畸形花的花瓣形状明显不规则,与正常花的花瓣形状不同。gydF4y2Ba1 e, fgydF4y2Ba).gydF4y2Ba
花表型常温和低温条件下生长的玫瑰植物。gydF4y2Ba一个gydF4y2Ba-gydF4y2BabgydF4y2Ba在常温(25/15°C)下生长的第九阶段的玫瑰花的俯视图(gydF4y2Ba一个gydF4y2Ba)及低温(15/5°C) (gydF4y2BabgydF4y2Ba)条件。gydF4y2BacgydF4y2Ba-gydF4y2BadgydF4y2Ba常温(25/15°C)下生长9期玫瑰花心侧图(gydF4y2BacgydF4y2Ba)及低温(15/5°C) (gydF4y2BadgydF4y2Ba)条件。gydF4y2BaegydF4y2Ba-gydF4y2BafgydF4y2Ba在常温(25/15°C) (e)和低温(15/5°C) (gydF4y2BafgydF4y2Ba)条件。gydF4y2BaggydF4y2Ba-gydF4y2BahgydF4y2Ba常温(25/15°C)下生长的玫瑰花瓣表型(gydF4y2BaggydF4y2Ba)及低温(15/5°C) (gydF4y2BahgydF4y2Ba)条件。注意,低温处理导致更多的内轮状花瓣。gydF4y2Ba我gydF4y2Ba似花瓣的雄蕊gydF4y2Ba
的变形花的比例是在控制温度只有大约2%,但在20/10℃下和88%36%在15/5℃,这表明变形花形成的发生在较低温度下显着增加(附加文件gydF4y2Ba1gydF4y2Ba:图S2)。一般来说,现代栽培的玫瑰有重瓣花,我们调查了这些处理导致的大花大小是否与花瓣的大小和/或数量有关。玫瑰花期7(完全开放的蓓蕾;解剖暴露于各处理的花器官(萼片、花瓣、雄蕊和心皮),计数。三种处理的萼片和心皮数目均无显著差异gydF4y2Ba1gydF4y2Ba),但在低温条件下,花瓣的数量显著增加。在控制温度下,平均花瓣数为28片,说明花是半重瓣花(8 - 40片)[gydF4y2Ba23gydF4y2Ba].而在20/10°C较低的温度下,花瓣数显著增加到33个,在最低温度下达到49个,花朵由半重瓣变成重瓣(>40个花瓣)。温度的降低也导致了雄蕊数量的减少,在对照温度下,平均雄蕊数为126,在20/10℃和15/5℃处理后,雄蕊数分别降至121和106。一般来说,玫瑰花有一些内部花瓣,花瓣的基部细长,形状不规则,这表明从雄蕊到花瓣的同源性转变(图。gydF4y2Ba1胃肠道gydF4y2Ba),因此值得注意的是,低温处理花的花瓣/雄蕊嵌合体数高于对照,从而促进了总花瓣数的增加(图5)。gydF4y2Ba1 g hgydF4y2Ba).这些结果表明,即使在正常栽培的玫瑰中,花瓣状雄蕊也可能从外部轮向内部轮逐渐过渡,但低温可以促进花瓣状雄蕊的形成(图2)。gydF4y2Ba1 g hgydF4y2Ba).gydF4y2Ba
同样值得注意的是,花器官的总数在不同处理之间没有显著差异(表1)gydF4y2Ba1gydF4y2Ba).因此,低温对花的发育没有不确定性影响。这些结果表明,低温对蔷薇雄蕊的花瓣化有很大的影响。gydF4y2Ba
表达式的分析gydF4y2BaRhAGgydF4y2Ba基因响应于花发育期间的低温gydF4y2Ba
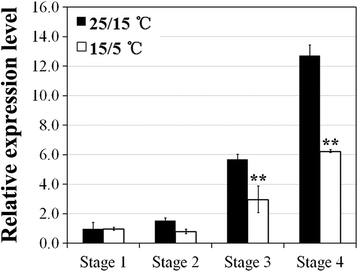
据报道gydF4y2BaAG)gydF4y2Ba基因在确定生殖器官的特性和花分生组织的特性方面起着双重作用[gydF4y2Ba9gydF4y2Ba],并参与花瓣数目的确定[gydF4y2Ba23gydF4y2Ba].要了解是否gydF4y2BaAG)gydF4y2Ba基因与玫瑰低温调节花瓣加倍相关联,我们分析了表达低温度的效果gydF4y2BaRhAGgydF4y2Ba,一个上涨的同源物gydF4y2BaAG)gydF4y2Ba[gydF4y2Ba23gydF4y2Ba],通过定量RT-PCR检测。结果表明gydF4y2BaRhAGgydF4y2Ba在第1和第2阶段萼片和花瓣原基形成时,花粉的含量较低;在第3和第4阶段雄蕊和心皮原基形成时,花粉的含量显著上升(图。gydF4y2Ba2gydF4y2Ba).该表达模式与其作为C类基因的分类相关。此外,低温暴露在雄蕊和卡皮尔形成阶段显着降低了其表达水平,表明这一点gydF4y2BaRhAGgydF4y2Ba可能参与低温诱导雄蕊的欧芹转化为花瓣。gydF4y2Ba
的表达模式gydF4y2BaRhAGgydF4y2Ba响应花发育过程中的低温。表达式gydF4y2BaRhAGgydF4y2Ba采用定量RT-PCR检测。2年生月季植株在25/15°C(黑色柱)或15/5°C(白色柱)下栽培。在第1至第4阶段采集花朵。gydF4y2BaRhTCTPgydF4y2Ba用作所有测试基因的内部控制。的表达水平gydF4y2BaRhAGgydF4y2Ba在第1阶段,在25/15℃下生长为1.0。值为平均值±标准差(gydF4y2BangydF4y2Ba= 3)。中计算的显著差异用星号表示gydF4y2BatgydF4y2Ba测试(* *gydF4y2BapgydF4y2Ba< 0.01;*gydF4y2BapgydF4y2Ba< 0.05)gydF4y2Ba
花图案的gydF4y2BaRhAGgydF4y2Ba-沉默花表型复制低温处理花gydF4y2Ba
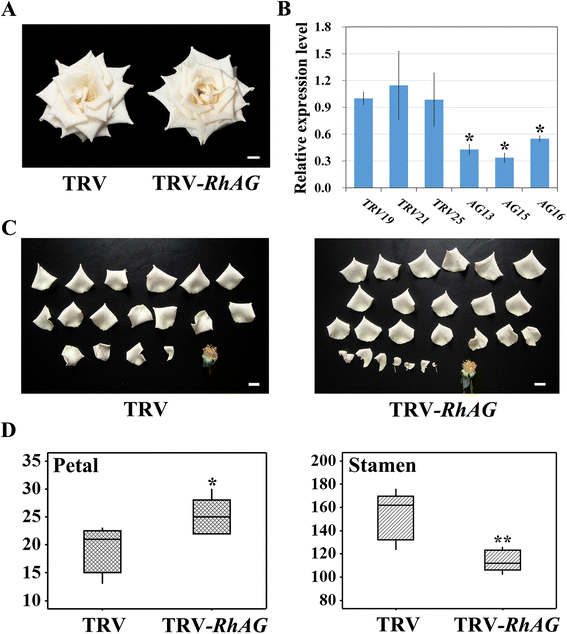
由于表达gydF4y2BaRhAGgydF4y2Ba在低温条件下减少,我们寻找因果关系的证据gydF4y2BaRhAGgydF4y2Ba功能和低温通过沉默诱导花瓣数增加gydF4y2BaRhAGgydF4y2Ba利用病毒诱导的基因沉默(VIGS)对3个月月龄的玫瑰植株进行了研究。在完全开放的渗透植物中观察到表明基因沉默的花表型(图。gydF4y2Ba3a,bgydF4y2Ba).在第10期,trv侵染花的花药呈黄色。相反,花药gydF4y2BaRhAGgydF4y2Ba因为他们覆盖了额外的内部花瓣沉默的花不暴露。我们计数花瓣和从两组花的雄蕊的数目,发现的沉默花花瓣数基本上较高,而雄蕊数目与TRV对照相比降低(图gydF4y2Ba3 c, dgydF4y2Ba).TRV花平均有19片花瓣,而gydF4y2BaRhAG -gydF4y2Ba沉默的花有25。相反,雄蕊的平均数量gydF4y2BaRhAG -gydF4y2Ba沉默花比TRV对照低25%。此外,与trv处理过的花相比gydF4y2BaRhAGgydF4y2Ba沉默的花有更多的花瓣状雄蕊(图。gydF4y2Ba3 cgydF4y2Ba),在低温处理的花中观察到。有趣的是,我们发现部分雌蕊gydF4y2BaRhAGgydF4y2Ba-沉默花转变为萼片状器官,表明gydF4y2BaRhAGgydF4y2Ba也参与了Gynoecia的身份(附加档案gydF4y2Ba1gydF4y2Ba:图S3)。这些结果表明gydF4y2BaRhAGgydF4y2Ba在蔷薇花瓣数调控和雄蕊向花瓣的同源性转化中起重要作用。gydF4y2Ba
沉默的gydF4y2BaRhAGgydF4y2Ba在玫瑰花朵。3个月月龄的玫瑰植株被渗透gydF4y2BaA.tumefaciensgydF4y2Ba包含TRV控制(TRV, pTRV1 + pTRV2),或TRV携带gydF4y2BaRhAGgydF4y2Ba片段(和-gydF4y2BaRhAGgydF4y2Ba, pTRV1 + pTRV2-gydF4y2BaRhAGgydF4y2Ba).gydF4y2Ba一个gydF4y2BaTRV对照表型(gydF4y2Ba左gydF4y2Ba),gydF4y2BaRhAGgydF4y2Ba沉默(gydF4y2Ba正确的gydF4y2Ba)第10阶段的花。gydF4y2BabgydF4y2Ba定量RT-PCR分析gydF4y2BaRhAGgydF4y2Ba在TRV对照和gydF4y2BaRhAGgydF4y2Ba沉默的花瓣。的表达水平gydF4y2BaRhAGgydF4y2Ba在TRV19对照组中设置为1.0。gydF4y2BaRhTCTPgydF4y2Ba作为内部控制。以第3期花芽为对照。值为平均值±标准差(gydF4y2BangydF4y2Ba= 3)。gydF4y2BacgydF4y2Ba从TRV花花瓣(gydF4y2Ba左gydF4y2Ba),gydF4y2BaRhAGgydF4y2Ba沉默的花(gydF4y2Ba正确的gydF4y2Ba).gydF4y2BadgydF4y2Ba花瓣(gydF4y2Ba左gydF4y2Ba)和雄蕊(gydF4y2Ba正确的gydF4y2Ba)数的TRV花gydF4y2BaRhAGgydF4y2Ba沉默的花(gydF4y2BangydF4y2Ba= 5)。gydF4y2Ba星号gydF4y2Ba表示计算的显著差异gydF4y2BatgydF4y2Ba测试(* *gydF4y2BapgydF4y2Ba< 0.01;*gydF4y2BapgydF4y2Ba< 0.05)。比例尺= 1厘米gydF4y2Ba
的表达模式gydF4y2BaRhAGgydF4y2Ba在花原基中低温响应的玫瑰花发育gydF4y2Ba
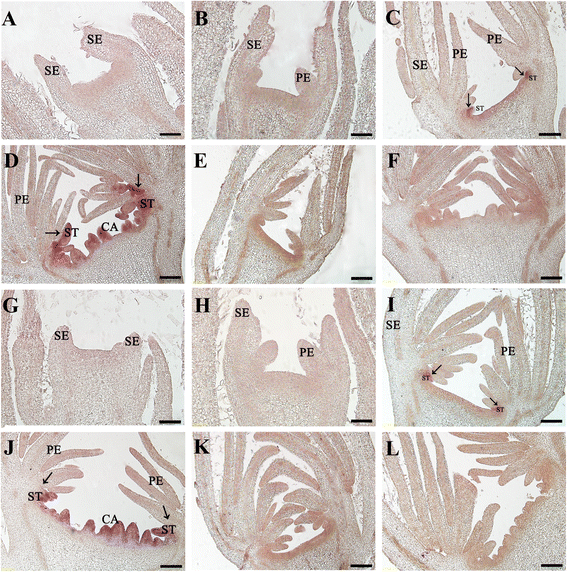
进一步确认所提议的作用gydF4y2BaRhAGgydF4y2Ba在花发育的调控中,我们研究了低温处理花原基中的表达模式gydF4y2Ba原位gydF4y2Ba杂化。正如预期的那样,无论环境温度制度还是发展阶段,表达gydF4y2BaRhAGgydF4y2Ba在旋涡1和2检测不到(图gydF4y2Ba图4a-dgydF4y2Ba和gydF4y2Bag-jgydF4y2Ba),而在第3轮和第4轮出现后,检测到持续的信号(图。gydF4y2Ba4C,D,我gydF4y2Ba, 和gydF4y2BajgydF4y2Ba),与以往的报告一致[gydF4y2Ba23gydF4y2Ba].有趣的是,我们观察到低温处理的芽和对照在第4阶段的表达模式不同。在低温处理的花蕾中,花瓣原基发育较多,表达区gydF4y2BaRhAGgydF4y2Ba仅向分生组织的中心(可能产生第4轮)延伸,并稍稍延伸到仅出现少量雄蕊原基的侧方区域(图。gydF4y2Ba4 jgydF4y2Ba).在控制花,gydF4y2BaRhAGgydF4y2Ba延伸到Whorl 3的较宽域的信号,从中出现了许多雄蕊基金(图。gydF4y2Ba4 dgydF4y2Ba).减少的表达区域支持通过定量RT-PCR获得的数据,进一步表明受限制的表达gydF4y2BaRhAGgydF4y2Ba由低温治疗引起的可能促进雄蕊的百叶草,导致双花形成。gydF4y2Ba
原位gydF4y2Ba杂交gydF4y2BaRhAGgydF4y2BamRNA的积累在玫瑰的花蕾。gydF4y2BaRhAGgydF4y2Ba在常温(25/15°C)下生长的玫瑰花蕾中,使用dig标记探针检测(gydF4y2BafgydF4y2Ba)或低温(15/5°C) (gydF4y2Bag-lgydF4y2Ba)条件。gydF4y2Ba一个gydF4y2Ba和gydF4y2BaggydF4y2Ba,第1期花芽;gydF4y2BabgydF4y2Ba和gydF4y2BahgydF4y2Ba,第2阶段花芽;gydF4y2BacgydF4y2Ba和gydF4y2Ba我gydF4y2Ba,花蕾3期;gydF4y2BadgydF4y2Ba和gydF4y2BajgydF4y2Ba,第4阶段花蕾。第三阶段使用感觉探针(gydF4y2BaegydF4y2Ba和gydF4y2BakgydF4y2Ba)及第四阶段(gydF4y2BafgydF4y2Ba和gydF4y2BalgydF4y2Ba)作为负控制。SE,萼片;体育,花瓣;圣,雄蕊;CA,心皮。箭头表示花瓣和雄蕊之间的边界。比例尺= 100 μm (gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,gydF4y2BaggydF4y2Ba和gydF4y2BahgydF4y2Ba)或200 μm (gydF4y2BacgydF4y2Ba-gydF4y2BafgydF4y2Ba;gydF4y2Ba我gydF4y2Ba-gydF4y2BalgydF4y2Ba)gydF4y2Ba
低温诱导DNA的高甲基化gydF4y2BaRhAGgydF4y2Ba启动子gydF4y2Ba
在过去的十年中,越来越多的证据表明,DNA甲基化与植物对各种环境刺激的反应有关[gydF4y2Ba31gydF4y2Ba].在此之前,gydF4y2BaAG)gydF4y2Ba基因的gydF4y2Ba答:芥gydF4y2Ba被报道为反义高甲基化-gydF4y2BaMET1gydF4y2Ba转基因线(gydF4y2Ba32gydF4y2Ba].gydF4y2Ba
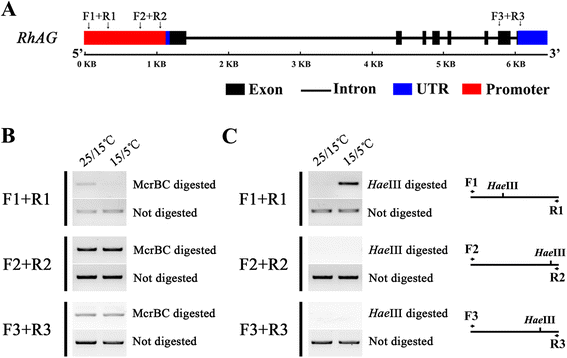
我们假设观察到的减少gydF4y2BaRhAGgydF4y2Ba低温表达可能与DNA甲基化状态的变化有关。为了验证这一点,我们首先克隆了基因组序列和起始密码子上游的1182 bp-DNA序列gydF4y2BaRhAGgydF4y2Ba从玫瑰花朵。基因结构由8个外显子和7个内含子组成,总长度为4942 bp(附加文件)gydF4y2Ba1gydF4y2Ba:图S4)。然后从上游1182 bp片段gydF4y2BaRhAGgydF4y2Ba由的McrBC限制酶消化裂解甲基化的DNA,不管它是CG,CHG或CHH甲基化[gydF4y2Ba33gydF4y2Ba].选择3个区域进行PCR扩增:−1149 ~−826 bp (F1 + R1);−446 ~−48 bp (F2 + R2);和+4493到+5058 bp (F3 + R3)(图。gydF4y2Ba5gydF4y2Ba).数字gydF4y2Ba5 bgydF4y2Ba的F1 + R1区域gydF4y2BaRhAGgydF4y2Ba启动子在15/5℃低温条件下甲基化程度较高,而其他两个区域在常温(25/15℃)和低温(15/5℃)条件下生长的DNA甲基化程度没有明显差异。由于几个消化部位gydF4y2Ba豪gydF4y2BaIII, CHH (H代表a, T,或C)基因座甲基化敏感酶gydF4y2BaRhAGgydF4y2Ba启动子,通过酶切进一步检测其甲基化水平gydF4y2Ba豪gydF4y2BaIII,其次为PCR (chopr -PCR) [gydF4y2Ba33gydF4y2Ba].We found that the low temperature condition led to CHH DNA hypermethylation in the tested F1 + R1 region, which was thus resistant to豪gydF4y2Ba三世劈理(无花果。gydF4y2Ba5度gydF4y2Ba).gydF4y2Ba
低温对DNA甲基化的影响gydF4y2BaRhAGgydF4y2Ba基因。研究了低温(15/5℃)对胞嘧啶DNA甲基化的影响gydF4y2BaRhAGgydF4y2Ba基因(gydF4y2Ba一个gydF4y2Ba)由gydF4y2BaMCRBC.gydF4y2Ba消化(gydF4y2BabgydF4y2Ba),gydF4y2Ba豪gydF4y2BaIII介导的Chec-PCR测定(gydF4y2BacgydF4y2Ba).gydF4y2Ba一个gydF4y2Ba结构示意图gydF4y2BaRhAGgydF4y2Ba基因。用于Chop-PCR检测的引物分别为F1 + R1、F2 + R2和F3 + R3。gydF4y2BabgydF4y2BaMCRBC.gydF4y2Ba消化试验。基因组DNA被消化gydF4y2BaMCRBC.gydF4y2Ba3 h, PCR扩增。gydF4y2BacgydF4y2Ba豪gydF4y2BaIII-mediated Chop-PCR化验。线性化的基因组DNA经酶切gydF4y2Ba豪gydF4y2BaIII, 3 h, PCR扩增。在每个试验中,未消化的基因组DNA作为对照gydF4y2Ba
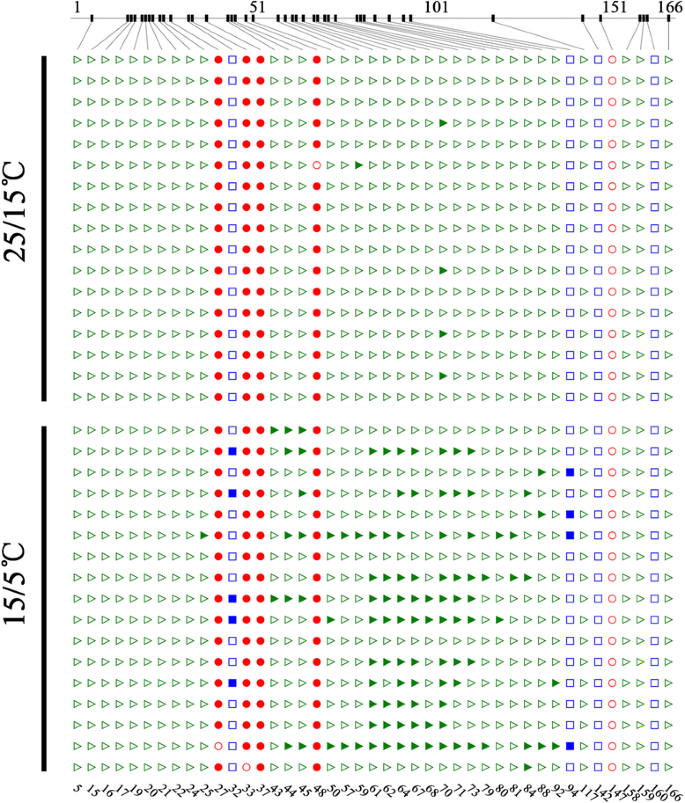
接下来,我们使用MethPrimer设计的测序引物,通过亚硫酸氢盐测序检测−1149到−826 bp区域的甲基化状态(gydF4y2Bahttp://www.urogene.org/cgi-bin/methprimer/methprimer.cgigydF4y2Ba)[gydF4y2Ba34gydF4y2Ba].根据测序结果,我们发现甲基化状态在180bp in-Lim-Lent-Limment碎片(-1,042至-863bp)中在低温下改变。在该区域中,几乎所有Cg基因座甲基化,在正常或低温条件下生长的植物中甲基化水平几乎相同(图。gydF4y2Ba6gydF4y2Ba;额外的文件gydF4y2Ba1gydF4y2Ba:图S5A)。4个CHG (H代表A、T或C)基因座在常温条件下均未发生甲基化,而2个CHG基因座在低温条件下发生甲基化,但甲基化率仅为20%左右(图2)。gydF4y2Ba6gydF4y2Ba;额外的文件gydF4y2Ba1gydF4y2Ba:图S5B)。正如预期的那样,CHH基因座的DNA甲基化差异最大,在常温下几乎都没有甲基化,而在低温下34个基因座中有20个是高甲基化的。此外,所有显示DNA甲基化状态发生变化的CHH基因座均被聚类(图2)。gydF4y2Ba6gydF4y2Ba;额外的文件gydF4y2Ba1gydF4y2Ba:图S5C)。鉴于启动子的DNA高甲基化通常与基因表达的抑制相关[gydF4y2Ba31gydF4y2Ba,这些结果支持了低温诱导表达减少的假设gydF4y2BaRhAGgydF4y2Ba至少部分是CHH DNA的超甲基化的结果gydF4y2BaRhAGgydF4y2Ba启动子。gydF4y2Ba
DNA甲基化分析gydF4y2BaRhAGgydF4y2Ba启动子亚硫酸氢盐测序。从常温(25/15°C)或低温(15/5°C)条件下生长的花芽中分离基因组DNA。亚硫酸氢盐转化的DNA被扩增和测序。使用CyMATE程序分析序列[gydF4y2Ba58gydF4y2Ba].通过亚硫酸氢盐测序分析的166bp DNA序列如图所示。顶部的数字表示该序列中的碱基对;底部的数字表示序列中的胞嘧啶。绿色三角形、蓝色正方形和红色圆圈分别代表CHH、CHG和CG (H代表A、T或C)构型中的胞嘧啶。填充形状表示甲基化位点,而开放形状表示未甲基化位点。每个处理分析17个克隆。如Hetzl等人所述,胞嘧啶密度由面板顶部的连接线表示[gydF4y2Ba58gydF4y2Ba]gydF4y2Ba
讨论gydF4y2Ba
低温对雄蕊瓣化过程中花瓣加倍的影响gydF4y2Ba
开花是被子植物繁殖和物种延续的重要阶段。开花过程受各种环境因素的控制,如环境温度,它影响花的发育速度和花的质量。例如,在花发育早期的低温会延迟一些玫瑰品种的花芽发生和发育(gydF4y2BaRosa HybridagydF4y2Ba),百合(gydF4y2Ba百合hansoniigydF4y2Ba)和菊花(gydF4y2Ba摘要通过gydF4y2Ba)[gydF4y2Ba35gydF4y2Ba- - - - - -gydF4y2Ba37gydF4y2Ba].温度也调节花器官的特性,导致不同轮间的同源性转化和器官数量的变化。在玫瑰中,高温会导致生殖器官转变为叶状器官[gydF4y2Ba27gydF4y2Ba],和花瓣数也已报道通过在若干物种或高或低的温度进行调节。一个例子是从康乃馨,其中华立和Baker [gydF4y2Ba38gydF4y2Ba据报道,在高温下降低一些品种的花瓣数。这与Garrod和Harris的发现形成了鲜明对比[gydF4y2Ba24gydF4y2Ba他认为,低温(5°C)促进了次生生长中心的形成,产生了额外的花瓣,因此花瓣总数显著增加。后者的结果与对玫瑰花的研究一致,研究发现,花瓣数增加、雄蕊数减少的“bullhead”表型是由低温诱导的,当温度升高时,这种表型会大幅减少[gydF4y2Ba28gydF4y2Ba- - - - - -gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba39gydF4y2Ba].gydF4y2Ba
在这项研究中,我们证明了玫瑰的花gydF4y2Bar .混合gydF4y2Ba简历。与正常生长温度下的花朵相比,暴露在低温下的文德拉花的花瓣总数更多,花蕾也更大,这与之前的一项研究一致[gydF4y2Ba39gydF4y2Ba].此外,我们发现花瓣数量的增加伴随着雄蕊数量的减少,而花瓣和雄蕊的总数量在不同温度下生长的花之间是相似的。低温处理的花形成了较多的花瓣状雄蕊。对这些表型的一种解释是,低温导致花瓣数量增加,至少部分是通过雄蕊花瓣化。此外,我们还观察到一些植物在低温下花的中心有萼片状的器官,这表明心皮向萼片的同源性转变,这与之前的报道一致gydF4y2Ba答:芥gydF4y2Ba[gydF4y2Ba10gydF4y2Ba].gydF4y2Ba
有趣的是,之前的报告表明gydF4y2BaRosa HybridagydF4y2Ba简历。Motrea,高温制度(26/21°C,日/夜)升高了表型表型的花朵比例高于低温(21/15℃)。在26/21℃或21/15℃条件下,Phylodod-表型花的花瓣数高于正常花,并且花瓣数的增加与文学表型的程度呈正相关,更严重的表型花瓣[gydF4y2Ba27gydF4y2Ba,gydF4y2Ba40gydF4y2Ba].细胞分裂素含量的减少被认为是叶型表型的原因[gydF4y2Ba27gydF4y2Ba].这些研究表明,花瓣的数量可能受到多种途径的控制,未来还需要进行更多的研究。gydF4y2Ba
的参与gydF4y2BaRhAGgydF4y2Ba在低温下,花瓣数量增加gydF4y2Ba
花同源c类基因gydF4y2BaAG)gydF4y2Ba在调节花分生组织的确定性和生殖器官的特性方面具有双重作用,即使在遥远的亲缘被子植物中,包括模式植物,也具有强烈的保守性gydF4y2Ba答:芥gydF4y2Ba,gydF4y2BaAntirrhinum Majus.gydF4y2Ba,和毛茛属植物gydF4y2Bat . thalictroidesgydF4y2Ba[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba].这些研究表明,植物减少gydF4y2BaAG)gydF4y2Ba功能将生殖器官转化为花被器官,并发展成花分生组织的不确定性,导致有多余花瓣的重瓣花。在玫瑰中,表示gydF4y2BaRhAGgydF4y2Ba据报道,在欧洲/中东和中国驯化过程中,与花瓣数较高的品种选择相关[gydF4y2Ba23gydF4y2Ba].在具有相似遗传背景的玫瑰中,表达域gydF4y2BaRhAGgydF4y2Ba局限在花的中心,在重瓣花的玫瑰中明显比单瓣花的品种更窄。此外,这条边界gydF4y2BaRhAGgydF4y2Ba表达域是不稳定的,允许选择花瓣数量增加的玫瑰[gydF4y2Ba23gydF4y2Ba].gydF4y2Ba
基于以上研究,我们推测低温诱导的玫瑰花外花瓣表型与低温诱导的玫瑰花外花瓣表型有关gydF4y2BaAG)gydF4y2Ba表达式,所以我们检查了表达式gydF4y2BaRhAGgydF4y2Ba以及在低温下生长的玫瑰植株中的其他同源基因。表达式分析表明,如所料,表示gydF4y2BaRhAGgydF4y2Ba低温处理在雄蕊和心皮形成阶段显著下调。为了获得更多的基因证据,我们抑制了gydF4y2BaRhAGgydF4y2Ba在玫瑰植物利用VIGS。这导致在花芽,雄蕊的数目减少和花瓣状雄蕊的数目增加额外花瓣形成。我们注意到,在VIGS实验的TRV控制花朵花瓣的平均数量(请见图。gydF4y2Ba3 dgydF4y2Ba)比在低温处理实验对照花基本上较低的(请参阅表gydF4y2Ba1gydF4y2Ba).这种现象可能是因为花的变化在不同的季节,批次,幼苗的年龄以及病毒的影响,因为它曾被报道ranunculid TRV2-empty植物物种显示,花萼大小不对称还原,偶尔的布朗,坏死斑点花萼,以及发育不良。然而,发育不良并不影响随后的生长[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba43gydF4y2Ba].无论这种病毒引起的效应在TRV2空玫瑰植物在当前的研究中存在的还不清楚。另外,花瓣加上雄蕊总数为少gydF4y2BaRhAGgydF4y2Ba在低温条件下,无显著差异。这可能是由于不同的生长条件,如季节,造成的环境影响。无论如何,花瓣和雄蕊数量的差异gydF4y2BaRhAGgydF4y2Ba-沉默的花朵和TRV控制表明,低温至少可以部分通过雄蕊向花瓣的同源性转换来调节花瓣数量,gydF4y2Ba通过gydF4y2Ba抑制表达gydF4y2BaRhAGgydF4y2Ba.最后,我们还发现了叶状器官的中心gydF4y2BaRhAGgydF4y2Ba-silenced花,正常形式的心脏。在TRV控制花中未观察到这种表型,并且类似于低温处理花的表型,进一步支持所提出的作用gydF4y2BaAG)gydF4y2Ba用于确定生殖器官的特性和VIGS实验的可靠性。gydF4y2Ba
我们还进行了gydF4y2Ba原位gydF4y2Ba杂交研究玫瑰花蕾,以确定表达模式gydF4y2BaRhAGgydF4y2Ba对低温生长的反应,并观察到在这种条件下gydF4y2BaRhAGgydF4y2Ba向花中心缩小的区域表示。空间表达模式的变化gydF4y2BaRhAGgydF4y2Ba对低温的反应可能促进重瓣花的形成,这已经被认为是玫瑰驯化过程中重瓣花选择的一个机制[gydF4y2Ba23gydF4y2Ba].gydF4y2Ba
由于花器官身份的测定需要在花卉发育过程中涉及多种花卉归属基因和其他调节因素,因此低温也可能影响其他型物质基因的表达,这可能有助于双花卉形成。参与该过程的其他基因的身份,尤其是与花瓣和雄蕊基金的组织相关的那些,是未来研究的一个有趣的主题。gydF4y2Ba
表观遗传DNA甲基化的参与gydF4y2BaRhAGgydF4y2Ba监管gydF4y2Ba
已经有充分的文献证明,表观遗传DNA甲基化涉及植物发育的许多方面,以及对内源性和外源性线索的响应[gydF4y2Ba31gydF4y2Ba,gydF4y2Ba44gydF4y2Ba- - - - - -gydF4y2Ba46gydF4y2Ba].在gydF4y2Ba答:芥gydF4y2Ba, DNA甲基化可能发生在植物的CG、CHG和CHH (H = A、C或T)环境中。一旦建立,CG和CHG的甲基化分别由MET1和CMT3维持,而CHH的甲基化需要建立gydF4y2Ba新创gydF4y2Ba通过DRM2和CMT2在每个细胞周期[gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba].对于基因表达,最重要的因素是DNA甲基化而不是DNA环境的区域。如果在某种基因的启动子区发生DNA甲基化,则无论是Cg,chg和chh甲基化还是两者,它会导致基因沉默。然而,基因体中的DNA高甲基化通常代表转录基因的特征[gydF4y2Ba47gydF4y2Ba,gydF4y2Ba49gydF4y2Ba- - - - - -gydF4y2Ba51gydF4y2Ba].在这里,我们报道了玫瑰启动子的DNA甲基化gydF4y2BaRhAGgydF4y2Ba的同系物gydF4y2Ba答:芥AG)gydF4y2Ba,受环境温度的调节。gydF4y2BaMCRBC.gydF4y2Ba和gydF4y2Ba豪gydF4y2Baiii -消化表明,在低温(15/5°C)下的生长导致了更重的甲基化gydF4y2BaRhAGgydF4y2Ba与在正常温度(25/15°C)下生长的植株相比。亚硫酸氢盐测序进一步表明CHH DNA的甲基化是由低温引起的。有趣的是,只有50%的CHH基因位点发生了甲基化,表明低温诱导的CHH甲基化具有位点特异性。引人注目的是,gydF4y2BaAG)gydF4y2Ba基因可能在反义-中被高甲基化gydF4y2BaMET1gydF4y2Ba转基因gydF4y2Ba答:芥gydF4y2Ba行。此外,检测区域的甲基化位点多为CHHgydF4y2BaMET1gydF4y2Ba被认为是CG基因座甲基化的原因[gydF4y2Ba32gydF4y2Ba].因此,表观遗传调控gydF4y2BaAG)gydF4y2Ba基因可能是一种保守途径。一般认为,基因启动子附近的DNA甲基化与基因表达的抑制相关[gydF4y2Ba47gydF4y2Ba,gydF4y2Ba49gydF4y2Ba- - - - - -gydF4y2Ba51gydF4y2Ba].在烟草中,冷应激活化基因表达gydF4y2BaNtGPDL通过gydF4y2Ba编码区DNA去甲基化的诱导[gydF4y2Ba52gydF4y2Ba].因此,我们的结果表明,环境温度触发了DNA甲基化状态的复杂变化gydF4y2BaRhAGgydF4y2Ba以保守的方式调节其表达水平。这些修改的性质和动态,以及可能的监管机构的识别,将是未来研究的主题。gydF4y2Ba
结论gydF4y2Ba
在目前的工作中,我们发现gydF4y2BaRhAGgydF4y2Ba,一个gydF4y2BaAG)gydF4y2Ba玫瑰的同源物,在环境温度依赖的方式调节花瓣数量。这是基于几个方面的证据。首先,低温处理通过促进雄蕊瓣化显著增加了玫瑰的花瓣数。第二,定量RT-PCR分析显示gydF4y2BaRhAGgydF4y2Ba与低温调控花的发育有关,而gydF4y2BaRhAGgydF4y2Ba通过增加花瓣状雄蕊的产生而导致花瓣数量的增加。第三,gydF4y2Ba原位gydF4y2Ba杂交研究表明,总体空间分布gydF4y2BaRhAGgydF4y2Ba在低温条件下,花芽转录因子明显降低。第四,DNA甲基化水平分析表明,低温处理提高了甲基化水平gydF4y2BaRhAGgydF4y2Ba通过亚硫酸氢盐测序,发现CHH基因座在低温条件下存在高甲基化的启动子区域。综上所述,我们的研究结果为环境温度调节花型的潜在机制提供了新的见解。我们证明低温可能减弱gydF4y2BaRhAGgydF4y2Ba表达至少部分通过增强DNA CHH的高甲基化gydF4y2BaRhAGgydF4y2Ba启动子。gydF4y2Ba
方法gydF4y2Ba
植物材料gydF4y2Ba
玫瑰(gydF4y2BaRosa HybridagydF4y2Ba)的简历。文德拉植物是在深圳职业技术学院的温室里种植的。玫瑰的花发育包括早期发育阶段[gydF4y2Ba23gydF4y2Ba]和开口阶段[gydF4y2Ba53gydF4y2Ba].我们将花发育的整个过程分为11个阶段:第1阶段,萼片原基的出现和发育;第二阶段,花瓣原基出现和发育;第3阶段,雄蕊原基出现和发育;第四阶段,心皮原基出现并拉长;第五阶段,花芽分化完全但花芽未开放;阶段6,芽部分开放;第7阶段,蓓蕾完全开放;阶段8和9,花部分开放;第10期,花完全开放,花药外观(黄色); and stage 11, flower is fully open with anther appearance (black).
花的低温处理gydF4y2Ba
2年生玫瑰植株在处理前进行统一修剪。所有植株随后在3个控制环境箱(Thermoline TPG-6000-TH)中栽培,昼夜温度为25/15°C(对照)、20/10°C和15/5°C。每次处理大约使用了30株植物。3个处理的光照/暗周期均为12/12 h,相对湿度为70 ~ 80%,处理温度为850 μmol mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba光强度。在20/10°C和15/5°C条件下,花芽分化完成后,将室内温度调至25/15°C的正常生长温度。gydF4y2Ba
花表型观察及花器官计数gydF4y2Ba
花发育6期后观察花的表型,7期计数花器官。每个处理随机抽取50朵花(每株只取1 ~ 2朵花),记录畸形玫瑰花的比例。每处理15朵花,共分4轮器官(萼片、花瓣、雄蕊和心皮)。花瓣/雄蕊嵌合体为花瓣。采用单因素方差分析或学生方差分析统计显著性gydF4y2BatgydF4y2Ba测试。gydF4y2Ba
RNA提取gydF4y2Ba
采用定量RT-PCR方法,分别在第1、2、3和4个阶段采集冷藏(15/5°C)或对照(25/15°C)条件下生长的植物花芽。全芽采收,液氮冷冻,−80°C保存。根据制造商的说明,使用Trizol试剂(Life technologies, Ohio, USA)提取总RNA。gydF4y2Ba
定量rt - pcrgydF4y2Ba
对于定量逆转录聚合酶链反应(quantitative RT-PCR),使用SuperScript™II RNase H逆转录酶(Invitrogen)从2 μg总RNA中合成互补dna (cdna)。以1 μl cDNA样品为模板,采用ABI PRISM®7500序列检测系统在标准模式下进行20 μl PCR反应,采用白金SYBR Green qPCR Supermix-UDG (Invitrogen公司)。所使用的引物在附加文件中列出gydF4y2Ba1gydF4y2BaS1:表。gydF4y2BaRhTCTPgydF4y2Ba用于内部控制。表达水平用相对标准曲线法归一化gydF4y2BaRhTCTPgydF4y2Ba.所有反应都进行了3个生物重复。gydF4y2Ba
RhAGgydF4y2Ba启动子隔离gydF4y2Ba
5 '上游序列的分离,包括启动子和5 ' UTRgydF4y2BaRhAGgydF4y2Ba,同Liu和Chen一样进行hi-TAIL PCR [gydF4y2Ba54gydF4y2Ba].gydF4y2Ba
RhAGgydF4y2Ba沉默在玫瑰花丛中gydF4y2Ba
由于原始TRV载体在玫瑰植株中的效率相对较低,我们采用改良的gfp标记TRV- gfp体系进行了VIGS实验[gydF4y2Ba55gydF4y2Ba].沉默gydF4y2BaRhAGgydF4y2Ba在玫瑰如先前一些修改[描述进行鲜花通过VIGSgydF4y2Ba55gydF4y2Ba,gydF4y2Ba56gydF4y2Ba].沉默的gydF4y2BaRhAGgydF4y2Ba,在3 ' UTR处选择一个332-bp的片段插入到pTRV2载体中。将3月龄月季植株浸泡在菌悬液中,在0.9 atm的真空条件下进行真空渗透。然后在23/18°C的MS液体培养基中洗涤培养。在25/15°C,相对湿度70- 80%,850 μmol m的控制环境箱中生长gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba光照强度,光照周期为12/12小时。花芽萌发时,通过检测GFP荧光对3期芽进行预筛选,对阳性芽进行RNA提取。的表达水平gydF4y2BaRhAGgydF4y2Ba通过定量RT-PCR检测,并观察所选植株的花表型。gydF4y2Ba
原位gydF4y2Ba杂交gydF4y2Ba
组织固定和gydF4y2Ba原位gydF4y2Ba杂交是像Zhang等人一样进行的[gydF4y2Ba57gydF4y2Ba, Ma等人[gydF4y2Ba56gydF4y2Ba]和Dubois等。[gydF4y2Ba23gydF4y2Ba].合成gydF4y2Ba原位gydF4y2Ba利用含有T7和SP6 RNA聚合酶结合位点的基因特异性引物对cDNA进行PCR扩增[gydF4y2Ba56gydF4y2Ba].用T7 RNA聚合酶生成反义探针,用SP6 RNA聚合酶生成义探针。引物对在附加文件中列出gydF4y2Ba1gydF4y2BaS1:表。gydF4y2Ba
印章-PCR和硫酸氢盐测序PCRgydF4y2Ba
DNA甲基化状态是通过斩波-PCR和硫酸氢盐测序[分析gydF4y2Ba33gydF4y2Ba].对于Chop-PCR,基因组DNA (500 ng)用甲基化敏感限制性内切酶酶切gydF4y2Ba豪gydF4y2BaIII或甲基化DNA消化酶gydF4y2BaMCRBC.gydF4y2Ba3小时。消化的DNA用作模板以扩增gydF4y2BaRhAGgydF4y2Ba扩增启动子和未消化基因组DNA作为对照。用于亚硫酸氢盐测序的引物由MethPrimer (gydF4y2Bahttp://www.urogene.org/cgi-bin/methprimer/methprimer.cgigydF4y2Ba)[gydF4y2Ba34gydF4y2Ba].基因组DNA从10个在常温(25/15°C)和低温(15/5°C)条件下生长的花蕾池中分离出来,然后根据制造商的说明,使用EZ DNA甲基化-金试剂盒(Zymo Research, Orange, CA, USA)进行亚硫酸氢盐处理。对于每个处理,随机选择17个克隆并进行测序。使用ClustalW服务器(gydF4y2Bahttp://www.ch.embnet.org/software/ClustalW.htmlgydF4y2Ba),然后使用CyMATE程序进行分析(gydF4y2Bahttp://cymate.org/cymate.htmlgydF4y2Ba)[gydF4y2Ba58gydF4y2Ba].gydF4y2Ba
可获得的支持数据gydF4y2Ba
完整的编码序列和启动子gydF4y2BaRhAGgydF4y2Ba可在NCBI下分别登录号U43372和BankIt1849645 SEQ1 KT429820。gydF4y2Ba
缩写gydF4y2Ba
- 美联社gydF4y2Ba:gydF4y2Ba
-
APETALAgydF4y2Ba
- πgydF4y2Ba:gydF4y2Ba
-
PISTILLATAgydF4y2Ba
- AG)gydF4y2Ba:gydF4y2Ba
-
无性生殖的gydF4y2Ba
- 9月gydF4y2Ba:gydF4y2Ba
-
SEPALLATAgydF4y2Ba
- 中收取:gydF4y2Ba
-
病毒诱导基因沉默gydF4y2Ba
- 定量rt - pcr:gydF4y2Ba
-
定量逆转录酶聚合酶链反应gydF4y2Ba
- 的互补:gydF4y2Ba
-
互补dnagydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
陈志强,王志强,王志强,等。拟南芥花同源性基因间的遗传相互作用。发展。1991;112:1-20。gydF4y2Ba
- 2.gydF4y2Ba
王志强,王志强。花发育的遗传调控。植物学报。大自然。1991;353:31-7。gydF4y2Ba
- 3.gydF4y2Ba
MADS-box蛋白复合物足以将叶子转化为花器官。大自然。2001;409:525-9。gydF4y2Ba
- 4.gydF4y2Ba
Pelaz S, Ditta GS, Baumann E, Wisman E, Yanofsky MF。B和C花器官识别功能的要求gydF4y2BaSEPALLATAgydF4y2BaMADS-box基因。大自然。2000;405:200-3。gydF4y2Ba
- 5.gydF4y2Ba
Ditta G, Pinyopich A, Robles P, Pelaz S, Yanofsky MF。的gydF4y2BaSEP4gydF4y2Ba基因的gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba花器官和分生组织的功能。咕咕叫医学杂志。2004;14:1935-40。gydF4y2Ba
- 6.gydF4y2Ba
花器官身份的发展:来自MADS房子的故事。植物学报2001;4:75-85。gydF4y2Ba
- 7.gydF4y2Ba
植物生物学:花的四重奏。大自然。2001;409:469 - 71。gydF4y2Ba
- 8.gydF4y2Ba
“花艺四重奏”的重建gydF4y2Ba在体外gydF4y2Ba涉及B类和E类花同源性蛋白。核酸Res. 2009; 37:2723-36。gydF4y2Ba
- 9.gydF4y2Ba
Galimba KD, Tolkin TR, Sullivan AM, Melzer R, the ßen G, Di Stilio VS.一个重花ranuncullid突变体中深度保守的C类花同源基因功能和C-和e-类蛋白相互作用的丢失。中国科学技术大学学报(自然科学版)2012;109:E2267-75。gydF4y2Ba
- 10.gydF4y2Ba
李志刚,李志刚。拟南芥花发育调控基因的研究进展。植物细胞。1989;1:37-52。gydF4y2Ba
- 11.gydF4y2Ba
花发展的ABC模型:过去和现在。发展。2012;139:4095-8。gydF4y2Ba
- 12.gydF4y2Ba
陈志强,王志强,王志强。花器官同源性基因的异位表达gydF4y2Ba无性生殖的gydF4y2Ba在转基因拟南芥中改变花器官的特性。细胞。1992;71:119-31。gydF4y2Ba
- 13.gydF4y2Ba
马海峰,马建军。拟南芥花分生组织鉴定方法的研究。植物细胞。1997;9:393 - 408。gydF4y2Ba
- 14.gydF4y2Ba
陈志强,王志强。花器官同源性基因的遗传多样性。细胞。1994;78:203-9。gydF4y2Ba
- 15.gydF4y2Ba
王志强,王志强,王志强,等gydF4y2BaAPETALA2gydF4y2Ba,miR172和gydF4y2Ba无性生殖的gydF4y2Ba用ABC模式进行花卉开发。发展。2010;137:3633-42。gydF4y2Ba
- 16.gydF4y2Ba
二倍体玫瑰重要形态和生理性状的遗传分析。Gartenbauwissenschaft。1999;64:14-20。gydF4y2Ba
- 17.gydF4y2Ba
张德华,张德华,张德华,等。基于AFLP的月季表型性状定位研究。Theor Appl Genet. 2002; 105:1207-14。gydF4y2Ba
- 18.gydF4y2Ba
Spiller M,Linde M,Hibrand-Saint Oyant L,Tsai Cj,Byrne DH,Smulders MJ,等。朝着二倍体玫瑰的统一遗传地图。Al Appl Genet。2011; 122:489-500。gydF4y2Ba
- 19.gydF4y2Ba
基于微卫星标记构建的月季遗传连锁图谱及其QTL定位。树木基因组。2008;4:11-23。gydF4y2Ba
- 20.gydF4y2Ba
Remay A, Lalanne D, Thouroude T, Le Couviour F, hiant - saint Oyant L, Foucher F.开花基因的研究揭示了赤霉素在玫瑰成花调控中的作用。Theor Appl Genet. 2009; 119:767-81。gydF4y2Ba
- 21.gydF4y2Ba
wang - bocoiran CFS, Gitonga VW, Yan Z, Dolstra O, van der Linden CG, van der Schoot J, et al.;四倍体切花玫瑰的遗传模式。Theor Appl Genet. 2012; 125:591-607。gydF4y2Ba
- 22.gydF4y2Ba
李志刚,李志刚,李志刚,等。蔷薇花起始发育的遗传与基因组学研究。J Exp Bot. 2013; 64:847-57。gydF4y2Ba
- 23.gydF4y2Ba
杜波依斯A, Raymond O, Maene M, Baudino S, Langlade NB, Boltz V,等。对c功能的修补:栽培玫瑰中选择双瓣花的分子框架。《公共科学图书馆•综合》。2010;5:e9288。gydF4y2Ba
- 24.gydF4y2Ba
加罗德JF,哈里斯GP。研究温室康乃馨:对花瓣数量的温度和生长物质的影响。安博特。1974; 38:1025至1031年。gydF4y2Ba
- 25.gydF4y2Ba
王志强,王志强,王志强,等。通过转录和激素调节花瓣和雄蕊发育gydF4y2BaSTAMENLESSgydF4y2Ba,西红柿(gydF4y2Ba番茄gydF4y2Bal)类似于b级gydF4y2BaAPETALA3gydF4y2Ba基因。J Exp Bot。2014; 65:2243-56。gydF4y2Ba
- 26。gydF4y2Ba
Wellmer F, Graciet E, Riechmann JL。中花器官规范gydF4y2Ba拟南芥gydF4y2Ba.J Exp Bot. 2014; 65:1-9。gydF4y2Ba
- 27。gydF4y2Ba
王志强,王志强,王志强,等。温度对月季花器官叶状细胞分裂素表达和细胞分裂素含量的影响。《植物生长规律》2001;35:207-14。gydF4y2Ba
- 28。gydF4y2Ba
Zieslin N, Moe R. Rosa。出自:Halevy AH,编辑。开花手册IV. CRC出版社:Boca Raton,美国;1985.214 - 25页。gydF4y2Ba
- 29。gydF4y2Ba
黄志强,王志强。白玫瑰花瓣发黑畸形的发育及原因。Acta Hortic。1969;15:149-56。gydF4y2Ba
- 30.gydF4y2Ba
成花玫瑰植物Zieslin N.调节:重新评估。Scientia Horti。1992年; 49:305-10。gydF4y2Ba
- 31。gydF4y2Ba
朱家杰。植物胁迫反应的表观遗传调控。植物生态学报。2009;12:133-9。gydF4y2Ba
- 32.gydF4y2Ba
王志强,王志强,王志强,等。拟南芥花特异基因的异位超甲基化。咕咕叫医学杂志。2000;10:179 - 86。gydF4y2Ba
- 33.gydF4y2Ba
何晓军,徐玉峰,朱胜,等。拟南芥中rna导向的DNA甲基化效应是ARGONAUTE 4和rna结合蛋白。细胞。2009;137:498 - 508。gydF4y2Ba
- 34.gydF4y2Ba
Li LC, Dahiya R. MethPrimer: methylation pcr引物的设计。生物信息学。2002;18:1427-31。gydF4y2Ba
- 35.gydF4y2Ba
Cockshull KE, Hand DW, Langton FA。白天和夜间温度对菊花开花和发育的影响。Acta长的矮。1981;125:101-10。gydF4y2Ba
- 36.gydF4y2Ba
申HK,就伏JH,金SH。温度对叶面积和花大小玫瑰。ACTA园艺。2001; 547:185-91。gydF4y2Ba
- 37.gydF4y2Ba
Lucidos JG, Ryu KB, Younis A, Kim CK, Hwang YJ, Son BG,等。不同的昼夜温度响应gydF4y2Ba百合hansoniigydF4y2Ba与生长和花的发育有关。Hortic Environ Biote. 2013; 54:405-11。gydF4y2Ba
- 38.gydF4y2Ba
Holley WD, Baker R. Carnation production。迪比克,爱荷华州:Wm。c·布朗;1963.gydF4y2Ba
- 39.gydF4y2Ba
影响玫瑰花败育和畸形的因素。杂志。1971;24:291 - 300。gydF4y2Ba
- 40.gydF4y2Ba
杨志强,王志强,王志强,等gydF4y2Ba罗莎gydF4y2BaxgydF4y2Ba矮牵牛gydF4y2Ba简历。砧木、花位、生长调节剂和季节的影响。J Exp Bot. 1992; 43:89-93。gydF4y2Ba
- 41.gydF4y2Ba
关键词:水稻,基因复制,功能进化,遗传多样性gydF4y2Ba无性生殖的gydF4y2Ba被子植物MADS盒基因亚家族。遗传学。2004;166:1011-23。gydF4y2Ba
- 42.gydF4y2Ba
Ó ' Maoiléidigh DS, Wuest SE, Rae L, Raganelli A, Ryan PT, Kwaśniewska K,等。生殖花器官鉴定规范的控制gydF4y2Ba拟南芥gydF4y2Ba由C功能调节剂AGAMOUS控制。植物细胞。2013;25:2482 - 503。gydF4y2Ba
- 43.gydF4y2Ba
病毒诱导的基因沉默作为比较功能研究的工具gydF4y2BaThalictrumgydF4y2Ba.《公共科学图书馆•综合》。2010;5:e12064。gydF4y2Ba
- 44.gydF4y2Ba
冯S,SE雅各布森。在植物表观遗传学修饰:进化的角度来看。CurrOp植物BIOL。2011; 14:179-86。gydF4y2Ba
- 45.gydF4y2Ba
他G,埃林AA,邓小平XW。表观基因组与植物发育。acta botanica yunnanica(云南植物研究)2011;62:411-35。gydF4y2Ba
- 46.gydF4y2Ba
Mirouze男,强调适应Paszkowski J.表观遗传学贡献植物。CurrOp植物BIOL。2011; 14:267-74。gydF4y2Ba
- 47.gydF4y2Ba
Law JA, Jacobsen SE。建立,维持和修改动植物DNA甲基化模式。Nat Rev Genet. 2010; 11:204-20。gydF4y2Ba
- 48.gydF4y2Ba
陈志强,陈志强,陈志强,等。拟南芥核小体重组体DDM1允许DNA甲基转移酶访问含有h1的异染色质。细胞。2013;153:193 - 205。gydF4y2Ba
- 49.gydF4y2Ba
琼斯PA。DNA甲基化的功能:岛屿,起始位点,基因机构和超越。自然遗传学牧师。2012; 13:484-92。gydF4y2Ba
- 50.gydF4y2Ba
DNA甲基化景观:来自表观基因组学的发人深思的见解。Nat Rev Genet, 2008; 9:465-76。gydF4y2Ba
- 51。gydF4y2Ba
陈swl, Henderson IR, Jacobsen SE。园艺基因组:DNA甲基化gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba.Nat Rev Genet 2005; 6:351-60。gydF4y2Ba
- 52。gydF4y2Ba
彩CS,佐野H.非生物胁迫诱导去甲基化和编码glycerophosphodiesterase样在烟草植物中的蛋白质的基因的转录激活。分子遗传学基因组。2007; 277:589-600。gydF4y2Ba
- 53。gydF4y2Ba
马楠,蔡林,卢文杰,谭华,高金平。外源乙烯影响切花玫瑰开花(gydF4y2BaRosa HybridagydF4y2Ba),通过调控编码乙烯生物合成酶的基因。中国科学C辑:生命科学,2005;48:434-44。gydF4y2Ba
- 54。gydF4y2Ba
刘玉刚,陈玉玲。高效热不对称交叉PCR扩增未知侧翼序列。生物学技术。2007;43:649-56。gydF4y2Ba
- 55。gydF4y2Ba
田军,裴海霞,张胜,陈建伟,陈伟,杨瑞英,等。TRV-GFP:一种改进的烟草嘎嘎病毒载体,用于高效和可视化的基因功能分析。J Exp Bot. 2014; 65:311-22。gydF4y2Ba
- 56。gydF4y2Ba
马楠,薛建强,李玉华,刘晓军,戴富武,贾文伟,等。gydF4y2BaRH-PIP2; 1gydF4y2Ba是一种玫瑰水通道蛋白基因,参与乙烯调控的花瓣扩张。植物杂志。2008;148:894 - 907。gydF4y2Ba
- 57.gydF4y2Ba
张晓东,马迪,张晓东,等。激光显微解剖窄鞘突变玉米发现新的基因表达在茎尖分生组织。公共科学图书馆麝猫。2007;3:e101。gydF4y2Ba
- 58.gydF4y2Ba
Hetzl J, Foerster AM, Raidl G, Scheid OM。CyMATE:亚硫酸氢盐测序后植物基因组DNA甲基化分析的新工具。植物j . 2007; 51:526-36。gydF4y2Ba
致谢gydF4y2Ba
我们感谢张晓兰博士(中国农业大学)的慷慨帮助gydF4y2Ba原位gydF4y2Ba杂交和优秀的建议。感谢PlantScribe (gydF4y2Bawww.plantscribe.comgydF4y2Ba)编辑稿子我们。gydF4y2Ba
资金gydF4y2Ba
广东省深圳市科技创新计划项目(no . 2113 K3070053);广东省自然科学基金项目(no . s20120100009479);国家自然科学基金项目(no . 31401914)。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
相应的作者gydF4y2Ba
额外的信息gydF4y2Ba
相互竞争的利益gydF4y2Ba
两位作者宣称他们没有相互竞争的利益。gydF4y2Ba
作者的贡献gydF4y2Ba
NM和YL构思并设计了本研究。TF和YT进行了基因表达研究、低温处理和表型分析gydF4y2Ba原位gydF4y2Ba杂化。WC参与实验设计,分析数据,起草手稿。深圳参加gydF4y2BaRhAGgydF4y2Ba启动子隔离和gydF4y2BaRhAGgydF4y2Ba沉默在玫瑰花丛中。NM进行了Chop-PCR和亚硫酸氢盐测序PCR。DZ参与了研究的设计、统计分析和论文撰写。所有作者阅读并批准了最终的手稿。gydF4y2Ba
作者的信息gydF4y2Ba
不适用gydF4y2Ba
数据和材料的可用性gydF4y2Ba
不适用gydF4y2Ba
马南、陈文文对这项工作贡献相当。gydF4y2Ba
额外的文件gydF4y2Ba
附加文件1:图S1。gydF4y2Ba
低温对不同花期花径的影响数据代表5次重复的平均值±SD。RT,常规温度(25/15°C;白天/晚上);低温(15/5°C;白天/晚上)。gydF4y2Ba图S2。gydF4y2Ba在不同温度条件下生长的蔷薇畸形花的比例。将两株一年生植株统一修剪,并暴露在25/15°C(对照,左)、20/10°C(中间)或15/5°C(右)的昼夜温度条件下。对于在低温条件下生长的植物,一旦芽分化完成,温度就恢复到正常生长温度。花在第7阶段时,记录畸形玫瑰花的比例(gydF4y2BangydF4y2Ba= 50)。gydF4y2Ba图S3。gydF4y2Ba沉默的gydF4y2BaRhAGgydF4y2Ba基因引起雌蕊向萼片状器官的转化。上面板,gydF4y2BaRhAGgydF4y2Ba-沉默和TRV控制没有花瓣的花。萼片样雌蕊,正常雌蕊。中部和底部面板,萼片状的雌蕊gydF4y2BaRhAGgydF4y2Ba沉默的花。比例尺,10毫米在顶部面板;中间板左10毫米,右5毫米;底部面板10mm。gydF4y2Ba图S4。gydF4y2Ba示意图gydF4y2BaRhAGgydF4y2Ba基因结构。线代表内含子,黑盒子代表外显子。起始密码子的第一对碱基对定义为0。的numbers indicate the 3’ ends of the DNA fragment. Bp, base pair.图S5。gydF4y2BaCG, CHG和CHH甲基化的百分比gydF4y2BaRhAGgydF4y2Ba启动子。CG (A)、CHG (B)和CHH (C)甲基化的百分比通过亚硫酸氢盐测序分析gydF4y2BaRhAGgydF4y2Ba启动子,利用从指示温度下生长的花蕾中提取的基因组DNA。每个处理分析17个克隆。gydF4y2Ba表S1。gydF4y2Ba寡核苷酸引物序列。(PDF 645 KB)gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)除非另有说明,否则适用于本文中提供的数据。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
马楠,陈伟,范涛。gydF4y2Baet al。gydF4y2Ba低温诱导的DNA高甲基化减弱gydF4y2BaRhAGgydF4y2Ba,一个gydF4y2Ba无性生殖的gydF4y2Ba和增加玫瑰的花瓣数(gydF4y2BaRosa HybridagydF4y2Ba).gydF4y2BaBMC植物杂志gydF4y2Ba15,gydF4y2Ba237(2015)。https://doi.org/10.1186/s12870-015-0623-1gydF4y2Ba
已收到gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-015-0623-1gydF4y2Ba
关键字gydF4y2Ba
- Rosa HybridagydF4y2Ba
- 低的温度gydF4y2Ba
- 花朵图案gydF4y2Ba
- RhAGgydF4y2Ba
- DNA甲基化gydF4y2Ba