摘要
背景
可有可无的玉米玉蜀黍L。B染色体是高度异色的,广泛认为缺乏功能基因。低拷贝B染色体虽然没有引起明显的表型变异,但其存在可能会影响A基因组基因的表达。B染色体是由标准染色体进化而来的;因此,它们可能含有与A染色体序列同源的基因区域。
结果
我们的数据表明,玉米B染色体会影响A-基因组转录,其具有与B染色体拷贝数的增加相关的更强的效果。相比之下,检测到总,检测到不同表达的基因,而没有B染色体线。这些差异表达基因主要参与细胞代谢和核苷酸结合。使用起动器+ B,我们扩增了与A基因组基因的高序列相似性的十个染色体基因座。荧光原位杂交(鱼类)证实,至少4〜5 kB大小基因位于B染色体上。此外,通过新创将未定位到玉米B73参考基因组的reads进行组装,并进行PCR验证,发现3个b -定位的LTR;其中3.2 kb的comp75688以b剂量依赖的方式表达。
结论
我们发现,在玉米B染色体存在的情况下,A基因组基因的转录发生了改变,其中B染色体数目的增加对A基因组基因转录的影响更大。B染色体上的转录活性基因与A基因组同源物具有高度的相似性,B染色体上的反转录转座子与A基因组序列也具有部分同源性。我们的数据进一步阐明了玉米B染色体的基因组结构和进化。
背景
B染色体是不需要对生物体的正常生长和发育不必要的超值。他们已被记录在来自真菌的各种物种中,以更高的真核生物,包括植物和动物[1].B染色体之所以被称为自私染色体,是因为它们的存在并不会给寄主带来任何明显的优势,也不会与A染色体配对或重组,并以非孟德尔方式积累[2].玉米B染色体的研究已经进行了几十年。它是一个高度异色染色体,有一个中心异染色质和长臂上的四个异色块[3.- - - - - -5],以及近端和远端缓和色区[6].这个超数染色体只出现在一些玉米品种,这表明B染色体的维护不是通过健身选择,但通过积累机制在第二个花粉有丝分裂不分离和优惠受精的卵子的精子含有B染色体(7,8].有几个区域控制着不分离特征,包括远端着色端[6],近埃克罗马汀的遗址[9,它的着丝粒和中心点[10,11].
假设b的起源来自同一或相关物种的标准A染色体[12].研究犬科动物鉴定出家犬与野生犬B染色体共杂的几个染色体区域[13].最近,利用下一代测序技术发现鱼类的B染色体Astatolilapia latifasciata和阿斯蒂阿纳克斯paranae[14,15]来源于多个a。黑麦B染色体序列分析表明,B染色体来源于3R和7R染色体;然后在独立进化过程中积累了大量特定的重复元素和细胞器序列插入[16].在玉米上也得到了类似的结果。研究人员发现B特异性重复ZmBs与Cent4(染色体4的着丝粒特异性重复)同源[17,18,提出了4号染色体的着丝粒可能是B染色体着丝粒的供体的可能性。Cheng和Lin对B染色体进行了显微解剖,克隆了19个B染色体序列,其中只有一个是B特异的CL-repeat,其余的同时存在于A和B染色体上[19].最近,利用随机扩增多态性DNA (RAPD)技术,在A和B染色体上发现了4个短重复序列[20.].然而,B染色体特异性重复序列的起源仍难以揭示。
人们普遍认为B染色体是高度异色的,不是必需的,因为它们不携带任何植物发育所必需的基因[2,21].然而,B染色体不是基因上惰性的。玉米B染色体的存在改变了染色体的重组频率[22],导致剥叶[23并降低生育力和活力,当存在多个副本时[24].更多的证据支持B染色体的转录特性。在蚱蜢体内发现了b衍生的rRNA转录本Eyprepocnemis plorans[25,26)和植物Crepis capillaris[27].慈鲷B染色体上的部分基因答:latifasciata在很大程度上是完整的,但是证实了三种细胞周期相关基因的表达[15].在该真菌中还发现了B染色体上的蛋白质编码基因Nectria Haematoccca.[28]和西伯利亚罗伊鹿Capreolus pygergus.[29].在黑麦中,B染色体上的部分假基因样片段被转录,B染色体的存在影响了a基因组基因的转录[30.].在玉米中,StarkB是一个大的DNA重复元件,由与a基因组同源的片段和b特异性序列组成,通过Northern Blotting和RT-PCR证实了该部分具有转录活性[31].两个B染色体定位的RAPD片段,与逆转录转座子Grande1和GrandeB同源,也被转录[20.].在另一项研究中,研究人员通过cDNA-AFLP (cdna amplified fragment length polymorphism, cdna扩增片段长度多态性)方法测定了4个b相关短转录本(平均~200 bp) [32[两者,其中两种表明B特异性转录和其他两个在有或没有B染色体的组织中转录。目前的证据表明,玉米B染色体是转录活性的,B染色体的存在可能对A-基因组基因表达产生负面影响[32].然而,由于cDNA-AFLP方法的限制,它们未能提供关于B染色体对A-基因组基因转录的基因组影响的细节,尤其是在具有或没有B的线征中表达的基因的表达水平变化染色体,更不用说差异表达基因的功能。此外,尚不清楚短转录物是否是蛋白质编码基因的一部分。此外,到目前为止,玉米B染色体上揭示了很少的可辨别基因。
本研究应用RNA-seq分析了B染色体不同拷贝数(B73 + 0B、B73 + 1B和B73 + 6b)玉米的转录组。我们发现a基因组基因的表达确实在B染色体存在的情况下受到影响,B染色体越多影响越大。利用含有玉米B染色体的燕麦-玉米添加系扩增了4个基因,每个基因长度约为5 kb。与a同源性相比,这4个基因获得了多个SNPs或插入/缺失,并通过FISH检测确定了它们在B染色体上的位置。由于没有B染色体的参考基因组序列,我们使用新创未映射(玉米B73参考基因组)组装读取以识别推定的B衍生的转录物,然后通过玉米和燕麦玉米添加管线验证它们的来源,或者没有 - B染色体。我们成功识别了三个位的LTR序列,一个484bp Comp30393,其染色体同源性具有几种SNP,1,633bp Comp7447和3.2 kB Comp75688,即B染色体特定序列。特别是,Comp75688显示B剂依赖性表达,B73 + 6Bs中的表达水平在B73 + 1B组织中的六倍倍。我们的结果揭示了基因组结构和玉米B染色体的演变。
结果
生成RNA-SEQ图书馆
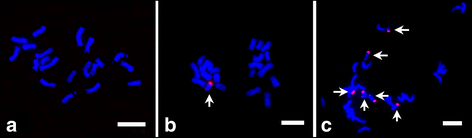
为了研究玉米B染色体的转录和B染色体对玉米a基因组表达的影响,我们以不同数量B染色体的玉米幼苗为材料,构建了14天幼叶的RNA-seq文库。含有B染色体的B73自交系为自花传粉系,由于B染色体的独特传代作用,其后代中B染色体的数量有所不同。我们使用荧光原位以玉米B特异重复序列ZmBs为探针进行杂交(FISH),测定玉米B染色体的数量。如图所示。1, B73 + 0B细胞含有20条染色体(2n = 2x = 20), B73 + 1B细胞含有21条染色体,其中有一条B染色体(2n = 2x = 20 + 1B,图2)。1 b),在B73 + 6Bs植物中有6条B染色体(图。1 c, 2n = 2x = 20 + 6B)。
然后,我们筛选了两批幼苗。每批选取9株带- b /不带- b的幼苗,在相同生长条件(28℃d 16 h, 20℃d 8 h)的光照室内培养,提取RNA。利用14天嫩叶的mRNA构建了101 bp的对端RNA-seq文库。第一批有4个RNA-seq文库,1个为B73 + 6Bs (6B_1), 1个为B73 + 1B (1B_1), 2个无B染色体的RNA-seq文库(0B_1和0B_2);第二批为1个0B (0B_3), 2个B73 + 1B (1B_2和1B_3), 2个B73 + 6Bs (6B_2和6B_3)。总而言之,我们得到了0、1、6条B染色体的三组数据,每组3个样本。
B染色体的存在影响a基因组基因的表达
这9个RNA-seq文库有36,491,110到97,545,922个reads,其中至少有28,279,554个reads与参考序列唯一对齐(附加文件1:表S1)。Spearman和Pearson相关性都表明每个组中的三个库表现出很大的相关性(附加文件2:表S2)。最弱的相关性是从Batch1和0b_3的0b_2之间,来自Batch2(> 0.91),B73 + 6bs组中的三个重复具有最高的相关性(> 0.95)。
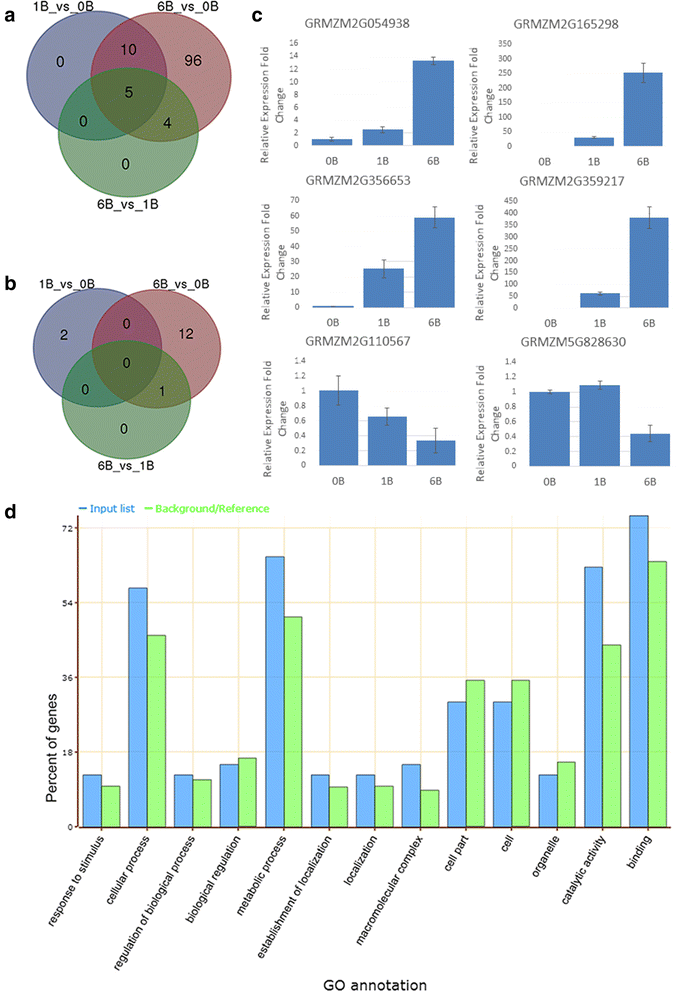
为了研究A基因组在B染色体存在下的表达变化,我们比较了玉米品系B73的转录组和B染色体不存在的转录组。考虑到批效应,我们分别分析了4个和5个批次样品的基因表达水平。差异表达基因(logFC≥3.0)的数量在两批之间存在差异(附加文件)3.:图S1),可能是由于环境差异。因此,我们拔出两批中鉴定的差异表达基因。在130个差异表达基因中,上调115(图。2额外的文件4)仅下调15个基因(图。2 b额外的文件4).115个上调基因中,15个在B73 + 1B与B73 + 0B比较中上调,9个在B73 + 6b与B73 + 1B比较中上调,均属于B73 + 6b与B73 + 0B比较。同时进行实时PCR验证(图。2摄氏度).在B染色体存在时,只有少数基因下调,其中6B与0B比较中有13个基因下调,1B与0B比较中有2个基因下调(图2)。2 b).我们的研究结果表明,尽管差异表达基因数量有限,但B染色体的存在确实会影响A基因组基因的表达,而且B染色体越多影响越大。
我们应用了AgriGO [33(网站http://bioinfo.cau.edu.cn/agriGO/)对含有B染色体的植物中调节的基因进行功能分析(附加文件4).在生物过程中,最重要的术语是细胞过程和代谢过程,而在分子功能范畴中,催化活性和结合项更为重要(图)。二维).在12个氧化石墨烯周期中,+ B叶片比0B叶片中上调的基因显著富集(表2)1)包括水解酶活性,大多数基因参与核糖核苷酸和脱氧核糖核苷酸结合。上调基因多与基础代谢有关。
位于b染色体上的伪基因与A染色体上的伪基因高度相似
由于上调基因比下调基因多,特别是在6B文库中,我们询问是否有上调基因也从B染色体表达。然而,通过序列分析很难区分那些同时位于A和B染色体上的基因。幸运的是,一个带有Starter line背景的玉米B染色体的燕麦-玉米添加(OMA)系,对于在陌生背景下复杂的复制玉米基因组的遗传学研究是一个有价值的工具[34],使之成为可能(附加文件5:图S2)。
首先,我们选择13条上调率最高的A基因组基因序列进行引物设计,然后以B73 + 0B、B73 + 1B、Starter和Starter + B为模板进行扩增。共10个基因的11对引物在含有玉米B染色体的OMA系(以下简称Starter + B)中得到扩增,但在OMA背景系Starter中没有扩增产物。GRMZM2G702253-2 F/2R在Starter + B中生成了三个不同大小的波段。除最小的一条从Starter基因组中扩增出来外,其余两条可能是从B染色体中扩增出来的。另外10对由9个A染色体基因设计的引物得到了与A基因组相同大小的扩增(附加文件)6:图S3),所以它们可能位于B染色体上。来自三种基因的其余4对引物在起动器和起动器+ B中没有扩增,这可能是由于它们在B染色体上的不存在或引物位点上的序列变化。我们测序从起动器+ B中扩增的PCR产物,然后对B73基因组进行喷射(附加文件7:表S3;额外的文件8).在12个b定位片段中,有11个片段与设计引物的a基因组同源基因的比对结果最好,而GRMZM2G165298_2与AF466202.2_FG007的比对结果最好,AF466202.2_FG007与GRMZM2G165298序列相似性较高。由于所有这些基因在a基因组中都有许多副同源基因,我们以B73 + 1B gDNA为模板,利用特异性引物扩增这4个基因的区域,该区域应该同时扩增a基因组和b基因组基因。正如预期的那样,B73 + 1B的测序图在SNP位点或在核苷酸缺失位点附近的上游/下游出现双峰,证实这些基因都是A-和b -定位的(Additional file)9:图S4)。
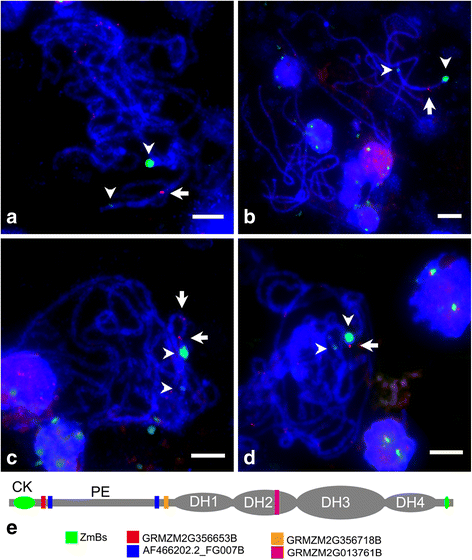
此外,我们生成了四个b定位基因的全长(附加文件8)起动器+ B并克隆到质粒上进行测序和鱼测定。我们对玉米参考基因组的四个序列爆发,并根据最同源的A-基因组基因指定为GRMZM2G013761B,GRMZM2G356718B,AF466202.2_FG007B和GRMZM2G356653B。如表所示2,虽然每个基因与其A同源物高度相似,但A和B染色体基因之间也存在插入/删除和SNPs(附加文件10).基于a -基因组基因预测其编码序列。AF466202.2_FG007B的编码区没有变化,GRMZM2G356653B的非保守区只有一个氨基酸取代;预测蛋白GRMZM2G356718B具有包括保守结构域在内的多个氨基酸替换;而GRMZM2G013761B的SNPs和InDels发生了剧烈的变化,可能导致帧移位和过早终止密码子,并可能成为无功能的伪基因。为了检测这些b定位基因是否被转录,我们在严格的参数设置下应用Tophat2.0包,以4个b定位基因序列作为参考。我们确实发现了在编码区域中映射到B特异性SNP位点的reads,具有100%的一致性,表明它们是从B染色体转录的(附加文件)11).
然后,我们在B73 + 1B噬菌体染色体上用四个B位基因作为探针鱼。如图所示。3.,在第二远端异染色质(DH2)区出现明显的GRMZM2G013761B信号(图2)。3), GRMZM2G356718B位于DH1侧近端着色区(PE)(图1)。3 b),AF466202.2_FG007B在焦化旋钮和DH1侧附近的PE区域上有两个基因座(图。3 c), GRMZM2G356653B位于靠近着丝粒旋钮的PE区域(图。3 d).这四个基因的相对位置在图2中示出。3 e.显然,在A染色体上有信号可能是它们的A同源或副同源基因的位置。综上所述,我们的测序和FISH结果证实了玉米B染色体上有转录活性基因,它们与A染色体上的对应基因高度相似。
三个转录本来自B染色体特异性位点
除了在B染色体上进行一些同源基因的位置,我们问:是否有任何成绩单是B染色体?由于A-和B基因组的高度相似,即使它们实际从B染色体转录也难以区分读取。到目前为止,没有玉米B染色体的参考序列。考虑到撬开玉米B染色体的独特转录,我们利用三位一体,一个强大的工具,在没有引用的情况下组装全长成绩单[35], 为了新创程序集使用未映射的只读。虽然我们使用的玉米材料是背景为B73的近自交系(NILs),但仍有一些B73 + 0B转录本无法被定位到B73参考基因组。为了消除带有和不带有B染色体的植物共享的转录本的干扰,我们从所有9个样本中收集了未映射的reads新创组装。该组件将产生更完整的成绩单,属于含有B染色体组。结果,通过读取支持49个组装基因和73个同种型基因,我们进一步验证了这些候选者。
利用NCBI nr数据库对49个基因和73个亚型基因序列进行了blast分析。总共有31个基因/亚型基因没有或只有部分命中,它们被认为是b特异性转录本的候选基因。PCR实验进一步证实候选基因实际上是b定位的。我们设计了PCR引物对,其中至少有一条引物位于nr数据库中未命中的区域,扩增了含有和不含有B染色体的玉米NILs、燕麦系Starter和Stater + B的基因组DNA。在Starter + B中扩增出3个片段(comp75688_c6_seq20、comp30393_c0_seq1和comp74447_c2_seq14),但在Starter中未扩增出12图S5A, S5C和S5D),因此它们实际上存在于玉米B染色体上。
Comp75688_C6_SEQ20的预测大小是1,942bp,部分序列与PB3-201 Retrotransposon GrandeB具有相似性,这是B染色体重复序列的反朗膦源元素StarkB[36].我们使用引物Comp75688-1 F / 4R放大此序列,发现Stater + B和B73 + B中有两个频段(附加文件12图S5A),较大的只存在于B染色体组中,较小的(~500 bp)存在于B73 + 0B、B73 + B和Starter + B染色体组中。因此,根据Starter + B株系的扩增结果,这两个序列(1.9 kb, 500 bp)应该位于B染色体上。我们对这两个片段进行了测序,发现B73 + 0B、B73 + B和Starter + B的500bp序列是由不同的片段组成的。所以我们只详细分析了较大的那个。测序结果表明,B73 + B和Starter + B的产物与RNA-seq具有100%的同源性新创组装序列。为了产生较大的片段,我们使用位于新定义的B特定区域中的基因特异性引物(Race_Comp75688_F和Race_Comp75668_r)应用5'-race和3-Race。最长的序列是3.2 kB(附加文件12:图S5B;额外的文件8).我们在NCBI nr数据库上播放了这段视频,最受欢迎的是玉米克隆pB3-201逆转录转座子GrandeB(同源性85%),其余1.2 kb序列为新发现的b特异性序列。然后用B73 + B和Starter + B的gDNA扩增3.2 kb序列,并进行测序。从B73 + B和starter + B中扩增出的B染色体序列comp75688进行序列分析,发现有2个SNPs(图2)。4额外的文件13),可能是在玉米B染色体传递过程中产生的。PCR和测序结果表明,3.2 kb的comp75688基因位于B染色体的叶片中。
为了检测另一个b特异性的候选转录本comp74447_c2_14,我们设计了引物来扩增一个291 bp的片段。但PCR产物为1633 bp,仅能在B染色体存在的情况下扩增,即以B73 + B和Starter + B的gDNA为模板(附文件)12:图S5C;额外的文件8).序列分析表明,comp74447_c2_seq14的106 bp与扩增序列完全一致(图2)。4 b额外的文件13).因此,comp74447的1633 bp片段也具有B染色体特异性,并在B染色体的叶片中转录。
COMP30393_C0_SEQ1是1,355 BP B衍生的成绩单候选,玉米参考基因组数据库中的部分命中(附加文件14:表S4)。我们只扩增了来自玉米GDNA和cDNA的484bp片段,而且没有-b(附加文件12:图S5D;额外的文件8).该产品也可以用含有玉米B染色体的燕麦进行扩增。如图所示。4摄氏度其中Starter + B、B73 + B gDNA和cDNA序列与comp30393_c0_seq1部分序列同源性100%。b源序列中有多个来自B73 + 0B gDNA和cDNA PCR产物的SNPs,即其A基因组同源序列(附加文件)13).因此,comp30393也位于B染色体上,与a基因组同源物具有高度的相似性。
我们总共鉴定了3个玉米叶片转录的B染色体片段。我们检测到comp75688和comp30393的转录本,它们的长度与各自的基因组序列相同。
三个b定位序列是ltr
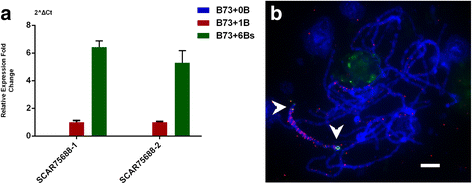
为了详细研究这三个b位置的片段,我们应用了RepeatMasker (http://www.repeatmasker.org/cgi-bin/WEBRepeatMasker)确定它们是否是重复的元素。如表所示3.其中,comp74447和comp75688为Gypsy家族LTR, comp30393为Copia家族LTR,因此,这三个片段均为非基因序列。我们对这三个序列在玉米参考基因组上进行了BLAST搜索。comp75688部分与玉米B73基因组具有同源性(附加文件)14:表S4)。然后用两个序列特征扩增区引物(scar)对comp75688的表达进行qRT-PCR分析。虽然在B73 + 0B中几乎没有扩增产物,但在B73 + 6b中表达量约为B73 + 1B的6倍(图)。5额外的文件15:图S6)。在以前的一项研究中,有报道称部分starkB被表达[27].这些研究人员使用北方杂交和RT-PCR检测几个b衍生转录本。他们没有用Oligo-dT引物生成的cDNA扩增任何产物,他们假设StarkB没有聚腺苷化。然而,我们通过RNA-seq、3 ' -RACE和Oligo-dT引物cDNA成功检测到b源转录本comp75688,该转录本可能也是串联StarkB的一部分。我们在这里使用的三种方法都需要一个聚腺苷化的尾巴,这表明我们发现的comp75688是一个新发现的b -定位序列。
此外,我们以全长3.2 kb的comp75688作为探针,对B73 + B的粗线染色体进行了FISH检测。如图所示。5 b虽然Comp75688的信号沿所有染色体扩散,但是B染色体的整个长臂上的信号更加浓缩,而大约一半的Comp75688是B特异性的推断是更浓缩的,而其余部分是部分同源的到A-基因组序列。在一起,三种B特异性序列是LTR序列,其中一个Comp75688以B剂量依赖性方式表达。
讨论
虽然这些额外的染色体对它们的生长和发育既不是必需的,也不会给它们的宿主带来任何明显的好处[37,它们的存在将在某种程度上影响a基因组[22,23].对黑麦和玉米B染色体转录的研究偶文揭示了几种受B染色体存在影响的衍生转录物[30.,32].然而,在植物中,特别是在全基因组水平上,关于B染色体存在时基因差异表达的研究还没有进行详细的研究。虽然发现了几个玉米b定位序列,但它们要么是重复元件,要么是短的基因样片段。B染色体上有限的序列不足以说明玉米A和B染色体之间的关系。
在我们的研究中,我们利用带B染色体和不带B染色体的B73 NILs的RNA-seq,发现玉米基因表达在玉米B染色体存在的情况下发生了变化。总的来说,两批RNA-seq数据显示,在+ B染色体中有115个基因上调,而在没有B染色体的植物中只有15个基因下调。另一方面,1B和0B之间只有15个基因上调。因此,B染色体拷贝数越低,对A基因组表达的影响越小。我们的研究结果与低B染色体数不会引起显著的表型变异一致,表型效应随着拷贝数的增加而变得明显。例如,当B染色体存在于多个副本中时,玉米植株的生育力和活力会降低[24].在我们的研究中,我们还发现了B染色体基因的转录。由于b基因与它们的A基因组同源物高度相似,这可能会导致一些b衍生转录本错误地定位到A染色体基因。因此,我们的研究可能高估了上调的基因数量,这可能导致我们的研究结果与以往的cDNA-AFLP研究结果存在差异,表明B染色体对a染色体定位基因的表达有负面影响[32,38].目前尚不清楚上调是否由衍生自B染色体的转录物直接贡献,或者在B染色体存在下上调染色体基因。然而,在B染色体存在下,并非所有差异表达的基因都上调,其中一些也在我们的研究中下调。此外,并非所有上调基因以剂量依赖性方式改变。因此,我们提出两种情况可能存在,这可能与非植物单倍体中的情况类似,相同A和B基因的表达可能不仅受基因剂量效应影响,而且通过直接反式效应[39].
在115个上调基因中,有5个基因在+ B植物与无B染色体植物的比较和不同拷贝数B染色体植物的比较中上调。这5个基因中有4个有蛋白注释,GRMZM2G113652编码一个包含驱动蛋白运动域的蛋白,参与微管结合,GRMZM2G013761是一个死盒RNA解螺旋酶编码基因,参与RNA代谢的各个方面,GRMZM2G356718编码tsl激酶相互作用蛋白,在染色质代谢中发挥作用。GO分析表明,这些上调基因主要参与细胞代谢和核苷酸结合(表)1,无花果。二维).B染色体的低拷贝可能不会导致显著的表型,而额外B染色体的存在可能会消耗更多的能量,需要更多的核酸代谢活性。
利用玉米B染色体的燕麦-玉米添加系,扩增了10个基因中的12个基因片段,并利用a基因组基因设计的引物获得了4 ~5 kb的全长基因/伪基因(附文件)8).以4个5 kb基因为探针的FISH检测结果显示,3个基因位于近色区,1个位于DH2区,4个基因的信号也出现在多聚焦的A染色体上(图2)。3来d).序列分析显示,1号、4号和10号染色体上分别有同源基因(见表)2),这7个相对较短的片段也可能来自a基因组基因,它们的a同源物位于染色体1、3、8和9(附加文件7:表S3)。除了a衍生的基因,我们还发现了三个b定位的LTR序列新创由Trinity将未定位的reads组装(到B73参考基因组)。3个ltr分别为comp75688 (3250 bp)、comp74447 (1633 bp)和comp30393 (484 bp),与a -基因组序列部分同源(附加文件)14:表S4;额外的文件8).因此,B定位序列与a同源物的分布模式表明B染色体最有可能以嵌合方式形成。B定位的A同源基因和LTR序列的序列分析支持玉米B染色体可能来源于A染色体的假设[17,20.,32,38,40,41].这样,位于B染色体的基因可能会与来自标准A染色体的原额外染色体一起被保留;另外,A同源基因或基因片段也可能通过转座子等方式进入B染色体。
虽然所有a衍生基因与a基因组的对应基因具有高度的相似性,但它们之间存在一些插入/删除和SNPs(见表)2和额外的文件10).GRMZM2G013761B与a -基因组同源物差异较大,SNPs和InDels会引起框架移位和过早终止密码子,从而改变蛋白质编码序列。换句话说,B染色体的基因可能会变成假基因。伪基因转录本可以产生内源性sirna或mirna结合位点,并作为基因调控因子[42].虽然一些B定位的基因丢失了蛋白质编码能力,但它们可能会调节A-基因组基因在反式.GRMZM2G356718B在其蛋白序列中也积累了许多可能影响蛋白功能的氨基酸替换。而部分基因与a同源物的保守性较高,如AF466202.2_FG007B与GRMZM2G356653B之间,预测它们可能是典型的蛋白编码基因,但剂量敏感性较低。否则它们会导致显著的表型[43].三个LTR序列中,comp75688的3 '端序列与A基因组序列同源,而1.2 kb的5 '端序列是一个新的B染色体特异性序列;comp74447只能从B染色体扩增,与a基因组同源序列差异较大;虽然在A和B染色体上都可以扩增出comp30393,但这两个同源物有多个SNPs。B染色体是独立于a基因组遗传的,在它的快速进化过程中没有选择压力[43对观测到的变化有贡献。对微解剖黑麦B染色体的测序显示,B染色体的SNP频率高于它们的a同源物[16].就像黑麦B染色体的情况一样,我们的研究表明,在玉米B染色体的快速进化过程中,B定位位点与a定位位点积累了变异。除了a衍生基因外,玉米B染色体还获得了B特异序列。
我们在携带B染色体特异性SNP的B73 + 1B RNA-SEQ文库中检测到读数,表明玉米B染色体基因也转录活跃(附加文件11).此外,转录的三个B位LTR。我们确定了来自B73 + B RNA-SEQ库的这些LTR。此外,我们检测到B73 + B cDNA内的Comp30393和Comp75688的B衍生成绩单;特别是,Comp75688的转录水平与B染色体的数量呈正相关。我们的结果与以前的研究一起[20.,31,32,提供了玉米B染色体基因和逆转录转座子位点具有转录能力的证据。
然而,只有少数B定位基因被验证。这可能是由于以下原因:1)玉米A-和b基因组可能具有很高的相似性,特别是在蛋白质编码基因方面,使其难以与A基因组相区分;2) B染色体上的功能基因数量可能有限。在独立的进化过程中,基因区总是积累高的序列变异。在这种情况下,一些B定位伪基因可能是转录不活跃的;3)部分b定位基因以特定的时空或遗传背景依赖方式表达。在黑麦和小麦中,一些b衍生的转录本局限于特定的组织[30.].在黑麦和玉米中,一些B衍生的转录物只能在某些线条中检测到[30.,32].在B73背景下,我们仅利用幼叶组织分析了B染色体的转录组及其对a基因组表达的影响,发现更多基因的机会甚至微乎其微。目前正在进行的玉米B染色体基因组测序结合RNA-seq数据,有望为玉米B染色体的转录组和进化提供更深入的了解。
结论
在本研究中,通过将玉米叶片转录组与多种B染色体的副本进行比较,我们发现在B染色体存在下改变玉米基因表达,并且增加B染色体的副本具有更多的影响。使用燕麦玉米添加管线,起动器+ B,我们验证了12个B染色体位于基因片段和三个LTR序列。鱼类结果直接说明了四〜5千克大小基因的分布和新发现的Retrotransposon,Comp75688,玉米B染色体。12个B比基因片段与其染色体对应物具有高相似性,而且还积累了SNP和插入/缺失等许多序列变化。使用我们组装为参考的B染色体序列,我们可以检测到B衍生的转录物。我们得出结论,B染色体是转录活性的,其存在会改变玉米转录组。玉米B染色体含有同源基因或B特异性回复转移。
方法
植物材料
含有B染色体的玉米自交系是由James A. Birchler博士(密苏里大学,哥伦比亚)好心提供的。用FISH法计数B染色体后,将幼苗移栽田间,每株自花授粉。从后代中筛选出B73 + 0B、B73 + 1B和B73 + 6Bs核。带有燕麦-玉米-添加系(Starter background)的玉米B染色体由Ralf G. Kynast博士(Royal Botanic Gardens, Kew)提供,并获得皇家植物园(Royal Botanic Gardens, Kew)董事会的许可使用。
用于FISH试验的根尖和减数分裂花药制备
根尖染色体的分析是按照前面描述的步骤进行的[44].B73、B73 + Bs和燕麦(发酵剂系和带玉米B染色体发酵剂)的籽粒在28℃下萌发。2 ~ 3天后,采收根尖,立即用氧化亚氮在2atm下处理2小时,固定在Carnoy溶液(乙醇:冰醋酸= 3:1)中,−20℃保存至使用。在减数分裂期含有B染色体的品系的流苏也用Carnoy溶液固定,并在−20℃保存。
鱼/吉斯”分析
将含有B染色体特异性重复序列ZmBs的质粒、B相关片段和玉米基因组DNA用地高素-11- dutp (Roche)或生物素-11- dutp (Vector laboratories)标记。分别用罗丹明(Roche)偶联的地高辛抗体和异硫氰酸荧光素(Vector Laboratories)偶联的抗亲和素抗体检测地高辛和生物素标记的探针。按照赵等人的方法进行了顺序FISH/GISH [45].将花药压碎,在相差显微镜下分期,选择粗线期的减数分裂细胞进行FISH试验。奥林巴斯BX61荧光显微镜,配备CCD相机(QImaging;采用RETGA-SRV FAST 1394)进行FISH/GISH图像采集。使用Image-Pro Plus 6.0软件(Media Cybernetics)和adobephotoshopcs3对数字图像进行分析和调整。
RNA分离和cDNA扩增
每粒玉米在气候室中栽培(28°C d 16 h, 20°C d 8 h, 50%谦卑)。按照RNAprep pure Plant Kit (Tiangen, Beijing, China, #DP432)提供的指令,从四叶期植物的第2个叶甲中分离得到总RNA。用Moloney鼠白血病病毒逆转录酶(Invitrogen)和oligo(dT)18引物合成第一链cDNA,总RNA约为1 μg。
RNA-seq分析
RNA-seq文库构建按照Illumina标准mRNA-seq文库制备试剂盒(Illumina)中制造商的协议进行,并在Illumina HiSeq2000平台上从两端到101个碱基进行测序。
使用拼接读取比对器TopHat将每个样本的Reads与玉米参考基因组(版本ZmB73_5a.59)进行比对,并使用cufflink程序(版本2.02)生成基因表达值(FPKM) [46].编辑包用于执行差异表达(DE)分析[47]从HT-SEQ程序估计的原始读数[48].使用Edger封装中提供的TMM(M值的修剪平均值)标准化计数。基于负二项式模型的每个基因计算p值,以及这些原始的p- 使用FDR(虚假发现率校正)方法进行调整值。都调整了p-Value(≤0.05)和折叠变化差(≥3)用于确定差异表达的基因。从DE基因列表中滤出在分子条件下滤除小于5cpm的平均低读数的基因,从DE基因列表中滤出。
基因本体学分析
利用单一富集分析(SEA)工具在agriGO数据库(http://bioinfo.cau.edu.cn/agriGO/analysis.php),使用玉米基因组(zea mays ssp V5a)作为注释。
B-specific记录分析
从B染色体的样本中收集未映射的读值。我们做了新创与三一会聚会[49]鉴定B染色体特定基因。每个基因被爆炸玉米国家生物技术信息中心(NCBI)网站核苷酸收集(nr/nt)数据库。通过对玉米和燕麦的gDNA和/或cDNA进行PCR扩增,验证了数据库中有部分命中或没有命中的B染色体特异性转录本。
为了生成b特异性全长基因,5' -RACE和3' -RACE按照SMARTer RACE 5'/3' Kit (Clontech, CA, USA)的说明书进行。
实时QRT-PCR
采用SYBR Green PCR master mix (Takara)进行qRT-PCR。进行了三次重复。ZmActin1用作内部引用来规范化表达式数据。相对表达量按2^ΔCt方法计算[50].引物在附加文件中列出16.
数据和材料的可用性
NCBI sequence Read Archive (http://www.ncbi.nlm.nih.gov/sra).Bioproject和SRA加入分别是Prjna317037和SRP072810。
缩写
- 鱼:
-
荧光原位杂交
- BP:
-
碱基对
- SNP:
-
单核苷酸多态性
- InDel:
-
插入/删除
- 走:
-
基因本体论
- OMA线:
-
燕麦玉米添加线
- LTR:
-
长末端重复
参考文献
- 1.
Jones Rn,Rees H. B染色体。纽约:学术;1982年。
- 2.
植物中一个世纪的B染色体:那又怎样?安机器人。2008;101(6):767 - 75。
- 3.
贝克特简森-巴顿。玉米B-A易位的细胞遗传学、遗传和植物育种应用。发表于:植物染色体工程:植物染色体工程:遗传学,育种,进化。a部分Gupta PK,土屋T编辑,第1版edn。阿姆斯特丹:爱思唯尔科学;1991.493 - 529
- 4.
Jin W,Lamb Jc,Vega JM,Dawe Rk,Birchler Ja,姜J。玉米B染色体厘米的分子和功能解剖。植物细胞。2005; 17(5):1412-23。
- 5.
病房EJ。玉米的异色B染色体:影响重组的片段。43 Chromosoma。1973;(3):177 - 86。
- 6.
病房EJ。不分离:玉米B染色体中控制位点的定位。遗传学。1973;73(3):387 - 91。
- 7.
玉米b型染色体交换的罗曼H.有丝分裂不分离。遗传学。1947;32(4):391 - 409。
- 8.
卡尔森的车手。B,玉米的染色体。Annu Rev Genet, 1978; 12:5-23。
- 9.
林。玉米B染色体不分离的区域控制。遗传学。1978;90(3):613 - 27所示。
- 10。
韩F,羔羊JC,Yu W,Gao Z,Birchler Ja。Centromere函数和非空隙是玉米B染色体累积机制的独立组分。植物细胞。2007; 19(2):524-33。
- 11.
卡尔森的车手。玉米b型染色体缺乏中心异染色质的不稳定遗传。基因组。2006;49(5):420 - 31所示。
- 12.
卡马乔JP,沙贝尔TF, Beukeboom LW。b染色体进化。acta botanica sinica(云南植物学报),2000;37(4):457 - 461。
- 13.
贝克尔SED, Thomas R, Trifonov VA, Wayne RK, Graphodatsky AS, Breen M.将狗与其亲属进行锚定揭示了犬科11种新的进化断点,并为B染色体的作用提供了新的线索。染色体研究》2011;19(6):685 - 708。
- 14.
Silva DM, Pansonato-Alves JC, Utsunomia R, Araya-Jaime C, Ruiz-Ruano FJ, Daniel SN, Hashimoto DT, Oliveira C, Camacho JP, Porto-Foresti F, et al.;用FISH作图、染色体绘制和DNA序列分析确定了一种长尾虾B染色体的起源。《公共科学图书馆•综合》。2014;9 (4):e94896。
- 15.
valente gt,conte ma,fantinatti,Cabral-de-Mello DC,Carvalho RF,Vicari Mr,Kocher Td,Martins C.基于综合基因组分析的碱性鱼类Astotilapia Latifasciata的B染色体的起源和演变。mol Biol Evol。2014; 31(8):2061-72。
- 16.
Martis MM, Klemme S, Banaei-Moghaddam AM, Blattner FR, Macas J, Schmutzer T, Scholz U, Gundlach H, Wicker T, Simkova H,等。自私多殖染色体揭示了它的起源是宿主基因组和细胞器序列的嵌合体。中国科学院院刊2012;109(33):13343-6。
- 17.
Alfenito先生,Birchler JA。玉米B染色体中心序列的分子特征。遗传学。1993;135(2):589 - 97。
- 18.
BT, Wanous MK, Birchler JA。玉米4号染色体着丝粒序列的特征:与B号染色体着丝粒进化关系的证据。遗传学。2001;159(1):291 - 302。
- 19.
程义明,林BY。玉米B染色体大片段的分子组织:新重复的指示。遗传学。2004;166(4):1947 - 61。
- 20。
高千瓦,林超英,彭顺生,程玉明。玉米b染色体4个特异性rapd的特性及SCAR标记的开发。中国生物医学工程学报。2015;29(2):431-41。
- 21。
Jin W, Lamb JC, Zhang W, Kolano B, Birchler JA, Jiang J.。染色体研究》2008;16(8):1203 - 14所示。
- 22。
Rhoades M.关于交叉过桥的细胞学基础的研究。在:孔雀w,brock p,编辑。遗传物质的复制和重组。堪培拉:澳大利亚Acad SCI;1968. p。229-41。
- 23.
斯桃波RW光碟。玉米叶片条纹与b染色体的存在相关。J在这里。1987;78(2):71 - 4。
- 24.
伦道夫低频。玉米B染色体的遗传特性。遗传学。1941;26(6):608 - 31所示。
- 25.
Ruiz-Estevez M,Lopez-Leon MD,Cabrero J,Camacho JP。核糖体DNA在蚱蜢Eypropnemis Plorans的不同B染色体变体中活性。genetica。2013; 141(7-9):337-45。
- 26.
Ruiz-Estevez M, Badisco L, Broeck JV, Perfectti F, Lopez-Leon MD, Cabrero J, Camacho JP。显示有活性的核糖体RNA基因的B染色体的rRNA贡献不显著。中国生物医学工程学报。2014;33(6):591 - 598。
- 27.
Leach CR, Houben A, Field B, Pistrick K, Demidov D, Timmis JN。毛蚴B染色体基因转录的分子证据。遗传学。2005;171(1):269 - 78。
- 28.
Miao VP,隐蔽的SF,Vanetten HD。一种针对可分配(“B”)染色体的抗生素抗性的真菌基因。科学。1991; 254(5039):1773-6。
- 29.
Trifonov VA,Dementyeva PV,Larkin DM,O'Brien PC,Perelman Pl,Yang F,Ferguson-Smith Ma,Graphodatsky。蛋白质编码基因的转录在西伯利亚罗鹿(Capreolus pygergus)的B染色体上。BMC BIOL。2013; 11:90。
- 30。
黑麦B染色体伪基因的形成与表达。植物细胞。2013;25(7):2536 - 44。
- 31。
Lamb JC, Riddle NC, Cheng YM, Theuri J, Birchler JA。玉米B染色体上反转录转座子衍生元件的定位和转录。染色体研究杂志2007;15(3):383 - 98。
- 32。
林洪志,林伟东,林春英,彭顺生,程义明。玉米b染色体相关转录本的cDNA-AFLP分析。Chromosoma。2014;123(6):597 - 607。
- 33。
杜Z,周X,Ling Y,Zhang Z,Su Z. Agrigo:农业社区的GO分析工具包。核酸RES。2010; 38(Web服务器问题):W64-70。
- 34。
Kynast RG, Okagaki RJ, Galatowitsch MW, Granath SR, Jacobs MS, Stec AO, Rines HW, Phillips RL。利用染色体加合和辐射杂交种解剖玉米基因组。美国国家科学院学报。2004; 101(26): 9921 - 6。
- 35.
Grabherr MG, Haas BJ, Yassour M, Levin JZ, Thompson DA, Amit I, Adiconis X, Fan L, Raychowdhury R, Zeng Q, et al.;没有参考基因组的RNA-Seq数据的全长度转录组组装。生物科技Nat》。2011;29(7):644 - 52。
- 36.
罗克良,彭顺福,陈丽娟,林斌。玉米B染色体中StarkB元件(22.8 kb)的串联组织。中国生物医学工程学报。2009;28(2):131-9。
- 37.
Stark EA, Connerton I, Bennett ST, Barnes SR, Parker JS, Forster JW。玉米b染色体结构的分子分析。染色体研究》1996;4(1):15 - 23。
- 38.
Carchilan M, Kumke K, Mikolajewski S, Houben A. Rye B染色体弱转录,可能改变A染色体序列的转录活性。Chromosoma。2009;118(5):607 - 16。
- 39.
Birchler Ja。对动脉倍增性基因表达研究的思考。Biochem J.2010; 426(2):119-23。
- 40.
程义明,林BY。微粉切除源自玉米B染色体序列的克隆与表征。遗传学。2003; 164(1):299-310。
- 41。
彭顺福,程义明。玉米b染色体长臂异色区卫星CentC重复序列的特征。染色体研究》2011;19(2):183 - 91。
- 42。
Kalyana-Sundaram S, Kumar-Sinha C, Shankar S, Robinson DR, Wu YM, Cao X, Asangani IA, Kothari V, presner JR, Lonigro RJ,等。表达的假基因在人类癌症的转录景观。细胞。2012;149(7):1622 - 34。
- 43。
Banaei-Moghaddam AM, Martis MM, Macas J, Gundlach H, Himmelbach A, Altschmied L, Mayer KF, Houben A. B染色体上的基因:用新工具重新审视旧问题。生物物理学报。2015;1849(1):64-70。
- 44。
Cai Z,刘H,Q,Pu M,Chen J,Lai J,Li X,Jin W. Coix Lacryma-Jobi L.和Coix Aquatica Roxb的差异基因组演化与形态。杂交广西被重复序列分析和精细的核型分析透露。BMC基因组学。2014; 15:1025。
- 45。
赵旭,徐旭,谢洪,陈胜,金伟。玉米单倍体诱导剂杂交受精与单亲本染色体消除。植物杂志。2013;163(2):721 - 31所示。
- 46。
Trapnell C, Roberts A, Goff L, Pertea G, Kim D, Kelley DR, Pimentel H, Salzberg SL, Rinn JL, Pachter L. TopHat和Cufflinks RNA-seq实验的差异基因和转录表达分析。Nat Protoc。2012;7(3):562 - 78。
- 47.
Nikolayeva O, Robinson MD. edgeR for differential RNA-seq and ChIP-seq analysis: an application to stem cell biology。方法:中华医学杂志。2014;1150:45-79。
- 48.
Anders S, Pyl PT, Huber W. HTSeq—一个用于处理高通量测序数据的Python框架。生物信息学,2015,31(2):166 - 9。
- 49.
Haas BJ, Papanicolaou A, Yassour M, Grabherr M, Blood PD, Bowden J, Couger MB, Eccles D, Li B, Lieber M, et al.;利用Trinity平台从RNA-seq中重建从头转录本序列,进行参考文献的生成和分析。Nat Protoc。2013;8(8):1494 - 512。
- 50.
Livak KJ,Schmittgen TD。使用实时定量PCR和2的相对基因表达数据分析(-Delta Delta C(T))方法。方法。2001; 25(4):402-8。
致谢
我们感谢Drs。James A. Birchler博士(密苏里大学哥伦比亚分校)提供了携带B染色体的玉米自交系B73; Ralf G. Kynast博士(英国皇家植物园,邱园)提供了携带玉米B染色体的燕麦-玉米-添加系。感谢阎辉煌博士对我们手稿的宝贵意见。国家自然科学基金项目(no . 31171563, no . 31421005)。
作者信息
隶属关系
通讯作者
额外的信息
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
作者的贡献
WJ构思了该项目,WH和YD进行了实验和序列分析。WH和XZ制备了RNA-SEQ材料。WH写了这篇论文,WJ修改了这篇论文。所有作者阅读并认可的终稿。
附加文件
附加文件1:表S1。
RNA-seq读取图谱结果总结。(XLSX 9 kb)
附加文件2:表S2。
RNA-SEQ数据在三组中的每一个中的相关性。(XLSX 9 kb)
附加文件3:图S1。
各组上调和下调基因的维恩图(GLMfit, fold change≥3,FDR = 0.1)。(A)组1基因上调;(B)组1基因下调;(C)第2组上调基因;(D)第2组中下调的氏族。(TIF 2204 kb)
额外的文件4:
数据集S1。差异表达基因的列表。(XLSX 71 kb)
附加文件5:图S2。
燕麦玉米添加管中玉米染色体的表征。绿色信号是生物素标记的玉米基因组DNA,红色信号是Digoxingenin标记的ZMBS重复元件。该燕麦菌病细胞中有两种玉米B染色体(箭头)。条=10μm。(TIF 481 KB)
附加文件6:图S3。
玉米B染色体基因片段扩增。每组第一车道为B73的gDNA,第二车道为B73 + 1B的gDNA,第三车道为燕麦发酵剂系的gDNA,最后一车道为燕麦-玉米-添加系- Starter + B的gDNA。11组采用根据8个a基因组基因序列设计的引物,除1、2、4、5组未与Starter + B进行扩增外,其余组Starter + B的PCR产物与玉米gDNA大小相同。最后一组用编码空泡H + - ATPase 16kda蛋白脂亚基(vatp-P1)蛋白的燕麦mRNA序列(GenBank登录:M73232.1)设计的引物扩增,仅以燕麦gDNA为模板扩增产物。(TIF 6469 kb)
附加文件7:表S3。
12 B定位基因片段的BLAST分析。(XLSX 14 KB)
额外的文件8:
B位基因片段,四个长长度基因和三个LTR列表。(XLSX 21 KB)
附加文件9:图S4。
4个A、B染色体同源基因片段的PCR产物测序图箭头表示SNP位点的双峰,箭头表示插入/删除位点,双峰出现在InDel位点的上游/下游。(TIF 3434 kb)
额外的文件10:
A-和b基因的多序列比对。外显子a -基因组同源物以红色显示,变异位点突出显示。(PDF 532 kb)
额外的文件11:
数据集S2。B73 + 1B RNA-seq文库中b源转录本的等位基因特异性分析(XLS 1762 kb)
附加文件12:图S5。
b定位序列的PCR扩增。基于重新组装的序列,我们扩增了comp75688_c6_seq19 (A)、comp74447 (C)和comp30393 (D)的1.9 kb + 500 bp序列,利用RACE结果设计的引物扩增了comp75688 (B)的3.2 kb完整序列。(TIF 3251 kb)
额外的文件13:
b染色体定位LTR片段的测序分析。(多克斯18 kb)
附加文件14:表S4。
七个B比基因片段的爆炸结果。(XLSX 11 KB)
附加文件15:图S6。
qPCR验证了comp75688在含有0B、1B和2b的植物中的表达。在另一批含0B、1B和2b的植株上进一步检测了comp75688的表达,其中2b植株的表达量约为1B植株的2倍。(TIF 1335 kb)
额外的文件16:
本研究使用的引物。(XLSX 11 KB)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
黄玮,杜勇,赵旭。et al。B染色体含有活性基因,影响玉米A染色体的转录(玉蜀黍L。).BMC植物杂志16,88(2016)。https://doi.org/10.1186/s12870-016-0775-7
已收到:
接受:
发表:
关键字
- 玉米
- B染色体
- RNA-seq
- 转录
- 进化