摘要
背景
白化茶叶品种“Anji Baicha”的新芽在低温下是黄色或白色,随着环境温度在早春的增加而变绿。'Anji Baicha'代谢物配置文件在三种颜色和发育阶段具有相当大的变异性,特别是关于类胡萝卜素,叶绿素和茶胺浓度。以往的研究重点是在特异性生长阶段的白化茶叶植物中的生理特性,基因表达差异和代谢物丰度的变化。然而,调节在白化茶叶中各种颜色和发育阶段的代谢物生物合成的分子机制尚未完全表征。
结果
我们使用RNA测序分析“安吉白茶”叶子在黄绿色,返白,并重新绿化阶段。叶转录三个阶段之间有很大不同。基于基因本体论的富集和基因和基因组富集分析的京都百科全书功能分类显示,差异表达个Unigenes主要与代谢途径,次生代谢产物的生物合成,苯丙生物合成,并在光合生物固碳。化学分析显示,高β胡萝卜素和茶氨酸的水平,但低叶绿素A.水平,在白化阶段比在绿色阶段。此外,还鉴定了参与类胡萝卜素、叶绿素和茶氨酸生物合成的unigenes,并对这些生物合成途径中差异表达的unigenes的表达模式进行了分析。通过共表达分析,我们确定了这些途径中的关键基因。这些基因可能是‘安吉白茶’茶树不同叶色和发育阶段代谢产物生物合成差异的原因。
结论
我们的研究提出了在不同阶段“安吉白茶”茶树的转录和生化分析的结果。每种颜色和发展阶段的不同的转录谱使我们能够确定改变生物合成途径和揭示这些变化对茶树的白化表型的贡献。此外,转录和相关代谢物的比较有助于澄清在不同阶段的次级代谢途径的基础的分子调节机制。
背景
茶树[茶树(l)O. Kuntze]在世界各地种植,用于生产无酒精饮料。大多数茶树的叶子都是正常的绿色。茶树育种家已经培育出了一些具有不同芽色(如黄色、白色和紫色)的品种,这些品种已成为生产具有特定颜色和风味的独特绿茶的宝贵材料。在中国西南部的安吉县,以及附近的地区,栽培了几个产生白色叶子的品种(如“安吉白茶”)。“安吉白茶”是一种绿色可逆转的白化茶品种,在低温下会产生黄色或白色的芽。温度升高使嫩芽变绿。1].在白化期,抑制叶绿体发育和叶绿素积累导致黄或白芽的出现。随着温度的升高,叶绿体结构恢复,叶绿素含量增加,叶片变绿[1-4.].另一个黄叶茶品种“中黄2”的调查显示,叶绿体超微结构被破坏,与堆叠基粒不佳和较低的叶绿素A.和B.绿茶品种“龙井43”[5.].
几种方法已应用于研究机构调解在“安吉白茶”植物白化表型。使用微阵列,在不同的阶段发白的检测差异表达基因(DEGS)。大多数的这些基因都与叶绿素及蛋白质生物合成[6.].聚焦于扩增片段长度多态性的分析有助于识别周期性白化病中的DEGs,包括转录因子基因以及与泛素化、叶绿体生物发生、信号转导、应激反应、细胞周期和碳水化合物和能量代谢相关的基因[7.].在三个发育阶段嫩叶的蛋白质组水平分析显示,差异表达的蛋白质主要涉及有关光合作用,蛋白质加工和碳的代谢,氮和硫[活动3.].
在早春的“Anji Baicha”新芽中的叶子颜色的变化伴随着代谢物轮廓的改变。阶段之间的产生的代谢物主要与光合生物和苯丙砜和黄酮类生物合成中的碳固定相关。碳水化合物和氨基酸代谢途径是在白光阶段期间的主要受干扰的途径,而不是绿色阶段[8.].另外,与健康效果和茶的感官质量有关的代谢物的丰度在发育阶段之间变化。在β-阶段,'Anji Baicha'叶子含有高浓度的游离氨基酸,尤其是Theanine [9.],这是一种独特的游离氨基酸,可占茶叶中总共氨基酸含量的约50%。它给茶是一种独特的味道,称为“umami”[10.].目前对安吉白茶白化阶段茶氨酸生物合成调控的分子机制知之甚少。
白化期‘安吉白茶’叶片叶绿素含量低是产生独特叶色的主要原因。然而,“安吉白茶”白化期叶片叶绿素代谢的分子机制尚未完全阐明。在高等植物中,类胡萝卜素起着关键的作用,与采光和防止过度光照的影响有关[11.].类胡萝卜素含量高的茶叶品种生产出美味的茶。在茶叶生产过程中,类胡萝卜素被降解为许多与茶叶品质密切相关的风味挥发性化合物[12.].以前的研究得出结论,“安吉白茶”植株在白化期和氯代茶树的类胡萝卜素总含量低于普通绿茶品种[5.那9.].然而,影响“安吉白茶”茶树颜色和发育阶段类胡萝卜素合成的分子机制尚不清楚。为了解决这些问题,我们收集了黄绿色阶段、白化阶段和返青阶段的叶片样本。首先,我们通过rna测序(RNA-seq)分析了每个颜色和发育阶段的基因表达模式。基于这些结果,我们组装了一个完整的基因集,包括不同阶段表达的基因。第二,我们鉴定了大量不同阶段表达的unigenes。此外,还分析了不同时期类胡萝卜素、叶绿素和茶氨酸的浓度,并对参与这些化合物代谢的关键基因编码酶的表达模式进行了分析。最后,通过分析unigenes表达量与代谢产物浓度之间的相关性,确定了调控类胡萝卜素、叶绿素和茶氨酸代谢产物差异合成的关键基因。
我们的研究结果显示,在各种颜色和发育阶段的“Anji Baicha”叶子中的代谢物生物合成的动态调节。我们阐明了在不同颜色和发育阶段的'Anji Baicha'叶中基因表达的调节,这可能与茶叶育种和种质改善有关。
结果与讨论
颜色的变化和“安吉白茶”叶子的发展在早春
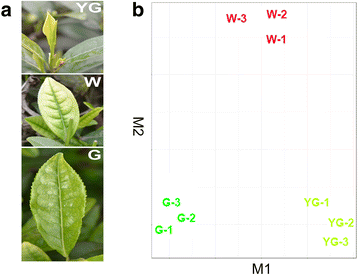
在早春,“安吉白茶”新芽的颜色是由环境温度的影响。在温度低于20℃时,新的芽黄绿色或白色。随着温度升高,新芽逐渐变绿。白化的表型是密切相关的叶绿素合成,这是在低温下抑制和还原时温度升高[2].根据叶片颜色的不同,将新梢发育分为三个阶段。1).初始发芽期,其中植物包括一个黄绿色的叶和一个芽的,被定义为黄绿色(YG)阶段。在这个阶段,叶子呈翠绿色与黄色边缘。作为第一叶发展,它成为灰白色,只有叶脉保持绿色。此期间被定义为返白(W)阶段。当温度高于22℃增加,叶变得越来越大,并逐渐变成绿色,类似于其他茶品种的叶子上。这个阶段被定义为重绿化(G)的阶段。
RNA测序,Unigene组装和“Anji Baicha”转录组的注释
为了分析叶片在YG、W和G阶段的转录组,我们创建了9个cDNA文库(每个阶段为3个重复),并利用Illumina HiSeq 2000平台进行了测序。9个样本的原始读取总数为2900 - 4800万1).此外,只有一个样本含有较少的超过3000万读取。总的来说,3.29亿短读段的三个不同阶段产生的,并且被选择用于进一步分析3.28亿高质量100-bp的读取。
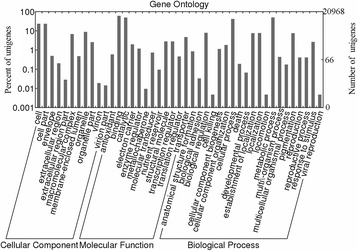
基于高质量读取,使用Trinity组装unigenes。最终,我们获得了179,951个unigenes,分别具有987年的平均和总长度和177.7 MB(表1).unigenes基于与公共数据库中的基因的序列相似,包括国家生物技术信息中心非冗余(NCBI-NR)蛋白质数据库[13.],拟南芥信息资源(TAIR) [14.],基因和基因组的京都百科全书(Kegg)数据库[15.],以及基因本体(GO)数据库[16.].我们在NCBI-nr、TAIR、GO和KEGG数据库中分别检测到104,191(57.90%)、131,724(73.20%)、76,749(42.60%)和67,049(37.30%)序列匹配2).
在黄绿色,结晶剂和再绿化阶段差异表达基因的鉴定和功能分类
每个阶段分析三个独立的生物学重复,以评估我们的结果的重现性。通过比较每个样本中每个unigene的读值,9个样本的生物重复使用CummeRbund生成的散点图进行验证[17.].该图揭示了九个RNA-SEQ样品根据其特定阶段聚集成三组三组(图。1 b).这说明三个生物重复在每个阶段的基因表达结果是一致的。我们的数据还表明,单基因在不同时期叶片中的表达水平不同。
在YG期检测到142,798个unigenes,在W期检测到150,130个unigenes,在G期检测到140,914个unigenes。单基因表达水平以每千碱基的外显子/百万测序片段(FPKM)来衡量。考虑到错误发现率(FDR)小于0.05,推定的差异基因被识别出来。在三个阶段的两两比较中,我们检测到15,320 (YG vs G)、9,476 (W vs G)和8,790 (YG vs W) DEGs(表3.).DEGS为YG和G级比其他比较之间的比较的更丰富表明,这两个阶段的转录概况均较其他阶段的更明显(表3.).
基于GO分析,10,445(5.8%)和1,589(0.9%)unigenes分别参与代谢过程(GO:0008152)和色素沉着(GO:0043473)(图。2).对DEG的浓缩分析显示每对阶段之间的显着上调或下调术语(附加文件1和2).在W与YG比较中,有4123个unigenes表达水平显著上调,4667个unigenes表达水平显著下调(表1)3.).上调的DEGs在氧化石墨烯条件下富集,如甘氨酸脱氢酶(脱羧)活性、氧化还原酶活性、光系统I、萜类生物合成过程和光系统I反应中心等。相比之下,下调的DEGs在氧化石墨烯条件下富集精氨酸琥珀酸合成酶活性、转录共激活物活性、精氨酸生物合成过程、嘌呤核苷单磷酸生物合成过程、核苷二磷酸还原酶活性和谷氨酸合成酶活性。G基因与W基因比较中,上调的有6141个,下调的有3335个。上调的DEGs在氧化石墨烯过程中富集,如萜类生物合成过程、维生素B6生物合成过程、甘氨酸脱氢酶(脱羧)活性、维生素B6代谢过程、磷酸吡啶醛生物合成过程、氧化还原酶活性和糖脂生物合成过程。下调的DEGs在氧化石墨烯中富集,包括-果呋喃糖苷酶活性、蔗糖-葡萄糖苷酶活性、GTP分解过程、甘油二酯O.酰基转移酶活性,甘油酯O.-acyltransferase活性,蛋白聚合,甘油脂的生物合成过程中,GTP代谢过程,并aminomethyltransferase活性。对于YG VSģ比较,6784首8536个Unigenes是上调和下调的,分别。上调DEGS在GO术语诸如氧化还原酶活性,细胞酰胺代谢过程,谷胱甘肽的生物合成过程中富集,GTP环II活性,萜的生物合成过程中,腐胺的生物合成过程中,和硫酸腺苷酰转移酶的活性。下调的DEGS在GO术语包括甲硫氨酸生物合成过程中,外膜,DNA复制,氧化还原酶活性,核糖核苷二磷酸还原酶的活性,和GTP分解代谢过程中富集。
Terpenoids形成了一种大型和多样的自然发生的有机化学品,因为它们是芳香的品质而广泛使用。在茶叶植物中,Terpenoids作为茶中芳香化学品的主要前体,并影响害虫抗性。与萜类化合物生物合成相关的次数从YG平均调节到W阶段,然后对G阶段上调。萜类化合物的浓度,包括总类胡萝卜素,β-胡萝卜素和叶黄素,比在正常的绿茶品种中较低,比在正常的绿茶品种中较低[5.那9.].这些结果表明,萜类生物合成过程在绿茶叶片中更为活跃。
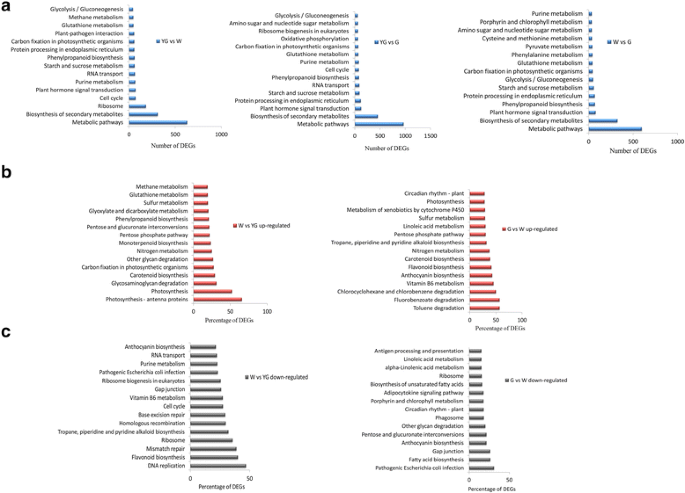
每对阶段之间的deg在不同KEGG通路相关的基因中富集(图)。3.).对应于最丰富的Degs的前15个Kegg路径如图2所示。3.随着叶片的颜色和发育变化从yg阶段到W阶段,然后富含阶段,富含Degs的Kegg途径基本保持不变。YG VS W,W VS G和YG VS G比较的共享KEGG途径包括代谢途径,二次代谢物,淀粉和蔗糖代谢的生物合成,苯丙烷化生物合成,嘌呤代谢,光合生物中的碳固定,以及糖酵解或葡糖生成。最丰富的上升 - (图。3 b)或下调(图。3 c)两个连续阶段之间的差异基因被分配到15个独立的KEGG通路。在W vs YG和G vs W比较中,KEGG通路上调的常见途径与光合作用、类胡萝卜素生物合成、氮代谢、戊糖磷酸途径和硫代谢有关。在W vs YG和G vs W比较中,常见的下调KEGG通路与核糖体、缝隙连接和花青素生物合成有关。
在光合生物中,叶片是光合作用或碳固定的部位,使其成为光能吸收的专业组织,CO2吸收和同化,以及减少形成糖类葡萄糖的反应。在光合生物中涉及碳固定的未成年人的表达水平在叶子颜色和从YG平台发生至W阶段发生的发育变化,然后达到G阶段(图。3).这些表达模式可能是各阶段与碳固定相关代谢物丰度差异的原因[8.].与光合作用相关的DEGs表达增强,可能导致碳水化合物合成增加,吸收的能量以淀粉或蔗糖的形式储存,从而为茶树的生存和发育提供能量来源[18.].‘安吉白茶’茶树W期的DEGs也与能量代谢有关[3.那6.那7.].
茶树中的次生代谢物使茶叶具有丰富、纯净的风味和营养成分[19.那20.].这些次生代谢物也对人类健康有益。我们的数据表明,所鉴定的deg与次生代谢产物的生物合成有关,这与微阵列分析的结果一致[6.].这些观察结果表明,次级代谢物的生物合成在叶子中的整个颜色和发育阶段进行差异调节。在类胡萝卜素生物合成中的曲面从YG平台到W阶段显着上调,然后达到G阶段(图。3 b).白化品种的类胡萝卜素总含量低于正常绿茶品种[5.那9.].与类胡萝卜素合成相关的度的视角可能会影响在阶段之间的总类胡萝卜素含量的差异。
黄酮类化合物是一组植物多酚类次生代谢产物,包括黄酮、黄酮醇、异黄酮、黄酮、黄烷醇、花青素等。黄烷-3-醇或儿茶素是茶叶中最主要的类黄酮化合物[21那22].这些化合物使茶成为人类饮食的重要组成部分。从YG阶段到W阶段,参与类黄酮生物合成的DEGs主要下调(图2)。3 c).相比之下,从W期到G期,这些DEGs主要上调(图1)。3 b).而在‘安吉白茶’的淡白色嫩枝中,与类黄酮生物合成相关的DEGs下调[6.].这一结果与我们的研究相反,这可能是因为这两项研究使用的组织不同。先前的研究表明,编码类黄酮关键生物合成酶的基因在白化期表达减少,大部分儿茶素的丰度在白化期低于绿色期[23].类黄酮化生物合成相关的DEG表达的动态改变可能有助于各种颜色和发育阶段之间的儿茶素丰富的差异。
类胡萝卜素生物合成
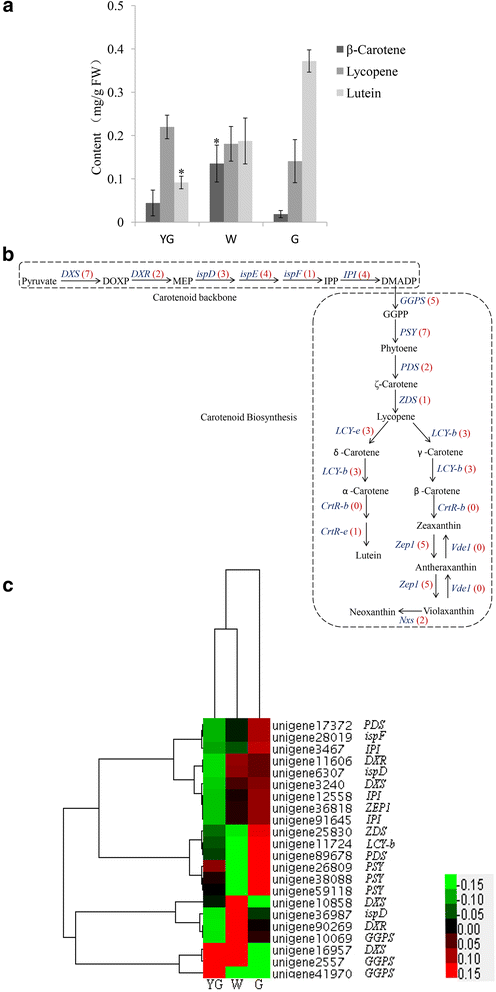
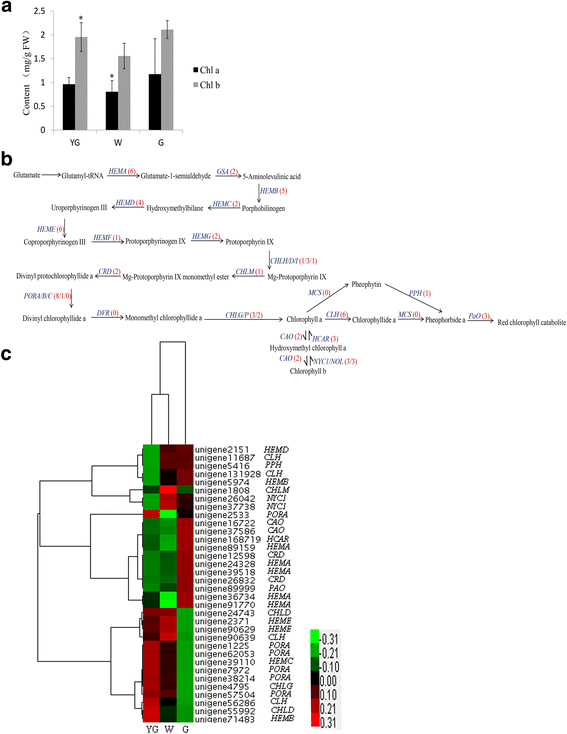
类胡萝卜素在光合作用中起着重要作用[24]并用作脱钙酸的前体[25那26].在茶树中,类胡萝卜素以黄色色素的形式存在于新鲜叶子中,并在红茶生产过程中降解为有香味的萜类化合物[27].耦合到时间飞行质谱气相色谱(GC-TOF-MS)分析以测定在不同阶段的β胡萝卜素,番茄红素,叶黄素和的浓度。与G期期间的水平相比,在W阶段观察到显着较高的β-胡萝卜素浓度,而在YG阶段检测到显着降低的叶黄素浓度(图。4).β-胡萝卜素、番茄红素和叶黄素浓度在YG期和G期差异较大。β-胡萝卜素浓度从YG期到W期呈上升趋势,W期到G期呈下降趋势。然而,从YG阶段到G阶段,番茄红素和叶黄素的浓度增加了(图2)。4).类胡萝卜素丰度的变化与类胡萝卜素生物合成基因表达的改变有关[28那29].在我们的数据库中,51个unigenes被注释为编码类胡萝卜素生物合成相关酶的关键基因(图。4 b和附加文件3.).与类胡萝卜素生物合成相关的所有deg的表达谱被分级聚类并绘制在热图中(图2)。4摄氏度).
二磷酸异戊烯基(IPP)形成类胡萝卜素的主干。在1-deoxyxylulose 5-phosphate (DOXP)途径中,IPP由丙酮酸和甘油醛-3-磷酸产生,DOXP合成酶(DXS)是该途径中的第一个酶。在番茄植物中,DXS参与类胡萝卜素生物合成的调控步骤[30.].在拟南芥蒂利亚纳,一个dx突变导致了叶绿体发育的抑制,叶绿素和类胡萝卜素的缺乏,以及幼苗的白化表型[31].在我们的数据库中,在各种颜色和发育阶段中,七个候选人未经编码的DXS(Unigene 16957,Unigene 10858和Unigene 3240)的表达水平有显着不同(图。4摄氏度).2个unigene (unigene 16957和unigene 10858)在W期显著上调,1个unigene (unigene 3240)在G期显著上调。在下一个类胡萝卜素生物合成步骤中,香叶基香叶基二磷酸合成酶(GGPS)催化三个IPP分子加入到二甲基烯丙基二磷酸中。我们的数据库中有5个同源基因ggp.其中2个基因(unigene 41970和unigene 2557)在YG期显著上调,1个基因(unigene 10069)在W期显著上调。
在类胡萝卜素生物合成途径中,八烯合酶(PSY)催化两个GGPP分子合成八烯[32(图。4 b).植物合酶是万寿菊花中类胡萝卜素生物合成的速率限制酶[33)、菜籽油(芸苔栗鸟)种子34]和成熟的番茄水果[28那35].在七个候选人中小组在我们的研究中鉴定个Unigenes,三的表达水平(单基因59118,单基因26809,和单基因38088)的显著在G阶段(图上调。4摄氏度).番茄红素β环化酶(LCY-b)的活性导致增加了一个β紫罗兰酮环中的番茄红素分子,以生成β胡萝卜素的每一端。另外,番茄红素ε-环酶产生ε环以产生δ-胡萝卜素。我们检测到四个unigenes同源LCY-B.在茶叶植物转录组中,其中一个(UNIGENE 11724)在G期上调节(图。4摄氏度).在番茄植物中,LCY-B.在绿色组织中积极表达[36那37].虽然LCY-B.在G期高表达,在该阶段中β-胡萝卜素浓度最低(图。4).这种基因表达水平与代谢物浓度的不一致可能是由于转录后调控LCY-B.,导致抑制酶活性。
玉米黄质环氧化酶(Zep1)催化玉米黄质通过炭黄质转化为紫黄质[38].我们确定了5个候选基因Zep1,其中(单基因36818)只有一个的表达期间对于g阶段多于在其他两个阶段。紫黄质deepoxidase(VDE)转换紫黄质回玉米黄质[39].我们没有发现任何候选人为个UnigenesVDE.,这可能不是三个茶叶色阶段明示或可能低于检测限的水平表现。有两种类型的植物新黄质合酶(NXS)的。一个是几乎相同的番茄红素β环化酶,它可以番茄红素转化为β胡萝卜素和紫黄质到新黄素。另一种形式只能转换到紫黄新黄质[40].在我们的数据库中,两个unigenene (unigene 40018和unigene 14302)的序列与nx,但在三个分析阶段中均未表现出显著差异。
计算各阶段DEGs表达水平与β-胡萝卜素、番茄红素和叶黄素浓度的Spearman相关系数。许多unigenes的表达水平与代谢物浓度显著相关(表)4.).我们确定了一个小组-编码unigene (unigene 26809),其表达量与β-胡萝卜素浓度显著相关。此外,12个unigenes的表达量与番茄红素浓度显著相关。这些unigenes编码DXS, DXR, ispF, IPI, GGPS, PSY, LCY-B, PDS, ZDS和ZEP。我们还检测到12个表达水平与叶黄素浓度显著相关的ungene,包括注释为的ungenedx那DXR那ISPD那ispF那IPI.那ggp那小组那LCY-B.那PDS那ZDS,和齐柏林飞艇.这些基因可能是“安吉白茶”不同叶色和发育期类胡萝卜素合成差异的原因。
叶绿素生物合成
叶绿素是光合作用,光捕获和能量转换至关重要。此外,叶绿素是镁2+含负责将植物绿四吡咯颜料。茶树的白化表型的拍摄开发过程中缺乏叶绿素的结果。在早春,叶绿体从黄化质体的发展和叶绿素的积累A.和B.被“安吉白茶”茶树的新芽挡住了[2].叶绿素A.和B.在每个阶段测定了浓度。与G期相比,W期和YG期的叶绿素浓度显著降低(图2)。5).此外,叶绿素A.和B.从YG阶段到W阶段,浓度降低,然后从W阶段到G阶段,浓度升高。5).
叶绿素代谢途径包括以下三个阶段:叶绿素的生物合成A.,叶绿素之间的相互转换A.和B.,以及叶绿素的降解A.[41-44].在我们的数据库中,71个unigenes与叶绿素生物合成相关,包括几乎所有关键酶的基因(图)。5 b和附加文件4.).所述DEGS的表达水平通过分层聚类分析(图来确定。5度).香叶酰香叶酰二磷酸还原酶基因表达水平(曹),这是一种与叶绿素有关的酶B.在叶绿素含量不足的植物中,生物合成会升高B.[45].两个曹个Unigenes(单基因16722和37586的Unigene)在我们的数据库中进行鉴定,并在G阶段两人都显著上调。这一发现意味着,高曹叶绿素的表达水平可能会诱导叶绿素的高效生物合成B.在G阶段增加其浓度(图。5).NYC1.编码叶绿素B.还原酶,催化叶绿素的降解B.至7-羟甲基叶绿素A.[46那47].叶绿素降解B.是抑制NYC1.由于自然衰老而保持绿色直到死亡前的突变植物[48].三NYC1.在我们的数据库中检测到个Unigenes,以及两种这些(单基因37738和单基因26042)的表达水平在W阶段均显著高于在YG和G级。高NYC1.W期ungene的表达水平可能会促进叶绿素的降解B.(无花果。4摄氏度).在植物中,NOL(NYC1样)蛋白密切相关NYC1,和NOL突变植物也保持绿色,类似于野生植物[49].三NOL在我们的数据库中发现了unigenes,但这些unigenes在YG阶段和G阶段的表达水平没有显著差异。羟甲基叶绿素A.还原酶(HCAR)转化7-羟甲基叶绿素A.叶绿素A.[50].的HCAR康乃馨花瓣中表达量与叶绿素含量密切相关[51].此外,HCAR在黄化阶段表达强烈上调答:芥幼苗变成绿色[52].这些结果表明,HCAR在绿化期叶绿素循环中起重要作用。三HCAR在我们的数据库中鉴定到1个基因,其中1个基因(unigene 168719)在G期显著上调。该基因在G期的高表达可能是叶绿素含量较高的原因之一A.在该阶段期间与其他两个阶段(图相比浓度。5).在叶绿素降解过程中,脱藻酶(phophytinase, PPH)起着关键作用。的表达产后大出血在黑暗中诱导,加速叶绿素降解。在产后大出血突变植物,叶绿素降解被抑制,植物衰老过程中表现出持续的绿色表型[53].在我们的研究中,表达产后大出血(单基因5416)于YG阶段比在W和G级(图更低。5 b),表明叶绿素含量最低A.降解速率发生在YG阶段。然而,叶绿素A.YG期的浓度低于G期。这可能是由于编码叶绿素合成酶(CHLG)的unigene 4795在G期的表达量显著高于YG期(图4)。5度).较高的叶绿素A.G阶段的浓度比YG阶段的浓度高,这可能与叶绿素有关A.合成比它被降解速度更快。叶绿素(CLH)催化叶绿素的转化A.对脱植基叶绿素A..在柑橘属植物,CLH表达水平与叶绿素含量呈负相关[54].我们确定了六个候选人CLH我们数据库中的未成年体(图。5 b),其中四个所述YG和G级之间显著差异表达。在YG和W阶段,分别,而2个Unigenes分别在G级(单基因11687和单基因131928)(图上调的单基因56286和单基因90639的表达水平上调。6摄氏度).单基因56286和单基因90639可能有助于叶绿素A.在Yg和W阶段期间降低叶绿素浓度比在G期中更低。表达水平氧分压,与叶绿素分解的速率密切相关[55].三氧分压在我们的数据库中检测到unigenes,但从YG阶段到G阶段,只有一个基因(unigene 89999)显著上调。而G期叶绿素含量相对较高(图2)。5).康乃馨的研究结果亦相同[51],可能由于转录后调控的氧分压抑制所编码的酶的活性[56或因为叶绿素A.合成比降解快。
DEGs表达水平与叶绿素浓度之间的Spearman相关系数A.和B.计算各阶段。两个和三个个Unigenes的表达水平与叶绿素被显著相关A.和B.浓度(表5.).的PORA(Unigene 2533)表达水平与叶绿素显着相关A.浓度。两个编码unigene (unigene 26042和unigene 37738)的表达NYC1.与叶绿素浓度显著相关A.和B..这些unigenes可能对叶绿素生物合成的差异负责A.和B.中不同叶色和“安吉白茶”茶树的发育阶段。
茶氨酸生物合成
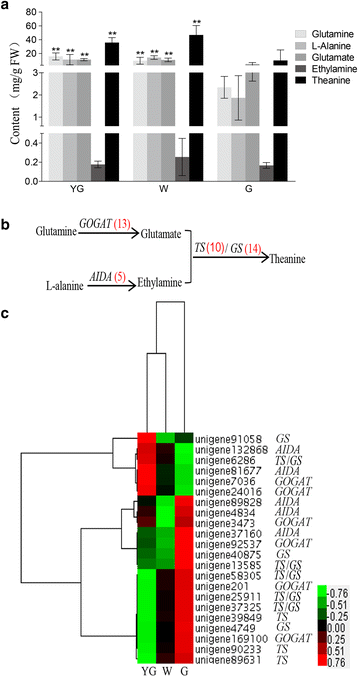
茶氨酸合成酶(TS)催化由谷氨酸和乙胺合成茶氨酸[57那58(图。6 b).参与生物合成茶氨酸的额外的酶包括谷氨酸合成酶(GOGAT)和丙氨酸脱羧酶(AIDA),其催化谷氨酰胺转化为谷氨酸和丙氨酸乙胺,分别。谷氨酰胺合成酶(GS)是高度同源的TS,并且还可以催化谷氨酸和乙胺转化成茶氨酸[59].进行超高效液相色谱 - 三重四极杆质谱(UPLC-QQQ-MS)分析,以确定谷氨酰胺,谷氨酸,丙氨酸和丁胺的浓度。另外,GC-TOF-MS用于测量不同阶段的乙胺浓度。除了乙胺外,在yg和w阶段的显着较高浓度下检测所有代谢物,而不是在G期中(图。6).谷氨酰胺和谷氨酸浓度从YG期到G期呈下降趋势。丙氨酸和茶氨酸浓度从YG阶段到W阶段呈上升趋势,从W阶段到G阶段呈下降趋势(图2)。6).
所有参与茶氨酸生物合成的unigenes都被鉴定出来(图。6 b和附加文件5.).与Theehine生物合成有关的次数在分层聚集并在热图中绘制(图。6摄氏度).G阶段包括许多高度表达的次数,包括编码在茶氨酸生物合成途径中的关键酶的所有未成熟。这些结果表明,G阶段是Theanine生物合成的重要阶段。Theanine生物合成途径中的一个衬底是乙胺,其通过Aida通过丙氨酸的脱羧化产生[60].因为这阿伊达该基因是茶树特有的,尚未被鉴定和功能特征阿伊达在我们的研究中使用的基因编码精氨酸脱羧酶,并包含类似于阿伊达[61那62].一共5个公认的阿伊达unigenes被确定。其中2个基因(unigene 132868和unigene 81677)在YG期显著上调,其余3个基因(unigene 89828、unigene 4834和unigene 37160)在G期显著上调。茶氨酸生物合成途径中的另一个底物是谷氨酸,它由谷氨酰胺通过GOGAT产生。在我们的数据库中,有13个假设GOGATunigenes被确定。其中2个基因(unigene 7036和unigene 24016)在YG期显著上调,4个基因(unigene 3473、unigene 92537、unigene 201和unigene 169100)在G期显著上调。这些结果表明,来自同一家族的ungenes在表达模式上存在差异。此外,高的非基因表达水平并不一定与高代谢物浓度相对应。增加的谷氨酸水平导致茶幼苗中茶氨酸生物合成上调[63].在我们的研究中,在W期和YG期谷氨酸和茶氨酸明显多于G期。先前的一项研究报道,白化品种的谷氨酸和茶氨酸浓度高于正常绿色品种[9.].谷氨酸也参与叶绿素合成(图)。5)[42].在W期抑制叶绿素合成可能导致谷氨酸水平升高,从而增加茶氨酸的合成。茶氨酸合成酶是茶树特有的,有10个候选TS在我们的数据库中确认了Unigenes。八个TS在G阶段个Unigenes(单基因39849,单基因89631,单基因40875,单基因13585,单基因58305,单基因25911,单基因37325,和单基因90233)表达上调,和一个(单基因6286)是下调。在花草茶,TS基因高度同源GS基因[57].14GS在个Unigenes我们的数据库进行了鉴定,其中6个还标注为TS基因。两GSunigenes在YG阶段显著上调,而有6个在G阶段显著上调(图2)。6摄氏度).
我们计算了各阶段deg表达水平与乙胺、谷氨酰胺和茶氨酸浓度之间的Spearman相关系数(表)6.).的表达水平GOGAT,这是由单基因编码201,被显著与乙胺浓度相关。五个Unigenes的表达水平(对应于GOGAT那阿伊达那GS,和TS)与谷氨酰胺浓度显著相关。阿伊达unigene 37160的表达水平与茶氨酸浓度相关。这些基因可能是“安吉白茶”不同叶色和发育阶段相关代谢物生物合成差异的原因。
在不同阶段的差异表达的基因的表达水平的验证
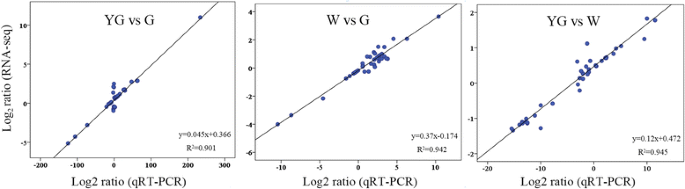
为了验证在DEGS表达水平的变化通过在不同的阶段FPKM值所反映,我们选择了42个Unigenes(11类胡萝卜素生物合成个Unigenes,22叶绿素代谢个Unigenes和九茶氨酸生物合成个Unigenes)和YG,W分析了它们的表达水平,和G级使用定量逆转录聚合酶链式反应(qRT-PCR)。Pearson相关系数被用来确定每对检测级之间的基因表达水平倍数变化的相关性,通过RNA-SEQ和qRT-PCR测量。结果显示很强的相关性(R.2 > 0.9) between the RNA-seq and qRT-PCR data (Fig.7.).这些观察结果表明,RNA-seq检测到的基因表达变化反映了不同阶段转录组谱的差异。
使用定量反转录聚合酶链反应(qRT-PCR)方法验证rna测序结果。从类胡萝卜素、叶绿素和茶氨酸生物合成途径中筛选出42个差异表达基因。散点图显示了对数比(log2通过QRT-PCR和RNA测序测量的Unigene表达水平的折叠变化。使用“管家的基因”标准化QRT-PCR数据GAPDH.qRT-PCR引物列于附加文件6.
结论
我们在不同颜色和发育阶段完成了对'Anji Baicha'茶叶植物的转录组级分析。转录组曲线在YG,W和G阶段之间大致不同。差异表达的unigenes主要与代谢途径,二次代谢产物的生物合成,苯丙醇化生物合成和光合生物中的碳固定有关。化学分析揭示了Theanine和β-胡萝卜素水平较高,叶绿素A.W期低于G期。此外,我们还鉴定了与类胡萝卜素、叶绿素和茶氨酸生物合成相关的ungene,并对这些途径中差异表达的ungene的表达模式进行了分析。通过对基因表达量和代谢物含量的分析,可以鉴定出表达量对代谢物浓度有显著影响的关键基因。这些结果揭示了基因表达与类胡萝卜素、叶绿素和茶氨酸的生物合成之间的关系。我们的发现有助于阐明白化茶树生物合成特征生物化学物质的分子机制。本研究获得的转录组水平数据可能为白化茶树的进一步分子和基因组研究提供有价值的资源。
方法
植物材料
茶厂[茶树(l)o . Kuntze简历。“安吉白茶”产于中国农业科学院茶叶研究所中国国家种质杭州茶叶资源库。在上午9 ~ 11点采集4年茶树叶片。早春时节,新芽呈黄绿色。YG期叶片为第一批叶片,于2014年4月1日采集。当嫩枝长出三片叶子和一个芽或四片叶子和一个芽时,第二或第三片叶子是白色的。这些W期叶片于2014年4月15日收获。晚春的高温使树叶变绿。G期叶片(即第五或第六叶)于2014年5月9日采集。 Each sample was individually collected from three tea plants to obtain three biological replicates for RNA-seq or from five tea plants to obtain five biological replicates for chemical component analyses. All collected samples were immediately frozen in liquid nitrogen and stored at −70 °C.
图书馆准备和测序
使用RNeasy Plus Mini Kit (Qiagen, Valencia, CA, USA)从茶叶中提取总RNA,然后用TURBO DNase (Ambion, Austin, TX, USA)处理。使用RNA 6000纳米LabChip试剂盒和2100生物分析仪(Agilent Technologies, Palo Alto, CA, USA)确认分离的RNA的完整性。用于测序的文库是用Illumina公司的试剂盒制备的。首先,用oligo(dT)磁珠从20 μg总RNA中纯化mRNA。其次,将纯化的mRNA在碎片缓冲液中切成短片段。以短片段为模板,合成第一链cDNA,然后合成第二链cDNA。第三,用QIAquick PCR Extraction Kit (Qiagen)纯化cDNA片段,在连接到测序适配器之前进行末端修复。最后用琼脂糖凝胶电泳纯化产物,PCR富集得到最终cDNA文库。使用Illumina HiSeq™2000测序系统(Illumina, San Diego, CA, USA)对cDNA文库进行测序。
Unigene组装、注释和表达分析
为了获得高质量的读取,滤波原始数据以删除适配器序列并读取未知或低质量的基础。德诺维使用Trinity程序进行组装(版本20130225 [64])。我们首先将读取组合使用默认参数来形成长于200 BP的片段,该片段被定义为Contigs。然后将读取映射到CONDIG,以使用作为模板的配对读数获得更长的序列。最后,CAP3 / PRICETI用于连接CONDIG,并获得在任何一端无法扩展的序列。将这种序列定义为unigenes。
Unigenes使用选定蛋白数据库的BLASTx功能进行注释,包括NCBI-nr [13.]和TAIR数据库[14.],考虑到10的电子值阈值-5.使用KAAS进行途径分析[15.],虽然使用Wego完成了Go Classifications [65基于Blast2GO程序提供的GO注释术语[66].使用Cufflinks(版本1.0.3)基于FPKM值计算基因表达水平[67].两个阶段之间的基因表达水平差异的显著性通过学生t检验评估,使用从每个阶段的三个cDNA文库中获得的FPKM值。为了识别两个阶段之间的差异基因,使用阈值FDR < 0.05来判断基因表达差异的显著性。在聚类3的帮助下,使用完全连锁分组对归一化FPKM值进行层次聚类分析。
单基因表达水平分析
使用涡轮DNase处理使用RNEasy Plus Mini Kit提取的总RNA以除去基因组DNA。使用随机六甲醚引物和来自高容量cDNA逆转录试剂盒(应用生物系统,CA,USA)的多元逆转录酶,在逆转录反应中,在逆转录反应中从逆转录反应中合成第一链CDNA。将cDNA样品在无核酸酶的水中稀释10倍,并用作QRT-PCR分析的模板。QRT-PCR引物对在附加文件中列出6..每个阶段采用3个技术重复和3个生物学重复对所有分析的单基因进行检测。qRT-PCR采用ABI 7500 Real-Time PCR System (Applied Biosystems)、SYBR Green和PrimeScript™RT Reagent qPCR Kit (Takara, Dalian, China)进行。根据比较周期阈值法计算相对转录本丰度GAPDH作为内部标准[68].Pearson相关分析使用SPSS统计学17.0软件包(SPSS Inc., Chicago, IL, USA)完成。相关分析采用对数比(即对数2Unigene表达水平阶段之间的折叠变化由QRT-PCR和RNA-SEQ确定.
叶绿素含量的测量
根据Arnon的方法,在五个生物学复制中测量叶绿素含量[69].用80%丙酮从100毫克的叶片样品中提取叶绿素。提取液在645和663 nm处进行分光光度分析。采用学生t检验比较YG、W期与G期的叶绿素含量。
由UPLC-QQQ-MS叶代谢物的定量
对于每个阶段,100mg叶样品浸没在500μl甲醇:水(3:1,v / v)中,用超声波混合5分钟。将混合物在12,000rpm下在4℃下离心10分钟,使用UPLC-QQQ-MS仪器分析上清液。对每个样品分析五种重复。
将2 μ l等量的上清注入Zorbax Eclipse Plus C18色谱柱(50 × 2.1 mm, 1.8 μm粒径)(Agilent Technologies, Palo Alto, CA, USA),并在Agilent 6400 Triple Quadrupole LC/MS系统(Agilent Technologies, Santa Clara, CA, USA)中保持20℃。二进制的流动相梯度洗脱混合物包括(A)水甲酸(0.1%,v / v)和(B)乙腈和示例使用以下梯度分离完成:98%和2% B从0到2分钟,B从3 - 7分钟,100%,98%和2% B从8到10分钟,流速为0.2毫升/分钟。在多反应监测模式下分析时,所有样品保持在4°C,以最大限度地提高灵敏度。源温度设为100℃,脱溶气温度设为300℃。气体流速3.0 L/min。采用Agilent MassHunter定性分析B.04.00软件(Agilent Technologies, Santa Clara, CA, USA)对数据进行分析。谷氨酰胺、谷氨酸、丙氨酸和茶氨酸的标准品溶于甲醇:水(3:1,v/v),最终浓度为100 μg/mL。将稀释后的标准品混合,生成校准曲线。根据标定曲线测定谷氨酰胺、谷氨酸、丙氨酸和茶氨酸的浓度。使用Student’s t检验比较YG、W期与G期的代谢物浓度。
通过GC-TOF-MS叶代谢物的定量
每100 mg叶片样品浸泡在500 μL甲醇:水(3:1,v/v)中,在65hz球磨机中均质3min。然后在4℃下12,000 rpm离心10min。350 -μL整除的上层清液被转移到一个玻璃取样瓶和vacuum-dried室温为1.5 h。干渣处理80μL methoxyamine吡啶(20毫克/毫升)和20分钟在80°C的环境,其次是增加80μL BSTFA(包含1%的中药,v / v)和一个孵化在70°C 1 h。
采用Agilent 7890气相色谱系统与Pegasus HT飞行时间质谱联用进行GC-TOF-MS分析。该体系包括DB-5MS毛细管柱,以5%的二苯基交联95%的二甲基聚硅氧烷(内径30 m × 250 μm,膜厚0.25 μm;J&W Scientific, Folsom, CA, USA)。以不分裂方式注入1 μ l的分析物。氦被用作载气。前入口吹扫流量为3 mL/min,通过色谱柱的气体流量为20 mL/min。首先将温度设置在50°C,持续1分钟,然后以10°C/min的速率将温度提高到320°C。温度保持在320°C 5 min,注入和传递线温度为280°C,离子源温度为220°C。在电子碰撞模式下,能级设置为−70 eV。质谱数据m/Z.在366秒的溶剂延迟之后,以20个光谱/ s的速率在全扫描模式下以85-600的范围。
β-胡萝卜素、番茄红素、叶黄素和乙胺标准品溶于甲醇:水(3:1,v/v)中,最终浓度为100 μg/mL。将稀释后的标准品混合,然后进行衍生化,对叶片样品进行分析,生成校准曲线。根据标定曲线测定β-胡萝卜素、番茄红素、叶黄素和乙胺的浓度,并采用学生t检验比较YG和W阶段与G阶段的浓度。
相关分析
相关分析采用SPSS统计学17.0软件包中的Spearman参数相关检验。
缩写
- AIDA:
-
丙氨酸脱羧酶
- 曹:
-
天竺葵二磷酸还原酶
- CLH:
-
叶绿素
- 度:
-
差异表达基因
- DXS:
-
1-脱氧木酮糖-5-磷酸合成酶
- FDR:
-
假发现率
- FPKM:
-
每百万百万次映射的外显子的碎片
- 旅客:
-
进行重建
- GGPS:
-
Geranylgeranyl二磷酸合酶
- 去:
-
基因本体论
- Gogat:
-
谷氨酸合成酶
- g:
-
谷氨酰胺合成酶
- HCAR:
-
羟甲基叶绿素A.还原酶
- IPP:
-
Isopentenyl二磷酸
- Kegg:
-
Kyoto基因和基因组的百科全书
- LCY-B:
-
番茄红素β-环酶
- NCBI-nr:
-
美国国家生物技术信息中心非冗余
- NOL:
-
NYC1样
- NYC1:
-
叶绿素B.还原酶
- PPH:
-
苯酚酶
- PSY:
-
八氢番茄红素合成酶
- 存在:
-
定量逆转录聚合酶链反应
- TAIR:
-
拟南芥信息资源
- TS:
-
茶氨酸合成酶
- UPLC-QqQ-MS:
-
超高效液相色谱 - 三重四极杆质谱法
- VDE:
-
violaxanthin eypeoxidase.
- W:
-
变白的
- YG:
-
黄绿色
- Zep1:
-
玉米黄质环氧
参考文献
- 1。
杜y,梁y,王h,王k,lu j,张g等。白化茶叶化学成分的研究。j hortic sci biotech。2006; 81:809-12。
- 2.
杜勇,陈辉,钟伟,吴磊,叶建军,林超,等。温度对低温诱导茶树叶片叶绿素积累和超微结构的影响。生物技术学报2010;7:1881-5。
- 3.
李Q,黄Ĵ,刘S,李江,杨X,刘Y,等人。嫩叶的蛋白质组学分析三个发展阶段中的白化茶品种。蛋白质组科学。2011; 9:1-12。
- 4.
程华,李树华,陈敏,于飞,严军,刘艳,等。安吉白茶的生理生化特性非凡。《茶叶科学》1999;19:87-92。
- 5.
王林,岳超,曹洪,周勇,曾军,杨勇,等。一个新的缺叶绿素茶树品种的生化和转录组分析。BMC Plant Biol. 2014;14:352。
- 6.
马春林,陈玲,王小春,金建强,马建强,姚明志,等。“安吉白茶”不同白化阶段的差异表达分析利用cDNA微阵列技术。Sci Hortic。2012;148:246-54。
- 7.
袁磊,熊光国,邓婷婷,吴勇,李军,刘树清,等。茶花品种安吉白茶周期性白化期间叶片基因表达的比较分析。基因。2015;561:23-9。
- 8.
李春芳,姚明忠,马春兰,马建强,金建强,陈磊。安吉白茶白化阶段代谢特征的差异。《公共科学图书馆•综合》。2015;10:e0139996。
- 9。
冯玲,高明军,侯瑞云,胡晓燕,张玲,万小春,等。白化茶品种幼叶质量成分的测定。食品化学。2014;155:98 - 104。
- 10。
山口S,二宫K.鲜味和食物的适口性。J Nutr。2000; 130:921S-6。
- 11.
Niyogi KK。光保护再访:遗传和分子生物学方法。Annu启植物生理学植物分子生物学。1999; 50:333-59。
- 12.
气候因子在茶香生物发生中的作用机制。植物化学,1974;13:2057 - 63。
- 13.
NCBI。非冗余蛋白质数据库。1999年。ftp://ftp.ncbi.nih.gov/blast/db/FASTA/nr.gz.2013年6月20日。
- 14.
拟南芥信息资源。1999年。ftp://ftp.arabidopsis.org/home/tair/Sequences/blast_datasets/TAIR9_blastsets/.访问日期2008年6月20日。
- 15.
京都基因百科全书和基因组数据库。1999年。http://www.genome.jp/kegg/.2013年6月20日。
- 16.
基因本体联盟。基因本体(GO)数据库和信息学资源。核酸RES。2004; 32:D258-61。
- 17.
Trapnell C, Roberts A, Goff L, Pertea G, Kim D, Kelley DR,等。TopHat和Cufflinks的RNA-seq实验差异基因和转录本表达分析Nat Protoc。2012;7:562 - 78。
- 18.
Bohler S, Sergeant K, Lefèvre I, Jolivet Y, Hoffmann L, Renaut J,等。臭氧长期暴露对杨树叶片膨大和完全膨大的不同影响树杂志。2010;30:1415-32。
- 19。
陈东,Milacic V,陈明生,万树森,林文辉,霍灿,等。茶多酚的生物学效应及其潜在的分子靶点。Histol Histopathol。2008;23:487。
- 20.
绿茶的化学性质及其应用。博卡拉顿:CRC出版社;1997.
- 21.
林玉玲,胡安宜敏,陈玉玲,梁永春,林建坤。新鲜茶叶中多酚的组成及其在成纤维细胞中氧自由基吸收能力与抗增殖作用的关系。中国农业科学(英文版)1996;44:1387-94。
- 22.
辛格HP,Ravindranath S,茶梢儿茶素辛格C.分析:分光光度定量分析和可视化的选择性使用重氮化磺胺二维色谱纸。JAgric Food Chem。1999; 47:1041-5。
- 23.
熊璐,李军,李勇,袁玲,刘树华,黄建军,等。白化茶树中儿茶素水平及儿茶素生物合成相关基因表达的变化。植物生理与生物化学。2013;71:132-43。
- 24.
van Grondelle R,Dekker JP,Gillbro T,Sundstrom V.能量转移和诱捕光合作用。Biochim Biophys Acta。1994年; 1187:1-65。
- 25.
拟南芥aba突变体环氧-类胡萝卜素生物合成受损。美国国立科学学院1991;88:7496-9。
- 26.
Chernys JT,Zeevaart JA。9-顺式 - 环氧加氧酶基因家族的表征和脱落酸生物合成中鳄梨的调节。植物理性。2000; 124:343-54。
- 27.
红茶生产中类胡萝卜素及其降解的研究。农业科学。1983;34:1390-6。
- 28.
Fraser PD, Truesdale MR, Bird CR, Schuch W, Bramley PM。番茄果实发育过程中类胡萝卜素的生物合成(组织特异性基因表达的证据)。植物杂志。1994;105:405-13。
- 29.
绿色大苹果。番茄果实成熟发育过程中类胡萝卜素形成的调控。中国生物医学工程学报2002;53:2107-13。
- 30.
罗志强,罗志强,罗志强,等。1-脱氧-d -木糖- 5-磷酸合成酶在番茄果实发育中的调控作用。植物j . 2000; 22:503-13。
- 31。
cl1是叶绿体发育所需的新基因,在进化过程中高度保守。植物j . 1996; 9:649-58。
- 32。
Camara B.植物植物植物合酶复合物:组分酶,免疫学和生物发生。方法酶。1993; 214:352-65。
- 33。
Moehs CP,田L,Osteryoung KW,类胡萝卜素合成基因表达的Dellapenna D.分析万寿菊花瓣发育过程中。植物mol biol。2001; 45:281-93。
- 34。
Shewmaker的CK,希伊JA,戴利男,科尔伯恩S,柯DY。八氢番茄红素合成酶的种子特异性表达:增加类胡萝卜素和其它代谢作用。植物杂志1999; 20:401-12X。
- 35。
布拉姆利P,Teulieres C,布莱恩I,鸟C,其中类胡萝卜素合成已经通过反义RNA的给pTOM5表达抑制的转基因番茄植物的舒赫W.生化表征。植物杂志1992; 2:343-9。
- 36。
啄木鸟I,Gabbay R,坎宁安JR FX,希尔施贝格J.克隆和用于从番茄的番茄红素的β-环化酶cDNA的表征揭示了果实成熟过程中其表达降低。植物mol biol。1996; 30:807-19。
- 37.
通过对番茄β -胡萝卜素和老金色突变的图谱克隆,发现了植物染色体质体中β -胡萝卜素形成的另一途径。美国国家科学学院2000;97:11102-7。
- 38.
叶黄素生物合成。辣椒β -环己烯基类胡萝卜素环氧化酶的克隆、表达、功能重组及调控。生物化学学报1996;71:28861 - 7。
- 39.
Niyogi Kk,Grossman Ar,Bjorkman O.拟南芥突变体为Xanthophyll循环定义了光合能量转换的调节中的核心作用。植物细胞。1998年; 10:1121-34。
- 40.
海森堡J.类胡萝卜素合成的开花植物。CURR OPIN植物生物学。2001; 4:210-8。
- 41.
王志强,王志强,王志强,等。植物叶绿素合成与降解的研究进展。植物学报2004;56:1-14。
- 42.
田中A,田中R.叶绿素代谢。植物生态学报。2006;9:498 - 498。
- 43.
增田T,藤田Y.法规和叶绿素代谢的演变。光化学光生物学科学。2008; 7:1131年至1149年。
- 44.
叶绿素分解的生物化学进展。acta botanica yunnanica(云南植物研究). 2013;
- 45.
艾斯皮内达,林福德,德瓦恩。AtCAO基因编码叶绿素a加氧酶,是拟南芥叶绿素b合成所必需的基因。美国国家科学学院1999;96:10507-11。
- 46.
陈志强,陈志强。叶绿素b与叶绿素a的转化与叶绿素降解的关系。中国生物化学学报,1999;
- 47.
黄志强。叶绿素b的生物合成及其循环。Photosynth杂志2002;74:187 - 93。
- 48.
Kusaba M,Ito H,Morita R,Iida S,Sato Y,Fujimoto M等。稻米非黄色着色1参与光收获综合体II和叶片衰老期间的降解。植物细胞。2007; 19:1362-75。
- 49.
Sato Y, Morita R, Katsuma S, Nishimura M, Tanaka A, Kusaba M.两种短链脱氢酶/还原酶,NON‐YELLOW COLORING 1和NYC1‐LIKE,在水稻衰老过程中需要叶绿素b和光收获复合体II的降解。植物j . 2009; 57:120-31。
- 50.
陈志强,王志强,王志强,等。一种新型乙烯基还原酶基因的克隆及表达分析。美国生物化学杂志。2008;283:9002-11。
- 51.
黄志强,王志强,王志强,等。植物叶片叶绿素积累相关基因的克隆与表达分析。《公共科学图书馆•综合》。2014;9:e113738。
- 52。
樱Y,金YS,柳SC,Hortensteiner S,白南淳NC。7-羟甲叶片衰老过程叶绿素叶绿素分解的中间体代谢窜还原酶功能。Biochem Biophys Res Communce。2013; 430:32-7。
- 53。
Schelbert S, Aubry S, Burla B, Agne B, Kessler F, Krupinska K, et al.;拟南芥叶绿素疏磷水解酶(Pheophytin phophobide hydrolase,简称pheophytinase)参与了叶片衰老过程中的叶绿素分解。植物细胞。2009;21:767 - 85。
- 54。
Shemer TA, Harpaz-Saad S, Belausov E, Lovat N, Krokhin O, Spicer V, et al.;乙烯诱导果实变色时柑橘叶绿素酶动态:叶绿素酶表达、翻译后加工动力学和细胞内原位定位的研究植物杂志。2008;148:108-18。
- 55。
PružinskáA,唐纳G,奥布里S,安德斯I,Moser的S,穆勒T,等人。叶绿素分解衰老拟南芥叶子。叶绿素降解物和参与反应褪绿叶绿素分解代谢酶的表征。植物理性。2005; 139:52-63。
- 56。
Pružinská A, Tanner G, Anders I, Roca M, Hörtensteiner s叶绿素分解:磷酸加氧酶是一种rieske型铁硫蛋白,由细胞加速死亡1基因编码。美国国立科学研究院2003;100:15259-64。
- 57。
邓卫东,王志强,王志强,等。茶树幼苗γ-乙基氨基-谷氨酸的生物合成。Phytochem。2008;1:115-9。
- 58。
茶树幼苗中茶氨酸合成酶的研究。农业生物化学。1965;29:984-8。
- 59。
Tachiki T,Suzuki H,Wakisaka S,Yano T,Tochikura T.通过贝克的酵母制剂和细菌谷氨酰胺合成酶的偶联产生γ-谷氨酰胺和γ-谷氨酰胺乙酰胺的生产。J Gen Appl Microbiol。1986; 32:545-8。
- 60.
Sinensis的Takeo T.L-丙氨酸脱羧酶。植物化学。1978; 17:313-4。
- 61.
石春艳,杨辉,魏春林,于欧,张志忠,姜春娟,等。对茶树转录组的深度测序揭示了茶类化合物主要代谢途径的候选基因。BMC基因组学。2011;12:1。
- 62.
Kidron H,Repo S,Johnson Ms,Salminen Ta。系统发育研究来自丙氨酸外周血酶结构家族的氨基酸脱羧酶的功能分类。mol Biol Evol。2008; 24:79-89。
- 63.
邓W-W,王S,陈强,张Z-Z,胡X-Y。盐处理对茶树幼苗茶氨酸的合成。植物理性生物化学。2012; 56:35-40。
- 64.
Grabherr Mg,Haas Bj,Yassour M,Levin Jz,Thompson Da,Amit I等。来自RNA-SEQ数据的全长转录组件没有参考基因组。NAT BIOTECHNOL。2011; 29:644-52。
- 65.
叶军,方磊,郑华,张勇,陈建军,张震,等。WEGO:一个用于绘制GO注释的网络工具。核酸学报2006;34:W293-7。
- 66.
Conesa A,Gotz S.Bast2Go:植物基因组学中功能分析的综合套件。int j植物基因组学。2008; 2008:619832。
- 67.
Trapnell C,帕切特L,Salzberg SL。高顶礼帽:发现与RNA-Seq的剪接点。生物信息学。2009年; 25:1105年至1111年。
- 68.
Livak KJ, Schmittgen TD。使用实时定量PCR和2−ΔΔCT方法分析相关基因表达数据。方法。2001;25:402-8。
- 69.
阿诺迪。铜酶在分离的叶绿体中。β寻常的多酚氧化酶。植物理性。1949年; 24:1-15。
确认
不适用。
资金
农业部农业科研体系专项资金(CARS-023);中国农业科学院农业科技创新计划(CAAS-ASTIP-2014-TRICAAS);国家自然科学基金项目(31400581、31500568和31600562)资助。
数据和材料的可用性
在这篇文章中给出的数据已存放在NCBI基因表达综合和使用的GEO系列登录号GSE66615访问(http://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=gse66615).原始的读测序数据已经存储在NCBI Sequence read Archive (http://www.ncbi.nlm.nih.gov/Traces/sra)使用BioProject Incession Number Prjna277458可访问。
作者的贡献
LC,CFL和MZY构思和设计研究。LC,CFL和YXX起草和修订的手稿。CFL,CLM,JQM和JQJ分析数据。CFL和DJH进行的qRT-PCR的实验,并在NCBI序列读数存档数据库沉积在测序数据。所有作者均已读取并批准最终手稿。
竞争利益
两位作者宣称他们没有相互竞争的利益。
同意出版
不适用。
伦理批准和同意参与
不适用。
作者信息
从属关系
通讯作者
权利和权限
开放访问本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于在这篇文章中可用,除非另有说明数据。
关于这篇文章
引用这篇文章
李CF.,徐YX.、马、金桥。et al。生物化学和转录组分析显示“Anji Baicha”的三种颜色和发育阶段不同代谢物生物合成谱(茶树).BMC植物杂志16,195(2016)。https://doi.org/10.1186/s12870-016-0885-2
收到:
接受:
发表:
关键字
- 白化
- 茶树
- 类胡萝卜素
- 叶绿素
- RNA-seq
- Theemine.
- 茶