摘要
背景
大丽黄萎病菌是使负责在棉花产量相当跌幅枯萎病的疾病的植物病原性真菌病原体。所述复杂的机构棉花电阻底层到轮枝菌属枯萎病仍然没有特征。鉴定内源性抗性基因可能有助于控制这种疾病。
结果
我们克隆了核糖体蛋白就是(GaRPL18)介导抗药性的基因轮枝菌属枯萎病,来自抗枯萎病的棉花品种(木本棉)然后,我们分析了该基因在棉花和棉花中的功能拟南芥植物。GaRPL18编码一个60S核糖体蛋白亚基,对细胞内蛋白质的生物合成很重要。然而,以往的研究表明,一些核糖体蛋白也对人类的肿瘤发生和先天性疾病有抑制作用,并在植物病害防御中发挥作用。这里,我们观察到大丽花感染诱发GaRPL18表达式。此外,我们确定GaRPL18表达模式与不同棉花品种的抗病水平一致。GaRPL18通过水杨酸(SA)处理,表达上调,提示参与GaRPL18在SA信号转导途径中,利用病毒诱导的基因沉默技术来确定GaRPL18表达水平影响棉花抗病性.抗萎蔫的棉花品种GaRPL18被沉默的人变得更容易受到伤害大丽花因为免疫相关分子的丰度显著降低。我们也改变了拟南芥生态型哥伦比亚(Col-0)植物GaRPL18按花浸法.植物overexpressingGaRPL18更能抵抗大丽花感染率高于野生型Col-0植物.转基因抗病性增强拟南芥植物大丽花可能是由SA途径介导的。
结论
我们的发现为GaRPL18,表明它在抗棉花“癌症”中起着至关重要的作用轮枝菌属枯萎病,主要受sa相关信号通路机制调控。
背景
大丽黄萎病菌Kleb。是一种破坏性的植物病原真菌,可对400多种植物造成枯萎病,包括棉花(木本棉) [1.,2.].大丽黄萎病菌通过穿透根感染棉花。然后它传播到根皮层并侵入木质部导管,在那里形成分生孢子,负责维管组织的定植和功能损伤。这会导致几种症状,包括萎蔫、变色、坏死和落叶[3.–6.].棉纤维的质量和产量每年减少作为结果轮枝菌属引起的枯萎大丽花严重的疫情可能导致产量损失超过30%[7.,8.].在中国,超过40%的棉花种植面积受到气候变化的威胁轮枝菌属萎蔫,每年可能导致棉花产量大幅下降和严重的经济损失。此外,即使没有寄主,这种真菌也能在土壤中长期存活,使轮枝菌属利用实际有效的化学处理难以控制枯萎病[9,10].许多方法被用来减少发病率轮枝菌属如应用耕作、土壤日晒、土壤改良剂和生物防治等。然而,这些方法并不总是有效的[11,12].土壤熏蒸是目前最有效的抑制黄斑病菌繁殖的处理方法轮枝菌属种,是昂贵的,可能对人体健康和环境[致命影响7.,13].抗病候选基因的鉴定和分离,以及抗病转基因棉花品种的开发,对于管理棉花品种至关重要轮枝菌属萎蔫[14–16].
核糖体蛋白(RP)在原核生物和真核生物中具有不同的复杂结构。真核核糖体由两个不相等的亚基(60S和40S)、四个核糖体rna(rRNAs)和82个不同的RPs组成。小核糖体亚单位由单个18S rRNA和大约33种蛋白质组成,而大亚单位由28S/25S、5.8S和5S rRNA以及大约49种蛋白质组成[17–19].核糖体是一种高度保守的蛋白质,对细胞活动至关重要。虽然其主要功能是合成蛋白质,但最近的深入研究表明,它对细胞的生长、分裂、发育和基因调控也很重要[20.–22].最近,研究已经表明,核糖体蛋白L3赋予抗性的N-端99个氨基酸到美洲商陆抗病毒蛋白和过表达镰刀菌素烟草中的霉菌毒素脱氧雪腐镰刀菌醇[23]另一项研究表明,核糖体蛋白L12和核糖体蛋白L19在小鼠的非宿主抗病性中起重要作用n benthamiana和拟南芥此外,这些基因在对有毒病原体的基本抗性中也起着次要作用[24]特别是,最近一项检测核糖体蛋白S14(RPS14)和癌症的研究得出结论,该蛋白可与小鼠双分钟2(MDM2)特异性相互作用通过MDM2泛素抑制p53的降解,从而促进p53活性。在胃癌和结直肠癌细胞中,在大量RPS14存在的情况下,细胞周期被阻滞,肿瘤细胞生长被抑制[25].另一项研究显示核糖体蛋白L4也可以调节MDM2-p53环来调节p53活性[26]虽然这些研究表明RPs对抗病性很重要,但它们不包括棉花品种。因此,更全面地描述棉花RP的功能可能有助于棉花育种轮枝菌属抗黄萎病棉花品种。
在自然条件下,植物经常会遇到各种潜在的病原体。植物不断进化以应对这些生物胁迫。例如,植物已经进化出一种免疫系统,其中包括组成性和诱导性防御系统,可以提供保护,防止潜在的危险病原体[27,28].植物还产生一些内源性信号分子,帮助调节植物的防御反应,包括茉莉酸(JA)、水杨酸(SA)和乙烯(ET),它们都参与复杂的信号转导网络。这些生化分子协同或拮抗地发挥作用,增强植物对不同病原体的抵抗力[29–32].我们的研究表明,棉花核糖体蛋白就是(GaRPL18)的表达水平可被积累的SA上调,提示RPs可介导棉花对棉花的抗性轮枝菌属通过SA信号通路枯萎。虽然SA是植物防御和获得性全身抵抗力是至关重要的,它主要是参与了前[33,34].外源SA在植物病原菌侵袭组织中表达的增加和外源SA的应用诱导了表达发病相关(公关)基因,从而增强对入侵病原体的抵抗力[35,36].植物免疫反应的激活也与活性氧中间体和一氧化氮(NO)水平的增加有关[37].虽然所有植物反应机制的信号转导网络是复杂的,但不同的信号分子和网络之间的串扰为植物提供了一种强有力的调节免疫反应的手段[38,39].
在这项研究中,我们着重于确定是否GaRPL18对棉花抗性重要吗轮枝菌属必造成的大丽花我们的目标也是鉴定与棉花防御反应相关的信号通路GaRPL18,我们收获了亚洲棉‘湖南昌德铁子面’样品经不同时间点处理后大丽花,茉莉酸甲酯(MeJA), SA, ETGaRPL18随后表达水平显著升高大丽花和SA)治疗。此外,我们采用病毒诱导基因沉默(VIGS)技术和转基因拟南芥行overexpressingGaRPL18从功能上描述GaRPL18在棉花。互补生理学和分子实验证实了这一点GaRPL18对棉花抗真菌枯萎病有显著贡献大丽花通过与SA信号通路相关的机制。我们的发现为棉花RP基因的分子特征和功能提供了深刻的见解轮枝菌属必.
方法
植物来源及生长条件
种子亚洲棉‘湖南长德铁丝棉’和‘南尚祛小花’分别来自中国农业科学院棉花研究所。这个GaRPL18超表达载体(即35S::GaRPL18)插入野生型(WT)拟南芥哥伦比亚生态型(Col-0)植物。用35S::GaRPL18在22°C和60%相对湿度的温室中,在16小时光照/8小时暗光周期下生长。种子来自不同的地方亚洲棉栽培品种在另一个温室中,在25°C和80%的相对湿度下,16小时光照/8小时暗光周期下培养。
培养大丽黄萎病菌以及植物的接种
对抗性落叶大丽黄萎病菌分离株(Vd07038)在马铃薯葡萄糖琼脂培养基上25℃培养6 d。然后在Czapek培养基[3% (w/v)蔗糖,0.2% (w/v)纳米培养基中培养菌落3.,0.05%(w/v)MgSO4. · 7小时2.O, 0.05% (w/v)氯化钾,0.002% (w/v) FeSO4. · 7小时2.O、0.131% (w/v) KH2.阿宝4.在25°C摇晃(150转/分)5-7天。为大丽花处理,将10ml悬浮液分生孢子(107.无菌蒸馏水分生孢子/ml)。同样的,拟南芥在使用无菌针头将10毫升分生孢子悬浮液注入土壤之前,植物生长了20天。对照植物接种等量的无菌蒸馏水。对于离体处理,幼苗接种大丽花,并使用先前描述的方法[测定发育不良的程度40].幼苗接种2μl分生孢子悬浮液(5 × 103.分生孢子/ml)萌发后2周。
cDNA的克隆与构建GaRPL18超表达构建
总RNA提取大丽花-抵抗力G.arboreum'利用RNAprep Pure Plant Kit(天根,北京,中国)的湖南昌德铁子棉植物。以纯化的RNA为模板,用PrimeScript™II 1st Strand cDNA Synthesis Kit (Takara, Dalian, China)制备cDNA。450 - bp全身GaRPL18编码序列与XBA我和AscI使用引物GaRPL18-F和GaRPL18-R克隆连接子(表1.).对于过度表达的研究35S::GaRPL18载体是通过消化GaRPL18编码序列与XBA我和Asc我(生物学实验室)。然后将酶切后的序列插入到修饰的pCAMBIA3300 (Cambia)植物二元载体中草丁膦(巴斯塔耐药基因。这个向量被用来进行变换根癌土壤杆菌对菌株GV3101进行冻融处理。
生物信息学分析
我们使用国家生物技术信息中心的在线BLAST工具来分析GaRPL18序列(https://blast.ncbi.nlm.nih.gov/Blast.cgi)。然后使用基因结构显示服务器2.0分析基因结构。我们还使用了ExPASy在线工具(http://web.expasy.org/compute_pi/)来预测等电点和分子量。用PyMOL程序绘制了三维结构的图像(http://www.pymol.org/).
病毒诱导基因沉默结构的产生和病原菌接种
我们使用棉花叶皱病毒基于(CLCrV)的VIG载体(即pCLCrVA和pCLCrVB),以CLCrV:CHLI(编码镁螯合酶亚单位i)作为阳性对照[41.,42.].这个GaRPL18采用聚合酶链反应(PCR)扩增片段‘HuNanChangDeTieZiMian’cDNA和VGaRPL18-F/VGaRPL18-R引物(见表)1.).PCR产物经酶切Spe我和AscI (BioLabs)并插入pCLCrVA载体。结构(即pCLCrVA-GaRPL18, pCLCrVA和pCLCrVB)进行转化农菌株GV3101。7日龄的子叶轮枝菌属然后将等量的CLCrV载体注入抗枯萎病的棉花幼苗。棉花苗在黑暗中孵育24小时后移入温室接种V.大丽花,病媒渗入后10天
拟南芥转化与分子分析
根癌土壤杆菌菌株GV3101含有GaRPL18利用过表达载体进行变换拟南芥Col-0通过花浸法[43.].T0然后将转基因种子均匀地铺于花盆中,1周后,向幼苗喷洒0.1% Basta以筛选出阳性转化子。假阳性的幼苗在死亡前会变黄。转基因T1.在含有0.1% Basta的Murashige和Skoog (MS)培养基上进行筛选。几天后,分离比约3:1(即Basta抗性:Basta敏感)的品系被用来产生T2.行。转基因T2.代中也选择MS培养基上含有Basta的识别Ť3.纯合子系3.与转基因和正确的偏析比系中检测的基础上定量逆转录(QRT)-PCR分析GaRPL18表达式。只有稳定的纯合子T4.表现出高强度的线条GaRPL18选择表达水平进行进一步的功能分析。
定量逆转录聚合酶链反应
我们从棉花的根和叶中提取了总RNA,也从棉花的叶中提取了总RNAGaRPL18-过度表达拟南芥和WT植物使用RNAprep纯植物试剂盒。使用PrimeScript™RT Reagent Kit和gDNA Eraser (Perfect Real Time;豆类)。这个Gahistone3(Cotton_A_11188)和ubiquitin10(accession: At4g05320)基因作为棉花和玉米的内控基因拟南芥,分别。我们用Primer Premier 6.0程序设计了所有qRT-PCR引物(见表)1.).以稀释后的cDNA为模板,用SYBR进行qRT-PCR®Premix Ex Taq™(Tli RNaseH Plus;Takara)和ABI 7900 qRT-PCR系统(Applied Biosystems, CA, USA)。三步法PCR条件为:95℃30 s, 95℃5 s, 60℃30 s,共40个循环。我们分析了每个反应的解离曲线,并使用了2−ΔΔCT方法(44.]来计算每个目的基因的表达水平。所有反应都进行至少3个生物重复。
量化大丽黄萎病菌殖民
我们使用了前面描述的定量RT-PCR方法检测和定量大丽花殖民。用V-QPCR-F和V-QPCR-R引物进行qRT-PCR分析(表1.)已按上文所述完成[45.].
茉莉酸甲酯,水杨酸和乙烯处理
用1mm的MeJA、SA或ET溶液处理植株。棉或拟南芥幼苗生长在温室中培育的花盆中。在叶面期用不同的溶液喷洒。对照植物用相同pH值的水处理。
游离水杨酸、一氧化氮、H2.O2.,过氧化氢酶水平
免疫系统相关分子SA NO H的丰度2.O2.,过氧化氢酶(CAT)检测方法不同。游离SA含量由Rigol L3000高效液相色谱系统(中国北京)测定,如前所述[46.].我们在液氮中研磨叶片样品,以便后续测量NO, H2.O2.,和CAT水平使用定量试剂盒(南京建城,北京,中国)。
细胞死亡分析
如前所述,用台台蓝染色法观察植物细胞死亡[47.].用台台蓝染料(1克苯酚、1毫克台台蓝、1毫升乳酸、1毫升甘油溶于1毫升无菌蒸馏水)浸泡叶片,煮沸染色。冷却至室温后,用水合氯醛溶液(2.5 g/ml)脱色。
大丽黄萎病菌恢复试验
确定某一事件的影响大丽花棉花感染拟南芥我们分析了第一个茎节的茎片段拟南芥茎长分别为4.5厘米和3厘米。按照前面描述的方法清洁茎[48.,然后切成六份。将茎段置于培养皿中马铃薯葡萄糖琼脂上,25°C孵育。植物对感染的敏感性是根据真菌生长的茎节的数量来确定的。
疾病指数、发育迟缓和黄化分析
对棉花植株,病害指数(DI)按公式计算:DI =[(∑病害等级×病株数)/(检株总数× 4)] × 100%。根据子叶和真叶的症状,将幼苗分为0级、1级、2级、3级和4级[49.,50.].疾病严重程度拟南芥按照0-5等级对植物进行分级,DI按前面所述的公式计算[40]:DI = [(∑疾病等级 × 受感染植物数量)/(受检植物总数 × 5)] × 100%. DI代表了植物健康的一个全面和客观的度量,高DI值对应于严重感染。发育迟缓的程度按0-3分(0 = 没有发育迟缓;1 = 叶面积适度减少 = 叶面积显著减少 = 叶面积、叶数和茎长显著减少)。叶褪绿症的评分为0-4分(0 = 无症状;1 = 高达25%的褪绿叶;2 = 高达50%的褪绿叶;3 = 高达75%的褪绿叶;4 = 高达100%的褪绿叶)[40].
结果
分析GaRPL18在棉花植物的结构和表达模式与处理大丽黄萎病菌还是荷尔蒙
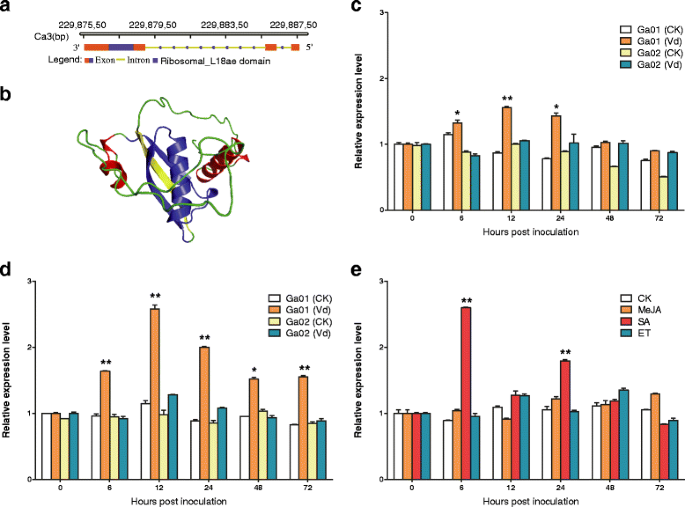
基于一项未发表的疾病反应的转录组学分析结果亚洲棉植物,我们分析了GaRPL18片段序列.‘湖南昌德铁丝棉’和‘南山曲小花’均对其具有抗性和敏感轮枝菌属分别枯萎.我们克隆了全长1211bp的基因GaRPL18用GaRPL18-F和GaRPL18-R引物测序1.)连同“HuNanChangDeTieZiMian”的cDNA。GaRPL18被定位到Ca3染色体上。定位于参考基因组22987558 bp与22988768 bp之间的互补链上。使用基因结构显示服务器2.0程序分析基因结构。外显子和内含子分别以彩色框和绿色线显示(图2)。1).GaRPL18包含2个内含子和3个外显子,长度分别为49、64和450 bp(从右到左)。该基因由一个450 bp的开放阅读框组成,编码149个氨基酸。1).GaRPL18也包含一个保守的核糖体l18ae结构域序列(图中蓝框表示)。1)根据ExPASy online工具计算出编码蛋白质的理论等电点和分子量分别为10.46和17.9KDa。3D结构显示核糖体_L18ae结构域(图中以蓝色表示)。1 b)主要由β转弯和α螺旋组成。因为GaRPL18的功能未知,尤其是在大丽花我们检查了受感染的棉花植株GaRPL18样本中的表达模式轮枝菌属接种后不同时间点的抗病性和感病棉系.这个GaRPL18在试验期间,水处理的对照植物的表达水平是稳定的(图。1 c, d).相比之下,GaRPL18敏感棉花植株的表达水平波动。此外,在轮枝菌属抗枯萎病的棉花植株大丽花,GaRPL18接种后6 h,根和叶的表达量显著上调,12 h后达到峰值。识别与之相关的信号通路GaRPL18,我们检查了GaRPL18激素处理的‘湖南长德铁子面’植物的表达模式我们观察到,GaRPL18植物激素对其表达有不同程度的影响。GaRPL18在施用外源SA后,表达迅速被诱导,在处理后6小时达到峰值,但在MeJA或ET处理后仍保持在基线水平(图)。1 e).这些结果表明,GaRPL18提高棉花的阻力大丽花,并影响sa介导的信号通路。
的结构分析和表达模式GaRPL18在下面大丽黄萎病菌棉花的胁迫或激素处理。A.基因结构分析。B蛋白质三维结构。c, d播种3周后,棉花成苗‘湖南changdetiezimian '(耐药,Ga01)和‘接种纳桑曲晓华(敏感,Ga02)大丽花孢子或同等无菌蒸馏水(模拟对照)。c的样本是叶,d是根。E抗性棉的叶子(‘用外源激素或同等无菌蒸馏水处理HuNanChangDeTieZiMian')。在0、6、12、24、48和72 hpi下收获模拟和处理的根和叶,并使用qRT PCR测定表达水平Gahiston3作为内部参考基因。模拟对照的表达水平标准化为“1”,误差条表示三个生物复制的标准偏差。星号表示统计上的显著差异,由Student的T以及(*P< 0.05;**P <0.001)
之间的相互作用GaRPL18和公关基因
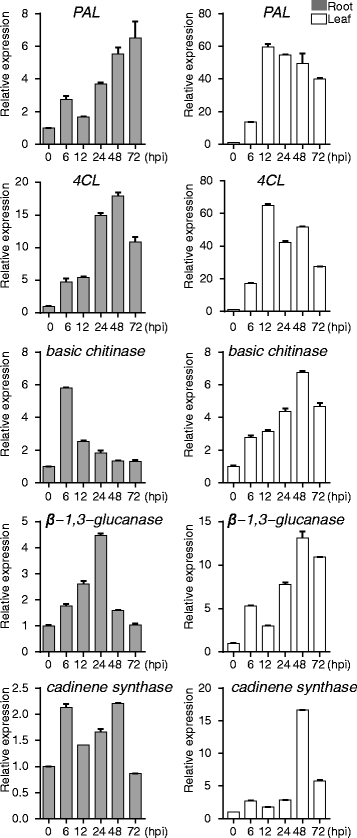
为了进一步澄清GaRPL18在轮枝菌属在棉花抗枯萎病植株中,我们监测了表达水平公关接种抗枯萎病棉花植株后不同时间点的基因大丽花.苯丙代谢是棉花防御反应的关键,涉及核心基因苯丙氨酸氨裂解酶(朋友;棉纤维(A_00465)和4-香豆酸:辅酶A连接酶(四氯化碳;棉花(A_02864)[51.].在叶组织中GaRPL18-相关的朋友和四氯化碳基因在12 h表达量最高,而四氯化碳在48 h后,根系的数量达到最大值。朋友在接种的植物中,表达水平继续增加基本几丁质酶(Cotton_A_36866)和β1,3-glucanase(Cotton_A_36866)基因对植物抗病非常重要,因为编码的酶可以分解病原菌的细胞壁,从而保护植物免受病害[27].在叶片中,表达水平GaRPL18-相关的基本几丁质酶和β-1,3-葡聚糖酶基因48小时后达到峰值。相比之下,最高基本几丁质酶和β-1,3-葡聚糖酶分别在6 h和24 h后观察其在根中的表达水平。杜松烯合酶(Cotton_A_34493)是一个参与合成萜类化合物的关键基因,萜类化合物是棉花中重要的植物抗毒素[52.].这个杜松烯合酶在接种植株的叶片和根系中表达量迅速增加,在48 h后达到峰值(图2)。2.).
沉默的GaRPL18棉花的抗病性大大减弱大丽黄萎病菌
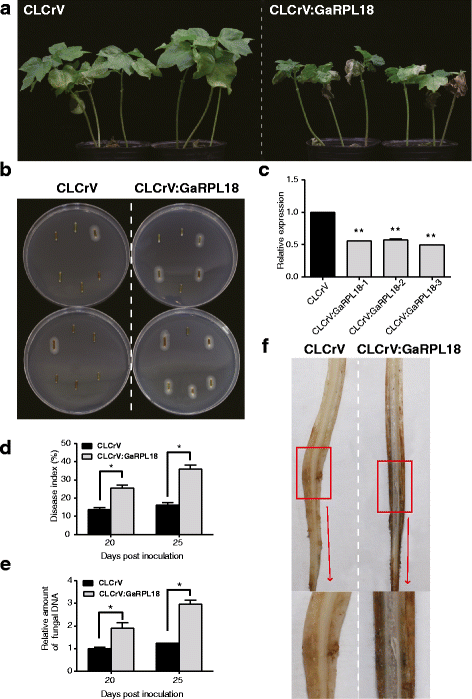
为了澄清的作用GaRPL18在棉花反应中大丽花,我们使用基于CLCrV的VIG生成GaRPL18-可拆卸的植物.“湖南长得铁子面”两周后,植物进行了一次试验根癌土壤杆菌采用qRT-PCR方法对基因沉默效率进行评价。丰富的GaRPL18与对照组相比,CLCrV:GaRPL18植物的转录本显著降低(图2)。3C),这表明GaRPL18在这些植物中被有效地沉默了。此外,后大丽花接种CLCrV:GaRPL18后,病媒控制植株组织无明显病害症状,而CLCrV:GaRPL18植株叶片坏死、发黄、发育不良、萎蔫。3A).使用回收率分析,我们检查了大丽花在被处理植物的感染茎上定殖该分析被用来确定真菌对每种植物的毒力。在CLCrV:GaRPL18植株中,真菌菌落数量比CLCrV对照植株多(图2)。3B.).我们使用DI值来确认棉花植株对大丽花在没有GaRPL18表达式。在接种后20和25 d (dpi), CLCrV:GaRPL18植株的DI值显著高于对照植株(图2)。3d).
核糖体蛋白GaRPL18与棉花的抗性有关大丽花.A.引起的疾病症状大丽花在25 dpi条件下,对空媒虫对照植株和CLCrV:GaRPL18植株的叶片进行了抑菌试验。B25-dpi茎段在PDA培养基上,25°C孵育。电镀后7天拍照。C转录水平的GaRPL18在空载体对照植物和CLCrV:GaRPL18植物的叶片中,通过使用Gahiston3作为内参基因。CLCrV值归一化为“1”。D20 dpi和25 dpi时疾病指数(DI)的评估。误差条表示三个生物重复的标准偏差(N≥30)。E水平大丽黄萎病菌利用qRT-PCR方法测定了空媒生物对照植株和CLCrV:GaRPL18植株叶片生物量的变化。误差棒代表三个生物重复的标准偏差。星号表示统计上的显著差异,由学生的决定T以及(*P< 0.05;**P< 0.001)。F感染的CLCrV:GaRPL18植株在25 dpi时木质部出现维管褐变
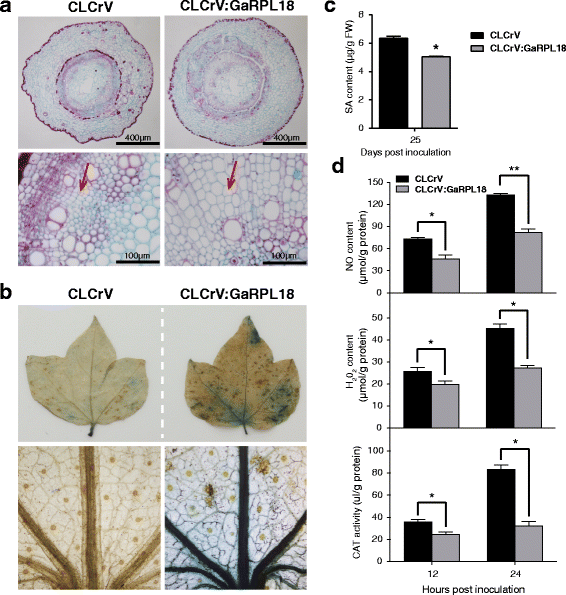
使用定量RT-PCR,我们量化大丽花殖民的水平。的表达水平大丽花基因表明CLCrV: GaRPL18植物更敏感大丽花而不是控制(图。3E).此外,我们还观察到CLCrV:GaRPL18植株的木质部表现出比对照更大的维管褐变(图2)。3F)对接种植株的棉花细胞形态进行的额外检查表明,CLCrV:GaRPL18植株的维管束细胞比对照植株的维管束细胞更长、更大(图。4A).这可能是因为大丽花菌丝体可能比对照更容易穿透CLCrV:GaRPL18植物大丽花,我们用台盼蓝染色死细胞。与对照叶片相比,CLCrV:GaRPL18叶片的台盼蓝染色区域更大,颜色更强烈,尤其是叶脉部位(图2)。4B).
基因沉默效应GaRPL18在棉花下大丽花压力。A.CLCrV和CLCrV:GaRPL18棉花植株茎在25 dpi时的细胞形态观察。B用台盼蓝染色观察CLCrV和CLCrV:GaRPL18棉株叶片在25dpi时的细胞死亡情况。C通过HPLC测量CLCrV和CLCrV:GaRPL18棉花植株在25 dpi下的SA含量。条形代表三个生物重复的标准误差。星号表示统计上的显著差异(Student'sT以及;*P <0.05).D以CLCrV和CLCrV:GaRPL18棉花植株为材料,分别在12 hpi和24 hpi条件下采收叶片,测定NO、H的含量2.O2.和猫。误差棒代表三个生物重复的标准偏差。星号表示与对照组相比有统计学意义的差异(学生的T以及;*P< 0.05;**P <0.001)
水杨酸,一氧化氮,H2.O2.,过氧化氢酶水平下降GaRPL18——沉默的棉花植株大丽黄萎病菌感染
进一步评估GaRPL18及其与棉花防御反应中SA通路的关系大丽花感染后,我们分析了SA的含量和其他几种免疫应答化合物(NO, H2.O2.,和猫)在大丽花治疗的植物。所有化合物在接种CLCrV:GaRPL18植株中的含量均低于CLCrV对照植株。4c,d).这些结果表明,沉默GaRPL18在抗枯萎的棉花植株中大丽花-SA、NO、H的诱导产生2.O2.,和CAT,进一步确认GaRPL18与SA信号通路密切相关。
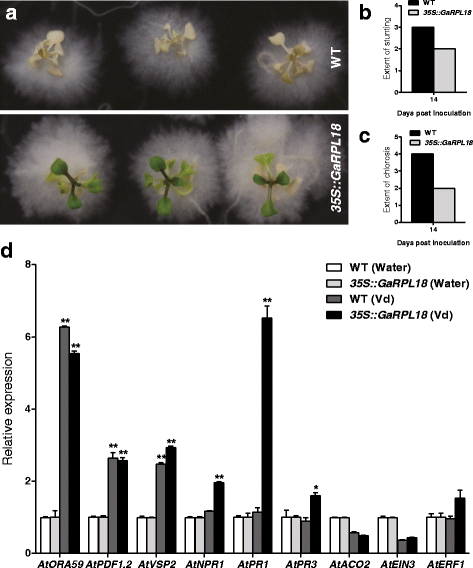
转基因拟南芥种子overexpressingGaRPL18在大小和重量上增加,而幼苗变得更能抵抗大丽黄萎病菌
拟南芥转化生态型Col-0,得到过表达的转基因株系GaRPL18在35S启动子的控制下。然后采用多种方法选择纯合子GaRPL18-overexpressing转基因品系,其包括0.1%Basta的治疗,PCR,和qRT-PCR(附加文件1.:图S1a-e)。我们观察到种子的稳定性GaRPL18-overexpressing T4.植物比野生植物大(附加文件)1.:图S1f)。对每1000粒成熟干种子的种子重量、种子长度、种子宽度和长宽比的分析表明,这些值较高GaRPL18-与野生型对照相比,过度表达转基因植物,尽管这种差异在长宽比上并不显著(另附文件1.:图S1g-i)。然后我们使用体外技术来评估耐药性拟南芥苗,大丽花.这个GaRPL18-overexpressing转基因植物与日常的野生型植物进行比较。正如预期的那样,转基因拟南芥植物对病毒的抗性更强轮枝菌属所有野生植株在接种后14天内死亡大丽花,而转基因植物仍然活着(图。5A)在野生型植株中,早在5 dpi时就观察到萎蔫,植株迅速变黄,生长受阻。在14 dpi时,观察到野生型叶片比转基因叶片(2级)发育更差(3级)。此外,野生型植物(4级)的失绿症比转基因植物(2级)更严重(图。5b,c).这进一步证实了转基因拟南芥植物overexpressingGaRPL18更能抵抗轮枝菌属枯萎比野生型植物。
过度表达的影响GaGRPL18在里面拟南芥水稻幼苗及其信号通路相关标记基因的效应大丽花压力。A.离体培养苗的疾病症状。对2周龄的苗进行处理大丽花。接种后14天拍摄照片。BWT和35S::GaRPL18植物在14 dpi。C野生型和野生型叶片褪绿程度35S::GaRPL18植物在14 dpi。WT:野生型。DJA、SA和ET信号通路相关标记基因在WT和ET中的表达模式GaRPL18转基因拟南芥在水或大丽花挑战24小时。使用qRT-PCR检测表达水平AtUBQ10作为内部对照基因。未处理对照的表达水平标准化为“1”。误差条表示三个生物复制的标准偏差。星号表示统计上的显著差异,由Student的T以及(*P< 0.05;**P <0.001). 野生型
影响GaRPL18水杨酸信号通路的过度表达大丽黄萎病菌对待转基因拟南芥植物
我们研究的信号传导途径有关的基因的表达水平,包括那些参与生物合成JA [即,octadecanoid-responsive拟南芥AP2/ERF结构域蛋白59(AtORA59),植物defensin 1.2(AtPDF1.2),及营养贮藏蛋白2(AtVSP2)], SA生物合成[即,发病相关基因的非表达(AtNPR1),致病相关基因1(AtPR1),及致病相关基因3(AtPR3), ET生物合成[即,氨基环丙烷羧酸氧化酶2(AtACO2),乙烯不敏感3(AtEIN3),及乙烯反应因子1(AtERF1)]。如图所示。5D的表达,GaRPL18在Col-0背景下,不影响JA、SA和ET通路相关基因的表达;这些标记基因在WT和过度表达的植物中的表达水平相似,而不影响其表达大丽花压力。此外,JA-和et相关标记基因的表达水平在WT对照组和对照组之间总体相似GaRPL18-overexpressing转基因拟南芥接种后24小时(hpi)的植株。而sa相关基因在转基因植株的莲座叶片中表达量高于野生型植株。WT叶片中的表达水平没有变化(图。5D).因此,GaRPL18过表达对JA和ET生物合成的信号转导通路影响不大,但对SA生物合成信号转导通路影响显著。
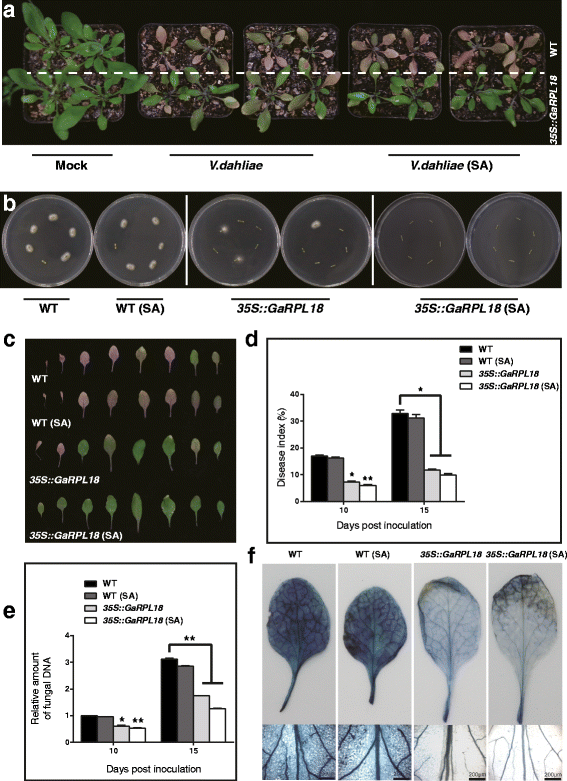
外源水杨酸的施用提高了转基因植株的抗性拟南芥植物大丽黄萎病菌
我们检查了这些细菌的抵抗力GaRPL18-过表达转基因拟南芥植物大丽花感染。当T4.这些株系接种了细菌大丽花转基因植株明显比野生型植株对该真菌更具抗性。然后我们对野生型和转基因的莲座叶进行预处理拟南芥用1 mM SA处理幼苗24 h,然后接种叶片大丽花每天补充外源性SA治疗4天。转基因拟南芥植物对大丽花相比于SA处理后的WT植株(图。6A)此外,我们使用恢复试验检测了受感染的WT和转基因茎的定殖情况大丽花.野生型、转基因和sa处理的转基因植株的菌落数量差异显著。总体而言,转基因植株的生长情况优于野生型植株,其中sa处理的转基因植株表现出最大的抗性大丽花.WT和SA处理的WT植物之间没有差异(图。6B).这进一步证明了两者之间的关系GaRPL18和SA。以更清楚地观察大丽花在莲座叶片上,我们以15 dpi的速度摘除莲座叶片。与我们之前的研究结果一致,SA处理增强了转基因植株的抗性拟南芥莲座丛叶大丽花,但对野生型叶片影响不大(图。6C).
过度表达的效果GaRPL18和外源性SA的防御反应大丽花在里面拟南芥。A.引起的疾病症状大丽花菌株对WT莲座叶片的影响,GaRPL18过表达植物和外源sa处理植物。接种3周龄幼苗V.大丽花,和预处理的转基因拟南芥野生型幼苗莲座叶1毫米SA接种前24小时大丽花.然后,每天补充外源性SA,直到4天。对照植物被喷了水。照片拍摄于15 dpi。B15-dpi茎段在PDA培养基上,25°C孵育。电镀后7天拍照。C的观察拟南芥莲座叶。D在10dpi和15dpi时评估疾病指数(DI)。误差棒表示三个生物重复的标准偏差(N≥30)。星号表示与对照组相比有统计学意义的差异(学生的T以及;*P< 0.05;**P< 0.001)。E生物量的量化大丽花通过中存在使用AtUBQ10作为WT莲座叶上的内控基因,GaRPL18在10 dpi和15 dpi下过度表达的植株和SA处理的植株。误差条表示三个生物复制的标准偏差。星号表示统计上的显著差异,由学生的T以及(*P< 0.05;**P< 0.001)。F台盼蓝染色用于观察叶片细胞死亡拟南芥15岁dpi
我们计算了DI值并对其进行了量化大丽花利用qRT-PCR对WT植物、sa处理的WT植物、转基因植物和sa处理的转基因植物进行定殖。WT植株的DI值显著高于转基因植株,包括SA处理植株(图2)。6D.)对真菌基因表达水平的分析表明,SA处理的转基因植物最具抗病性,而WT植物最易感病(图。6E).台台蓝染色结果与野生型和sa处理的野生型相似。我们观察到深蓝色的叶脉和大面积染色的叶肉区域。转基因叶片叶脉呈浅蓝色,叶肉染色不广泛。这些观察结果与sa处理的转基因植株具有更强的抗病能力是一致的。1207米).
讨论
轮枝菌属枯萎病是植物最致命的真菌病害之一,严重降低了棉花的品质和年产量。因此,阐明了棉花抗枯萎病的分子机制大丽花是培育抗病棉花新品种的关键。先前的研究涉及大丽花感染表明,这种病原体通过在根部发芽来攻击易感植物。然后,它利用各种机制通过根皮层进入植物的维管系统,从而允许植物进一步定植。当真菌完全感染植物时,它会产生微孢子,这些孢子在土壤中保持稳定和休眠,直到它们接触到新的宿主[53.].培育抗虫棉新品种轮枝菌属张伯伦,需要更多的研究来确定与抗性相关的基因。技术进步促进了基因的挖掘和功能分析。有一些报道描述了与抗性相关的蛋白质编码基因的应用大丽花开发转基因植物拟南芥能抑制疾病发展的植物。这些基因包括编码谷胱甘肽s -转移酶的基因[54.,55.、限速酶[56.和转录调节因子[57.].然而,涉及基因挖掘工作一直不足,而中国的产棉区仍受到年爆发轮枝菌属枯萎。棉花枯萎病抗性基因的缺乏,使棉花枯萎病抗性基因的鉴定和功能鉴定成为可能大丽花抗病性相关基因对棉花抗枯萎病新品种的培育至关重要。在这项研究中,我们证实了这一点GaRPL18,它编码RP,影响抗轮枝菌属枯萎。
RPs在蛋白质合成过程中的功能和特性已经得到了深入的研究,最近的深入研究证实了RPs在其他过程中也有重要的作用[20.–22]特别是,一些研究表明PRs在植物抗病性中起着重要作用[23,24]最近的癌症研究得出结论,RPs可以调节MDM2–p53调节环中关键基因的表达,从而促进p53活性并抑制肿瘤生长[25,26,58.–60.].此外,RP还有其他与抗病有关的作用。例如,突变为RPS19与先天性红细胞减少有关,红细胞前体丰度减少或缺乏[61.].然而,rp编码基因在棉花抗病过程中的功能和特性目前尚不清楚大丽花.在本研究中,我们确定RP介导了棉花植株的抗性大丽花.
确认GaRPL18在棉花的抗病反应中,利用从抗枯萎病棉花植株中提取的RNA所产生的cDNA克隆了该基因。我们还分析了GaRPL18不同棉花品种处理后的表达模式大丽花。这个GaRPL18在抗枯萎病棉花植株中,表达量迅速且显著上调,而在易感枯萎病棉花植株中表达量相对不变。然后我们检查了公关抗萎蔫棉花植株的基因。我们确认了棉花的抗性大丽花从一起起作用的各种疾病抗性系统之间的相互作用的结果,以抵抗病原体的入侵。利用VIGS技术,我们确定的是,沉默GaRPL18在抗枯萎病的棉花植株中,抗枯萎病能力显著降低大丽花.此外,NO, H2.O2., CAT含量在棉花植株中较低GaRPL18比在病媒控制植物中更沉默大丽花诱导NO含量的增加,这对植物的抗病有重要作用[62.].一项较早的研究得出结论,H2.O2.抗病番茄植株中的CAT含量显著高于对照植株,CAT在早期防御反应中起着重要作用[63.].我们的结果表明,NO, H2.O2.,而CAT会影响GaRPL18-对大丽花棉花的植物。这些观察证实了GaRPL18对棉花抗性重要吗大丽花,这与报道的其他rp的抗癌作用一致。我们使用了转基因拟南芥植物进一步分析大丽花基于DI值的抗病性状,大丽花定植、台盼蓝染色和恢复试验。此外,随着真菌生长和传播的增加,野生型植物的莲座叶逐渐出现疾病症状,而野生型植物的莲座叶几乎没有疾病症状GaRPL18-过度表达的转基因植物。这意味着该真菌在转基因植物的根中受到抑制,并阻止其扩散到莲座叶中。此外,在离体条件下分析了小麦的抗枯萎病能力GaRPL18-overexpressing拟南芥植物进一步证实了植物的作用GaRPL18植物体内防御反应大丽花.这表明,GaRPL18的积累极大地阻碍了病原菌的定植,甚至在苗期也是如此。总之,我们确认了这一点GaRPL18-过表达的转基因植株对大丽花比野生型植物多,且其程度大丽花转基因植株的定殖率显著低于野生型植株。
我们还观察到GaRPL18SA快速上调表达,在应用激素后6小时达到峰值水平。相比之下,MeJA和ET处理对表达的影响最小GaRPL18表示因此,我们假设GaRPL18可能与SA信号通路有关。这是由SA水平的显著下降证实的大丽花感染的CLCrV:GaRPL18植物。SA的在受胁迫植物的信令可以刺激下游抗病基因的表达的激活,以提供从病原体[保护64.,65.]有许多基因与SA信号通路相关,包括NPR1,PR1,PR3,沃克斯,AtGSTF6[66.–69.].为了验证这些结果,我们检测了JA-、SA-和et相关标记基因的表达水平大丽花来华的转基因拟南芥植物overexpressingGaRPL18.SA信号通路相关基因的上调表达(即。,AtNPR1,AtPR1,AtPR3)和SA含量证实了我们的假设。为了进一步澄清两者之间的联系GaRPL18和SA信令,我们处理的转基因和野生型植物外源SA,并且观察到,激素的转基因植物的抗性显著增加至大丽花这些发现意味着GaRPL18与SA信号通路协同工作,对细菌具有强烈的抗菌作用大丽花因此GaRPL18可能对繁殖有用轮枝菌属抗黄萎病棉花品种。
结论
据我们所知,这项研究是第一次检验RP功能与棉花抗药性的关系大丽花.我们使用VIGS技术证实了这一点GaRPL18对棉花的抗性有重要意义吗大丽花感染。我们的数据还表明,育种新的品种,过度表达GaRPL18也许是一种有效的控制方法轮枝菌属棉花枯萎。最后,本研究揭示了水杨酸是棉花防御反应系统的重要相关因子,并揭示了水杨酸的作用机制GaRPL18相关的大丽花耐药与SA信号通路有关。
缩写
- 4CL:
-
4-香豆酸:辅酶A连接酶
- ACO2:
-
氨基环丙烷羧酸氧化酶2
- 类别:
-
过氧化氢酶
- CLCrV:
-
棉花叶皱病毒
- DI:
-
疾病指数
- EIN3:
-
乙烯不敏感3
- ERF1:
-
乙烯反应因子1
- 等:
-
乙烯
- 是:
-
茉莉酸
- MDM2:
-
鼠双分钟2
- 惩罚:
-
甲基jasmonate
- 不:
-
一氧化氮
- NPR1:
-
发病相关基因的非表达
- ORA59:
-
Octadecanoid-responsive拟南芥AP2/ERF结构域蛋白59
- 朋友:
-
苯丙氨酸氨裂解酶
- PDF1.2:
-
植物防御素1.2
- 公关:
-
发病相关
- 总机:
-
核糖体蛋白
- 山:
-
水杨酸
- 中收取:
-
病毒诱导基因沉默
- VSP2:
-
营养贮藏蛋白2
- WT:
-
野生型
参考文献
- 1.
卡雷罗·卡隆一世、特拉佩罗·卡萨斯JL、奥利瓦雷斯·加西亚C、蒙特·E、赫莫萨·R、吉姆·内兹·迪亚兹RM。木霉能有效地防治由黄萎病引起的橄榄黄萎病。作物保护。2016;88:45–52.
- 2.
魏芳,徐昕。生物熏蒸产品单独和联合使用对土壤大丽黄萎病菌微菌核活力的影响。作物保护。2016;79:170-6。
- 3.
Gerik J。用免疫酶染色技术研究大田棉花根感染黄萎病。植物病理学杂志。1988;78(9):1174-78。
- 4.
门尼斯-迪亚兹RM,Cirulli男,Bubici G,del Mar的门尼斯-加斯科男,Antoniou的PP,Tjamos EC。黄萎病,橄榄生产的主要威胁:其管理的现状和未来前景。植物派息。2012; 96(3):304-29。
- 5。
徐升,朱L,屠L,郭X,长L,太阳升,高W,通过SSH棉花防御反应黄萎病张X的基因表达差异。ĴPhytopathol。2011; 159(9):606-15。
- 6。
程华强,韩立波,杨春林,吴新明,钟乃强,吴建辉,王凤霞,王海英,夏国祥。棉花MYB108与CML11形成正反馈调节回路,参与对黄萎病菌侵染的防御反应。J Exp Bot. 2016;67(6): 1935-50。
- 7。
Fradin EF, Thomma BP。大丽花和白叶黄萎病的生理和分子特性研究。植物学报。2006;7(2):71-86。
- 8。
蔡海星,莫杰,孙Q,杨军,刘军。棉花抗黄萎病的分子研究和基因工程:综述。Afr J生物技术公司。2009;8(25):7363–72.
- 9.
张伟,张华,齐芳,简国华。陆地棉黄萎病侵染后转录组分析及基因功能分析。生物化学学报。2016;473(4):879-85。
- 10.
韩强,吴芳,王旭,齐华,石磊,任安,刘强,赵敏,唐翠萍。细菌脂肽iturins通过影响真菌信号通路诱导大丽黄萎病细胞死亡,并介导与病原菌相关分子模式触发免疫相关的植物防御反应。环境Microbiol。2015;17(4):1166 - 88。
- 11.
中国生物防治的历史、现状和未来——本期特刊简介。控制杂志。2014;68:1-5。
- 12.
曾辉,陈锐,罗欣,田军。芽孢杆菌TUBP1蛋白的分离及抗黄萎病活性研究。学生物化学过程。2016;51(10):1691 - 98。
- 13.
张捷,方H,周H,萨诺戈S,马Z.遗传育种和分子标记辅助选择在棉花抗黄萎病。农作物科学。2014; 54(4):1289。
- 14.
苗W,王X,李M,宋C,王Y,胡D,王J。用harpin编码基因hpaXoo对棉花进行遗传转化,通过启动机制增强对不同病原体的防御反应。植物生物学。2010;10:67.
- 15.
Parkhi V, Kumar V, Campbell LM, Bell AA, Shah J, Rathore KS转拟南芥NPR1基因的棉花对多种真菌病原和肾状线虫的抗性转基因研究》2010;19(6):959 - 75。
- 16。
李女,沉H,王男,番K,比比N,NI M,元S,王X.的合成抗微生物肽BTD-S在拟南芥中表达增强的抗黄萎病拟南芥赋予。Mol Gen Genet MGG。2016; 291(4):1647至1661年。
- 17。
Tollervey JVD.酿酒酵母中核糖体的合成.年度修订基因杂志,1999;33:261–311。
- 18。
Belknap JEGWR.从马铃薯中分离泛素核糖体蛋白基因(ubi3)及其启动子在转基因植物中的表达.植物分子生物学.1994;24:119-27。
- 19。
佩里RP。核糖体蛋白质的平衡生产。基因。2007;401(1 - 2):1 - 3。
- 20.
张海峰,张海峰,张海峰,等。拟南芥细胞质核糖体蛋白基因在拟南芥基因组中的表达。植物杂志。2001;127(2):398 - 415。
- 21.
Rogalski M, Schottler MA, Thiele W, Schulze WX, Bock R. Rpl33是烟草中非必需的质体编码核糖体蛋白,在低温胁迫条件下是必需的。植物细胞。2008;20(8):2221 - 37。
- 22.
Petibon C, Parenteau J, Catala M, Elela SA。内含子通过调节重复核糖体蛋白基因的剪接来调节核糖体蛋白的产生。核酸学报2016;44(8):3878-91。
- 23.
泛联图书RDNE。核糖体蛋白L3的截断形式的表达可以抵抗美洲商陆抗病毒蛋白镰刀菌素霉菌毒素deoxynivalenol。植物与微生物学报。2005;18(8):762-70。
- 24.
Nagaraj S,Senthil Kumar M,Ramu VS,Wang K,Mysore KS。植物核糖体蛋白RPL12和RPL19在细菌病原体的非寄主抗病性中起作用。前沿植物科学。2015;6:1192.
- 25.
周欣,郝强,廖军,张强,陆华。核糖体蛋白S14在核糖体应激下解MDM2-p53环。致癌基因。2012;32(3):388 - 96。
- 26.
何旭,李勇,戴M-S,孙X-X。核糖体蛋白L4是MDM2-p53环的一种新型调控因子。Oncotarget。2016;7(13):16217 - 226。
- 27.
卜波,邱丹,曾华,郭磊,袁军,杨晓霞。一种真菌蛋白诱导子PevD1对棉花抗黄萎病的作用。植物学报2014;33(3):461-70。
- 28.
关键词:水杨酸,脱落酸,茉莉酸,抗病性拟南芥来轮枝菌属longisporum。植物生态学报。2014;32(4):591 - 598。
- 29.
Lorenzo O,Solano R.调节茉莉酸信号网络的分子参与者。Curr Opin Plant Biol.2005;8(5):532-40。
- 30.
生物营养与坏死营养病原体防御机制的比较。植物病理学杂志2005;43:205-27。
- 31.
董晓东。不同生活方式植物对病原菌抗性的调节。中国科学(d辑:地球科学)2007;104(47):18842-7。
- 32.
拟南芥的茉莉酸信号网络:关键调控节点和新的生理机制。新植醇。2008;177(2):301 - 18。
- 33.
授予M,羔羊C.系统免疫。植物生物学。2006;9(4):414–20.
- 34.
Sang-Wook Park EK,Dhirendra K,Stephen M,Klessig DF。水杨酸甲酯是植物系统获得性抗性的关键移动信号。科学。2008;318(5):113-6。
- 35.
谷胱甘肽的蛋白质组学分析s-转移酶拟南芥拟南芥揭示了特定植物-PHI和tau的类差动水杨酸诱导的表达。植物分子生物学。2004; 54:205-19。
- 36.
Bari R,Jones JD.植物激素在植物防御反应中的作用.植物分子生物学.2009;69(4):473-88。
- 37.
Caarls L,Pieterse CM,Van Wees SC.水杨酸如何对茉莉酸信号进行转录控制。前沿植物科学。2015;6:170。
- 38.
Fradin EF, Zhang Z, Juarez Ayala JC, Castroverde CD, Nazar RN, Robb J, Liu CM, Thomma BP。番茄Ve1介导的黄萎病抗性的遗传解剖。植物杂志。2009;150(1):320 - 32。
- 39。
李爱华,张瑞,潘丽,唐丽,朱敏,褚建军,孙旭,魏斌,张旭,等。通过对h2o2处理小麦幼苗的转录组分析,发现了一个响应h2o2的脂肪酸去饱和酶基因参与抗白粉病。《公共科学图书馆•综合》。2011;6 (12):e28810。
- 40.
Veronese P,Narasimhan ML,Stevenson RA,Zhu J-K,Weller SC,Subbarao KV,Bressan RA.一种控制拟南芥黄萎病症状反应位点的鉴定.植物杂志,2003;35(5):574-87。
- 41.
低温增强了双生病毒介导的棉花叶皱缩病毒基因沉默。植物杂志。2008;148(1):每周。
- 42.
关键词:棉花,基因,microrna,功能分析植物生态学报;2014;12(5):638-49。
- 43.
Clough SJBA.花卉浸渍:一种简化的农杆菌拟南芥的介导转化。《植物杂志》,1998年;16(6):735–43.
- 44.
Livak KJ, Schmittgen TD。采用实时荧光定量PCR和2(-Delta Delta C(T))方法分析相对基因表达数据。方法。2001;25(4):402 - 8。
- 45.
Atallah ZK, Bae J, Jansky SH, Rouse DI, Stevenson WR。利用多重实时定量PCR检测和定量大丽黄萎病在不同黄萎病反应的马铃薯株系中的定殖。植物病理学。2007;97(7):865 - 72。
- 46.
茱莉亚·杜尼·特尔,玛丽·c·威尔德姆斯:三个独特的突变体拟南芥识别eds限制生物营养真菌病原体生长所需的基因座。植物j . 2000; 24(2): 205 - 18。
- 47.
Choi DS,Hwang BK.参与细胞死亡和防御信号传导的辣椒脱落酸应答1(ABR1)的蛋白质组学和功能分析。植物细胞。2011;23(2):823-42。
- 48.
张勇,王旭,杨树华,迟军,张刚,马志强。拟南芥抗黄萎病基因的克隆、鉴定及功能分析。植物学报2011;30(11):2085-96。
- 49.
王YQ,陈DJ,王DM,黄庆,姚ZP,刘FJ,魏XW,李RJ。过表达天麻抗真菌蛋白增强了轮枝菌属有色棉的抗枯萎性。植物品种。2004;123:454-9。
- 50
张斌,杨勇,陈婷,余伟,刘婷,李华,樊X,任烨,沈德,刘磊,等。编码受体样蛋白的海岛棉Gbve1基因对落叶和非落叶黄萎病菌株都具有抗性。公共科学图书馆一号。2012;7(12):e51091。
- 51
徐升,朱L,屠L,刘L,远d,金L,龙升,张十木质素代谢具有棉的抗青枯病菌黄萎病核心作用,通过RNA-Seq的依赖的转录所揭示分析和组织化学。J Exp Bot。2011; 62(15):5607-21。
- 52.
马d,胡Y,杨C,刘斌,方L,万Q,良W,梅G,王磊,王H,等人。在棉花腺毛形成的遗传基础。NAT Communce。2016; 7:10456。
- 53.
Klimes A,Dobinson KF,Thomma BP,Klosterman SJ.基因组学促进了我们对黄萎病属维管束萎蔫病菌生物学的快速理解。植物病理学年鉴。2015;53:181–98。
- 54.
Nutricati E,Micheli A,Blando F,De Bellis L.两种拟南芥谷胱甘肽S-转移酶的特性。植物细胞代表2006;25(9):997-1005。
- 55.
Wisser RJ, Kolkman JM, Patzoldt ME, Holland JB, Yu J, Krakowsky M, Nelson RJ, Balint-Kurti PJ。玉米抗病的多变量分析表明其遗传基础是多效性的,其中包含一个GST基因。中国科学(d辑:地球科学)2011;108(18):7339-44。
- 56.
莫HJ,孙YX,朱XL,王XF,张Y,杨J,燕GJ,马智。棉花S-腺苷甲硫氨酸脱羧酶介导的精胺生物合成是水杨酸和亮氨酸相关信号在对大丽花黄萎病的防御反应中所必需的。Planta.2016;243(4):1023-39。
- 57.
李芳,刘超,张超,吴振华,陈勇。棉花ERF转录因子基因的克隆及表达分析。植物学报。2009;28(1):176-83。
- 58.
白丹,张军,肖伟,郑晓霞。核糖体蛋白L6对HDM2-p53通路的调控及其对核糖体应激的响应。核酸学报2014;42(3):1799-811。
- 59.
核糖体蛋白S7既是MDM2的调控因子,也是MDM2的底物。摩尔细胞。2009;35(3):316 - 26所示。
- 60
陈建军,郭凯,郭康。核糖体蛋白L26 (RPL26)和核糖体蛋白L26 (RPL26)在p53 mRNA翻译调控中的相互作用。中国生物化学杂志。2012;287(20):16467-76。
- 61
Natalia Draptchinskaia PG, Björn Andersson, Monica Pettersson, Thiébaut-Noël Willig,, Irma Dianzani SB, Gil Tchernia, Joakim Klar1, Hans Matsson, Dimitri Tentler, Narla Mohandas BCND。编码核糖体蛋白S19的基因在Diamond-Blackfan贫血症中发生突变。自然遗传学. 1999;21(2):169–75.
- 62
施Fu-Mei Y-ZL。大丽黄萎病毒素诱导的拟南芥一氧化氮的产生主要依赖于硝酸还原酶。BMC众议员2008;41(1):79 - 85。
- 63
Gayoso C,波马尔楼诺 - 乌萨E,美利奴羊楼德Ilarduya OM。番茄黄萎病的VE-介导的抗性应答涉及H2O2,过氧化物酶和木质素和驱动PAL基因表达。BMC植物生物学。2010; 10:232。
- 64.
作者:李志刚,李志刚,李志刚。植物免疫小分子激素网络的研究进展。化学学报。2009;5(5):308-16。
- 65.
张勇,王雪峰,丁志刚,马强,张国荣,张少林,李志科,吴立强,张国勇,马志勇。大丽黄萎病菌接种棉的转录组分析为棉花改良提供了资源。BMC基因组学。2013;14(637):最近。
- 66.
Dubreuil Maurizi C、Vitecek J、Marty L、Branciard L、Frettinger P、Wendehenne D、Meyer AJ、Mauch F、Poinssot B.拟南芥突变体pad2-1的谷胱甘肽缺乏影响氧化应激相关事件、防御基因表达和超敏反应。植物生理学。2011;157(4):2000–12.
- 67.
Herrera Vasquez A,Salinas P,Holuigue L.水杨酸和活性氧物种在防御基因表达的转录控制中相互作用。前沿植物科学。2015;6:171。
- 68.
马诺哈尔,田敏,莫罗,朴SW,崔HW,费Z, Friso G, Asif M, Manosalva P, von Dahl CC,等。使用两种高通量筛选技术鉴定多个水杨酸结合蛋白。植物科学学报。2014;5:777。
- 69.
应晓波,董磊,朱辉,段春刚,杜庆生,吕德强,方云云,Garcia JA,方荣新,郭海生。来自烟草的RNA依赖RNA聚合酶1抑制RNA沉默并增强本氏烟草的病毒感染。植物细胞。2010;22(4):1358 - 72。
确认
我们感谢朱教授小组成员(中国农业科学院棉花研究所)提供的大丽花隔离和他们的技术援助。
资金
这项工作得到中国国家自然科学基金(批准号:U1303892)和郑州科技计划(批准号153PXXY180)的资助。资助机构没有参与研究设计、数据收集、分析和解释,也没有参与手稿的编写。
数据和材料的可用性
本研究中生成或分析的所有数据均包含在本文及其补充信息文件中。
作者的贡献
构思设计实验:QG, ZY, SH, FL。进行实验:QG, ZY。分析数据:QG和ZY。提供试剂/材料/分析工具:QW, HIB, JZ, YZ, EC。撰写手稿:QG。所有作者都已阅读并批准了当前版本的手稿。
相互竞争的利益
作者宣称没有相互竞争的利益。
同意出版
不适用。
伦理批准和同意参与
不适用。
作者信息
从属关系
相应的作者
额外的文件
附加文件1:图S1。
稳定转T4基因系的筛选及过表达效应GaRPL18在里面拟南芥。a, b, c产物纯合T的过程3.行。d阳性线检测。e的表达水平GaRPL18采用qRT-PCR检测AtUBQ10作为内部控制基因。误差棒代表三个生物重复的标准偏差。对种子的观察GaRPL18-转基因拟南芥和WT。每千克种子重量成熟干燥的种子。ħ种子长度和种子宽度。我长度与宽度的比率。(PDF 9473 KB)
权利和权限
开放获取本文根据知识共享署名4.0国际许可的条款分发(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
龚,Q.,杨,Z.,王X.等水杨酸相关棉(木本棉)核糖体蛋白GaRPL18有助于抵抗大丽黄萎病菌.BMC植物生物学17,59(2017)。https://doi.org/10.1186/s12870-017-1007-5
收到了:
认可的:
出版:
关键词
- 棉花
- 轮枝菌属必
- 耐药基因
- 核糖体蛋白
- GaRPL18
- 水杨酸