抽象的
背景
随着糖工具的快速发展,凝集素-碳水化合物相互作用的研究也不断扩大,为分析、诊断和药物传递等领域的应用开辟了道路。几丁质结合凝集素(CBLs)在对抗含几丁质病原体的免疫防御中发挥重要作用。来自物种的CBLs茄科番茄,马铃薯和Jimsonweed等家庭向含有多N-乙酰丙基胺的糖链显示不同的结合特异性。
结果
在本报告中,CBLS来自Solanum Integifolium.用离子交换色谱法分离。各组分具有血凝活性(HA)。重组CBL在293F细胞培养上清中能抑制细胞的生长辣椒和colletotrichum gleooosporioide..此外,通过对HA的抑制,证实了CBLs的糖结合特性。CBL与Spodoptera frugiperdan -乙酰氨基葡萄糖(N-Acetylglucosamine, GlcNAc)能部分抑制sf21昆虫细胞,其作用与sf21细胞线粒体膜电位降低有关。
结论
结果表明,CBL表现出抗真菌性能并抑制昆虫细胞生长,其与凝集素 - 碳水化合物相互作用直接相关。CBL的进一步鉴定和表征将有助于扩大其在植物防御和生物医学应用中的应用范围。
背景
凝集素是一种碳水化合物结合蛋白,能够以特定的方式结合多糖和复杂碳水化合物[1].凝集素以糖脂、糖蛋白或寡糖的形式与糖配体反应。因此,它们已被认为是许多应用的有用工具,如凝集、抗肿瘤治疗、免疫调节[2,3.,以及抑制昆虫、真菌、细菌和病毒的生长速度[4,5].植物凝集素从Erythrina Velutina能与A, B, O血型相互作用,而凝集素Calpumea钻进,白biflorus和槐花能与A型和B型血结合其他非A、B和O型血也可以通过植物凝集素来区分,例如从植物中分离的凝集素虹膜amara对M血型和来自紫荆花紫竹和野豌豆属graminae凝集素对N型血具有特异性[6,7].植物凝集素凝集不同类型血细胞的能力是由于偏爱识别特定的聚糖模式。植物凝集素有12个科,可以分为紫红素,双孢蘑菇Agglutinin,Chitinase相关的aggutinin,Cyanovirin,euonymuseuropaeus.凝集素,雪花莲基于碳水化合物识别域(CRD)结构相似性的凝集素,含Hevein结构域的蛋白质,jacalin相关凝集素,豆科植物凝集素,LysM motif, Nictaba和Ricin-B家族[8].大多数凝集素结合独特的外源性聚糖模式,但不结合内源性(自产)聚糖。外源碳水化合物结构的特异性识别证明它们可能在创建防御系统中发挥作用。事实上,一些植物凝集素在逆境中被诱导并表现出防御特性来增加杀虫、杀菌和抗真菌活性[9,10].
许多植物和动物都有几丁质结合凝集素(CBLs),用于免疫防御含有几丁质的病原体。甲壳素是自然界中一种丰富的生物聚合物,由GlcNAc重复单元组装而成,广泛分布于昆虫的外骨骼、真菌的细胞壁、线虫的卵、海洋硅藻、甲壳类动物和浮游动物的壳内。GlcNAc重复单元由几丁质均聚物的糖苷键连接[11].许多植物CBLs有共同的结构基序,这些基序由富含半胱氨酸的氨基酸序列组成,称为几丁质结合域(chitin binding domains, CBDs) [12].一些植物的cbl含有多种cbd。例如,荨麻属dioica凝集素(UDA)荨麻属dioica和茄属植物tuberosum马铃薯凝集素(STL)有两种cbd,小麦胚芽凝集素(WGA)则有两种cbdLycopersion Esculentum番茄凝集素(LEL)有四种cbd [13].此外,来自物种的CBLS茄科家族不仅具有CBDs,而且还具有额外的富含羟脯氨酸(Hyp)的结构域,例如曼陀罗(曼佗罗;DSA),番茄(茄属植物lycopersicum;LEL),土豆(S. Tuberosum.;STL),并含有一个类似于细胞壁糖蛋白延伸蛋白的额外的hyper -rich结构域,用于合并糖基化基元[14].虽然这些CBLs的HA同样可以被几丁质抑制,但糖结合特异性对糖蛋白和糖链的偏好是不同的。有许多基于不同凝集素的糖基应用,用于识别新的生物标志物或不同疾病的治疗[15,16].因此,迫切需要探索更多种类的几丁质结合凝集素,以增加凝集素芯片平台;这可能会提高带有GlcNAc片段的糖的敏感性和差异。
红色茄子(茄属植物integrifolium Poir。)属于茄科家庭,又称苦番茄。它被记载为台湾原住民因其抗炎作用而食用的一种本地药用蔬菜[17,18].但是,无论美国integrifolium含有类似其他物种的CBLs茄科家庭不为人知。在本研究中,我们分离了CBLs美国integrifolium并对其体外生物学特性进行了评价。CBLs的分子表征美国integrifolium允许我们将它们与其他物种的独特身份进行比较茄科家庭未来的应用。
结果
凝集素的纯化Solanum Integifolium.
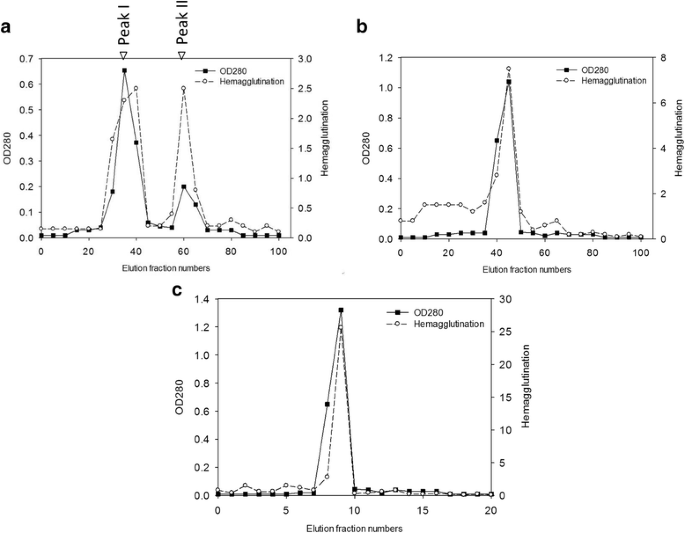
根据之前的报道,属的物种茄属植物含有几丁质结合凝集素,在植物中起防御作用。为了净化CBL美国integrifolium(猩红茄子),使用DEAE Sephadex A-25和Sephadex G-75柱色谱法固定来自茄子果实的提取物。有两个峰,显示来自Sephadex A-25色谱法中的HA(图。1).浓缩的峰I级分进一步进行Sephadex G-75柱,该粒子也显示出主要的HA激活峰(图。1 b).为了进一步了解CBL的几丁质结合性能,将HA活性最高的部分负载到几丁质树脂珠上。几丁质珠中的结合蛋白,当用结合缓冲液洗脱时,显示出HA的单峰(图。1 c).
茄子凝集素的纯化。一个茄子粗提取物在DEAE Sephadex A-25柱(1.0cm×20cm)上的离子交换色谱。用0.02M Tris-HCl缓冲液预平衡柱,pH 8.在5ml级分中以0.5ml / min的流速在5ml级分中洗脱结合的蛋白质,并且在280时监测级分纳米。使用胰蛋白酶化的人血细胞通过红细胞(RBC)凝集来测定血凝滴度。b在0.02M Tris-HCl(pH8.0)中,在Sephadex G-75柱(2.6cm×40cm)上从离子交换柱(2.6cm×40cm)的离子交换柱的分馏。使用与0.5ml / min的流速以3ml级分中的相同的缓冲液洗脱蛋白质。c几丁质凝胶柱色谱(1.0cm×20cm)从Sephadex G-75柱洗脱的蛋白质。在0.1ml / min的流速下在0.5ml级分中使用20mM乙酸洗脱结合的蛋白质
茄子凝集素的特征
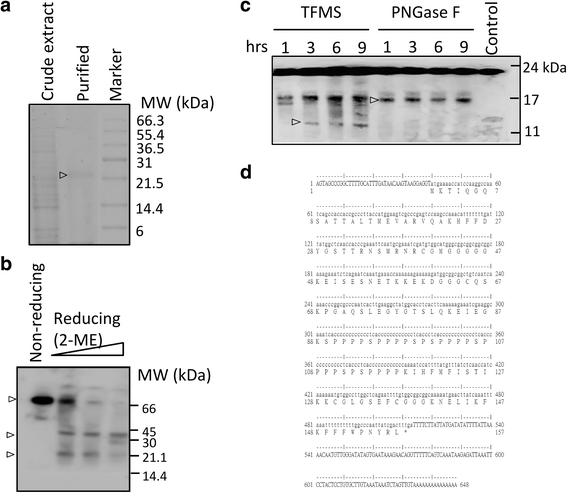
亲和纯化的凝集素组分被浓缩,同时进行15% SDS-PAGE和天然PAGE。SDS-PAGE鉴定出两个主要的条带,分子量分别为30和20 kDa。2而在非还原SDS-PAGE中,CBL分子大小约为66kda(图1)。2 b).蛋白质受到还原剂2-巯基乙醇(2- me)的影响,表明CBLs含有二硫键(图。2 b结果表明,CBL的低聚形式是在非还原条件下观察到的。
茄子纯化的凝集素的测定。一个用几丁质珠纯化对粗提取物和洗脱蛋白的SDS-PAGE分析结果。b2-ME(0,3,10, 30%)的反应混合物用非还原SDS-PAGE分析,考马斯亮蓝染色。c纯化凝集素的脱糖基化。用三氟甲磺酸(TFMS)和肽 - N-糖苷酶F(PNGASE F)处理纯化的CBL,然后通过SDS-PAGE分析。箭头表示脱糖基化形式。d氨基酸序列由基质辅助激光解吸电离质谱(MALDI)获得。与EMBOSS prettyseq推导的氨基酸序列比较(http://www.bioinformatics.nl/cgi-bin/emboss/prettyseq)
蛋白质糖基化是一种常见的翻译后修饰,能明显增加蛋白质的分子量。我们通过体外酶解检测CBL的糖基化状态,以确定蛋白质部分的准确大小。用三氟甲烷磺酸(TFMS)和肽- n -糖苷酶F (PNGase F)孵育生成去糖基化CBL。使用TFMS消化糖苷键可以从CBLs中去除o -连接的低聚糖和n -连接的低聚糖,而不消化肽键。我们发现经tms处理的CBLs比未经处理的要小。(无花果。2摄氏度与对照组相比,n -糖苷酶F (PNGase F)释放的n -聚糖也会导致更小的蛋白带(图1 - 4)。2摄氏度).为了获得纯化后凝集素的氨基酸序列信息,从SDS-PAGE中提取与推测凝集素相对应的馏分,进行n端肽序列测定,然后进行质谱分析。分离得到的CBL的n端氨基酸序列为MKTIQGQSATTALTMEVARVQA。为了获得更多的肽序列信息,对胰酶切的肽片段进行了附加测序。凝胶酶解物的质谱分析确定了独特的序列(附加文件1:表S1)。
我们从n端序列设计了简并引物,从部分序列设计了其他引物(附加文件)1:表S2)。通过不同引物组合的PCR方法获得CBL的全长cDNA序列。从质谱分析的胰蛋白酶消化肽中引用了义和反义简并引物。CBL开放阅读框(471 bp)推导出的氨基酸序列由157个氨基酸组成(图1)。二维),其中包含用胰蛋白酶从内部氨基酸分析中获得的肽序列。CBL的等电点pI为9.46,分子质量为16,812.18 Da。
重组猩红茄子CBL的分子特性
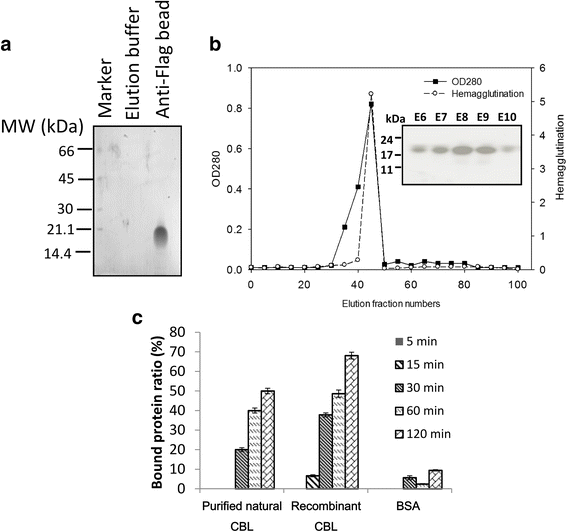
从CBL中分离的cDNA克隆到293F表达系统中,产生可溶性重组凝集素。从培养上清中提取的凝集素水平被评估为含有1.6 mg / l的纯化(图。3).通过几丁质亲和柱层析和HA活性评价重组CBL的几丁质结合特异性。1 c.进行抑制糖和糖衍生物的抑制作用。结果表明Glcnac至CBL的竞争效果在3.12mm的最小抑制浓度下(表1),提示CBL具有聚糖结合特异性。为了分析CBL在不同温度、pH和金属离子条件下的活性,在温度50 ~ 75℃、pH 0 ~ 14和ca2 +等二价阳离子条件下评价HA2,CUCL.2, FeCl3., MgCl2, MnCl2, ZnCl2.CBL活性在50 ~ 65°C温度范围内热稳定,在50°C时最优活性(附加文件)2:图S2)。在pH为4 ~ 8的范围内,活性稳定,在pH为6时活性最大。在pH为2和9时,蛋白质仍保持20%的凝集素活性;在pH值为12-14的缓冲液中,残留活性迅速下降至仅1%2:图S3)。在金属离子的存在下,发现金属离子对CBL活性的影响很小(附加文件1:表S3)。以乙二醇几丁质为底物,对重组CBL进行SDS-PAGE分析。凝胶电泳后,用钙荧光对凝胶中未消化的乙二醇几丁质进行染色,显示出抗紫外荧光暗带(洗脱6~洗脱10:E6~E10,图)。3 b).收集含HA的几丁质凝胶柱(E6~E10)的洗脱组分进行几丁质结合分析。将几丁质与纯化的天然CBL、重组CBL和牛血清白蛋白(BSA;控制)。用分光光度计对未结合蛋白进行分析。我们发现,CBL组的结合蛋白呈时间依赖性增加,而BSA组的结合蛋白水平没有变化(图)。3 c).这表明CBL但不是BSA特异性与甲壳素结合。
CBL的抗真菌活性
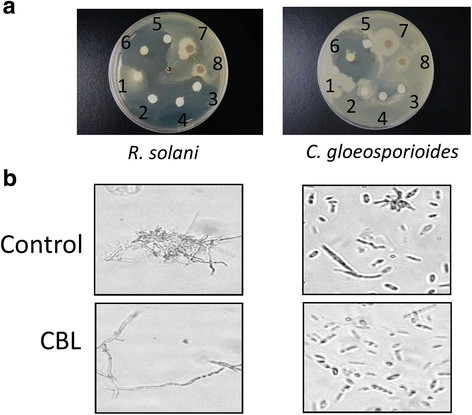
为了评估抗真菌活性,采用平板和液体测定法来评估真菌的生长。的辣椒和刺盘孢属、炭疽与粗提取物的各种浓度孵育,纯化CBL或重组CBL美国integrifolium(无花果。4).在平板实验中,纯化和重组CBLs均表现出对真菌的生长抑制作用。重组CBL具有抑制生长的作用,抑制直径分别为8 mm和12 mmc、和R. Solani.分别(附加文件1:表S4。孵育后,生长少R. Solani.在重组CBL治疗中观察到(图。4 b).c、与...相比没有表现出有效的生长抑制R. Solani.(无花果。4 b).
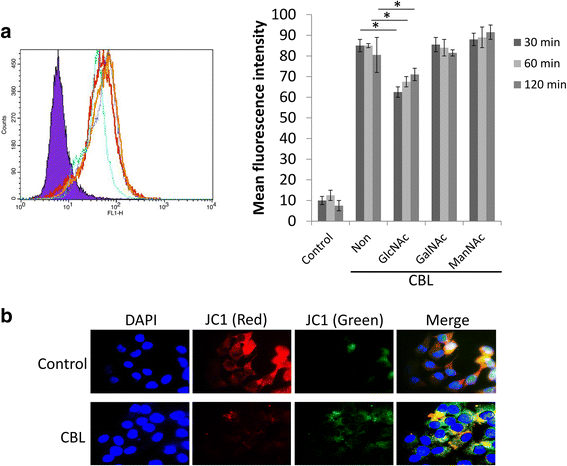
CBL导致sf21昆虫细胞线粒体膜电位降低
当我们试图在sf21昆虫细胞表达系统中表达CBL时,转染CBL的sf21细胞活细胞较少,很难产生杆状病毒进行蛋白扩增(数据未显示)。为了评估CBL影响sf21昆虫细胞生长条件的可能性,我们通过荧光素异硫氰酸酯(FITC)标记CBL结合试验检测CBL与sf21细胞的相互作用。从293F细胞培养上清中纯化重组CBL,用FITC标记,与sf21细胞孵育。流式细胞术数据显示sf21细胞上存在CBL-FITC。为了进一步验证凝集素-碳水化合物相互作用的结合特异性,将GlcNAc、GalNAc和ManNAc竞争对手加入CBL-FITC和sf21细胞结合溶液中。在GlcNAc处理组中,CBL-FITC在sf21细胞表面的结合亲和力降低(图)。5).为了进一步证实CBL对SF21细胞的影响,CBL刺激后的线粒体功能由5,5',6,6'-四氯-1,1',3,' - 四乙基苯并咪唑基碳碳碳碘化锰(JC-1)染色证明。对照组的主要红色荧光表明线粒体膜中的聚集JC-1形式(图。5 b而在经cbl处理的sf21细胞中,绿色荧光增强反映游离JC-1的存在,表明线粒体膜电位的去极化(图)。5 b).
CBL对昆虫细胞的影响。一个CBL-FITC与SF21细胞结合。将CBL-FITC(1μg/ ml)加入到SF21细胞中30分钟。使用流式细胞术通过平均荧光强度(FL1)测定CBL-FITC至SF21细胞的表面结合。表示在CBL-FITC和SF21细胞的结合溶液中使用作为竞争对手的糖。紫色:没有CBL-FITC处理的细胞;浅蓝色:N-乙酰-D-葡糖胺预处理(GLCNAC);红色:N-乙酰-D-半乳糖胺预处理(Galnac);深蓝色:单独CBL-FITC(非);橙色:N-乙酰-β-D-甘露那胺预处理(Mannac)。bCBL降低sf21细胞线粒体膜电位。Sf21细胞与CBL或不与CBL共孵育24 h。JC-1染色检测细胞线粒体膜电位变化,荧光显微镜下观察。线粒体膜电位的降低对应着绿色荧光(游离JC-1)的增加和红色荧光(聚集JC-1)的减少。
讨论
本研究分析了CBL来自美国integrifolium对两种植物病原真菌具有抗真菌活性R. Solani.和c、.早期研究已鉴定出植物凝集素UDA荨麻属dioica体外抑制植物致病真菌和腐生真菌的生长[19].随后,从橡胶树中提取的几丁质结合蛋白(Hevea Brasiliensis.)也被报道为几种真菌的有效抑制剂[20.].此外,马铃薯[21],Setcreasea purpurea.,中草药黄芪mongholicus[22]和菠萝蜜[23含有具有抗真菌活性的几丁质结合凝集素。最近,孟加拉马铃薯品种德喜的凝集素(茄属植物tuberosum L。)含有聚糖结合性质,与GlcNAc聚合物亲和。首次观察到马铃薯凝集素对生物膜形成的抑制作用铜绿假单胞菌[24].CBL的几丁质结合特性表明其不仅影响真菌细胞壁结构,还影响细菌生物膜。这些发现支持了植物凝集素在防御和预防感染方面的强大作用。
几丁质(Chitin, C8H13O5N)n是由GlcNAc通过β, 1 - 4连接的聚合物组成的天然多糖。凝集素的种类茄科番茄,马铃薯和Jimsonweed等家庭含有几丁质结合结构域(CBD)[25,是催化和水解几丁质糖苷键的活化位点[26,27].此外,它们还具有一个额外的富含羟脯氨酸的结构域,类似于细胞壁糖蛋白延伸素,用于合并典型的β- l-阿拉伯呋喃苷重复糖基化基元[14].我们的研究确定CBL来自美国integrifolium.CBL的氨基酸序列是从其他物种的甲壳素结合凝集素中是独特的茄科家庭(附加文件2:图S1) [28,29].它含有PPPPS重复,其类似于LEL,STL和DSA Chitin结合凝集素。与番茄和马铃薯凝集素相比,CBL的RCGMGGGGXGKXXXXXXSNE主题的相似性也可以在N末端附近找到。
一般来说,植物凝集素是从它们的天然来源,如细菌、叶子、种子、果实、块茎和根中纯化出来的。有时,纯化过程是耗时的,并在每批中呈现异构体和杂质。目前已经开发了不同的重组凝集素表达平台,使得研究凝集素的生物活性更加可行[30.].在这项工作中,CBL可以在293F表达系统中正确生产,并将重组产物表达到培养基中。色谱纯化后的重组CBL仍然具有HA活性,并且抗真菌活性进一步确保可能施加293°F表达平台用于重组植物凝集素的产生。此外,我们发现CBLS在SF21昆虫细胞平台中的有限表达是由于CBL与昆虫细胞结合并降低了SF21细胞本身的线粒体膜电位。这些结果表明CBLS通过碳水化合物识别和去极化的线粒体膜电位影响SF21昆虫生长条件。将来,工程昆虫细胞N-聚糖加工途径[31,基于凝集素结合变化的快速测定[32]和凝集素毒性引起的细胞凋亡[33]将迅速表征凝集素的聚糖识别和功能。这些数据提供了拟合性分析的信息,并有助于拟合分析和技术开发的应用,并且可能对生物医疗应用特别有用[34].
结论
在这里,我们识别新的CBL美国integrifolium可以通过离子交换色谱和甲壳素亲和柱色谱法纯化。由293°F细胞培养上清液产生的重组CBL保持其碳水化合物结合特异性。CBL的碳水化合物结合性能确认与SF21昆虫细胞的结合可以部分抑制GlcNAc,但不是Galnac或N-乙酰诺萨胺(Mannac)。此外,添加重组CBL至R. Solani.和c、培养阻止了它们的生长,证明CBL与几丁质结合。
方法
材料
的美国integrifolium水果购自台湾花莲的食品市场。这些样品保存在有标签的密封塑料袋中,置于−80°C冰箱中进行凝集素纯化。Sephadex A-25、Sephadex G-75等试剂购自Sigma-Aldrich公司。
粗提物的制备
提取协议是根据以前公布的程序进行修改的[14].短暂,新鲜的水果切成块,在烤箱干50°C,然后与0.1 M氯化钠混合在4°C的过滤后48 h。网(80年嗯,BD猎鹰)和在12000转离心30分钟在4°C,上层受到硫酸铵沉淀(40 ~ 70%)。将颗粒溶解在蒸馏水中,并在4°C的水中透析过夜。
凝集素的纯化
的提取美国integrifoliumDEAD Sephadex A-25柱(1.0 cm × 20 cm)。用透析缓冲液(0.1 M NaCl, 0.02 M Tris-HCl, pH 8.0)洗涤柱,0.02 ~ 1 M NaCl(流速0.5 ml/min)线性梯度纯化。对洗脱组分进行血凝试验。在Sephadex G-75色谱柱(2.6 cm × 40 cm)上进一步测定具有血凝活性的组分。含血凝集活性的组分被浓缩,并使用带有YM-10膜的Amicon®Pro纯化系统(Millipore Co., Billerica, MA, USA)对磷酸盐缓冲盐水(PBS)进行透析。从Sephadex G-75柱中洗脱的浓缩蛋白被稀释到几丁质凝胶结合缓冲液(50 mM Tris HCl, 1 mM EDTA, 500 mM NaCl, 0.1% Tween-20, pH 8)中,并装入几丁质凝胶柱(New England Biolabs)中。洗脱柱后,结合蛋白用20 mM醋酸洗脱,在5 mM磷酸钠缓冲液中透析,pH为6.0。色谱分离的馏分保存在−80°C进行电泳。
红细胞凝集试验
凝集素的HA是在96孔圆底板(康宁)中进行的,使用的是从台湾Formosa Biomedical Technology Co (Taiwan)获得的A1、A2、B和O型面板。胰酶化红细胞用0.05 M Tris-HCl洗涤,pH 7.5,室温3000 rpm离心5分钟。用磷酸盐缓冲盐水(PBS, pH 7.2)稀释红细胞至4%浓度。4%的水洗红细胞悬液(50 μl)与从凝集素中纯化的连续稀释的凝集素混合美国integrifolium在PBS中提取(pH7.2)。特异性血凝单元定义为在60分钟后悬浮液中凝集的RBC的凝集素混合物(Mg)的最小量。
纯化凝集素的电泳
纯化的凝集素对SDS-PAGE和Native页面进行。将浓缩的蛋白质在5×取样缓冲液中稀释(312mm Tris-HCl,pH6.8,10%SDS,50%甘油,25%2-巯基乙醇和0.01%溴苯酚蓝)。为了非降低蛋白质分析,将蛋白质级分与5×采样缓冲液混合,或没有连续稀释的2-巯基乙醇。然后,用凝胶电泳分离样品,用Coomassie亮蓝染色,用10%乙酸饮用。
Deglycosylation化验
Trifluoromethanesulfonate (tfm;Sigma)用于从糖蛋白中去除N-和o -聚糖。浓缩蛋白用预冷无水TFMS在冰上处理。在消解结束时,样品用吡啶-甲醇-水溶液(吡啶-甲醇-水[3:1:1])中和。根据制造商手册使用PNGase F (Sigma-Aldrich,美国)去除n -糖基化。浓缩蛋白与PNGase F混合在50 mM pH 7.2的磷酸钠缓冲液中,37℃。混合物在SDS-PAGE上分离,凝胶用周期性酸-希夫(PAS)染色进行碳水化合物染色。未加入脱糖基化试剂的样品作为阴性对照。
氨基酸序列分析
SDS-PAGE检测蛋白条带,从凝胶中切除靶点,在37°C下胰酶消化过夜。采用Edman降解法测定n端氨基酸序列。洗脱后的蛋白用PNGase F去糖基化,然后用糜蛋白酶金(美国Promega公司)进一步消化过夜。为了进行蛋白质鉴定,将消化后的肽混合物送到基质辅助激光解吸电离质谱(MALDI-MS)。结果用MASCOT (Matrix Science)进行分析。使用MAFFT (http://www.ebi.ac.uk/Tools/msa/mafft/)的默认设置(间隙和匹配的权重相等)。
重组CBL生产
克隆猩红色茄子凝集素,构建表达蛋白的质粒,总RNASolanum Integifolium.从鲜红茄子的果实部分收获,并在Trizol试剂(Invitrogen)中重新悬浮。为了合成第一链cDNA,使用total RNA Mini kit (Geneaid,台湾)分离总RNA,并按照说明书使用Deoxy + HiSpec逆转录酶(yestaybiotech Co.,台湾)进行逆转录。根据质谱获得的氨基酸序列,采用不同组合的退化引物(addiol file 1: Table S2)进行PCR扩增。PCR产物琼脂糖凝胶电泳,凝胶洗脱(Qiagen), DNA测序(Mission Biotech Co., Taiwan)。PCR产物的DNA测序结果采用EMBOSS prettyseq (http://www.bioinformatics.nl/cgi-bin/emboss/prettyseq)与MS数据进行比较。
CBL全长编码序列的PCR产物亚克隆到pCMV-Flag质粒(Sigma)中。将含CBL构建的质粒用293 Fectin (Invitrogen公司)瞬时转染到293F细胞(由台湾中央研究院谢世良博士提供),在293 Freestyle培养基(Life Technologies公司)中培养96-144 h。根据制造商的协议(Sigma-Aldrich),使用anti-FLAG珠纯化培养上清。
几丁质结合化验
为比较纯化的天然CBL与重组CBL的结合效果,进行几丁质结合实验。连续稀释的CBL与几丁质(Sigma)在37°C下孵育5分钟至2小时。经过短暂的离心(10,000 x g, 3分钟),上清液显示未结合的cbl, cbl结合的几丁质形成小球。上清液用分光光度计(Multiskan Spectrum, Thermo Scientific)分析残留未结合CBL。结合率由对照组与CBL系列浓度组未结合的光密度(OD)比计算。以牛血清白蛋白为阴性对照。
温度、pH和金属离子的影响
为了测试CBL在不同温度、pH和金属离子浓度条件下的活性,将纯化的凝集素与不同pH或不同金属离子溶液混合,并在指定的时间间隔内孵育。制备了以下试剂,可将pH值从0修改为14:1 M HCl, 1 M NH4OAc, 1 M三盐酸,1 M NaHCO3.0.1 M NaOH。为了测试温度的影响,将纯化的凝集素在50°C到75°C的时间间隔内暴露。混合物立即在冰上冷却,然后加热到室温进行HA活性测定。为了研究金属离子对CBL的影响,纯化蛋白在50 mM EDTA缓冲液中透析去除金属离子。将反应混合物浓缩并交换成50 mM Tris-HCl缓冲液,pH 7.2。在50 mM的Ca、Cu、Fe、Mg、Mn、Zn或EDTA氯盐存在下制备金属离子溶液。
红细胞凝集抑制试验
为了研究碳水化合物对CBL活性的特异性,在96孔圆底微量滴定板上测定了糖对HA的抑制作用。各种糖和糖衍生物用PBS连续稀释。将凝集素样品与等量连续稀释的糖在室温(RT)下孵育10分钟,然后在每孔中加入4%的红细胞悬液。以1h后对HA完全抑制的糖浓度为最低抑制浓度(MIC)。报告的结果是三种测定方法的平均值。
抗真菌测定
采用纸片扩散法和液体法评价CBL的抑菌活性。的孢子辣椒和刺盘孢属、炭疽培养到含有马铃薯葡萄糖琼脂(PDA)的培养皿中。使用毛细管移液管将来自粗提取物,纯化,重组或沸腾的条件施用的浓缩的CBL(1和5mg / ml)施加到灭菌的纸质盘(直径5mm)上。在非生长区的直径(mm)中测量生长抑制程度。还通过将CBL(100μg/ ml)添加到含有的马铃薯葡萄糖肉汤中的液体测定系统中使用R. Solani.和c、(原生质体:106/ 100μL)。煮沸CBL作为阴性对照。混合物在25℃下培养48 h,每天在显微镜下观察真菌菌丝的生长情况。
流式细胞术检测CBL结合
用FITC(Sigma)标记CBL蛋白。简而言之,将FITC加入到0.1mNaHCO中的CBL中3.(pH值7)在4°C下保存30分钟。在PD-10脱盐柱(GE Amersham)上进行色谱分离,去除游离FITC。将洗脱后的CBL-FITC组分在Amicon超离心过滤器(Sigma)中浓缩,利用280和490 nm处的吸光度计算蛋白浓度。结合试验,Spodoptera frugiperda(Sf) 21细胞(由台湾国立阳明大学Shr-Jeng Jim Leu提供)在Grace 's Insect培养基中培养,并在培养板上(6孔,Costar)过夜。在sf21细胞中加入1 μg/mL的CBL-FITC,作用30分钟。为了竞争凝集素-碳水化合物的相互作用,在CBL-FITC和sf21细胞结合溶液中使用指示糖和糖衍生物(50 mM)作为竞争物。用冷PBS洗两次染色的细胞,并使用Kaluza软件(Beckman)进行Gallios流式细胞术分析。
线粒体膜电位测定
采用JC-1染色检测线粒体膜电位。sf21细胞(5 × 105)与CBLs (5 μg/mL)孵育24小时。PBS洗涤细胞,2000×g离心5分钟。PBS洗涤2次后,用2.5 μg/mL JC-1染料在37℃黑暗下染色。用荧光显微镜分析线粒体模式。
缩写
- CBD:
-
Chitin-binding域
- cbl:
-
Chitin-binding凝集素
- FITC:
-
异硫氰酸荧光素()
- GlcNAc:
-
N-乙酰葡糖胺
- 哈:
-
红血球凝聚活动
- 忧郁:
-
羟脯氨酸
- JC-1:
-
5、5 ' 6 6 ' -tetrachloro-1, 1, 3, -tetraethylbenzimidazolylcarbocyanine碘
- 美国integrifolium:
-
Solanum Integifolium.
- 科幻小说:
-
Spodoptera frugiperda
参考
- 1.
作为模式识别分子的凝集素:先天免疫中表位密度的影响糖生物学。2010;20(3):270 - 9。
- 2.
Coelho LC, Silva PM, Lima VL, Pontual EV, Paiva PM, Napoleao TH,等。凝集素,连接蛋白质与生物技术/药理学和治疗应用。基于Evid的Complement Alternat Med. 2017;2017:1594074。
- 3.
van Kooyk Y, Rabinovich GA。控制先天和适应性免疫反应的蛋白质-聚糖相互作用。Nat Immunol。2008;9(6):593 - 601。
- 4.
JandúJJB,Moraes Neto RN,Zagmignan A,De Sousa Em,Brelaz-de-Castro MCA。Dos Santos Correia MT,等。用植物凝集素靶向免疫系统,以打击微生物感染。前药狼。2017; 8:671。
- 5.
半乳糖凝集素在感染中的作用。微生物学报。2009;7(6):424-38。
- 6.
ingale ag,hivrale au。植物作为凝集素的丰富储备。植物信号表现。2013; 8(12):E26595。
- 7.
Gorakshakar Ac,Ghosh K.使用凝集素免疫树病。亚洲j transfus sci。2016; 10(1):12-21。
- 8.
Van Damme Ej,Lannoo N,Peumans WJ。植物凝集素。植物资源进展。2008; 48:107-209。
- 9.
尚格云顿。蛋白质-碳水化合物相互作用是植物防御和动物免疫的一部分。分子。2015;20(5):9029 - 53年。
- 10.
尚格云顿。植物防御前沿的凝集素结构域。植物科学学报2014;5:397。
- 11.
Bueter Cl,Specht Ca,Levitz SM。内含物和壳聚糖的先天传感。PLOS POAROG。2013; 9(1):E1003080。
- 12.
基于保守催化机制的植物几丁质酶样凝集素碳水化合物结合特性的结构基础中国生物医学工程学报。2015;40(2):115-21。
- 13.
小栗S,天野K,中下H,永田Y,桃木YS。番茄果实凝集素的分子结构与性质。生物化学学报。2008;72(10):2640-50。
- 14.
Moller SR, Yi X, Velasquez SM, Gille S, Hansen PL, Poulsen CP,等。植物细胞壁特异糖蛋白糖基转移酶ExAD的鉴定与进化。Sci众议员2017;7:45341。
- 15.
Bojarova P,Kren V.加糖生物材料结合章参:成就和观点。生物摩特SCI。2016; 4(8):1142-60。
- 16.
一种基于微流控凝集素条形码的高效液相色谱分析平台。Sci众议员2016;6:20297。
- 17.
Plazas M, Prohens J, Cunat AN, Vilanova S, Gramazio P, Herraiz FJ,等。大红茄(Solanum a衣索伊克)和大红茄(S. Macrocarpon)茄子的还原能力、绿原酸含量和生物活性。中国生物医学工程学报。2014;15(10):17221-41。
- 18.
王莉,赵淑英,沈永涛,颜凤娣,丁海英,抗炎WMJ。茄青果提取物的作用及机理研究。Biomed Res Int. 2014;2014:953873。
- 19.
Broekaert WF, VAN Parijs J, Leyns F, Joos H, Peumans WJA。刺荨麻根茎中具有抗真菌特性的几丁质结合凝集素。科学。1989;245(4922):1100 - 2。
- 20.
Van Parijs J, Broekaert WF, Goldstein IJ, Peumans WJ。Hevein:一种从橡胶树(巴西橡胶树)乳胶中提取的抗真菌蛋白。足底。1991;183(2):258 - 64。
- 21.
关键词:薯类,凝集素,几丁质酶,抗真菌活性C R academy Sci III。1993, 316(8): 788 - 92。
- 22.
严强,姜志,杨胜,邓伟,韩洛。蒙古黄芪新型同二聚体凝集素的抗真菌活性研究。生物化学学报。2005;442(1):72-81。
- 23.
Trindade MB, Lopes JL, Soares-Costa A, montero -Moreira AC, Moreira RA, Oliva ML, et al.;面包果属新型几丁质结合凝集素的结构表征及其抗真菌活性。生物物理学报。2006;1764(1):146-52。
- 24.
一种具有抗菌和抗菌膜活性的新型几丁质结合凝集素的纯化。中国生物化学学报。2014;51(2):142-8。
- 25.
Hevein家族几丁质结合凝集素的糖结合谱:一项综合研究。中华医学杂志。2017;18(6):1160。
- 26.
Sudisha J, Sharathchandra RG, amruesh KN, Kumar A, Shetty HS。植物防御反应的发病机制相关蛋白。植物防御:生物防治。2012;12:379-403。
- 27.
Nishimoto K, Tanaka K, Murakami T, Nakashita H, Sakamoto H, Oguri S. Datura Stramonium agglutinin: cloning, molecular characterization and recombinant production in Arabidopsis Thaliana。糖生物学。2015;25(2):157 - 69。
- 28.
Peumans WJ,Rouge P,Van Damme EJ。番茄凝集素由两种由克服素状接头分开的两种同源几丁质结合模块组成。Biochem J. 2003; 376(PT 3):717-24。
- 29.
Van Damme Ej,Barre A,Rouge P,Peumans WJ。马铃薯凝集素:独特的嵌合植物蛋白的更新模型。工厂J. 2004; 37(1):34-45。
- 30.
Oliveira C,Teixeira Ja,Domingues L.植物凝集素的植物凝集素在生物医学应用中的微生物系统中的重组生产 - Frutalin案例研究。前植物SCI。2014; 5:390。
- 31.
马桥- asazuma H, Kuo CW, Khoo KH, Jarvis DL。利用CRISPR-Cas技术修饰昆虫细胞n -聚糖加工通路。ACS Chem Biol. 2015;10(10): 2199-208。
- 32.
斯坦利P,Sundaram S.章定毒性的快速测定和反映哺乳动物细胞中糖基化改变的结合变化。Curr Protoc Chem Biol。2014; 6(2):117-33。
- 33.
史志,孙锐,于涛,刘锐,程丽娟,鲍建军,等。植物凝集素诱导癌细胞凋亡的新途径的鉴定。中华医学杂志。2016;17(2):228。
- 34.
林兆基,吴TB。凝集素:生产和实际应用。生物技术学报。2011;89(1):45-55。
确认
作者要感谢佛教慈济总医院医学研究部的共聚焦显微镜图像捕捉和质谱鉴定。
资金
这项工作得到了佛教慈济基金会(TCMMP104-03和TCIRP101005)的资助。
数据和材料的可用性
本研究生成的数据集可在UniProt数据库(登录号:SPIN200010264)中获得,网址如下:(https://www.ebi.ac.uk/swissprot/Submissions/spin/submission/).
作者信息
从属关系
贡献
CSC和CYC进行了实验。DMR为取样材料和试剂的评审和编辑做出了贡献。AS有助于取样材料和试剂。CPC对概念的形成、批判性的修改和审查以及编辑做出了贡献。RIY设计了实验,撰写了论文,进行了评论性的校订和编辑。所有作者阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准和同意参与
本研究使用的植物材料均来自当地市场。收集植物不需要特定的许可证。这些植物以前被保存在台湾嘉南药科大学植物标本室。这项研究不需要伦理上的批准或同意,因为没有涉及濒危或受保护的植物物种。
同意出版
不适用。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
附加文件
附加文件1:表S1。
经质谱鉴定胰蛋白酶消化肽序列。表S2。引物序列。表S3。CBL在各种金属离子中的活性。表S4。CBL对真菌的体外抑制作用。(PDF 120 kb)
附加文件2:图S1。
LEL、STL和DSA与CBL的多次比对。使用MAFFT (http://www.ebi.ac.uk/Tools/msa/mafft/)的默认设置(间隙和匹配的权重相等)。图S2。温度对CBL的影响。用50、60、65、70或75°C对凝集素进行不同时间的预热。图S3。pH对CBL的影响。将凝集素在pH为0 ~ 14的溶液中进行rt培养,结果具有>3独立实验的代表性。(PDF 341 kb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
陈,CS。,陈,CY。,Ravinath,D.M.et al。几丁质结合凝集素的功能表征Solanum Integifolium.具有抗真菌、杀虫活性。BMC植物杂志18,3(2018)。https://doi.org/10.1186/s12870-017-1222-0
收到了:
接受:
发表:
关键字
- Chitin结合凝集素
- Solanum Integifolium.
- 红血球凝聚
- 抗真菌
- 昆虫细胞